La infección por Helicobacter pylori afecta aproximadamente al 50% de la población española y es causante de la gastritis crónica, la úlcera péptica y el cáncer gástrico. Se han llevado a cabo hasta el momento, en nuestro país, 3 reuniones de Consenso sobre el manejo de la infección por H.pylori (la última de ellas en 2012). Los cambios en los esquemas de tratamiento y la creciente evidencia disponible al respecto han justificado la organización de esta IVConferencia Española de Consenso en marzo de 2016, centrada en el tratamiento de esta infección. Participaron 19 expertos sobre el tema, que realizaron una búsqueda sistemática de la evidencia científica y elaboraron una serie de recomendaciones que fueron sometidas a un proceso de interacción de votaciones anónimas seriadas mediante metodología Delphi. Para clasificar la evidencia científica y la fuerza de las recomendaciones se utilizó el sistema GRADE. Este consenso establece, como punto de partida, un aumento de la exigencia en la eficacia de los tratamientos recomendados, que deben alcanzar, o preferiblemente superar, el 90% de curación al ser administrados de forma empírica. De este modo, tanto en primera como en segunda línea se recomiendan tratamientos cuádruples con o sin bismuto, generalmente prescritos durante 14días. El tratamiento cuádruple sin bismuto concomitante, que incluye un inhibidor de la bomba de protones, claritromicina, amoxicilina y metronidazol, se recomienda como primera línea. En el presente consenso se revisan también con detalle otras alternativas de tratamiento tanto de primera línea como de rescate.
Helicobacter pylori approximately infect 50% of Spanish population and causes chronic gastritis, peptic ulcer and gastric cancer. Until now, three consensus meetings on H.pylori infection had been performed in Spain (the last in 2012). The changes in the treatment schemes, and the increasing available evidence, have justified organizing the IVSpanish Consensus Conference (March 2016), focused on the treatment of this infection. Nineteen experts participated, who performed a systematic review of the scientific evidence and developed a series of recommendation that were subjected to an anonymous Delphi process of iterative voting. Scientific evidence and the strength of the recommendation were classified using GRADE guidelines. As starting point, this consensus increased the minimum acceptable efficacy of recommended treatments that should reach, or preferably surpass, the 90% cure rate when prescribed empirically. Therefore, only quadruple therapies (with or without bismuth), and generally lasting 14 days, are recommended both for first and second line treatments. Non-bismuth quadruple concomitant regimen, including a proton pump inhibitor, clarithromycin, amoxicillin and metronidazole, is recommended as first line. In the present consensus, other first line alternatives and rescue treatments are also reviewed and recommended.
La infección por Helicobacter pylori afecta a alrededor del 50% de la población mundial y desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas como la gastritis crónica, la úlcera péptica y el cáncer gástrico, por lo que un diagnóstico adecuado y un tratamiento eficaz son esenciales en la práctica clínica. Se han organizado hasta el momento diversas Conferencias de Consenso sobre el diagnóstico y tratamiento de la infección por este microorganismo en América, Europa y Asia. En nuestro país se han organizado hasta la fecha 3 reuniones de Consenso sobre el diagnóstico y tratamiento de la infección por H.pylori: en 19991,2, en 20043,4 y en 20125. Los notables cambios acontecidos en los esquemas de tratamiento y la creciente evidencia disponible al respecto han justificado la organización de esta cuarta Conferencia Española de Consenso en marzo de 2016. Dado que no se han producido avances relevantes en los aspectos relacionados con las indicaciones del tratamiento o las técnicas diagnósticas de la enfermedad, esta conferencia de consenso se centrará exclusivamente en la actualización de las recomendaciones sobre el tratamiento de la infección por H.pylori.
MetodologíaParticipantes en el Consenso. Se invitó a todos los expertos que participaron en la última Conferencia de Consenso celebrada en 20123. Además, se identificó (mediante la estrategia de búsqueda «helicobacter pylori AND Spain» en PubMed) e invitó a los investigadores que durante los últimos 4años hubieran publicado como primer autor algún artículo sobre el tratamiento de la infección por H.pylori. En total, 19 expertos fueron invitados, de los que finalmente participaron 18 (95%), incluyendo gastroenterólogos, microbiólogos, médicos de atención primaria y expertos en metodología científica y medicina basada en la evidencia. Dos gastroenterólogos (JPG y JMI) actuaron como coordinadores.
Búsquedas bibliográficas. Se priorizó la identificación de revisiones sistemáticas y otros documentos de síntesis crítica de la literatura científica. Se consultaron las siguientes bases de datos electrónicas: TRIP Database, NHS National Library of Guidelines, National Guideline Clearinghouse, Cochrane Database of Systematic Reviews (The Cochrane Library), Database of Abstracts of Reviews of Effects (DARE) y MEDLINE (accedido mediante PubMed). En una segunda fase, se realizó una búsqueda de estudios individuales, ensayos clínicos aleatorizados y estudios observacionales, así como una revisión de las referencias bibliográficas de los documentos incluidos.
Clasificación de la evidencia científica y fuerza de las recomendaciones. Para clasificar la evidencia científica y la fuerza de las recomendaciones se utilizó el sistema Grading of Recommendations Assessment, Development and Evaluation Working Group (GRADE) (http://www.gradeworkinggroup.org/). El sistema GRADE es una propuesta de clasificación estructurada y explícita que está siendo adoptada de manera generalizada en el ámbito internacional, con la ventaja de superar las limitaciones de los sistemas previos y homogeneizar el sistema de formulación de recomendaciones para todas las instituciones6,7.
Evaluación de las recomendaciones por el grupo de consenso. Las recomendaciones fueron elaboradas inicialmente por los coordinadores. Posteriormente fueron sometidas a un proceso de interacción de votaciones anónimas seriadas mediante metodología Delphi8. Se realizaron 3 rondas de votación, 2 online anónimas y una presencial. El procedimiento online se realizó utilizando las herramientas electrónicas de captura de datos REDCap, software alojado en el servidor de la Asociación Española de Gastroenterología (AEG) (https://redcap.aegastro.es/)9. AEG es una sociedad médico-científica sin ánimo de lucro dedicada al estudio y a la formación docente en las enfermedades del ámbito de la gastroenterología, y ofreció este servicio de forma gratuita con el objetivo único de fomentar la investigación liderada por investigadores independientes. Research Electronic Data Capture (REDCap) es una aplicación web segura diseñada para dar soporte a la captura de datos de estudios de investigación, ofreciendo: 1)una interfaz intuitiva para la recolección de datos validados; 2)trazabilidad de la manipulación, acceso y exportación de datos; 3)procedimientos automatizados de exportación de datos en bloque a programas estadísticos habituales, y 4)procedimientos para la importación de datos de fuentes externas.
Para cada recomendación, los participantes puntuaron su grado de acuerdo mediante una escala de Likert de 6 grados (1: totalmente en desacuerdo; 2: bastante en desacuerdo; 3: algo en desacuerdo; 4: algo de acuerdo; 5: bastante de acuerdo; 6: totalmente de acuerdo). Cualquier valoración inferior al 6 obligaba a los coordinadores a revisar cada uno de los apartados de dicha recomendación (enunciado, grado de evidencia, fuerza de la recomendación y justificación) y realizar sugerencias de mejora. Tras cada votación, los 2 coordinadores revisaban las recomendaciones de acuerdo a los comentarios y votos recibidos, integrando las sugerencias para maximizar el acuerdo.
Las recomendaciones resultantes de las 2 rondas de votación online se discutieron y aprobaron durante una reunión presencial, que tuvo lugar en Madrid el 1 de marzo de 2016, moderada por los 2 coordinadores (JPG y JMI). Durante la reunión se revisaron, modificaron (cuando fue necesario) y votaron nuevamente las recomendaciones. Una recomendación fue aprobada si más del 75% de los participantes estaba de acuerdo (puntación de 4 a 6 en la escala de Likert). AGM actuó como secretario científico del consenso, levantando acta de la reunión, responsabilizándose del recuento de votos de las distintas rondas de votación, del registro de comentarios y de la sistematización del proceso de incorporación de sugerencias.
Aspectos éticos. El consenso se ajustó a las recomendaciones éticas establecidas10. Los participantes realizaron declaraciones de conflictos de intereses antes y después del proceso de votación Delphi.
Patrocinios, avales y financiación. La conferencia contó con el patrocinio científico del Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas (CIBEREHD). Este documento de Consenso ha sido avalado por la Asociación Española de Gastroenterología y por la Sociedad Española de Patología Digestiva, las cuales se han adherido y dan soporte a las recomendaciones del consenso. No se ha contado con financiación por parte de ningún laboratorio farmacéutico.
RecomendacionesCada recomendación se acompaña del resultado de la votación (porcentaje de acuerdo), el grado de recomendación (GR; fuerte o débil), la calidad de la evidencia (CE; alta, moderada, baja o muy baja) y de la discusión de la evidencia correspondiente.
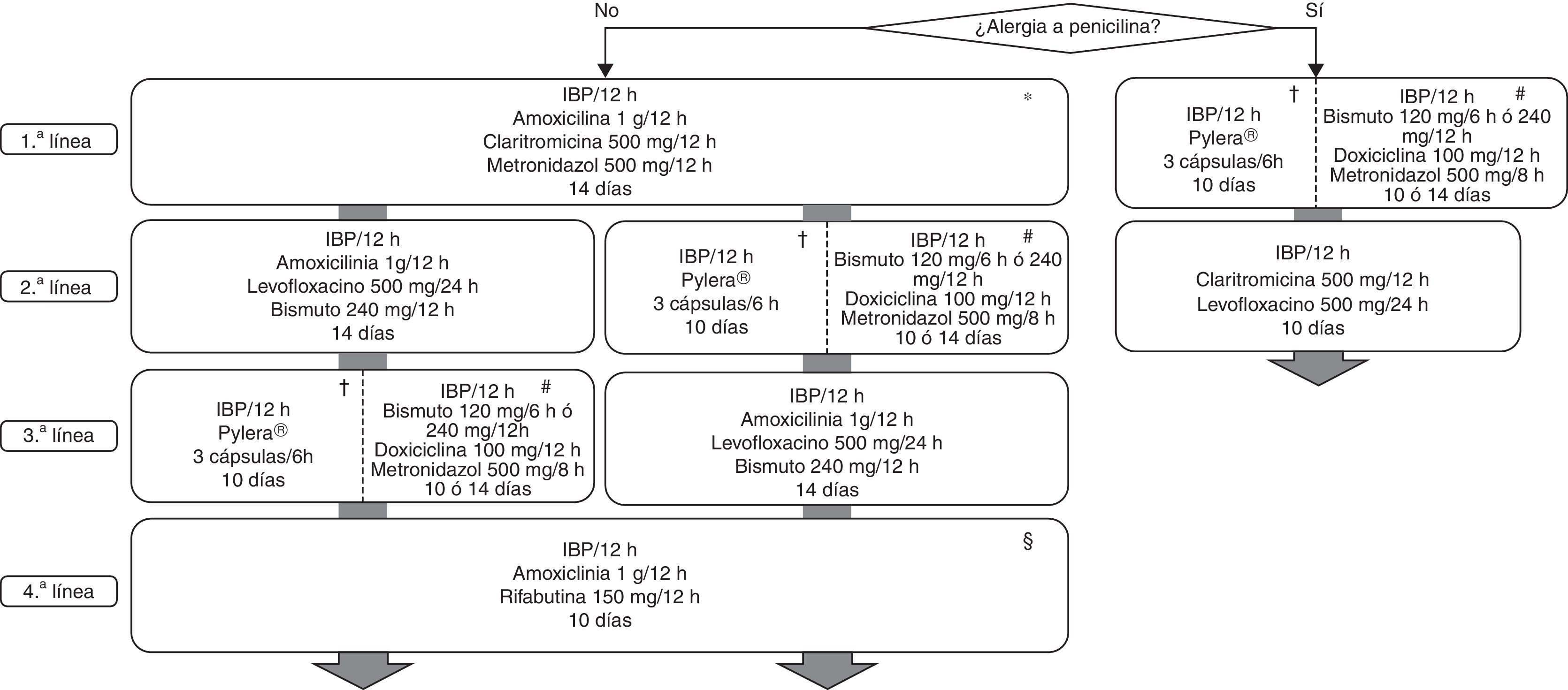
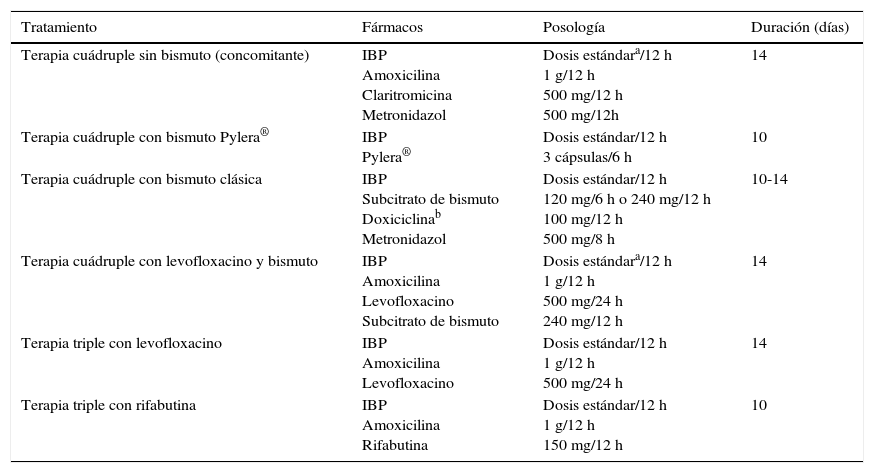
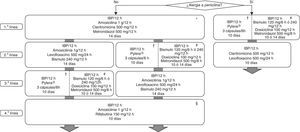
Todas las recomendaciones aprobadas en el presente Consenso Español sobre el tratamiento de la infección por H.pylori se incluyen en la tabla 1. Los fármacos, la duración y la dosis de cada uno de los componentes de las pautas recomendadas se encuentran desglosados en la tabla 2. Finalmente, el algoritmo de tratamiento inicial y de rescate de la infección está representado en la figura 1.
Recomendaciones sobre el tratamiento de la infección por Helicobacter pylori
| Recomendación 1. Actualmente se recomienda que un tratamiento erradicador sea considerado efectivo cuando sea capaz de curar la infección por H.pylori en un porcentaje próximo o preferiblemente superior al 90% de los pacientes |
| Recomendación 2. Como tratamiento de primera línea de la infección por H.pylori se recomienda una pauta cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) |
| Recomendación 3. La terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría ser una alternativa como tratamiento erradicador de primera línea, una vez que su eficacia sea confirmada en nuestro medio |
| Recomendación 4. Se recomienda que la duración del tratamiento cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) sea de 14 días |
| Recomendación 5. Se sugiere que la duración de la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) sea de 10 o 14 días |
| Recomendación 6. En pacientes alérgicos a la penicilina se recomienda de primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) |
| Recomendación 7. No se recomienda asociar probióticos al tratamiento erradicador de manera generalizada |
| Recomendación 8. Tras el fracaso de un primer tratamiento que incluya claritromicina (triple o cuádruple) se recomienda una pauta con levofloxacino, preferiblemente cuádruple (IBP, amoxicilina, levofloxacino y bismuto). Otra alternativa es una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) |
| Recomendación 9. Tras el fracaso de un primer tratamiento con una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) se recomienda una pauta triple o cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino ±bismuto) |
| Recomendación 10. Tratamiento de rescate en pacientes alérgicos a penicilina: |
| a) Tras el fracaso de un primer tratamiento triple (IBP, claritromicina y metronidazol) se sugiere emplear una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) |
| b) Tras el fracaso de un primer tratamiento cuádruple con bismuto se sugiere una terapia triple con IBP, levofloxacino y claritromicina |
| Recomendación 11. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea con levofloxacino se recomienda un tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) |
| Recomendación 12. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) se recomienda un tratamiento con levofloxacino |
| Recomendación 13. Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) y una segunda línea con levofloxacino se sugiere un tratamiento cuádruple concomitante (IBP, amoxicilina, claritromicina y metronidazol) |
| Recomendación 14. Tras el fracaso de un tercer tratamiento se sugiere reevaluar cuidadosamente la necesidad de erradicar la infección y, en su caso, pautar una cuarta línea con rifabutina (IBP, amoxicilina y rifabutina) |
| Recomendación 15. En los pacientes con úlcera duodenal no complicada que no requieren AINE/aspirina no se recomienda mantener el tratamiento antisecretor tras haber finalizado el tratamiento erradicador de H. pylori. |
| Recomendación 16. En los pacientes con úlcera gástrica que no requieren AINE/aspirina se recomienda mantener el tratamiento antisecretor durante 4 a 8 semanas tras haber finalizado el tratamiento erradicador de H. pylori |
| Recomendación 17. En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H. pylori elimina la práctica totalidad de las recidivas; por tanto, una vez confirmada la erradicación y en ausencia de toma de AINE/aspirina, se recomienda no administrar tratamiento de mantenimiento con antisecretores |
Fármacos, dosis y duración de los tratamientos erradicadores para la infección por Helicobacter pylori
| Tratamiento | Fármacos | Posología | Duración (días) |
|---|---|---|---|
| Terapia cuádruple sin bismuto (concomitante) | IBP Amoxicilina Claritromicina Metronidazol | Dosis estándara/12 h 1 g/12 h 500 mg/12 h 500 mg/12h | 14 |
| Terapia cuádruple con bismuto Pylera® | IBP Pylera® | Dosis estándar/12 h 3 cápsulas/6 h | 10 |
| Terapia cuádruple con bismuto clásica | IBP Subcitrato de bismuto Doxiciclinab Metronidazol | Dosis estándar/12 h 120 mg/6 h o 240 mg/12 h 100 mg/12 h 500 mg/8 h | 10-14 |
| Terapia cuádruple con levofloxacino y bismuto | IBP Amoxicilina Levofloxacino Subcitrato de bismuto | Dosis estándara/12 h 1 g/12 h 500 mg/24 h 240 mg/12 h | 14 |
| Terapia triple con levofloxacino | IBP Amoxicilina Levofloxacino | Dosis estándar/12 h 1 g/12 h 500 mg/24 h | 14 |
| Terapia triple con rifabutina | IBP Amoxicilina Rifabutina | Dosis estándar/12 h 1 g/12 h 150 mg/12 h | 10 |
IBP: inhibidor de la bomba de protones.
El beneficio de administrar IBP de última generación (rabeprazol o esomeprazol) y la utilización de doble dosis de los mismos no está claramente establecido, a diferencia de lo que ocurría con el tratamiento triple estándar; sin embargo, es probable que estas optimizaciones añadan también beneficios erradicadores a estas pautas terapéuticas.
Algoritmo para el tratamiento inicial y de rescate de la infección por Helicobacter pylori.
H: horas; IBP: inhibidor de la bomba de protones.
* La terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría ser una alternativa como tratamiento erradicador de primera línea, una vez que su eficacia sea confirmada en nuestro medio.
† Existe una nueva formulación con todos los antibióticos incluidos en una única cápsula.
# La tetraciclina clorhidrato/hidrocloruro por separado no está comercializada en España; se puede emplear en su lugar doxiciclina (100mg/12h), aunque la experiencia es mucho más limitada y existen dudas sobre su equivalencia terapéutica.
§ Se sugiere reevaluar cuidadosamente la necesidad de erradicar la infección.
Debido a que la ventaja de guiar la terapia erradicadora mediante el estudio de la susceptibilidad antimicrobiana de la cepa de H.pylori frente a la administración empírica del tratamiento no ha sido suficientemente confirmada11,12, y a que este estudio no es generalmente accesible13, los comentarios incluidos en este documento de consenso se basarán en el supuesto de que dicha susceptibilidad es desconocida.
• Recomendación 1. Actualmente se recomienda que un tratamiento erradicador sea considerado efectivo cuando sea capaz de curar la infección por H.pylori en un porcentaje próximo o preferiblemente superior al 90% de los pacientes.
Acuerdo: 92,3%; votos: totalmente de acuerdo (84,6%); bastante de acuerdo (7,7%); totalmente en desacuerdo (7,7%). GR: fuerte. CE: muy baja.
El objetivo de la terapia dirigida a eliminar cualquier microorganismo debería ser alcanzar un éxito del 100%, y la infección por H.pylori no debe ser una excepción14. Sin embargo, en todos los consensos europeos15-18 y españoles2,4,5 previos se había establecido que una tasa de curación igual o superior al 80% podía ser considerada suficiente. Dado que actualmente disponemos de terapias cuádruples con tasas de curación próximas o incluso superiores al 90%19,20, se ha considerado que este umbral de eficacia debe ser, en adelante, el exigido para considerar como efectivo un tratamiento frente a la infección por H.pylori. Para conseguir este objetivo, todos los tratamientos deben estar optimizados en términos de duración, dosis e intervalo de administración de inhibidores de la bomba de protones (IBP) y antibióticos21.
• Recomendación 2. Como tratamiento de primera línea de la infección por H.pylori se recomienda una pauta cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol).
Acuerdo: 100%; votos: totalmente de acuerdo: (100%). GR: fuerte. CE: moderada.
La elección del tratamiento de primera línea para la infección por H.pylori dependerá primordialmente de la tasa de resistencia de esta bacteria a los antibióticos prescritos. No se recomienda la terapia triple clásica (IBP, claritromicina y amoxicilina) cuando la tasa de resistencia a claritromicina es >15%18, dado que por encima de este umbral las cifras de erradicación son inaceptablemente bajas21. Otros factores que influyen sobre la eficacia del tratamiento erradicador son el cumplimiento por parte del paciente y su historial previo de consumo de antibióticos, que podría condicionar la elección de la primera opción terapéutica21. A continuación se revisa la evidencia disponible respecto de las diferentes pautas de tratamiento de primera línea.
Terapia triple (IBP, claritromicina y amoxicilina)La eficacia media de la terapia triple en nuestro país fue del 80 y del 70% en 2 revisiones sistemáticas publicadas en 2011 y 201322,23. La eficacia de la terapia triple en los estudios publicados posteriormente en nuestro medio ha sido siempre inferior al 75%24,25. En un estudio multicéntrico reciente utilizando la terapia triple durante 14 días con dosis altas de IBP se consiguió incrementar la eficacia hasta el 81%26. Con respecto a la tasa media de resistencia a claritromicina en España, esta era del 14% en 200927 y del 18% en una revisión actualizada en el año 201323. Un reciente estudio ha evidenciado una tasa de resistencia a claritromicina del 34% en niños28, mientras que en un estudio multicéntrico andaluz publicado en 2015 la tasa media de resistencia fue del 18%29. En conjunto, toda esta evidencia apunta a la necesidad de abandonar la terapia triple como tratamiento de primera línea en España, especialmente cuando existen en la actualidad alternativas terapéuticas capaces de obtener tasas de curación significativamente mejores; entre ellas se encuentran las terapias cuádruples sin bismuto (en régimen secuencial, concomitante o híbrido), que se revisarán a continuación.
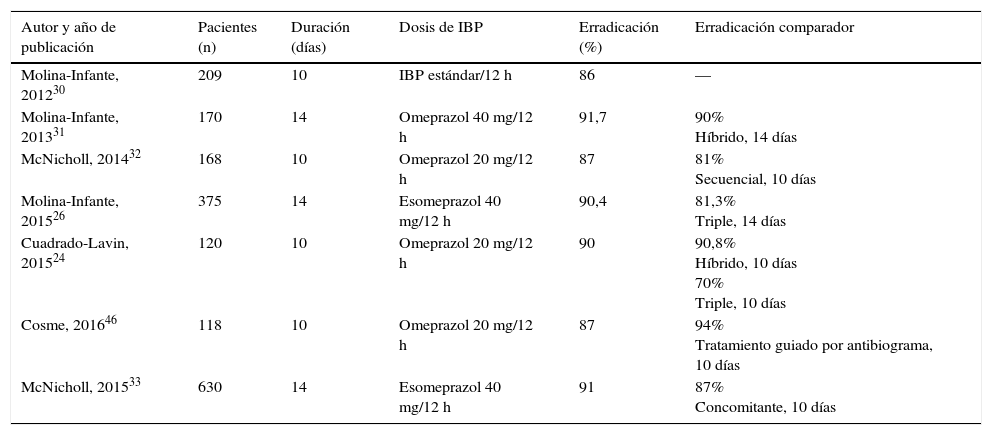
Terapias cuádruples sin bismuto (IBP, amoxicilina, claritromicina y metronidazol)La eficacia de las terapias cuádruples sin bismuto dependerá de la tasa de cepas de H.pylori resistentes a la vez a claritromicina y a metronidazol (resistencia dual o doble)21. El tratamiento concomitante es el cuádruple más efectivo en situaciones de alta resistencia. Se ha estimado que los tratamientos secuencial, híbrido y concomitante conseguirán tasas de curación >90% cuando esta tasa de resistencia doble esté por debajo del 5, del 9 y del 15%, respectivamente. En nuestro medio la tasa de resistencia dual se mantiene aún por debajo del 15%. Diversos estudios llevados a cabo en Europa (España24,26,30-33, Grecia34-36 e Italia37,38) y Asia (Taiwán39,40 y Japón41) han demostrado una eficacia próxima o superior al 90% en el análisis «por intención de tratar». No obstante, en determinadas regiones de Europa y Asia, con tasas de resistencia a claritromicina y metronidazol muy superiores, la eficacia del tratamiento concomitante ha sido subóptima (Turquía42, Corea del Sur43,44 y China45). Los resultados obtenidos con este tratamiento cuádruple en diversos estudios llevados a cabo en España desde el año 2012 se resumen en la tabla 3, constatándose una eficacia erradicadora media de aproximadamente el 90%24,26,30-33,46. Por tanto, el tratamiento cuádruple concomitante se considera una alternativa válida de primera elección.
Estudios españoles que han evaluado la eficacia («por intención de tratar») de la terapia cuádruple sin bismuto concomitante de primera línea en los últimos 5 años
| Autor y año de publicación | Pacientes (n) | Duración (días) | Dosis de IBP | Erradicación (%) | Erradicación comparador |
|---|---|---|---|---|---|
| Molina-Infante, 201230 | 209 | 10 | IBP estándar/12 h | 86 | — |
| Molina-Infante, 201331 | 170 | 14 | Omeprazol 40 mg/12 h | 91,7 | 90% Híbrido, 14 días |
| McNicholl, 201432 | 168 | 10 | Omeprazol 20 mg/12 h | 87 | 81% Secuencial, 10 días |
| Molina-Infante, 201526 | 375 | 14 | Esomeprazol 40 mg/12 h | 90,4 | 81,3% Triple, 14 días |
| Cuadrado-Lavin, 201524 | 120 | 10 | Omeprazol 20 mg/12 h | 90 | 90,8% Híbrido, 10 días 70% Triple, 10 días |
| Cosme, 201646 | 118 | 10 | Omeprazol 20 mg/12 h | 87 | 94% Tratamiento guiado por antibiograma, 10 días |
| McNicholl, 201533 | 630 | 14 | Esomeprazol 40 mg/12 h | 91 | 87% Concomitante, 10 días |
IBP: inhibidor de la bomba de protones.
Respecto a la terapia secuencial (IBP junto con amoxicilina durante los primeros 5días, seguido de IBP junto con claritromicina y metronidazol durante los últimos 5días), diversos estudios y metaanálisis recientes han puesto de manifiesto que no es superior a la terapia triple de 14días de duración47-50. Por otra parte, el tratamiento concomitante es significativamente superior al secuencial cuando ambos son pautados con una duración similar51. Además, recientemente se han publicado resultados subóptimos con esta pauta en nuestro medio32,52,53. Por tanto, actualmente se desaconseja el empleo de la terapia secuencial.
El tratamiento híbrido (IBP junto con amoxicilina durante los primeros 5-7días, seguido de IBP junto con amoxicilina, claritromicina y metronidazol durante los últimos 5-7días) es una alternativa terapéutica que reduce la carga de antibióticos durante la primera mitad del tratamiento, pudiendo favorecer teóricamente la tolerancia y el cumplimiento terapéutico. Este tratamiento demostró una eficacia inicial del 97% en un estudio multicéntrico llevado a cabo en Taiwán54, posteriormente confirmada en 2 estudios también provenientes de este país, incluso con una duración inferior a 14días55,56. No obstante, es importante destacar que la tasa de resistencia a claritromicina en Taiwán es baja, del 8%57. La eficacia del tratamiento híbrido ha sido corroborada en estudios posteriores en Irán58,59 y en España24,31. La tasa de erradicación en ambos estudios españoles fue del 90%, con duraciones de 1024 y 14días31. Por el contrario, se han publicado estudios recientes donde el tratamiento híbrido ha sido menos eficaz (77-85%) en Italia37,38 y Corea44,60. En cualquier caso, se precisa una validación comparativa más sólida de esta terapia híbrida antes de poder incorporarla a nuestro armamentario terapéutico.
En resumen, como tratamiento de primera línea de la infección por H.pylori en España se recomienda una pauta cuádruple concomitante sin bismuto. La duración y la dosis de sus componentes (esto es, IBP, claritromicina, amoxicilina y metronidazol) se resumen en la tabla 2. Para más detalles acerca de la duración del tratamiento, véase la recomendación 4.
• Recomendación 3. La terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría ser una alternativa como tratamiento erradicador de primera línea, una vez que su eficacia sea confirmada en nuestro medio.
Acuerdo: 100%; votos: totalmente de acuerdo (92,3%); bastante de acuerdo (7,7%). GR: débil. CE: baja.
La terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría ser una alternativa válida al tratamiento cuádruple sin bismuto, dado que está constituida por fármacos, como el bismuto y la tetraciclina, frente a los que H.pylori nunca o solo excepcionalmente es resistente61. Por otra parte, la resistencia a metronidazol puede ser parcialmente compensada mediante el uso prolongado, a intervalos cortos y con dosis altas de este antibiótico61. En países como China, con tasas de resistencia a claritromicina entre el 20 y el 40%, y a metronidazol superiores al 60%, donde ningún tratamiento triple o cuádruple sin bismuto alcanzará cifras aceptables de eficacia, las terapias cuádruples con bismuto constituyen actualmente el tratamiento de elección de primera línea62. Sin embargo, la experiencia en nuestro medio ha estado limitada por la frecuente falta de disponibilidad de tetraciclina.
Tres metaanálisis llevados a cabo en la última década han coincidido en subrayar que el tratamiento cuádruple con bismuto (eficacia media del 81, del 78 y del 77%) no aporta ninguna ventaja sobre el tratamiento triple63-65. Sin embargo, la terapia cuádruple con bismuto fue prescrita solo durante 7días en los estudios en los que se basan estos metaanálisis, y además fueron publicados hace una década o más, cuando las tasas de resistencia a claritromicina (que penalizan la eficacia de la triple terapia) eran considerablemente menores. Un reciente ensayo multicéntrico europeo demostró buenos resultados con Pylera® (una cápsula que contiene bismuto, tetraciclina y metronidazol) administrado durante 10días, alcanzando una eficacia «por intención de tratar» modificada (confirmada mediante una única prueba del aliento) del 90% (significativamente superior a la de la terapia triple)66. Existen, no obstante, algunas limitaciones e incógnitas en relación a esta nueva formulación galénica (Pylera®), como son: 1)está disponible en un formato único de 10días, cuando podría ser que la duración de 14días incrementara su eficacia frente a cepas de H.pylori resistentes a metronidazol67; 2)incluye dosis relativamente bajas de tetraciclina (2g/día en el esquema clásico frente a 1,5g/día en Pylera®); 3)hasta el momento es muy escasa la experiencia —y por tanto la evidencia científica— de esta nueva formulación terapéutica en el tratamiento de la infección en nuestro país, y 4)aunque Pylera® mejorará muy probablemente el cumplimiento terapéutico, se desconoce si influirá en la aparición de efectos adversos68. Además, no existen estudios comparativos entre terapias cuádruples sin bismuto (concomitante) y con bismuto. La reciente comercialización de Pylera® en España, en el año 2016, permitirá resolver todas estas dudas.
Por último, una novedad terapéutica recientemente incorporada son los tratamientos cuádruples con bismuto junto con amoxicilina y metronidazol. Estas combinaciones tienen la ventaja de utilizar antibióticos baratos y fácilmente accesibles, evitando la tetraciclina. La elevada eficacia de este nuevo esquema de primera línea de tratamiento (próxima o superior al 90%) ha sido demostrada en 2 recientes estudios llevados a cabo en China y Tailandia68,69, países con una elevada tasa de resistencia a claritromicina (del 45 y del 50%, respectivamente). Cabe destacar que la eficacia de este tratamiento cuádruple con bismuto frente a cepas resistentes a metronidazol se redujo significativamente cuando fue utilizado con una duración menor de 7días (72%)69 frente a 14días (>90%)68. No obstante, este prometedor esquema terapéutico debe ser validado en nuestro medio antes de poder ser recomendado.
En resumen, la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) podría ser una alternativa como tratamiento erradicador de primera línea en España, una vez que su eficacia sea confirmada en nuestro medio. La duración y la dosis de sus componentes se resumen en la tabla 2. Para más detalles acerca de la duración del tratamiento, véase la recomendación 5.
• Recomendación 4. Se recomienda que la duración del tratamiento cuádruple concomitante sin bismuto (IBP, claritromicina, amoxicilina y metronidazol) sea de 14días.
Acuerdo: 100%; votos: totalmente de acuerdo (85,7%); bastante de acuerdo (14,3%). GR: fuerte. CE: baja.
La terapia cuádruple concomitante sin bismuto, desarrollada a finales de los años noventa, fue diseñada inicialmente para reducir la duración del tratamiento erradicador70. De hecho, los estudios iniciales provenientes de Alemania y Japón sugerían que una duración de 3 a 5días podría ser suficiente para alcanzar tasas de curación aceptables71,72. Sin embargo, más recientemente, diferentes ensayos clínicos que han comparado esta terapia con duraciones diferentes han demostrado tasas de curación superiores con los tratamientos más largos: 3días (81%) vs. 5días (89%)73; 5días (87%) vs. 7días (90%)74; 5días (89%) vs. 10días (96%)75; o 5días (78%) vs. 14días (86%)38. En un reciente estudio español, no aleatorizado, un tratamiento concomitante con una duración de 14días (y con dosis altas de IBP) fue superior a otro con una duración de 10días (y con dosis estándar de IBP; 87% vs. 91%, p<0,01)33. Acorde con ello, el primer metaanálisis sobre esta terapia puso de manifiesto que la eficacia del tratamiento concomitante era dependiente de la duración, de tal manera que a mayor duración del tratamiento, mayor eficacia76. Por último, esta misma tendencia puede observarse en la experiencia colectiva española en los últimos 4 años, donde los tratamientos de 14 días son los únicos que de manera consistente han superado el umbral de eficacia del 90% (tabla 3).
En resumen, actualmente, y como norma general, se recomienda que la duración del tratamiento cuádruple concomitante sea de 14 días. El tratamiento concomitante conseguirá tasas de curación superiores al 90% en regiones con tasas de resistencia dual (claritromicina y amoxicilina) <15%, como es el caso de España en la actualidad, siempre que sea optimizado en términos de duración prolongada (14 días) (y posiblemente dosis altas de IBP)77.
• Recomendación 5. Se sugiere que la duración de la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) sea de 10 o 14días.
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: débil. CE: baja.
En un metaanálisis publicado en el año 2004 sobre diferentes tratamientos erradicadores se observó que la eficacia de la terapia cuádruple con bismuto administrada durante 1-3, 4 y 7días fue inferior comparada con una duración de 10 a 14días78. De igual manera, se constató que una duración igual o superior a 10 días alcanzaba tasas de curación superiores al 85%, incluso en regiones con elevada prevalencia de resistencia a metronidazol78. Sin embargo, en una reciente revisión sistemática de la Colaboración Cochrane, que incluía 6 estudios (1.157pacientes) con diferentes combinaciones cuádruples de bismuto, no se pudo demostrar una ventaja significativa de ninguna de las duraciones (7, 10 y 14días)79.
Hasta la fecha, existe un único estudio (417 pacientes) que compara directamente la terapia cuádruple con bismuto con una duración de 10 y 14días, sin encontrar diferencias entre ambas pautas (91,6% vs. 92,6%)80. En 2 grandes ensayos clínicos aleatorizados llevados a cabo con Pylera® (la cápsula que contiene bismuto, tetraciclina y metronidazol) con una duración de 10días, la eficacia «por intención de tratar» fue del 87,7%81 y del 80%66, siendo eficaz frente a las cepas resistentes a metronidazol en el 80 y en el 91% de los casos, respectivamente. En un pequeño estudio piloto donde se evaluó la eficacia de esta misma formulación galénica durante 14días la eficacia «por intención de tratar» fue del 85,1%, si bien consiguió erradicar el 100% de las cepas resistentes a metronidazol67. En todos estos estudios la eficacia «por protocolo» fue superior (91%81, 93%66 y 97%67) a la obtenida «por intención de tratar», lo que sugiere que el deficiente cumplimiento por la relativamente elevada tasa de efectos adversos con esta terapia (58%81, 47%66 y 74%67) sea la clave para explicar estos resultados, independientemente de la duración del tratamiento.
Un tratamiento cuádruple con bismuto de 10días será altamente eficaz frente a cepas sensibles a metronidazol, pero es probable que un tratamiento de 14días sea más eficaz que el de 10 frente a cepas resistentes a este antibiótico68. En este sentido, recientemente 2 estudios que han evaluado nuevos tratamientos cuádruples con bismuto asociado a IBP, amoxicilina y metronidazol han evidenciado tasas de curación >90% en China y Tailandia, países con tasas de resistencia a metronidazol del 45 y del 50%, respectivamente69,82; sin embargo, la eficacia de este nuevo tratamiento frente a cepas resistentes a metronidazol se redujo significativamente cuando fue utilizado con una duración inferior: 7días (72%)82 vs. 14 días (>90%)69. Este matiz debe ser tenido en cuenta en nuestro país, donde actualmente la cifra media de resistencia a metronidazol es del 41% (30-47%)23. La experiencia reciente en nuestro medio con el tratamiento cuádruple con bismuto de primera línea ha sido limitada por los frecuentes problemas de dispensación de las tetraciclinas. La reciente comercialización de Pylera® en nuestro medio permitirá dilucidar si este tratamiento es suficientemente eficaz utilizado durante 10días (único formato disponible en la actualidad) o si será preciso prolongar su duración. Son necesarios estudios comparativos que evalúen la eficacia, la seguridad y el coste de distintas pautas para aclarar la duración ideal de la terapia cuádruple con bismuto. Mientras tanto, parece prudente sugerir que la duración de esta terapia sea como mínimo de 10días.
• Recomendación 6. En pacientes alérgicos a la penicilina se recomienda de primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
La amoxicilina es uno de los agentes antimicrobianos más eficaces contra H.pylori y, por tanto, la mayoría de tratamientos erradicadores incluyen este antibiótico. Hasta el momento, la experiencia con el tratamiento erradicador en los pacientes alérgicos a la penicilina es muy escasa, aunque esta circunstancia está presente en la práctica clínica con relativa frecuencia.
En los pacientes con alergia a los betalactámicos se recomendaba generalmente un tratamiento triple con IBP, claritromicina y metronidazol18. En un metaanálisis realizado hace 15años el tratamiento con IBP, claritromicina y nitroimidazol se consideró relativamente efectivo para el tratamiento de la infección por H.pylori, con tasas medias de erradicación por encima del 80%83. En un estudio prospectivo español inicial se administró este régimen durante 7días a 12 pacientes alérgicos a la penicilina y se obtuvo una tasa de erradicación («por intención de tratar») de tan solo el 58%84. En otro estudio español posterior, en este caso multicéntrico, se alcanzaron cifras de erradicación tan bajas como del 55% al emplear este mismo tratamiento en 50 pacientes85. Las desalentadoras tasas de curación (<60%) en los recientes estudios españoles mencionados anteriormente84,85 podrían ser debidas, al menos en parte, al aumento de las tasas de resistencia tanto a la claritromicina como al metronidazol23,27,86.
Por otra parte, 2 grupos de investigadores han evaluado la eficacia de un régimen con IBP, tetraciclina y metronidazol durante 10días en 5 y 17pacientes con alergia a la penicilina, obteniendo tasas de erradicación «por intención de tratar» del 80-85%87,88. Estos alentadores resultados sugieren que esta combinación triple (o mejor aún, con la adición de bismuto, que resultaría en un régimen cuádruple) puede ser una mejor alternativa para el tratamiento de primera línea en presencia de alergia a la penicilina (principalmente en áreas con alta resistencia a metronidazol o claritromicina). Esto sería así, probablemente, debido a que el efecto negativo de la resistencia a metronidazol se supera por la coadministración de bismuto89 y porque la eficacia de este régimen no está influenciada por la resistencia a claritromicina66.
En este sentido, muy recientemente se han actualizado los resultados de un estudio multicéntrico español, prospectivo, en el que se administró a 267 pacientes alérgicos a la penicilina un tratamiento de primera línea con omeprazol, claritromicina y metronidazol durante 7días o con omeprazol, bismuto, tetraciclina y metronidazol durante 10días90. La tasa de erradicación «por intención de tratar» con la terapia triple fue de tan solo el 57%, siendo claramente mayor con el régimen cuádruple (74%). El cumplimiento del tratamiento fue del 94 y del 98%, respectivamente. Se describieron un 14% de efectos adversos con ambos regímenes (todos leves). Por lo tanto, se concluyó que, a pesar de que en zonas de baja resistencia a claritromicina se puede prescribir una combinación triple con IBP, claritromicina y metronidazol en pacientes alérgicos a la penicilina, la terapia cuádruple clásica con bismuto debe preferirse en áreas, como España, con alta resistencia a claritromicina.
Finalmente, Liang et al.91 aleatorizaron a 109 pacientes alérgicos a la penicilina a recibir una terapia cuádruple clásica con bismuto (IBP, bismuto, tetraciclina y metronidazol) durante 2 semanas o un régimen cuádruple con bismuto modificado (IBP, bismuto, tetraciclina y furazolidona). Las tasas de erradicación «por intención de tratar» fueron, respectivamente, del 88 y del 92%, apoyando la efectividad de los regímenes que contienen bismuto en pacientes alérgicos a la penicilina.
En resumen, en pacientes alérgicos a la penicilina en nuestro medio se recomienda de primera línea una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
• Recomendación 7. No se recomienda asociar probióticos al tratamiento erradicador de manera generalizada.
Acuerdo: 100%; votos: totalmente de acuerdo (85,7%); bastante de acuerdo (7,1%); algo de acuerdo (7,1%). GR: fuerte. CE: baja.
Los probióticos son microorganismos vivos que, administrados en cantidades adecuadas, pueden conferir efectos beneficiosos para la salud; actualmente están indicados en el tratamiento de la gastroenteritis aguda y la diarrea por antibióticos92. Los microorganismos más comúnmente utilizados en las formulaciones probióticas en la práctica clínica son Lactobacillus spp., Bifidobacterium y Saccharomyces, así como Bacillus, Streptococcus y Escherichia coli. Sus potenciales efectos beneficiosos incluyen la regulación de la microbiota intestinal, la estimulación de la respuesta del sistema inmune y la potencial actividad inhibitoria frente a H.pylori demostrada in vivo e in vitro93.
Existe sólida evidencia científica sintetizada en múltiples metaanálisis publicados sobre el uso de múltiples formulaciones probióticas distintas (Lactobacillus combinado con Bifidobacterium, lactoferrina bovina, fermento lácteo, Saccharomyces boulardii y otras formulaciones probióticas) que apuntan globalmente a una reducción de efectos adversos y, en menor medida, a una mejoría en las tasas de curación con los tratamientos erradicadores94-104. Sin embargo, se han publicado resultados negativos con el uso de probióticos asociados a la terapia triple105-107. Es probable que estos resultados discordantes estén relacionados con el uso de diferentes cepas y combinaciones de las mismas, así como de distintas concentraciones, dosis y duraciones del tratamiento77,108. Por otro lado, la inmensa mayoría de estudios publicados sobre probióticos han evaluado su impacto sobre la terapia triple clásica, un tratamiento bien tolerado, con una eficacia insuficiente y que ya no se recomienda como tratamiento de primera línea. Un metaanálisis reciente que incluía 33 ensayos clínicos y 4.459 pacientes demostró que la ganancia terapéutica obtenida con los probióticos era mayor cuanto menos eficaz era el tratamiento erradicador102. De hecho, la suplementación probiótica no aportó ningún beneficio terapéutico cuando la efectividad del tratamiento erradicador era superior al 80%. No se ha publicado hasta la fecha ningún estudio que evalúe la utilidad de los probióticos asociados al tratamiento cuádruple concomitante, que es el recomendado actualmente en España como primera línea.
Finalmente, es preciso señalar que los probióticos no están financiados en España, lo que incrementa el coste del tratamiento erradicador; además, hace más complejo el tratamiento cuádruple, al añadir un quinto fármaco. Por último, no se han publicado estudios que nos permitan predecir qué pacientes tienen un riesgo más elevado de padecer efectos secundarios con la antibioterapia, lo cual permitiría individualizar la administración de probióticos. Podría plantearse el uso de probióticos en casos muy seleccionados, como por ejemplo en pacientes con mala tolerancia o con efectos secundarios con tratamientos antibióticos previos.
En conclusión, se precisa disponer de una mayor evidencia acerca del impacto de los probióticos sobre la efectividad y la seguridad de las nuevas terapias cuádruples erradicadoras frente a H.pylori antes de que puedan ser implementados en la práctica clínica diaria. Por ello, por el momento no se recomienda asociar probióticos al tratamiento erradicador de manera generalizada.
• Recomendación 8. Tras el fracaso de un primer tratamiento que incluya claritromicina (triple o cuádruple) se recomienda una pauta con levofloxacino, preferiblemente cuádruple (IBP, amoxicilina, levofloxacino y bismuto). Otra alternativa es una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo: 100%; votos: totalmente de acuerdo (76,9%); bastante de acuerdo (15,4%); algo de acuerdo (7,7%). GR: fuerte. CE: moderada (tras fracaso de triple); baja (tras fracaso de cuádruple).
Tras fracaso de la triple terapiaTras el fracaso de una triple terapia con IBP, claritromicina y amoxicilina es concebible pensar que H.pylori ya era resistente a claritromicina (resistencia primaria) o bien que ha desarrollado resistencia (secundaria) a este antibiótico tras el tratamiento erradicador fallido; por tanto, se debe evitar utilizar de nuevo este antibiótico. En este sentido, un análisis combinado de 8 estudios constató una tasa de erradicación muy baja, del 46%, cuando se repitió la terapia que contenía claritromicina109.
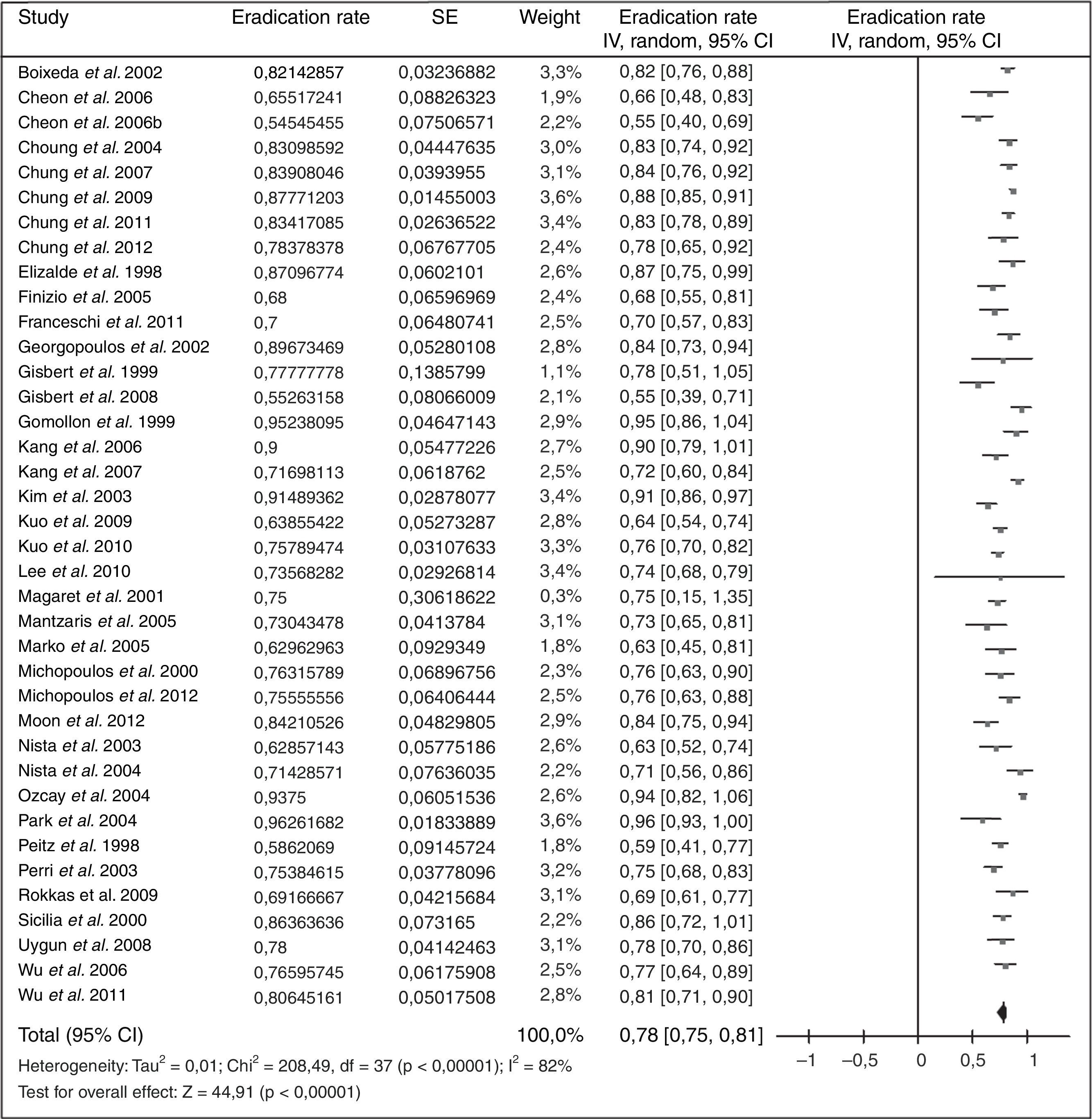
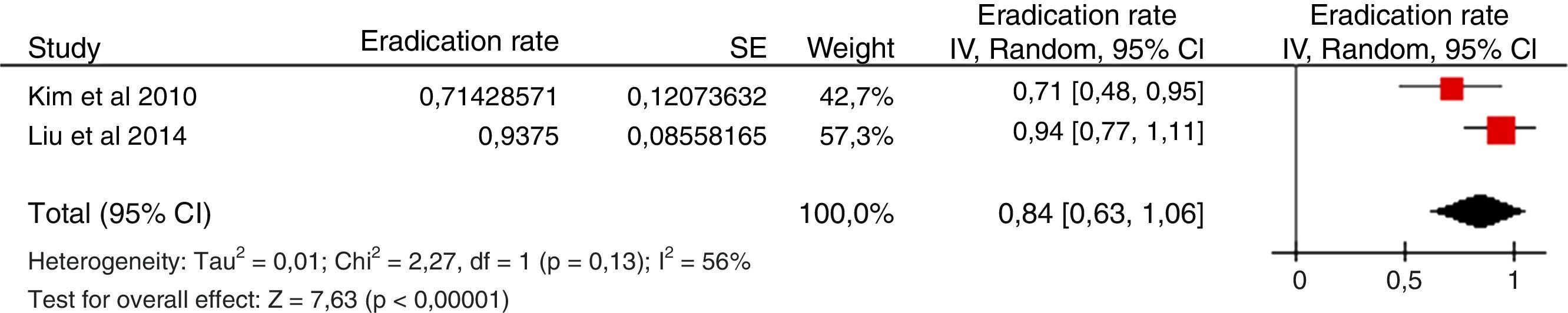
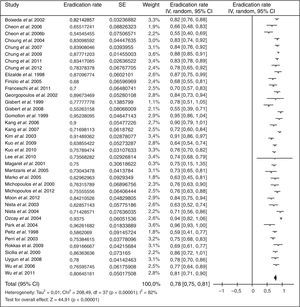
Cuando ha fracasado el tratamiento triple estándar (IBP, claritromicina y amoxicilina; combinación que actualmente ya no se recomienda) tradicionalmente se ha recomendado como rescate la terapia cuádruple clásica (IBP, bismuto, tetraciclina y metronidazol). Los resultados obtenidos con esta estrategia se resumen en la figura 2 (erradicación media del 78%)109.
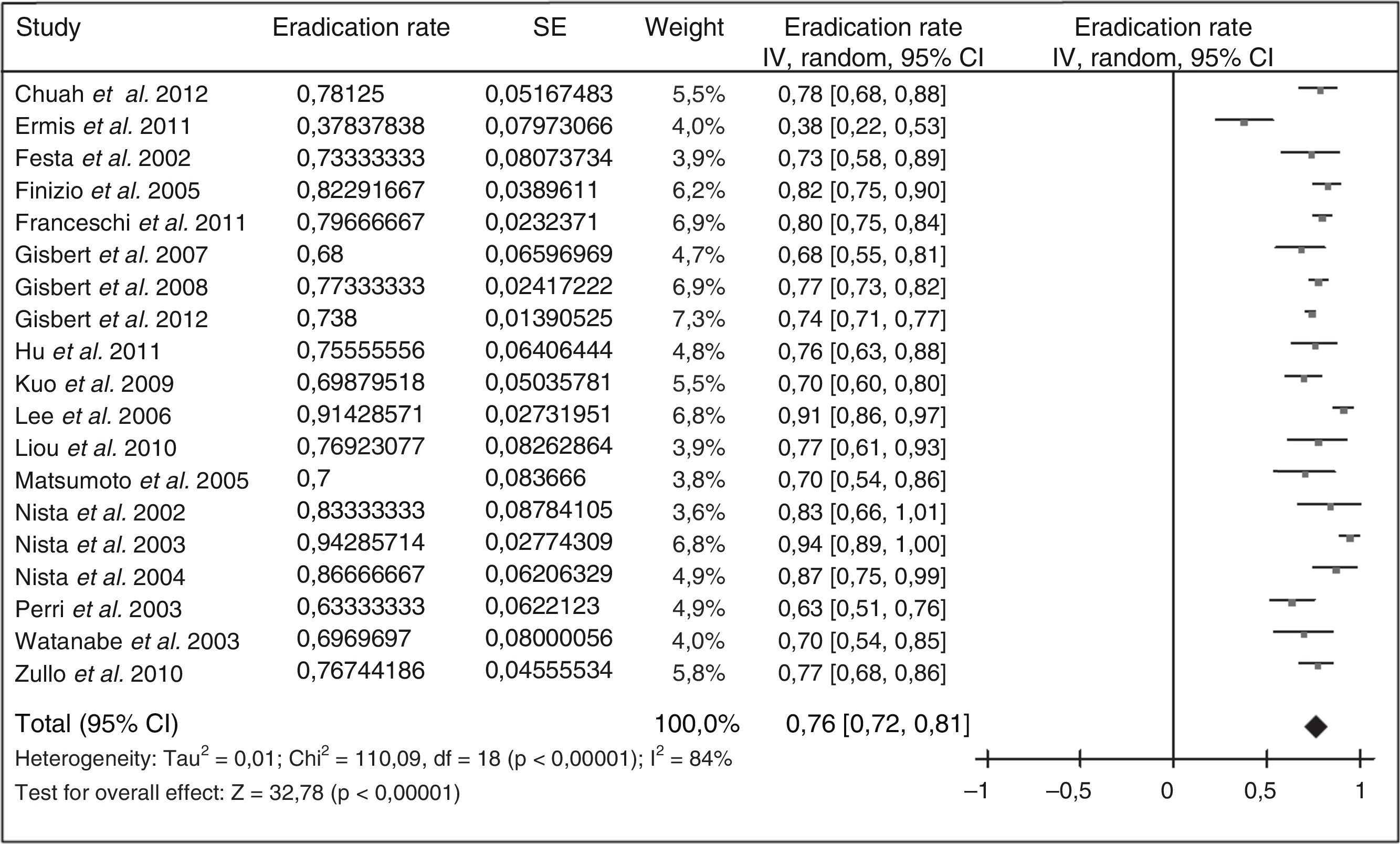
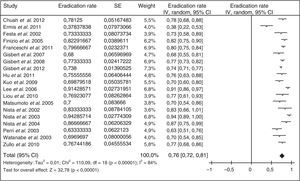
Debido a la complejidad de la terapia cuádruple con bismuto y a la ausencia de disponibilidad de tetraciclina y sales de bismuto en muchos países, más recientemente se han llevado a cabo diversos estudios empleando levofloxacino como tratamiento de rescate. Los resultados han sido alentadores, tal como se resume en la figura 3 (erradicación media del 76%). Tres metaanálisis han comparado, como segunda línea, una pauta triple con levofloxacino frente a una terapia cuádruple con bismuto, y han demostrado una mayor eficacia y una menor incidencia de efectos adversos con la terapia triple con levofloxacino110,111. Recientemente se ha actualizado dicho metaanálisis, incluyéndose 13 estudios con un total de 1.709 pacientes (1.011 con tratamiento triple con levofloxacino y 698 con terapia cuádruple de bismuto)109. Este metaanálisis evidenció una tendencia no estadísticamente significativa a una mayor eficacia erradicadora del tratamiento triple con levofloxacino frente al cuádruple con bismuto (79% vs. 70%; odds ratio [OR]=1,43; intervalo de confianza del 95% [IC 95%]=0,88-2,31), con una tasa significativamente menor de efectos adversos (14% vs. 32%; OR=0,30; IC 95%=0,19-0,50) y de efectos adversos graves (0,7% vs. 7,8%; OR=0,15; IC 95%=0,04-0,59). La triple terapia con levofloxacino de 10días demostró ser más eficaz que la de 7días (89% vs. 70%). Por último, un subanálisis que incluía únicamente estudios que administraban un tratamiento triple con IBP, levofloxacino, amoxicilina durante 10días demostró la mayor eficacia de este tratamiento en comparación con la terapia cuádruple con bismuto (89% vs. 66%; OR=4,22; IC 95%=2,84-6,26).
Estos prometedores resultados con levofloxacino han sido confirmados recientemente en un amplio estudio multicéntrico español, en el que 1.000 pacientes en los que había fracasado un primer tratamiento erradicador con IBP, amoxicilina y claritromicina recibieron durante 10días IBP, amoxicilina y levofloxacino112. La erradicación se logró en el 74% de los pacientes, y aunque se describieron efectos adversos en una quinta parte de los casos, ninguno de ellos fue grave. En este estudio se valoró también si la eficacia disminuía con el paso del tiempo, pues las resistencias a las quinolonas en España parecen estar incrementándose con rapidez. Sin embargo, las tasas de erradicación se mantuvieron estables con el paso del tiempo (durante los 6años del estudio)112.
No obstante, es evidente que la eficacia de la triple terapia con levofloxacino es mejorable (recordemos que actualmente nuestro objetivo terapéutico debe ser alcanzar una eficacia erradicadora igual o superior al 90% y no conformarnos con cifras menores, independientemente de que se trate de un tratamiento inicial o de rescate). Por otra parte, como se ha mencionado, la tasa de resistencias a las quinolonas está aumentando con relativa rapidez y ello puede repercutir negativamente en la eficacia de la terapia triple. Se ha sugerido que con la adición de bismuto se podría disminuir dicho efecto negativo. En este sentido, un reciente estudio ha demostrado que con la adición de bismuto (IBP, amoxicilina, levofloxacino y bismuto durante 14días) se obtiene una eficacia erradicadora del 95% «por protocolo»113. La eficacia «por intención de tratar» fue también elevada, del 88%. Estas cifras fueron superiores a las obtenidas con un tratamiento triple —tradicional— con IBP, amoxicilina y levofloxacino (sin bismuto). Estos resultados favorables se obtuvieron a pesar de una elevada tasa de resistencia a quinolonas (30%), superior a la descrita en nuestro medio. Este tratamiento cuádruple (IBP, amoxicilina, levofloxacino y bismuto) logró la erradicación en el 98% de los pacientes con cepas de H.pylori sensibles a las quinolonas y, lo que es más importante, alcanzó la erradicación en un porcentaje relativamente elevado (del 71%) de cepas resistentes a levofloxacino. Sin embargo, cuando se empleaba el tratamiento triple con levofloxacino habitual, únicamente se lograba erradicar la infección en el 38% de los pacientes con cepas resistentes a las quinolonas.
Diversos estudios han evaluado este tratamiento cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino y bismuto) como tratamiento de segunda línea, como se muestra en la tabla 4, alcanzando en general tasas de erradicación satisfactorias113-118. Entre ellos, un reciente estudio multicéntrico español administró una combinación cuádruple con esomeprazol (40mg/12h), amoxicilina (1g/12h), levofloxacino (500mg/24h) y bismuto (240mg/12h) durante 14días a 200 pacientes en los que había fracasado previamente una terapia triple (IBP, claritromicina y amoxicilina) o cuádruple sin bismuto118. El 96% de los pacientes tomó correctamente la medicación. Globalmente, las tasas de erradicación «por protocolo» y «por intención de tratar» fueron del 91,1 y del 90%. Estas cifras fueron similares independientemente del tratamiento previo. El 46% de los pacientes presentó efectos adversos, pero únicamente el 3% fue clasificado como intenso, y ninguno de ellos fue grave. Por tanto, los autores concluyeron que la terapia cuádruple con bismuto y levofloxacino durante 14días constituye una terapia de segunda línea eficaz (≥90% curación), simple y segura en pacientes con fracaso erradicador al tratamiento triple. No obstante, debe señalarse que se ha estimado que este tratamiento no alcanzará cifras de erradicación aceptables (≥90%) si la proporción de cepas de H.pylori resistentes a levofloxacino es >25%119. En España, los datos más recientemente publicados describen tasas de resistencia a levofloxacino del 15% en Cantabria120, del 27% en Cáceres31 y del 13% en un estudio multicéntrico andaluz29, por lo que se debe vigilar localmente el incremento de las tasas de resistencia a quinolonas.
Estudios que evalúan la eficacia («por intención de tratar») de la combinación de IBP, amoxicilina, levofloxacino y bismuto para la erradicación de la infección por Helicobacter pylori
| Autor y año de publicación | País | Línea de tratamiento | Duración (días) | Erradicación n/N (%) |
|---|---|---|---|---|
| Bago, 2007114 | Croacia | Primera | 7 | 57/66 (86) |
| Gao, 2010115 | China | Primera | 10 | 60/72 (83) |
| Gisbert, 2015118 | España | Segunda | 14 | 180/200 (90) |
| Hsu, 2008116 | Taiwán | Tercera | 10 | 31/37 (84) |
| Liao, 2013113 | China | Primera | 14 | 70/80 (87,5) |
| Yee, 2007117 | China | ≥ Segunda | 7 | 37/51 (73) |
IBP: inhibidor de la bomba de protones.
Finalmente, debe señalarse que un pequeño estudio ha evaluado recientemente, por primera vez, la eficacia de Pylera®, simplificando la administración de la terapia cuádruple con bismuto, en 49 pacientes con fracaso de uno o más tratamientos erradicadores121. La gran mayoría de pacientes habían recibido uno o varios tratamientos con omeprazol, claritromicina y amoxicilina; H.pylori era resistente a claritromicina en 31 de los 49 (63%) pacientes. El tratamiento con Pylera® durante 10días consiguió la erradicación de H.pylori en el 93 y el 95% de los pacientes en el análisis «por intención de tratar» y «por protocolo», respectivamente.
Tras fracaso de la terapia cuádruple sin bismutoLos tratamientos cuádruples sin bismuto, que incluyen IBP, amoxicilina, claritromicina y un nitroimidazol (sobre todo en régimen concomitante) son cada vez más utilizados como primera línea. Es un reto encontrar tratamientos de rescate tras el fracaso de estas terapias que emplean antibióticos clave como la claritromicina y los nitroimidazoles.
Para el presente consenso se ha realizado una revisión sistemática con metaanálisis para evaluar qué tratamientos de segunda línea se han investigado tras una tentativa fallida de erradicación de la infección por H.pylori con dichas terapias. Los estudios se seleccionaron si evaluaban la eficacia de regímenes de segunda línea tras el fracaso de terapias de primera línea como la secuencial, concomitante o híbrida. Se excluyeron los estudios si el tratamiento de segunda línea era elegido de acuerdo con la sensibilidad antibiótica, o si no se describía con detalle la composición de las terapias (administradas como primera línea o de rescate). Los datos se sintetizaron por tasa de erradicación «por intención de tratar» y, cuando fue posible, se realizaron metaanálisis utilizando el método de la varianza inversa.
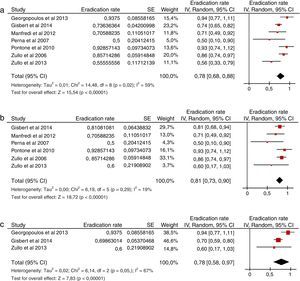
Utilizando dicha estrategia, se seleccionaron 16 estudios: 7 de ellos incluían pacientes tras el fracaso del tratamiento concomitante, 15 tras el fracaso del tratamiento secuencial y uno tras el fracaso del tratamiento híbrido. La mayoría de los estudios evaluaban una terapia de rescate con IBP, amoxicilina y levofloxacino, combinación con la que se obtuvo una tasa de erradicación global del 78% tras el fracaso de una terapia cuádruple sin bismuto (fig. 4a)36,37,122-126. En todos los estudios se administró el régimen de rescate durante 10días, y en todos excepto en uno122 se prescribieron 250mg de levofloxacino 2veces al día. Esta terapia triple (IBP, amoxicilina y levofloxacino) fue efectiva tanto tras el fracaso del tratamiento secuencial (81%) (fig. 4b)37,122-126 como del concomitante (78%) (fig. 4c)36,37,122. Solo un estudio37 evaluó los resultados de la terapia triple con levofloxacino tras el fracaso de la terapia híbrida, con un 50% de tasa de curación. La tolerancia de este régimen de rescate fue generalmente buena.
a Eficacia («por intención de tratar») de un tratamiento de segunda línea con IBP, amoxicilina y levofloxacino tras el fracaso erradicador de una terapia cuádruple sin bismuto (secuencial o concomitante).
Figura 4b Eficacia («por intención de tratar») de un tratamiento de segunda línea con IBP, amoxicilina y levofloxacino tras el fracaso erradicador de una terapia secuencial.
Figura 4c Eficacia («por intención de tratar») de un tratamiento de segunda línea con IBP, amoxicilina y levofloxacino tras el fracaso erradicador de una terapia concomitante.
Algunos autores han utilizado moxifloxacino en lugar de levofloxacino en este régimen triple de rescate (es decir, IBP, amoxicilina y moxifloxacino); la tasa media de erradicación fue del 71% (238 pacientes) tras el fracaso de terapias cuádruples sin bismuto127-129. Estos resultados deben interpretarse con cautela, debido a la alta heterogeneidad de los datos y a las diferencias en las características de los estudios (por ejemplo, la duración y la dosis de moxifloxacino eran diferentes en cada estudio).
Como se ha mencionado previamente, un aspecto importante de la terapia que contiene levofloxacino es que resulta menos efectiva en presencia de resistencia a fluoroquinolonas130. Así, estudios recientes sugieren que la eficacia de la terapia triple con levofloxacino está disminuyendo, probablemente debido al aumento de estas resistencias131. De igual manera, el bismuto parece poseer un efecto sinérgico con determinados antibióticos y superar en gran medida la resistencia a claritromicina y levofloxacino113,132. Así, algunos autores han evaluado un régimen cuádruple añadiendo bismuto al levofloxacino (es decir, IBP, amoxicilina, levofloxacino y bismuto) obteniendo resultados esperanzadores113-118. Un reciente estudio multicéntrico español evaluó la eficacia de una combinación cuádruple con IBP, amoxicilina, levofloxacino y bismuto, durante 14días, en 200 pacientes en los que había fracasado previamente una terapia triple o cuádruple sin bismuto (ya fuera secuencial o concomitante), obteniendo tasas de erradicación «por protocolo» y «por intención de tratar» del 91,1 y del 90%, respectivamente118. Estas cifras fueron similares independientemente del tratamiento previo: terapia triple 88,5% vs. secuencial 93,8% vs. concomitante 91,9%. Por tanto, la terapia cuádruple con bismuto y levofloxacino durante 14días constituye una terapia de segunda línea eficaz (≥90% curación) no solo en pacientes tras un fracaso erradicador con la terapia triple estándar sino también en aquellos con fracaso del tratamiento cuádruple secuencial o concomitante; los resultados son incluso mejores que los descritos con la terapia triple con levofloxacino.
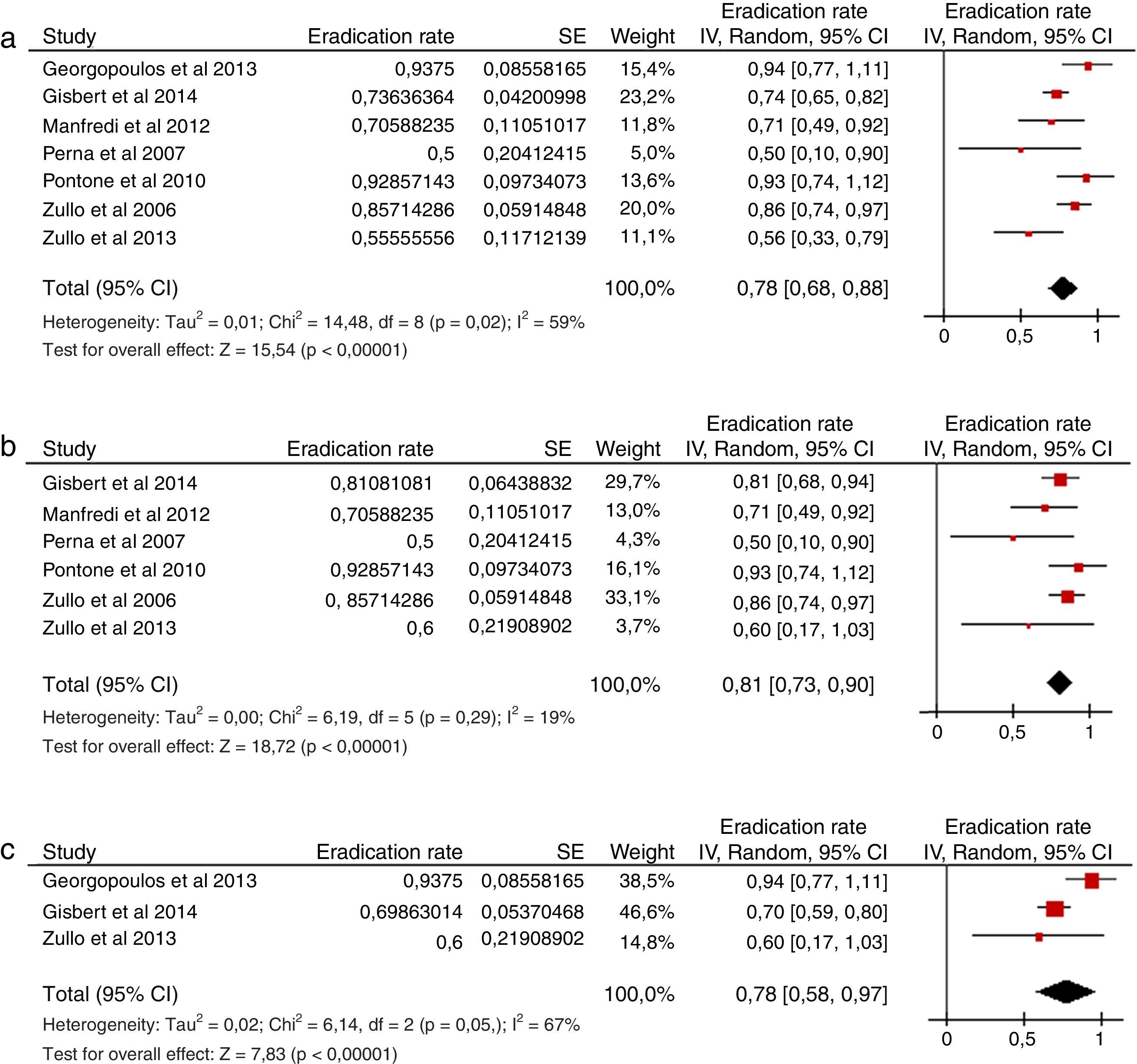
Hasta ahora, solo 2 estudios (ambos con un tamaño muestral pequeño) han evaluado la eficacia de la terapia cuádruple clásica (IBP, bismuto, tetraciclina y metronidazol) tras el fracaso de una terapia cuádruple sin bismuto (en régimen secuencial en ambos casos) (fig. 5). En el primero, la infección se erradicó en los 8 pacientes (100%) tratados con una terapia cuádruple con bismuto durante 10 días133; en el segundo, la infección se erradicó en 10 de 14 pacientes (71%) tratados durante 14días134.
Existe muy poca evidencia con otras opciones de tratamiento. Hsu et al.135 evaluaron una terapia cuádruple con bismuto modificada (administrando levofloxacino en lugar de metronidazol) tras fracaso erradicador con el régimen secuencial, obteniendo una tasa de erradicación del 96%. Fakheri et al.136 evaluaron, tras el fracaso de un régimen secuencial, una terapia híbrida con pantoprazol, amoxicilina y subcitrato de bismuto durante 14días, añadiendo furazolidona exclusivamente durante la primera semana; se erradicó la infección en el 81% de los pacientes. Finalmente, Liou et al.137 analizaron la eficacia de una terapia secuencial modificada durante 14días (lansoprazol y amoxicilina administrados durante los 7 primeros días, seguidos de lansoprazol, metronidazol y levofloxacino durante 7días más) tras el fracaso erradicador con el tratamiento secuencial, consiguiendo una tasa de erradicación del 80%.
En resumen, la terapia triple con IBP, amoxicilina y levofloxacino ha constituido el régimen de rescate más ampliamente evaluado tras el fracaso de las terapias cuádruples sin bismuto, alcanzando tasas de erradicación próximas al 80%. Más recientemente, el bismuto ha sido considerado como un valioso adyuvante en la terapia triple con levofloxacino; por lo tanto, la terapia cuádruple (IBP, amoxicilina, levofloxacino y bismuto) puede considerarse preferible a la triple como rescate, aunque la experiencia con este régimen es todavía limitada. Por último, la terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) ha logrado resultados alentadores como tratamiento de rescate, pero como se ha mencionado previamente, solo ha sido evaluada en 2 pequeños estudios.
• Recomendación 9. Tras el fracaso de un primer tratamiento con una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) se recomienda una pauta triple o cuádruple con levofloxacino (IBP, amoxicilina, levofloxacino ±bismuto).
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
Después de un fracaso erradicador con una terapia cuádruple con bismuto podría utilizarse teóricamente cualquier tratamiento, incluyendo la repetición de la misma terapia cuádruple con bismuto, dado que la tasa de resistencia adquirida después del uso de amoxicilina, bismuto o tetraciclina es insignificante (<3%) y la resistencia a metronidazol se puede superar parcialmente con mayores dosis y duración del antibiótico21. Sin embargo, parece lógico no repetir el tratamiento que ya ha fracasado. También parece razonable pensar que si se ha utilizado como primera opción el tratamiento cuádruple con bismuto es debido a la existencia de una elevada tasa de resistencia a claritromicina (la cual reduce la eficacia de la terapia triple) y combinada a claritromicina y metronidazol (lo que se asocia con una menor eficacia de las terapia cuádruples sin bismuto)21.
La experiencia tras el fracaso de un tratamiento cuádruple con bismuto es muy escasa. En este contexto, el consenso de MaastrichtIV recomendó el uso de una pauta triple con levofloxacino18. Los estudios que han evaluado la eficacia de una tercera línea combinando IBP, amoxicilina y levofloxacino para la erradicación de H.pylori después del fracaso de 2 tratamientos, siendo el de segunda línea la pauta cuádruple con bismuto, se resumen en la tabla 5 (eficacia entre el 60 y el 85%)138-142.
Estudios que evalúan la eficacia («por intención de tratar») de una combinación de tercera línea con IBP, amoxicilina y levofloxacino para la erradicación de la infección por Helicobacter pylori tras 2 fracasos erradicadores
| Autor y año de publicación | Pacientes (n) | Tratamientos previos (fallidos) | Duración (días) | Erradicación (%) |
|---|---|---|---|---|
| Gatta, 2005138 | 151 | 1°) IBP+C+A o M 2°) IBP+C+A o M; Q | 76 | |
| Gisbert, 2006139 | 100 | 1°) IBP+C+A 2°) Q | 10 | 60 |
| Gisbert, 2006140 | 20 | 1°) IBP+C+A 2°) Q | 10 | 85 |
| Rokkas, 2009141 | 30 | 1°) IBP+C+A 2°) Q | 10 | 70 |
| Gisbert, 2012142 | 200 | 1°) IBP+C+A 2°) Q | 10 | 68 |
A: amoxicilina; C: claritromicina; IBP: inhibidor de la bomba de protones; M: metronidazol; Q: terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Muy recientemente, un estudio coreano llevado a cabo en 28 pacientes ha demostrado que una triple terapia con moxifloxacino alcanza una tasa de erradicación del 67% como tratamiento de segunda línea tras el fracaso de un tratamiento cuádruple con bismuto128.
En un estudio realizado en China, la terapia con bismuto fue efectiva como tratamiento de primera línea en el 99% de los pacientes, y en los 2 pacientes en los que fracasó, la terapia secuencial (IBP y amoxicilina, seguida de IBP, claritromicina y metronidazol) fue efectiva133. Sin embargo, el empleo de un tratamiento de segunda línea que contenga claritromicina tras el fracaso erradicador de una terapia cuádruple con bismuto no parece ser, en general, útil en la práctica clínica, ya que esta terapia cuádruple con bismuto se suele recomendar precisamente como tratamiento de primera línea en áreas con una elevada resistencia a la claritromicina. Por el contrario, es bien sabido que la terapia triple con levofloxacino es efectiva como segunda línea tras el fracaso de una terapia con claritromicina110,111,143; por tanto, esta parecería más recomendable tras el fracaso erradicador de un régimen cuádruple con bismuto.
Por último, como se ha mencionado previamente (véase apartado dedicado al tratamiento de rescate tras el fracaso del tratamiento triple o cuádruple sin bismuto), la adición de bismuto a la terapia triple con levofloxacino ha alcanzado resultados prometedores; la eficacia de esta combinación (IBP, amoxicilina, levofloxacino y bismuto) como tratamiento de rescate tras el fracaso de la terapia cuádruple con bismuto debe ser evaluada en el futuro.
• Recomendación 10. Tratamiento de rescate en pacientes alérgicos a la penicilina:
- a)
Tras el fracaso de un primer tratamiento triple (IBP, claritromicina y metronidazol) se sugiere emplear una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
- b)
Tras el fracaso de un primer tratamiento cuádruple con bismuto se sugiere una terapia triple con IBP, levofloxacino y claritromicina.
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: débil. CE: muy baja.
La erradicación de H.pylori en pacientes alérgicos a la penicilina es un reto, especialmente en aquellos en los que ya ha fracasado un intento erradicador previo. En un estudio piloto español, 15 pacientes alérgicos a la penicilina en los que había fracasado un primer tratamiento con IBP, claritromicina y metronidazol recibieron un segundo tratamiento con IBP, claritromicina y levofloxacino durante 10días85. El cumplimiento fue completo en todos los casos. Se describieron efectos adversos en el 20% de los pacientes, todos ellos leves. La tasa de erradicación («por intención de tratar») fue del 73%.
Más recientemente, en un estudio multicéntrico español, 267 pacientes alérgicos a la penicilina recibieron un tratamiento de primera línea con IBP, claritromicina y metronidazol o una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol), y como tratamientos de rescate, una terapia cuádruple con bismuto o un régimen con IBP, claritromicina y levofloxacino durante 10días90. La tasa de erradicación «por intención de tratar» con IBP, claritromicina y levofloxacino fue del 64%, tanto tras el fracaso de IBP, claritromicina y metronidazol como de la cuádruple con bismuto de primera línea, y el cumplimiento fue del 88-100%, con un 23-29% de efectos adversos (todos leves). Por tanto, los autores concluyeron que un tratamiento triple con IBP, claritromicina y levofloxacino representa una alternativa de segunda línea en pacientes con alergia a la penicilina. La posibilidad de que la eficacia de esta última combinación pudiera incrementarse optimizando la dosis del IBP y la duración del tratamiento, o mediante la adición de bismuto, deberá ser explorada en el futuro.
Liang et al.91 aleatorizaron a 109 pacientes alérgicos a la penicilina (la mayoría de ellos tras fracaso a IBP, claritromicina y metronidazol) a recibir una terapia cuádruple clásica con bismuto (IBP, bismuto, tetraciclina y metronidazol) durante 2semanas o un régimen cuádruple con bismuto modificado (IBP, bismuto, tetraciclina y furazolidona; este último antibiótico no está disponible en España). Las tasas de erradicación «por intención de tratar» fueron, respectivamente, del 88 y del 92%.
En un estudio retrospectivo, Furuta et al.144 trataron a 28 pacientes alérgicos a la penicilina con IBP, metronidazol y sitafloxacino durante 1 o 2semanas, logrando la erradicación de H.pylori en el 100% de los pacientes. Estos alentadores resultados se obtuvieron a pesar de una elevada tasa de resistencia a levofloxacino (60%), lo que podría explicarse por el hecho de que el sitafloxacino tiene una concentración mínima inhibitoria (CMI) más baja que la del levofloxacino y podría ser eficaz en pacientes infectados por cepas con mutaciones en los genes gyrA (un marcador genético de resistencia a levofloxacino)145. Sin embargo, en este estudio las CMI del sitafloxacino no se determinaron y, por tanto, se desconoce la prevalencia de cepas resistentes a este antibiótico, así como también se ignora si el régimen empleado en este estudio es eficaz en pacientes con cepas de H.pylori resistentes al sitafloxacino. Obviamente, la eficacia de este régimen basado en sitafloxacino deberá ser confirmada en futuros estudios.
Finalmente, Tay et al.146 prescribieron, a un grupo de 69 pacientes alérgicos a la penicilina en los que había fracasado al menos un tratamiento triple estándar (habitualmente IBP, claritromicina y metronidazol), un régimen cuádruple con IBP, bismuto, ciprofloxacino y rifabutina, logrando una tasa de erradicación del 94%. Debe señalarse, no obstante, que los autores realizaron sistemáticamente cultivo y solo utilizaron este esquema en pacientes con cepas sensibles a quinolonas, lo que podría explicar los excelentes resultados obtenidos en este estudio.
En resumen, en pacientes alérgicos a la penicilina, tras el fracaso de un tratamiento triple (IBP, claritromicina y metronidazol) se sugiere emplear una terapia cuádruple con bismuto (IBP, amoxicilina, tetraciclina y metronidazol); mientras que, tras el fracaso de un primer tratamiento cuádruple con bismuto, se sugiere una terapia triple con IBP, levofloxacino y claritromicina.
• Recomendación 11. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea con levofloxacino, se recomienda un tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol).
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: muy baja.
Tras el fracaso de una combinación triple o cuádruple con claritromicina, frecuentemente se recomienda administrar una terapia triple con IBP, amoxicilina y levofloxacino5. En ocasiones este segundo tratamiento también fracasa, y en estos casos habitualmente se prescribe una terapia cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol)13. La elección del tratamiento de rescate depende de los fármacos que se hayan empleado en los intentos erradicadores previos. Ya que la repetición del mismo antibiótico no es recomendable (con las consabidas excepciones del bismuto, amoxicilina y, en menor medida, metronidazol), la terapia cuádruple con bismuto parece actualmente la opción más adecuada, pues evita fundamentalmente la readministración de claritromicina y levofloxacino y, por tanto, es la estrategia que se utiliza habitualmente en la práctica clínica en nuestro medio13.
No obstante, la experiencia con esta pauta cuádruple tras el fracaso de 2 tratamientos erradicadores es muy escasa. Recientemente se ha realizado un estudio multicéntrico español en el que se evaluó la eficacia de la terapia cuádruple con bismuto como tercera línea147. Una ventaja de esta pauta es que no se ve influenciada por la resistencia a claritromicina ni a las fluoroquinolonas (antibióticos empleados en el primer y segundo intento erradicador, respectivamente). Así, se incluyeron pacientes consecutivos en los que había fracasado un primer tratamiento con IBP, claritromicina y amoxicilina, y un segundo con IBP, amoxicilina y levofloxacino. Se administró un tercer tratamiento erradicador con IBP (a dosis estándar cada 12h), subcitrato de bismuto (120mg/6h o 240mg/12h), tetraciclina (entre 250mg/8h y 500mg/6h) y metronidazol (entre 250mg/8h y 500mg/6h) durante 7 a 14días. Se incluyeron 200 pacientes, 2 de los cuales no finalizaron el seguimiento. La erradicación «por intención de tratar» fue del 65%. Se describieron efectos adversos en el 22% de los casos, ninguno de ellos grave.
Una posibilidad ante el fracaso de 2 tratamientos erradicadores es realizar cultivo y antibiograma para, en función de la susceptibilidad bacteriana, seleccionar la combinación antibiótica más adecuada.
Aunque esta opción de tratamiento «dirigido» es la habitualmente recomendada en otros consensos, su ventaja sobre el tratamiento empírico no ha sido suficientemente confirmada. El subanálisis de los estudios que incluían tratamientos de segunda línea en un reciente metaanálisis11 y una revisión de la literatura12 en donde se comparaba la eficacia del tratamiento empírico frente a la terapia basada en la susceptibilidad antibiótica no pudo demostrar diferencias estadísticamente significativas entre ambas estrategias. No se identificó ningún ensayo clínico aleatorizado que comparara tratamiento empírico frente a dirigido por antibiograma en tercera línea, pero la tasa media de erradicación de los estudios que empleaban la estrategia basada en el cultivo fue de tan solo el 72%11.
Previamente se ha especificado que los comentarios incluidos en este documento de consenso se han basado en el supuesto de que la susceptibilidad antibiótica es desconocida. Además, la mayoría de los autores del presente documento opinan que hay argumentos para no realizar sistemáticamente cultivo antes de indicar un tercer tratamiento erradicador sino que, por el contrario, se debe recomendar la administración de un tratamiento empírico tras el fracaso de un segundo intento. Esta recomendación está basada en que el cultivo de H.pylori es una técnica disponible en pocos centros, que precisa realizar una prueba invasiva (endoscopia digestiva alta), con una sensibilidad inferior al 90% y con una aparente discordancia entre los resultados obtenidos in vitro y la tasa de erradicación in vivo148. Además, el cultivo únicamente proporciona información útil acerca de algunos antibióticos ya utilizados en tratamientos erradicadores previos de primera línea (claritromicina y metronidazol) y de segunda línea (levofloxacino), los cuales, por definición, no se deberían volver a emplear.
En resumen, se concluye que el tratamiento empírico de rescate cuádruple con bismuto es una alternativa válida tras el fracaso de un tratamiento con claritromicina y otro con levofloxacino.
• Recomendación 12. Tras el fracaso de un primer tratamiento con claritromicina y una segunda línea cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) se recomienda un tratamiento con levofloxacino.
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: baja.
Tras el fracaso de un tratamiento triple o cuádruple con claritromicina, frecuentemente se ha recomendado una terapia cuádruple con IBP, bismuto, tetraciclina y metronidazol5,13. Cuando este segundo tratamiento también fracasa, con la intención de no readministrar ni claritromicina ni metronidazol, se ha sugerido prescribir una pauta triple con IBP, amoxicilina y levofloxacino5,13.
No obstante, la experiencia con esta combinación tras el fracaso de 2 tratamientos erradicadores es escasa. Hace unos años se publicó un estudio multicéntrico español en el que se evaluaba la eficacia de la triple terapia con levofloxacino como tercera línea, alcanzándose la erradicación en aproximadamente el 70% de los casos139. Recientemente, estos resultados han sido confirmados en un estudio multicéntrico nacional más amplio, incluyendo un total de 200 pacientes142. Se incluyeron pacientes consecutivos en los que había fracasado un primer tratamiento con IBP, amoxicilina y claritromicina, y un segundo con una pauta cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol). Se administró un tercer tratamiento erradicador con IBP, amoxicilina y levofloxacino durante 10días. La erradicación «por intención de tratar» fue del 68%. Se describieron efectos adversos en el 19% de los casos, ninguno de ellos grave.
Otros autores han obtenido también aceptables resultados con este tratamiento triple de tercera línea con levofloxacino, con tasas de erradicación que han oscilado entre el 60 y el 86%, como se resume en la tabla 5138-142.
Por tanto, se concluye que el tratamiento empírico de rescate triple con IBP, amoxicilina y levofloxacino constituye una alternativa de tercera línea tras el fracaso de 2 terapias erradicadoras previas que contenían antibióticos clave como amoxicilina, claritromicina, metronidazol y tetraciclina. No existen resultados publicados aún con la terapia cuádruple con levofloxacino (añadiendo bismuto al tratamiento con IBP, amoxicilina y levofloxacino), que como hemos visto con anterioridad incrementa en un 15% la eficacia de la terapia triple con levofloxacino de segunda línea118, pero por analogía parece razonable que sea también una buena alternativa en este caso.
• Recomendación 13. Tras el fracaso de un primer tratamiento cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) y una segunda línea con levofloxacino se sugiere un tratamiento cuádruple concomitante (IBP, amoxicilina, claritromicina y metronidazol).
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: débil. CE: muy baja.
En este caso (fracaso de un primer tratamiento cuádruple con bismuto y una segunda línea con levofloxacino), puesto que no se ha utilizado claritromicina anteriormente, se sugiere emplear un tratamiento cuádruple sin bismuto (concomitante), que es precisamente el tratamiento de primera línea de elección en nuestro medio. Es preciso mencionar que esta recomendación no se basa en ninguna evidencia directa, sino que se establece de acuerdo con datos indirectos, asunciones teóricas y la ausencia de otras alternativas terapéuticas eficaces.
Otra opción es volver a utilizar el bismuto con amoxicilina y tetraciclina (fármacos para los que la tasa de resistencia adquirida es <3%), pero combinado con otros antibióticos no empleados previamente, como furazolidona (aunque este fármaco no está actualmente disponible en nuestro medio)149. Esta estrategia ha demostrado recientemente su eficacia91 y ha sido incluida en las últimas recomendaciones terapéuticas de consenso en China62, donde las tasas de resistencia primaria a claritromicina y levofloxacino son tan elevadas que impiden el empleo de tratamientos con estos antibióticos para la infección por H.pylori.
• Recomendación 14. Tras el fracaso de un tercer tratamiento se sugiere reevaluar cuidadosamente la necesidad de erradicar la infección y, en su caso, pautar una cuarta línea con rifabutina (IBP, amoxicilina y rifabutina).
Acuerdo: 100%; votos: totalmente de acuerdo (92,3%); bastante de acuerdo (7,7%). GR: débil. CE: muy baja.
En ocasiones la infección por H.pylori persiste a pesar de haber administrado 3 tratamientos erradicadores148. Dado que se desconoce si el beneficio obtenido por la potencial erradicación de H.pylori supera los problemas de seguridad con líneas de tratamiento más complejas, en estos pacientes se debe reevaluar individualmente la indicación del tratamiento erradicador y la posibilidad de dejar tratamiento antisecretor de mantenimiento. Evidentemente, la decisión de prescribir una cuarta línea de tratamiento será más clara cuanto mayor sea el beneficio de la erradicación de H.pylori, como es el caso de pacientes con un úlcera péptica (sobre todo si han sufrido complicaciones previas) o con un linfoma MALT gástrico.
Una reciente revisión de la literatura ha evaluado el papel de la rifabutina —un antibiótico que posee una elevada actividad in vitro frente a H.pylori— en el tratamiento de esta infección150. La tasa media de resistencia de H.pylori a la rifabutina (calculada a partir de 11 estudios, incluyendo 2.982 pacientes) fue de solo el 1,3%. Cuando únicamente se consideraron los estudios que incluían pacientes sin tratamiento erradicador previo, esta cifra fue incluso menor (0,6%). Globalmente, la tasa media de erradicación de H.pylori (análisis «por intención de tratar») con las combinaciones que incluían rifabutina (1.008 pacientes incluidos) fue del 73%. Específicamente, las cifras correspondientes para los tratamientos con rifabutina de cuarta/quinta línea (95 pacientes) fueron del 79%139,151-156. Para el tratamiento de la infección por H.pylori la mayoría de los estudios han empleado 300mg/día de rifabutina, dosis que parece ser más efectiva que la de 150mg/día. La duración óptima del tratamiento no está establecida, pero generalmente se recomienda administrarlo durante 10-12días. La incidencia media de efectos adversos fue del 22%; la mielotoxicidad fue el más relevante (por lo que debería realizarse un hemograma de control al finalizar el tratamiento), aunque excepcional; hasta este momento, todos los pacientes se han recuperado de la leucopenia sin problemas en unos pocos días tras la finalización del tratamiento, y no se han descrito infecciones ni otras complicaciones asociadas a la mielotoxicidad150.
Estos resultados han sido confirmados recientemente en un estudio multicéntrico español en el que se evaluó la eficacia de un cuarto tratamiento de rescate empírico con rifabutina en pacientes en los que habían fracasado previamente 3 intentos erradicadores (el primero con IBP, claritromicina y amoxicilina; el segundo con una cuádruple terapia con IBP, bismuto, tetraciclina y metronidazol, y el tercero con IBP, amoxicilina y levofloxacino)157. Se administró un cuarto tratamiento erradicador con IBP, amoxicilina (1g/12h) y rifabutina (150mg/12h) durante 10días. Se incluyeron 100 pacientes consecutivos. Ocho pacientes no tomaron la medicación correctamente (en 6 casos debido a efectos adversos). La tasa de erradicación «por intención de tratar» fue del 50%. Se describieron efectos adversos en 30 pacientes (30%). La mielotoxicidad, presente en el 4% de los pacientes y leve en todos ellos, se resolvió espontáneamente en todos los casos tras la finalización del tratamiento. Por tanto, se concluye que incluso tras el fracaso de 3 tratamientos previos, una cuarta terapia de rescate empírica con rifabutina (junto con IBP y amoxicilina) puede ser efectiva para erradicar la infección por H.pylori en aproximadamente la mitad de los casos. Finalmente, aunque la evidencia al respecto es muy limitada146,158, ante múltiples fracasos erradicadores podría plantearse asociar bismuto a la rifabutina, con la intención de incrementar la eficacia erradicadora.
En resumen, tras el fracaso de un tercer tratamiento se recomienda evaluar cuidadosamente la necesidad de erradicación y la posibilidad de dejar tratamiento antisecretor de mantenimiento. En caso de que se considere necesaria la erradicación, se recomienda valorar individualmente la necesidad de una cuarta línea de tratamiento, por ejemplo, con rifabutina, con un estricto control y seguimiento del paciente.
• Recomendación 15. En los pacientes con úlcera duodenal no complicada que no requieren antiinflamatorios no esteroideos (AINE)/aspirina no se recomienda mantener el tratamiento antisecretor tras haber finalizado el tratamiento erradicador de H.pylori.
Acuerdo: 100%; votos: totalmente de acuerdo (92,9%); bastante de acuerdo (7,1%). GR: fuerte. CE: alta.
Inicialmente, la mayoría de los autores que empleaban IBP en las terapias erradicadoras para la enfermedad ulcerosa duodenal no complicada (sin hemorragia digestiva ni perforación) prolongaban estos fármacos durante 2-4semanas tras la conclusión del tratamiento antibiótico, con el objetivo de asegurar la cicatrización ulcerosa159. Sin embargo, se ha comprobado que para obtener una elevada tasa de cicatrización ulcerosa en estos pacientes es suficiente el empleo de IBP limitado al período de administración de los antibióticos del tratamiento erradicador. Así, una revisión sistemática de la literatura médica identificó 24 estudios, incluyendo un total de 2.378 pacientes, en los que se evaluaba la cicatrización ulcerosa con IBP más 2 antibióticos durante 7 días160. La tasa de cicatrización media («por intención de tratar») fue del 86% al considerar todos los pacientes (tanto con éxito como con fracaso erradicador de H.pylori). Esta cifra ascendió al 95% cuando únicamente se incluyeron aquellos pacientes en los que se había erradicado la infección. El metaanálisis de los 6 estudios aleatorizados161-166 que comparan la eficacia en términos de cicatrización ulcerosa al administrar IBP más 2 antibióticos durante 7días frente a ese mismo tratamiento asociado a IBP durante 2-4semanas más160, constató la cicatrización de la úlcera en el 91 y el 92% de los casos, respectivamente. La OR para esta comparación fue de 1,11 (IC95%=0,71-1,74), siendo los resultados homogéneos. Por último, cuando se efectuó un subanálisis incluyendo únicamente los pacientes con úlcera duodenal, los resultados fueron similares (OR de 1,14, con un IC95% de 0,71 a 1,84). Posteriormente a la publicación de este metaanálisis se han llevado a cabo otros 2 estudios aleatorizados con resultados similares167,168.
En resumen, se concluye que para obtener una elevada tasa de cicatrización de la úlcera duodenal no complicada en pacientes que no toman AINE ni aspirina es suficiente el empleo de IBP durante el período de administración de los antibióticos. No obstante, en el caso de las úlceras duodenales complicadas (hemorragia digestiva, perforación) es prudente administrar antisecretores hasta confirmar la erradicación de H.pylori.
• Recomendación 16. En los pacientes con úlcera gástrica que no requieren AINE/aspirina se recomienda mantener el tratamiento antisecretor durante 4 a 8semanas tras haber finalizado el tratamiento erradicador de H.pylori.
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: moderada.
Existen 2 revisiones de la literatura médica publicadas hace más de una década que proporcionan argumentos a favor de no prolongar el tratamiento antisecretor en los pacientes con úlcera gástrica, en consonancia con la actitud adoptada con la úlcera duodenal. La primera de ellas concluye que «la erradicación de H.pylori induce una mayor cicatrización de las lesiones ulcerosas independientemente de que estas sean duodenales o gástricas»169. La otra revisión sistemática llega a la conclusión de que «la erradicación de H.pylori cicatriza tanto la úlcera duodenal como la gástrica, con un porcentaje de curación similar»170. De estos datos se desprendía que la tasa de cicatrización con el tratamiento erradicador de H.pylori era similar para la úlcera gástrica y la duodenal.
Sin embargo, estudios recientes sugieren la necesidad de prolongar el tratamiento con antisecretores, especialmente en las úlceras gástricas de tamaño superior a 1cm. Un primer estudio documentó la cicatrización del 100% de las úlceras gástricas menores de 1cm a las 8 semanas de la administración de un tratamiento erradicador durante 2semanas171. Esta tasa de cicatrización se redujo considerablemente cuando las úlceras fueron mayores de 1cm, siendo importante destacar que todas las úlceras no cicatrizadas a las 8semanas desaparecieron tras tratamiento adicional con IBP. Uno de los estudios, aleatorizado, que aporta información muy relevante sobre este tema evaluó la cicatrización de la úlcera gástrica asociada a H.pylori tras tratamiento erradicador durante una semana o IBP durante 8semanas172. Se pudo constatar que la tasa de cicatrización a las 8 semanas del tratamiento erradicador se reducía exponencialmente en función del tamaño de la úlcera (89% para úlceras <1cm, 54% para úlceras de entre 1 y 1,4cm y 5% para aquellas iguales o mayores de 1,5cm), mientras que era significativamente superior en el grupo tratado con IBP durante 8semanas (100% para úlceras <1cm, 77% para úlceras de entre 1 y 1,4cm y 77% para aquellas iguales o mayores de 1,5cm)172.
Más recientemente se ha publicado otro estudio aleatorizado en el que se comparaba la administración de terapia erradicadora aislada frente a dicha terapia seguida de IBP durante 3 semanas173. La cicatrización de la úlcera gástrica a las 4 semanas fue inferior en los pacientes tratados solo con triple terapia, sin IBP posterior (64% vs. 82%). Así mismo, en los pacientes con úlcera gástrica no cicatrizada, un ciclo de 4 semanas adicionales de IBP (esomeprazol) incrementó el porcentaje de cicatrización hasta el 89-96%. Cabe destacar que este estudio presenta ciertas deficiencias metodológicas, como la exclusión de pacientes con úlceras >2cm y un control endoscópico de la cicatrización excesivamente precoz (a las 4semanas) para una úlcera gástrica.
Finalmente, un reciente estudio japonés aleatorizó a 115 pacientes con úlcera gástrica estratificados en función del tamaño de la lesión (<0,5cm, 0,5-1,5cm y>1,5cm) a recibir tratamiento erradicador (durante una semana) más 7semanas de IBP vs. tratamiento erradicador más 7 semanas de un agente citoprotector168. Las tasas de cicatrización ulcerosa a las 8 semanas fueron significativamente superiores en el grupo de tratamiento erradicador más IBP. En concordancia con los estudios previos, los resultados de cicatrización ulcerosa con tratamiento erradicador más IBP fueron superiores para las úlceras gástricas >1,5cm (85% vs. 43%).
En resumen, la escasa evidencia disponible apunta a una mayor tasa de cicatrización ulcerosa con tratamiento erradicador seguido de IBP para las úlceras gástricas asociadas a la infección por H.pylori. En todos los estudios consignados previamente168,172,173 se constató una ausencia de cicatrización de hasta el 20% con el tratamiento erradicador aislado, siendo este fallo superior para las úlceras de mayor tamaño. Por tanto, se recomienda que, tras haber finalizado el tratamiento erradicador, se prolongue la terapia antisecretora entre 4 y 8semanas en las úlceras gástricas, especialmente en las mayores de 1cm. Finalmente, es conveniente recordar que tras completar el tratamiento erradicador y el IBP posterior, se debe realizar una revisión endoscópica para confirmar la cicatrización ulcerosa.
• Recomendación 17. En los pacientes con hemorragia digestiva por úlcera péptica la erradicación de H.pylori elimina la práctica totalidad de las recidivas; por tanto, una vez confirmada la erradicación y en ausencia de toma de AINE/aspirina, se recomienda no administrar tratamiento de mantenimiento con antisecretores.
Acuerdo: 100%; votos: totalmente de acuerdo (100%). GR: fuerte. CE: alta.
La úlcera péptica es la primera causa de hemorragia digestiva alta, y la infección por H.pylori es el factor etiológico principal en la enfermedad ulcerosa gastroduodenal174. La terapia antisecretora de mantenimiento a largo plazo ha sido el tratamiento estándar para prevenir la recidiva hemorrágica en los pacientes con un episodio previo de sangrado digestivo por úlcera péptica. Aunque es sobradamente conocido que la erradicación de H.pylori se asocia con una drástica disminución de las recidivas ulcerosas, hasta hace poco tiempo se desconocía la eficacia del tratamiento erradicador en la prevención de la recidiva hemorrágica por úlcera péptica.
Se ha publicado un metaanálisis, siguiendo la metodología de la Colaboración Cochrane, en el que se compara la eficacia del tratamiento erradicador de H.pylori frente al tratamiento antisecretor para la prevención de la recidiva hemorrágica por úlcera péptica175,176. En un primer subanálisis se incluyeron 7 estudios con un total de 578 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo de tratamiento erradicador fue del 2,9% y en el grupo sin tratamiento erradicador ni antisecretores de mantenimiento fue del 20% (OR=0,17; IC95%=0,10-0,32). En un segundo subanálisis se incluyeron 3 estudios con un total de 470 pacientes: el porcentaje promedio de recidiva hemorrágica en el grupo que recibió tratamiento erradicador fue del 1,6% y en el grupo en el que no se prescribió tratamiento erradicador pero sí antisecretores de mantenimiento fue del 5,6% (OR=0,24; IC95%=0,09-0,67). Diversos estudios han evaluado la incidencia de recidiva hemorrágica en pacientes con erradicación confirmada de H.pylori y que fueron seguidos sin administrar tratamiento antisecretor de mantenimiento177-196. Dado que la duración del seguimiento oscila notablemente entre los diversos estudios, se han tenido en cuenta los períodos de seguimiento de cada uno y se ha calculado la incidencia de recidiva hemorrágica anual respectiva (por paciente y año de seguimiento). Así, el seguimiento global fue de 1.913 pacientes-año, y se detectaron 13 recidivas hemorrágicas entre los pacientes en los que se erradicó la bacteria; la recurrencia anual fue del 0,88% por paciente y año de seguimiento.
Estos resultados favorables han sido confirmados en un reciente estudio multicéntrico español en el que se incluyeron prospectivamente 1.000 pacientes con hemorragia digestiva por úlcera gastroduodenal en los que se erradicó la infección por H.pylori y posteriormente no se prescribió tratamiento antisecretor197. Se detectaron 3 episodios de recidiva hemorrágica al año de seguimiento (en 2 casos tras la ingesta de AINE y en uno tras la reinfección por H.pylori), y otros 2 episodios a los 2años (uno tras la ingesta de AINE y otro tras la reinfección por H.pylori). La incidencia acumulada de resangrado fue del 0,5%, y la tasa de incidencia, del 0,15% por paciente-año. De los resultados mencionados se deduce que el tratamiento de la infección por H.pylori es más efectivo que el tratamiento antisecretor (ya sea con o sin antisecretores de mantenimiento) para prevenir la recidiva hemorrágica por úlcera péptica. Consecuentemente, debe evaluarse la presencia de infección por H.pylori en todos los pacientes con hemorragia digestiva por úlcera péptica y prescribirse tratamiento erradicador a los que estén infectados. Una vez confirmada la erradicación no es preciso administrar tratamiento de mantenimiento con antisecretores (si el paciente no requiere AINE), ya que la erradicación de H.pylori elimina la práctica totalidad de las recidivas hemorrágicas. No obstante, parece prudente que en una úlcera péptica que haya presentado complicaciones (por ejemplo, hemorragia digestiva) se administren antisecretores hasta confirmar la erradicación de H.pylori.
Conflicto de intereses de los participantes en la IV Conferencia Española de Consenso sobre el tratamiento de la infección de Helicobacter pyloriJavier P. Gisbert: asesoramiento científico, soporte para investigación y actividades formativas: Almirall, Allergan, AstraZeneca, Casen Recordati, Nycomed.
Javier Molina-Infante: asesoramiento científico: Casen Recordati; actividades formativas: Allergan, Zambón.
Javier Amador: ninguno.
Fernando Bermejo: ninguno.
Luis Bujanda: ninguno.
Xavier Calvet: actividades formativas: Allergan.
Manuel Castro-Fernández: actividades formativas: Allergan.
Antonio Cuadrado: ninguno.
J. Ignasi Elizalde: ninguno.
Emili Gene: ninguno.
Fernando Gomollón: ninguno.
Ángel Lanas: ninguno.
Carlos Martín de Argila: actividades formativas: Allergan, Casen Recordati.
Fermín Mearin: ninguno.
Miguel Montoro: asesoramiento científico: Almirall.
Ángeles Pérez-Aisa: actividades formativas: Allergan.
Emilio Pérez-Trallero: ninguno.
Adrián G. McNicholl: actividades formativas: Allergan.