Se necesitan nuevos parámetros, complementarios al TNM clínico, para orientar preoperatoriamente acerca de la resecabilidad R0 del cáncer gástrico. Analizaremos el posible valor predictivo del cociente neutrófilos/linfocitos (N/L) circulantes sobre dicha resecabilidad.
MétodosEstudiamos retrospectivamente 257 carcinomas gástricos, diagnosticados consecutivamente y sin tratamiento neoadyuvante. Realizamos un análisis univariante y multivariante de la frecuencia de casos con resección R0 entre los grupos con cociente N/L «normal» (<5) y «patológico» (≥5). Adicionalmente, estudiamos el subgrupo de pacientes operados (n=156), analizando la frecuencia de resección R0, según su cociente N/L<5 o≥5.
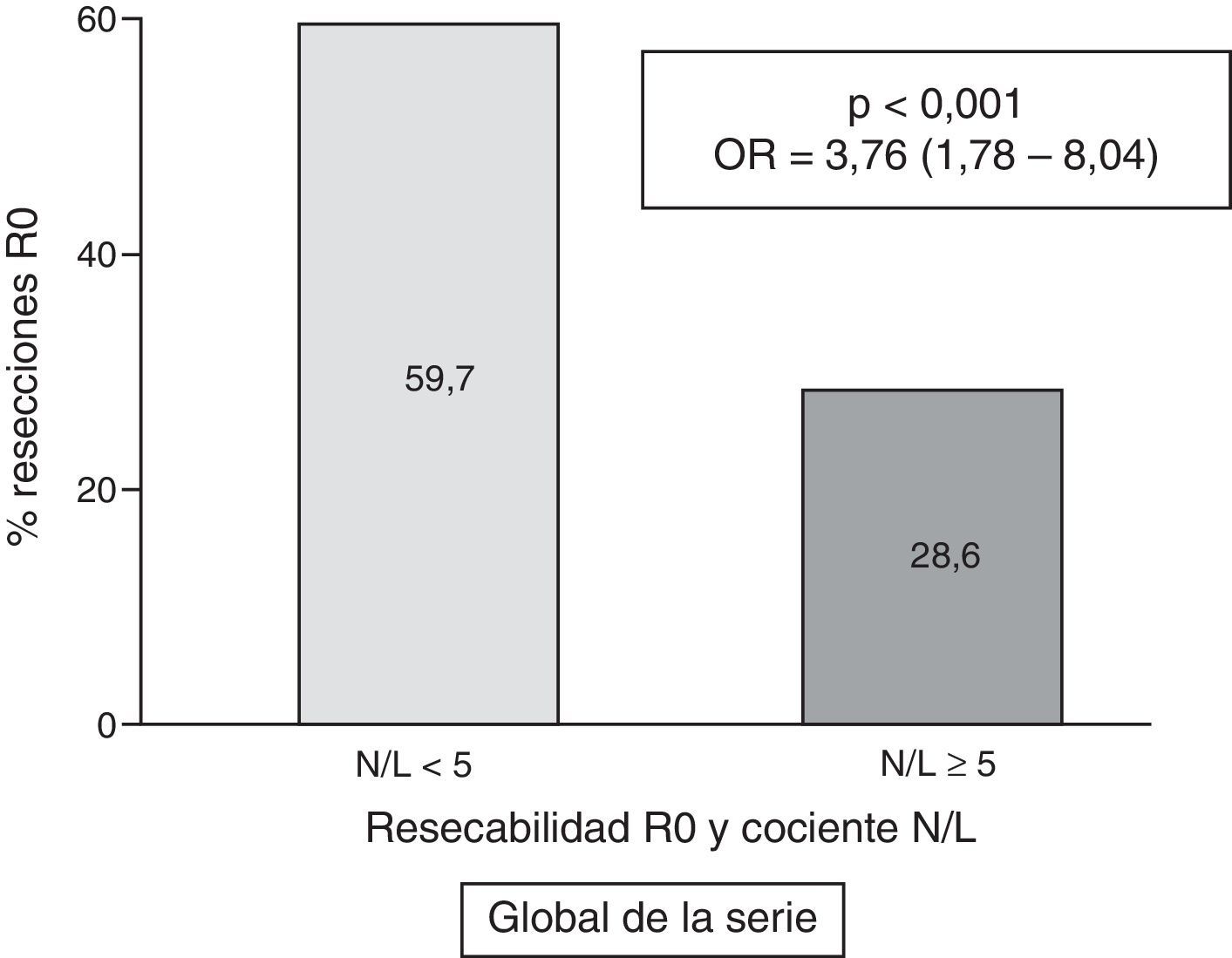
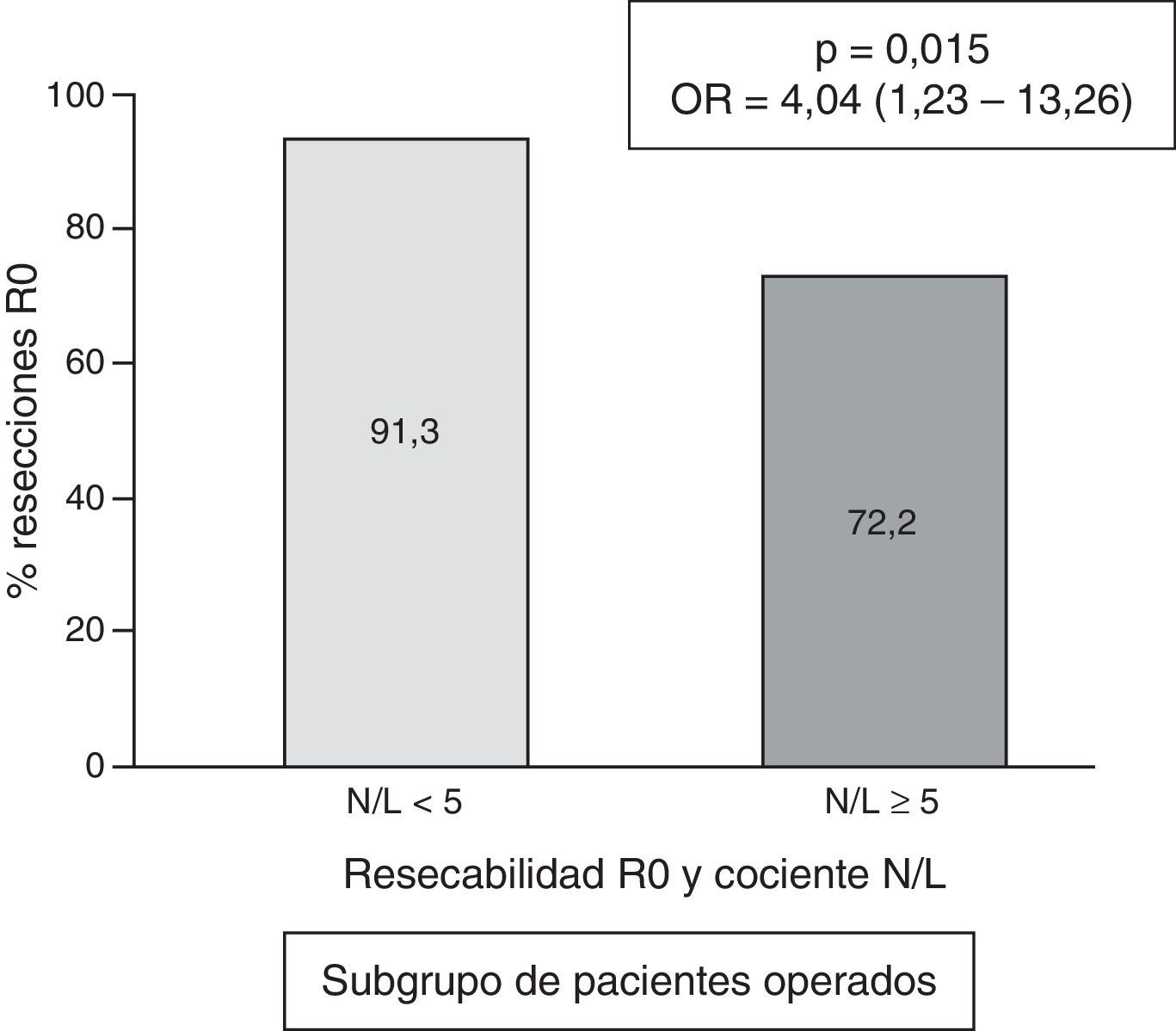
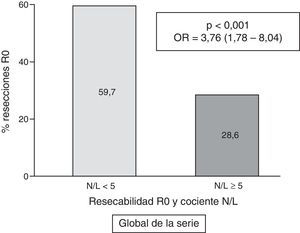
ResultadosFueron operados 156 casos, con 139 resecciones R0. Registramos un cociente N/L elevado en 46 casos (17,9%). Globalmente, la resecabilidad R0 fue superior en los pacientes con cociente N/L<5: 59,7% frente al cociente≥5: 28,6% (p<0,001; OR=3,76; IC 95%=1,78-8,04). En el análisis multivariante se confirma la relación entre cociente N/L<5 y resección R0 (p=0,006; OR=3,86; IC 95%=1,46-10,22). En el subgrupo de pacientes operados se mantiene la mayor frecuencia de resección R0 en los casos con cociente<5: 91,3% frente a 72,2% (p=0,015; OR=4,04; IC 95%=1,23-13,26).
ConclusionesDe modo global, un cociente N/L<5 en el momento del diagnóstico del cáncer gástrico se relaciona de modo significativo e independiente con una mayor frecuencia de resección tumoral R0. En el subgrupo de pacientes operados se confirma esta mayor proporción de resección R0 en los casos con cociente N/L<5.
New parameters complementary to clinical TNM classification are needed, to orient preoperative on the possibility of a R0 gastric cancer resection. We analysed the possible predictive value of blood neutrophil/lymphocytic ratio (N/L) in relation to resectability.
MethodsTwo hundred and fifty-seven gastric cancers consecutively diagnosed and without neoadjuvant treatment were retrospectively studied. Univariate and multivariate analysis of the frequency of R0 cases was performed between groups with a normal N/L ratio (<5) and pathological N/L ratio (≥5). Furthermore, we studied the subgroup of operated patients (n=156) analysing the frequency of R0 resection according to N/L ratio<5 or≥5.
ResultsOne hundred and fifty-six patients underwent surgical intervention, of which 139 had R0 resections. A high N/L ratio was registered in 46 cases (17.9%). Globally, resectability was higher in patients with a N/L ratio<5: 59.7% vs. N/L ratio≥5: 28.6% (P<.001; OR=3.76; 95% CI=1.78-8.04). The relation between N/L ratio<5 and R0 resection was confirmed in the multivariate (P=.006; OR=3.86; 95% CI=1.46-10.22). In the operated subgroup, the higher frequency of R0 resection achievement is maintained in cases with N/L ratio<5: 91.3% vs. 72.2% (P=.015; OR=4.04; 95% CI=1.23-13.26).
ConclusionsThe presence of a N/L ratio<5 at the diagnosis of a gastric carcinoma is related in a significant and independent way with a higher frequency of R0 tumoral resection, globally. This higher proportion of R0 resection cases in patients with a N/L<5 ratio is confirmed in the subgroup of operated patients.
El cáncer gástrico es un proceso patológico heterogéneo que incluye diferentes perfiles clínicos, epidemiológicos y moleculares1. Esta neoplasia viene presentando a lo largo de las últimas décadas un descenso en su incidencia, especialmente en los países occidentales2. No obstante, sigue manteniendo una elevada mortalidad, estimada a nivel mundial en 740.000 fallecimientos/año3, lo que supone el 10% de todos los exitus por cáncer4, solo superada por el cáncer de pulmón5. En el carcinoma gástrico se han publicado unas cifras de supervivencia a los 5 años de tan solo un 25%2, debidas a que muy frecuentemente el diagnóstico del tumor se efectúa en estadios avanzados6. La posibilidad de supervivencia pasa por la resección radical (R0) de la neoplasia3,7, aunque con frecuencia la extirpación no pueda asegurarse previamente y, de hecho, un elevado porcentaje de los pacientes acaba siendo no susceptible de resección3.
La orientación sobre la posible resecabilidad de la lesión se establece básicamente mediante la estadificación tumoral TNM clínica o pretratamiento8. A pesar de la mejoría de las exploraciones diagnósticas, sigue dándose el hecho de que la cirugía programada con intención curativa descubre entre un 5 y un 20% de casos con mayor progresión locorregional de la esperada y, sobre todo, de metástasis peritoneales o viscerales, no detectadas en la estadificación previa y que hacen irresecable al tumor9,10, lo que limita la validez predictiva del TNM clínico11,12. Una correcta clasificación previa de los pacientes es muy importante tanto para orientar más eficazmente una posible terapia con neoadyuvancia en caso de enfermedad avanzada13 como para intentar evitar laparotomías innecesarias, con su coste y morbilidad añadidos. Por tanto, antes de iniciar un tratamiento, sería útil contar con otros parámetros, aplicables a la totalidad de los casos diagnosticados de cáncer gástrico e independientes del TNM, que fueran potencialmente predictivos de resecabilidad R014. Para ello se ha analizado el posible valor predictivo de una serie de variables séricas que pudieran complementar la estadificación tumoral. Dentro de estos parámetros se han incluido marcadores tumorales como el antígeno carcinoembrionario y el antígeno carbohidratado 19-9, obteniéndose unos valores de sensibilidad para el diagnóstico de metástasis inferiores al 40%15. Muy recientemente, se ha postulado una relación entre el cociente de neutrófilos/linfocitos circulantes (cociente N/L) y la frecuencia de diseminación metastásica en el cáncer gástrico3,16, que haría irresecable la lesión. Dicho cociente N/L forma parte de la respuesta inflamatoria sistémica del paciente frente al tumor17. Contamos con 3 metaanálisis del año 201518–20 que confirman un peor pronóstico en los casos de cáncer gástrico resecado que previamente presentaban un cociente N/L elevado, relacionándolo con una posible mayor progresión de las lesiones en estos pacientes. Sin embargo, no disponemos de trabajos que analicen –antes de iniciarse el tratamiento y que, por tanto, incluyan casos con y sin indicación de cirugía– el valor pronóstico de un cociente N/L elevado sobre la posibilidad de resección R0 tumoral, independientemente del estadio TNM clínico del paciente. Por ello, el objetivo de nuestro estudio ha sido analizar, en todos los casos en los que se diagnosticó el tumor, el valor predictivo de la elevación del cociente N/L en sangre periférica sobre la posterior posibilidad de resección radical del cáncer gástrico, y comprobar si este valor es independiente con respecto a la estadificación TNM preoperatoria. Adicionalmente, hemos querido estudiar, en el subgrupo de pacientes que fueron operados, el valor predictivo del cociente N/L sobre la frecuencia de resección R0 de su neoplasia.
Pacientes y métodosAnalizamos retrospectivamente una serie de pacientes con carcinoma gástrico registrados durante el periodo enero 2005-diciembre 2009 en nuestro hospital, con una población asistida de 230.000 habitantes en el momento del estudio, obteniéndose la autorización del Comité Ético del centro para la revisión de las historias clínicas informatizadas. Los 257 casos incluidos fueron diagnosticados de modo consecutivo y confirmados mediante gastroscopia con toma de biopsias. Los pacientes no presentaban una enfermedad hematológica ni un proceso infeccioso o inflamatorio que pudiera alterar su fórmula leucocitaria. Fueron excluidos del estudio los casos que recibieron tratamiento neoadyuvante para descartar un posible efecto del tratamiento sobre la posterior resecabilidad.
Se efectuó el estudio de extensión tumoral mediante tomografía axial computarizada y ecoendoscopia para establecer la estadificación TNM pretratamiento. En 4 pacientes se practicó una laparoscopia diagnóstica. La decisión terapéutica se tomó de forma individualizada por el Comité Interdisciplinar de Tumores Digestivos, compuesto por especialistas en gastroenterología, cirugía digestiva, radiología, anatomía patológica y oncología médica y radioterápica, según los protocolos de nuestro hospital. Las indicaciones de tratamiento se agruparon en: A) casos no operables por el estado del paciente, tanto psíquico como físico (este último se valoró mediante la puntuación pretratamiento de la American Society of Anesthesiologists [ASA]; 1: sujeto sano; 2: enfermedad sistémica leve y controlada; 3: enfermedad sistémica grave, no incapacitante, y 4: enfermedad sistémica grave e incapacitante) y en segundo término por su edad; B) casos no operables por la aparente irresecabilidad del tumor tras el estudio de extensión, debida a la presencia de metástasis, según la estadificación clínica TNM de la American Joint Committee on Cancer, 7.a edición21, y C) casos operables con intención curativa, que fueron intervenidos. Los pacientes fueron operados por un mismo equipo quirúrgico especializado, confirmándose la cirugía radical o R0 tras la ausencia de afectación microscópica tumoral en el estudio anatomopatológico de la pieza.
Comparamos las posibles diferencias en cuanto a edad (test de Student) y puntuación ASA (test de Chi2) entre los casos considerados como no operables por las características del paciente y el resto de la serie.
El cociente N/L en sangre periférica se determinó en la analítica más próxima al inicio del tratamiento, una vez diagnosticado el tumor. Este plazo fue siempre inferior a los 7 días naturales. Tras comprobar su distribución normal o no mediante el test de Kolmogorov-Smirnov, determinamos la mediana y el rango intercuartílico de los valores del cociente N/L en el global de la serie. Con el test de Mann-Whitney comparamos las posibles diferencias de los valores cuantitativos del cociente N/L entre los grupos con y sin resección tumoral R0.
El punto óptimo de corte del cociente N/L se determinó mediante el estudio de la curva ROC, quedando establecidos como patológicos los valores de N/L iguales o superiores a 5. Efectuamos un análisis univariante de la frecuencia de resecabilidad R0 mediante los test de Chi2 y Fisher, determinando la odds ratio (OR) y su intervalo de confianza al 95% (IC 95%). Se valoraron los siguientes parámetros: sexo del paciente; edad mayor de 70 años (punto óptimo de corte según la curva ROC); localización anatómica de la neoplasia: tercio proximal, medio o distal; tipo histológico de Lauren: intestinal o difuso, y grado de diferenciación en las biopsias endoscópicas (bueno, moderado, poco diferenciado e indiferenciado); estadificación tumoral TNM al diagnóstico (i-iv) y, finalmente, cociente N/L<5 o≥5.
Las variables que mostraron una p<0,05 fueron incluidas en un análisis multivariante de regresión logística binaria, siendo la variable dependiente la resecabilidad R0 y calculando la OR así como su IC 95%.
Por último, hemos estudiado por separado al subgrupo de pacientes que se consideraron operables y que fueron intervenidos con intención curativa. En dicho subgrupo cuantificamos los casos con cociente N/L≥5 y comparamos la frecuencia de resecciones R0 conseguidas entre los pacientes con y sin cociente N/L patológico.
Para los cálculos estadísticos se empleó el programa SPSS® 19 para Windows (SPSS Inc., Chicago, IL, EE. UU.), considerando significativos los valores de p<0,05.
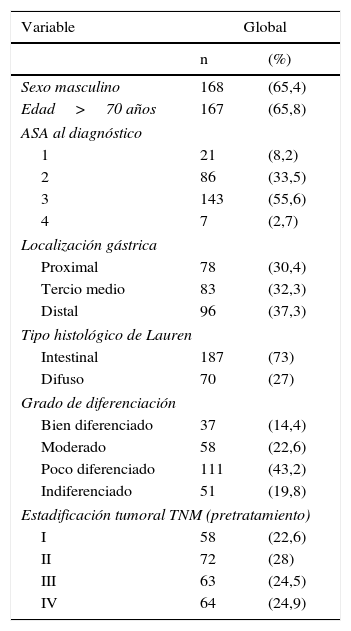
ResultadosLas principales características de nuestra serie (n=257), referentes a los pacientes y a su neoplasia, se describen en la tabla 1.
Características de la serie estudiada (n=257)
| Variable | Global | |
|---|---|---|
| n | (%) | |
| Sexo masculino | 168 | (65,4) |
| Edad>70 años | 167 | (65,8) |
| ASA al diagnóstico | ||
| 1 | 21 | (8,2) |
| 2 | 86 | (33,5) |
| 3 | 143 | (55,6) |
| 4 | 7 | (2,7) |
| Localización gástrica | ||
| Proximal | 78 | (30,4) |
| Tercio medio | 83 | (32,3) |
| Distal | 96 | (37,3) |
| Tipo histológico de Lauren | ||
| Intestinal | 187 | (73) |
| Difuso | 70 | (27) |
| Grado de diferenciación | ||
| Bien diferenciado | 37 | (14,4) |
| Moderado | 58 | (22,6) |
| Poco diferenciado | 111 | (43,2) |
| Indiferenciado | 51 | (19,8) |
| Estadificación tumoral TNM (pretratamiento) | ||
| I | 58 | (22,6) |
| II | 72 | (28) |
| III | 63 | (24,5) |
| IV | 64 | (24,9) |
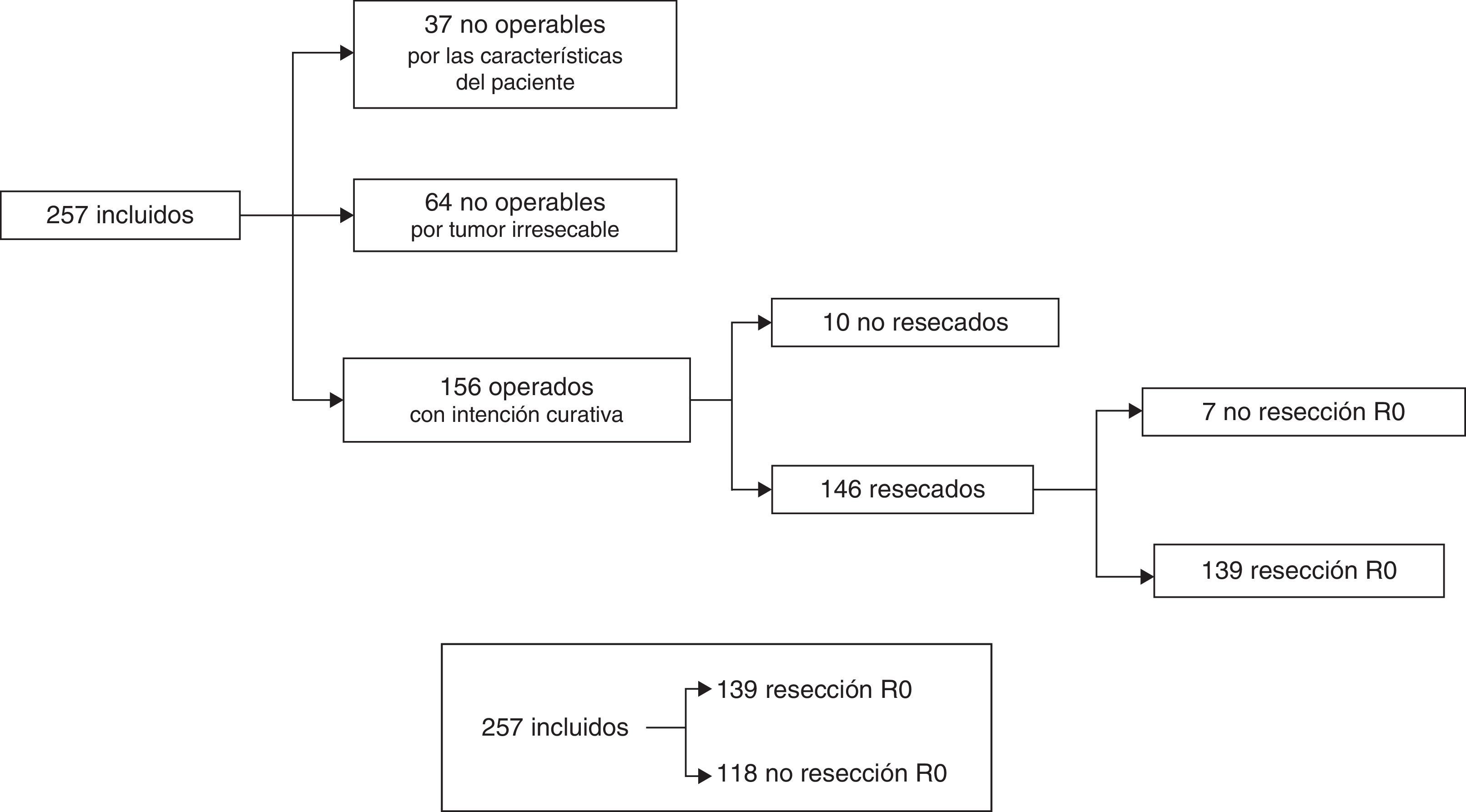
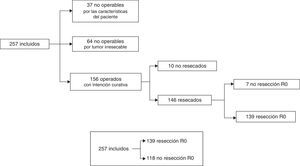
Los grupos de decisiones terapéuticas se representan en forma de diagrama de flujo en la figura 1 y fueron: A) casos no operables por las características del paciente: 37/257 (14,4%); B) no operables por considerarse irresecables: 64/257 (24,9%), y C) casos operables con intención curativa: 156/257 (60,7%). Dentro del grupo C, pacientes considerados inicialmente como operables, solo se pudo realizar una laparotomía exploradora en 6/156 casos (3,8%), cirugía paliativa derivativa en 4/156 (2,6%) y resección con bordes microscópicamente afectados (R1) en 7/156 (4,5%). En los 139 casos restantes (89,1%) se consiguió una resección tumoral R0. Nuestra serie global quedó finalmente dicotomizada en casos con resección R0: 139/257 (54,1%) y resto de casos: 118/257 (45,9%) (fig. 1).
La edad media del grupo A, considerado como no operable por las características del paciente, fue de 83,8±9,9 años, significativamente superior a la del resto de los casos: 70,8±11,1 (p<0,001). Así mismo, la puntuación de la clasificación ASA del grupo A fue superior a la del resto de la serie: grupo A ASA 1=0/37 (0%); ASA 2=3/37 (8,1%); ASA 3=30/37 (81,1%) y ASA 4=4/37 (10,8%). Resto de casos: ASA 1=21/221 (9,5%); ASA 2=83/221 (37,6%); ASA 3=113/221 (51,1%) y ASA 4=3/221 (1,4%), con una significación de p<0,001.
Los puntos de corte óptimos de las variables continuas para la valoración de la resecabilidad R0 (curvas ROC) fueron: edad>70 años, área bajo la curva=0,659, y cociente N/L≥5, área bajo la curva=0,652.
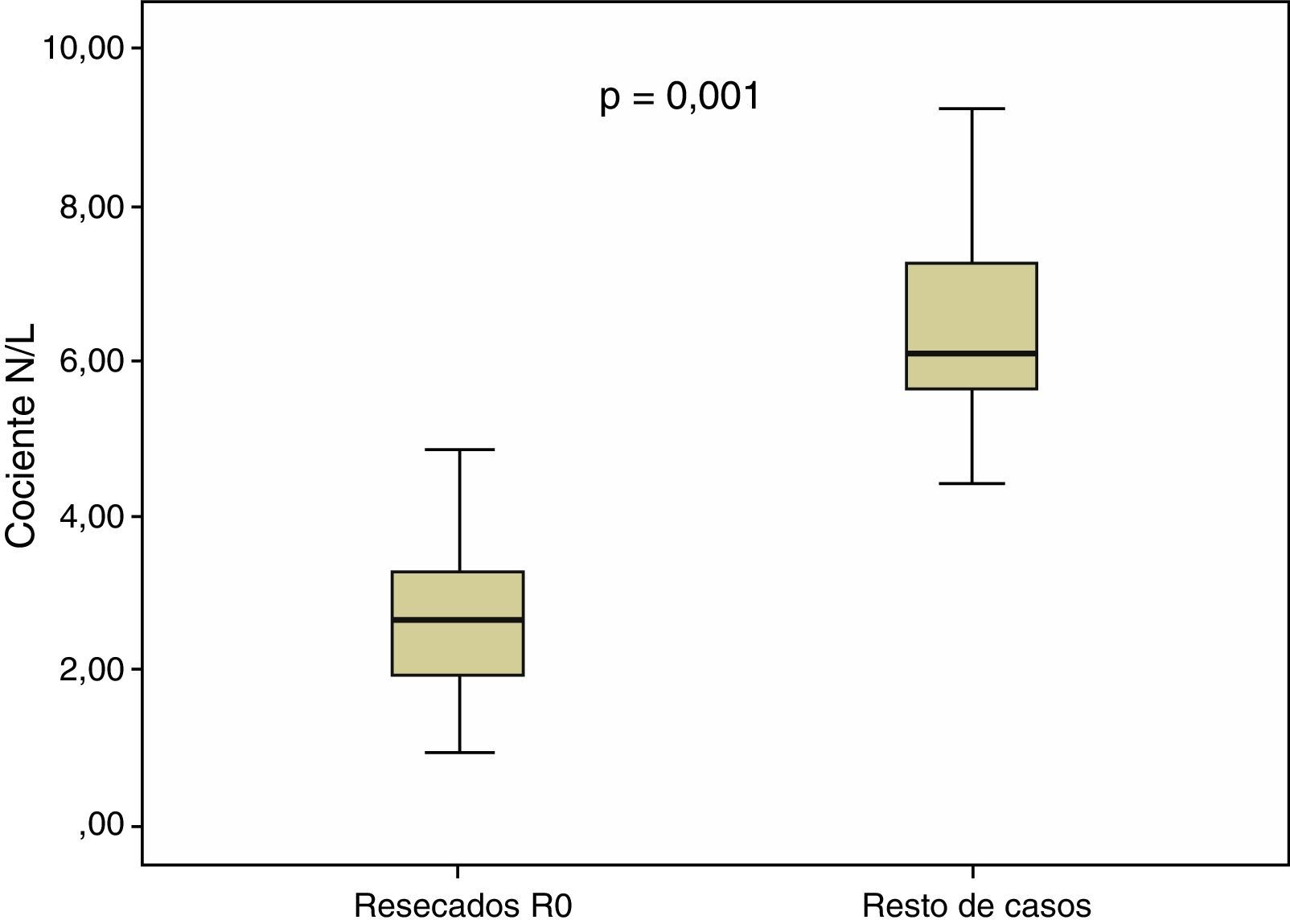
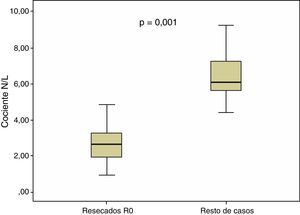
En el conjunto de nuestros casos, la mediana del cociente N/L fue de 2,70, con un rango intercuartílico de 1,80-3,90. En los pacientes con resección R0, los valores cuantitativos del cociente N/L presentaron una mediana de 2,30, con un rango intercuartílico de 1,70-3,40, resultando significativamente superiores (p=0,001) a los del grupo sin resección R0: mediana=3,05, rango intercuartílico 2,20-5,60. Estas diferencias se representan en la figura 2.
En el global de la serie registramos un cociente N/L elevado (≥5) en 46 casos (17,9%).
No encontramos diferencias significativas en cuanto a las características de los pacientes entre los subgrupos con cociente N/L normal y≥5: edad=71,7±11,8 versus 76,3±10,8 años (p=0,21); sexo masculino: 66,2 versus 61,4% (p=0,54), y ASA pretratamiento: 1=8,9%; 2=36,1%; 3=52,6% y 4=2,3% versus 1=4,5%; 2=20,5%; 3=72,1% y 4=4,5%, respectivamente (p=0,10).
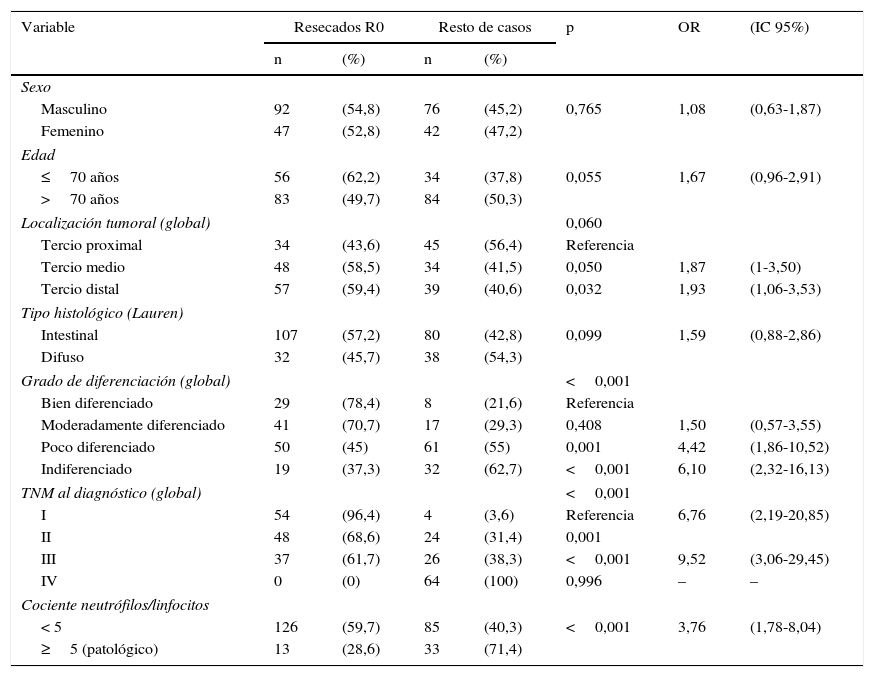
En la tabla 2 se exponen los resultados del análisis univariante sobre la frecuencia de resección tumoral R0 entre los diversos parámetros analizados, tanto del paciente como de la neoplasia. La figura 3 representa gráficamente la frecuencia de tumores con resección R0 según el valor normal o patológico del cociente N/L.
Análisis univariante de la frecuencia de resecabilidad R0
| Variable | Resecados R0 | Resto de casos | p | OR | (IC 95%) | ||
|---|---|---|---|---|---|---|---|
| n | (%) | n | (%) | ||||
| Sexo | |||||||
| Masculino | 92 | (54,8) | 76 | (45,2) | 0,765 | 1,08 | (0,63-1,87) |
| Femenino | 47 | (52,8) | 42 | (47,2) | |||
| Edad | |||||||
| ≤70 años | 56 | (62,2) | 34 | (37,8) | 0,055 | 1,67 | (0,96-2,91) |
| >70 años | 83 | (49,7) | 84 | (50,3) | |||
| Localización tumoral (global) | 0,060 | ||||||
| Tercio proximal | 34 | (43,6) | 45 | (56,4) | Referencia | ||
| Tercio medio | 48 | (58,5) | 34 | (41,5) | 0,050 | 1,87 | (1-3,50) |
| Tercio distal | 57 | (59,4) | 39 | (40,6) | 0,032 | 1,93 | (1,06-3,53) |
| Tipo histológico (Lauren) | |||||||
| Intestinal | 107 | (57,2) | 80 | (42,8) | 0,099 | 1,59 | (0,88-2,86) |
| Difuso | 32 | (45,7) | 38 | (54,3) | |||
| Grado de diferenciación (global) | <0,001 | ||||||
| Bien diferenciado | 29 | (78,4) | 8 | (21,6) | Referencia | ||
| Moderadamente diferenciado | 41 | (70,7) | 17 | (29,3) | 0,408 | 1,50 | (0,57-3,55) |
| Poco diferenciado | 50 | (45) | 61 | (55) | 0,001 | 4,42 | (1,86-10,52) |
| Indiferenciado | 19 | (37,3) | 32 | (62,7) | <0,001 | 6,10 | (2,32-16,13) |
| TNM al diagnóstico (global) | <0,001 | ||||||
| I | 54 | (96,4) | 4 | (3,6) | Referencia | 6,76 | (2,19-20,85) |
| II | 48 | (68,6) | 24 | (31,4) | 0,001 | ||
| III | 37 | (61,7) | 26 | (38,3) | <0,001 | 9,52 | (3,06-29,45) |
| IV | 0 | (0) | 64 | (100) | 0,996 | – | – |
| Cociente neutrófilos/linfocitos | |||||||
| < 5 | 126 | (59,7) | 85 | (40,3) | <0,001 | 3,76 | (1,78-8,04) |
| ≥5 (patológico) | 13 | (28,6) | 33 | (71,4) | |||
IC: intervalo de confianza al 95%; OR: odds ratio.
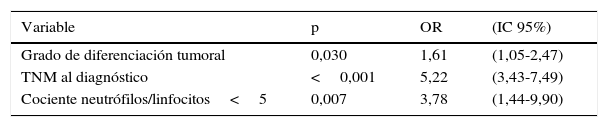
Los parámetros con p<0,05 en el estudio univariable de resecabilidad, es decir, el grado de diferenciación tumoral, la estadificación TNM clínica y el cociente N/L≥5, fueron incluidos en un modelo multivariante, cuyos resultados se muestran en la tabla 3.
Análisis multivariante de la frecuencia de resecabilidad R0
| Variable | p | OR | (IC 95%) |
|---|---|---|---|
| Grado de diferenciación tumoral | 0,030 | 1,61 | (1,05-2,47) |
| TNM al diagnóstico | <0,001 | 5,22 | (3,43-7,49) |
| Cociente neutrófilos/linfocitos<5 | 0,007 | 3,78 | (1,44-9,90) |
| Variable | p | OR | (IC 95%) |
|---|---|---|---|
| Grado de diferenciación tumoral | 0,030 | 1,61 | (1,05-2,47) |
| TNM al diagnóstico | <0,001 | 5,22 | (3,43-7,49) |
| Cociente neutrófilos/linfocitos<5 | 0,007 | 3,78 | (1,44-9,90) |
IC: intervalo de confianza al 95%; OR: odds ratio.
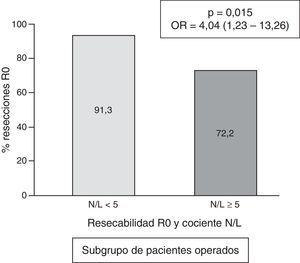
En el subgrupo de pacientes operados, la frecuencia de casos con cociente N/L≥5 fue de 18/156=11,5%. El valor numérico del cociente N/L presentó una mediana de 2,3, con un rango intercuartílico de 1,70-3,40. En los pacientes operados que presentaron un cociente N/L «normal» (<5), la frecuencia de conseguirse una resección R0 fue del 91,3 frente al 72,2% de resección R0 en los casos con cociente N/L patológico (p=0,015; OR=4,04; IC 95%=1,23-13,26 (fig. 4).
DiscusiónUna vez diagnosticado un carcinoma de estómago, la cirugía resectiva constituye la piedra angular del tratamiento del paciente7. Con la excepción de determinadas circunstancias, como puedan ser la obstrucción, el dolor refractario o la hemorragia persistente, en el carcinoma gástrico no está indicada la intervención sin intención resectiva curativa, ya que la cirugía puramente paliativa no modifica la supervivencia del paciente y aumenta la morbimortalidad22.
A la hora de indicar el tratamiento deberemos valorar, en primer lugar, si el paciente cumple criterios de operabilidad, es decir, si reúne las condiciones psíquicas y físicas para soportar una cirugía resectiva. Esta decisión conlleva un posible componente subjetivo, especialmente en cuanto a la capacidad psíquica. En nuestro caso, las resoluciones fueron tomadas por un comité interdisciplinar formado por el mismo equipo de especialistas a lo largo del estudio y sin tener en cuenta el posible valor del cociente N/L que posteriormente hemos analizado. Por ello, consideramos que la estimación de inoperabilidad no habrá constituido un factor de sesgo para la valoración de nuestros resultados. Como era de esperar, al comparar retrospectivamente los casos no operables por las características del paciente con el resto, se confirma una significativa mayor edad y comorbilidad, estimada mediante la clasificación ASA.
Una vez considerado el caso como operable, se pasará a valorar la posible resecabilidad del tumor. Este criterio terapéutico se preestablece antes de iniciar el tratamiento, teniendo en cuenta el grado de extensión de la neoplasia, registrado en las exploraciones de estadificación tumoral, y aceptándose que la presencia de metástasis peritoneales o a distancia contraindica la indicación quirúrgica con intención curativa23,24. Siguiendo estos criterios, 64 pacientes fueron descartados para la cirugía por presentar un tumor irresecable.
La estadificación se fundamenta en pruebas radiológicas, sobre todo la tomografía axial computarizada11 y con menor frecuencia la resonancia magnética o la tomografía por emisión de positrones25. Estas técnicas tienen un valor limitado para la estratificación locorregional del tumor y para la detección de metástasis peritoneales o lesiones pequeñas y superficiales en el hígado11. La realización de una ecoendoscopia mejora la valoración del crecimiento locorregional de la neoplasia, de las colecciones líquidas perigástricas26 y de la carcinomatosis peritoneal11,26, pero tiene una escasa utilidad para la identificación de metástasis a distancia9, estando menos establecida la utilidad de otras exploraciones como la laparoscopia diagnóstica. Este último procedimiento, efectuado con o sin ecografía incorporada, si bien presenta una mayor precisión para el diagnóstico de metástasis, resulta una técnica más agresiva y costosa9,22, habiéndose aconsejado limitar su empleo a tumores con estadio clínico T3-T4, sin aparente afectación adenopática ni metastásica22.
El criterio de resección radical solo puede establecerse tras la intervención quirúrgica y el examen histológico de la pieza, que debe confirmar la extirpación con bordes libres del tumor, junto con una adecuada linfadenectomía. Los criterios de irresecabilidad incluyen la afectación de hígado, páncreas, ligamento hepatoduodenal, aorta, tronco celíaco, arterias esplénica, hepática común y mesentérica superior, venas mesentérica superior y cava inferior, así como la pared abdominal9.
En nuestra serie se excluyeron de antemano los casos que recibieron tratamiento neoadyuvante, dada su posible influencia sobre la ulterior tasa de resección radical27. La frecuencia registrada de casos con resección R0 sobre el total de los tumores que inicialmente fueron considerados como operables fue del 89,1%, y se sitúa en los límites altos de concordancia publicados por otros autores, que muestran una considerable proporción de pacientes que en el estudio pretratamiento de extensión fueron considerados como operables con intención curativa, y que tras una laparotomía pasaron a ser casos no resecables10,11,28.
Dadas las limitaciones de la estadificación tumoral TNM prequirúrgica11, sería útil disponer de otras variables predictoras de resecabilidad, independientes del TNM, para poder mejorar la estrategia terapéutica en el cáncer gástrico29. Además de evitar laparotomías innecesarias, ayudaría a seleccionar grupos de pacientes irresecables de entrada, que se pudieran beneficiar de un tratamiento neoadyuvante, con la posibilidad de un posterior rescate para la cirugía27.
Ya se ha comentado que el cociente N/L en sangre periférica expresa la respuesta inflamatoria sistémica del paciente en distintas neoplasias30–32 y también en el cáncer de estómago33. El «microambiente» del tumor incluye células con acción inmunológica. Los neutrófilos y los linfocitos forman parte del estroma de la neoplasia y se correlacionan estrechamente con los neutrófilos y linfocitos circulantes en sangre periférica29, formando parte el cociente N/L de la respuesta inflamatoria sistémica del huésped frente al tumor17. Los neutrófilos facilitan la progresión de la lesión induciendo la mutación de genes supresores tumorales, segregando citocinas y enzimas promotoras de la proliferación tumoral y la metastatización, liberando elastasas y la enzima matriz metalopeptidasa-9 que degrada la matriz extracelular. Así mismo, los neutrófilos inhiben la apoptosis y estimulan la angiogénesis mediante la secreción del factor de crecimiento vascular endotelial29,34,35. Por su parte, la disminución de linfocitos conlleva una disfunción en la actividad citolítica, células natural killer y células T activadas36. La elevación del cociente N/L se ha relacionado con una menor supervivencia tras la resección aparentemente curativa del carcinoma gástrico18–20,37,38. Para explicar este peor pronóstico se ha asociado el incremento del cociente N/L con una mayor facilidad para el crecimiento del tumor, expresada como una mayor frecuencia de casos T437 y de aparición de metástasis3,16. Por este motivo, y ante la falta de referencias bibliográficas, hemos querido analizar, en la totalidad de nuestros casos incluidos, la posible capacidad predictora de la elevación del cociente N/L pretratamiento sobre la ulterior resecabilidad R0 del tumor, incluyendo tanto a los pacientes no resecados como a aquellos en los que se consiguió una extirpación radical del tumor.
A la hora de valorar al cociente N/L en el cáncer gástrico se han utilizado diferentes puntos de corte7,20,36,38,39, estando todavía por definir cuál puede ser el que mejor discrimine a los pacientes. Para nuestro estudio, y al igual que otros autores7,40, establecimos como cutoff óptimo un valor≥5, que se alcanzó en uno de cada 6 casos. Como en otras publicaciónes33,41, nuestros pacientes con cociente N/L patológico no mostraron diferencias significativas en relación con la edad, el sexo o la puntuación de comorbilidad (ASA) con respecto al subgrupo con cociente N/L normal, siendo el valor cuantitativo del cociente N/L significativamente inferior en los pacientes con resección R0 en comparación con el resto de los casos. Hemos valorado la posible relación entre el cociente N/L y la resecabilidad, comparando la frecuencia de los casos en los que se consigue una resección R0 entre los subgrupos con y sin cociente patológico. Nuestro estudio muestra que, en el momento del diagnóstico de la neoplasia, un valor elevado del cociente N/L se relaciona significativamente con una menor posibilidad de resecabilidad R0, alcanzándose un valor de la OR cercano a 4.
En el análisis multivariante efectuado, confirmamos cómo el cociente N/L mantiene su significación y, por tanto, su valor predictivo sobre una ulterior resección radical. Este valor se muestra independiente tanto de la clasificación TNM pretratamiento como de otras variables relacionadas con una mayor agresividad biológica de la neoplasia, como su menor grado de diferenciación33.
En el subgrupo de 156 pacientes operados con intención curativa hemos registrado un descenso tanto de la frecuencia de casos con cociente N/L patológico como del valor cuantitativo del cociente. Dado que los casos operables corresponden en su mayoría a neoplasias menos avanzadas, nuestros resultados apoyarían la relación propuesta entre el cociente N/L y el grado de desarrollo tumoral3,16,37.
En el análisis efectuado en el grupo de los pacientes operados también hemos registrado una significativa mayor frecuencia de casos con resección R0 entre los pacientes con cociente N/L «normal», confirmándose una OR 4 veces mayor de alcanzar una resección radical con respecto a los enfermos con un cociente N/L patológico. No obstante, el reducido número de pacientes en los que no se consiguió una resección R0 limita la validez de nuestros resultados.
La determinación del cociente N/L en sangre periférica es un parámetro sencillo, de muy fácil obtención, no agresivo y que tiene un coste mínimo. El registro de un cociente N/L elevado podría ayudar a seleccionar, desde el mismo momento del diagnóstico del cáncer gástrico, un subgrupo de pacientes con menor posibilidad de conseguir una resección radical de su neoplasia. En estos casos deberían considerarse otras posibilidades antes de indicar una cirugía con intención curativa, que tendría mayores probabilidades de verse gravada con los costes y la morbilidad de una laparotomía no terapéutica. Otra posible utilidad de nuestros hallazgos, que nos limitamos a mostrar y que deberá ser confirmada en estudios posteriores, podría ser la orientación para indicar una laparoscopia diagnóstica en los pacientes con cociente N/L patológico, especialmente en los que se hayan considerado como candidatos a una cirugía con intención curativa. La laparoscopia presenta una elevada precisión para la confirmación de metástasis peritoneales y viscerales que contraindicasen la cirugía y pudieran ser tributarias de un tratamiento neoadyuvante9, pero conlleva una mayor agresividad y consumo de recursos sanitarios, por lo que sus criterios de indicación todavía siguen en discusión.
Al igual que el resto de los trabajos consultados, nuestro estudio tiene la limitación de ser retrospectivo, lo que resta validez a los resultados obtenidos. Por una parte, al tratarse de un análisis unicéntrico se asegura que los pacientes han sido operados por un único equipo especializado, lo que evita el posible sesgo debido a los cirujanos. A esta ventaja inicial se opone el inconveniente de no contar con una validez externa y presentar una casuística más limitada, hecho que se acentúa al estudiar la frecuencia de resección R0 en el subgrupo de pacientes operados con intención curativa. Por todo ello, y ante la falta de antecedentes bibliográficos, especialmente en nuestra área geográfica, creemos necesario efectuar nuevos estudios, preferiblemente prospectivos y multicéntricos, que puedan confirmar el valor predictivo del cociente N/L pretratamiento sobre la probabilidad de resección R0 en el carcinoma gástrico.
Conflicto de interesesLos autores no presentan ningún conflicto de intereses.
Los autores agradecen la valiosa ayuda prestada por Berta Ibáñez (NavarraBiomed, Fundación Miguel Servet; REDISSEC) en la elaboración del estudio estadístico.