La prevalencia del síndrome del intestino irritable (SII) es muy elevada, lo que comporta una gran repercusión sanitaria, social y económica. El número de consultas médicas, de pruebas diagnósticas (en este caso no diagnósticas) y de prescripciones terapéuticas es muy grande, con el consiguiente gasto de recursos. Representa, además, una de las primeras causas de absentismo laboral. Por otra parte, si bien el SII no pone en riesgo la vida del paciente, sí condiciona de forma considerable su calidad de vida.
Se han publicado diversos estudios epidemiológicos sobre la prevalencia del SII y ésta oscila entre un 5 y un 20%, dependiendo de la población estudiada y de los criterios diagnósticos empleados1. En cualquier caso, el SII está presente en todos los países y es una causa importante de frecuentación médica. Desde hace mucho tiempo se ha dicho que sólo la tercera parte de los sujetos con SII buscaba atención médica. Estos datos procedían de investigaciones en Estados Unidos2, pero datos obtenidos de la población española demuestran que en España más de las 2 terceras partes de personas con SII acude al médico3. Los motivos por los que unas personas buscan asistencia sanitaria y otras no lo hacen no están del todo claros. Algunos estudios parecen indicar que la razón fundamental es la intensidad de las molestias, mientras que en otros son los factores psicosociales los determinantes. Otro de los factores que sin duda influyen en la decisión de consultar al médico es la facilidad de acceso y gratuidad del sistema sanitario en el que se encuentra el paciente. Así, en España, el 58% de los sujetos con SII con estreñimiento y el 67% de SII con diarrea busca atención sanitaria4.
De acuerdo con los datos anteriores es obvio que la repercusión económica del SII es muy grande. Para su cálculo, han de tenerse en cuenta tanto los costes directos (p. ej., visitas médicas, procedimientos diagnósticos, precio del tratamiento, visitas de urgencia o ingresos hospitalarios) como los costes indirectos (p. ej., absentismo laboral, disminución en la productividad o cirugía innecesaria). Durante el año 2000, en Estados Unidos los costes directos del SII fueron de 1.353 millones de dólares y los costes indirectos fueron de 205 millones de dólares5. A esta enorme cantidad habría que sumarle todas aquellas medicaciones que no precisan prescripción médica y también los gastos paramédicos que corren a cargo del enfermo.
Además, los estudios que han comparado la repercusión de la enfermedad en la calidad de vida han constatado que el deterioro es similar en los pacientes con SII y en los pacientes con enfermedad inflamatoria intestinal (EII)6. ¿Puede alguien seguir pensando que el SII es una enfermedad de segunda? ¿Es poco importante porque el intestino de los pacientes que lo experimentan no está (visiblemente) inflamado? ¿Es sólo el hermano pobre —y aún sin adoptar— de la EII?
Diagnóstico clínico del síndrome del intestino irritableCon el objetivo de buscar un diagnóstico positivo del SII y no solamente un diagnóstico de exclusión se han descrito diversos criterios que agrupan diferentes síntomas considerados como fundamentales. Esta aproximación al diagnóstico no es nueva de la enfermedad digestiva, ya que se ha utilizado previamente con mucha frecuencia tanto para enfermedades reumatológicas como para trastornos psiquiátricos. En el caso del SII, gran parte del mérito se le debe a Manning et al, que en 1978 publicaron los primeros criterios7. Posteriormente, en 1989, se establecieron unos criterios más precisos, fueron los llamados criterios de Roma8; aquí se incluían síntomas de posible estreñimiento, y no sólo de diarrea, como hacían los de Manning. Los iniciales criterios de Roma se modificaron, y se añadió la necesidad de una duración mínima de los síntomas de 3 meses9. Con el tiempo, en 1999, un grupo de expertos decidió que había que acotar más la temporalidad del síndrome para establecer el diagnóstico y decidieron que los síntomas debían estar presentes, al menos, durante 12 semanas (no necesariamente consecutivas) durante los últimos 12 meses; habían nacido los criterios de Roma II10. En la actualidad, desde el 2006, el diagnóstico clínico del SII se debe seguir según los criterios de Roma III, en los que tan sólo se necesita tener molestias 3 días al mes en los últimos 3 meses, aunque con un inicio de síntomas de al menos 6 meses antes11.
Probablemente los criterios de Roma sean importantes (e inexcusables) a la hora de incluir pacientes en estudios de investigación. No obstante, hay muchos enfermos en los que los síntomas están presentes pero no cumplen los citados criterios; ellos también deben beneficiarse de los avances fisiopatológicos y terapéuticos de aquéllos en los que se cumplen todos los criterios y se establece el diagnóstico12. Otro posible defecto de los actuales criterios diagnósticos es que no tienen en cuenta aspectos que con enorme frecuencia acompañan al síndrome: las manifestaciones extradigestivas y los trastornos psicológicos. Si verdaderamente se considera al SII en la esfera biopsicosocial parece lógico incluir alguno de estos aspectos en su valoración diagnóstica.
Posibles conexiones entre el síndrome del intestino irritable y la enfermedad inflamatoria intestinalLas enfermedades se conocen inicialmente por sus manifestaciones clínicas. Después, el estudio de sus mecanismos fisiopatológicos y sus respectivas respuestas terapéuticas hace que se clasifiquen de una u otra manera. De tal forma, si un(a) paciente tiene dolor abdominal y diarrea puede estar afectado(a) tanto por un SII como por una EII. Naturalmente, al realizar las exploraciones complementarias se demostrará si hay o no lesiones morfológicas evidentes y si el diagnóstico final es de SII o de EII. Pero, ¿y si la causa de ambas fuese común?, ¿y si fuesen los extremos opuestos del espectro de la inflamación intestinal, la microinflamación y la macroinflamación?, ¿y si la EII es la expresión inflamatoria de una causa común y en los pacientes con SII no se pueden desarrollar esos mecanismos inflamatorios? Naturalmente, éstas no son más que especulaciones, pero hay algunos datos que hacen que esta hipótesis no sea totalmente descabellada. La posible conexión entre SII y EII se puede sustentar en 5 puntos: en primer lugar, ambas enfermedades presentan síntomas semejantes; en segundo lugar, con frecuencia los síntomas se solapan en un mismo paciente; en tercer lugar, tienen una agregación familiar común; en cuarto lugar, participan de ciertos factores predisponentes comunes, como el antecedente de una gastroenteritis aguda, y en quinto lugar (y fundamental), se demuestran signos microinflamatorios en el intestino de enfermos con SII.
El solapamiento entre SII y EII se ha analizado en diferentes estudios. En todos ellos se ha puesto de manifiesto que la prevalencia de SII en pacientes con colitis ulcerosa o enfermedad de Crohn en fase de quiescencia es entre 2 y 3 veces superior a la de la población general13–15. Estos datos apoyan la hipótesis de que los brotes inflamatorios pueden tener un papel fisiopatológico en el desarrollo de SII. Por otra parte, se ha podido comprobar que es muy frecuente que los pacientes con EII presenten síntomas compatibles con SII durante años antes del diagnóstico de la enfermedad inflamatoria. De hecho, la presencia de un cuadro compatible con trastorno funcional digestivo (TFD) puede comportar un retraso en el diagnóstico de la EII16.
En los pacientes que presentan solapamiento entre las 2 entidades, es fundamental establecer un diagnóstico preciso del origen de los síntomas en cada momento de la evolución para, así, evitar tratamientos innecesarios (p. ej., esteroides o inmunomoduladores) o para no retrasar la introducción de éstos cuando verdaderamente son necesarios. Este aspecto representa un reto importante para el médico y, en muchas ocasiones, se precisa de la realización de pruebas molestas e invasivas, como la endoscopia, para establecer el diagnóstico diferencial. Actualmente, en un intento de prescindir de la endoscopia se están desarrollando y validando pruebas basadas en marcadores de inflamación en sangre y heces con capacidad para discriminar entre SII y EII activa17.
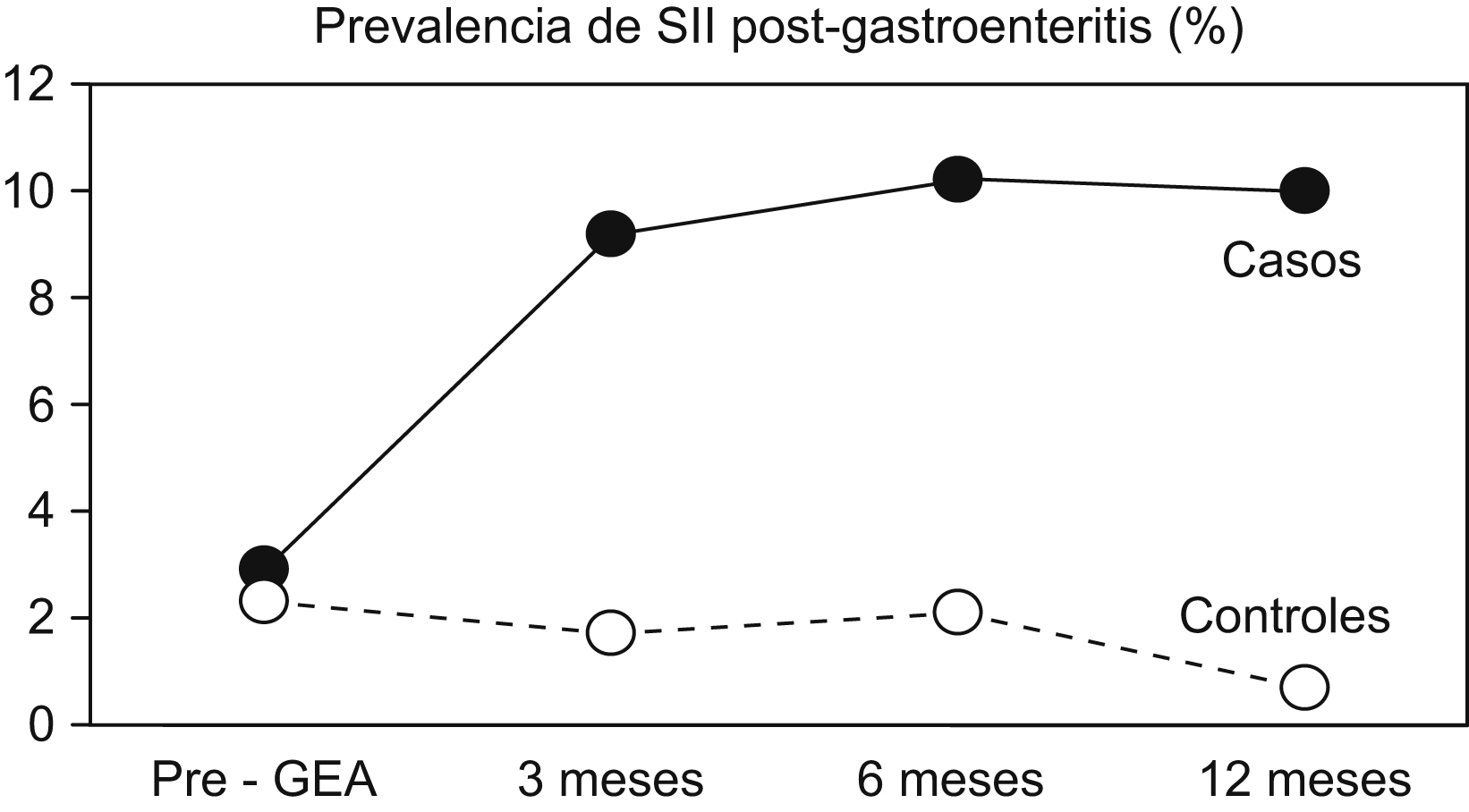
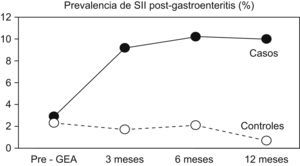
Por otra parte, se ha comprobado que los familiares de primer grado de enfermos con EII presentan 2 veces más TFD que un grupo control de similares características18. Además, tanto en el SII como en la EII el antecedente de una gastroenteritis aguda es un factor de riesgo de la enfermedad19,20 (fig. 1). Además, desde hace muchos años se especula con la posibilidad de que en el SII haya cambios inflamatorios mínimos, de difícil demostración, que fuesen los causantes del síndrome. Esta posibilidad convertiría a este TFD en una «forma menor» de EII.
Figura 1. La prevalencia del síndrome del intestino irritable (SII) aumentó de forma muy considerable durante el primer año de evolución en los pacientes que tuvieron una gastroenteritis aguda (GEA) por Salmonella, mientras que se mantuvo estable en los sujetos controles que no tuvieron la infección19.
Hallazgos inflamatorios presentes en el síndrome del intestino irritableLos signos macroscópicos de inflamación, como el edema y el eritema de la mucosa o la presencia de aftas o úlceras, o los signos microscópicos compatibles con colitis linfocítica o colágena obligan a descartar el diagnóstico de SII. Por tanto, durante años se ha considerado que no había hallazgos inflamatorios en la mucosa intestinal en pacientes con SII, y que su presencia descartaba por completo el diagnóstico. A su vez, la investigación en la fisiopatología del SII se ha centrado en el estudio de las alteraciones de la motilidad y de la sensibilidad visceral. Así, se ha comprobado que el incremento de la percepción a los estímulos generados en la pared gastrointestinal o hipersensibilidad visceral es un mecanismo fisiopatológico fundamental en el SII. Sin embargo, en los últimos años, la constatación de que la presencia o actividad de las células inmunitarias en la mucosa de pacientes con SII puede ser diferente a la de los individuos sanos ha llevado a postular que la inflamación de bajo grado o activación inmunitaria tenga un papel patogénico en el SII (tabla 1). Se especula que los cambios microinflamatorios podrían ser el origen de la hipersensibilización de las terminales nerviosas en el tejido intestinal y contribuirían a establecer o perpetuar la hipersensibilidad visceral21. Esta hipótesis se ve reforzada por los estudios realizados en animales de experimentación en los que se ha podido comprobar que incluso una inflamación leve o muy alejada anatómicamente puede provocar cambios persistentes en los nervios entéricos y en la función muscular digestiva, siendo el mecanismo causante de la sensibilización de las terminaciones aferentes de la pared intestinal22–24.
Tabla 1. Hallazgos inflamatorios en el síndrome del intestino irritable
| Autor, año | n | Subtipo de SII | Tejido | Tipo celular explorado | Hallazgos principales |
| Salzmann, 198925 | 62 | No seleccionado | Colon | Células inflamatorias | Aumento global de celularidad |
| Weston, 199326 | 20 | No seleccionado | Íleon terminal | Mastocitos | Aumento de mastocitos |
| O’Sullivan, 200027 | 14 | No seleccionado | Colon (CD, CT, CI, recto) | PMN, células mononuclerares y mastocitos | Aumento de mastocitos en ciego |
| Törnblom, 200228 | 10 | SII grave | Yeyuno proximal | Global LIE | Infiltración del plexo mientérico con degeneración neuronal |
| Chadwick, 200229 | 69 | >70% SII con manifestación de diarrea | Colon (CD, CT, CI, recto) | LIES, CD3, CD8, CD25, PMN, NK y mastocitos | Aumento de LIE, CD3, CD25, mastocitos y PMN |
| Park, 200331 | 14 | SII con manifestación de diarrea | Ciego, recto. | Mastocitos activados/reposo | Aumento de mastocitos. Mastocitos activados junto a fibras nerviosas |
| Dunlop, 200345 | 23 | >80% SII con manifestación de diarrea o con deposición alternante | Recto | Linfocitos, CE, mastocitos | Aumento de mastocitos y linfocitos de lámina propia |
| Wang, 200430 | 56 | 50% postinfeccioso | Íleon y recto | Mastocitos, terminaciones nerviosas | Aumento de mastocitos. Mastocitos activados junto con fibras nerviosas |
| Barbara, 200433 | 44 | No seleccionado | CI | Mastocitos | Aumento de mastocitos. Mastocitos activados junto con fibras nerviosas |
| Ohman, 200536 | 33 | No seleccionado | CD | Linfocitos | Aumento de linfocitos CD8 |
| Guilarte, 200732 | 20 | SII con manifestación de diarrea | Yeyuno proximal | Mastocitos, LIE | Aumento de mastocitos y linfocitos de lámina propia |
CD: colon derecho; CE: células enterocromafines; CI: colon izquierdo; CT: colon transverso; LIE: linfocitos intraepiteliales; NK: natural killer‘linfocitos citolíticos’; PMN: leucocitos polimorfonucleares; SII: síndrome del intestino irritable.
El primer trabajo acerca de los fenómenos inflamatorios en el SII fue el publicado por Salzmann et al25 en 1989, en el que cuantificaron la celularidad global de la lámina propia en sujetos con SII. De forma global, los 62 casos con SII presentaban un aumento significativo de la celularidad en la mucosa en comparación con sujetos sanos, siendo este incremento más marcado en aquellos casos de SII con predominio de diarrea. Sin embargo, en este estudio no se determinaron los tipos celulares implicados. Posteriormente, 2 grupos investigadores independientes coincidieron en el hallazgo de un incremento del número de mastocitos en la mucosa ileal26 y en el ciego27 en pacientes con SII no seleccionados de acuerdo con su hábito deposicional.
Un enfoque más temerario y controvertido consistió en el estudio de las biopsias transmurales del yeyuno proximal obtenidas mediante laparoscopia en 10 pacientes con SII muy grave. El hallazgo más relevante consistió en la observación de que en todas las biopsias se observaba algún grado de degeneración ganglionar del plexo mientérico asociada a una infiltración linfocitaria de bajo grado. Estos resultados no son fácilmente reproducibles y, por otra parte, son discutibles debido a que el tejido control se obtuvo a partir de autopsias y a que no se conoce bien si los 2 grupos fueron comparables en cuanto a la edad, la manipulación del tejido u otras circunstancias que pueden haber influido en las conclusiones28.
El análisis microscópico sistemático de la mucosa del colon en el SII fue realizado por Chadwick et al29 en biopsias mucosas de las 4 regiones del colon (colon ascendente, transverso, descendente y recto) utilizando un marcaje inmunohistoquímico para la cuantificación de las diferentes células del sistema inmunitario (neutrófilos, mastocitos, linfocitos CD3, CD8, CD25 y linfocitos citolíticos 1). En el estudio histológico sistemático de los 69 casos de SII no seleccionados (aunque hasta un 70% correspondió a los subgrupos de diarrea o hábito deposicional alternante) se observaron 2 patrones: a) pacientes con un estudio histológico normal y b) pacientes con un aumento inespecífico de la celularidad en la lámina propia. En ambos grupos la cuantificación de las células inflamatorias demostró diferencias significativas con la población control. Así, se observó que los linfocitos intraepiteliales y los linfocitos CD3 de la lámina propia eran aproximadamente el doble de los de la población control y el incremento de los linfocitos CD25 era de 6,5 veces superior a los controles. A su vez, sólo en el grupo con un patrón de aumento inespecífico de la celularidad de la lámina propia el recuento de leucocitos polimorfonucleares y de mastocitos fue superior al recuento en las biopsias de sujetos sanos.
La constatación de un aumento de mastocitos en la mucosa de pacientes con SII llama poderosamente la atención, ya que estas células, además de participar en fenómenos inflamatorios, secretan potentes sustancias neuromoduladoras como la histamina y la triptasa, que tienen efectos sobre las terminaciones nerviosas aferentes y que, por tanto, podrían tener un papel relevante en la respuesta a los estímulos mecánicos y químicos.
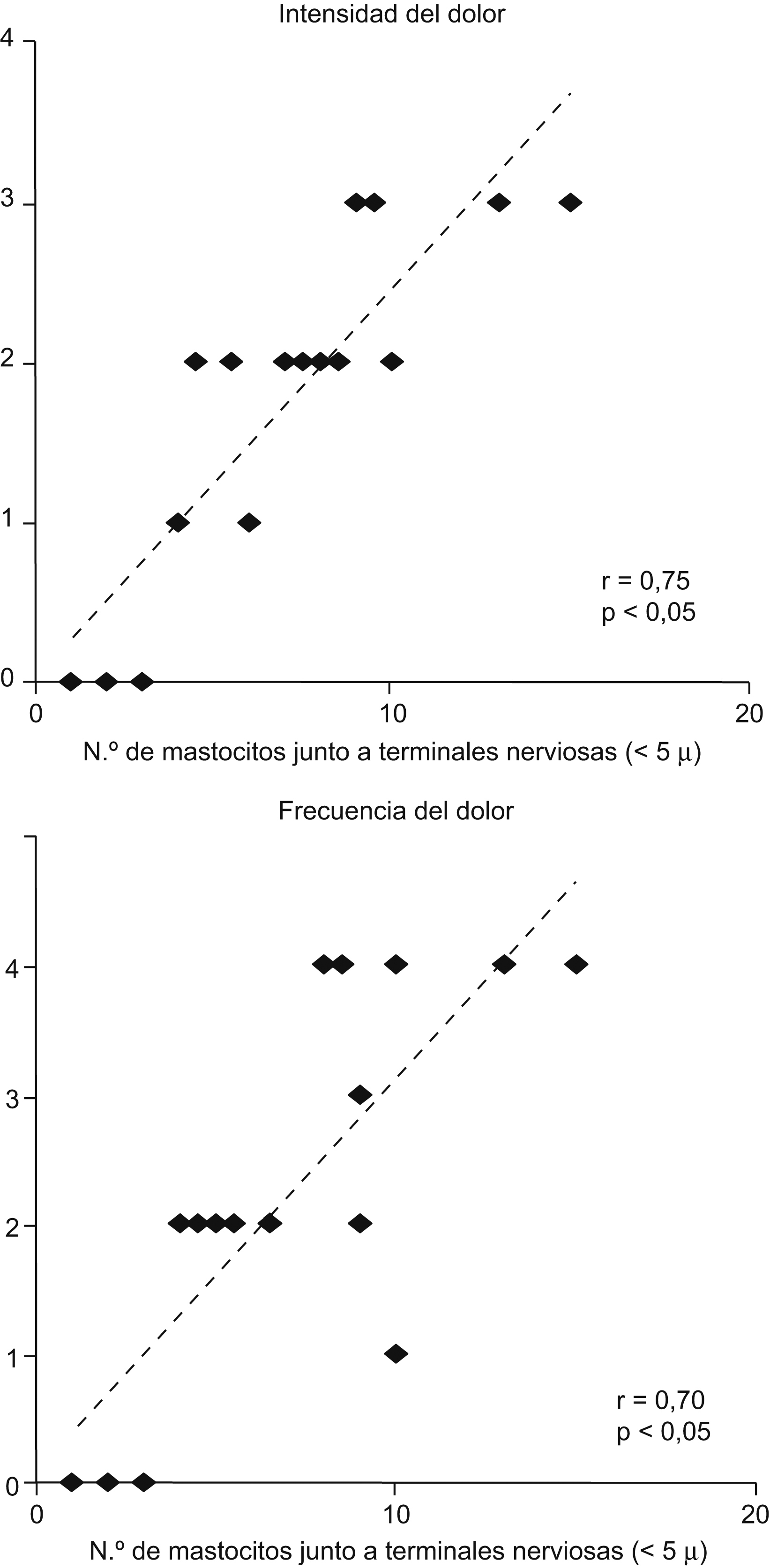
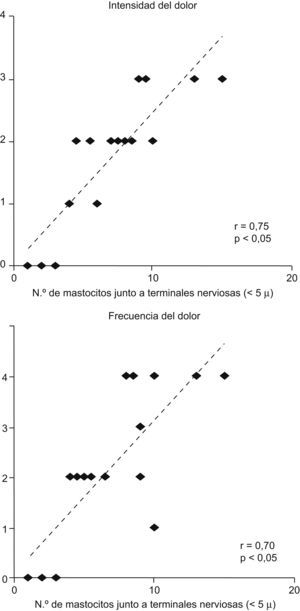
Esta hipótesis se ha comprobado en 3 trabajos en los que se observa que en la mucosa de ciego, colon izquierdo, recto e incluso yeyuno de pacientes con SII30–32 el número de mastocitos activados es superior al de las biopsias de personas sanas. Además, se ha podido constatar un hecho fundamental: estas células mastocíticas activadas se encuentran junto a las terminales nerviosas de la mucosa, hecho que no ocurre en los controles sanos31–33. El estudio de Barbara et al33 ha aportado además un dato clave: hay una correlación positiva entre la intensidad de estas alteraciones mastocíticas y la intensidad y frecuencia del dolor abdominal que presentan los pacientes con SII (fig. 2). Además, un estudio más reciente ha demostrado una correlación entre la intensidad del infiltrado de mastocitos en la mucosa del colon con la presencia de depresión y de fatiga, lo que indica, también, la relación entre factores psicológicos alterados y la microinflamación34.
Figura 2. Correlación entre la intensidad y frecuencia del dolor abdominal y el número de terminaciones nerviosas a una distancia menor o igual a 5 micras en la mucosa del colon de pacientes con síndrome del intestino irritable33.
El hallazgo de un aumento de otro tipo celular, los linfocitos CD25, también ha suscitado interés, ya que estas células tienen una acción reguladora que se considera importante para la prevención de la autoinmunidad y para el control de la respuesta inflamatoria del intestino. Ello conduce a la hipótesis de que en los pacientes con SII puede haber una exposición antigénica (autógena o exógena) y que las células CD25 estarían previniendo la progresión a una forma más florida de inflamación29,35.
En otro estudio, además de cuantificar específicamente los diferentes tipos de células inmunes, se comprobó que la expresión de la molécula de adherencia intestinal (integrina β 7) o su ligando, es superior en los linfocitos T de los SII que en los controles y esta circunstancia es similar a lo que ocurre en la colitis ulcerosa36.
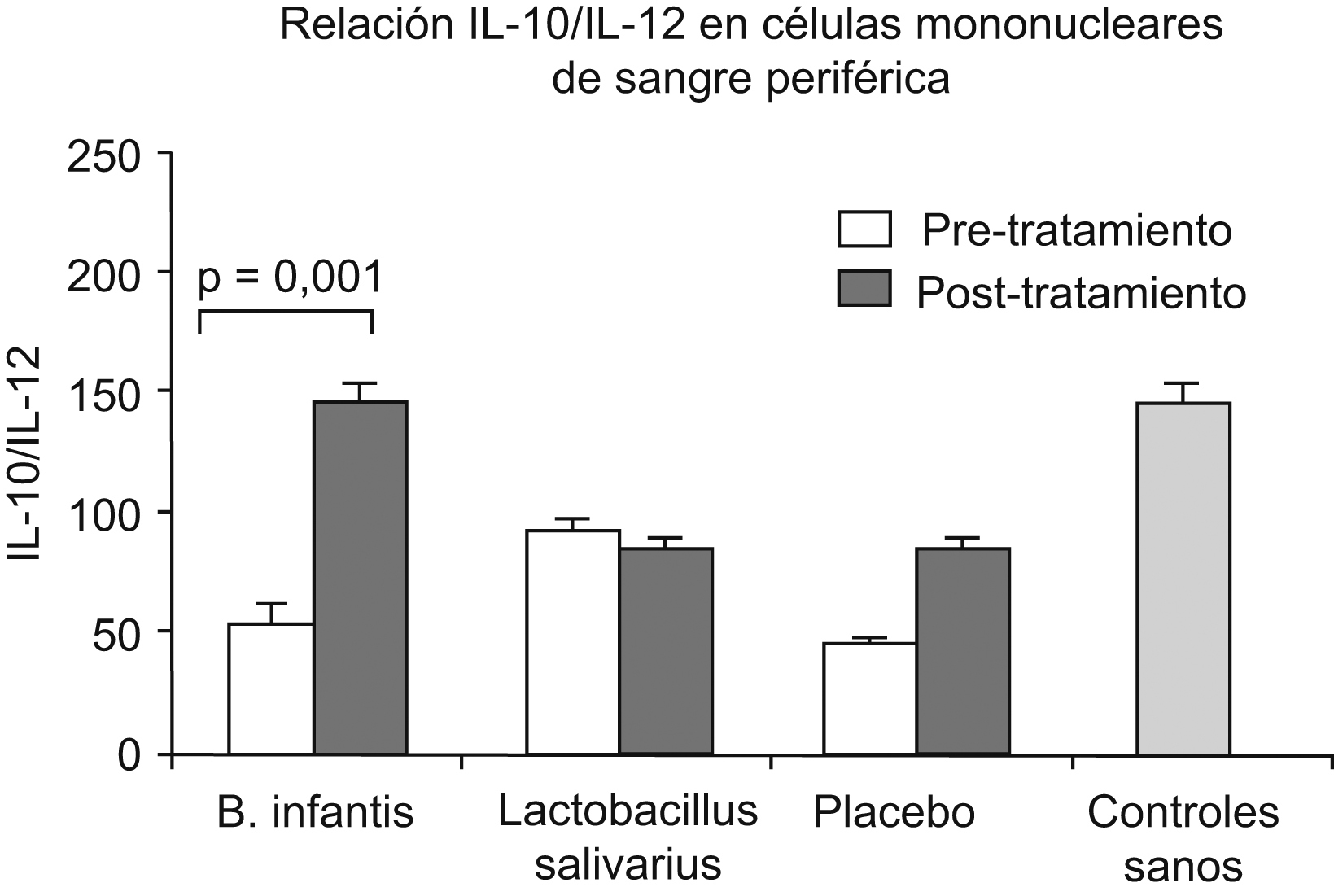
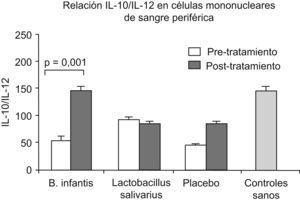
Por otra parte, este proceso inflamatorio es modulado por la presencia de las citocinas proinflamatorias y antiinflamatorias. La producción de citocinas por parte de las células mononucleares de sangre periférica es un parámetro que se puede obtener de forma sencilla y poco invasiva. En pacientes con SII se ha observado que la producción in vitro de citocinas es mayor que en controles sanos, y esto se ha constatado en los diferentes subtipos de SII, con diarrea, estreñimiento o deposición alternante37–41. Por otra parte, se ha demostrado que la producción de la citocina antiinflamatoria interleucina (IL)-10 está disminuida respecto a la citocina proinflamatoria IL-12, de forma que el cociente entre IL-10 e IL-12 muestra una reducción de más del 50% respecto a los controles sanos40. Los mismos autores ponen de manifiesto que una cepa de organismos probióticos que consiguen la normalización de este perfil proinflamatorio también produce una mejoría clínica significativa; con el resto de cepas ensayadas no se siguió ni mejoría clínica ni normalización del perfil de las citocinas (fig. 3)40.
Figura 3. Normalización del perfil de la expresión de citocinas interleucina (IL)-10 e interleucina-12 en células mononucleares de sangre periférica de pacientes con síndrome del intestino irritable con el tratamiento del probiótico Bifidobacterium infantis40.
También se han utilizado algunas técnicas sencillas y no invasivas para analizar la presencia en la mucosa intestinal de otros marcadores de inflamación. Kristjansson et al41 han utilizado un material de celulosa en un parche (patch) que en contacto con la mucosa rectal tiene capacidad para adsorber y permitir analizar diferentes moléculas de interés. Este grupo ha observado que en pacientes con SII la mieloperoxidasa y la lipocalina, marcadores de actividad de los polimorfonucleares, estaban aumentados entre 4 y 7 veces por encima de los valores en los controles sanos y con un valor similar al de pacientes con colitis linfocítica, enfermedad celíaca o colitis ulcerosa inactiva; debe tenerse en cuenta que el incremento en los casos de colitis ulcerosa activa fue de entre 100 y 200 veces los valores normales. La presencia de marcadores de la inflamación en el SII también se ha evaluado en las heces. En este caso, los valores de proteína eosinofílica X, mieloperoxidasa, triptasa, IL 1-β, TNF-α (tumor necrosis factor alpha‘factor de necrosis tumoral alfa’) no fueron diferentes a los controles, mientras que en la colitis linfocítica sí se encontró aumento de la proteína eosinofílica X, la mieloperoxidasa y la triptasa42. De la misma forma, la calprotectina no se encuentra elevada en heces de pacientes con SII, y por eso su determinación se ha propuesto como una técnica sencilla y no invasiva para el diagnóstico diferencial entre la EII y las enfermedades funcionales intestinales43.
Síndrome del intestino irritable postinfeccioso: un posible modelo de inflamaciónAunque los signos microinflamatorios se han observado en la población no seleccionada de pacientes con SII, los estudios presentan una limitación importante debido a que se trata de una población heterogénea, en cuanto a las manifestaciones clínicas y al tiempo de evolución. En cambio, cuando el cuadro de SII se desarrolla tras la curación de una infección aguda bacteriana (SII postinfeccioso), se puede disponer de los datos referentes a las circunstancias iniciales y analizarlos. Este subgrupo de pacientes con SII postinfeccioso es un modelo muy interesante para estudiar la patogenia del SII por ser más homogéneo que la población global con SII. De hecho, esta situación es un «experimento natural» que se inicia periódicamente al azar en la población sana y que permite una aproximación a la historia natural del desarrollo y persistencia de los fenómenos inflamatorios en este subgrupo de SII postinfeccioso (tabla 2).
Tabla 2. Hallazgos inflamatorios en el síndrome del intestino irritable postinfeccioso
| Autor, año | n | Tiempo desde la GEA | Tejido | Parámetros evaluados | Hallazgos principales |
| Gwee, 199952 | 10 | 3 meses | Recto | Células inflamatorias | Aumento global |
| Spiller, 200044 | 10 | 3–48 meses | Recto | Linfocitos, CE | Aumento de LIE y CE |
| Dunlop, 200345 | 28 | 4 meses | Recto | Linfocitos, CE, mastocitos | Aumento de LIE y CE |
| Dunlop, 200345 | 23 | Indeterminado | Recto | Linfocitos, CE, mastocitos | Aumento de CE y linfocitos de lámina propia |
| Gwee, 200346 | 8 | 3 meses | Recto | Expresión de interleucinas | Aumento de mARN de IL 1-β, mARN de arIL 1-β |
| Wang, 200430 | 56 * | Indeterminado | Íleon y recto | Expresión de interleucinas | Aumento de mARN de IL 1-β |
arIL 1-β: antagonista del receptor de la interleucina 1-β; CE: células enterocromafines; GEA: gastroenteritis aguda; IL-1β: interleucina 1-β; LIE: linfocitos intraepiteliales; mRNA: ácido ribonucleico mensajero.
* Sólo el 50% presentaba síndrome del intestino irritable postinfeccioso.
En este campo, Spiller et al44 han realizado aportaciones relevantes. Este grupo ha descrito como hallazgos más significativos en la mucosa del colon de pacientes con SII postinfeccioso el incremento del número de células enterocromafines y de linfocitos intraepiteliales, que se sitúa aproximadamente en un valor 6 veces superior a la cuantificación en los controles sanos. Estas alteraciones son cuantitativa y cualitativamente similares a los hallazgos inmunohistológicos en biopsias mucosas obtenidas a las 2 semanas de una infección aguda por Campylobacter.
En otro estudio, los mismos autores comprobaron que a los 4 meses de la infección aguda sólo se observaba la hiperplasia de células enterocromafines en los casos con SII postinfeccioso y no en pacientes que tras la infección quedaron asintomáticos45. Asimismo, en los pacientes en que tras la gastroenteritis infecciosa se desarrolló SII, a los 3 meses se presentó una expresión de IL proinflamatoria 1-β superior a los controles sanos y a los controles en los que no se desarrolló SII postinfeccioso tras la gastroenteritis46.
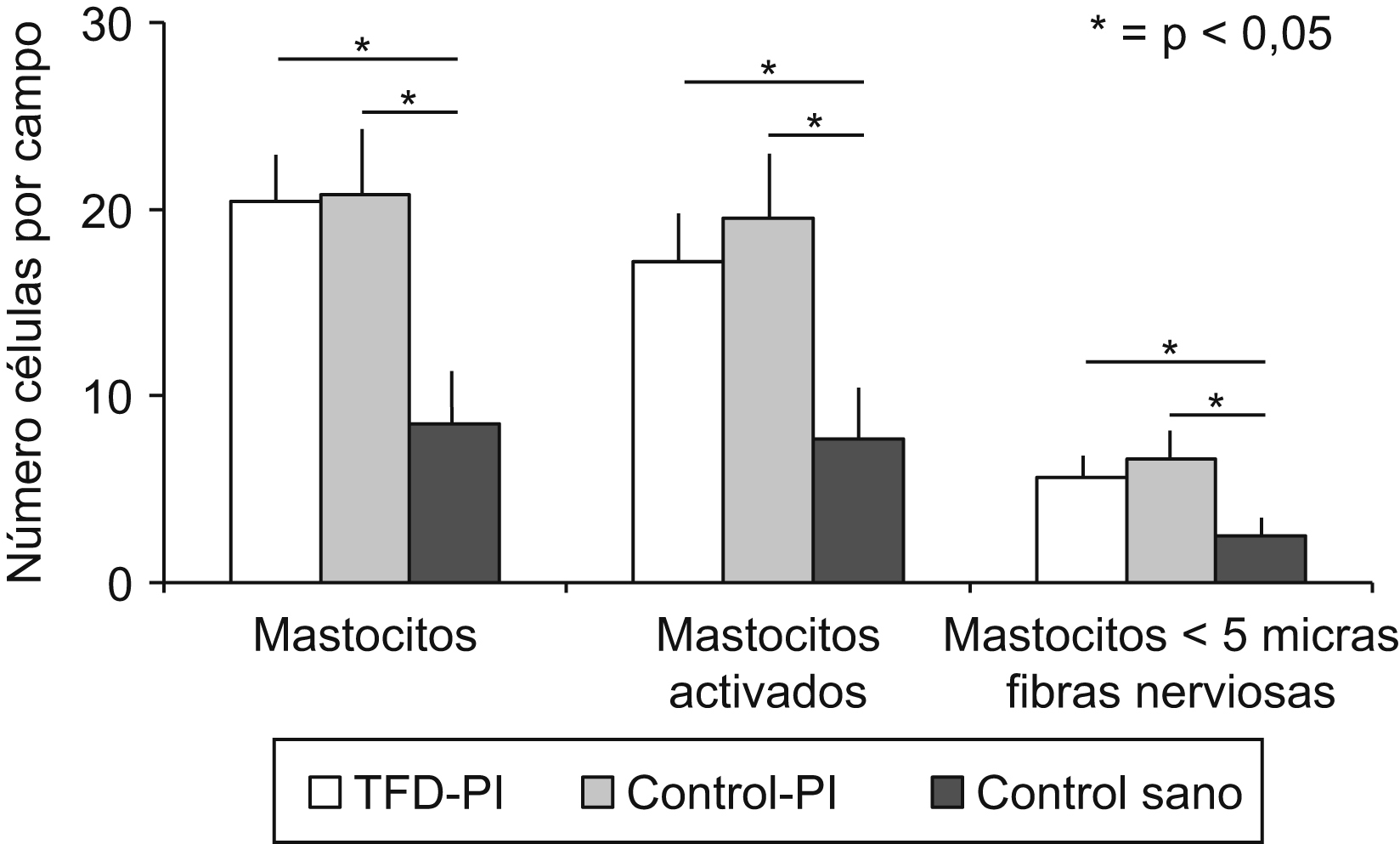
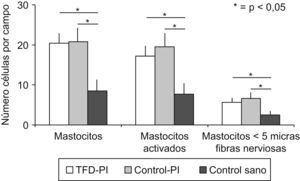
Con el paso del tiempo los fenómenos inflamatorios postinfecciosos podrían atenuarse, a pesar de la permanencia del SII y de la hipersensibilidad visceral. Esta circunstancia se ha observado en un estudio prospectivo realizado por este grupo, en el que a los 3 años de un brote de gastroenteritis aguda por Salmonella la mucosa de pacientes en los que se había desarrollado SII o DF mostraba un número similar de células inmunes y una producción de citocinas equiparable a los controles47 (fig. 4).
Figura 4. Los pacientes que tuvieron con anterioridad una gastroenteritis, tanto en los que se desarrolló un trastorno funcional digestivo (TFD-PI) como en los que se mantuvieron asintomáticos (Control-PI), tenían un mayor número de mastocitos, de mastocitos activados y de mastocitos en las proximidades de las terminaciones nerviosas que los controles sanos. Sin embargo, no hubo diferencias entre el grupo TFD-PI y el grupo Control-PI47.
No se conocen con exactitud los mecanismos que provocan la permanencia de estas alteraciones inmunológicas y el desarrollo de SII postinfeccioso sólo en algunos sujetos de una población previamente sana. Se han identificado algunos factores, unos dependientes del germen patógeno o de la enfermedad aguda y otros atribuibles al huésped. La duración prolongada de la gastroenteritis, el sexo femenino y la edad menor de 60 años son factores que aumentan el riesgo de tener un trastorno funcional intestinal. Pero son 2 mecanismos dependientes del huésped los que tienen más implicaciones en la fisiopatología del SII: el polimorfismo de los genes que codifican las citocinas proinflamatorias o antiinflamatorias y los estresores psicológicos temporalmente cercanos a la infección aguda48.
La persistencia de actividad inflamatoria o cambios neuroinmunes puede estar genéticamente determinada. Los escasos estudios ponen de manifiesto que los genotipos relacionados con la alta producción de la citocina proinflamatoria TNF-α y con la baja producción de la IL reguladora IL-10 son más frecuentes en SII que en la población general, pudiendo contribuir al perfil proinflamatorio que se ha observado en la expresión de citocinas en los pacientes con SII49,50.
Por otra parte, los estresores psicológicos temporalmente cercanos a la infección aguda son factores asociados al desarrollo de SII postinfeccioso. Los pacientes en los que se desarrolla SII tienen grados más altos de ansiedad, depresión, somatización y neuroticismo en el momento de la infección aguda que aquellos en los que no se desarrolla45,51; además el grado de episodios estresantes también es un factor predictivo de la aparición de SII postinfeccioso52.
La posibilidad de una relación causal entre los estresores psicológicos y los fenómenos inflamatorios es una hipótesis atractiva que merece una investigación exhaustiva. El eje hipotalamohipofisosuprarrenal y el sistema autonómico simpático son los efectores de la respuesta al estrés y podrían ser los mediadores de esa relación. Por el momento, se puede decir que, como grupo, los pacientes con SII tienen una respuesta exagerada a la infusión de corticorrelina (hormona estimulante de la corticotropina) con un incremento superior a lo esperado de la corticotropina y el cortisol, y que estos fenómenos se correlacionan positivamente con el valor también aumentado de la IL-637. Ésta y otras interacciones entre las respuestas neuroendocrinas y las inmunológicas pueden ser un camino para intentar desvelar los interrogantes actuales acerca de la fisiopatología del SII.
Autor para correspondencia.
Fermín Mearin
Dirección: fmearinm@meditex.es