La seudocirrosis es un término radiológico que hace referencia a una alteración de la morfología hepática que asemeja una cirrosis en ausencia de la histología típica en el estudio anatomopatológico1. Esta entidad ha sido descrita mayormente en casos de cáncer de mama metastásico con o sin uso de quimioterapia sistémica (QT). Sin embargo se han visto casos similares en otras neoplasias como cáncer de páncreas, esófago y tiroides2–5. Su prevalencia y el mecanismo exacto por el que se produce son aún desconocidos. Según los estudios publicados hasta el momento se ha propuesto que el cambio morfológico puede ser secundario tanto al efecto de la infiltración metastásica del tejido sano como a la toxicidad hepática de la QT6.
Presentamos el caso de una mujer de 39 años que ingresó en el servicio de digestivo en agosto 2015, por alteración del perfil hepático y hallazgo en TAC abdominal de afectación difusa del parénquima hepático.
Como antecedentes personales destacaba una mastectomía con linfadenectomía derecha por carcinoma ductal infiltrante pT1b(m) pN1a (RE−, RP, HER2+++ p53 [80%], Ki-67 [30%], BRCA−) en junio de 2012. Recibió tratamiento con QT adyuvante con 4 ciclos de ciclofosfamida+doxorrubicina y, posteriormente, terapia combinada con docetaxel+trastuzumab durante 3 meses hasta marzo de 2013. Continuó con trastuzumab en monoterapia hasta completar un año, finalizando la quimioterapia en enero de 2014 y realizándose mastectomía profiláctica izquierda en junio de 2014. La paciente se mantuvo asintomática y con analíticas normales durante 26 meses de seguimiento, con una TAC toraco-abdominal en mayo de 2014 que fue rigurosamente normal.
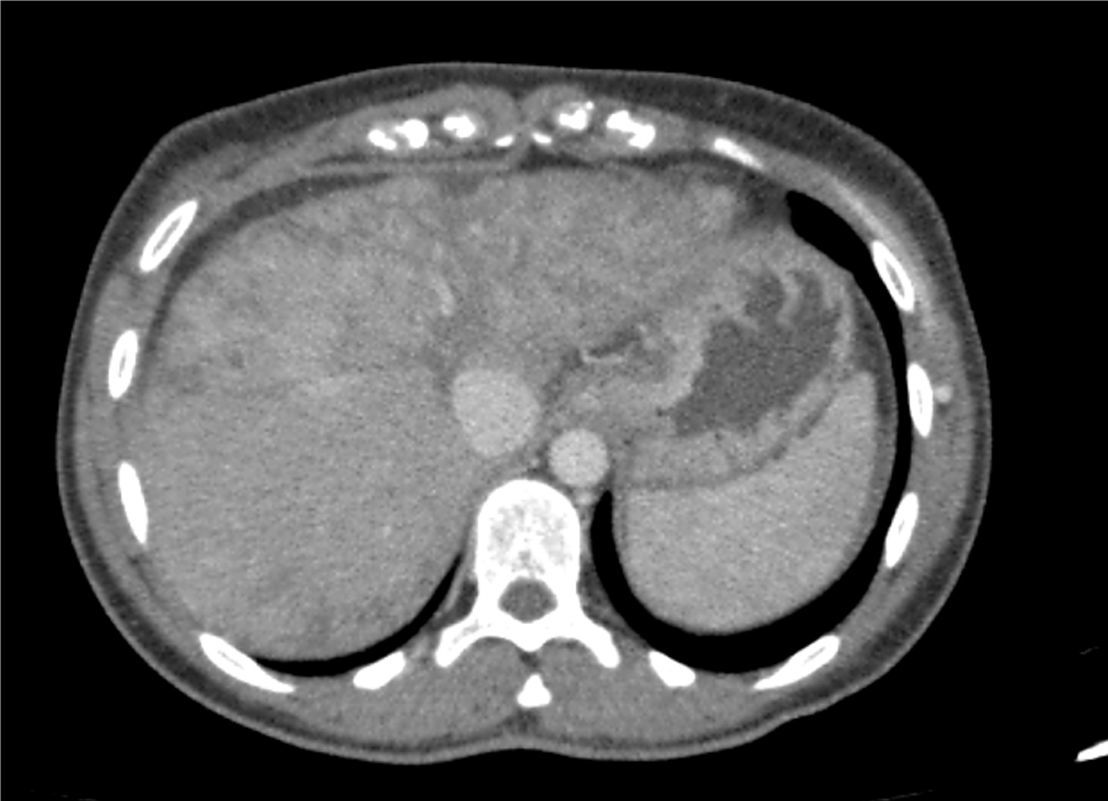
Al ingreso la paciente presentaba un cuadro de 3 meses de astenia e ictericia sin ninguna otra sintomatología asociada, negando toma de tóxicos o fármacos. La exploración física fue normal y analíticamente destacaba una hipertransaminasemia con hiperbilirrubinemia a expensas de indirecta y serologías para virus EVB, CMV, VHB, VHA y VHC negativas. La TAC (fig. 1) realizada un mes previo al ingreso describía una afectación difusa del parénquima hepático de predominio en lóbulo hepático izquierdo, con patrón de realce heterogéneo sin LOE hepáticas ni signos de diseminación metastásica, sugestivo de enfermedad venooclusiva hepática. Durante el ingreso, presentó empeoramiento de la función hepática (Child-Pugh B7 y MELD de 16) y una trombocitopenia progresiva, presentando asimismo títulos bajos de anticuerpos antinucleares (ANA), siendo el resto del estudio autoinmune negativo.
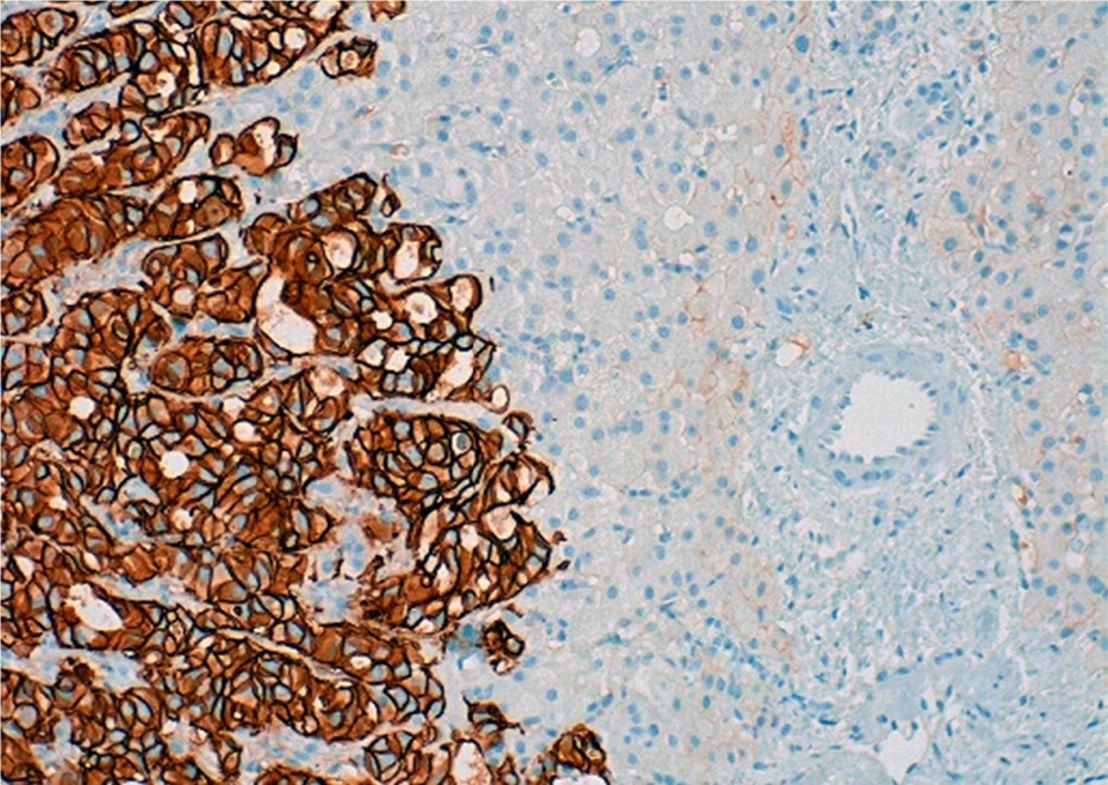
La RM hepática mostró un hígado regenerativo con extensas áreas de fibrosis y signos de hipertensión portal (HTP), sin evidencia de lesiones sugestivas de malignidad. Se descartó afectación de venas suprahepáticas mediante eco-Doppler y se realizó una gastroscopia donde se objetivaron VVEE grado III/IV y una GHTP moderada. Finalmente, dada la coagulopatía se optó por una fina biopsia hepática guiada con ECO, obteniendo 2 cilindros hepáticos delgados fragmentados, pero con patrón arquitectural conservado. A nivel microscópico se observaron áreas de fibrosis mal delimitadas con nidos de células tumorales e imágenes de permeación vascular a nivel sinusoidal y de algunas venas portales, explicándose el mecanismo de HTP (presinusoidal y sinusoidal). Sin embargo, no existían datos de síndrome veno-oclusivo ya que las venas centrales no se encontraban afectadas y tampoco se encontraron nódulos de hiperplasia nodular regenerativa (HNR). La inmunohistoquímica mostró positividad nuclear para GATA-3, hecho característico, aunque no específico del tejido mamario. Además, las células infiltrativas presentaban HER2+++ (fig. 2), y tinción negativa para RE y RP (un comportamiento similar al tumor de mama primario). Por lo tanto, los hallazgos confirmaron la presencia de metástasis hepática de carcinoma de mama después de más de 2 años del diagnóstico, a pesar de la realización de mastectomía, 2 protocolos de QT adyuvante y un año de tratamiento biológico. En un tiempo de evolución de 2 meses, la paciente desarrolló empeoramiento clínico, analítico y radiológico, produciéndose finalmente su fallecimiento.
La seudocirrosis sobre hígado metastásico, puede relacionarse con la retracción de la cápsula de Glisson sobre las metástasis hepáticas por efecto de la QT, simulando una cirrosis macronodular7. Es independiente de la presencia y/o el tamaño de las metástasis hepáticas y es secundario a agentes QT. La toxicidad produce isquemia del parénquima con la consecuente reconstitución secundaria en forma de HNR en ausencia de los característicos puentes de fibrosis presentes en la cirrosis. Fisiopatológicamente, la HNR puede ser causante de HTP por compresión de las sinusoides y venas centrales, de manera similar al síndrome veno-oclusivo. Hay publicados escasos artículos en la literatura en los que la seudocirrosis aparece en ausencia de tratamiento QT. Para explicar este fenómeno se ha propuesto como mecanismo la propia reacción desmoplásica en forma de fibrosis extensa secundaria a la infiltración de células atípicas metastásicas6.
El paciente puede estar asintomático y únicamente detectarse una alteración analítica. Cuando progresa la enfermedad, pueden observarse los signos típicos de una cirrosis hepática descompensada. Los hallazgos radiológicos son los característicos de una cirrosis, con lobulación de los bordes hepáticos, retracción capsular multifocal, pérdida de volumen del lóbulo hepático derecho, hipertrofia del lóbulo caudado y lóbulo hepático izquierdo asociado o no a signos de HTP. Puede resultar de ayuda la comparación con estudios previos, donde se suele ver un hígado anatómicamente normal. Las alteraciones morfológicas se desarrollan habitualmente en un plazo muy corto, de entre semanas y pocos meses tras el comienzo de la QT, progresando más rápidamente que la cirrosis. La única manera de diferenciar entre una cirrosis verdadera y la seudocirrosis es el estudio histológico. Sin embargo, es un método invasivo que no siempre se puede realizar. Por ello, será fundamental una buena historia clínica para relacionar los hallazgos radiológicos con los antecedentes personales.