A pesar de la disponibilidad de nuevos y potentes fármacos para la enfermedad de Crohn, una relevante proporción de pacientes se someterá a una resección intestinal para el control de la enfermedad a lo largo de su evolución. En ausencia de un tratamiento preventivo eficaz, la aparición de nuevas lesiones intestinales tras la cirugía por la enfermedad de Crohn es la norma; a este hecho se le conoce como recurrencia posquirúrgica y puede aparecer muy precozmente, incluso pocas semanas después de la resección quirúrgica. Además, los fármacos actualmente disponibles para la prevención de la recurrencia posquirúrgica tienen una eficacia limitada; hasta el 50% de los casos vuelven a presentar actividad de la enfermedad de Crohn a pesar del tratamiento preventivo, lo que puede conducir a una nueva cirugía con la consiguiente pérdida de función intestinal que finalmente puede derivar a la aparición de síndrome de intestino corto, como complicación irreversible, en algunos pacientes. Por tanto, el manejo de los pacientes con enfermedad de Crohn sometidos a resección intestinal debe estar orientado a la prevención, detección precoz y, en el peor de los casos, al tratamiento de la recurrencia posquirúrgica. En este artículo se revisan la historia natural, las medidas de diagnóstico, monitorización, prevención y el tratamiento de la recurrencia posquirúrgica y se proponen recomendaciones en base al conocimiento actual.
Despite the availability of new, powerful drugs for Crohn's disease, a significant proportion of patients will undergo an intestinal resection to control the disease as it develops. In the absence of an effective preventative treatment, the appearance of new intestinal lesions after surgery for Crohn's disease is the norm; this is known as post-operative recurrence and may appear very early on, even a few weeks after the surgical resection. Furthermore, the drugs that are currently available for the prevention of post-operative recurrence have a limited effect; up to 50% of cases present recurrent Crohn's disease activity despite the preventative treatment, which may require further surgery with the consequent loss of intestinal function, leading some patients to suffer from short bowel syndrome as an irreversible complication. The management of Crohn's disease patients who undergo an intestinal resection should thus be geared towards prevention, early detection and, in the worst case scenario, the treatment of post-operative recurrence. This article reviews the natural history, diagnostic measures, monitoring, prevention and treatment of post-operative recurrence, and proposes recommendations based on existing knowledge.
La enfermedad de Crohn (EC) se caracteriza por ser una afección inflamatoria crónica del tracto digestivo, que suele afectar el segmento distal del intestino delgado, diversos segmentos del intestino grueso o ambos. Este proceso inflamatorio, cuyo origen todavía no está claramente establecido, conduce con frecuencia al daño tisular irreversible en forma de estenosis intestinales o fístulas, plastrones inflamatorios o abscesos intraabdominales en el 20-40% de los pacientes ya en el momento del diagnóstico de la enfermedad y hasta el 55% tras una media de 5 años de evolución, según estudios poblacionales1. Aunque algunas de estas complicaciones pueden manejarse inicialmente con tratamiento médico, la mayoría de ellas precisará la resección del segmento intestinal afecto. Por otra parte, existe una proporción limitada de pacientes con EC que desarrollarán resistencia al tratamiento médico y que, a pesar de no sufrir complicaciones estenosantes o penetrantes, también van a requerir resección intestinal para el control de los síntomas. Un estudio poblacional recientemente publicado demostró que la proporción de pacientes con EC sometida a resección intestinal se había reducido significativamente en las últimas décadas; a pesar de ello, en la cohorte de diagnóstico más reciente (1998-2003) el 19% de los pacientes requirió resección intestinal en el comienzo de la enfermedad y hasta el 25% en los primeros 5 años de evolución2. Por tanto, la resección intestinal sigue siendo actualmente necesaria en una notable proporción de pacientes con EC a pesar de contar con nuevos fármacos.
Lamentablemente, tras la cirugía un elevado porcentaje de pacientes presentará nuevas lesiones en segmentos intestinales previamente no afectados por la enfermedad, fenómeno que se conoce como recurrencia posquirúrgica (RPQ). El desarrollo de RPQ implica un mayor riesgo de requerir nuevas resecciones intestinales, con lo que ello supone respecto a la morbimortalidad asociada al acto quirúrgico y al riesgo de pérdida de función intestinal. Por esta razón, el paciente con EC que ha sufrido una resección intestinal debe ser evaluado, monitorizado y tratado adecuadamente, para evitar la pérdida intestinal irreversible. En los últimos años se han comunicado los resultados de diferentes estudios que aportan datos relevantes tanto en cuanto a la monitorización con nuevas herramientas como la calprotectina, la necesidad de monitorización precoz tras la cirugía o el uso de nuevos fármacos para la prevención de la RPQ que pueden cambiar nuestra práctica clínica. El objetivo de este documento es ofrecer una visión actualizada de la historia natural de la EC tras la resección intestinal con anastomosis ileocólica, revisar las estrategias y tratamientos que se han evaluado y mostrado eficaces en la prevención y tratamiento de la RPQ, y proponer un algoritmo de manejo postoperatorio a largo plazo de los pacientes con EC. Para ello se han realizado diversas búsquedas bibliográficas en PubMed combinando los términos MeSH [Crohn's disease] [recurrence] [postoperative] [natural history] [ileostomy] [outcome] [prevention] [treatment] [infliximab] [adalimumab] [azathioprine] [thiopurines] [mesalamine] [diagnosis] [timing].
Historia natural de la enfermedad de Crohn tras resección intestinalEl término RPQ se utiliza para definir la aparición de nuevas lesiones en la EC tras una resección intestinal quirúrgica teóricamente curativa, a diferencia del término recidiva, que hace referencia a la reaparición de sintomatología clínica en el contexto de un brote de actividad inflamatoria y en un paciente previamente en remisión clínica.
El estudio más relevante para el conocimiento de la historia natural de la RPQ data de 19843. Rutgeerts et al. siguieron prospectivamente a 114 pacientes que, tras resección ileal o ileocólica con anastomosis y sin tratamiento alguno, fueron monitorizados anualmente mediante colonoscopia con intubación y visualización de 40cm del neoíleon. En este estudio se describió una tasa de RPQ del 72% al año de la resección y demostró que las lesiones se localizan más frecuentemente en la zona de la anastomosis o proximalmente a la misma, reproduciendo habitualmente el mismo patrón inicial de la enfermedad. La normalidad macroscópica e histológica de esta zona, demostrada utilizando endoscopia peroperatoria4 y biopsias intraoperatorias3 no impide la aparición de RPQ posterior. Aunque se ha sugerido que las lesiones tras la resección deben considerarse «nuevas», parece más verosímil la teoría de que la EC es una enfermedad difusa del tracto intestinal y que no debe considerarse el concepto de «curación» ni siquiera cuando, aparentemente, no exista evidencia de enfermedad tras la cirugía. La presencia de cambios morfológicos detectados por microscopia electrónica en áreas histológicamente normales de mucosa ileal y cólica, incluyendo márgenes de resección, apoya el concepto de afectación difusa y generalizada de la enfermedad4. Además, el hecho de que la tasa de RPQ evaluada por endoscopia al año de la cirugía se relacione con la presencia de lesiones microscópicas refuerza su papel como precursoras de las lesiones posteriores4.
Las causas por las cuales la RPQ ocurre preferentemente en el neoíleon terminal se desconocen, pero esta preferencia anatómica pudiera tener la misma causa que la localización ileocecal inicial tan frecuente de la EC. Puede especularse que sobre una base de un intestino predispuesto a la inflamación crónica de forma difusa, la acción de agentes ambientales activaría una mayor respuesta inflamatoria macroscópica en una zona concreta; de hecho, se ha sugerido que la RPQ no se produce (al menos no tan rápidamente) si se protege la anastomosis del flujo fecal mediante una ileostomía proximal5. Sin embargo, la posibilidad de que existan otros factores relacionados con la RPQ, además de los endoluminales, la avala la posibilidad comentada más adelante de que pueda aparecer RPQ tras una ileostomía definitiva.
Recientemente se han descrito diferentes perfiles de microbiota (valorados en el momento de la resección) en relación con la evolución posterior, siendo diferentes en pacientes con y sin RPQ posterior6. Por otra parte, es conocida la eficacia de los antibióticos en la prevención de la RPQ y también se ha sugerido recientemente la posibilidad de beneficio de los probióticos7.
Se han descrito diversos acontecimientos que participan en la alteración mucosa del íleon neoterminal, entre ellos los fenómenos de isquemia local8, pero se desconoce su impacto real. De hecho, en un estudio efectuado en un grupo de 28 pacientes a los que se había practicado una hemicolectomía derecha o resección ileocecal con anastomosis ileocólica por adenocarcinoma de colon o pólipos vellosos, no se detectó ninguna lesión en las anastomosis9.
Clasificación de la recurrencia posquirúrgicaEn 1990, el grupo belga que más ha aportado al conocimiento de la RPQ publicó el conocido índice de Rutgeerts10, considerado el patrón oro para la gradación de las lesiones recurrentes (tabla 1). La relevancia de este estudio radica en que demostró que la gravedad de las lesiones endoscópicas visualizadas en los 30 primeros cm de neoíleon se correlaciona con la probabilidad de presentar síntomas propios de la enfermedad. De hecho, los síntomas aparecen cuando ya existen lesiones endoscópicas avanzadas y no es infrecuente observar pacientes con lesiones avanzadas que todavía permanecen asintomáticos. El afta o la ulceración en la anastomosis podría ser la lesión inicial, viene precedida de cambios inflamatorios en la submucosa y tiende a la progresión hacía úlceras. Estas posteriormente confluyen, se hacen más profundas y pueden dar lugar a fístulas, fibrosis y estenosis.
Índice endoscópico de Rutgeerts para la gradación endoscópica de la recurrencia posquirúrgica
| i0 | Mucosa normal |
|---|---|
| i1 | Presencia de menos de 5 aftas |
| i2 | > 5 aftas con mucosa normal entre ellas o lesiones discontinuas más relevantes o lesiones confinadas a<1cm de la anastomosis, en general úlceras |
| i3 | Ileítis aftosa difusa sobre mucosa afecta |
| i4 | Ileítis con úlceras profundas o amplias, empedrado o estenosis |
El hecho de que las lesiones mucosas aparezcan de forma relativamente precoz tras la cirugía y que siempre precedan (a menudo en años) a la aparición de síntomas propios de la EC, condujo a definir lo que se conoce como RPQ endoscópica (RPQe) cuando existen lesiones en la ileoscopia (con independencia de la presencia de síntomas) y RPQ clínica (RPQc) cuando existen síntomas atribuibles a la EC en presencia de lesiones en el neoíleon. Esta diferenciación y el hecho de que la RPQe sea precoz y mucho más común que la RPQc, ha propiciado que la mayoría de los ensayos clínicos utilicen la prevención de RPQe como objetivo principal con el fin de acortar el tiempo de seguimiento. Algunos autores han utilizado otros conceptos como RPQ morfológica (definida por cualquier prueba de imagen –ileoscopia, enterografía por resonancia magnética, radiología baritada, cápsula–), RPQ histológica (cambios inflamatorios en el estudio anatomopatológico sin necesidad de lesiones macroscópicas) o RPQ quirúrgica (necesidad de una nueva resección intestinal debido al desarrollo de RPQ), si bien son términos poco utilizados en práctica clínica.
Aunque el concepto de RPQe es claro, los criterios para definirla son arbitrarios. Los propios autores que describieron el índice endoscópico consideran que lesiones superiores a i1 deben definirse como RPQe. Sin embargo, existen algunos argumentos que podrían favorecer el considerar RPQe solo lesiones más avanzadas. En primer lugar, el estudio inicial de Rutgeerts10 mostraba una elevada probabilidad de RPQc en aquellos pacientes con lesiones i3-i4 y muy baja en aquellos con lesiones i0-i1; por su parte, los pacientes con lesiones i2 presentaban un riesgo «intermedio». Por ello se ha sugerido que el objetivo primario de los estudios que valoran fármacos para la prevención de RPQ debería ser la prevención de lesiones i3-i411. En segundo lugar, es posible que no todas las lesiones encuadrables como i2 tengan el mismo significado pronóstico, e incluso se ha sugerido que el pronóstico de las lesiones confinadas exclusivamente a la anastomosis pueda ser mejor12. De hecho, se ha propuesto la denominación de subgrupo i2a para este tipo de lesiones12, excluyéndose este grupo de la definición de RPQe en los ensayos clínicos de prevención de RPQ más recientemente realizados. En tercer lugar, debe recordarse que la diferencia entre i1 e i2 puede radicar tan solo en una lesión aftoide, lo cual no debería marcar una diferencia en el pronóstico.
Un aspecto relevante en el momento de evaluar la RPQe es el segmento de neoíleon terminal a explorar. En el estudio inicial de Rutgeerts10 los pacientes con lesiones avanzadas (i3-i4) presentaban una longitud media de intestino afecto de 22cm (10-55cm) mientras que solo fue de 8cm (2-15cm) en aquellos con lesiones más leves (i1-i2). De ello se extrapola que si exploran 15cm de neoíleon es suficiente para poder clasificar las lesiones, especialmente si no las hay o son leves. Por otra parte, no existe consenso sobre si la observación de lesiones aisladas más allá de la vecindad con la anastomosis quirúrgica debe ser considerada o no como RPQ. De hecho, se detectan lesiones en el intestino delgado proximal al segmento afectado hasta en el 65% de los pacientes si se realiza una enteroscopia intraoperatoria13 y la existencia de estas lesiones no parece influir en el riesgo de RPQ precoz durante el seguimiento14.
La incidencia de RPQ varía según las series publicadas y según el tipo de RPQ considerado (endoscópica, clínica, radiológica o quirúrgica) y, en ausencia de tratamiento, tiende a ser tan elevada como en el estudio inicial de Rutgeerts10. Así, más del 60% de los pacientes operados presentan RPQe al año de la cirugía, mientras que las tasas de RPQc sin tratamiento son del 20-30% al año de la resección, con un incremento del 10% en cada año posterior15.
Factores de riesgo de recurrencia posquirúrgicaSe han analizado numerosos factores de riesgo para valorar su relación con la aparición de RPQ. La ausencia de criterios unificados hace que sea muy difícil extraer conclusiones definitivas16,17. Los factores que se han evaluado con mayor frecuencia pueden estar relacionados con las características del paciente, de la enfermedad o con factores relativos a la cirugía realizada (tabla 2).
Factores de riesgo potencialmente relacionados con la recurrencia posquirúrgica
| Relacionados con el paciente |
| Fumador |
| Edad más precoz al inicio de la enfermedad |
| Historia familiar de enfermedad inflamatoria intestinal |
| Manifestaciones extraintestinales previas o presentes |
| Factores genéticos: mutaciones de NOD2/CARD15 |
| Relacionados con la enfermedad |
| Localización ileal o ileocólica |
| Menor tiempo desde el diagnóstico hasta la resección |
| Resección intestinal previa |
| Patrón penetrante |
| Enfermedad perianal |
| Afectación extensa (o resección extensa) |
| Títulos elevados de anticuerpos contra Sacharomyces cerevisae (ASCA) |
| Presencia de granulomas en la pieza de resección |
| Gravedad de la plexitis mientérica en la pieza de resección |
| Relacionados con la cirugía |
| Ninguno definitivamente relacionado |
El único factor de riesgo universalmente aceptado y definitivamente relacionado con la aparición de RPQ es el tabaco. Los pacientes con EC que fuman tras la cirugía presentan un riesgo 2,5 veces mayor de RPQ y el doble de riesgo de RPQc en comparación con los no fumadores18. Como se ha comentado con anterioridad, es posible que existan factores endoluminales relacionados con características de la microbiota intestinal que aumenten la posibilidad de RPQ. Muy recientemente se ha sugerido que los pacientes que presentan un aumento del género Proteus y reducción de Faecalibacterium tienen mayores posibilidades de RPQ y precisamente los sujetos fumadores tienen una mayor proporción de Proteus19. Se han evaluado otros posibles factores predisponentes de RPQ en numerosos estudios pero los resultados no son concluyentes y deben interpretarse en un contexto individualizado. Algunos, como son la historia previa de resección, el comienzo agresivo con enfermedad fistulizante, la enfermedad perianal, la resección superior a 50cm o la enfermedad extensa de intestino delgado17, apuntan a una enfermedad más agresiva con necesidad de tratamiento intensivo precoz o a un mayor riesgo de insuficiencia intestinal en caso de resección repetida.
En relación a factores quirúrgicos que pudieran tener un impacto en el desarrollo posterior de RPQ y tras resultados contradictorios previos y controversias sobre el tipo de intervención y anastomosis, parece demostrado que no hay diferencias en las tasas de RPQ ni a corto ni largo plazo entre cirugía abierta y laparoscópica20, ni entre el tipo de anastomosis realizada (término-terminal frente a latero-lateral)21. Tampoco hay diferencias en cuanto a la longitud de los márgenes de resección entre la zona sana y la zona afecta22, con lo que la norma es que debe resecarse exclusivamente la zona macroscópicamente afecta con un margen de seguridad mínimo (aproximadamente 2cm).
La plexitis mientérica, que involucra a los mastocitos de la submucosa, ha sido el factor anatomopatológico más claramente relacionado con la aparición de RPQ precoz. De los tres estudios publicados que han demostrado esta asociación, solo uno es prospectivo23 y evalúa la presencia de lesiones endoscópicas a los 3 meses y al año de la cirugía. La RPQ precoz es más frecuente a mayor gravedad de la plexitis en los márgenes de la pieza resecada. Sin embargo, la presencia de plexitis se relaciona con la neuromodulación entérica que aumenta la permeabilidad paracelular y puede ser un epifenómeno relacionado con la inflamación.
Riesgo de recurrencia posquirúrgica en pacientes con ileostomía definitivaExiste muy poca evidencia sobre la incidencia real y los factores asociados a la RPQ tras la ileostomía terminal. Clásicamente, se consideraba una situación en la que el riesgo de aparición de nuevas lesiones era bajo y no se aconsejaba ni medidas de prevención ni de monitorización. Los datos más recientes han descrito una frecuencia de RPQ mayor a la esperada. Así, se ha descrito en series retrospectivas que puede aparecer en el 35% de los casos24. En nuestro medio se ha comunicado un porcentaje de RPQc del 31% en pacientes con ileostomía definitiva, sin identificar factores de riesgo clínicos o epidemiológicos asociados25. Recientemente se han publicado los resultados de un metaanálisis reciente que incluyó 18 estudios con un total de más de 1.000 pacientes, en el que el riesgo de RPQc tras proctocolectomía con ileostomía definitiva fue del 28%, con tasas medias acumuladas del 23 y 40% a los 5 y 10 años. El antecedente de afectación ileal se asoció a un riesgo 3,2 veces superior (RR 3,2; IC 95% 1,8–5,6), mientras que el patrón penetrante y una edad joven al diagnóstico de la EC también se asociaron con un incremento del riesgo26. Por tanto, aunque la tasa de RPQ en los pacientes con ileostomía definitiva es inferior que cuando existe una anastomosis ileocólica, parece recomendable su monitorización endoscópica aunque la periodicidad, la interpretación de las lesiones y la actitud terapéutica no están definidas.
Objetivos terapéuticos tras la resección intestinal en la enfermedad de CrohnComo ya se ha mencionado, la resección intestinal en la EC suele indicarse ante el desarrollo de complicaciones de la EC o por falta de respuesta al tratamiento médico. Esto, unido a la elevada probabilidad de RPQ si no se toman medidas preventivas, justifica que estos pacientes deban considerarse como un grupo de riesgo o de mal pronóstico. Por este motivo, los objetivos terapéuticos tras la resección intestinal son más exigentes y se centran en evitar la aparición de lesiones «de novo» o, en todo caso, revertir o ralentizar la progresión de la RPQ desde lesiones morfológicas mínimas a un nuevo daño estructural, con el fin último de preservar la máxima integridad intestinal27.
Prevención de la recurrencia posquirúrgicaAbandono del tabaquismoEl tabaquismo activo constituye el factor que más comúnmente se ha asociado a un mayor riesgo de RPQ18, corroborado más recientemente en el contexto de estudios prospectivos y series amplias28,29. El tabaquismo activo no es infrecuente en estos pacientes. En dos cohortes multicéntricas recientes italiana y española, la proporción de pacientes fumadores en el momento de la cirugía fue de alrededor de un tercio30,31. Aunque no existe (ni existirá) ningún estudio controlado que lo haya evaluado, se considera que la recomendación de abandonar el tabaquismo supone la única medida que debe indicarse a todo paciente con EC sometido a una resección intestinal. En este sentido, diversos estudios han demostrado que la mera información sobre el efecto deletéreo del tabaco puede ser de utilidad para facilitar el abandono de su consumo en pacientes con EC32,33. Además, el abandono del tabaquismo conlleva beneficios más allá de la propia EC, reduciendo el riesgo de enfermedad cardiovascular y de desarrollo de determinadas neoplasias, entre otros.
Prevención farmacológicaNumerosos ensayos clínicos controlados han evaluado la eficacia de distintos fármacos en la prevención de la RPQ. El objetivo principal ha sido la prevención de la RPQe (definida como la existencia de lesiones i2 o superior en la ileocolonoscopia) en la mayoría de ellos, como indicador indirecto del riesgo de RPQc. Como ya se ha comentado anteriormente, el riesgo de RPQc es elevado a medio plazo en los pacientes con lesiones i3-i4 pero claramente inferior en caso de lesiones i2. En este sentido, solo algunos estudios ofrecen datos en relación con la prevención de lo que se ha venido a denominar RPQe avanzada o significativa (definida por la existencia de lesiones i3-i4), la cual parece de mayor relevancia clínica, al menos a corto-medio plazo.
Algunos fármacos como la budesonida, la administración oral de interleucina-10, o algunos probióticos no han demostrado ser superiores a placebo en la prevención de la RPQe17.
La mesalazina, a pesar de ser el fármaco que más se ha evaluado en esta indicación, solo ha demostrado un efecto preventivo discreto en algunos de los distintos metaanálisis realizados al respecto34,35. Por esta razón, junto a su excelente perfil de seguridad y bajo coste, solo podría plantearse en pacientes de bajo riesgo para RPQ o con contraindicación absoluta o relativa para tiopurinas o anti-TNF.
Los antibióticos nitroimidazólicos (metronidazol, ornidazol) han demostrado ser superiores a placebo tanto en la prevención de RPQe como de RPQc a corto plazo (12 meses)36,37. Sin embargo, su uso se asocia a una tasa elevada de efectos adversos que comprometen su uso a corto plazo (especialmente en relación con intolerancia digestiva) y al riesgo de neurotoxicidad potencialmente irreversible si se administran por períodos prolongados. Es por ello que su aplicabilidad en la prevención a largo plazo es prácticamente nula pero su administración durante los primeros 3 meses tras la cirugía de forma concomitante a tiopurinas parece incrementar discretamente la eficacia de estas a corto plazo, hipotéticamente debido a su efecto terapéutico demorado38. Por esta razón, diversos ensayos clínicos controlados los han empleado ya sea en pacientes de bajo riesgo o como coadyuvante de otros fármacos en pacientes de alto riesgo29,39.
La administración preventiva de tiopurinas se ha evaluado en diversos ensayos clínicos pero con importantes diferencias metodológicas entre ellos, dificultando alcanzar conclusiones sólidas al respecto. A pesar de ello, el metaanálisis más recientemente publicado al respecto40 apoya su eficacia en la prevención de la RPQe y RPQc. Por otra parte los dos estudios de diseño más adecuado coinciden en demostrar que la tasa de RPQe a los 12 meses se sitúa en torno al 44% cuando se utilizan dosis convencionales de azatioprina (2-2,5mg/kg/día) asociadas a metronidazol durante los primeros 3 meses tras la cirugía38,41. La principal limitación de las tiopurinas sigue siendo la tasa asociada de intolerancia al tratamiento; en un ensayo clínico controlado sobre estrategias de prevención de RPQ, el 30% de los pacientes intervenidos que reunían criterios de alto riesgo de RPQ presentaron intolerancia previa o actual a tiopurinas29.
Los anticuerpos anti-TNF generaron grandes expectativas tras los espectaculares resultados obtenidos en un estudio piloto42. La publicación de los resultados de un ensayo clínico controlado con potencia estadística suficiente ha demostrado que infliximab (a dosis de 5mg/kg cada 8 semanas –sin pauta de inducción–) es claramente superior a placebo en la prevención de RPQe a medio plazo (con tasas de RPQe a los 18 meses del 22% en el grupo infliximab frente a 51% en el grupo placebo, P<0,001). Sin embargo, en este estudio no se hallaron diferencias en la prevención de la RPQc (13% frente a 20%, respectivamente, P=0,97)43. Hasta el momento, solo un estudio ha comparado un agente anti-TNF frente a las tiopurinas en un estudio controlado. López-Sanromán et al., en un estudio promovido por GETECCU, no observaron diferencias en la tasa de RPQe a las 54 semanas entre adalimumab (inducción con 160mg, 80mg y mantenimiento con 40mg cada 2 semanas) y azatioprina (2-2,5mg/kg/día) asociados a un curso de metronidazol los primeros 3 meses tras la cirugía (29 frente a 33% según análisis por protocolo, P=0,76), si bien el estudio podría tener una potencia estadística insuficiente39.
Estrategias de prevenciónComo se ha mencionado previamente, el riesgo de desarrollar RPQ se asocia a determinados factores de riesgo, lo cual significa que existe una población en la que el riesgo-beneficio de iniciar tratamiento preventivo con tiopurinas o agentes anti-TNF podría no estar justificado. La mayoría de los estudios controlados de prevención de RPQ no han estratificado los pacientes según sus factores de riesgo, o bien solo han incluido pacientes considerados de alto riesgo (generalmente definido por la existencia de patrón penetrante, tabaquismo activo o cirugía previa). Recientemente se han publicado los resultados del primer ensayo clínico en el que el tratamiento preventivo difería, dependiendo de si se trataba de pacientes de alto o bajo riesgo de RPQ, de forma que los primeros recibían tiopurinas (o adalimumab, en caso de intolerancia) y los segundos solo un curso de metronidazol durante 3 meses29. A pesar de que existió cierta diferencia en la tasa de RPQe a favor del grupo de bajo riesgo a los 18 meses de seguimiento (50 frente a 70%), esta no alcanzó significación estadística (p=0,4) y la mitad de los pacientes de «bajo riesgo» presentaba RPQe a los 18 meses. Por tanto, en espera de nuevos datos al respecto, la decisión del tratamiento preventivo en base a los factores asociados a RPQ disponibles a día de hoy no parece justificada.
Algunos autores cuestionan la necesidad de iniciar prevención farmacológica de forma sistemática en todos los pacientes con EC sometidos a resección ileocecal. Un estudio prospectivo, controlado y aleatorizado, promovido por la International Organization for study of Inflammatory Bowel Diseases, intentó evaluar el inicio de tiopurinas tras la cirugía o su introducción en caso de RPQe constatada en la ileoscopia realizada a los 6 o 12 meses de seguimiento en pacientes con EC de «riesgo elevado» (patrón penetrante en los 2 meses previos a la resección, cirugía previa, fumadores, proteína C reactiva elevada o uso de antibióticos en el momento de la cirugía y/o edad inferior a 30 años)44. En el grupo de pacientes que inicialmente no iniciaron prevención, el 58% presentaron RPQe (80% de ellos en el primer control endoscópico a los 6 meses) por un 50% en el grupo tratado sistemáticamente con azatioprina. Aunque no existieron diferencias en las tasas de RPQe a los 18 meses entre ambos grupos, el estudio solo incluyó 63 de los 200 pacientes previstos inicialmente para alcanzar la potencia estadística necesaria. Por otra parte, sabemos que entre el 60 y el 75% de los pacientes que desarrollan RPQe a los 12 meses de la cirugía ya presentan lesiones endoscópicas a los 6 meses38,44. Por último, hay que recordar que en ninguno de los estudios en los que se ha evaluado prospectivamente el inicio o intensificación del tratamiento en pacientes con RPQe (ya sea con mesalazina, azatioprina, o adalimumab) se ha obtenido la desaparición de las lesiones en más del 50% de los casos29,45. Por esta razón, esperar a tratar cuando ya existen lesiones puede ser una estrategia arriesgada si tenemos en cuenta que se trata de pacientes que ya han presentado alguna complicación de la EC y han sufrido una resección intestinal.
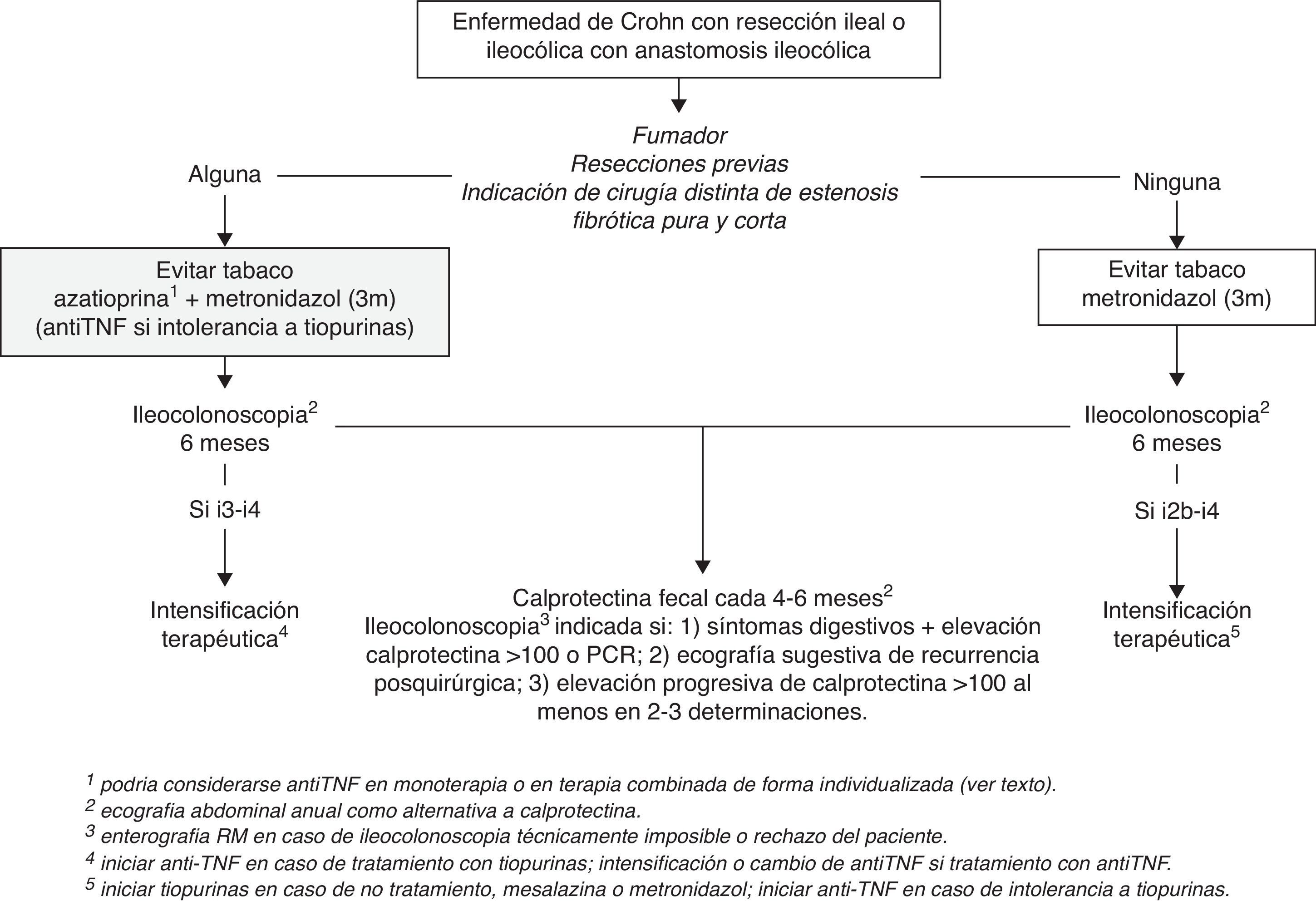
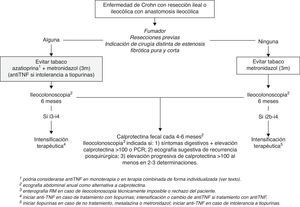
Por tanto, a día de hoy, se recomienda insistir y facilitar el cese de tabaquismo e iniciar un curso de 3 meses de metronidazol a dosis de 15-20mg/kg/día en todos los pacientes sometidos a resección intestinal en la EC. Asimismo, excepto en aquellos pacientes con resecciones indicadas por estenosis fibróticas puras de corta longitud y sin resecciones previas, es recomendable iniciar tratamiento preventivo con tiopurinas o agentes anti-TNF después de la cirugía, tan pronto como sea posible (fig. 1). Dado que no se han demostrado diferencias entre tiopurinas y anti-TNF por el momento y debido a su coste reducido, las tiopurinas deberían ser el fármaco de elección. Sin embargo, debe considerarse el tratamiento con anti-TNF en monoterapia o en tratamiento combinado, de forma individualizada y de acuerdo con la historia previa de la enfermedad y las características del paciente (edad, comorbilidades). En este sentido, el antecedente de múltiples resecciones intestinales o de resecciones amplias podría justificar la indicación de anti-TNF (en monoterapia o en terapia combinada) dado el mayor riesgo de síndrome de intestino corto si aconteciese la RPQ. Igualmente, la edad avanzada o el antecedente de linfoma podrían considerarse indicaciones de anti-TNF en monoterapia para evitar el uso de tiopurinas.
Seguimiento de la enfermedad de Crohn tras la resección intestinalEl seguimiento posquirúrgico de la EC debe tener como objetivo detectar y valorar la gravedad de la RPQ en un momento en que esta sea tratable. Como ya se ha comentado, la RPQ suele ser detectable ya en los primeros 6-12 meses tras la cirugía y, por lo tanto, cabe diferenciar el seguimiento inicial y el seguimiento a largo plazo. De hecho, entre el 60 y el 75% de los pacientes que presentan RPQe a los 12 meses de la cirugía ya presentan lesiones endoscópicas a los 6 meses38,44, mientras que más allá de los 12 meses el porcentaje se incrementa solo ligeramente a los 3 y 10 años, con un máximo de 79%3. Por este motivo y por los mejores resultados en cuanto a RPQe a medio plazo si se realiza una evaluación endoscópica precoz (a los 6 meses) con intensificación terapéutica en caso de lesiones endoscópicas29, actualmente se considera que la monitorización de estos pacientes debe ser precoz tras la cirugía (6 meses).
En este apartado examinaremos brevemente las herramientas disponibles para la monitorización de la RPQ, para luego poder proponer un algoritmo de seguimiento que pueda ajustarse a la mayoría de los pacientes.
Monitorización endoscópica de la recurrencia posquirúrgicaDebido a que el índice de Rutgeerts ha sido el estándar de oro para el diagnóstico, la gradación y evaluación de la RPQ morfológica tanto en ensayos clínicos como en práctica clínica, la ileocolonoscopia sigue siendo la técnica de elección para la evaluación inicial de la RPQ. Es importante destacar que la ileocolonoscopia solo debe realizarse si se tiene un plan terapéutico definido en caso de hallar RPQe. Por otra parte, su indicación no debería depender de si se ha iniciado o no tratamiento preventivo y ni del fármaco elegido (sean tiopurinas o anti-TNF), pues sabemos que ninguno es absolutamente eficaz.
La endoscopia debe intentar explorar al menos 15-20cm del neoíleon y debe permitir el cálculo del índice de Rutgeerts. La modificación posterior de este índice por Domènech, dividiendo el grado i2 de recurrencia en i2a (lesiones confinadas a la anastomosis) e i2b (lesiones fuera de la anastomosis), permite matizar un aspecto polémico puesto que las lesiones i2a podrían comportarse de manera más benigna; sin embargo, esto no excluye su evolución a estenosis anastomótica12. La colonoscopia debe ser realizada por un gastroenterólogo con experiencia en la evaluación endoscópica de este tipo de lesiones, pues la variabilidad interobservador es alta (sobre todo en el grado i2) y esto puede llevar a decisiones terapéuticas incorrectas46. La correcta interpretación y gradación de las lesiones no es baladí, dados los riesgos y costes de los tratamientos que se van a emplear en la RPQ, por lo que siempre que sea posible sería recomendable grabar o fotografiar las imágenes. Es preciso tener en cuenta que la ileoscopia puede resultar técnicamente imposible en hasta el 10% de los casos47, lo que obligará a emplear como prueba de inicio una técnica de imagen sectorial.
Las lesiones más leves (i0 e i1) tienen escasa tendencia a progresar a RPQc, mientras que las lesiones más graves (i3 e i4) progresan casi indefectiblemente. Sin embargo, esto se refiere a un seguimiento a corto-medio plazo y no hay seguridad de que las lesiones leves no terminen resultando en recurrencia sintomática si se prolonga el seguimiento10,48. Por esta razón no existen pautas ni acuerdo sobre la duración del seguimiento posquirúrgico más allá de la ileocolonoscopia inicial, si bien la opinión generalizada es que este debe continuar48,49. La periodicidad de nuevas ileocolonoscopias tras una primera exploración (incluso si esta ha sido normal) no está establecida. Sin embargo, existen algunas circunstancias en las que la repetición de la endoscopia parece claramente indicada, como cuando se sospecha RPQ, ya sea en base a criterios clínicos (síntomas), biológicos (biomarcadores) o por otras pruebas de imagen no invasivas.
Monitorización de la recurrencia posquirúrgica por métodos no invasivosEn la actualidad, los métodos no invasivos suelen limitarse al seguimiento de la RPQ tras una primera evaluación por endoscopia y, por tanto, forman parte de la estrategia de seguimiento a largo plazo. Como se comenta a continuación, algunos de ellos presentan una correlación excelente con la RPQ evaluada mediante ileocolonoscopia, por lo que en un futuro podrían utilizarse (particularmente aquellas de coste económico menor como la calprotectina fecal o la ecografía abdominal) como cribado para decidir la realización incluso de la primera exploración endoscópica. Los medios no invasivos se pueden agrupar en tres tipos: seguimiento clínico, marcadores inflamatorios (proteínaC reactiva y calprotectina, principalmente) y las técnicas de imagen48.
Seguimiento clínicoLa sintomatología no es fiable para diagnosticar la RPQe48. Por un lado, los síntomas suelen acontecer solo cuando las lesiones endoscópicas son avanzadas. Así, en el estudio clásico de Rutgeerts, solo un 20% de los pacientes presentaba RPQc, por un 73% con RPQe3. Por otra parte, en el paciente postoperado a menudo suelen darse situaciones clínicas cuyos síntomas pueden mimetizar una recurrencia sin serlo, como la malabsorción de sales biliares, el sobrecrecimiento bacteriano o las bridas.
Proteína C reactivaLa proteína C reactiva (PCR) es el marcador sérico de inflamación que mejor se correlaciona con la actividad de la EC50. Su disponibilidad es alta y su coste es razonable, por lo que se solicita a menudo durante el seguimiento del paciente con EC intervenida. Sin embargo, la PCR no muestra una correlación adecuada con la aparición de cambios endoscópicos51,52, por lo que debe tomarse como un dato adicional sin valor absoluto. Por otra parte, valores persistentemente elevados en ausencia de otra sospecha o en presencia de síntomas digestivos justificarían la realización de otras exploraciones para descartar RPQ.
Calprotectina fecalLa calprotectina fecal (CF) constituye en la actualidad el biomarcador de actividad y, especialmente, de remisión más prometedor en la enfermedad inflamatoria intestinal. Su resistencia a la degradación que le confiere estabilidad a temperatura ambiente hasta 72 h tras la obtención de la muestra y su bajo coste la convierten en un firme candidato a tener un papel relevante en la monitorización de la RPQ. Como contrapartida, presenta cierta variabilidad intraindividual, por lo que se ha recomendado que la toma de decisiones relevantes (como pudiera ser el inicio de un tratamiento inmunosupresor o biológico), se haga en base a más de una determinación53,54.
Diversos estudios prospectivos que han valorado la correlación de CF en el diagnóstico de la RPQe (definida en todos ellos por lesiones >i1 de Rutgeerts) concluyen que su elevación se correlaciona bien con la presencia de lesiones recurrentes. La utilidad de la CF radica en su elevado valor predictivo negativo, de forma que valores inferiores a 100 mcg/g son altamente indicativos de ausencia de RPQe55–57. De especial interés resulta el uso conjunto de PCR y CF. En efecto, la concurrencia de unos valores respectivos de <5mg/l y <100 mcg/g, posee un valor predictivo negativo del 81% para el diagnóstico de RPQe48,57. Por último, es importante recordar que los valores de CF pueden persistir elevados en los primeros 3 meses tras la cirugía, por lo que no resulta útil su determinación durante este periodo53. A pesar de su prometedor potencial en la monitorización de la RPQ, son necesarios más estudios para establecer la periodicidad de determinaciones y cuántas determinaciones elevadas son coste-efectivas para indicar una ileocolonoscopia diagnóstica.
Técnicas de imagenEl empleo de técnicas de imagen en el estudio de la RPQ tiene su papel en el seguimiento tras la ileocolonoscopia inicial y en aquellos casos (no infrecuentes) en que esta no ha sido posible técnicamente o por rechazo del paciente a realizarse la colonoscopia. Cada una de estas opciones presenta sus ventajas e inconvenientes, pero probablemente la enterorresonancia magnética sea la más adecuada en este contexto. De todos modos, la selección de la prueba de imagen dependerá generalmente de cinco factores: disponibilidad, experiencia, certeza diagnóstica, seguridad y coste. En este sentido, y a pesar de que la modernización de los equipos de adquisición de imágenes de tomografía computarizada (TC) ha resultado en tiempos de exposición y dosis de irradiación cada vez menores, su uso rutinario en el estudio de la RPQ no puede recomendarse. Más acusado es todavía el desuso en el que ha caído el tránsito intestinal; a pesar de ser una técnica universalmente disponible, se ve lastrada por la necesidad de irradiación y por su baja sensibilidad en el diagnóstico de la RPQ58.
Un aspecto que no ha sido suficientemente explorado, es la diferencia entre la recurrencia mucosa, detectable por endoscopia o por videocápsula endoscópica, y las alteraciones a nivel mural y vascular que a menudo se observan mediante técnicas de imagen sectorial. La correlación entre ambas no es perfecta59 y se desconoce su relevancia y de qué manera incluirla en los algoritmos.
Ecografía abdominal (simple o con contraste). La ecografía abdominal es una técnica disponible en la mayoría de los centros, barata, sin radiación y bien aceptada por el paciente. Por otra parte, presenta una marcada dependencia anatómica para la obtención de imágenes adecuadas (menos satisfactorias en pacientes obesos y más satisfactorias en colon ascendente, descendente e íleon terminal) y también de la experiencia del explorador. Existe cierta controversia acerca de los parámetros que se deben valorar en el estudio de la RPQ, pero hay unanimidad en considerar que el grosor de la pared del neoíleon es el más importante. Si se considera un grosor superior a los 3,5mm, el valor predictivo positivo es del 94% y el negativo del 71%58. Estos resultados pueden mejorarse con el empleo de contraste intraluminal (macrogol), habitualmente denominada small intestine contrast ultrasound (SICUS)60. Otros datos a valorar pueden ser la rigidez del neoíleon, la dilatación retrógrada (>25mm), la estenosis ileal (<10mm) y la observación de hiperecogenicidad de la grasa mesentérica, fístulas o abscesos61. El estudio del flujo intestinal mediante doppler permite hasta cierto punto graduar la inflamación. Su observación, junto al engrosamiento de la pared, es probablemente el conjunto de criterios diagnósticos más fiable en el estudio ecográfico de la RPQ62.
Enterorresonancia magnética. La enterorresonancia magnética aúna algunas de las ventajas de la ecografía (ausencia de irradiación) con otras de la TC (imagen reproducible, valoración de complicaciones extraluminales)58. Se suele administrar una cantidad importante de contraste oral (polietilenglicol, con o sin manitol) y se utiliza contraste IV para evaluar la actividad inflamatoria. Su capacidad diagnóstica es, al menos, similar a la de la TC e incluso superior en el diagnóstico de estenosis y de actividad inflamatoria. Se ha evaluado repetidamente en el control de la RPQ63–65, aunque debe tenerse cuidado en la extrapolación de aquellos trabajos que usan enteroclisis, técnica más invasiva, compleja y molesta, que no puede recomendarse de rutina. Los signos más característicos de recurrencia son el engrosamiento de la pared intestinal, la hipervascularización (signo del peine) y la captación de contraste, mientras que la observación de imágenes transmurales de complicación como úlceras o fístulas hablaría de una recurrencia de más gravedad63. Se ha descrito una sensibilidad del 75-90%, con una especificidad del 80-100%66. Es posible además establecer una graduación mediante enterorresonancia63, cuya trascendencia no está validada. A diferencia del resto de exploraciones radiológicas, se trata de una exploración poco confortable para el paciente, de interpretación difícil, y requiere un especialista en imagen dedicado y entrenado.
Videocápsula endoscópica. Su papel en el diagnóstico de la RPQ es interesante, sobre todo por ser la técnica que más se asemeja a la ileocolonoscopia. Además, supera a esta en la capacidad de evaluar la presencia de enfermedad proximal, que puede existir hasta en dos de cada tres pacientes (aunque no necesariamente cambiará la actitud terapéutica). Su posible papel en el diagnóstico de la RPQ se ha evaluado repetidamente47,67,68, con cifras de sensibilidad menores que las de la colonoscopia (en torno al 75-80%) y de especificidad cercanas al 100%. Sin embargo, hay que tener en cuenta su coste y el riesgo de impactación, lo cual limita su uso tanto en casos de ileocolonoscopia incompleta como de sospecha de recurrencia estenótica.
Algoritmo de seguimiento de la enfermedad de Crohn tras resección intestinalCon la evidencia disponible, parece recomendable realizar una ileocolonoscopia a los 6 meses de la cirugía (o de la restauración de la continuidad intestinal, en el caso de que se hubiera precisado una ileostomía temporal) como primera evaluación de la RPQ, independientemente del tratamiento preventivo recibido. En ese mismo momento, parece razonable la realización de aquellas exploraciones (como referencia basal) que se haya escogido como método de monitorización a largo plazo, siendo la CF y la ecografía transabdominal las más coste-efectivas en esta indicación (fig. 1). Con los datos disponibles, la CF debería considerarse la más adecuada para el seguimiento a largo plazo, con determinaciones cada 4 a 6 meses. Al tratarse de una técnica muy dependiente del explorador y poco utilizada en la evaluación intestinal en nuestro medio, la ecografía debería considerarse en caso de no disponer de CF y probablemente debería efectuarse anualmente. La realización de una nueva ileocolonoscopia no estaría indicada en caso de CF inferior a 100 mcg/mg, dado el elevado valor predictivo negativo que ha demostrado en todos los estudios. Sin embargo, debería plantearse la repetición de la ileocolonoscopia en los siguientes supuestos: 1) aparición de síntomas digestivos junto a elevación de marcadores biológicos como la CF o la PCR; 2) sospecha de RPQ por ecografía; 3) elevación progresiva de CF en al menos 2 o 3 determinaciones consecutivas. En aquellos pacientes que en la ileocolonoscopia previa presentaron lesiones leves-moderadas (i1-i2) y con cifras de CF >100 mcg/mg, podría plantearse la realización de ileocolonoscopias periódicas, ya que la CF no ha demostrado discriminar la gravedad de las lesiones recurrentes y que el riesgo de progresión de las lesiones mucosas persiste en el tiempo.
En aquellos pacientes en los que la ileocolonoscopia no es técnicamente posible o que rechazan la realización de la colonoscopia, la enterorresonancia debe ser la técnica de elección, realizándose con la misma periodicidad y con los mismos criterios mencionados que para la ileocolonoscopia.
Tratamiento de la recurrencia posquirúrgica establecidaEl 25-50% de los pacientes que inician tratamiento preventivo de la RPQ con tiopurinas o agentes anti-TNF desarrollarán lesiones endoscópicas en los primeros 6-12 meses tras la cirugía. En estos pacientes, el objetivo terapéutico debe orientarse a la reversión o mejoría de las lesiones para evitar el desarrollo de síntomas. Por tanto, en una proporción notable de pacientes será necesario cambiar u optimizar el tratamiento una vez detectemos RPQe. Los resultados de estudios recientes sobre el manejo terapéutico tras una resección intestinal en pacientes con EC indican que la intensificación del tratamiento según los hallazgos endoscópicos a los 6 meses permite un mejor control de la enfermedad y constituye una estrategia coste-efectiva29,69,70. El estudio POCER comparó dos estrategias de seguimiento y manejo de pacientes con EC y resección intestinal29. Los pacientes bajo tratamiento preventivo a los que se intensificaba el tratamiento según los hallazgos endoscópicos a los 6 meses tras la cirugía presentaron una tasa de RPQe significativamente menor y una proporción de pacientes con ileoscopia normal (i0) significativamente mayor a los 18 meses que el grupo de pacientes en tratamiento preventivo que no se habían monitorizado ni se les había realizado ningún cambio en el tratamiento hasta el final del estudio. Sin embargo, también es cierto que no existieron diferencias en la tasa de pacientes con RPQe avanzada.
Los salicilatos, las tiopurinas y los agentes anti-TNF son los únicos fármacos evaluados para el tratamiento de la RPQ. Reinisch et al.45, en un estudio controlado, prospectivo y aleatorizado, compararon la eficacia de mesalazina y azatioprina para prevenir la RPQc en pacientes con RPQe avanzada (i3-i4) acontecida en los primeros 24 meses tras la cirugía y sin tratamiento preventivo. Los 78 pacientes incluidos se aleatorizaron a recibir azatioprina 2-2,5mg/kg/día o 4g/día de mesalazina. La azatioprina logró una menor tasa de RPQc y una mayor tasa de mejoría endoscópica respecto a los tratados con mesalazina. También disponemos de datos procedentes de aquellos pacientes del estudio POCER29 que presentaron RPQe (definida por lesiones i2 o superiores) en el control endoscópico efectuado a los 6 meses de la cirugía y en los que se procedió a «intensificación» del tratamiento. Tras 12 meses, el tratamiento con tiopurinas (en aquellos pacientes sin tratamiento preventivo previo) consiguió remisión endoscópica en el 25%; adalimumab (en pacientes en tratamiento preventivo previo con tiopurinas) consiguió la remisión endoscópica en el 39% y la intensificación de adalimumab de quincenal a semanal lo consiguió en el 50% de los casos.
Datos procedentes de dos estudios prospectivos abiertos que han comparado distintos tratamientos para RPQ, demuestran que los pacientes tratados con agentes anti-TNF obtienen porcentajes significativamente más elevados de mejoría en el índice de Rutgeerts (69-75%) o bien curación mucosa completa (38-54%) respecto a los pacientes tratados con mesalazina (0%) o azatioprina (38%)69,70, así como una menor tasa de RPQc. Regueiro et al. publicaron los resultados obtenidos en aquellos pacientes que habían sido tratados inicialmente con placebo y que habían desarrollado RPQe al final del seguimiento de un estudio piloto controlado. De los 12 pacientes que iniciaron infliximab, el 58% presentaron mejoría endoscópica, aunque alrededor de la mitad (los que tenían un índice de Rutgeerts más grave) requirieron cirugía tras un seguimiento medio de 3 años71. Un único estudio abierto evaluó infliximab a dosis de 3mg/kg cada 8 semanas para el tratamiento de la RPQe (≥i2), observando que tras un año todos los pacientes tratados alcanzaron curación mucosa72. Adalimumab también ha sido evaluado en este contexto, en un estudio prospectivo y abierto, en pacientes bajo tratamiento preventivo con azatioprina, salicilatos o infliximab con RPQe 6 meses tras la cirugía, observando mejoría endoscópica en un 60% tras dos años de tratamiento (15% con desaparición de las lesiones -i0-)73. Finalmente, en un estudio retrospectivo en pacientes bajo tratamiento preventivo con azatioprina con RPQe (i2b o i3) sin RPQc, se comparó la evolución tras añadir mesalazina (dosis media de 3g/día) o no realizar ningún cambio de tratamiento. Tras casi dos años de seguimiento, se constató mejoría de las lesiones en el 49%, en el 22% estas no cambiaron y en el 30% progresaron, sin observar diferencias entre los dos grupos de estudio74.
Por tanto, podemos concluir que los aminosalicilatos no están indicados en el tratamiento de la RPQ establecida. En aquellos pacientes que presentan RPQe sin tratamiento preventivo previo se recomienda iniciar tratamiento con tiopurinas y/o agentes anti-TNF cuando aparezcan lesiones i2b o superiores, con los mismos criterios comentados en la prevención de RPQ. En aquellos pacientes bajo tratamiento preventivo con tiopurinas o agentes anti-TNF, el escalamiento terapéutico parece más razonable solo en casos de RPQe avanzada (i3-i4) (fig. 1). En todos ellos debe seguirse una monitorización estrecha para valorar la respuesta. Aunque no se dispone de datos al respecto, parece también recomendable insistir en el cese del hábito tabáquico en aquellos pacientes fumadores con RPQe.
Conflicto de interesesEugeni Domènech: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, AbbVie, Hospira, Pfizer, Kern Pharma, Takeda, Celgene, Ferring, Shire Pharmaceuticals, Tillotts Pharma, Gebro Pharma, Otsuka Pharmaceutical.
Antonio López San Román: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, AbbVie, Hospira, Pfizer, Kern Pharma, Takeda, Celgene, Ferring, Shire Pharmaceuticals, Tillotts Pharma, Gebro Pharma, FAES.
Pilar Nos: asesoramiento científico, soporte para investigación y/o actividades formativas de Abbvie, Hospira, Pfizer, Kern Pharma. Takeda, Ferring, Otsuka Pharmaceutica.
Maribel Vera: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, Abbvie, Pfizer, Ferring, Shire Pharmaceuticals, Takeda.
María Chaparro: asesoramiento científico, soporte para investigación y/o actividades formativas de de Tillots- Pharma, Shire Pharmaceuticals, Abbvie, MSD y Takeda.
Maria Esteve: asesoramiento científico, soporte para investigación y/o actividades formativas de de Tillots- Pharma, Abbie, MSD, Gebro Pharma, Takeda, MSD, Abbie y Faes Farma.
Javier P. Gisbert: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, Abbvie, Hospira, Kern Pharma, Biogen, Takeda, Janssen, Pfizer, Roche, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma.
Míriam Mañosa: asesoramiento científico, soporte para investigación y/o actividades formativas de MSD, Abbvie, Ferring, FAES, Otsuka Pharmaceutica, Shire Pharmaceuticals.