La pancreatitis crónica (PC) es una enfermedad relativamente infrecuente, compleja y muy heterogénea. La ausencia de un patrón oro aplicable a las fases iniciales de la PC hace que su diagnóstico precoz sea difícil. Algunas de sus complicaciones, en particular el dolor crónico, pueden ser difíciles de manejar. Hay mucha variedad en el diagnóstico y tratamiento de la PC y de sus complicaciones entre los diferentes centros y profesionales. El Club Español Pancreático ha desarrollado un consenso sobre el manejo de la PC. Dos coordinadores eligieron un panel multidisciplinario de 24 expertos en esta enfermedad. Se elaboró una lista de preguntas. Cada pregunta fue revisada por 2 expertos. Con ello se elaboró un borrador compartido con todo el panel de expertos y discutido en una reunión presencial. En la primera parte del consenso se aborda el diagnóstico de la PC y de sus complicaciones.
Chronic pancreatitis (CP) is a relatively uncommon, complex and highly heterogeneous disease. There is no clear pattern applicable to the initial stages of CP, which hampers its early diagnosis. Some of the complications of CP, especially chronic pain, can be difficult to manage. There is wide variation in the diagnosis and treatment of CP and its complications among centers and health professionals. The Spanish Pancreatic Club has developed a consensus document on the management of CP. Two coordinators chose a multidisciplinary panel of 24 experts in this disease. A list of questions was drawn up. Each question was reviewed by two experts. These questions were then used to produce a draft, which was discussed in a face-to-face meeting with all the participants. The first part of the consensus document focusses on the diagnosis of CP and its complications.
La PC se caracteriza por el desarrollo de deficiencias en la función tanto exocrina como endocrina junto con alteraciones morfológicas que afectan tanto al parénquima como a los conductos de la glándula pancreática. Ello hace que las manifestaciones clínicas de la enfermedad sean muy diversas. Su síntoma principal es el dolor, que suele aparecer en fases iniciales cuando tanto las manifestaciones funcionales o estructurales detectables no se han desarrollado1. Recientemente, la irrupción de la ecoendoscopia ha permitido detectar mínimos cambios estructurales en fases iniciales que señalan la presencia de una PC2. Sin embargo, la ausencia en este momento de un patrón oro impide conocer su verdadera precisión diagnóstica. Lógicamente, el manejo de un paciente con PC incluye inicialmente el tratamiento del dolor y la evaluación y tratamiento de la insuficiencia pancreática. El tratamiento puede ser fundamentalmente farmacológico, endoscópico y quirúrgico por lo que el abordaje siempre ha de ser multidisciplinario3. Probablemente, la complejidad de esta enfermedad pancreática, su dificultad para el diagnóstico preciso y esta diversidad de tratamientos justifica la escasez de guías consensuadas para su manejo4–6.
ObjetivoPor todo lo anteriormente expuesto, el Club Español Pancreático ha llevado a cabo una conferencia de consenso con el fin de guiar la actitud diagnóstica y terapéutica de los profesionales que asisten a pacientes con PC.
MetodologíaAl igual que en los consensos previos7–9, la metodología aplicada es una modificación de las Consensus Development Conferences10. Los apartados de la conferencia son: el panel de expertos, las preguntas suscitadas y la agenda. La responsabilidad de la planificación y la conducción de la logística de la conferencia de consenso corrieron a cargo de la Unidad de Patología Pancreática del Hospital General Universitario de Alicante. Los miembros del panel de expertos fueros elegidos entre facultativos de diversas especialidades médicas y quirúrgicas que intervienen habitualmente en el manejo de la PC según criterios de experiencia clínica e investigadora en esta enfermedad, de experiencia en metodología, estadística y revisión sistemática de la literatura médica, considerando también el prestigio nacional e internacional de cada uno de los expertos en el ámbito de su especialidad. Finalmente, el panel quedó constituido por 24 expertos (13 gastroenterólogos, 2 endoscopistas, 3 cirujanos, 4 endocrinólogos y 2 anestesiólogos). Para evitar sesgos de opinión, la identidad de los miembros del panel se mantuvo oculta hasta la fase final de la conferencia de consenso de forma que cada uno de los miembros desconocía la identidad del resto.
La agenda de la conferencia de consenso se definió de acuerdo a la elaboración de una serie de preguntas clave sobre distintos aspectos diagnósticos y terapéuticos de la PC. Con este esquema de actuación en la agenda se incluyeron finalmente 23 preguntas que fueron distribuidas entre los panelistas. Se siguió como criterio que cada panelista contestara a 2 preguntas y que cada respuesta se realizara en función de la evidencia científica disponible, por lo que debían basarse en la revisión sistemática de la literatura médica existente. Con ello, los panelistas enunciaban unas recomendaciones según una escala común para todos ellos. Así, el grado de evidencia científica se basó en las clasificaciones propuestas por el Oxford Center for Evidence-Based Medicine11. La integración de las diferentes respuestas de los panelistas a las preguntas propuestas constituyó el primer borrador del texto de consenso. Este borrador se distribuyó a cada uno de los panelistas para que tuviera la oportunidad de participar en la redacción final de cada respuesta. Con estas nuevas aportaciones se elaboró un segundo borrador que se discutió en una reunión conjunta de los panelistas y los coordinadores. Fue en ese momento donde se desveló la identidad de los panelistas y la asignación de las preguntas. En esta reunión quedó definido el presente texto de consenso. Un resumen de todas las preguntas y recomendaciones se detalla en la tabla 1.
Resumen de las recomendaciones del Club Español Pancreático para el diagnóstico y tratamiento de la pancreatitis crónica: parte 1 (diagnóstico)
| 1. ¿Qué es una pancreatitis crónica? |
| Una pancreatitis crónica es una enfermedad inflamatoria del páncreas caracterizada por cambios morfológicos irreversibles |
| Al diagnóstico debe llegarse por la conjunción de datos clínicos, métodos de imagen y/o pruebas funcionales |
| 2. ¿Qué pruebas de imagen no endoscópicas permiten el diagnóstico de pancreatitis crónica? |
| El diagnóstico de pancreatitis crónica mediante pruebas de imagen es relativamente sencillo en estadios avanzados de la enfermedad |
| La RM/CPRM y la CPRM con secretina son las técnicas no endoscópicas que pueden detectar con mayor fiabilidad fases menos avanzadas de la enfermedad |
| 3. ¿Qué pruebas de imagen endoscópicas permiten el diagnóstico de pancreatitis crónica? |
| La USE es la técnica de imagen más sensible para el diagnóstico de pancreatitis crónica y su especificidad se incrementa a medida que aumenta el número de criterios diagnósticos |
| 4. ¿Cómo se define y cómo se diagnostica la insuficiencia pancreática exocrina? |
| El patrón oro para este diagnóstico es el coeficiente de absorción grasa (CFA) determinado mediante la cuantificación de la excreción de grasa en heces recogidas durante 72 h consecutivas |
| El test de aliento con 13C-triglicéridos mixtos podría ser una alternativa adecuada al CFA para el diagnóstico de IPE en el contexto de una pancreatitis crónica |
| 5. ¿Cómo se define y se diagnostica la insuficiencia pancreática endocrina? |
| Criterios para el diagnóstico de diabetes mellitus secundaria a pancreatitis crónica son: una glucemia plasmática en ayunas ≥ 126mg/dl y/o una hemoglobina glicosilada ≥ 6,5% |
| 6. ¿Cuál es la etiología de la pancreatitis crónica? ¿Cuál debe ser el estudio etiológico inicial? |
| El alcohol y el tabaco son los factores que han mostrado una clara relación con el desarrollo de la pancreatitis crónica |
| Otras causas demostradas aunque menos frecuentes son la obstructiva, la pancreatitis autoinmune y la pancreatitis hereditaria |
| El estudio etiológico inicial que debe realizarse a un paciente será: una historia clínica que incluya antecedentes familiares y hábitos tóxicos, enfermedades asociadas previas y actuales; una analítica general con estudio de gammaglobulinas y, si cumple criterios de pancreatitis hereditaria, un estudio genético. Técnicas de imagen y una prueba del sudor pueden también ser útiles |
| 7. ¿Hay diferentes tipos de pancreatitis crónica? |
| La pancreatitis crónica puede clasificarse según los siguientes tipos: pancreatitis crónica calcificante, pancreatitis crónica obstructiva, pancreatitis crónica autoinmune y pancreatitis crónica del surco |
| 8. ¿Cuándo se debe solicitar un estudio genético de pancreatitis crónica y cómo interpretar los resultados? |
| Los pacientes con pancreatitis crónica de causa no aclarada, con historia familiar o niños con episodios inexplicables de esta dolencia, son susceptibles de ser testados para las mutaciones PRSS1, CFTR, SPINK1 y CTRC |
| 9. Pancreatitis autoinmune: ¿cómo diagnosticarla y cómo tratarla? |
| El diagnóstico de pancreatitis autoimmune se establece mediante la combinación de hallazgos radiológicos, cambios histológicos, alteraciones serológicas, manifestaciones sistémicas y la respuesta a corticoides sistémicos |
| Se basa en clasificaciones como las de la escuela japonesa y los criterios diagnósticos HISORt que han sido unificados en el Consenso Internacional sobre Criterios Diagnósticos de la pancreatitis autoinmune |
| El tratamiento consiste en la administración de corticoides |
| No hay consenso sobre la opción de realizar tratamiento de mantenimiento con dosis bajas de corticoides |
| Para el tratamiento de las recaídas se recomiendan corticoides o azatioprina |
| Ante la reiterada recurrencia se ha probado el tratamiento con inmunomoduladores con buenos resultados preliminares |
| 10. ¿Qué clasificación pronóstica y de estadio evolutivo se debe utilizar? |
| Las clasificaciones de M-ANNHEIM y Büchler son las que aportan mayor información pronóstica |
| 11. ¿Qué parámetros clínicos y analíticos se deben manejar en el seguimiento de los pacientes con pancreatitis crónica? |
| En los pacientes con pancreatitis crónica estable se recomienda hacer un control clínico y analítico cada 6 meses. En los pacientes con complicaciones el seguimiento ha de hacerse de forma individualizada |
| La presencia de insuficiencia pancreática exocrina y endocrina debe ser evaluada anualmente durante el seguimiento |
| 12. ¿En qué pacientes con pancreatitis crónica, cómo y cuándo se debe realizar un cribado de cáncer de páncreas? |
| La pancreatitis hereditaria es la única forma de pancreatitis en la que se aconseja un cribado para identificar cáncer de páncreas en fase precoz |
| La técnica más recomendada es la ecoendoscopia |
| El cribado debe iniciarse a los 45 años, o 15 años antes de la edad del caso familiar más joven |
A pesar de los esfuerzos realizados en los últimos 50 años, no existe una definición clínica de PC que sea aceptada mayoritariamente. Se han sucedido varias reuniones de expertos12–14 con el objetivo de alcanzar un consenso. Cada informe emitido fundamenta la definición de PC en los métodos diagnósticos disponibles en ese momento, desde la histología hasta las modernas técnicas de imagen como la resonancia magnética (RM)14.
Desde un punto de vista genérico, la PC se define como una enfermedad inflamatoria del páncreas caracterizada por cambios morfológicos irreversibles que provocan típicamente dolor y/o pérdida permanente de función exocrina y endocrina15. Los cambios morfológicos incluyen la dilatación irregular del conducto principal y de los conductos secundarios, calcificaciones en ductos y parénquima, parénquima de contorno irregular, seudoquistes y atrofia glandular. Puede existir estenosis de colédoco distal y, más raramente, de duodeno y colon transverso. La afectación vascular no es infrecuente en forma de trombosis venosas (esplénica) o afectación arterial (seudoaneurismas). El examen microscópico característico detecta la presencia de fibrosis y atrofia acinar que se acompaña de un componente variable de infiltrado inflamatorio crónico. La afectación suele ser parcheada. La presencia exclusiva de atrofia acinar no se considera PC. Además, debe distinguirse entre la PC y la fibrosis simple sin inflamación que puede verse en sujetos sanos14.
RecomendaciónLa pancreatitis crónica es una enfermedad inflamatoria del páncreas caracterizada por cambios morfológicos irreversibles que provocan típicamente dolor y/o pérdida permanente de función exocrina y endocrina. Al diagnóstico debe llegarse por la conjunción de datos clínicos, métodos de imagen y/o pruebas funcionales (nivel de evidencia 5; grado de recomendación D).
¿Qué pruebas de imagen no endoscópicas permiten el diagnóstico de pancreatitis crónica?El diagnóstico de PC mediante pruebas de imagen se basa en los cambios morfológicos de la glándula que suelen ser muy evidentes en sus fases avanzadas, pero difíciles de detectar en los estadios iniciales16,17.
En la radiografía simple de abdomen la presencia de calcificaciones en el área pancreática junto a manifestaciones clínicas compatibles puede ser diagnóstica de PC. Por su parte, la ecografía transabdominal solo detecta estadios avanzados de la PC18.
La tomografía computarizada (TC) es la mejor técnica de imagen no endoscópica para diagnosticar y localizar las calcificaciones pancreáticas. Al igual que la ecografía es únicamente útil en el diagnóstico de la PC en fases avanzadas. La dilatación del conducto pancreático y de sus ramas secundarias se correlaciona bien con la colangiopancreatografía retrógrada endoscópica (CPRE). También detecta atrofia parenquimatosa y lesiones focales.
La RM tiene una mayor sensibilidad para detectar fases precoces de la PC al observar cambios de señal previos a los cambios morfológicos. Estos incluyen la pérdida de la señal normal de alta intensidad, en secuencias T-1. En la fase arterial, tras la administración de gadolinio, se observa una disminución de la señal ofreciendo un aspecto heterogéneo del páncreas con aumento progresivo de la captación en las fases tardías19. La colangiopancreatografía por RM (CPRM) permite una excelente visualización de los conductos biliar y pancreático. Las anomalías del conducto pancreático incluyen la dilatación irregular y el aspecto arrosariado, conteniendo con frecuencia cálculos intraductales. Las ramas colaterales aparecen también dilatadas en fases avanzadas20. La CPRM tras la administración de secretina puede proporcionar una mejor visualización del conducto pancreático y de sus ramas y simultáneamente hacer una valoración de la función pancreática exocrina basada en la cuantificación de la repleción duodenal o del coeficiente de difusión21.
RecomendaciónEl diagnóstico de pancreatitis crónica mediante pruebas de imagen (radiografía simple, ecografía abdominal, TC, RM/CPRM) es relativamente sencillo en estadios avanzados de la enfermedad. La RM/CPRM y la CPRM con secretina son las técnicas no endoscópicas que pueden detectar con mayor fiabilidad fases menos avanzadas de la enfermedad. (nivel de evidencia 2c; grado de recomendación B).
¿Qué pruebas de imagen endoscópicas permiten el diagnóstico de pancreatitis crónica?Aunque la CPRE se ha considerado tradicionalmente como la prueba de referencia para el diagnóstico morfológico, la aparición de nuevos métodos de imagen como la ecoendoscopia (USE) y la CPRM, junto a las complicaciones asociadas a la técnica, la han relegado a un segundo plano22.
La USE es el método de imagen más sensible para establecer el diagnóstico de PC y permite la obtención de muestras de forma dirigida23. Se han definido unos criterios que caracterizan la enfermedad, dividiéndolos en criterios parenquimatosos y ductales24,25. Hasta el momento no existe un punto de corte óptimo para establecer el diagnóstico de la PC. En la práctica clínica habitual, suele emplearse un punto de corte de 4 criterios. Con la hipótesis de que no todos los criterios tienen la misma relevancia se ha propuesto la clasificación del Rosemont26 en la que se definen de forma estricta los criterios ecoendoscópicos de PC y su validez específica. Sin embargo, esta clasificación no parece mejorar el valor diagnóstico de los criterios previamente mencionados27. Otro problema para la validación de la USE ha sido el patrón oro. Cuando se ha comparado la USE con la CPRE y el test de secretina, la concordancia fue del 100% en las formas graves (> 5 criterios), del 50% en las moderadas (3-5 criterios) y del 13% en las leves (0-2 criterios). De hecho, hasta el 25% de los pacientes con test de secretina-ceruleína normal mostraron alteraciones en la USE indicativas de PC, y cuando se aplicó como patrón oro la suma de hallazgos de la CPRE, test de secretina y las características clínicas del paciente, la USE mostró una sensibilidad diagnóstica superior al 84% y una especificidad cercana al 100%28. Cuando se compara con la histología como patrón oro, la sensibilidad de la USE para el diagnóstico de PC supera el 80% con una especificidad del 100%29, existiendo una correlación excelente entre el número de criterios USE presentes y la gravedad de la PC en la histología30.
RecomendaciónLa CPRE permite establecer el diagnóstico de pancreatitis crónica. Sin embargo, su papel actualmente es limitado en favor de otros métodos de imagen menos invasivos (nivel de evidencia 3; grado de recomendación C). La USE es la técnica de imagen más sensible para el diagnóstico de pancreatitis crónica y su especificidad se incrementa a medida que aumenta el número de criterios diagnósticos (nivel de evidencia 1b; grado de recomendación A).
¿Cómo se define y cómo se diagnostica la insuficiencia pancreática exocrina?Basándonos en el concepto de insuficiencia como la incapacidad de un órgano para realizar su función fisiológica y teniendo en cuenta la conocida reserva funcional del páncreas, la insuficiencia pancreática exocrina (IPE) debe referirse exclusivamente a la situación en la que la alteración de la función pancreática se asocia a una incapacidad del páncreas para realizar un proceso de digestión normal.
Habitualmente, el patrón oro para el diagnóstico de IPE es la determinación del coeficiente de absorción grasa (CFA) mediante la cuantificación de la excreción grasa en heces recogidas durante 72 h. Sin embargo, esta técnica tiene varios inconvenientes: es molesta tanto para el paciente como para el personal del laboratorio, su disponibilidad es limitada y los estudios que la validan son antiguos31,32. En PC, una secreción pancreática por debajo del 10% del límite inferior de la normalidad medida por el test de secretina-CCK se correlaciona con la presencia de esteatorrea33. De esta forma, podría emplearse como prueba para el diagnóstico de la IPE. No obstante, la invasividad, la complejidad, el coste y la ausencia de protocolización de este test lo hacen poco recomendable. Se ha descrito una variante de esta prueba con utilización del endoscopio para la obtención del aspirado duodenal34, pero no existen estudios que hayan correlacionado el test endoscópico de función pancreática con el CFA. Clásicamente se considera que una concentración de elastasa en heces inferior a 50μg/g es consistente con la presencia de IPE. Sin embargo, no existen estudios de correlación entre elastasa fecal con el CFA en pacientes con PC, mientras que en pacientes con fibrosis quística esta correlación es pobre, con una sensibilidad de tan solo el 40% y una especificidad del 81% para el diagnóstico de IPE35. Entre los sustratos empleados para el test de aliento destaca el 13C-triglicéridos mixtos que es el único que ha sido adecuadamente comparado con el CFA, mostrando una elevada correlación y una sensibilidad y especificidad del 91% para el diagnóstico de IPE36. Desafortunadamente, esta prueba no está muy extendida. El grado de relleno duodenal durante una CPRM estimulada con secretina tiene una sensibilidad del 69% y una especificidad del 90% en el diagnóstico de IPE medida por CFA37.
RecomendaciónÚnicamente debe denominarse insuficiencia pancreática exocrina a la situación en la que la alteración de la función pancreática se asocia a una incapacidad del páncreas para realizar un proceso de digestión normal (nivel de evidencia 5; grado de recomendación D). Aunque no ampliamente disponible, el coeficiente de absorción grasa (determinado mediante la cuantificación de la excreción de grasa en heces recogida durante 72 h) se considera el patrón oro para este diagnóstico (nivel de evidencia 5; grado de recomendación D). Valores muy reducidos de elastasa fecal deben hacer sospechar la existencia de IPE (nivel de evidencia 5; grado de recomendación D). El test de aliento con 13C-triglicéridos mixtos podría ser una alternativa adecuada al CFA para el diagnóstico de IPE en el contexto de una pancreatitis crónica (nivel de evidencia 1b; grado de recomendación A). La presencia de un relleno duodenal reducido tras la administración de secretina durante un estudio de CPRM puede ser un indicador de insuficiencia pancreática exocrina, aunque un relleno duodenal normal no descarta su existencia (nivel de evidencia 1b; grado de recomendación A).
¿Cómo se define y se diagnostica la insuficiencia pancreática endocrina?La diabetes secundaria a PC (DM-PC), también denominada diabetes tipo 3c, queda incluida en «otras formas específicas» de diabetes dentro de la clasificación etiológica de diabetes mellitus de la American Diabetes Association y se define como un grupo de enfermedades metabólicas caracterizadas por hiperglucemia como consecuencia de defectos en la secreción y/o acción de la insulina secundaria a procesos que afectan difusamente al páncreas38.
Para el diagnóstico de DM-PC se aconseja la determinación de glucemia plasmática en ayunas (GPA) y/o hemoglobina glucosilada (HbA1c). Una GPA ≥ 126mg/dl y/o una HbA1c ≥ 6,5% serían diagnósticas de DM; en ausencia de hiperglucemia inequívoca el resultado debe ser confirmado repitiendo la prueba38. En los casos con valores limitantes o con duda deben repetirse las pruebas o medir la glucemia plasmática a los 120 min de la sobrecarga oral de glucosa (75g), ya que con la prueba de sobrecarga oral de glucosa se demostraron alteraciones de la glucemia compatibles con DM en un 22% de los pacientes con glucemia basal normal39. En este caso valores de glucemia≥200mg/dl confirman el diagnóstico.
RecomendaciónLa DM-PC se define como un grupo de enfermedades metabólicas caracterizadas por hiperglucemia como consecuencia de defectos en la secreción y/o acción de la insulina secundaria a procesos que afectan difusamente al páncreas (nivel de evidencia 5; grado de recomendación D). Criterios para el diagnóstico de diabetes mellitus secundaria a pancreatitis crónica son: una glucemia plasmática en ayunas ≥ 126 mg/dl y/o una hemoglobina glucosilada ≥ 6,5% (nivel de evidencia 1a; grado de recomendación B).
¿Cuál es la etiología de la pancreatitis crónica? ¿Cuál debe ser el estudio etiológico inicial?En 200115 se publicó el sistema de clasificación etiológica denominado TIGAR-O que posteriormente fue modificado40. Esta clasificación se basa en que, en la mayoría de casos, la PC es la consecuencia de la interacción de múltiples factores de riesgo, si bien en ocasiones no se alcanza a conocer su etiología.
Actualmente el alcoholismo se considera la principal causa de PC en los países industrializados pero se estima que debe existir una susceptibilidad individual (probablemente con base genética junto con cofactores ambientales) y que solo una minoría (5%) de los bebedores importantes desarrolla pancreatitis15. Basándose en estudios de cohortes, se considera que el alcohol es la etiología dominante en un paciente con PC si consume al menos 60 g diarios41,42. El hecho de que los individuos bebedores sean también importantes fumadores ocasiona una serie de limitaciones a los estudios que analizan la relación entre el tabaco y la pancreatitis. Sin embargo, aunque el tabaco se ha propuesto como un factor de riesgo independiente para el desarrollo de PC, probablemente podría comportarse como un cofactor y acelerar la progresión de la enfermedad en pacientes con PC alcohólica41,43–45.
La presencia de una obstrucción ductal puede también causar una PC como se detallará en el apartado correspondiente. Aunque se ha comprobado una prevalencia mayor de páncreas divisum en pacientes con PC que la que presenta la población general46, se ha señalado que puede actuar como cofactor etiológico unido a factores genéticos47. Se ha observado que el 20% de los pacientes con insuficiencia renal presentan alteraciones morfológicas pancreáticas frente a solo el 5% de los controles48. Sin embargo, los escasos estudios realizados al respecto no son lo suficientemente consistentes. Por último, algunos fármacos, como inhibidores de la angiotensina, estatinas, didanosina, azatioprina, esteroides, lamivudina, hidroclorotiazida, ácido valproico, anticonceptivos orales e interferón, se han descrito como inductores de PC49. Otras causas reconocidas de PC como la pancreatitis autoinmune y la pancreatitis hereditaria serán tratadas posteriormente.
El primer paso para iniciar el estudio etiológico es una correcta anamnesis en la que se interrogue acerca de fármacos consumidos y antecedentes de insuficiencia renal crónica, consumo de alcohol y tabaco. En caso de sospecha de consumo elevado de alcohol negado por el paciente, puede ser útil hablar con sus familiares o valorar alteraciones analíticas asociadas al etilismo, como la elevación de la transferrina deficiente en hidratos de carbono, GGT, ferritina, VCM o relación GOT/GPT elevada, así como puede ser útil para el diagnóstico de pancreatitis autoinmune la identificación de cifras elevadas de IgG4 y autoanticuerpos. Las técnicas de imagen como TC y CPRM estimulada con secretina pueden ayudar a identificar alteraciones morfológicas pancreáticas.
También es de utilidad la realización de una prueba del sudor (o la secuenciación de genes de CFTR, véase más adelante) para orientar hacia la existencia de una fibrosis quística. Ante situaciones de duda, la práctica de una USE puede ayudar en el diagnóstico y estadificación de la PC50, además de permitir la obtención de material histológico que objetive la presencia de linfoplasmocitos IgG4 positivos, propios de la pancreatitis autoinmune, o descartar razonablemente la presencia de atipias.
RecomendaciónEl alcohol y el tabaco son los factores que han mostrado una clara relación con el desarrollo de la PC (nivel de evidencia 2a; grado de recomendación B). Otras causas demostradas aunque menos frecuentes son la pancreatitis obstructiva, la autoinmune y la hereditaria, que serán tratadas en otros apartados. El estudio etiológico inicial que debe realizarse a un paciente será: una historia clínica que incluya antecedentes familiares y hábitos tóxicos, enfermedades asociadas previas y actuales; una analítica general con estudio de gammaglobulinas y, si cumple criterios de pancreatitis hereditaria (véase el apartado «¿Cuándo se debe solicitar un estudio genético de pancreatitis crónica y cómo interpretar los resultados?»), un estudio genético. Técnicas de imagen como la TC, la RM y la USE, así como un test del sudor, pueden también ser útiles (nivel de evidencia 5; grado de recomendación D).
¿Hay diferentes tipos de pancreatitis crónica?En general, las manifestaciones clínicas, funcionales y morfológicas de los pacientes con PC son muy similares15. Sin embargo, se ha podido observar que determinados factores etiológicos de la enfermedad tienen un comportamiento y unas características histológicas bien diferenciadas51. Por ello, la PC puede ser clasificada según las características clínicas, histológicas y de respuesta al tratamiento:
- -
PC calcificante (PCC). Caracterizada por dolor abdominal, brotes recurrentes de pancreatitis aguda, desarrollo de calcificaciones y aparición de insuficiencia pancreática exocrina y endocrina. Histológicamente se asocia a fibrosis perilobular y destrucción acinar con infiltrado de células inflamatorias agudas y crónicas. Las causas son el abuso del consumo de alcohol y tabaco, la hereditaria y la idiopática15.
- -
PC obstructiva. Se desarrolla por encima de un área de obstrucción ductal. Aparece dilatación del conducto pancreático proximal a la obstrucción, atrofia de las células acinares y fibrosis difusa y uniforme51. Suele ser consecuencia de la presencia de un tumor o secundaria a una estenosis ductal postinflamatoria, a un traumatismo, a disfunción del esfínter de Oddi o a un páncreas divisum. Muchas veces es indolora aunque puede aparecer con clínica de pancreatitis aguda. En algunas ocasiones presenta calcificaciones. Los cambios histológicos y funcionales de esta forma de PC pueden ser total o parcialmente reversibles si se trata el proceso responsable de forma precoz.
- -
PC autoinmune. Sus características se detallan en la respuesta de una cuestión aparte.
- -
Pancreatitis del surco. Afecta al surco formado entre la cabeza del páncreas, el duodeno y la vía biliar. Se han descrito 2 tipos: la forma pura (localizada en el surco, preserva el tejido pancreático sin provocar estenosis del conducto pancreático principal), y la forma segmentaria (tejido cicatricial fibroso que rellena el surco duodenal y que se extiende al parénquima pancreático, con estenosis del Santorini y de la vía biliar y sin afectar al conducto pancreático principal)52.
Según las características clínicas, morfológicas, histológicas y de respuesta al tratamiento, la pancreatitis crónica puede clasificarse según los siguientes tipos: pancreatitis crónica calcificante, pancreatitis crónica obstructiva, pancreatitis crónica autoinmune y pancreatitis crónica del surco (nivel de evidencia 5; grado de recomendación D).
¿Cuándo se debe solicitar un estudio genético de pancreatitis crónica y cómo interpretar los resultados?La PC hereditaria es una enfermedad hereditaria autosómica dominante con una penetrancia del 80%. En el 70% de los pacientes se han descrito mutaciones del gen PRSS153,54. Variantes del gen inhibidor de la proteasa serina Kazal tipo 1 (SPINK1), que bloquea la actividad tripsina intrapancreática previniendo una activación adicional del tripsinógeno y limita una ulterior lesión tisular también se han relacionado con la PC55. El gen que codifica el quimotripsinógeno C (CTRC) tiene baja penetrancia. Mutaciones en este gen han sido relacionadas con PC56,57. Otro gen cuyas mutaciones pueden asociarse a PC es el gen regulador de la conductancia transmembrana de la fibrosis quística (CFTR)58–62. Estas mutaciones pueden asociarse, de forma que se ha descrito que mutaciones en el gen CFTR sumadas a SPINK1 tienen un riesgo de pancreatitis muy elevado63. Se puede considerar que las mutaciones de PRRS1 son causantes de la PC hereditaria, mientras que las mutaciones de SPINK1, CFTR y CTRC serían favorecedoras de la pancreatitis alcohólica, idiopática y tropical.
Actualmente se propone que pacientes con pancreatitis recurrente, PC de causa no aclarada o con historia familiar de pancreatitis o niños con inexplicables episodios de esta dolencia deben ser testados para las mutaciones PRSS164. El diagnóstico de pancreatitis hereditaria es importante no solo por el riesgo de PC sino por el seguimiento que se debe hacer a estos pacientes dado el riesgo tan alto de desarrollo de cáncer de páncreas cercano al 40%65. En cuanto a la identificación del resto de genes asociados a la pancreatitis, se ha propuesto que se realice solo dentro de protocolos aprobados por comités éticos de investigación66. No obstante, esta posición deberá ser revisada según los nuevos descubrimientos que tendrán lugar en este campo y la posibilidad de que la prohibición de cofactores como tabaco o alcohol modifique su historia natural. Una vez identificado un paciente con mutaciones de PRSS1 se le deben recomendar cambios de hábitos como cese en la ingesta de alcohol (debido a su toxicidad) y del consumo de tabaco (factor de riesgo para el desarrollo de cáncer de páncreas). También habrá que valorar el estudiar todos los familiares directos y facilitarles consejo genético.
RecomendaciónLos pacientes con pancreatitis crónica de causa no aclarada, con historia familiar o niños con episodios inexplicables de esta dolencia son susceptibles de ser testados para las mutaciones PRSS1, CFTR, SPINK1 y CTRC (nivel de evidencia 5; grado de recomendación D).
Pancreatitis autoinmune: ¿cómo diagnosticarla y cómo tratarla?La pancreatitis autoinmune carece de sintomatología específica. El diagnóstico diferencial se establece con el cáncer de páncreas. Debe ser sospechada ante una pancreopatía de origen poco claro asociada a enfermedades autoinmunes o tras análisis histológico67. Puesto que las manifestaciones clínicas son poco sensibles y específicas el diagnóstico de la pancreatitis autoinmune se basa en manifestaciones radiológicas, alteraciones analíticas y hallazgos histológicos aunque no existe consenso uniforme68,69. El aumento de la IgG4 sérica es el parámetro analítico con mayor valor diagnóstico70,71. De hecho, la pancreatitis autoinmune ha sido considerada como una enfermedad sistémica asociada a IgG4 y no realmente como una verdadera forma de PC. Por otra parte, la elevación de IgG4 sérica también se ha encontrado en algunos pacientes con cáncer de páncreas o en sujetos normales72. En las pruebas de imagen es característica la observación de un aumento del tamaño del páncreas (focal o difusa) con típico halo en el borde (capsule-like rim) y un estrechamiento irregular del conducto pancreático (también segmentario o difuso), asociado frecuentemente a un estrechamiento de las vías biliares73. Las alteraciones histopatológicas se consideran como la prueba de referencia: intensa infiltración linfoplasmocitaria, predominantemente periductal, intensa fibrosis con mayor o menos sustitución de la masa acinar (en relación con lo avanzada o inicial de la pancreatitis autoinmune) y flebitis obliterativa67,74. Con frecuencia se observa, tanto en el páncreas como en otros órganos cuando están afectados, una intensa infiltración de linfocitos y plasmacélulas IgG4+, constituyendo una confirmación de la enfermedad67,75,76. En general, la punción con aguja fina no permite obtener suficiente tejido como para observar estas alteraciones y asegurar un diagnóstico, por lo que se precisa una biopsia o la resección quirúrgica73,76. Recientemente se ha comprobado que la presencia significativa de plasmacélulas IgG4 tras biopsia endoscópica de la papila duodenal presenta una alta especificidad y una moderada sensibilidad para el diagnóstico de la pancreatitis autoinmune tipo 175. Es característica específica de esta afección la eficacia del tratamiento con corticoides en la resolución de sus síntomas y alteraciones morfológicas68,69,77.
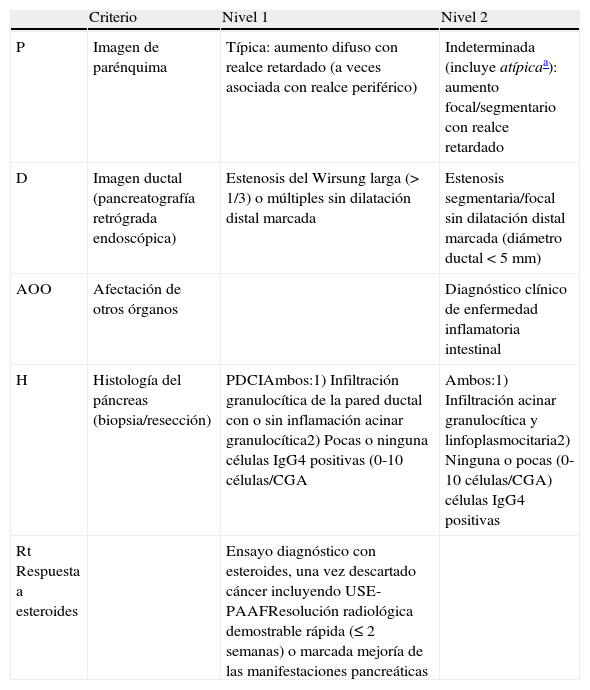
En la actualidad son principalmente dos los criterios diagnósticos claramente definidos: los de la escuela japonesa78 y los de la Clínica Mayo en Estados Unidos (criterios HISORt)79. La Asociación Internacional de Pancreatología elaboró en 2010 el Consenso Internacional sobre Criterios Diagnósticos (CICD) de la pancreatitis autoinmune80 en un intento de unificar los criterios diagnósticos establecidos por diversas sociedades entre ellas las 2 anteriores. El CICD clasifica la enfermedad en tipo 1 y tipo 2. Los términos pancreatitis esclerosante linfoplasmocitaria (PELP; sin lesiones epiteliales granulocíticas) y pancreatitis ductocéntrica idiopática (PDCI; con lesiones granulocíticas) hacen referencia únicamente a los patrones histológicos. Pero dado que la histología no es un dato siempre disponible, los términos tipo 1 y tipo 2 han sido introducidos para describir el perfil clínico asociado a la PELP y la PDCI, respectivamente. El tipo 2 no es considerado una enfermedad relacionada con la IgG4. Para establecer el diagnóstico de pancreatitis autoinmune, el CIDC utiliza la combinación de varios aspectos cardinales de la enfermedad como los hallazgos de imagen, serología, afectación de otros órganos, histología y respuesta al tratamiento. Cada uno de estos aspectos se categoriza en nivel 1 y nivel 2, según su fiabilidad diagnóstica (tablas 2 y 3).
Clasificación de los criterios diagnósticos de pancreatitis autoinmune tipo 1 en nivel 1 y 2
| Criterio | Nivel 1 | Nivel 2 | |
| P | Imagen de parénquima | Típica: Aumento difuso con realce retardado (a veces asociada con realce periférico) | Indeterminada (incluye atípicaa): Aumento focal/segmentario con realce retardado |
| D | Imagen ductal (pancreatografía endoscópica retrógrada) | Estenosis del Wirsung larga (> 1/3) o múltiples sin dilatación distal marcada | Estenosis segmentaria/focal sin dilatación distal marcada (diámetro ductal<5mm) |
| SAOO | SerologíaAfectación de otros órganos | IgG4 > 2 veces sobre el valor límite alto de la normalidada) o b)a) Histología de órganos extrapancreáticos.Al menos 3 de los siguientes:1) Marcada infiltración linfoplasmocitaria con fibrosis y sin infiltración granulocítica2) Fibrosis estoriforme3) Flebitis obliterativa4) Abundantes (> 10 cél./CGA) IgG4 positivasb) Evidencia radiológica típica. Al menos uno de los siguientes:1) Estenosis biliar proximal segmentaria/múltiple (hiliar/intrahepática) o proximal y distal2) Fibrosis retroperitoneal | IgG4 1-2 veces sobre el valor límite alto de la normalidada) o b)a) Histología de órganos extrapancreáticos incluyendo biopsias endoscópicas del conducto biliarb. Ambos de los siguientes:1) Marcada infiltración linfoplasmocitaria sin infiltración granulocítica2) Abundantes (> 10 cél./CGA) IgG4 positivasb) Evidencia clínica o radiológica. Al menos uno de los siguientes:1) Aumento simétrico de las glándulas salivales/lacrimales2) Afectación radiológica renal descrita en asociación con la PAI |
| H | Histología del páncreas | PELP (biopsia/resección).Al menos 3 de los siguientes:1) Infiltrado linfoplasmocitario periductal sin infiltración granulocítica2) Flebitis obliterativa3) Fibrosis estoriforme4) Abundantes (> 10 cél./CGA) IgG4 positivas | PELP (biopsia).Al menos 2 de los siguientes:1) Infiltrado linfoplasmocitario periductal sin infiltración granulocítica2) Flebitis obliterativa3) Fibrosis estoriforme4) Abundantes (> 10 cél./CGA) IgG4 positivas |
| Rt Respuesta a esteroides | Ensayo diagnóstico con esteroides, una vez descartado cáncer incluyendo USE-PAAFResolución radiológica demostrable rápida (≤2 semanas) o marcada mejoría de las manifestaciones pancreáticas/extrapancreáticas |
CGA: campo gran aumento.
Extraída de Shimosegawa et al.80.
Atípica: masa de baja densidad, dilatación ductal o atrofia pancreática distal. Estos hallazgos atípicos en un paciente con ictericia obstructiva son muy indicativos de cáncer de páncreas. Estos casos deben ser considerados como cáncer de páncreas a menos que existan importantes evidencias colaterales de pancreatitis autoinmune y se haya realizado un exhaustivo diagnóstico para descartar malignidad.
Clasificación de los criterios diagnósticos de pancreatitis autoimmune tipo 2 en nivel 1 y 2
| Criterio | Nivel 1 | Nivel 2 | |
| P | Imagen de parénquima | Típica: aumento difuso con realce retardado (a veces asociada con realce periférico) | Indeterminada (incluye atípicaa): aumento focal/segmentario con realce retardado |
| D | Imagen ductal (pancreatografía retrógrada endoscópica) | Estenosis del Wirsung larga (> 1/3) o múltiples sin dilatación distal marcada | Estenosis segmentaria/focal sin dilatación distal marcada (diámetro ductal<5mm) |
| AOO | Afectación de otros órganos | Diagnóstico clínico de enfermedad inflamatoria intestinal | |
| H | Histología del páncreas (biopsia/resección) | PDCIAmbos:1) Infiltración granulocítica de la pared ductal con o sin inflamación acinar granulocítica2) Pocas o ninguna células IgG4 positivas (0-10 células/CGA | Ambos:1) Infiltración acinar granulocítica y linfoplasmocitaria2) Ninguna o pocas (0-10 células/CGA) células IgG4 positivas |
| Rt Respuesta a esteroides | Ensayo diagnóstico con esteroides, una vez descartado cáncer incluyendo USE-PAAFResolución radiológica demostrable rápida (≤ 2 semanas) o marcada mejoría de las manifestaciones pancreáticas |
CGA: campo gran aumento.
Extraída de Shimosegawa et al.80.
Atípica: masa de baja densidad, dilatación ductal o atrofia pancreática distal. Estos hallazgos atípicos en un paciente con ictericia obstructiva son muy indicativos de cáncer de páncreas. Estos casos deben ser considerados como cáncer de páncreas a menos que existan importantes evidencias colaterales de pancreatitis autoinmune y se haya realizado un exhaustivo diagnóstico para descartar malignidad.
El tratamiento con esteroides es la terapia estándar81,82. No existe una pauta terapéutica estandarizada sino basada en la experiencia de múltiples estudios retrospectivos y opiniones de expertos. El tratamiento es claramente eficaz en las primeras semanas y la ausencia de respuesta cuestiona el diagnóstico77. Inicialmente, se suelen administrar oralmente 0,6mg/kg de peso de prednisona durante 2-4 semanas, momento en el que se considera que la respuesta ha sido positiva si se da una clara mejoría de los signos clínicos, de la IgG4 sérica y/o de las pruebas de imagen. En este caso, se reduce progresivamente la dosis 5mg/semana hasta completar las 11 semanas en las que se retira el tratamiento o se reduce hasta 2,5-5mg/día manteniéndolo al menos 6-12 meses. La tasa de recaídas es mucho mayor con tratamientos cortos que con los más prolongados y la reintroducción del tratamiento esteroideo vuelve a tener una respuesta positiva. Algunos grupos recomiendan tratamiento de mantenimiento con dosis bajas de corticoides (2,5-5mg/día) por un periodo de hasta 3 años porque el índice de recidivas es menor81. En estos casos se ha probado el tratamiento con inmunomoduladores (azatioprina, micofenolato de mofetilo) con resultados preliminares esperanzadores. En el subtipo 2 de PA, menos estudiado, parece que las recaídas son infrecuentes83. En caso de recaída se recomienda iniciar de nuevo dosis altas de corticoides o introducir azatioprina84.
RecomendaciónEl diagnóstico de pancreatitis autoinmune se establece mediante la combinación de hallazgos radiológicos, cambios histológicos, alteraciones serológicas, manifestaciones sistémicas y respuesta terapéutica a corticoides y se basa en clasificaciones como las de la escuela japonesa y los criterios HISORt que han sido unificados en el Consenso Internacional sobre Criterios Diagnósticos de la pancreatitis autoinmune (nivel de evidencia 5; grado de recomendación D). El tratamiento consiste en la administración de corticoides durante 3 a 6 meses. No hay consenso sobre la opción de realizar tratamiento de mantenimiento con dosis bajas de corticoides. Para el tratamiento de las recaídas se recomiendan corticoides o azatioprina (nivel de evidencia 2A; grado de recomendación B). En las recaídas, más frecuentes con la pauta corta, se debe reintroducir las dosis iniciales de esteroides con buena respuesta (nivel de evidencia 2b; grado de recomendación B). Ante la reiterada recurrencia se ha probado el tratamiento con inmunomoduladores con buenos resultados preliminares (nivel de evidencia 4; grado de de recomendación C).
¿Qué clasificación pronóstica y de estadio evolutivo se debe utilizar?Se han propuesto múltiples sistemas de clasificación de PC, sin embargo ninguno de ellos se ha extendido en la práctica clínica ni como estándar de comparación de estudios.
El sistema ABC85 divide a los pacientes en función de la ausencia de dolor abdominal (A), dolor sin complicaciones (B) y dolor con complicaciones (C). La Sociedad Japonesa de Páncreas ha propuesto una clasificación que refleja la calidad de vida y puede usarse para las valoraciones del curso clínico y efectos de los tratamientos86. La clasificación de Manchester87 divide la PC en 3 estadios: leve, moderada y estadio final. Finalmente 2 nuevas clasificaciones han sido propuestas: la de M-ANNHEIM40 que ofrece la oportunidad de categorizar a los pacientes de acuerdo con la etiología y comparar los diversos cursos clínicos en función del estadio evolutivo y la gravedad de la enfermedad y que incorpora una escala para determinar el índice de gravedad de la enfermedad; y la de Büchler88 que combina criterios clínicos, morfológicos y de función pancreática, estableciendo en función de estos parámetros 3 grados de enfermedad. Si bien este último sistema es mucho menos extenso y elaborado que el de M-ANNHEIM, presenta algunas ventajas con respecto a este por su sencillez y ser fácilmente reproducible en la práctica clínica.
RecomendaciónNo existen estudios prospectivos que hayan validado las diferentes clasificaciones pronósticas y de estadio evolutivo de la pancreatitis crónica. De los sistemas propuestos, las clasificaciones de M-ANNHEIM y Büchler son las que aportan mayor información pronóstica (nivel de evidencia 5; grado de recomendación D).
¿Qué parámetros clínicos y analíticos se deben manejar en el seguimiento de los pacientes con pancreatitis crónica?El objetivo del seguimiento de la PC es la detección precoz de insuficiencia endocrina, exocrina y la existencia de complicaciones que pueden presentarse en cualquier fase de la enfermedad. Estas complicaciones son los seudoquistes, obstrucción biliar, obstrucción duodenal, sobrecrecimiento bacteriano, ascitis pancreática, hemorragia intraquística, intraductal o retroperitoneal, trombosis esplénica y/o mesentérica, y cáncer de páncreas. No está bien establecido con qué periodicidad y con qué parámetros han de hacerse los controles durante el seguimiento de la PC. Parece razonable, en los pacientes con PC estables, hacer un control clínico y analítico cada 6 meses. En los pacientes con complicaciones el seguimiento ha de hacerse de forma individualizada.
El curso del dolor abdominal puede ser impredecible pero tiene tendencia a mejorar con el tiempo, a la inversa que la IPE y la DM-PC que tienden a empeorar. Es importante establecer un diagnóstico diferencial con otros procesos abdominales que pueden causar cuadros de dolor de características parecidas. La ictericia es debida a la obstrucción del colédoco intrapancreático por la inflamación y fibrosis del páncreas, y en algunos casos por la compresión de un seudoquiste.
La obstrucción duodenal producida por PC puede ser debida a la inflamación de la cabeza pancreática o a un seudoquiste. La ascitis pancreática se produce como consecuencia de la rotura anterior del conducto pancreático o más frecuentemente de un seudoquiste. Los pacientes que presenten un cambio en el patrón del dolor, pérdida de peso y/o ictericia han de ser evaluados para descartar cáncer de páncreas.
Con respecto al control analítico que precisa un paciente con PC no existen datos basados en la evidencia que establezcan qué parámetros y cada cuánto analizarlos. Por ello, una recomendación razonable incluiría el análisis de parámetros en sangre que permitan controlar las consecuencias de la enfermedad, lo que comprendería una analítica general que incluya parámetros nutricionales, perfil hepático, pancreático y glucémico.
Para detectar la aparición de IPE es necesaria la determinación de pruebas funcionales. Aunque, como ya se ha comentado, el patrón oro es la CFA. Esta prueba es laboriosa, molesta y por ello no muy accessible por lo que suele ser reemplazada por otras más extendidas (aunque menos precisas) como la elastasa fecal89 o o el test del aliento con triglicéridos marcados36. En enfermos con IPE es recomendable realizar en alguna ocasión una densitometría ósea por presentar mayor riesgo de desarrollar osteopenia y osteoporosis90. La valoración de la función pancreática endocrina se recomienda en todos los pacientes con PC mediante determinación anual de glucemia basal y hemoglobina glucosilada38.
RecomendaciónEn los pacientes con pancreatitis crónica estable se recomienda hacer un control clínico y analítico cada 6 meses. En los pacientes con complicaciones el seguimiento ha de hacerse de forma individualizada (nivel de evidencia 5; grado de recomendación D). La presencia de insuficiencia pancreática exocrina y endocrina debe ser evaluada anualmente durante el seguimiento (nivel de evidencia 5; grado de recomendación D). Al inicio de la aparición del dolor o si se producen cambios en el patrón, es importante establecer un diagnóstico diferencial con otros procesos abdominales que pueden causar cuadros de dolor de características similares (nivel de evidencia 2b; grado de recomendación C).
¿En qué pacientes con pancreatitis crónica, cómo y cuándo se debe realizar un cribado de cáncer de páncreas?La relación entre PC y cáncer de páncreas se ha confirmado en diferentes trabajos epidemiológicos y de cohortes. No obstante, estos estudios obtienen cifras muy variables en la cuantificación del riesgo dependiendo de la metodología y del tipo de PC. No debe existir un solapamiento temporal entre el diagnóstico de PC y cáncer de páncreas por lo que para que se consideren verdaderos casos de cáncer en pacientes con PC estos deben llevar un mínimo de 2 años de evolución desde el diagnóstico de PC. Recientemente se ha publicado un metanálisis para aclarar qué tipos de PC tienen riesgo de desarrollar cáncer de páncreas91, en el que se concluye que un 5% de los pacientes con PC desarrollará cáncer de páncreas en un periodo de 20 años después del diagnóstico de la pancreatitis. Sin embargo, el riesgo de desarrollar cáncer de páncreas en la pancreatitis hereditaria parece más elevado. Así, se considera que la PC tiene un riesgo entre 5 y 10 veces superior al de la población general, mientras que para la pancreatitis hereditaria el riesgo es aún mayor92,93. Concretamente, según un estudio del International Hereditary Pancreatitis Study este riesgo es hasta 50 veces superior94 y según el European Registry of Hereditary Pancreatitis and Pancreatic Cancer hay un riesgo cada vez más alto de desarrollar cáncer de páncreas después de los 50 años, independientemente del genotipo65.
Los expertos del IV International Symposium of Inherited Diseases of the Pancreas recomiendan un programa de cribado en aquellos pacientes incluidos en el grupo de riesgo mayor de 10, o sea, en la pancreatitis hereditaria92.
No existe una clara opinión de consenso sobre cómo realizar el cribado. Muchos centros recomiendan la utilización de la USE, basados en su capacidad en identificar masas pancreáticas de tamaño menor de 1cm95,96 y la posibilidad de practicar una punción con aguja fina. Sin embargo, esta habilidad se ve mermada cuando existe un proceso inflamatorio pancreático, como en el caso de la pancreatitis hereditaria97. La TC y la CPRM también presentan dificultades, ya que tienen una sensibilidad limitada para detectar pequeñas lesiones que sean potencialmente curables.
El momento adecuado de iniciar el cribado también es discutible y se basa en las recomendaciones de los expertos92. Se ha establecido que debería iniciarse a los 45 años o 15 años antes del caso de cáncer de páncreas más joven aparecido en la familia, si existe en ella el antecedente de pancreatitis hereditaria. En el caso de los fumadores debería iniciarse antes98. Tampoco existe acuerdo sobre la frecuencia con la que debe realizarse la vigilancia, las recomendaciones oscilan en un intervalo de entre 1 y 3 años92.
RecomendaciónLa pancreatitis hereditaria es la única forma de pancreatitis en la que se aconseja un cribado para identificar cáncer de páncreas en fase precoz (nivel de evidencia 2b; grado de recomendación B). La técnica más recomendada es la ecoendoscopia realizada cada 1-3 años, aunque tiene limitaciones (nivel de evidencia 5; grado de recomendación D). El cribado debe iniciarse a los 45 años, o 15 años antes de la edad del caso familiar más joven (nivel de evidencia 5; grado de recomendación D).
Conflicto de interesesEnrique de-Madaria, Enrique Domínguez-Muñoz, Julio Iglesias-García y José Lariño-Noia han sido ponentes remunerados por Abbott Laboratories. Enrique Domínguez-Muñoz es Consultor de Abbott Laboratories y Pentax. Julio Iglesias-García es Consultor de Cook Medical Company. Luis Gómez y Yolanda Sastre han sido ponentes remunerados por Mundipharma, Zambon, Ferrer Pharma y Grunenthal Pharma. José Ramón Aparicio es Consultor de Boston Scientific.
DedicatoriaEl presente consenso está dedicado a la memoria de Luisa Guarner y Miguel Pérez-Mateo.
Esta publicado previamente en lengua inglesa: The Spanish Pancreatic Club recommendations for the diagnosis and treatment of chronic pancreatitis: Part 1 (diagnosis).Martínez J, Abad-González A, Aparicio JR, Aparisi L, Boadas J, Boix E, de Las Heras G, Domínguez-Muñoz E, Farré A, Fernández-Cruz L, Gómez L, Iglesias-García J, García-Malpartida K, Guarner L, Lariño-Noia J, Lluís F, López A, Molero X, Moreno-Pérez O, Navarro S, Palazón JM, Pérez-Mateo M, Sabater L, Sastre Y, Vaquero E, de-Madaria E. Pancreatology. 2013 Jan;13(1):8-17.