Los pacientes con enfermedad inflamatoria intestinal (EII) presentan, con cierta frecuencia, una serie de alteraciones de otros sistemas que pueden preceder al diagnóstico de la enfermedad, pasar a un primer plano debido a su intensidad y, en numerosas ocasiones, condicionar el tratamiento. Para considerar que una de estas alteraciones es una manifestación extraintestinal de la EII es necesario, generalmente, que sea significativamente más frecuente en el curso de esta entidad que en la población general, o bien que se asocie característicamente a la actividad de ésta; además, se debe excluir que sea secundaria a una alteración anatómica, nutricional o metabólica condicionada por la propia enfermedad y descartar que se deba a factores iatrogénicos1 . La prevalencia de las manifestaciones extraintestinales varía con el tipo de estudio, ya que en los transversales se presentan en un 25-35% de los pacientes con EII2,3 , mientras que los longitudinales ponen de manifiesto que esta frecuencia aumenta con el tiempo2,3 . Por otra parte, los estudios que incluyen a pacientes con manifestaciones extraintestinales subclínicas obtienen prevalencias más elevadas, de hasta el 60-70%1 . Algunas de estas manifestaciones acompañan al brote de actividad de la EII, mientras que otras siguen un curso independiente2 .
Los trastornos articulares, que constituyen el contenido de la presente revisión, representan la manifestación extraintestinal más frecuente de la EII. La relación entre artritis periférica y EII se estableció por primera vez para la colitis ulcerosa (CU) en 1929, y a partir de este momento se consideró que la artritis que aparecía tanto en pacientes con CU como en aquellos con enfermedad de Crohn (EC) o enfermedad de Whipple representaba una variante de la artritis reumatoide4 . En 1964, la Asociación Americana de Reumatología diferenció la artritis periférica asociada a la EII de la artritis reumatoide sobre la base de sus características clínicas y la negatividad del factor reumatoide. A partir de 1976 las artritis asociadas a la EII se incluyeron dentro del grupo de espondiloartropatías sero-negativas5,6 .
CLASIFICACIÓNLas espondiloartropatías seronegativas son un conjunto de enfermedades reumáticas inflamatorias crónicas, interrelacionadas y solapadas, tales como la espondilitis anquilosante (EA) idiopática, las artritis reactiva, psoriásica o crónica juvenil, y la espondiloartritis indiferenciada5,6 . Estos trastornos reumatológicos comparten una serie de rasgos comunes como su agregación familiar, presencia de lesiones mucocutáneas y entesopatía, y actualmente su diagnóstico se basa en los criterios del Grupo Europeo para el Estudio de la Espondiloartropatía (GEEE), los cuales se muestran en la tabla I7 . En las espondiloartropatías seronegativas se engloba, junto a los trastornos antes mencionados, la patología articular de la EII con el nombre genérico de artropatía enteropática, la cual puede presentarse en la práctica bajo 2 formas clínicas principales: la artritis periférica y la artritis axial. Además, incluye un grupo variado de otros trastornos periarticulares 1,3,4,8,9 (tabla II). La artritis periférica se subdivide en 2 grupos que se establecen de acuerdo con la distribución de la afectación articular y su historia natural. El tipo 1 o pauciarticular se establece cuando la artritis afecta a menos de 5 articulaciones, cursa como ataques agudos autolimitados de menos de 10 semanas de duración que, generalmente, coinciden con las exacerbaciones de la EII y se asocian fuertemente con otras manifestaciones extraintestinales, fundamentalmente el eritema nodoso y la uveítis. En el tipo 2 o poliarticular la artritis afecta a 5 o más articulaciones, sus síntomas persisten durante meses o años, es independiente de la actividad de la EII y se asocia con uveítis pero no con otras manifestaciones extraintestinales 9 . La afectación axial incluye la sacroileítis y la EA, ambas con características clínicas y radiológicas similares a las formas idiopáticas 3,4 . Otras manifestaciones periarticulares que pueden presentarse incluyen artralgias, entesitis, periostitis, osteopatía hipertrófica y presencia de lesiones granulomatosas articulares 1 .
TABLA I. Criterios del Grupo Europeo para el Estudio de la Espondiloartropatía7
TABLA II. Clasificación de la artropatía enteropática1,3,4,8,9
PREVALENCIA GLOBAL DE LA PATOLOGÍA ARTICULAR
La patología articular es la más frecuente de las manifestaciones extraintestinales de la EII; el 33% de los pacientes presenta, al menos, una manifestación relacionada con ella10 . Sin embargo, la prevalencia de cada trastorno individual varía ampliamente en la bibliografía, lo que puede atribuirse a la influencia de diversos factores metodológicos, entre los que destacan: a) diferencias en la procedencia de los pacientes incluidos en cada estudio, ya que en unos proceden de centros terciarios de referencia, mientras que en otros se seleccionaron desde la población general o de series de pacientes diagnosticados en hospitales generales; b) el tiempo de evolución de la enfermedad, factor que influye especialmente en la prevalencia acumulada de la artritis periférica, ya que ésta es una manifestación autolimitada de corta duración, y c) diferencias en la definición de las espondiloartropatías.
Artritis periféricaLas tasas de prevalencia de la artritis periférica variaron entre el 0,4 y el 34,6% en los estudios iniciales11 . Orchard et al9 , en su estudio retrospectivo de 1.459 pacientes en el que se distinguió por primera vez el tipo 1 del tipo 2 de artritis periférica, obtuvieron una prevalencia global del 7,4%; la artritis de tipo 1 fue más frecuente que la de tipo 2 (un 4,3 y un 2,9%, respectivamente). En trabajos poblacionales recientes se obtienen prevalencias globales similares10,12 (tabla III). Salvarani et al10 , en una cohorte de 160 pacientes con EII, evidenciaron una prevalencia acumulada de artritis periférica del 10,6% al incluir tanto a pacientes con historia pasada de artritis como a pacientes con artritis activa en el momento de la valoración. Por otra parte, el estudio IBSEN (Inflammatory Bowel South-Eastern Norway) 12 , que valoró prospectivamente la aparición de artritis periférica en 521 pacientes seguidos durante 6 años, obtuvo una prevalencia puntual (signos de artritis en el momento de la valoración) del 0,8% y una prevalencia acumulada a lo largo del período de seguimiento del 12%; esta diferencia considerable entre la prevalencia puntual y la acumulada refleja la naturaleza episódica de la artritis periférica en la EII. Por el contrario, un estudio reciente efectuado en un hospital universitario sobre 103 pacientes consecutivos obtiene prevalencias puntual y acumulada superiores (un 10 y un 30%, respectivamente) 13 (tabla III). Los estudios comentados anteriormente han valorado también la prevalencia de ambos tipos de artritis periférica (tabla III), y todos ellos coinciden al señalar la baja prevalencia de la artritis de tipo 2 (1,2-5% de los pacientes con EII). Este hallazgo ha llevado a cuestionar la utilidad clínica de la clasificación de la artritis periférica propuesta por Orchard et al 9 . Con todo ello, el estudio de la incidencia y prevalencia de la artritis periférica debería basarse en estudios longitudinales llevados a cabo sobre pacientes con EII, seleccionados desde la población general y expuestos a múltiples y consecutivos exámenes articulares 12 .
TABLA III. Prevalencia de la artritis periférica en la enfermedad inflamatoria intestinal comunicada en estudios recientes
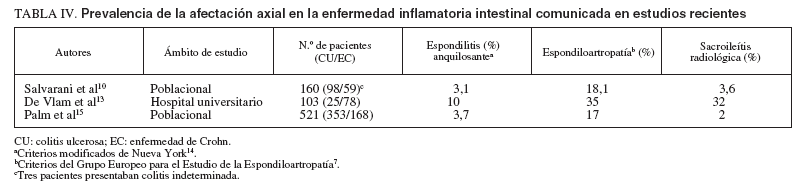
TABLA IV. Prevalencia de la afectación axial en la enfermedad inflamatoria intestinal comunicada en estudios recientes
Artritis axial
Los estudios recientes sobre la prevalencia de la afectación articular axial en la EII se han basado en la utilización de los criterios modificados de Nueva York para la EA descritos en 198414 y en los desarrollados por el GEEE en 19917 . En estos estudios se observa que la prevalencia de la afectación axial varía no sólo en función de la procedencia de los pacientes, como ocurre con la artritis periférica, sino también según los criterios diagnósticos empleados, ya que los del GEEE son más amplios que los modificados de Nueva York al incluir otros trastornos (p. ej., la espondiloartropatía indiferenciada) y más laxos al considerar formas radiológicas más leves de sacroileítis. En 2 estudios de base poblacional la prevalencia de la afectación axial fue, respectivamente, del 3,1 y el 3,75% cuando se utilizaron los criterios modificados de Nueva York, y del 18,1 y el 17% al aplicar los del GEEE10,15 . No obstante, Salvarani et al10 observan que hasta un 14,4% de los pacientes con manifestaciones clínicas de espondiloartropatía no cumplen los criterios del GEEE, por lo que consideran que la afectación axial posiblemente sea superior a la estimada en la actualidad. Por otra parte, De Vlam et al13 , en un estudio efectuado en un hospital universitario, evidencian unas tasas de prevalencia mayores (del 10 y el 35%) (tabla IV). Asimismo, los factores anteriormente comentados influyen en la prevalencia de sacroileítis, que se detectó mediante radiografía simple en el 2 y el 3,6% de los pacientes en estudios poblaciones10,15 y en el 32% de los pacientes seleccionados en un centro terciario13 (tabla IV); en esta diferencia también influyen factores relacionados con la interpretación de las radiografías sacroilíacas y con el método de gradación de éstas (gran variabilidad inte-robservador)10 . Además, en la estimación de la prevalencia de la sacroileítis influye también significativamente la técnica empleada para su diagnóstico. Así, la tomografía computarizada diagnostica la sacroileítis en el 32% de los pacientes frente al 18% detectado mediante radiografía simple16 ; lo mismo ocurre con otras técnicas como la resonancia magnética y la gammagrafía17 . Estas técnicas son más sensibles que la radiografía simple para la detección de sacroileítis asintomáticas. Nosotros hemos observado, en una serie de 170 pacientes con EII (54 CU y 116 EC), la presencia de artritis periférica en 23 pacientes (13,5%) y de dolor de raquis de características inflamatorias en 28 (16,5%). Se observaron signos de sacroileítis en las radiografías simples en
21/159 pacientes (13,2%). Nuestros resultados son similares a los de los trabajos poblacionales, dado que la valoración se realizó sobre la totalidad de los pacientes con EII visitados en nuestra consulta, la cual incluye a prácticamente todos los pacientes con EII de nuestra área sanitaria.
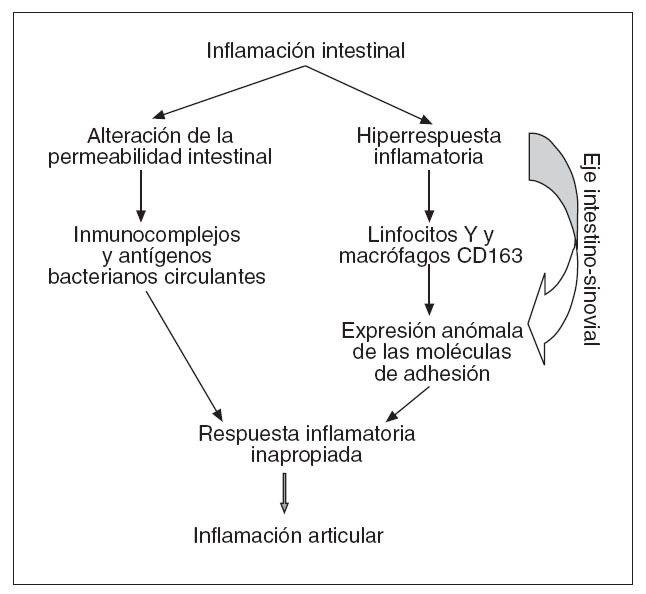
PATOGENIALos mecanismos patogénicos de las enfermedades articulares, como ocurre con los del resto de las manifestaciones extraintestinales de la EII, no se conocen con exactitud. En la actualidad se barajan 2 teorías principales y no excluyentes para explicar la patogenia de las manifestaciones extraintestinal de la EII. La primera atribuye a la pérdida de la capacidad del intestino de actuar como barrera selectiva, que regula la penetración antigénica en el organismo, que determinadas sustancias (componentes bacterianos principalmente) alcancen la circulación sistémica y activen los diversos componentes de la inflamación en otros sistemas18 . La segunda centra la patogenia en un desbordamiento de la respuesta inflamatoria intestinal, que encuentra otras localizaciones donde manifestar19. Los siguientes hechos fundamentan las anteriores teorías patogénicas de las enfermedades articulares. Mediante diversas técnicas experimentales se ha demostrado el aumento de la permeabilidad intestinal en la EII, así como en la EA, la artritis crónica juvenil y la artritis psoriásica incluso en ausencia de enfermedad intestinal20,21 . Asimismo, se ha involucrado a ciertas bacterias anaerobias en la patogenia de diferentes tipos de artritis al observarse que la administración de metronidazol previene el desarrollo de artritis en ratas con asas intestinales ciegas, una vez que se eliminan del intestino anaerobios tipo Bacteroides sp.4 . Por otra parte, el desarrollo de poliartritis que acontece en los pacientes con obesidad mórbida tras una derivación yeyunoileal22 , así como en los pacientes con CU sometidos a proctocolectomía y reservorio ileoanal23 , la cual se acompaña de presencia de inmunocomplejos y antígenos bacterianos circulantes, y la curación de la artritis que sigue a la remisión del brote de EII representan hallazgos que apoyan esta teoría. Sin embargo, el hecho de que los inmunocomplejos no se hayan podido demostrar en las articulaciones inflamadas de los pacientes con EII, así como que la afectación articular axial siga un curso independiente de los brotes de la enfermedad son razones que abogan en contra del papel patogénico del aumento de la permeabilidad intestinal4 . La posibilidad de que la patogenia de las enfermedades articulares sea consecuencia de una hiperrespuesta inflamatoria se basa en el hallazgo de la presencia de linfocitos T con idéntica memoria antigénica específica, tanto en la mucosa intestinal como en la sinovial de las articulaciones afectadas en los pacientes con artropatía enteropática; este hecho implicaría la circulación de estas células desde la pared del tubo digestivo hasta las articulaciones a través de lo que se ha dado en llamar el «eje intestinosinovial» 24 . Este fenómeno podría ser consecuencia de una forma particular de expresión de las moléculas de adhesión tales como la proteína 1 de adhesión vascular y la molécula 1 de adhesión celular vascular 25 . Además, los macrófagos también parecen contribuir en la puesta en marcha del eje intestino-sinovial, ya que los pacientes con EII expresan un aumento selectivo de macrófagos con receptor CD163, tanto en la mucosa intestinal afectada como en la sana y en la sinovial 26 . Los macrófagos pueden actuar a través de 2 mecanismos: a) expresando gran cantidad del antígeno DR del complejo principal de histocompatibilidad (HLA), que desencadenaría una respuesta desmesurada de los linfocitos T, y b) produciendo una intensa secreción de citocinas inflamatorias –p. ej., factor de necrosis tumoral alfa (TNF-α)– no acompañada de la correspondiente secreción de citocinas antiinflamatorias (p. ej., interleucina 10) 25,26 . Todos estos datos se pueden englobar en un concepto en el que, tras la activación de los linfocitos T específicos, alteraciones innatas del sistema inmunitario crean un ambiente permisivo para la persistencia de antígenos bacterianos presentes en la circulación sistémica como consecuencia del aumento de la permeabilidad intestinal, así como para el desarrollo de una respuesta inflamatoria inapropiada tanto en las articulaciones como en el intestino 25 (fig. 1). En consecuencia, los mediadores que desempeñan un papel importante en estas alteraciones inmunológicas, como el exceso de TNF-α o el déficit de interleucina 10, representan interesantes dianas terapéuticas.
Fig. 1. Patogenia de la patología articular en la enfermedad inflamatoria intestinal.
GENÉTICA Y ASOCIACIONES CON EL COMPLEJO PRINCIPAL DE HISTOCOMPATIBILIDAD
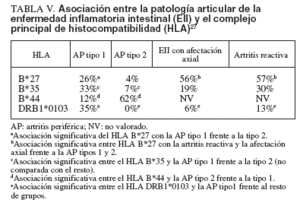
La artropatía enteropática se incluye, como ya se ha indicado, en el grupo de espondiloartropatías seronegativas, el cual se asocia fuertemente al HLA-B27. Sin embargo, los diferentes tipos de trastornos articulares en la EII muestran una asociación variable con el sistema HLA27 (tabla V). La artritis axial es la enfermedad articular con más fuerte asociación al HLA-B27 –se presenta en el 56% de los pacientes–, aunque en menor medida que la presentada por la EA idiopática, que se sitúa alrededor del 90% de los casos. La artritis periférica se asocia menos frecuentemente al HLA-B27; se ha constatado en el 26 y el 4%, respectivamente, en las artritis tipo 1 y 2. Por otra parte, la artritis periférica tipo 1 se asocia preferentemente al DRB1*0103, un subtipo raro del DR1, y al HLA-B35, mientras que la tipo 2 lo hace al HLA-B44, lo que indicaría que ambos tipos de artritis son diferentes no sólo desde el punto de vista clínico sino también etiológica e inmunogenéticamente. Estas asociaciones de la artropatía enterogénica son similares en la CU y la EC. La inconstante asociación de artropatía enterogénica y HLAB27 indica que la ausencia de este antígeno en pacientes con espondiloartropatía seronegativa no excluye la posibilidad de EII subclínica. El gen NOD2 (CARD15) tiene un papel importante en el desarrollo de la EC y proporciona una posible relación entre la inflamación intestinal y la articular4 . Sin embargo, se ha excluido la relación de este gen con las espondiloartropatías, aunque otros miembros de esta familia genética podrían estar implicados28 . En un trabajo realizado en nuestro país, no se evidenció asociación significativa entre las 3 mutaciones más frecuentes del gen NOD2 y la 29.
TABLA V. Asociación entre la patología articular de la enfermedad inflamatoria intestinal (EII) y el complejo principal de histocompatibilidad (HLA) 27
CARACTERÍSTICAS CLÍNICAS
Artritis periféricaLas artritis periféricas se manifiestan por dolor e hinchazón y/o aumento de la temperatura en las articulaciones afectadas. Esta enfermedad articular puede presentarse bajo 2 formas, descritas por Orchard et al9 : artritis periférica tipo 1 o pauciarticular, y artritis periférica tipo 2 o poliarticular, cuyas principales características se han comentado anteriormente en el apartado de la clasificación. Ambos tipos de artritis presentan una frecuencia similar en la CU (tipo 1: 3,6%; tipo 2: 2,5%) y en la EC (tipo 1: 6%; tipo 2: 4%) y son más frecuentes entre las muje-9,10,12 . Existe controversia acerca de la frecuencia de la artritis periférica en relación con la extensión de la afectación intestinal en la EC, ya que su asociación clásica con la colitis granulomatosa, postulada por Farmer et al30 , se ha confirmado en un estudio reciente12 pero no en otros9,10,13.
Las artritis periféricas no suelen ser erosivas ni deformantes, y en los exámenes radiológicos cursan sin destrucción de las articulaciones10 . No obstante, se han descrito casos, en pacientes con EC, de artritis erosiva y deformante31 . Las articulaciones que con más frecuencia se afectan son las rodillas (55%), los tobillos (35%) y las articulaciones de los dedos de las manos y de los pies (18%)9,10,12,13 . El momento de presentación es variable, aunque muestran tendencia a presentarse tras el diagnóstico de la EII. De acuerdo con los resultados de diversos estudios, el 1518% de las artritis periféricas se presentan antes del diagnóstico, el 38% en el momento de éste y en el 46-77% años después del diagnóstico de la EII10,12,13 .
Artritis axialLa afectación axial de la EII se comporta como una EA idiopática o como una sacroileítis asintomática4 . El diagnóstico de EA actualmente se establece sobre la base de los criterios modificados de Nueva YorK14 (tabla VI). La EA enteropática posee algunos rasgos diferentes de la idiopática, como el presentarse a cualquier edad, mientras que el inicio de la EA idiopática suele producirse antes de los 40 años de edad, y no mostrar predominio según el sexo (relación varón/mujer: 1/1), mientras que la EA idiopática afecta más a varones (relación varón/mujer: 2,5/1)8 .
TABLA VI. Criterios modificados de Nueva York para el diagnóstico de espondilitis anquilosante14
Clínicamente, la EA asociada a EII se manifiesta como dolor de espalda de características inflamatorias, dolor en nalgas esporádico (alternando en ambas nalgas) o dolor torácico, y los índices clínicos reflejan una anquilosis ósea generalizada y progresiva desde la región lumbar a la columna cervical5 . Los cambios radiológicos en la EA enteropática, semejantes a los de la idiopática, consisten en cuadratura vertebral por acortamiento de los cuerpos vertebrales y disminución de su densidad, seguidos de calcificaciones ligamentosas y desarrollo progresivo de la «columna en bambú»32 ; no obstante, esta última no se evidencia tan frecuentemente en los pacientes con EII1,15,16.
En estudios recientes se ha observado que la EA, anteriormente considerada más común en la EC (5-22%) que en la CU (2-6%)33 , se presenta con igual frecuencia en ambas enfermedades (CU: 2,6-12%; EC: 5-9%)10,13,15 cuando se define de acuerdo con los criterios modificados de Nueva York. Por otra parte, la afectación global axial tampoco muestra diferencia entre la CU y la EC cuando su frecuencia se evalúa con los criterios del GEEE (CU: 17,3-44%; EC: 18,6-32%)10,13,15 . El curso de la EII y el inicio de la afectación axial son, generalmente, independientes, y con frecuencia los síntomas axiales preceden a la enfermedad intestinal en varios años33 . Los síntomas de la EA se presentan antes que los intestinales en todos los pacientes con CU y en el 50% de los pacientes con EC15 . La asociación de uveítis, entesitis y artritis periférica es significativamente mayor en los pacientes con EII y EA que en aquellos sin espondilitis15 . La EA no se relaciona ni con la extensión ni con la localización de la EII13,16 . La sacroileítis radiológica es mucho más frecuente que la EA. Los signos radiológicos reflejan el desarrollo de cambios inflamatorios en estas articulaciones que de forma gradual progresan hasta la anquilosis13 . Su frecuencia es similar en pacientes con CU y con EC, y es más prevalente en pacientes con una evolución prolongada (5 años o más)13 . En la mayoría de los pacientes, la sacroileítis es asintomática y no se relaciona con la presencia de dolor lumbosacro ni con una reducción del índice de Schober, y tampoco con el desarrollo de artritis o entesitis13 . Sin embargo, en un trabajo reciente el 45% de los pacientes con EC y dolor de espalda presentaron signos de sacroileítis en la tomografía computarizada con test de compresión de las sacroilíacas positivo34 .
Otras manifestaciones articularesLas artralgias, caracterizadas por dolor articular sin signos inflamatorios asociados, se presentan en un 30% de los pacientes9,13 . En nuestra experiencia, en la mayor parte de los casos las artralgias son de características mecánicas. La entesitis se define como la presencia de signos inflamatorios en la inserción ósea de los tendones en ausencia de infección o traumatismo12 . La entesitis en la EII suele afectar a la inserción del tendón de Aquiles y se caracteriza por dolor intenso asociado o no a dificultad para la marcha e hinchazón en el punto de inserción de, al menos, un mes de duración; otras localizaciones periféricas de entesitis son la fascia plantar y la inserción del tendón del cuádriceps13 . Su frecuencia varía entre el 7 y el 10% de los pacientes y es mayor en la EC que en la CU12,13 . Otras manifestaciones articulares como tendinitis, periostitis, osteopatía hipertrófica y la presencia de lesiones granulomatosas articulares se presentan con escasa frecuencia en los pacientes con EII.
Inflamación intestinal en pacientes con espondiloartropatía
En series retrospectivas de pacientes con espondiloartropatía se han observado alteraciones inflamatorias intestinales macro y microscópicas en la ileocolonoscopia hasta en un 67% de los casos, sin que presentaran síntomas digestivos, y se ha observado que algunos de ellos desarrollan posteriormente una EII franca21,35-37 . Asimismo, en el 41% de familiares de pacientes con EA se ha demostrado la presencia de concentraciones fecales elevadas de calprotectina, indicativas de la presencia de inflamación intestinal subclínica38 . Las lesiones intestinales subclínicas observadas en la ileocolonoscopia incluyen signos inflamatorios agudos (similares a las enterocolitis infecciosas) o, más frecuentemente, cambios crónicos indicativos de EC temprana39 . Estudios prospectivos recientes han confirmado estos hallazgos al detectar lesiones intestinales subclínicas en el 72% de los pacientes con espondiloartropatía, de los cuales el 12% desarrolló EII franca, con mayor frecuencia EC; los factores de riesgo para el desarrollo de EII fueron la presencia de diarrea frecuente en las fases iniciales de la espondiloartropatía, elevación de reactantes de fase aguda, presencia de lesiones inflamatorias intestinales crónicas y de sacroileítis bilateral o EA con HLA-B27 negativo40-42 . No obstante, algunas de estas lesiones intestinales observadas en pacientes con espondiloartropatía podrían ser debidas al consumo de antiinflamatorios no esteroideos (AINE).
TRATAMIENTOEn general se admite que el tratamiento de la EII debe ser la primera acción terapéutica, pues se considera que la mejoría de las enfermedades articulares seguirá al control de aquélla. Sin embargo, no siempre el tratamiento adecuado de la EII lleva a una resolución o mejoría del problema articular, lo que ocurre, fundamentalmente, cuando el curso de la artropatía es independiente del de la enfermedad intestinal; en estos casos, para el tratamiento de la enfermedad articular se deben considerar las mismas opciones terapéuticas empleadas en las espondiloartropatías primarias, pero siempre con el cuidado de no inducir un agravamiento de la EII43 . Para el tratamiento de los trastornos articulares que se producen en la EII disponemos de las medidas que se comentan a continuación.
Medidas generales
Se basan en la aplicación de medidas físicas que contemplen un adecuado equilibrio entre el reposo y la actividad física, mediante el desarrollo de programas de ejercicios apropiados y regulares, fisioterapia, hidroterapia y estiramientos pasivos de las articulaciones. Estas medidas se han mostrado beneficiosas en estudios aleatorizados44,45 , ya que mejoran la amplitud de los movimientos, la postura y minimizan las deformidades. El uso de entablillados, correctores o corsés no es beneficioso y debería evitarse6 . Otras medidas generales incluyen el abandono del tabaco, la vacunación anual frente al virus de la gripe, evitar caídas y modificaciones en la vivienda y en el lugar de trabajo6 .
Antiinflamatorios no esteroideosEstos fármacos tienen un papel relevante en el tratamiento de las espondiloartropatías en general, ya que muchas veces son el único tratamiento capaz de controlar el dolor y la rigidez causada por la afectación axial. Del mismo modo, los AINE se utilizan frecuentemente para el tratamiento de la artropatía enteropática43 . Sin embargo, estos fármacos comprometen los mecanismos de defensa de la mucosa gastrointestinal y pueden causar diferentes tipos de lesiones tanto gastroduodenales como ileocolónicas hasta en el 65% de los pacientes que los consumen46,47 ; en concreto, el consumo crónico de AINE origina lesiones que pueden simular una EII, tales como enteritis asintomática hasta en un 70% de los pacientes, colitis hasta en un 10% de casos o estenosis in-testinales48,49 . Por otra parte, los resultados de trabajos retrospectivos sobre el riesgo de desencadenar o reactivar una EII debido al consumo de AINE son controver-tidos50,51 . Los inhibidores selectivos de la ciclooxigenasa 2 originan menor daño intestinal que los AINE inespecíficos y son tan eficaces como éstos46 . En 2 estudios recientes se ha valorado la eficacia y seguridad de estos fármacos en el tratamiento de los trastornos articulares de la EII. El primero de ellos, de carácter retrospectivo, incluyó a 27 pacientes que fueron tratados con celecoxib (200 mg/día) o rofecoxib (25 mg/día); el tratamiento fue beneficioso, completa o parcialmente, en un 81% de los casos, mientras sólo 3 pacientes (11%) presentaron efectos secundarios y en 2 (7,4%) se produjo reagudización de la EII52 . Más recientemente se ha evaluado, de forma prospectiva, el papel del rofecoxib (25 mg o 12,5 mg/día) en 32 pacientes con EII y manifestaciones articulares. En el 41% de los pacientes se consiguió una buena respuesta de su enfermedad articular sin que se evidenciara ninguna reactivación de la EII y en 4 pacientes (12,5%) se presentaron efectos secundarios53 . En definitiva, los inhibidores selectivos de la ciclooxigenasa 2 parecen ser una alternativa eficaz y segura a los AINE inespecíficos, aunque son necesarios más estudios para confirmarlo.
Sulfasalazina y mesalazina
La sulfasalazina es un fármaco ampliamente utilizado en la actualidad para el tratamiento de las espondilartropatías43 . La base para su utilización en la artropatía enteropática se encuentra en sus conocidos efectos beneficiosos para el tratamiento de la artritis reumatoide, la EA idiopática y la misma EII54,55 . En estudios iniciales la sulfasalazina mostró una eficacia similar en el tratamiento de la afectación periférica y axial de la EA56,57 , y un meta-análisis publicado en 1990, que incluía 5 estudios aleatorizados y controlados, puso de manifiesto que el efecto de este fármaco era superior al del placebo para reducir la rigidez matutina y mejorar el estado general de los pacientes, sin que se evidenciaran diferencias en su eficacia entre el tratamiento de la artritis periférica y de la axial58 . Sin embargo, estudios controlados más recientes indican que su papel en el tratamiento de las espondiloartropatías se centra en las manifestaciones periféricas59-61 . La mesalazina ha mostrado una eficacia limitada y no superior a la de la sulfasalazina en el tratamiento general de las espondiloartropatías62 . En nuestro conocimiento, no se ha valorado el uso de este fármaco para el tratamiento específico de la artropatía enteropática.
CorticoidesEstos fármacos deben utilizarse sistémicamente sólo para el control de la enfermedad intestinal, dado que no parecen tener efecto terapéutico alguno a la hora de enlentecer la progresión o mejorar la afectación axial, aunque podrían ser útiles para el control de la artritis periférica43 . Su administración intraarticular puede ayudar cuando haya un número reducido de articulaciones afectadas43 .
InmunodepresoresLa azatioprina, fármaco de efectividad demostrada en el mantenimiento de la remisión de la EII (tanto en la CU como en la EC)63 , parece tener escaso valor en el tratamiento de las manifestaciones de la artropatía enteropática; existe sólo evidencia anecdótica de su valor en la entesopatía rebelde43 . Por otra parte, el metotrexato ha mostrado un efecto positivo en el tratamiento general de las espondiloartropatías, preferentemente sobre la afectación periférica, en varios estudios prospectivos64-66 , pero su efecto no se ha valorado específicamente en la artropatía enteropática. A pesar de estas consideraciones, un estudio reciente ha observado que el consumo de inmunodepresores es significativamente mayor entre los pacientes con EII que presentan espondiloartropatía axial que entre quienes no la presentan10 .
TalidomidaEste fármaco sedante no barbitúrico, actualmente reintroducido para el tratamiento de algunas enfermedades dermatológicas, muestra un efecto inhibidor de la liberación de TNF-α desde las células inflamatorias67 . En varios estudios, la talidomida se ha mostrado eficaz para el tratamiento de la EC a corto plazo y de la EA, aunque con efectos secundarios frecuentes que limitan su utiliza-67,68 . La identificación reciente de una molécula derivada de la talidomida (CC-3052 17) podría suponer la disponibilidad de un agente antiinflamatorio no neurotóxico ni teratogénico, apto para su administración oral, como alternativa terapéutica a los anticuerpos monoclonales anti-TNF-α69 .
Tratamientos biológicosEl infliximab es un anticuerpo quimérico monoclonal anti-TNF-α altamente eficaz y bien tolerado en el tratamiento de las espondiloartropatías tanto periféricas como axiales70,71 . En 2 estudios recientes este fármaco se ha mostrado eficaz a la hora de mejorar rápidamente la enfermedad articular (periférica y axial), así como de inducir la remisión de la enfermedad intestinal72,73 . En otro estudio prospectivo y multicéntrico publicado en 2002, se ha valorado el efecto del infliximab sobre la artritis periférica o las artralgias en 153 pacientes con EC refractaria; a las 12 semanas del inicio del tratamiento 27/59 (46%) pacientes con manifestaciones articulares quedaron asintomáticos74 . De esta forma, el infliximab se considera una opción terapéutica potencial de la artropatía enteropática, al menos para los pacientes con manifestaciones más graves, especialmente cuando se asocia a EII refractaria. El etanercept, un bloqueador humano recombinante del TNF, es también eficaz en el tratamiento de la EA43 . Sin embargo, no ha mostrado su eficacia, a diferencia del infliximab, en el tratamiento de la EII, por lo que su uso en la artropatía enteropática no parece tan plenamente justificado43 . En definitiva, el tratamiento de la artropatía enteropática debe iniciarse mediante la aplicación de medidas generales y el recurso a AINE así como a la eventual infiltración intra o periarticular de corticoides. Si estas medidas no son eficaces o si los pacientes no las toleran, debe instaurarse un tratamiento de segunda línea con salazopirina y/o infliximab, fármacos que posibilitan el tratamiento simultáneo de las enfermedades articular e intestinal.
CONCLUSIÓNLa patología articular es la manifestación extraintestinal más frecuente de la EII. Tiene un impacto significativo sobre la calidad de vida53 y puede originar trastornos invalidantes. En ocasiones puede ser la manifestación inicial de la EII. La presencia de trastornos articulares, especialmente axiales, puede condicionar el tratamiento de la EII10,12.
Correspondencia: Dr. J.M. Paredes . Servicio de Medicina Digestiva. Hospital Universitario Dr. Peset. Avda. Gaspar Aguilar, 90. 46017 Valencia. España. Correo electrónico: chemapar@hotmail.com
Recibido el 5-10-2004; aceptado para su publicación el 6-10-2004.