La osteoporosis es una complicación frecuente en la enfermedad hepática crónica, especialmente en las etapas finales de la enfermedad. El problema es más crítico en los pacientes trasplantados, cuando la pérdida ósea se acelera durante el período inmediatamente después de la cirugía. El principal mecanismo implicado en el desarrollo de osteoporosis en los hepatópatas es el déficit de la formación ósea, por el efecto nocivo de sustancias como la bilirrubina y los ácidos biliares, o bien por el efecto tóxico del alcohol o el hierro sobre los osteoblastos.
Para la prevención y el tratamiento de la osteoporosis es recomendable una buena nutrición y la administración de suplementos de calcio y vitamina D. No hay pautas concretas en su tratamiento farmacológico, pero se ha demostrado que los bisfosfonatos son eficaces para aumentar la masa ósea en pacientes con colestasis crónica, con un buen perfil de seguridad.
Osteoporosis is a common complication of chronic liver disease, especially in the final stages. This entity is more critical in liver transplant recipients, when bone loss accelerates during the immediate postoperative period. The main mechanism involved in the development of osteoporosis in liver disease is deficient bone formation due to the harmful effects of substances such as bilirubin and bile acids or the toxic effect of alcohol or iron on osteoblasts.
To prevent and treat osteoporosis, good nutrition and calcium and vitamin D supplementation are required. There are no specific recommendations on drug treatment but bisphosphonates are effective in increasing bone mass in patients with chronic cholestasis and have a good safety profile.
La osteoporosis es la enfermedad ósea que se desarrolla en los pacientes con una hepatopatía crónica, y en la actualidad es excepcional el desarrollo de una osteomalacia debida a un trastorno importante de la mineralización ósea1. La osteoporosis se caracteriza por una reducción del nivel de masa ósea y de su calidad, que se asocia a un aumento del riesgo de desarrollar fracturas por fragilidad2. Ello conlleva un deterioro de la calidad de vida del paciente, ya mermada por su enfermedad de base.
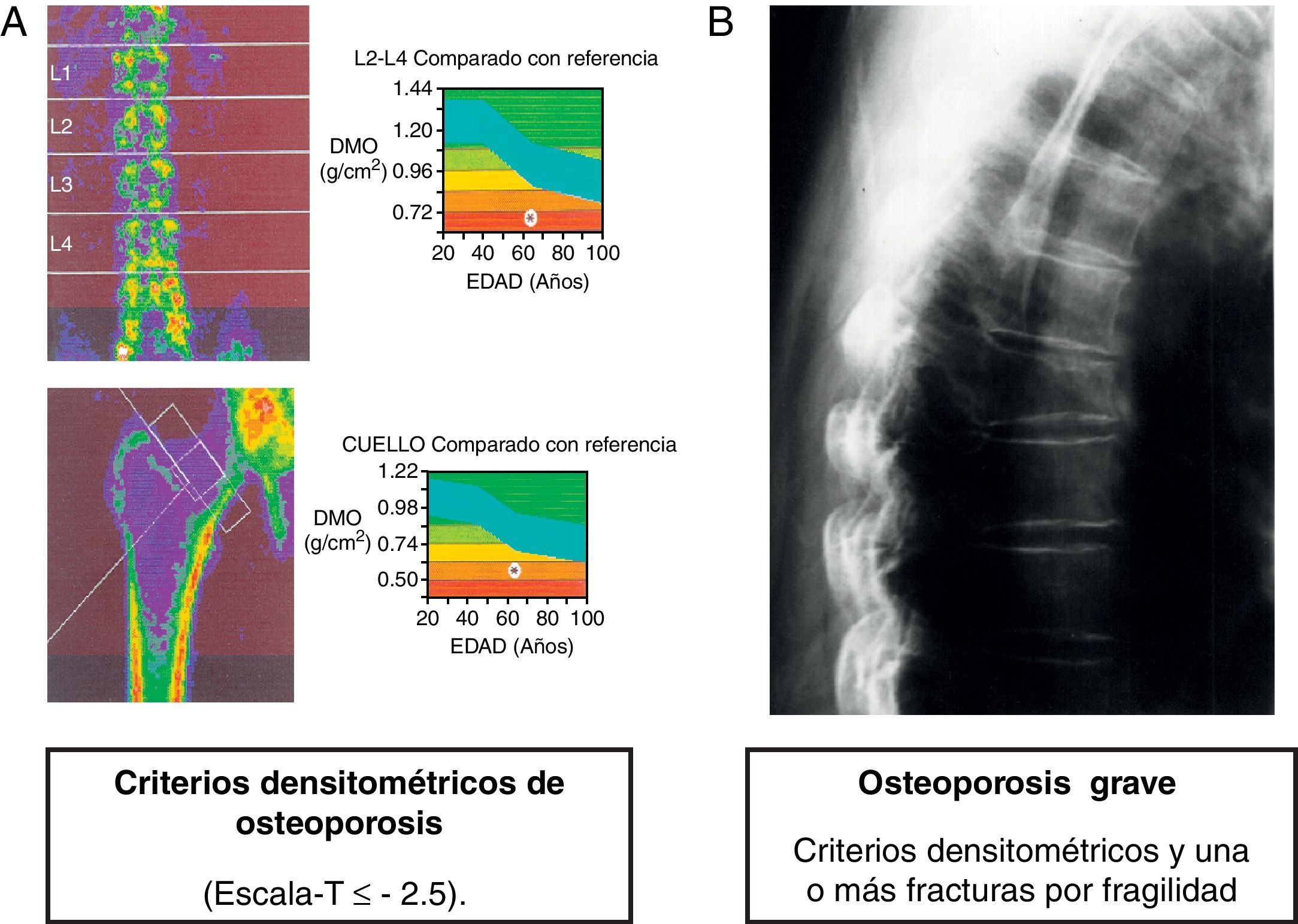
En la actualidad, el diagnóstico de osteoporosis se basa en la evaluación de la densidad mineral ósea (DMO) y en la detección de fracturas (fig. 1). Cuando se valora la densitometría ósea, la escala T (T-score) indica el número de desviaciones estándar que se aleja de la media respecto a la población joven del mismo sexo. Un valor en la escala T inferior a −2,5 indica una osteoporosis en la mujer posmenopáusica y en los varones mayores de 50 años. Cuando este valor se sitúa entre −1 y −2,5 la clasificación es de osteopenia o masa ósea baja3.
Esta revisión describe la prevalencia de osteoporosis, de osteopenia y de fracturas, así como los conocimientos actuales sobre su patogenia. Además, se da una visión actualizada del manejo de los trastornos óseos en pacientes con una enfermedad hepática crónica, desde la colestasis al trasplante de hígado.
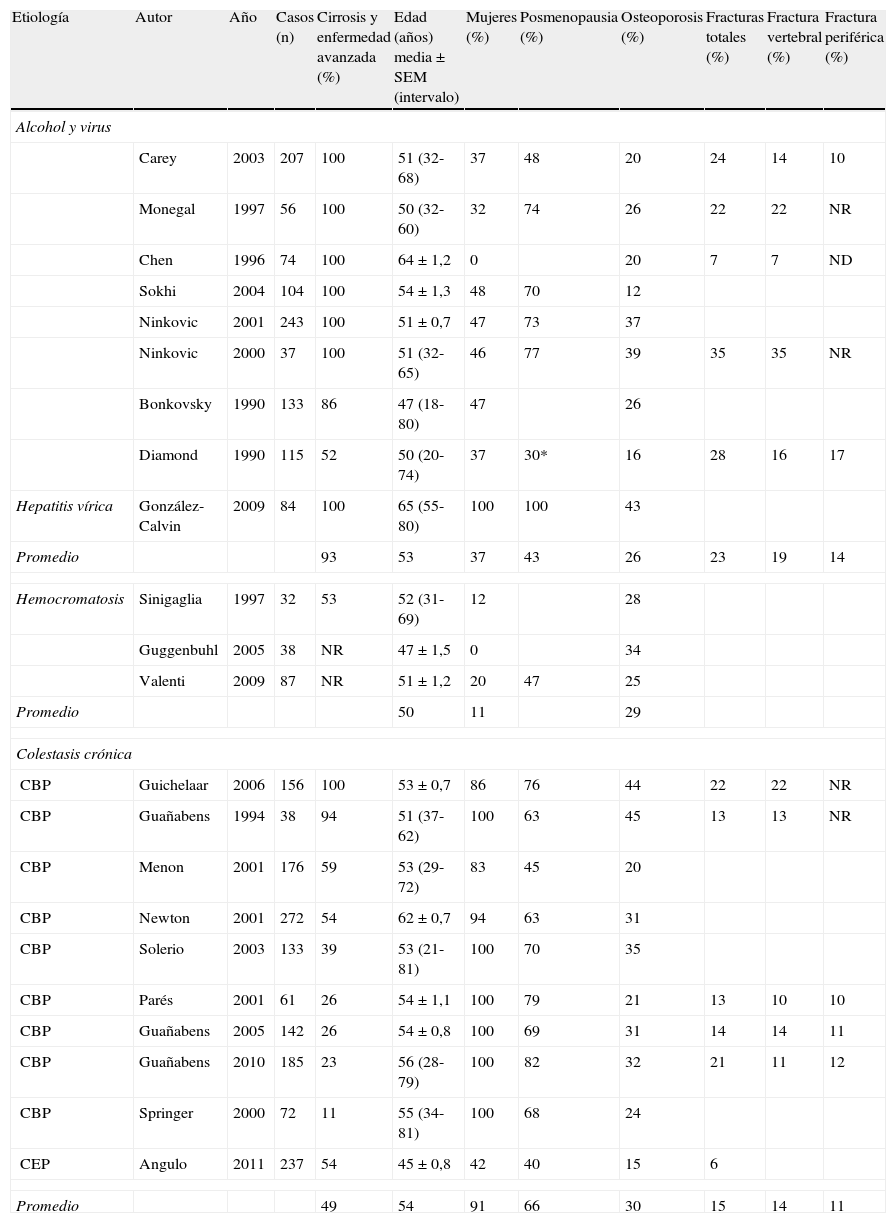
Prevalencia de osteoporosis y fracturas en las enfermedades hepáticasHay una cierta heterogeneidad en la prevalencia de osteoporosis en pacientes con enfermedad hepática crónica, que depende de la selección de pacientes y de los criterios de diagnóstico4–6 (tabla 1). Aproximadamente un 30% de los pacientes con enfermedad hepática tienen una osteoporosis, con una mayor prevalencia en pacientes con cirrosis biliar primaria (CBP)7. Esta mayor prevalencia, que se situó en un 37% en una serie de 185 mujeres de nuestro medio, es debida a que estos pacientes tienen 2 factores de riesgo adicionales para osteoporosis: colestasis crónica y sexo femenino. Es importante destacar que la osteoporosis y la osteopenia se relacionan con la gravedad del daño hepático5.
Prevalencia de osteoporosis y fracturas en las enfermedades hepáticas según la etiología y gravedad
| Etiología | Autor | Año | Casos (n) | Cirrosis y enfermedad avanzada (%) | Edad (años) media±SEM (intervalo) | Mujeres (%) | Posmenopausia (%) | Osteoporosis (%) | Fracturas totales (%) | Fractura vertebral (%) | Fractura periférica (%) |
| Alcohol y virus | |||||||||||
| Carey | 2003 | 207 | 100 | 51 (32-68) | 37 | 48 | 20 | 24 | 14 | 10 | |
| Monegal | 1997 | 56 | 100 | 50 (32-60) | 32 | 74 | 26 | 22 | 22 | NR | |
| Chen | 1996 | 74 | 100 | 64±1,2 | 0 | 20 | 7 | 7 | ND | ||
| Sokhi | 2004 | 104 | 100 | 54±1,3 | 48 | 70 | 12 | ||||
| Ninkovic | 2001 | 243 | 100 | 51±0,7 | 47 | 73 | 37 | ||||
| Ninkovic | 2000 | 37 | 100 | 51 (32-65) | 46 | 77 | 39 | 35 | 35 | NR | |
| Bonkovsky | 1990 | 133 | 86 | 47 (18-80) | 47 | 26 | |||||
| Diamond | 1990 | 115 | 52 | 50 (20-74) | 37 | 30* | 16 | 28 | 16 | 17 | |
| Hepatitis vírica | González-Calvin | 2009 | 84 | 100 | 65 (55-80) | 100 | 100 | 43 | |||
| Promedio | 93 | 53 | 37 | 43 | 26 | 23 | 19 | 14 | |||
| Hemocromatosis | Sinigaglia | 1997 | 32 | 53 | 52 (31-69) | 12 | 28 | ||||
| Guggenbuhl | 2005 | 38 | NR | 47±1,5 | 0 | 34 | |||||
| Valenti | 2009 | 87 | NR | 51±1,2 | 20 | 47 | 25 | ||||
| Promedio | 50 | 11 | 29 | ||||||||
| Colestasis crónica | |||||||||||
| CBP | Guichelaar | 2006 | 156 | 100 | 53±0,7 | 86 | 76 | 44 | 22 | 22 | NR |
| CBP | Guañabens | 1994 | 38 | 94 | 51 (37-62) | 100 | 63 | 45 | 13 | 13 | NR |
| CBP | Menon | 2001 | 176 | 59 | 53 (29-72) | 83 | 45 | 20 | |||
| CBP | Newton | 2001 | 272 | 54 | 62±0,7 | 94 | 63 | 31 | |||
| CBP | Solerio | 2003 | 133 | 39 | 53 (21-81) | 100 | 70 | 35 | |||
| CBP | Parés | 2001 | 61 | 26 | 54±1,1 | 100 | 79 | 21 | 13 | 10 | 10 |
| CBP | Guañabens | 2005 | 142 | 26 | 54±0,8 | 100 | 69 | 31 | 14 | 14 | 11 |
| CBP | Guañabens | 2010 | 185 | 23 | 56 (28-79) | 100 | 82 | 32 | 21 | 11 | 12 |
| CBP | Springer | 2000 | 72 | 11 | 55 (34-81) | 100 | 68 | 24 | |||
| CEP | Angulo | 2011 | 237 | 54 | 45±0,8 | 42 | 40 | 15 | 6 | ||
| Promedio | 49 | 54 | 91 | 66 | 30 | 15 | 14 | 11 | |||
CBP: cirrosis biliar primaria; CEP: colangitis esclerosante primaria; ND: no realizado; NR: no reportado.
La prevalencia de osteoporosis en otras enfermedades hepáticas ha sido menos estudiada. Un 25-34% de pacientes con hemocromatosis desarrollan una osteoporosis8–11. Así, un estudio reciente que incluía 87 pacientes (80% varones) con hemocromatosis evidenció que una cuarta parte de ellos tenían una osteoporosis y un 40% tenían osteopenia, incluso aquellos pacientes sin cirrosis o hipogonadismo.
La prevalencia de fracturas en pacientes con enfermedad hepática crónica oscila entre el 7 y el 35%5,6. Las fracturas son más frecuentes en las mujeres posmenopáusicas y en los pacientes tratados con glucocorticoides12. En las mujeres con CBP, el riesgo de fractura vertebral es superior cuando hay una osteoporosis o una osteopenia con un valor de la escala T inferior a −1,55. La clara correlación entre el desarrollo de fractura vertebral y un valor en la escala T inferior a −1,5, en columna lumbar o en cuello de fémur, es un criterio útil para identificar aquellas pacientes con un mayor riesgo de fractura.
Más de un tercio de los pacientes con enfermedad hepática en fase terminal, antes del trasplante, tienen osteoporosis13,14. Por otra parte, en un estudio realizado en nuestro medio hace más de 10 años, la mayoría de los pacientes con trasplante hepático tenían una rápida pérdida de masa ósea en los primeros 6 meses después del trasplante, que llegaba a ser del 6% en la columna lumbar a los 3 meses15. Esta pérdida rápida de masa ósea se asociaba a una incidencia de fracturas entre el 25 y el 35% en el primer año después del trasplante, siendo más frecuente en aquellos pacientes que habían desarrollado fracturas antes del trasplante16. Probablemente esta incidencia de fracturas sea menor en los últimos años17, en relación con la mejoría de los regímenes inmunosupresores.
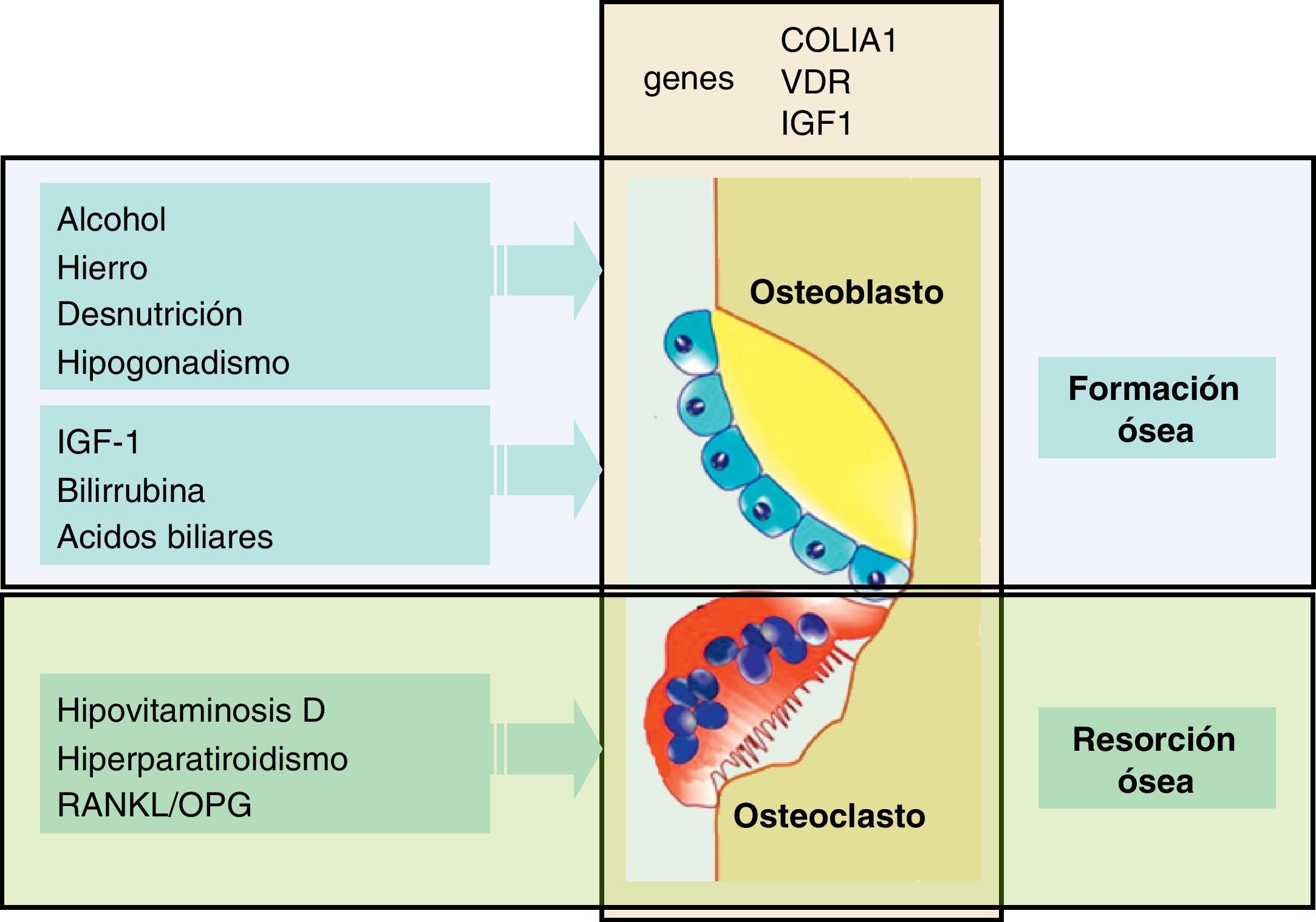
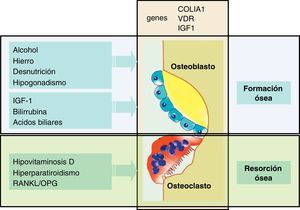
Patogenia de la osteoporosisPara comprender la patogenia de la osteoporosis es conveniente recordar que el hueso es un tejido dinámico con una resorción y formación periódica y continuada2. Así, el nivel de masa ósea depende del balance entre estos 2 procesos opuestos: la resorción ósea, realizada por los osteoclastos y la formación ósea, inducida por los osteoblastos (fig. 2). Como consecuencia, si la resorción excede a la formación hay un balance negativo, que se traduce en una pérdida de masa ósea, y por tanto, favorece la osteoporosis.
El conocimiento de la patogenia de la osteoporosis en las enfermedades hepáticas crónicas se ha centrado, en gran medida, en el estudio de pacientes con CBP y de receptores de trasplante hepático, y ha sido menos analizado en otras enfermedades hepáticas como la de etiología viral o en la hepatopatía alcohólica. A pesar de estas limitaciones, la mayoría de estudios indicarían que hay una disminución de la función osteoblástica (formación ósea) y un cierto aumento de la actividad osteoclástica, de resorción ósea. En este sentido se ha observado un deterioro de la función osteoblástica, en estudios histomorfométricos de biopsias óseas de pacientes con CBP18,19, hecho que se ha confirmado en un estudio más reciente en pacientes con colestasis crónica antes del trasplante20. Estos datos morfométricos de disminución de la formación ósea son concordantes con los estudios que muestran unos bajos valores séricos de osteocalcina21, una proteína que es un buen marcador de la función osteoblástica. Esta disfunción osteoblástica puede relacionarse con la disminución de factores tróficos como el factor de crecimiento semejante a la insulina (IGF-1) o de la acción nociva de sustancias retenidas en la colestasis, como la bilirrubina y los ácidos biliares. Así, se ha descrito que los valores séricos de IGF-1 están disminuidos en pacientes con cirrosis22, y por otra parte datos experimentales indican que la administración de IGF-1 aumenta la masa ósea y la DMO en ratas cirróticas23. Además, otras alteraciones como el aumento de producción de una isoforma de fibronectina con un dominio oncofetal en los pacientes hepatópatas podría contribuir a una menor formación ósea24.
Se ha involucrado al aumento de la bilirrubina y de los ácidos biliares, como consecuencia de la colestasis o de la propia enfermedad hepática, en la disminución de la formación ósea. Así, se ha observado, en estudios in vitro realizados en cultivos de osteoblastos, que la bilirrubina no conjugada tiene una acción nociva sobre la viabilidad y proliferación celular25. En un estudio publicado recientemente, utilizando cultivos primarios de osteoblastos humanos se ha observado que la bilirrubina no solo disminuye la viabilidad de estas células, sino que también tiene una acción nociva sobre la diferenciación y mineralización26. La presencia de 50μM de bilirrubina en el medio de cultivo disminuyó claramente la diferenciación osteoblástica, y la mineralización evaluada en la línea celular osteoblástica SAOS-2. Además se observó que la acción perjudicial de la bilirrubina sobre estas líneas de osteoblastos también ocurría en los experimentos realizados con suero de pacientes ictéricos. En este sentido, la bilirrubina y el suero de pacientes ictéricos tienen un efecto significativo sobre algunos genes implicados en la diferenciación osteoblástica. Así, se ha observado en los mismos modelos experimentales, que la adición de bilirrubina no conjugada al medio de cultivo reduce la expresión del RUNX2, un importante factor de transcripción implicado en la diferenciación celular, y además se observó una cierta acción negativa sobre este gen en los experimentos realizados con suero de pacientes ictéricos.
La acción nociva de la bilirrubina sobre el hueso se ha cuestionado a raíz de algunos estudios clínicos realizados en individuos con síndrome de Gilbert, con un aumento continuado de bilirrubina no conjugada, en quienes se evaluó la asociación de la hiperbilirrubinemia y la masa ósea medida mediante densitometría. Mientras que algunos estudios no han hallado ninguna asociación27, el más reciente ha observado una correlación inversa entre los valores de bilirrubina no conjugada y DMO en 17 sujetos con síndrome de Gilbert, lo cual apoyaría este efecto negativo de la bilirrubina sobre la masa ósea28. Otros estudios experimentales en ratas Gunn, que son hiperbilirrubinémicas, han sido incapaces de demostrar la acción lesiva de la bilirrubina ya que tanto la masa ósea como los valores de osteocalcina fueron similares en estas ratas y en las controles sin esta alteración. El efecto nocivo de la bilirrubina debe, sin embargo, evaluarse dentro de un contexto global de enfermedad hepática, ya que en estos casos no solo hay un aumento de la bilirrubina, sino toda una sucesión de cambios en otros mecanismos relacionados con la colestasis tales como el aumento de ácidos biliares, así como de citocinas inflamatorias y del estado del metabolismo fosfocálcico, incluida vitamina D y hormona paratiroidea (PTH).
Algunos ácidos biliares, que están aumentados en la colestasis y en las enfermedades hepáticas avanzadas, también tienen un efecto nocivo sobre los osteoblastos humanos, no solo en relación con su viabilidad, sino también a través del receptor de la vitamina D (VDR). Así, el ácido litocólico (LCA), al igual que la vitamina D es un agonista del VDR29. La presencia de 100μM de LCA en el medio de cultivo disminuyó la viabilidad de los osteoblastos, y este efecto se atenuó dependiendo de la presencia de suero fetal bovino en el medio, pero especialmente de una mayor concentración de albúmina. Este aspecto sustentaría que al haber mayor cantidad de albúmina en el medio, esta quelaría al ácido biliar y en consecuencia disminuiría su potencial lesivo, ya que la albúmina tiene una elevada afinidad para los ácidos biliares. Otro aspecto notable es el hecho de que el LCA tiene la capacidad de modular la acción de la vitamina D sobre los genes dependientes del receptor de esta vitamina, debido a su capacidad agonista sobre el VDR. En los experimentos realizados con concentraciones de LCA que no afectaban la viabilidad celular, se observó como este ácido biliar disminuyó la expresión del gen de la enzima 24-hidroxilasa (CYP24A1), que está implicada en el catabolismo de la vitamina D, y de otros genes como el de la osteocalcina, íntimamente relacionado con la formación ósea. De hecho, 10μM de LCA disminuyó la capacidad de la vitamina D para activar a estos genes de una forma muy significativa. Si estos resultados experimentales se trasladan a la situación clínica se puede especular que el aumento del ácido litocólico como consecuencia de la colestasis, interferiría con la vitamina D a nivel de su receptor y disminuiría la expresión de genes ligados con la formación ósea. Así se podrían explicar algunos de los fenónemos observados en pacientes con colestasis avanzada o con enfermedad hepática terminal, en quienes se ha descrito una disminución de la formación ósea. Así mismo, estos efectos lesivos serían más pronunciados en los pacientes con una grave insuficiencia hepática y con hipoalbuminemia.
Por otra parte, se ha observado una reducción de la formación ósea en los pacientes alcohólicos, con bajos niveles séricos de osteocalcina cuando el consumo de alcohol es elevado30, que se normalizan con la abstinencia. Los depósitos de hierro en la hemocromatosis también pueden ser responsables de una baja formación ósea, debido a la lesión directa que producen los efectos del hierro en la actividad de los osteoblastos31.
Como se ha indicado previamente, en algunos estudios se ha descrito un aumento de la resorción ósea en ciertos períodos evolutivos de la enfermedad ósea asociada a la hepatopatía. Así, por ejemplo, se ha descrito un aumento de la resorción como una característica temprana de la enfermedad ósea en la CBP, incluso en ausencia de osteoporosis32. Además, Guichelar et al. hallaron una resorción ósea aumentada en pacientes con enfermedad colestásica terminal20,33. En este sentido, la bilirrubina y el suero de pacientes ictéricos también aumentan la expresión de genes relacionados con la resorción ósea26.
Entre los mecanismos responsables de la pérdida de masa ósea y de la alteración del remodelado óseo cabe destacar la contribución de un déficit de calcio y de vitamina D, más o menos intenso, que puede conducir a un hiperparatiroidismo secundario34. Por otro lado, la participación de la osteoprotegerina (OPG), una proteína que inhibe la proliferación y maduración de los osteoclastos, a través de la vía OPG/RANKL/RANK, podría contribuir al aumento de la resorción ósea. El sistema OPG/RANKL es clave en la osteoclastogénesis mediada por los osteoblastos, ya que tanto la OPG como el RANKL se sintetizan en los osteoblastos y sus precursores, pero actúan sobre los osteoclastos, modulando la resorción ósea. Los osteoblastos sintetizan el ligando del receptor activador del factor nuclear NK-beta (RANKL) que actúa sobre las células hematopoyéticas, y que activa la diferenciación de los osteoclastos5. Asimismo, los osteoblastos sintetizan OPG que por su parte bloquea al RANKL. Los datos sobre este sistema en las enfermedades hepáticas y particularmente en la CBP son poco claros. La OPG no está reducida, sino al contrario, sus valores están aumentados en esta enfermedad colestásica, y además los niveles circulantes no están relacionados con la osteoporosis35,36. En los experimentos con osteoblastos se ha observado que el suero de pacientes ictéricos añadido al medio de cultivo es capaz de activar los genes implicados en la osteoclastogénesis derivados de los osteoblastos. Así, el suero de pacientes ictéricos aumenta la expresión del gen de RANKL y disminuye el gen de OPG, lo cual da lugar a un aumento del cociente RANKL/OPG26. Si estos resultados se trasladasen a un paciente concreto podrían explicar en parte el aumento de la resorción ósea que se observa en la colestasis crónica, y que hasta el momento se habían atribuido a un cierto hiperparatiroidismo secundario a hipovitaminosis D.
En la patogenia de las osteoporosis asociada a las enfermedades hepáticas debe asimismo tenerse en cuenta la participación de otros factores. Recientemente, se ha señalado un papel de las citocinas proinflamatorias en la patogenia de la pérdida de masa ósea en las enfermedades crónicas del hígado37. Así, se ha demostrado en la cirrosis de etiología viral que las concentraciones séricas del receptor p55 del factor de necrosis tumoral (sTNFR-55) son significativamente superiores en pacientes con osteoporosis y se correlacionan inversamente con la DMO38.
Otros procesos como el hipogonadismo y la mala alimentación pueden ser factores que contribuyan al cuadro completo de la enfermedad ósea en estos pacientes. En este sentido, el hipogonadismo es frecuente en la hemocromatosis10, en la cirrosis y en la enfermedad hepática alcohólica39. Por último, también se ha considerado el déficit de vitamina K como un factor adicional en la patogenia de la osteoporosis en la enfermedad hepática, ya que la vitamina K interviene en la carboxilación de los residuos glutamil de la osteocalcina40.
También se ha evaluado la susceptibilidad genética de la osteoporosis en las enfermedades hepáticas y en particular de la CBP, con unas conclusiones inciertas41. Los resultados sobre la predisposición genética para osteoporosis determinada por polimorfismos del gen del receptor de la vitamina D son controvertidos42,43. Un estudio en 72 mujeres canadienses con CBP llegó a la conclusión de que el genotipo VDR es un predictor independiente de disminución de la masa ósea en esta enfermedad, mientras que otros 2 estudios (uno húngaro y otro español) no encontraron esta asociación43,44. Por otra parte, tampoco se ha hallado una clara relación entre el polimorfismo del gen de la cadena alfa-1 del colágeno tipo I y desarrollo de osteoporosis en esta enfermedad colestásica, aunque se ha asociado con un menor pico (nivel máximo) de masa ósea en estos pacientes43. En conjunto, se puede considerar que los polimorfismos genéticos parecen no influir o tener un efecto muy escaso en el desarrollo de la osteoporosis en estos pacientes.
Evaluación de la osteoporosisSe deben considerar los factores de riesgo de osteoporosis en los pacientes con enfermedad hepática crónica, teniendo en cuenta los factores de riesgo generales para la población y los específicos de los pacientes con una hepatopatía. Considerando estos aspectos, los principales factores de riesgo a valorar son: la edad avanzada, el consumo crónico de alcohol, el tabaquismo, un índice de masa corporal inferior a 19kg/m2, el antecedente de fractura personal y en familiares de primer grado, el hipogonadismo en varones, la menopausia precoz, la amenorrea secundaria de más de 6 meses y el tratamiento con glucocorticoides (dosis de 5mg/día de prednisona o superior, durante más de 3 meses)45.
Las indicaciones de la densitometría ósea en pacientes con enfermedad hepática crónica no están completamente establecidas, aunque hay consenso en que la DMO debe ser evaluada en pacientes con fracturas previas por fragilidad, con exposición a glucocorticoides y antes del trasplante hepático4,6,46. Además, es conveniente la medición de la DMO en pacientes con colestasis crónica, especialmente si coexisten alguno de los factores de riesgo previamente descritos, y si el paciente tiene una cirrosis o ha recibido recientemente un trasplante hepático (tabla 2). Para analizar la evolución de la DMO tampoco hay normas establecidas. Si hay situaciones clínicas asociadas con una pérdida rápida de masa ósea, como en los pacientes con colestasis intensa, en los trasplantados y en los pacientes en los que se ha iniciado tratamiento con glucocorticoides, es recomendable que se repita la densitometría ósea en el intervalo de un año. En otras situaciones, sería recomendable un seguimiento con densitometría cada 2 o 3 años.
Recomendaciones para la determinación de la densidad mineral ósea
| • Antecedentes de fracturas por fragilidad |
| • Tratamiento con corticoides (> 3 meses;>5mg/día de prednisona) |
| • Colestasis crónica |
| • Factores mayores de riesgo de osteoporosis, especialmente en las colestasis crónica y si hay cirrosisa |
| • Alcoholismo crónico |
| • Hemocromatosis |
| • Antes y después de trasplante hepático |
En la evaluación de la osteoporosis en los enfermos con una enfermedad hepática crónica, se recomienda la realización de una radiografía de columna dorsal y lumbar en proyección lateral para identificar fracturas vertebrales5. Además, en todos los pacientes se deberán determinar los niveles circulantes de calcio (ajustado por la albúmina) y de fósforo, de 25-hidroxivitamina D y de PTH. En casos particulares, se deberán descartar alteraciones de la función tiroidea y gonadal. Los marcadores bioquímicos del recambio óseo serán útiles en la evaluación de la respuesta al tratamiento para la osteoporosis. La indicación de biopsia ósea transilíaca, sin descalcificación del espécimen, es adecuada solo si se sospecha un defecto marcado de mineralización, es decir, una osteomalacia.
Es importante considerar que en los pacientes con una enfermedad hepática avanzada puede haber artefactos en las mediciones de la DMO y en los valores de los marcadores óseos, por lo que estas pruebas pueden ser inexactas. Así, la DMO de columna lumbar medida por DXA en pacientes con ascitis importante, superior a 4 l, puede estar falsamente reducida45. Por otro lado, los marcadores óseos relacionados con el colágeno tipo 1 no reflejan con exactitud el grado de remodelado óseo en la CBP, ya que pueden estar influidos por el metabolismo hepático de colágeno21.
Prevención y tratamiento de la osteoporosisModificación de los factores de riesgo y medidas de apoyo para la salud óseaLos factores que contribuyen a la pérdida ósea se deben reducir a un mínimo. Así, es recomendable suspender el consumo de alcohol y de tabaco, y ajustar la dosis de glucocorticoides al mínimo necesario. Se debe recomendar la actividad física tanto como sea posible, sobre todo con ejercicios dirigidos a mejorar la mecánica de la columna vertebral. Además, es aconsejable una dieta equilibrada, ya que los pacientes con enfermedad hepática avanzada con frecuencia tienen poco apetito y están desnutridos.
Se recomendarán suplementos de calcio (1.000-1.500mg/día) y vitamina D (400-800 U/día o 266μg de calcifediol cada 2 semanas) o la dosis necesaria para mantener valores normales de 25-hidroxivitamina D. Se debe tener un especial cuidado con los pacientes que reciben resinas, como la colestiramina, ya que su administración puede reducir la absorción intestinal de vitamina D4,5. A pesar de la recomendación de suplementos de calcio y vitamina D, no hay datos que confirmen la eficacia de estos suplementos en la prevención de la pérdida ósea en pacientes con enfermedad hepática.
Tratamientos específicosSe han propuesto diferentes fármacos para el tratamiento de la osteoporosis en los pacientes con enfermedad hepática crónica, pero la mayoría de los estudios han incluido un número reducido de pacientes, por lo que es difícil llegar a conclusiones definitivas, particularmente en la reducción de fracturas por fragilidad. Tampoco hay acuerdo sobre el momento adecuado para iniciar el tratamiento. Sin embargo, se está de acuerdo en que los pacientes con osteoporosis establecida y, por lo tanto, con fracturas por fragilidad, deben ser tratados para reducir el riesgo de futuras fracturas. Teniendo en cuenta que los pacientes con una escala T lumbar o en cuello de fémur inferior a −1,5 tienen un alto riesgo de fractura vertebral, parece razonable considerar el tratamiento en pacientes con colestasis crónica cuando la DMO está por debajo de este umbral5, sobre todo si tienen factores de riesgo adicionales para osteoporosis. Del mismo modo, es adecuado el tratamiento antes del trasplante hepático si el paciente tiene una osteoporosis y es razonable tratar a todos los pacientes inmediatamente después del trasplante de hígado, ya que es imposible identificar con certeza aquellos que van a desarrollar fracturas especialmente en el primer año.
BisfosfonatosLos bisfosfonatos son fármacos anticatabólicos o antirresortivos que aumentan la masa ósea y reducen la incidencia de fracturas en la osteoporosis posmenopáusica. Sus efectos en los pacientes con enfermedad hepática no están totalmente definidos, básicamente por el escaso número de estudios y el escaso número de pacientes tratados47–54. Sin embargo, se ha demostrado que la administración cíclica de etidronato es capaz de prevenir la pérdida ósea después de 2 años de tratamiento y que el alendronato aumenta la masa ósea en pacientes con CBP, con una magnitud comparable a la observada en la osteoporosis secundaria a otras causas50. Así, un ensayo controlado con placebo de alendronato (70mg/semana) en pacientes con CBP mostró que el alendronato es capaz de aumentar la masa ósea al año de tratamiento, con un buen perfil de seguridad51,52. Los resultados preliminares de la comparación de alendronato 70mg semanal con ibandronato 150mg mensual, en pacientes con CBP con osteoporosis o baja masa ósea y fracturas por fragilidad, mostraron que ambos fármacos tienen efectos similares sobre la DMO, pero la adherencia al tratamiento fue superior con ibandronato mensual, sin efectos adversos en las pruebas de función hepática ni en el tubo digestivo alto.
El pamidronato, administrado por vía parenteral, se ha evaluado en pacientes con enfermedad hepática en fase terminal y después del trasplante hepático55–57. Hay resultados contradictorios respecto a su eficacia en la prevención de la pérdida de masa ósea y son muy escasos los ensayos que aportan datos sobre su efecto en la reducción del riesgo de fractura. Un estudio multicéntrico controlado con placebo, realizado en España y que incluía 79 pacientes trasplantados hepáticos, mostró que 90mg de pamidronato administrado en las primeras 2 semanas y 3 meses después del trasplante, mantiene la DMO lumbar durante el primer año, sin efectos adversos significativos. Sin embargo, el tratamiento con pamidronato no se asoció a una reducción de la pérdida ósea en cuello femoral ni de la incidencia de fracturas57.
También se han evaluado el alendronato, el risedronato y el ácido zoledrónico en pacientes con trasplante hepático. En un ensayo aleatorizado, el alendronato (70mg/semana), asociado a calcio y vitamina D (0,5μg de calcitriol), aumentó significativamente la DMO a los 2 años del trasplante hepático, cuando se comparó con calcio y calcitriol. Además, el alendronato fue bien tolerado, pero no mostró una reducción de las fracturas incidentes54. Otro estudio con alendronato semanal también mostró que el alendronato previene la pérdida ósea asociada al trasplante53. El tratamiento con ácido zoledrónico merece una especial atención. Así, la administración parenteral de ácido zoledrónico (4mg) dentro de la primera semana y a 1, 3, 6 y 9 meses después del trasplante, se asoció a un aumento de la DMO, pero no mostró una reducción del riesgo de fractura. Como efecto adverso, destacó el desarrollo de frecuentes episodios de hipocalcemia tras la infusión58. Otro estudio con 8 dosis de ácido zoledrónico (4mg) administradas en el primer año después del trasplante hepático, mostró que los pacientes tratados habían reducido el recambio óseo y lo más importante, el número de fracturas era significativamente inferior al del grupo tratado únicamente con calcio y vitamina D59.
Terapia hormonalHay poca información sobre el tratamiento hormonal en pacientes con enfermedad hepática avanzada. Los escasos ensayos con estrógenos transdérmicos en pacientes con CBP o con cirrosis de etiología autoinmune muestran que la terapia hormonal previene la pérdida ósea o incluso aumenta la DMO, sin efectos adversos sobre la enfermedad hepática. En varones con hemocromatosis e hipogonadismo, el tratamiento con testosterona asociado a sangrías también fue eficaz para aumentar la masa ósea60. Sin embargo, dados los conocidos efectos adversos de la terapia hormonal, se deben valorar los beneficios pero también los riesgos, especialmente cuando existen tratamientos alternativos para la osteoporosis del paciente con enfermedad hepática.
Otros tratamientosLa seguridad y eficacia de raloxifeno, un modulador selectivo de los receptores estrogénicos, ha sido evaluada solo en 9 mujeres posmenopáusicas con CBP61. Pero lo más importante, no existen estudios que evalúen la eficacia y seguridad en la osteoporosis de los pacientes con enfermedad hepática, de fármacos frecuentemente utilizados o novedosos en el tratamiento de la osteoporosis posmenopáusica, como son los fármacos anabólicos teriparatida (rhPTH [1-34]) o PTH (1,84), el ranelato de estroncio o el denosumab. Un estudio experimental evaluó la administración intermitente de hormona paratiroidea (hPTH [1-34]) en ratas con ligadura de los conductos biliares, mostrando que este fármaco restaura la DMO y el grosor de las trabéculas óseas. Por ello, la hPTH (1-34) podría, en teoría, ser un fármaco eficaz para la osteoporosis en pacientes con colestasis crónica62.
Conclusiones y perspectivasLa osteoporosis es una complicación frecuente en la enfermedad hepática crónica, especialmente en las etapas finales de la enfermedad, y en los casos de colestasis crónica, en la hemocromatosis y en el abuso de alcohol. El problema es más crítico en los pacientes trasplantados, cuando la pérdida ósea se acelera durante el período inmediatamente después de la cirugía. El principal mecanismo implicado en el desarrollo de osteoporosis en los hepatópatas crónicos es el déficit de la formación ósea, por el efecto nocivo de las sustancias retenidas en la colestasis, como la bilirrubina y los ácidos biliares, o bien, por el efecto tóxico del alcohol o el hierro sobre los osteoblastos.
Para la prevención y el tratamiento de la osteoporosis es recomendable una buena nutrición y la administración de suplementos de calcio y vitamina D. En la actualidad no hay pautas concretas en su tratamiento farmacológico, pero se ha demostrado que los bisfosfonatos, especialmente el alendronato y el ibandronato, son eficaces para aumentar la masa ósea en pacientes con colestasis crónica, con un buen perfil de seguridad. La eficacia de los bisfosfonatos en los pacientes tras el trasplante hepático está pendiente de confirmación. En este contexto, el alendronato y el ácido zoledrónico han mostrado ser eficaces en la prevención de la pérdida ósea. La administración parenteral del ácido zoledrónico aporta ventajas adicionales en estos pacientes. La eficacia de estos fármacos en la reducción de fracturas no ha sido suficientemente demostrada, fundamentalmente por el escaso número de pacientes incluidos en los estudios. El desarrollo de ensayos más amplios con bisfosfonatos y la evaluación de nuevos fármacos para la osteoporosis pueden cambiar su futuro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.