La enfermedad celíaca se produce por la ingesta de gluten en niños y adultos genéticamente susceptibles, y es la intolerancia alimentaria grave más común en los países occidentales. La eliminación del gluten presente en la dieta es obligatoria en estos pacientes, ya que la mayoría de las complicaciones que pueden presentarse son más frecuentes en caso de incumplir el tratamiento.
El desarrollo de neoplasias constituye la complicación más grave de la celiaquía (el más frecuente es el linfoma de células T asociado a enteropatía), pero se han descrito otras, como la yeyunoileítis ulcerativa, y manifestaciones extrain-testinales, como la hepatitis crónica, la enfermedad pulmonar fibrosante, el síndromes de epilepsia, etc. Presentamos el caso de un varón de 53 años de edad con síndrome diarreico de muy larga evolución, en el que no se sospechó una enfermedad celíaca y se complicó con un linfoma intestinal de células T asociado a enteropatía y una paniculitis mesentérica.
Celiac disease is the most common severe food intolerance in the Western world and is due to gluten ingestion in genetically susceptible children and adults. The key treatment in these patients is a gluten-free diet, because most complications are more common when dietary compliance is poor. The most serious complication of celiac disease is the development of neoplasms (the most common of which is entero-pathy-associated T-cell lymphoma). However, a number of reports have indicated an increased prevalence of ulcerative jejunitis and extraintestinal manifestations, including chro-nic hepatitis, fibrosing lung disease, and epilepsy syndromes.
We report the case of a 53-year-old-man with long-standing diarrhea; because celiac disease was not suspected, the patient developed celiac-associated T-cell lymphoma and me-senteric panniculitis.
La enfermedad celíaca se define por la presencia de malabsorción intestinal de nutrientes secundaria a una inflamación crónica de la mucosa del intestino delgado proximal, que puede progresar hacia una atrofia vellositaria después de la ingesta del gluten o proteínas relacionadas derivadas de cereales, como el trigo, el centeno y la cebada1.
Aunque muchos pacientes están asintomáticos o tienen síntomas leves, lo que puede subestimar su prevalencia, se calcula que la prevalencia de esta enfermedad en la mayor parte de Europa es de alrededor de 1:1.0002, e incluso estudios más recientes realizados en niños muestran una prevalencia en torno al 1%3.
El diagnóstico se basa en la clínica del paciente, los marcadores serológicos de enfermedad celíaca4, el estudio del genotipo HLA (haplotipos HLA-DQ2 y DQ8), en los hallazgos característicos de la biopsia del intestino delgado y ante la mejoría al realizar una dieta libre de gluten; no obstante, la mayoría de pacientes celíacos permanecen sin diagnosticar, porque tienen pocos o ningún síntoma, pero en ocasiones también debido a un bajo grado de sospecha clínica5.
El problema que ello acarrea es que la enfermedad celíaca se asocia a un pronóstico excelente si el diagnóstico se establece en una fase temprana y el paciente sigue correctamente una dieta sin gluten; en cambio, los pacientes no diagnosticados –y, por tanto, no tratados– pueden presentar complicaciones secundarias a la malabsorción, así como un mayor riesgo de neoplasias que pueden poner en peligro sus vidas6.
Presentamos el caso de un paciente de 53 años de edad, con antecedentes de historia previa de dispepsia y síndrome diarreico de larga evolución, que ingresó por un episodio de hemorragia digestiva, y se diagnosticó de un linfoma de células T asociado a enteropatía y paniculitis mesentérica sobre una enfermedad celíaca de base, que habían permanecido sin diagnóstico y, por tanto, sin tratamiento hasta la fecha.
OBSERVACIÓN CLÍNICAVarón de 53 años de edad, sin antecedentes patológicos de interés. Fue evaluado un año antes en el servicio de aparato digestivo de la zona a partir de una sintomatología dispéptica y una historia de deposiciones líquidas de años de evolución, de predominio matutino y sin productos patológicos; se había realizado una endoscopia oral, que mostró una hernia hiatal con esofagitis por reflujo grado I, y una analítica básica y un enema opaco, que resultaron normales.
Ingresa en el año 2002 por presentar un cuadro de 24 h de evolución de deposiciones mezcladas con sangre roja, precedidas de dolor abdominal cólico e hipogástrico, que se acompañaron de sensación de mareo y sudoración profusa, aunque no llegó a perder la conciencia. La exploración a su ingreso revela una palidez mucocutánea, una presión arterial de 100/70 mmHg y una frecuencia cardíaca de 90 lat/min; el resto de exploración no reveló hallazgos patológicos, salvo la constatación de sangre de color achocolatado al tacto rectal. Entre los resultados de los exámenes complementarios, cabe destacar en el hemograma 11.700 leucocitos/ μl; hemoglobina de 8,5 g/dl (volumen corpuscular medio de 77,8 fl) y 349.000 plaquetas. La cifra de urea era de 61 mg/dl. Los valores de glucemia, creatinina, sodio, potasio, estudio de coagulación, gasometría venosa, amilasemia, sedimento urinario, bioquímica hepática y proteinograma estaban dentro de la normalidad. El colesterol total era de 211 mg/dl y los triglicéridos de 68 mg/dl. Los resultados de la radiografía simple de tórax y de abdomen fueron normales.
En la endoscopia oral no se observaron restos hemáticos ni lesiones potencialmente sangrantes. Mediante colonoscopia se exploró la totalidad del colon sin apreciarse lesiones potencialmente sangrantes.
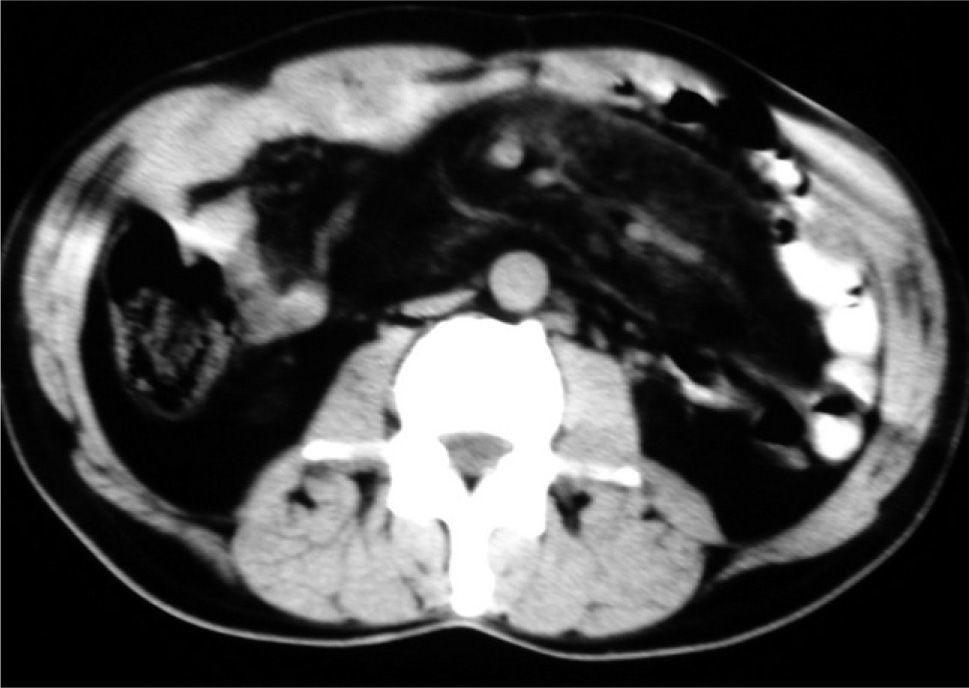
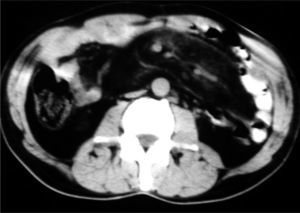
El paciente evolucionó favorablemente en las primeras 48 h, con la hemorragia controlada; para descartar lesiones en el intestino delgado, se realizó una arteriografía selectiva del tronco celíaco y los vasos mesentéricos superior e inferior, en la que no se apreciaban signos patológicos, salvo una distribución de las asas intestinales atípica por la periferia del abdomen, dejando el área central libre. Ante este hallazgo se realizó una tomografía computarizada (TC) abdominal (fig. 1), en la que llamaba la atención la separación de asas en el íleon en relación con una paniculitis mesentérica, que se manifestaba por una infiltración de la grasa mesentérica retroperitoneal adyacente a los vasos mesentéricos superiores, donde se hacen patentes múltiples formaciones nodulares, junto con un engrosamiento de la pared de las asas ileales. El tránsito intestinal (fig. 2) puso de manifiesto un desplazamiento de las asas de yeyuno e íleon con ausencia de asas en el centro del abdomen, con un estiramiento del borde mesentérico y un edema de pliegues en el íleon, compatibles con una afectación de la grasa por proceso tipo mesenteritis esclerosante.
Ante estos hallazgos, se realizó una laparotomía exploradora con enteroscopia intraoperatoria: se apreciaba un intestino delgado medio y distal con cierto grado de rigidez y nodularidad, con ulceraciones de distribución parcheada en toda su extensión. Se realizó una biopsia intraoperatoria compatible con un linfoma y, finalmente, se resecaron 3 segmentos del intestino delgado con su meso, y se realizó una anastomosis terminoterminal. El estudio histológico del mesenterio fue compatible con una paniculitis mesentérica, y el de las asas intestinales de linfoma T intestinal asociado a enteropatía con atrofia vellositaria e infiltrado inflamatorio en las zonas no afectadas por el linfoma, compatibles con una enfermedad celíaca (estudio inmunohistoquímico CD45+++, CD20–, CD3++, CD8++).
El paciente recibió 6 ciclos de quimioterapia citostática CHOP durante 5 meses, y en la actualidad se encuentra asintomático por completo, sin signos de enfermedad neoplásica activa y siguiendo correctamente una dieta sin gluten.
DISCUSIÓNLa enfermedad celíaca es un proceso de base autoinmune que afecta al intestino delgado y se desencadena por la ingesta de gluten y otras proteínas relacionadas presentes en el trigo, el centeno y la cebada.
Algunos estudios previos han confirmado un riesgo aumentado de aparición de tumores asociados a la celiaquía, como el carcinoma faríngeo y esofágico o el adenocarcinoma de intestino delgado6, que suelen aparecer en pacientes diagnosticados en la edad adulta; no obstante, el linfoma intestinal es la neoplasia asociada con más frecuencia, a pesar de lo cual afortunadamente se considera una rara complicación7.
El estudio de los genes de HLA demuestra que los pacientes celíacos con linfoma T intestinal asociado a enteropatía suelen presentar los antígenos DQA1*0501 y DQB1*0201, aunque otros alelos de clase HLA-DR/DQ también pueden ser factores de riesgo para el desarrollo de linfoma5. Además, se ha constatado que los pacientes con esprue refractario, portadores de un fenotipo aberrante de linfocitos intraepiteliales, CD3+/CD8–, presentan un pronóstico desfavorable, incluido un mayor riesgo de aparición de linfoma7,8. Así, en un amplio estudio, que incluyó a 93 pacientes con esprue refractario, se constata que entre los 43 con fenotipo CD3+/CD8+ la mortalidad es nula, con buena respuesta clínica al tratamiento con prednisona, azatioprina y dieta sin gluten, frente a 50 pacientes con fenotipo CD3+/CD8–, donde la mitad desarrolla un linfoma de células T a los 4-6 años de seguimiento, con una mortalidad a los 5 años del 56%9; el fenotipo de linfocitos de nuestro paciente fue CD3+/CD8+; a pesar de ello, desarrolló un linfoma, lo cual, aunque está descrito, constituye una rareza9.
Al margen de estas consideraciones, está demostrado que en los pacientes celíacos la instauración de la dieta sin gluten puede prevenir muchas enfermedades autoinmunes y el desarrollo de tumores (incluido el linfoma), además de mejorar notablemente su calidad de vida10. Diversos estudios epidemiológicos demuestran que en la población general el número de pacientes no diagnosticados puede ser hasta 10 veces superior al de los diagnosticados11; por tanto, se debe descartar una enfermedad celíaca en pacientes con anemia ferropénica refractaria al tratamiento oral con preparados de hierro, osteoporosis, retraso del crecimiento, infertilidad, historia familiar, procesos autoinmunes, elevación de transaminasas y, por supuesto, en los que tengan un síndrome diarreico crónico, aunque no presenten pérdida de peso12, como en este caso, donde tal vez un diagnóstico más temprano de la enfermedad con la exclusión del gluten de la dieta podría haber prevenido el desarrollo de complicaciones que se presentaron con posterioridad.
El linfoma de células T asociado a enteropatía a menudo suele ser multifocal, con lesiones ulcerativas, lo que explica el elevado porcentaje de presentación clínica en forma de hemorragia o perforación, o bien el desarrollo de estas complicaciones durante el tratamiento con quimioterapia13. No hay un tratamiento satisfactorio para este tipo de linfomas y, a pesar de la quimioterapia, el pronóstico resulta ominoso, con una supervivencia a los 5 años en torno al 10%9; en nuestro caso, en cambio, la respuesta al tratamiento quimioterápico fue excelente, y el paciente se encuentra asintomático 5 años después, siguiendo correctamente una dieta sin gluten.
Por tanto, hasta que se disponga de tratamientos eficaces para este tipo de neoplasias, un estricto seguimiento de la dieta sin gluten parece ser la única posibilidad de prevención, la cual debe iniciarse lo más precozmente posible; varios estudios de seguimiento han demostrado que especialmente resulta más eficaz si se instaura en los primeros años de vida14.
Otra peculiaridad de nuestro caso es que el paciente presentaba también una paniculitis mesentérica, que se confirmó, además de por las técnicas de imagen, en el estudio histológico del mesenterio resecado. Tras realizar una búsqueda en MEDLINE empleando como motor de búsqueda PubMed y las palabras clave coeliac disease y mesenteric panniculitis, no encontramos ningún caso de asociación publicado en la literatura médica castellana.
La paniculitis mesentérica consiste en una inflamación aséptica de la grasa mesentérica, que en muchas ocasiones resulta asintomática y se presenta como hallazgo incidental en un estudio mediante ecografía y TC15, como el caso descrito. Si predomina el engrosamiento fibrótico y el acortamiento del mesenterio, puede dar lugar a cuadros de obstrucción intestinal, por lo que se denomina mesenteritis retráctil16.
En un estudio realizado en 49 pacientes con paniculitis mesentérica, en 34 de ellos se asoció a enfermedad maligna (la mayoría linfomas), en 4 no se identificó ninguna enfermedad subyacente y 11 presentaban una enfermedad inflamatoria benigna coexistente, pero en ningún caso se trataba de una celiaquía17.
En caso de producir síntomas, además del tratamiento de la enfermedad de base, se pueden emplear corticoides o inmunodepresores, reservando la cirugía sólo para ciertas complicaciones, como la isquemia o la obstrucción intestinal18.
En nuestro caso, la paniculitis mesentérica no provocó manifestaciones clínicas, pero dada su asociación con linfoma, una vez más hay que recalcar que esta complicación posiblemente también había podido haberse prevenido con un diagnóstico y un tratamiento mucho más precoces de la celiaquía de base19.