Buscar puntos de corte de la glutámico-pirúvica transaminasa (GPT) y de ADN del virus de hepatitis B (ADN-VHB) al diagnóstico, en pacientes con infección crónica VHB antígeno e negativo (AgHBe(–)), que puedan ser predictores de la evolución, pronóstico y/o de la necesidad de terapia antiviral.
MétodosEstudio observacional de cohortes retrospectivo de pacientes diagnosticados de infección crónica por VHB AgHBe(–) (2005-2012). Se investigó un punto de corte de GPT normal al diagnóstico que predijera la alteración de esta en la evolución, de ADN-VHB basal que predijera la elevación de este por encima de 2.000UI/ml, y de GPT y ADN-VHB como predictores de la necesidad de tratamiento, mediante curvas ROC.
ResultadosSe incluyeron 126 pacientes (seguimiento: 42,1±21,5meses), de los cuales 93 tenían GPT normal al diagnóstico. En el análisis de curvas ROC el punto de corte de ADN-VHB que mejor predijo la elevación de este por encima de 2.000UI/ml fue 900UI/ml (sensibilidad: 90%; especificidad: 88%; VPP: 79%; VPN: 100%; precisión diagnóstica: 89%), y el que mejor predijo la alteración de GPT normal al diagnóstico posteriormente elevada fue 25mU/ml (sensibilidad: 95,4%; especificidad: 81,6%; VPP: 67%; VPN: 96%; precisión diagnóstica: 80,6%). Los pacientes con GPT 26-40mU/ml al diagnóstico presentaron más complicaciones o necesidad de tratamiento que aquellos con GPT≤25mU/ml (p<0,05). La combinación de GPT y ADN-VHB que maximizó la necesidad de tratamiento fue 38mU/ml de GPT y 6.000UI/ml de ADN-VHB (sensibilidad: 75%; especificidad: 93,4%; VVP: 60%; VPN: 96,6%).
ConclusiónLos pacientes VHB AgHBe(–) con GPT<25mU/ml y ADN-VHB<9.000UI/ml al diagnóstico presentan buena evolución y podrían no requerir un seguimiento tan estrecho en los primeros años desde el diagnóstico.
To identify glutamic pyruvic transaminase (GPT) and hepatitis B virus DNA (HBV-DNA) cut-off values at diagnosis in patients with hepatitis B virus e antigen-negative chronic infection (HBeAg(–)), which may be predictors of clinical course, prognosis and/or the need for antiviral therapy.
MethodsA retrospective and observational cohort study of patients diagnosed with HBeAg(–) chronic infection (2005-2012). A normal GPT cut-off value at diagnosis that predicts abnormal GPT values in the clinical course of the infection, a baseline HBV-DNA cut-off value that predicts an increase in HBV-DNA above 2,000IU/ml, and GPT and HBV-DNA as predictors of the need for treatment were investigated using ROC curves.
Results126 patients were enrolled (follow-up: 42.1±21.5months), 93 of which had normal GPT levels at diagnosis. In the ROC curve analysis, 900IU/ml was found to be the HBV-DNA cut-off value that best predicted this value's increase above 2,000IU/ml (sensitivity: 90%; specificity: 88%; PPV: 79%; NPV: 100%; diagnostic precision: 89%), while 25mU/ml was the normal GPT cut-off value at diagnosis that best predicted subsequently elevated GPT levels (sensitivity: 95.4%; specificity: 81.6%; PPV: 67%; NPV: 96%; diagnostic precision: 80.6%). Patients with GPT 26-40mU/ml at diagnosis presented with more complications or required more treatment than subjects with GPT≤25mU/ml (P<.05). The combined GPT and HBV-DNA values that elicited the highest treatment need were 38mU/ml of GPT and 6,000IU/ml of HBV-DNA (sensitivity: 75%; specificity: 93.4%; PPV: 60%; NPV: 96.6%).
ConclusionHBeAg(–) patients with GPT<25mU/ml and HBV-DNA<900IU/ml at diagnosis have positive outcomes and may not require such stringent follow-up in the first years after diagnosis.
La infección crónica por el virus de la hepatitis B (VHB) es un problema de salud pública a nivel mundial, estimándose que unos 350-400 millones de personas en el mundo presentan infección crónica por este virus1, y que unas 620.000 personas mueren anualmente en relación con esta infección2,3.
La infección crónica AgHBe(–) se produce tras la seroconversión del antígeno e de la hepatitis B (AgHBe), perdiendo este y apareciendo los anticuerpos anti-AgHBe durante la fase inmunorreactiva, y representa una de las fases finales de la historia natural de la infección. En el 75% de los casos, del estado inmunorreactivo AgHBe(+) se pasa al estado de portador inactivo del VHB (PI), caracterizado por una glutámico-pirúvica transaminasa (GPT) persistentemente normal, ácido desoxirribonucleico (ADN) bajo, y con poca o nula afectación histológica. En el 25% restante, la seroconversión del AgHBe da paso a la hepatitis crónica por el VHB (HBC) AgHBe(–), bien directamente, en gran parte por mutaciones que se producen en los nucleótidos de la región precore y/o del promotor del core, o secundariamente a una reactivación desde PI, donde se producen periodos de reactivación con un patrón de niveles fluctuantes de ADN del VHB (ADN-VHB), aminotransferasas, y de hepatitis activa4.
La fase de infección crónica AgHBe(–) fue descrita por primera vez en países mediterráneos5,6, estando en la actualidad descrita en todo el mundo7. Estudios recientes en Europa, Asia, y Estados Unidos describen un incremento en la prevalencia de este tipo de pacientes8-11, representando en la actualidad el 85-90% de los pacientes. En nuestra serie publicada recientemente12 representan el 87,61%, siendo similar a otros trabajos recientes publicados en nuestro país13,14, y en otras áreas del mundo15-24.
En el momento actual, en un paciente con infección crónica por VHB AgHBe(–) de reciente diagnóstico se indica la necesidad de realizar un seguimiento estrecho en los primeros meses desde el diagnóstico para asegurar el estadio evolutivo en el cual se encuentra. En los últimos años, se han publicado varios trabajos para discernir si otros puntos de corte en la normalidad de la GPT pudieran ser más adecuados para realizar una correcta clasificación de los pacientes AgHBe(–), así como para la detección de pacientes con daño histológico significativo, existiendo trabajos a favor25-32 y en contra33-38. Así, nos propusimos investigar si existían puntos de corte de GPT y ADN-VHB al diagnóstico que predijeran la alteración de estos en la evolución, observando si pueden resultar predictores de mal pronóstico y/o necesidad de tratamiento en los primeros años de seguimiento, lo que podría ayudar en el manejo de este tipo de pacientes.
Material y métodosPacientesEstudio observacional de cohortes retrospectivo de pacientes diagnosticados de infección crónica por VHB AgHBe(–) en el momento del diagnóstico desde el 1 de junio de 2005 al 1 de julio de 2011 para la inclusión de pacientes, y seguimiento hasta el 31 de diciembre de 2012.
Se incluyeron todos los pacientes mayores de 13 años, con AgHBs positivo durante más de 6 meses, con AgHBe(–) y anti-HBeAg(+), y 3 o más analíticas con GPT y ADN-VHB. Se excluyeron enfermos coinfectados por VIH, VHC y/o VHD; presencia de insuficiencia renal avanzada (definido por un aclaramiento de creatinina <30ml/min y/o diálisis), otras hepatopatías asociadas (estudio de hormonas tiroideas, de autoinmunidad, perfil férrico [gen de la hemocromatosis si 2 determinaciones de IST>45%], porfirinas en orina, alfa1-antitripsina, cupremia, cobre en orina y ceruloplasmina); también se excluyeron los pacientes con obesidad tipo 2 o superior (índice de masa corporal [IMC] ≥35kg/m2), datos de esteatohepatitis en biopsia hepática, cirrosis de causa no claramente relacionada con la infección crónica por VHB y consumo de alcohol ≥40g/día, así como aquellos que habían recibido tratamiento previo para la infección por VHB.
Se recogieron las características clínico-analíticas al diagnóstico. En la evolución se recogieron cada 6±2meses variables analíticas, serológicas, ADN-VHB por reacción en cadena de la polimerasa (PCR), y control ecográfico cada 6 meses en los pacientes cirróticos y cada uno o 2 años en no cirróticos.
Se diagnosticó de carcinoma hepatocelular (CHC) las lesiones ocupantes de espacio >1cm, en pacientes con cirrosis hepática, con al menos una prueba de imagen (tomografía y/o resonancia magnética con contraste) con comportamiento típico de CHC (captación en fase arterial y lavado en fase portal o tardía), realizando estudio histológico en los pacientes con comportamiento radiológico atípico o dudoso, y en aquellos sin cirrosis hepática.
Se consideró evento hepático desfavorable el desarrollo de cirrosis, complicaciones en relación con esta (descompensación edemoascítica [DEA], encefalopatía hepática [EH], hemorragia digestiva alta por varices esofágicas [HDA], CHC), necesidad de tratamiento o muerte en relación con la infección crónica por el VHB.
Para la determinación de la carga viral se utilizaron diferentes técnicas de PCR: de junio de 2005 a febrero de 2009, Cobas Amplicor HBV Monitor (Roche Diagnostics); de marzo a noviembre de 2009, Cobas Ampliprep/Cobas Taqman HBV test (Roche Diagnostics), y de diciembre de 2009 a diciembre de 2012, Cobas Ampliprep/Cobas Taqman HBV test versión 2.0 (Roche Diagnostics).
El estudio de fibrosis hepática se realizó por biopsia hepática (clasificación de METAVIR39) o Fibroscan®, según las indicaciones de la guía clínica vigente en cada momento. Los pacientes con bajos niveles de ADN-VHB (<2.000UI/ml), GPT persistentemente normal (<40mU/ml), sin sospecha de fibrosis (analítica, clínica ni ecográfica), se consideró que no tenían enfermedad hepática, no realizándose biopsia hepática ni Fibroscan®; realizándose dichos procedimientos a los pacientes en los que existían dudas. Para este trabajo se establecieron las siguientes categorías: biopsia hepática normal o cambios mínimos (A0-F0), cirrosis (F4) y diferentes grados de fibrosis. Si no existía biopsia hepática y sí Fibroscan® se clasificaron los distintos grados de fibrosis hepática según los valores del trabajo de Viganò et al.40, siendo: F0-1 (de 2,5 a 6,2kPa), normal; F2-3 (de 6,2 a 13,1kPa), diferentes grados de fibrosis; y F4 (>13,1kPa), cirrosis. A su vez se incluyeron como pacientes cirróticos aquellos con datos clínico-analíticos o de pruebas de imagen definitivos de cirrosis (hepatopatía crónica con hipertensión portal), en los cuales no hacía falta realizar biopsia hepática o Fibroscan® para llegar al diagnóstico. Así, precisaron estudio de fibrosis hepática 43 pacientes (46,2%), de los cuales en 21 (48,84%) se realizó biopsia hepática y en 22 (51,16%) Fibroscan®.
Se consideró el seguimiento clínico de los pacientes hasta la última revisión en consulta de hepatología. En el estudio analítico se incluyó para el estudio hasta la última analítica de seguimiento con serología para el VHB, teniendo en cuenta para dicho análisis únicamente a los pacientes con 3 o más analíticas en el seguimiento. En los pacientes que requirieron tratamiento médico para la infección crónica por el VHB (en función de las indicaciones de la guía clínica de la European Association of the Study of the Liver [EASL] vigente en cada momento) se evaluó el seguimiento clínico hasta la fecha de la consulta en que se inició este, y el analítico hasta la última analítica previa a este.
La realización del estudio fue aprobada por el Comité Ético de nuestro centro.
Análisis estadísticoSe realizó un análisis comparativo de GPT persistentemente normal (GPTPN) vs. GPT alterada en alguna ocasión (GPTNA). Para este análisis comparativo se utilizó el contraste no paramétrico U de Mann Whitney, y el contraste chi-cuadrado en caso de variables cualitativas.
Se utilizaron curvas ROC para encontrar el valor de GPT normal al diagnóstico que predijera mejor la alteración de esta en la evolución. Se obtuvo de ese punto la sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN). Una vez determinado este, se realizó un análisis comparativo del nuevo punto de corte de GPT sin tener en cuenta el sexo, frente al clásico de 30mU/ml en hombres y 19mU/ml en mujeres, utilizando las mismas pruebas que las descritas anteriormente. Se considera GPT normal baja a GPT inferior a este punto de corte dentro de la normalidad de GPT, y GPT normal alta a GPT entre este punto de corte y 39mU/ml. Se realizó un análisis evolutivo en función de estos puntos de corte, teniendo en cuenta también los factores de mal pronóstico de cada grupo en la evolución.
Se construyó un modelo de predicción de modificación de GPT de valores basales normales a valores alterados mediante un modelo logístico donde introdujimos como variable dependiente la modificación o no de este valor durante el seguimiento del paciente, y como independiente aquellas que resultaron ser significativamente diferentes en el análisis previo. Los resultados se muestran como OR y su intervalo de confianza al 95%.
Se realizó un análisis comparativo de dos puntos de corte de GPT (teniendo y sin tener en cuenta el sexo) en pacientes con GPT normal (<40mU/ml) al diagnóstico, evaluando si existen diferencias significativas en las características basales, formación de los grupos en función de la evolución de la GPT, y en los factores de mal pronóstico.
Finalmente, se realizó un análisis de curvas ROC para evaluar qué punto de ADN-VHB <2.000UI/ml al diagnóstico predice mejor la elevación de este por encima de 2.000UI/ml en la evolución, así como un punto de corte conjunto de GPT y ADN-VHB al diagnóstico que sea predictivo de la necesidad de tratamiento en la evolución.
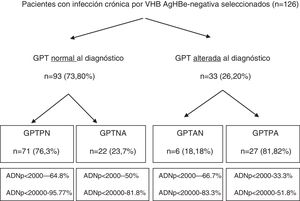
ResultadosSe detectaron 216 pacientes con AgHBs(+), cumpliendo los criterios de inclusión 126 pacientes (seguimiento medio de 42,1±21,5meses), cuyas características basales se pueden consultar en una publicación reciente de nuestro grupo41. En la figura 1 se observa el diagrama de flujo en función de la GPT al diagnóstico y en el seguimiento, y en la tabla 1 los eventos hepáticos desfavorables en función de los grupos formados según GPT.
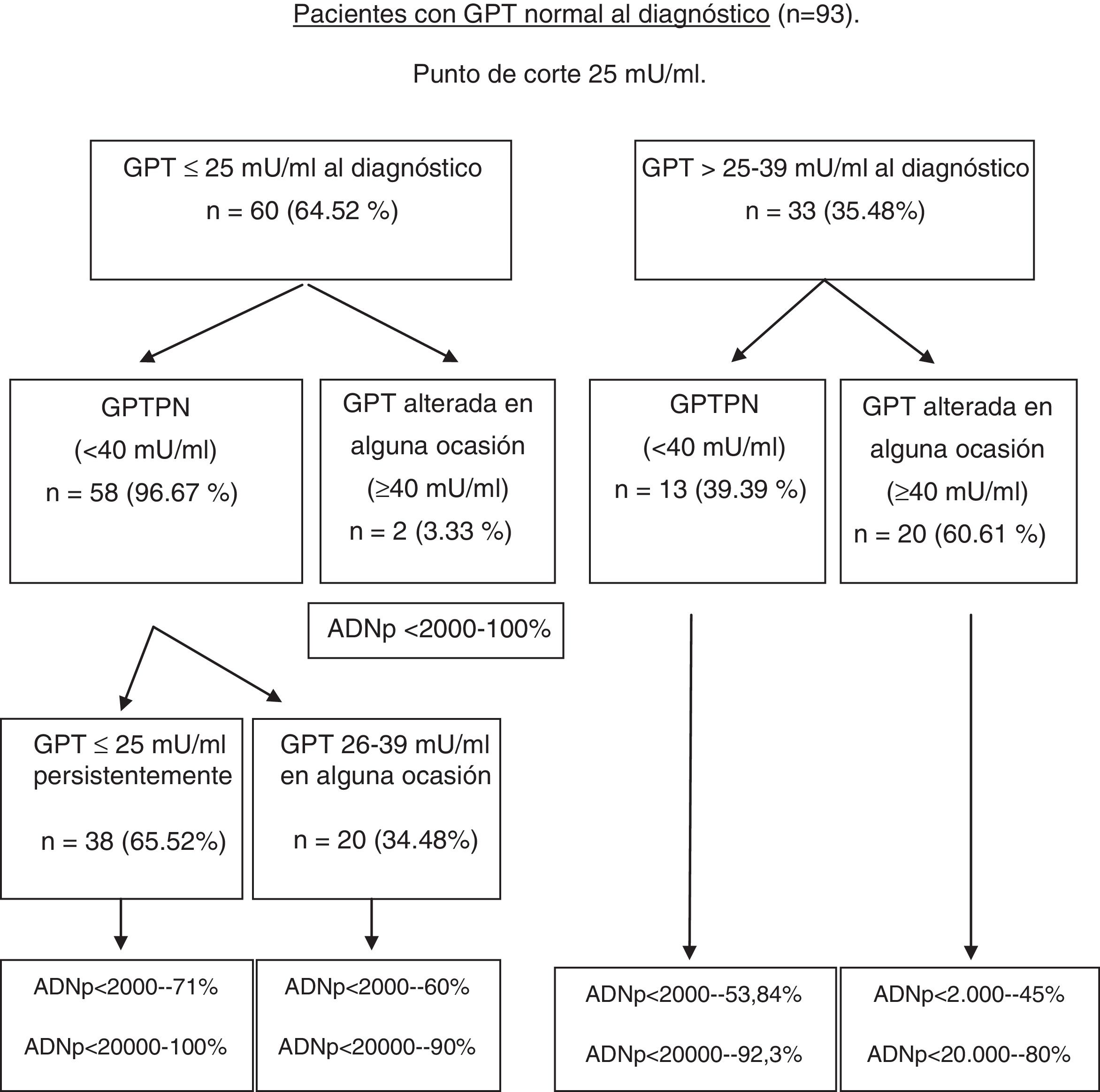
Diagrama de flujo en función de GPT normal o alterada al diagnóstico y en la evolución. Porcentaje de ADN-VHB pico alcanzado en cada grupo.
ADNp: ácido desoxirribonucleico del VHB pico; GPT: glutámico-pirúvica transaminasa; GPTAN: GPT alterada al diagnóstico normalizada en la evolución; GPTNA: GPT normal posteriormente alterada; GPTPA: GPT persistentemente alterada; GPTPN: GPT persistentemente normal.
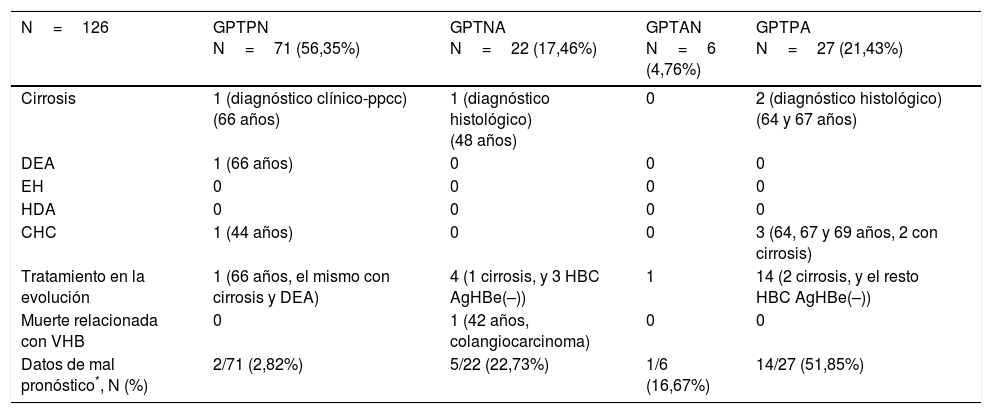
Eventos hepáticos desfavorables en función de los grupos formados con punto de corte de 40mU/ml de GPT
| N=126 | GPTPN N=71 (56,35%) | GPTNA N=22 (17,46%) | GPTAN N=6 (4,76%) | GPTPA N=27 (21,43%) |
|---|---|---|---|---|
| Cirrosis | 1 (diagnóstico clínico-ppcc) (66 años) | 1 (diagnóstico histológico) (48 años) | 0 | 2 (diagnóstico histológico) (64 y 67 años) |
| DEA | 1 (66 años) | 0 | 0 | 0 |
| EH | 0 | 0 | 0 | 0 |
| HDA | 0 | 0 | 0 | 0 |
| CHC | 1 (44 años) | 0 | 0 | 3 (64, 67 y 69 años, 2 con cirrosis) |
| Tratamiento en la evolución | 1 (66 años, el mismo con cirrosis y DEA) | 4 (1 cirrosis, y 3 HBC AgHBe(–)) | 1 | 14 (2 cirrosis, y el resto HBC AgHBe(–)) |
| Muerte relacionada con VHB | 0 | 1 (42 años, colangiocarcinoma) | 0 | 0 |
| Datos de mal pronóstico*, N (%) | 2/71 (2,82%) | 5/22 (22,73%) | 1/6 (16,67%) | 14/27 (51,85%) |
AgHBe(–): antígeno e negativo del VHB; CHC: hepatocarcinoma; DEA: descompensación edemoascítica; EH: encefalopatía hepática; GPT: glutámico-pirúvica transaminasa; GPTAN: GPT alterada al diagnóstico normalizado en la evolución; GPTNA: GPT normal posteriormente alterada; GPTPA: GPT persistentemente alterada; GPTPN: GPT persistentemente normal; HBC: hepatitis B crónica; HDA: hemorragia digestiva alta; ppcc: pruebas complementarias; VHB: virus de la hepatitis B.
De los 126 pacientes incluidos, 93 presentaban GPT normal al diagnóstico. En estos se realizó un análisis comparativo de pacientes con GPTPN, 71 (76,3%) vs. GPTNA, 22 (23,7%). Con respecto a las variables demográficas, no hubo diferencias significativas en relación con la edad (37,9 [31,9-45,9] vs. 37,1 [32,3-47,8]; p=0,93) ni con la nacionalidad extranjera (38% vs. 41%; p=0,8), pero sí en el sexo, siendo varones un 72,7% de los GPTNA frente a un 32,39% de los GPTPN (p=0,001). Las variables analíticas basales presentaron diferencias significativas en la GOT (20 [17-23] vs. 26 [23-31,2]mU/ml), GPT (21 [16-24] vs. 32 [28,5-36,2]mU/ml) y GGT mediana (14 [9-19] vs. 20 [13-35,2]mU/ml), siendo superiores en el grupo GPTNA (p<0,05). A su vez, los valores de GPT, tanto pico (25 [19-29] vs. 92 [60,2-140,5]mU/ml como valle (16 [13-18] vs. 40 [24,2-50,7]mU/ml), fueron superiores en los GPTNA (p<0,05). La carga viral mediana al diagnóstico de ambos grupos fue GPTPN de 811 (144-3.520) vs. GPTNA de 940 (600-17.000), p=0,37. El porcentaje de pacientes con ADN>20.000UI/ml fue superior en los pacientes con GPTNA de forma significativa (4,23% vs. 18,1%; p=0,03). Se observó una mayor frecuencia de cirrosis en el grupo de GPTNA (9% vs. 3,1%) y más resultados normales en el grupo de GPTPN (71,8% vs. 54,5%), sin llegar a la significación estadística (p=0,50).
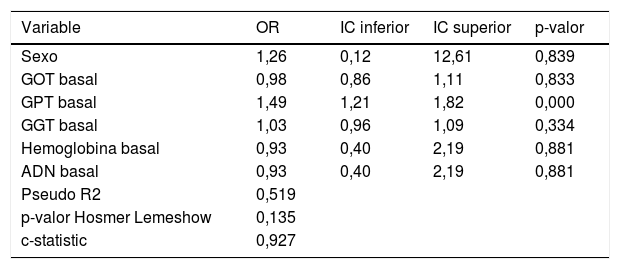
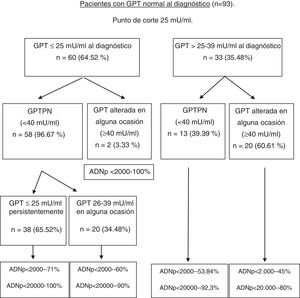
Realizamos un análisis de curvas ROC que nos permitiese encontrar un valor en la variable GPT en el momento del diagnóstico que prediga la alteración de este valor basal a un valor alterado por encima de 39mU/ml durante la evolución de la enfermedad. El punto que maximizó ambos estadísticos fue 25mU/ml, con un porcentaje de pacientes correctamente clasificados del 80,6% (S: 95,4%; E: 81,6%; VPP: 67,7%; VPN: 96,6%) (área bajo la curva ROC: 0,927). Realizamos una regresión logística univariante con el objeto de conocer el riesgo de alterar la GPT según el valor basal del mismo, introduciendo como variable dependiente el grupo de GPT, y como independiente si el individuo tiene o no una GPT basal superior a 25mU/ml, obteniendo una OR de 44,6 (p<0,001). El resultado del modelo multivariante de predicción de modificación de GPT de valores basales normales a alterados se muestra en la tabla 2, donde observamos que lo que determina el cambio de GPT es su valor basal. Es decir, con cada unidad de mU/ml que se incremente su GPT en el momento del diagnóstico, hay un riesgo de modificar su GPT a valores alterados del 49%.
Modelo multivariante en pacientes con GPT basal normal posteriormente alterada en función de GOT, GPT, GGT, hemoglobina y ADN basal
| Variable | OR | IC inferior | IC superior | p-valor |
|---|---|---|---|---|
| Sexo | 1,26 | 0,12 | 12,61 | 0,839 |
| GOT basal | 0,98 | 0,86 | 1,11 | 0,833 |
| GPT basal | 1,49 | 1,21 | 1,82 | 0,000 |
| GGT basal | 1,03 | 0,96 | 1,09 | 0,334 |
| Hemoglobina basal | 0,93 | 0,40 | 2,19 | 0,881 |
| ADN basal | 0,93 | 0,40 | 2,19 | 0,881 |
| Pseudo R2 | 0,519 | |||
| p-valor Hosmer Lemeshow | 0,135 | |||
| c-statistic | 0,927 |
ADN: ácido desoxirribonucleico; GGT: γ-glutamil transferasa; GOT: glutamato-oxalacetato transaminasa; GPT: glutámico-pirúvica transaminasa; IC: intervalo de confianza; OR: odds ratio.
La formación de los grupos en la evolución en función de la GPT basal y en el seguimiento teniendo como nuevo punto de corte 25mU/ml, así como el pico de ADN alcanzado en la evolución en cada uno de los grupos se observa en la figura 2. En función de estos grupos formados se pueden ver en la tabla 3 las complicaciones, la necesidad de tratamiento, el fallecimiento, así como el porcentaje de pacientes con mal pronóstico que se produjeron en cada grupo al diagnóstico y en la evolución.
Diagrama de flujo de pacientes con GPT normal al diagnóstico según evolución de GPT y punto de corte de 25mU/ml. Porcentaje de ADN-VHB pico alcanzado en cada grupo.
ADNp: ácido desoxirribonucleico del VHB pico; GPT: glutámico-pirúvica transaminasa; GPTPN: GPT persistentemente normal.
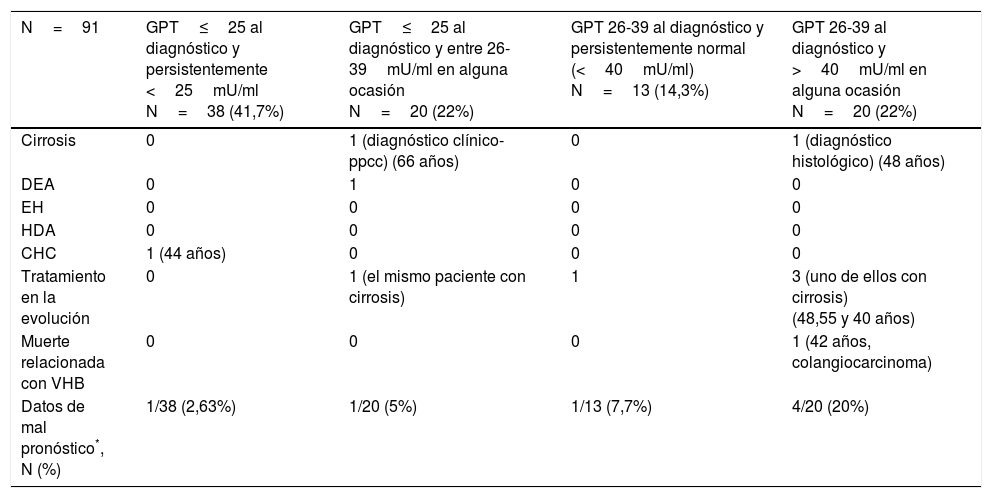
Eventos hepáticos desfavorables de pacientes con GPT normal al diagnóstico (<40mU/ml) en función de los grupos formados con punto de corte de 25mU/ml
| N=91 | GPT≤25 al diagnóstico y persistentemente <25mU/ml N=38 (41,7%) | GPT≤25 al diagnóstico y entre 26-39mU/ml en alguna ocasión N=20 (22%) | GPT 26-39 al diagnóstico y persistentemente normal (<40mU/ml) N=13 (14,3%) | GPT 26-39 al diagnóstico y >40mU/ml en alguna ocasión N=20 (22%) |
|---|---|---|---|---|
| Cirrosis | 0 | 1 (diagnóstico clínico-ppcc) (66 años) | 0 | 1 (diagnóstico histológico) (48 años) |
| DEA | 0 | 1 | 0 | 0 |
| EH | 0 | 0 | 0 | 0 |
| HDA | 0 | 0 | 0 | 0 |
| CHC | 1 (44 años) | 0 | 0 | 0 |
| Tratamiento en la evolución | 0 | 1 (el mismo paciente con cirrosis) | 1 | 3 (uno de ellos con cirrosis) (48,55 y 40 años) |
| Muerte relacionada con VHB | 0 | 0 | 0 | 1 (42 años, colangiocarcinoma) |
| Datos de mal pronóstico*, N (%) | 1/38 (2,63%) | 1/20 (5%) | 1/13 (7,7%) | 4/20 (20%) |
CHC: hepatocarcinoma; DEA: descompensación edemoascítica; EH: encefalopatía hepática; GPT: glutámico-pirúvica transaminasa; HDA: hemorragia digestiva alta por varices; ppcc: pruebas complementarias.
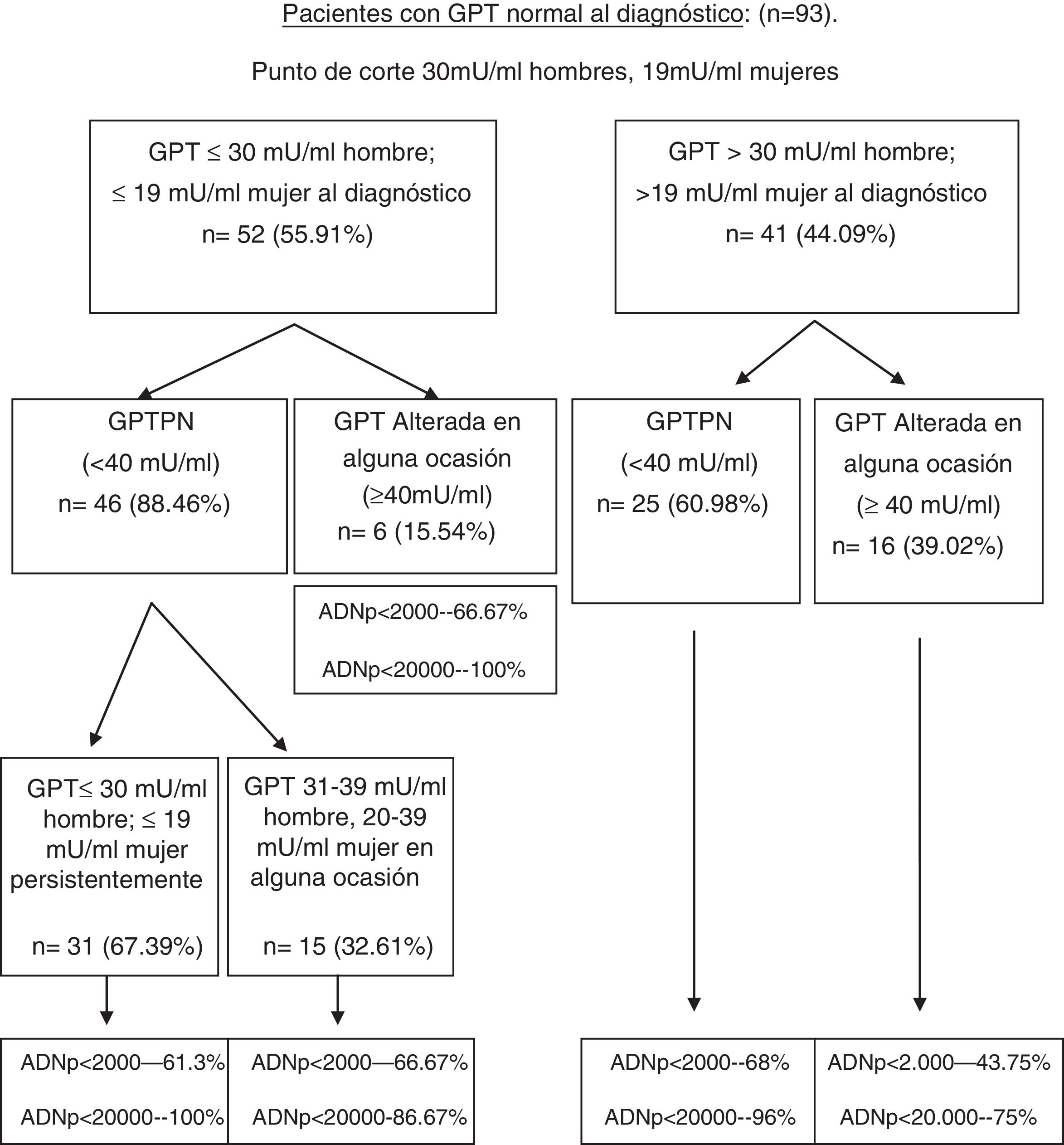
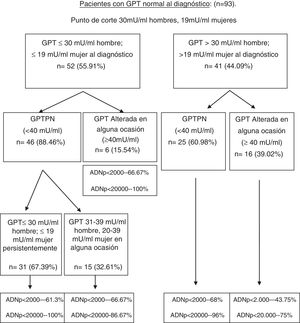
Realizando el mismo análisis para un punto de corte conocido teniendo en cuenta el sexo (30mU/ml de GPT para hombres y 19mU/ml de GPT para mujeres) se consigue un porcentaje de pacientes correctamente clasificados del 66,6% (S: 72,7%; E: 64,7%; VPP: 39%; VPN: 88,4%). A su vez, en la figura 3 se muestra el porcentaje de pacientes distribuidos en cada uno de los grupos formados con este punto de corte al diagnóstico y en la evolución, y el porcentaje de ADN-VHB pico (ADNp) alcanzado en la evolución. Se realizó el mismo análisis con los grupos formados con este punto de corte según el sexo en relación con las complicaciones, la necesidad de tratamiento, el fallecimiento, así como el porcentaje de factores de mal pronóstico en la evolución, siendo similar al obtenido con el punto de corte de 25mU/ml.
Diagrama de flujo de pacientes con GPT normal al diagnóstico según evolución de GPT con punto de corte de 30mU/ml en hombres y 19mU/ml en mujeres. Porcentaje de ADN-VHB pico alcanzado en cada grupo.
ADNp: ácido desoxirribonucleico del VHB pico; GPT: glutámico-pirúvica transaminasa; GPTPN: GPT persistentemente normal.
Se realizó un análisis comparativo para estos dos puntos de corte dentro de la normalidad de la GPT (teniendo y no teniendo en cuenta el sexo). No se observaron diferencias significativas en las características basales al diagnóstico (p<0,05), ni en la formación de los grupos en función de la GPT (p<0,05), ni en el porcentaje de pacientes que precisaron tratamiento o presentaron datos de mal pronóstico en la evolución (p<0,05).
En relación con el ADN-VHB, realizamos un análisis de curvas ROC para ver qué punto de corte al diagnóstico predecía mejor la alteración de este por encima de 2.000UI/ml en la evolución, observándose que el punto de corte de 900UI/ml de ADN-VHB al diagnóstico es el que consiguió los mejores valores, con un porcentaje de pacientes correctamente clasificados del 89,8% (S: 90,7%; E: 88,7%; VPP; 78,9%; VPN: 100%), y un área bajo la curva del 96,03% (IC: 91,7-98,9). A su vez, en los pacientes con GPTPN realizamos un análisis de la evolución del ADN-VHB en función del ADN-VHB basal, observándose que de los pacientes con ADN-VHB <2.000UI/ml al diagnóstico solo el 23% alcanzó un ADNp entre 2.000-20.000UI/ml, y ninguno sobrepasó las 20.000UI/ml, y de los que al diagnóstico tenían ADN-VHB entre 2.000-20.000UI/ml, solo el 9% presentó un ADNp superior a 20.000UI/ml (p=0,000).
Finalmente, realizamos un análisis de curvas ROC para ver qué punto de corte de GPT y ADN-VHB al diagnóstico predecía mejor la necesidad o no de tratamiento en la evolución, obteniéndose que el punto de corte conjunto de 6.000UI/ml de ADN-VHB y 38mU/ml de GPT es el que consigue los mejores valores (S: 75%; E: 93,44%; VPP: 60%; VPN: 96,61%).
DiscusiónLa GPT es la enzima hepática más específica para determinar afectación hepática. Debido a que la concentración de la enzima en una población forma una distribución continua, el punto de corte que discrimina entre los hígados sanos y enfermos no está claramente definido. Así, no queda claro si los actuales límites de normalidad de GPT son los más apropiados para determinar si existe o no daño hepático en la mayoría de los individuos, con las implicaciones que esto conlleva. Algunos investigadores han sugerido la necesidad de un punto de corte menor como estándar de la normalidad. Esto lo basan en registros de valores de GPT en donantes de sangre25, en la asociación entre GPT normal y tasas elevadas de muerte relacionadas con enfermedades hepáticas29, y en el riesgo aumentado de complicaciones o en los altos niveles de carga viral del VHB en relación con su hepatopatía en pacientes con HBC42,43.
En los últimos 35 años el límite superior de normalidad (LSN) de la GPT ha variado entre 30 y 50mU/ml, estando el límite más común en torno a 38-40mU/ml44,45. Sin embargo, las poblaciones de referencia podrían haber incluido a gente con afectación hepática leve-moderada, no detectada por desconocimiento de la enfermedad, como puede ocurrir en pacientes en estado de PI. En la actualidad, el LSN de GPT se ha reevaluado en diferentes países mediante la participación de distintos grupos de edad. Estos estudios sugieren que el límite superior de normalidad de GPT debe revisarse, indicando la recomendación de 30mU/ml para hombres y de 19mU/ml para mujeres25,26,30-32,46, mostrando que se puede perder un porcentaje de pacientes con daño histológico significativo, que varía del 1532 al 8,4%28. En un reciente estudio realizado en 53.037 adultos chinos, se establece como nuevo punto de corte de normalidad para esta población 35mU/ml en hombres y 23mU/ml en mujeres27, siendo estos también inferiores a lo establecido hasta el momento.
En nuestro estudio hemos obtenido 25mU/ml como el mejor valor de corte de GPT normal al diagnóstico, sin tener en cuenta el sexo, para predecir la probabilidad de pasar de valores de GPT normales a alterados en la evolución. Nuestros resultados muestran que los pacientes con GPTNA son más frecuentemente varones, presentan niveles más elevados de GOT, GGT, de carga viral al diagnóstico, así como de pico y valle de GPT, y un porcentaje más elevado de ADNp>20.000UI/ml de forma estadísticamente significativa, con lo que esto puede implicar. Como puede observarse en la figura 2, los pacientes que alteran la GPT en alguna ocasión en la evolución, al diagnóstico se encuentran en el grupo de GPT normal alto (26-39mU/ml) en la mayoría de los casos, estando solo 2 en el grupo de GPT normal bajo (0-25mU/ml), pero estos 2 casos presentaron ADNp<2.000UI/ml, lo que indica que probablemente se trate de una alteración de la GPT por una causa distinta a la infección por el VHB (sobrepeso/obesidad claseI lo más frecuente). En el estudio de fibrosis hepática, no encontramos diferencias estadísticamente, aunque los 2 pacientes en los que se objetivó cirrosis estaban en el grupo de GPT normal alto (26-39mU/ml) al diagnóstico o en la evolución, y existe un mayor porcentaje de resultados normales o con fibrosis leve en el grupo de GPTPN. Algunos autores han descrito que los pacientes en rango alto de la normalidad de GPT presentan una mayor afectación histológica de forma estadísticamente significativa28,32, y que dicha afectación histológica está directamente relacionada con la edad >40años y GPT>0,5×LSN, lo que coincide con nuestros resultados.
Respecto a los factores de mal pronóstico durante el seguimiento, vemos que son los pacientes que están en el grupo de GPT normal alto y que la alteran en la evolución los que presentan mayor número de factores de mal pronóstico, principalmente en relación con la necesidad de tratamiento (tabla 3). Por el contrario, los pacientes con GPT≤25mU/ml al diagnóstico, en dos tercios de los casos, mantienen esta en el mismo rango en la evolución, con ADN<20.000UI/ml en casi el 100% de los casos, existiendo solo un paciente de 44años con un factor de mal pronóstico (CHC).
Otros estudios de pacientes con infección crónica por VHB con GPTPN encuentran que los pacientes AgHBe(–) con niveles normales bajos o altos de GPT en relación con un punto de corte tradicional tuvieron similar afectación histológica y evolución33-38, por lo que algunos grupos concluyen que no es útil establecer un punto de corte dentro de la normalidad de GPT para el manejo de este tipo de pacientes47. Sin embargo, la mayoría de estos trabajos comparan grupos de pacientes que se mantienen en el tiempo en el rango de GPT normal alto o normal bajo, y nosotros planteamos la utilidad de estos puntos de corte principalmente en el momento del diagnóstico.
Al realizar el análisis con el punto de corte de 30mU/ml para hombres y 19mU/ml para mujeres en nuestros pacientes, no encontramos diferencias estadísticamente significativas en las características basales, en la formación de los grupos, ni en el porcentaje de factores de mal pronóstico, teniendo como contrapartida que presenta un menor porcentaje de pacientes correctamente clasificados para predecir la alteración de la GPT en la evolución, por lo que nos parece más útil en la práctica clínica el punto de corte de 25mU/ml de GPT.
Es conocida la necesidad de plantear tratamiento en pacientes con ADN-VHB superior a 2.000UI/ml por la posibilidad de daño histológico48. En los últimos años se han buscado herramientas que nos ayuden a predecir la evolución de estos pacientes, presentando cada vez más importancia el valor de la cuantificación del AgHBs para diferenciar entre portadores inactivos y pacientes con HBC AgHBe(–)49. Nosotros no hemos podido realizar este tipo de análisis al no disponer de esta determinación, si bien hemos observado que los pacientes con ADN-VHB <900UI/ml al diagnóstico tienen un VPN del 100% de no alterar el ADN-VHB por encima de 2.000UI/ml en los primeros 3años desde el diagnóstico, lo que sitúa a estos pacientes en estado de PI, con una mejor evolución clínica, y con la posibilidad de no realizar un seguimiento tan estrecho. A su vez, los pacientes con GPTPN con ADN-VHB<2.000UI/ml al diagnóstico mantienen ADN-VHB<2.000UI/ml en tres cuartas partes de los casos en el periodo de estudio. La indicación de tratamiento en nuestra serie fue la existencia de cirrosis (20%), y el hecho de estar en estado de HBC AgHBe(–) (80%). De estos últimos, el 87,5% presentaban GPT alterada al diagnóstico, por lo que en la gran mayoría de los casos los pacientes que requieren tratamiento tienen GPT alterada desde el diagnóstico. En un estudio español13, donde se incluían pacientes recientemente diagnosticados con infección crónica por VHB (91% AgHBe(–)), se trató al 17%, siendo datos similares a los nuestros. En nuestro grupo se indica necesidad de tratamiento en la mayoría de las ocasiones siguiendo las recomendaciones de la EASL; así, siguiendo estas indicaciones hemos encontrado que el punto de corte conjunto al diagnóstico de ≤6.000UI/ml de ADN-VHB y ≤38mU/ml de GPT tiene un alto VPN para la no necesidad de tratamiento en los primeros años tras el diagnóstico, lo que puede resultar relevante para el tipo de seguimiento necesario realizar en pacientes por debajo de estos puntos de corte al diagnóstico.
Con estos datos planteamos que los pacientes con GPT≤25UI/ml y ADN-VHB<900UI/ml podrían tener un seguimiento más laxo al diagnóstico, cada uno o 2 años; pacientes con GPT≤25mUI/ml y un ADN-VHB>900UI/ml o GPT 26-39mUI/ml con ADN-VHB<900UI/ml, entre 6-12 meses; y los pacientes con GPT 26-39UI/ml y ADN-VHB>900 UI/ml un seguimiento más estrecho, cada 3-6 meses. Siempre teniendo en cuenta el resultado del estudio de fibrosis realizado en cada paciente.
A pesar de todo lo expuesto, tenemos en cuenta las limitaciones de nuestro estudio: de carácter retrospectivo, realizado en un único centro, disponiendo solo la mitad de los pacientes de estudio de fibrosis hepática, y con un tiempo de seguimiento solo a medio plazo. Nuestros resultados apoyan la necesidad de realizar estudios prospectivos, multicéntricos, con un periodo de seguimiento más prolongado, con el fin de ver si nuestros datos se mantienen en este tipo de estudios.
Con los resultados que presentamos en este trabajo documentamos una vez más cómo los pacientes con infección crónica por VHB AgHBe(–) y GPT normal al diagnóstico no son un grupo homogéneo, precisando realizar un seguimiento en los primeros años tras el diagnóstico. No obstante, planteamos unos puntos de corte de GPT y ADN-VHB al diagnóstico para diferenciar entre pacientes con alto y bajo riesgo de desarrollo de factores de mal pronóstico y/o necesidad de tratamiento, y con ello poder realizar un seguimiento más individualizado de cada caso.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.
Al Dr. Marcelino Sánchez Casado, Adjunto de la UCI del Hospital Virgen de la Salud de Toledo, por su ayuda tanto en la metodología como en la estadística para la realización de este trabajo.
A la Dra. Belén Piqueras y al Dr. Fernando Bermejo, Adjunto y Jefe de Servicio de Digestivo del Hospital Universitario de Fuenlabrada, respectivamente, por su ayuda en la revisión final de este trabajo.