La esteatohepatitis no alcohólica (EHNA) es la forma más agresiva de hígado graso no alcohólico (HGNA) e involucra el riesgo de progresión a etapas más avanzadas de enfermedad hepática. Se requieren métodos no invasivos para identificar a pacientes con EHNA.
ObjetivoEvaluar el rendimiento diagnóstico de la determinación de los niveles séricos de citoqueratina-18 como marcador no invasivo de EHNA en población chilena.
MétodosSe determinaron los niveles séricos de CK-18 en un grupo de 41 pacientes con HGNA-probado por biopsia. El diagnóstico de EHNA se basó en los criterios histológicos recomendados (presencia de balonamiento) y se calculó el puntaje de actividad del HGNA (PAH) y grado de fibrosis. Mediante correlación de Spearman se evaluó la asociación entre CK-18 y PAH. Se confeccionó una curva ROC para evaluar la capacidad de CK-18 como test diagnóstico para EHNA. Además, se evaluó el rendimiento del puntaje de fibrosis en hígado graso no alcohólico (NFS) para pesquisa de fibrosis y EHNA y se lo comparó con CK-18 por regresión lineal simple. Los datos son expresados en medianas [percentil 25-75] y evaluados con test de rangos de Wilcoxon.
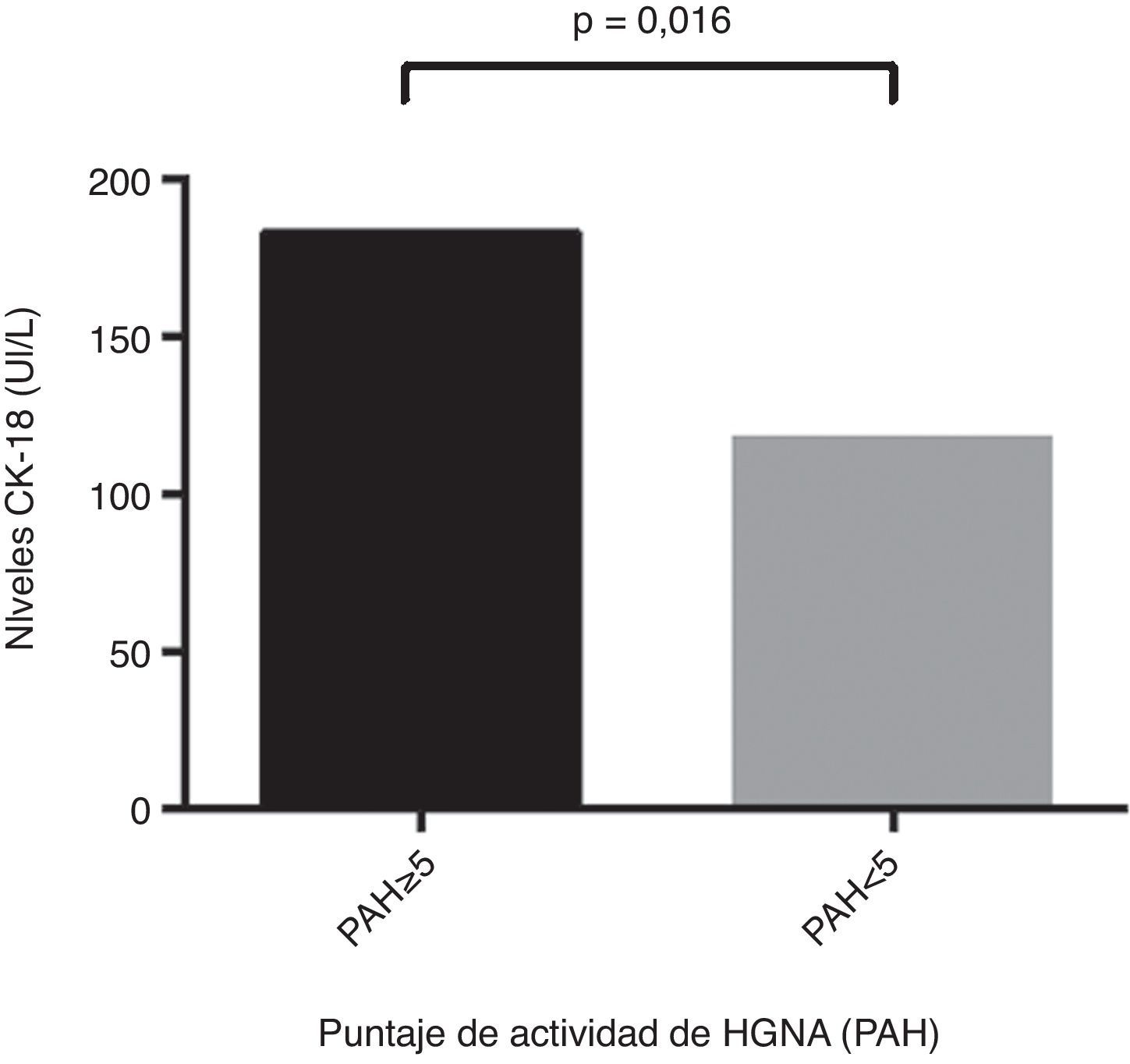
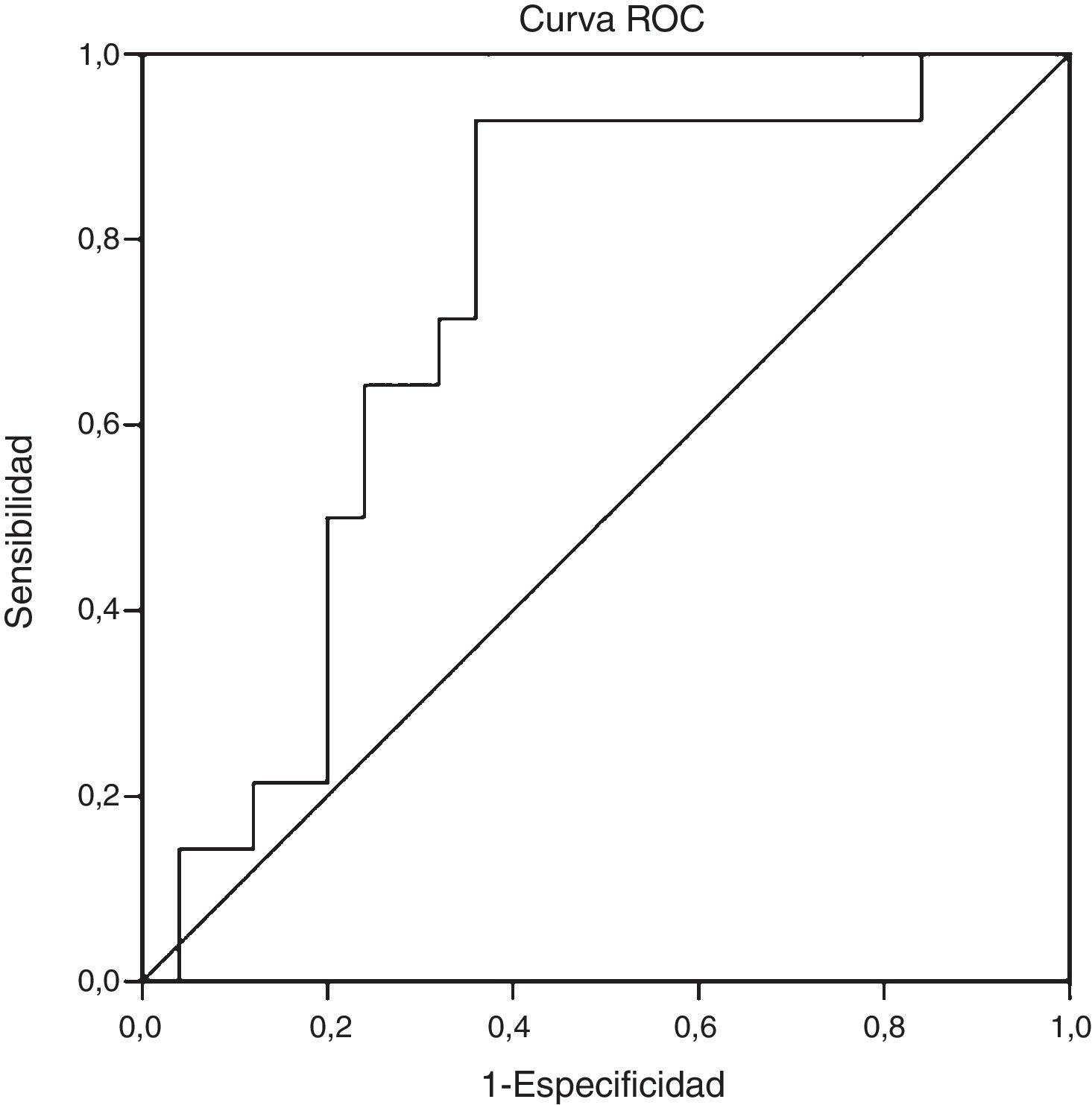
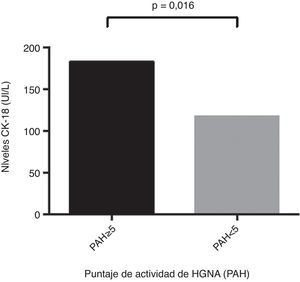
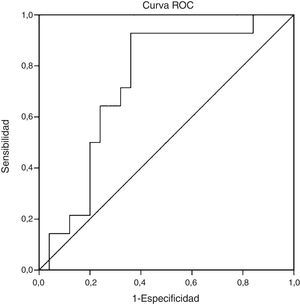
ResultadosLa edad promedio del grupo estudiado (23% hombres) fue de 50,4±11,1 años. Un 34,2% fue diagnosticado con EHNA (PAH≥5). Los niveles de CK-18 fueron mayores en los pacientes con EHNA versus los sin EHNA (183,6 UI/l [97,4-734,4] vs. 117,2 UI/l [83,8-954,8], p=0,016). Los niveles de CK-18 fueron buenos predictores de la presencia de EHNA en la biopsia con un área bajo la curva (AUC) de 0,732 (IC95% 0,572-0,897). Un punto de corte de 130,5 UI/l de CK-18 exhibió una sensibilidad de 92,9% y una especificidad de 63%, con un VPP de 56,5% y un VPN 94,4%, y clasificó correctamente al 73,2% de los pacientes con EHNA. El NFS tuvo un buen rendimiento para diagnóstico de fibrosis avanzada (AUC 0,739, IC95% 0,56–0,91), pero limitado para identificar EHNA (AUC 0,413, IC95% 0,21-0,61).
ConclusiónLa determinación de CK-18 es un buen marcador no invasivo de EHNA. Si bien, NFS tiene un buen rendimiento en la identificación de pacientes con fibrosis avanzada, no fue de utilidad para diagnosticar EHNA. En pacientes con HGNA, la determinación de CK-18 y NFS es útil en la pesquisa de EHNA y fibrosis hepática respectivamente.
Nonalcoholic steatohepatitis (NASH) is the most aggressive form of nonalcoholic fatty liver disease (NAFLD) and involves the risk of progression to more advanced stages of liver disease. Non-invasive methods are needed to identify patients with NASH.
ObjectiveTo evaluate the diagnostic performance of the determination of serum levels of cytokeratin-18 (CK-18) as a non-invasive marker of NASH in the Chilean population.
MethodsSerum CK-18 levels were determined in a group of 41 patients with biopsy-proven NAFLD. NASH diagnosis was based on Brunt's criteria (histological parameters and ballooning), and the NAFLD activity score (NAS) and the presence of fibrosis were determined. The correlation between the NAFLD activity score (NAS) and CK-18 was evaluated with Spearman's rank correlation coefficient. A ROC curve was produced to assess the diagnostic value of CK-18 for NASH. The NAFLD fibrosis score (NFS) (to predict fibrosis and NASH) was compared to CK-18 with simple linear regression. Data were expressed in median [25th-75th percentile] and evaluated with the Wilcoxon rank test.
ResultsThe mean age of the study group (23% male) was 50.4±11.1 years. 34.2% were diagnosed with NASH (NAS≥5). CK-18 levels were significantly higher in patients with NASH versus those without NASH (183.6 IU/l [97.4 to 734.4] vs. 117.2 IU/l [83.8 to 954.8], p= 0.016). CK-18 levels were a good predictor of NASH on biopsy with an area under the curve (AUC) of 0.732 (95% CI, 0.572 to 0.897). A CK-18 cut-off of 130.5 IU/l had a sensitivity of 92.9%, specificity of 63%, positive predictive value of 56.5% and negative predictive value of 94.4%, and was able to correctly classify 73.2% of patients with NASH. NFS identified advanced liver fibrosis (AUC 0.739, 95% CI, 0.56–0.91), but was of limited value to identify NASH (AUC 0.413, 95% CI, 0.21-0.61).
ConclusionCK-18 is a good non-invasive marker for NASH. Although NFS was found to be an accurate marker of advanced liver fibrosis, it was not of value to identify NASH. In patients with NAFLD, CK-18 and NFS could be useful in predicting NASH and liver fibrosis, respectively.
El hígado graso no alcohólico (HGNA) corresponde a una entidad clínico-patológica caracterizada por la presencia de esteatosis en al menos el 5% de los hepatocitos, asociada o no a la presencia de cambios inflamatorios y presencia de fibrosis1. La presencia de elementos histológicos de inflamación, balonización de los hepatocitos con o sin fibrosis define la llamada esteatohepatitis no alcohólica (EHNA), considerada una forma más agresiva de la enfermedad y cuya trascendencia radica en su potencial progresión a cirrosis hepática y hepatocarcinoma2.
La prevalencia global del HGNA ha sido estimada en un 25,24% (95% IC: 22,10-28,65) de la población3–5. En Chile, un estudio con ultrasonografía abdominal reportó una prevalencia de HGNA de 23% de la población estudiada6.
Los niveles séricos de aminotransferasas han sido tradicionalmente utilizados como indicadores de gravedad de la enfermedad, sin embargo, debe tenerse en cuenta que dichos niveles pueden ser oscilantes en el tiempo y que su elevación se observa solo en el 50% de los pacientes con EHNA, es decir, puede existir enfermedad hepática significativa aún con niveles de aminotransferasas normales7. Es por esto que la biopsia hepática sigue siendo el estándar dorado («gold standard») para el diagnóstico de HGNA y para diferenciar la esteatosis aislada de la EHNA y formas de daño hepático más avanzadas8. Dicho procedimiento tiene un costo significativo y un riesgo clínico que aconseja su uso racional9. Actualmente se encuentran en desarrollo y validación modelos no invasivos bioquímicos y de imágenes (elastografía transiente, elastografía por resonancia magnética, elastografía ShearWave, etc.) para identificar aquellos pacientes con enfermedad hepática más avanzada. Sin embargo, la mayoría de estas herramientas permite identificar la presencia de fibrosis10,11 y no de inflamación y, por lo tanto, no permite diferenciar los pacientes con EHNA de los de esteatosis simple.
En la actualidad, es necesario validar un método diagnóstico que sea simple, barato y que permita discriminar entre esteatosis simple y EHNA. Estudios experimentales y clínicos sugieren que la apoptosis de los hepatocitos podría jugar un rol central en el daño hepático y la progresión de la enfermedad en el HGNA12. En efecto, se ha observado que tanto en pacientes con EHNA como en modelos animales de EHNA la apoptosis es el proceso predominante de muerte celular en los hepatocitos13. El proceso apoptótico activa caspasas efectoras (principalmente caspasa-3), lo que se asocia al clivaje de diferentes sustratos incluyendo la citoqueratina-18 (CK-18), el filamento intermedio proteico más importante en el hígado14. CK-18ha sido evaluado en diferentes poblaciones como un potencial marcador de daño hepatocelular que permita diferenciar entre sujetos con esteatosis aislada y EHNA15.
El objetivo del presente estudio fue evaluar la utilidad diagnóstica y validar clínicamente los niveles séricos del fragmento sérico de CK-18 como marcador no invasivo de EHNA en una población chilena.
Pacientes y métodosPoblación de estudioSe seleccionaron los pacientes con diagnóstico de HGNA demostrado por biopsia entre enero de 2010 y noviembre de 2013, en el Hospital Clínico Universidad Católica de Chile, los cuales fueron contactados dentro de 3 meses tras la confirmación del diagnóstico histológico y se les solicitó consentimiento informado para la medición sérica de CK-18, posterior a la aprobación del comité de ética de la institución.
Los criterios de inclusión fueron la elevación persistente de niveles plasmáticos de aminotransferasas (aspartato aminotransferasa y alanino aminotransferasa), estudio de imágenes compatible con hígado graso y biopsia consistente con diagnóstico de HGNA. Se excluyeron aquellos pacientes que cursaran con infecciones por virus hepatitis A, B, C, D y E, enfermedad hepática autoinmune, enfermedad de Wilson, déficit de α1-antitripsina, antecedentes de transfusiones sanguíneas y uso de alcohol o hepatotóxicos. Además se realizó una evaluación clínica (de antecedentes de hipertensión arterial, diabetes mellitus tipo 2 [DMT2], tabaquismo y antropométrica) y bioquímica (pruebas hepáticas, abúmina, glucemia, insulinemia, perfil lipídico, plaquetas y aminotransferasas). Empleando variables clínicas y bioquímicas se calculó el NAFLD fibrosis score (NFS) de acuerdo a lo recomendado11.
Análisis histológicoLos pacientes sometidos a biopsia hepática contaron con más de 8 h de ayuno y el procedimiento se realizó bajo sedación, anestesia local y guía ecográfica por técnica de Menghini.
Las muestras fueron procesadas en formalina y teñidas con hematoxilina-eosina y Sirius red. La evaluación histológica fue realizada por patólogo experto ciego a los datos clínicos. El diagnóstico de EHNA se basó en los criterios de Brunt et al.16 y se calculó el puntaje de actividad del HGNA (PAH)/(NAFLD activity score-NAS)17 y grado de fibrosis en cada paciente. Posteriormente la población estudiada fue clasificada según PAH<o ≥ 5, en no-EHNA o EHNA respectivamente. Cada muestra fue además calificada según grado de fibrosis (0: sin fibrosis, 1: fibrosis periportal o perisinusoidal, 2: fibrosis portal/periportal y perisinusoidal, 3: fibrosis en puente, 4: cirrosis).
Medición de niveles de CK-18A los pacientes seleccionados se les realizó una venopunción y la muestra fue procesada para obtener plasma, el cual fue guardado a -80°C. Las muestras fueron posteriormente utilizadas para la determinación cuantitativa de los niveles de CK-18 mediante el kit ELISA comercial M30-Apoptosense (PEVIVA; VLVbio: Bromma, Suecia). Todas las mediciones fueron realizadas en duplicado.
Análisis estadísticoLos datos son expresados como promedios (intervalo de confianza [IC], 95%), medianas (con rango intercuartil) o porcentajes (%), según correspondió. Variables ordinales y continuas fueron evaluadas con Student T test y test de rangos de Wilcoxon, según pruebas de normalidad. Se utilizó el coeficiente de correlación de Spearman para evaluar la asociación entre CK-18 y PAH. Se calculó sensibilidad y especificidad como test diagnóstico para distintos puntos de corte, evaluando el área bajo la curva (area under the curve [AUC]) y se confeccionó una curva ROC para evaluar la capacidad de CK-18 como test diagnóstico para EHNA, según PAH ≥5, utilizando el índice de Youden para definir punto de corte óptimo para análisis de curva ROC. En forma paralela, se determinó el puntaje de fibrosis en HGNA (NAFLD fibrosis score [NFS])10 y se evaluó su rendimiento diagnóstico para fibrosis en histología y para puntaje PAH≥5 por medio de curvas ROC. En forma similar, se comparó el NFS con niveles de CK-18 por medio de regresión lineal simple. Un valor p<0,05 se consideró como estadísticamente significativo. Todos los análisis se realizaron con IBM SPSS Statistics versión 20.
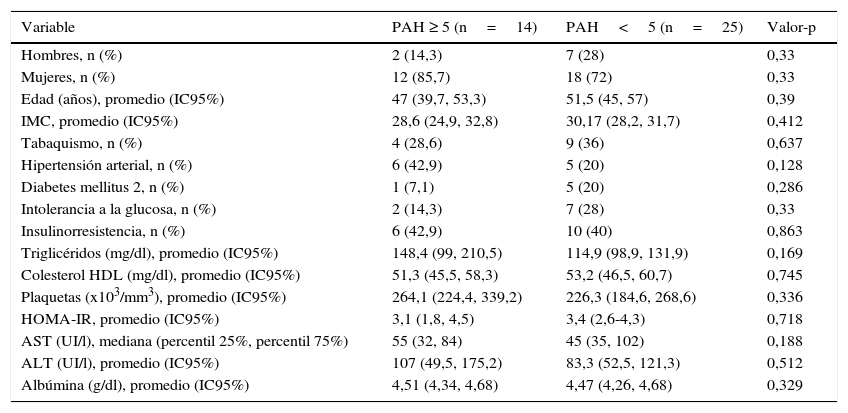
ResultadosSe reclutaron 41 pacientes con diagnóstico de HGNA demostrado por biopsia, quienes accedieron al estudio y firmaron el consentimiento informado. Las principales características demográficas, clínicas y de laboratorio de la población estudiada se presentan en la tabla 1. El promedio de edad fue 50,4±11,1 años, 23% eran hombres y un 34,2% fue diagnosticado de EHNA (PAH ≥5). Las características de la población incluyendo edad, índice de masa corporal, tabaquismo, hipertensión arterial, DMT2, intolerancia a la glucosa, insulinorresistencia (IR), así como niveles de triglicéridos, colesterol HDL, plaquetas, HOMA-IR, AST y ALT no variaron en forma significativa entre ambos grupos (PAH ≥5 y PAH <5) (tabla 1).
Características demográficas y clínicas de la población estudiada
| Variable | PAH ≥ 5 (n=14) | PAH<5 (n=25) | Valor-p |
|---|---|---|---|
| Hombres, n (%) | 2 (14,3) | 7 (28) | 0,33 |
| Mujeres, n (%) | 12 (85,7) | 18 (72) | 0,33 |
| Edad (años), promedio (IC95%) | 47 (39,7, 53,3) | 51,5 (45, 57) | 0,39 |
| IMC, promedio (IC95%) | 28,6 (24,9, 32,8) | 30,17 (28,2, 31,7) | 0,412 |
| Tabaquismo, n (%) | 4 (28,6) | 9 (36) | 0,637 |
| Hipertensión arterial, n (%) | 6 (42,9) | 5 (20) | 0,128 |
| Diabetes mellitus 2, n (%) | 1 (7,1) | 5 (20) | 0,286 |
| Intolerancia a la glucosa, n (%) | 2 (14,3) | 7 (28) | 0,33 |
| Insulinorresistencia, n (%) | 6 (42,9) | 10 (40) | 0,863 |
| Triglicéridos (mg/dl), promedio (IC95%) | 148,4 (99, 210,5) | 114,9 (98,9, 131,9) | 0,169 |
| Colesterol HDL (mg/dl), promedio (IC95%) | 51,3 (45,5, 58,3) | 53,2 (46,5, 60,7) | 0,745 |
| Plaquetas (x103/mm3), promedio (IC95%) | 264,1 (224,4, 339,2) | 226,3 (184,6, 268,6) | 0,336 |
| HOMA-IR, promedio (IC95%) | 3,1 (1,8, 4,5) | 3,4 (2,6-4,3) | 0,718 |
| AST (UI/l), mediana (percentil 25%, percentil 75%) | 55 (32, 84) | 45 (35, 102) | 0,188 |
| ALT (UI/l), promedio (IC95%) | 107 (49,5, 175,2) | 83,3 (52,5, 121,3) | 0,512 |
| Albúmina (g/dl), promedio (IC95%) | 4,51 (4,34, 4,68) | 4,47 (4,26, 4,68) | 0,329 |
Mediana (percentil 25%, percentil 75%): AST, CK-18.
n (%) Porcentaje: sexo, tabaquismo, hipertensión arterial, diabetes mellitus tipo 2, intolerancia a la glucosa, resistencia a insulina.
Promedio (IC95%): edad, índice de masa corporal (IMC), triglicéridos, colesterol HDL, plaquetas, HOMA-IR, ALT, albúmina.
Respecto a los niveles de CK-18 en la población estudiada se observaron valores entre 83,8 UI/l y 385,2 UI/l, como mínimo y máximo respectivamente. Además, se evidenció que los pacientes con puntaje de PAH ≥5 presentaban niveles de CK-18 significativamente más elevados en comparación con pacientes con PAH<5 (183,6 UI/l [132,300] vs.117,2 UI/l [103,2, 164,5]; p= 0,016) (fig. 1). Por otra parte, se observó la existencia de una correlación significativa entre el aumento de CK-18 y el puntaje de PAH (R2= 0,376, p= 0,018), por lo que, se puede inferir que el riesgo de tener EHNA en la biopsia hepática aumenta proporcionalmente con el aumento de los niveles de CK-18.
Niveles de CK-18 según puntaje de actividad de HGNA (PAH). Individuos con puntaje de PAH mayor o igual a 5: 183,6 UI/l (CI 95% 132-300), presentaban niveles de CK-18 significativamente más elevados en comparación con pacientes con PAH menor a 5: 117,2 UI/l (CI95% 103,2-164,5) (p= 0,016).
Al evaluar el rendimiento diagnóstico de los niveles séricos de CK-18 como predictor de EHNA en la biopsia (determinada por PAH ≥5), observamos un AUC de 0,732 (IC95; 0,572-0,897) (fig. 2). Al considerar como referencia un punto de corte de CK-18 de 130,5 UI/l el test tuvo una sensibilidad de 92,9%, especificidad de 62,9%, valor predictivo positivo de 56,5% y valor predictivo negativo de 94,4%, otorgando un índice de Youden de 0,6 y logrando clasificar correctamente al 73,2% de pacientes con EHNA en histología.
Respecto a la evaluación de la fibrosis, los pacientes con fibrosis avanzada (n=10, 24,39%) tuvieron una mediana de CK-18 de 128 UI/l, mientras que los pacientes sin fibrosis avanzada (n=31, 75,61%) presentaron una mediana de CK-18 de 132,7 UI/l (p=0,499). Aunque se pudo apreciar que existe una relación inversa entre el grado de fibrosis y los niveles de CK-18, con un coeficiente de Spearman de -0,79, esta tendencia no alcanza significación estadística (p= 0,632), con un AUC para fibrosis avanzada de 0,426 (IC95; 0,213-0,638).
Empleando los valores obtenidos para el NFS en nuestro grupo de pacientes con HGNA encontramos que un 36,6% fue clasificado en bajo riesgo, un 29,3% como indeterminado y un 34,2% en alto riesgo de presentar fibrosis significativa; teniendo el NFS una AUC para detección de fibrosis avanzada en histología de 0,739 (IC95 0,563, 0,915), en coincidencia con lo descrito en la literatura11. Al evaluar el rendimiento diagnóstico de NFS para PAS ≥5, encontramos que el AUC fue de 0,413 (IC95% 0,21–0,61), lo que implica que no constituye un buen test diagnóstico para discriminar presencia de inflamación en HGNA. En forma similar, los valores de NFS se correlacionaron pobremente con niveles de CK-18 en regresión lineal simple (R2=-0,01, p=0,553).
DiscusiónEl HGNA es una patología cuya prevalencia ha aumentado en forma paralela a la pandemia de obesidad y diabetes. Esta patología se asocia al potencial desarrollo de complicaciones tanto a nivel hepático como cirrosis y hepatocarcinoma, como extrahepático incluyendo DMT2, enfermedades cardiovasculares y cáncer18. Dentro de los factores de riesgo más importantes asociados al desarrollo de la enfermedad se encuentran la obesidad, DMT2 y la presencia de síndrome metabólico4. Los pacientes con DMT2 tienen mayor prevalencia de HGNA, pero también de fibrosis avanzada, por lo que constituyen un grupo especial de riesgo19,20. Además, estudios han sugerido que diferencias étnicas determinan la prevalencia de EHNA en distintas poblaciones, siendo esta más común en latinos y menos prevalente en afroamericanos21. Lo anterior, está posiblemente relacionado a una distinta susceptibilidad genética al desarrollo de adiposidad visceral, DMT2 y específicamente al desarrollo de IR22.
Los datos sobre la historia natural del HGNA son limitados y su estudio es complejo por la necesidad de seguimiento a largo plazo, el sesgo de selección en los pacientes y las modalidades diagnósticas empleadas en los diferentes estudios. El análisis de biopsias pareadas separadas por intervalos significativos ha permitido estimar que entre un 10 y 20% de los pacientes con EHNA podrían desarrollar cirrosis en una década3,4. Además, los pacientes con EHNA exhiben un riesgo aumentado de desarrollar carcinoma hepatocelular3. Sin embargo, es de notar que en un estudio reciente conducido por McPherson et al. demostraron, empleando biopsias pareadas separadas por una media de 6 años, que pacientes con esteatosis aislada pueden progresar tanto a EHNA como a fibrosis clínicamente significativa, por lo que dicha condición no parece ser benigna en todos los casos como se consideraba previamente23. Por otra parte, varios estudios han determinado que la presencia de fibrosis y no de EHNA es el predictor más preciso de mortalidad en pacientes con HGNA24,25. Dada la larga historia natural de la enfermedad, es difícil demostrar la influencia de la EHNA en la mortalidad de causa hepática, pero es posible que sea así ya que es el desarrollo de cirrosis y hepatocarcinoma, que ocurre más frecuentemente en sujetos con EHNA, el que posiblemente explica el aumento de mortalidad por causa hepática asociado al HGNA4,26.
En el contexto descrito más arriba, contar con marcadores no invasivos como la CK-18 podría permitir identificar a los individuos con EHNA, y por lo tanto en mayor riesgo de progresión y centrar en ellos acciones diagnósticas ulteriores y esfuerzos terapéuticos intensivos. En este sentido, se podría proponer que pacientes con marcadores de EHNA (como por ejemplo niveles altos de CK-18) y otros factores de riesgo de progresión, como DMT2 u obesidad, debiesen ser incorporados en programas multidisciplinarios de control de la enfermedad metabólica.
El principal hallazgo de nuestro estudio es que la medición de niveles plasmáticos de CK-18 en la población chilena es un marcador confiable de EHNA en la biopsia, con AUC de 0,732 (IC95% 0,572-0,897) y al establecer un punto de corte de 130,5 UI/l, según índice de Youden, el test tiene una sensibilidad de 92,9% y especificidad de 63%. Otros grupos habían previamente descrito el uso de CK-18 como predictor de la presencia de EHNA, con AUROC entre 0,71 y 0,9327–30. Consistentemente, la utilidad de la medición plasmática de CK-18ha sido validada por estudios multicéntricos y una metanálisis que mostró un AUC combinada de 0,82 (IC 95%; 0,76-0,88)31,32. Feldstein et al. describieron que por cada 50 UI/l que aumenta la CK-18, la probabilidad de tener EHNA aumenta en un 30% (odss ratio 1,74, 95% IC: 1,31–2,31)31.
Las limitaciones de nuestro estudio incluyen el sesgo de referencia, ya que fue realizado en un hospital terciario, y los resultados podrían no aplicarse a la población general de pacientes con HGNA. Además, dadas las características del estudio no permite establecer pronóstico de valores más altos de CK-18 en el curso de la enfermedad en comparación con valores menores. Por ello es que se requieren nuevos estudios para su validación. La relación de niveles de CK-18 con la evolución de HGNA, progresión y regresión de EHNA se ha comunicado en un estudio reciente33. Otro aspecto que sería interesante investigar es el potencial efecto de los sensibilizadores a la insulina sobre la medición de CK-18.
Interesantemente, en nuestra serie de pacientes los niveles de CK-18 no se correlacionaron con la presencia de fibrosis avanzada, situación previamente descrita en la literatura34. Estas observaciones podrían estar relacionadas con el tamaño muestral, o con que la mayoría de los pacientes se encontraban en estadios iniciales de la enfermedad. En cambio, el NFS tuvo un adecuado rendimiento para diagnóstico de fibrosis avanzada en histología, similar a lo descrito en la literatura11. Sin embargo, su utilidad en discriminar esteatosis simple versus inflamación en la histología fue limitada, sugiriendo que su uso en estadios iniciales de la enfermedad sin la presencia de fibrosis, sería de limitada utilidad.
En conclusión, CK-18 es un marcador no invasivo de sencilla determinación, ya que solo requiere una muestra de plasma. CK-18 es un buen marcador no invasivo de EHNA y superior a NFS. Por otro lado, en este estudio NFS fue superior en la identificación de pacientes con fibrosis avanzada. CK-18 en combinación con NFS podrían ser marcadores no invasivos útiles en la identificación de EHNA y fibrosis hepática en pacientes con HGNA.
Autoría/colaboradoresJuan Pablo Arab y Cristián Hernández-Rocha contribuyeron en la misma medida al artículo (ambos comparten la primera autoría).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue parcialmente financiado por el FONDECYT #1150327 a M.A. y la Comisión Nacional de Investigación Científica y Tecnológica (grant PFB 12/2007, Basal Centre for Excellence in Science and Technology [a M.A.]) del Gobierno de Chile.