INTRODUCCIÓN
Los pacientes infectados por Helicobacter pylori tienen un riesgo elevado de cáncer gástrico1-3. El riesgo de desarrollar carcinoma gástrico es mayor en el subgrupo de pacientes infectados que tienen gastritis atrófica4,5. De hecho, el riesgo relativo de carcinoma gástrico en individuos con atrofia mucosa grave del antro y el cuerpo gástricos está aumentado 30 veces6.
El diagnóstico de gastritis atrófica requiere la realización de una endoscopia con toma de biopsias del antro y el cuerpo, ya que la histología se considera el patrón de referencia para el diagnóstico de gastritis atrófica7,8. En los últimos años se ha investigado la posibilidad de diagnosticar la gastritis atrófica mediante la determinación de pepsinógeno y gastrina en suero9-12. El pepsinógeno I se sintetiza únicamente en las células principales y en las células mucosas del cuerpo gástrico, mientras que el pepsinógeno II se sintetiza en las glándulas de todo el estómago y en las glándulas de Brunner del duodeno9. Por tanto, unos valores bajos de pepsinógeno I y una proporción de pepsinógeno I/II baja indicaría la presencia de atrofia moderada-grave del cuerpo gástrico9. La gastrina se sintetiza en las células G que se encuentran en el antro gástrico y en el duodeno. Más del 90% de la gastrina producida en el antro corresponde al péptido gastrina-17 («pequeña gastrina»)9. Por tanto, los valores séricos bajos de gastrina-17 indicarían la presencia de atrofia moderada o grave del antro gástrico9. Se ha propuesto un panel serológico (Gastropanel, Biohit, Helsinki, Finlandia) que combina los valores séricos de pepsinógeno I y II, gastrina-17 y los anticuerpos anti-H. pylori para el diagnóstico de la atrofia gástrica9. En estudios realizados en grupos de pacientes dispépticos el Gastropanel tiene una sensibilidad del 64-89% y una especificidad del 79-95% para el diagnóstico de gastritis atrófica9-12.
El objetivo de este estudio es evaluar la utilidad de un panel serológico (Gastropanel®) como un método de cribado de gastritis atrófica en pacientes dispépticos en nuestro medio. Como la prevalencia de gastritis atrófica en los pacientes dispépticos es baja13, hemos incluido también en el estudio un grupo de pacientes consecutivos con cáncer gástrico, cuya prevalencia de gastritis atrófica es hipotéticamente mayor4,5.
PACIENTES Y MÉTODOS
Pacientes
La muestra total se compone de 56 pacientes procedentes de 2 grupos. El primer grupo lo formaban 47 pacientes con dispepsia no investigada (24 varones, 23 mujeres; edad media, 39 ± 15,4 años) estudiados en las consultas externas del Servicio de Aparato Digestivo del Hospital Virgen de la Salud (Toledo). Debido a la baja prevalencia de gastritis crónica atrófica en nuestros pacientes con dispepsia no investigada13, de cidimos incluir en el estudio un segundo grupo de 10 pacientes consecutivos diagnosticados de carcinoma gástrico en nuestra unidad de endoscopias. Uno de los pacientes del grupo de carcinoma gástrico fue excluido por estar tomando inhibidores de la bomba de protones cuando se extrajo la muestra para el estudio serológico. Por tanto, el segundo grupo se componía de 9 pacientes con carcinoma gástrico (6 varones, 3 mujeres; edad media, 72,8 ± 12 años). El estudio fue aprobado por el comité de ética y ensayos clínicos de nuestro hospital y todos los pacientes firmaron un consentimiento informado.
Endoscopia y biopsias
En todos los pacientes de ambos grupos (dispepsia no investigada y carcinoma gástrico) se realizó una endoscopia digestiva alta. En 12 de los 47 pacientes con dispepsia (25,5%) se encontró una causa orgánica de la dispepsia. Las causas de dispepsia orgánica en esta serie fueron: úlcera péptica en 9 casos (4 úlceras gástricas, 4 úlceras duodenales y un paciente con ambas), esofagitis de reflujo en 4 casos (2 de ellos tenían también úlcera duodenal) y úlcera maligna en un caso (carcinoma gástrico precoz de tipo difuso).
En el grupo de carcinoma gástrico, 2 pacientes tenían un cáncer gástrico precoz y los otros 7 tenían una enfermedad avanzada. Se disponía de una muestra de resección quirúrgica en 6 pacientes, lo cual permitió realizar un estudio más extenso de la histología gástrica en esos casos. En 3 pacientes con carcinoma irresecable la histología se evaluó en las muestras de biopsia obtenidas durante la endoscopia diagnóstica.
En todos los pacientes de ambos grupos se obtuvieron 2 biopsias del antro (a 3 cm del píloro) y 2 biopsias del cuerpo (pared anterior y posterior del cuerpo medio), además de las biopsias tomadas de lesiones visualizadas durante la endoscopia. Se empleó una biopsia adicional del antro para el test de la ureasa (Pyloriset Urease®, Orion diagnostics, Espoo, Finlandia). Las muestras para la histología se fijaron en formalina y se incluyeron en parafina. Se emplearon secciones histológicas teñidas con hematoxilina-eosina para evaluar la presencia de gastritis crónica y atrofia mucosa. La evaluación fue realizada por dos patólogos (R.R.M. y J.V.) siguiendo las indicaciones del sistema Sydney revisado7. La gastritis crónica se clasificó en atrófica y no atrófica. Debido al reducido número de casos con gastritis atrófica, no se intentó dividir la gastritis atrófica de acuerdo con su localización topográfica (antro, cuerpo, o ambas). La presencia de infección por H. pylori se evaluó en secciones de mucosa gástrica teñidas con Giemsa. Se consideró que había infección por H. pylori cuando eran positivos 2 de los 3 métodos diagnósticos empleados (test de la ureasa, histología y anticuerpos anti-H. pylori).
Estudio serológico
Se extrajo una muestra de sangre en ayunas de cada uno de los pacientes para la determinación de los valores de pepsinógeno I y II, gastrina-17 y anticuerpos IgG anti-H. pylori. Las muestras se centrifugaron a 1.500 3 g durante 10 min, y las muestras de suero se almacenaron a 70 °C hasta que fueron analizadas.
Los valores de pepsinógeno I y II, gastrina-17 y anticuerpos anti-H. pylori se determinaron mediante tests EIA específicos (Biohit plc, Helsinki, Finlandia). La probabilidad de atrofia gástrica se determinó con el software Gastosoft for Excel (Biohit plc, Helsinki, Finlandia). El programa determina si el paciente tiene o no gastritis por H. pylori y si la gastritis es o no atrófica. El programa también detecta la gastritis atrófica tipo anemia perniciosa en individuos H. pylori-negativos9.
Estadística
La prevalencia de gastritis atrófica y no atrófica en pacientes dispépticos y en pacientes con carcinoma gástrico se comparó con el test exacto de Fisher. Los valores medios de pepsinógeno I y II y de gastrina-17 en los diferentes grupos de pacientes se compararon mediante el test de ANOVA. Para conseguir una distribución normal se emplearon transformaciones logarítmicas de los valores de pepsinógenos y gastrina-17. Un valor de p < 0,05 se consideró estadísticamente significativo. El grado de concordancia entre el diagnóstico histológico y el diagnóstico proporcionado por el panel serológico se evaluó con el índice kappa. Se empleó el índice kappa ponderado, que tiene en cuenta la concordancia entre valores próximos de categorías histólogicas ordenadas.
RESULTADOS
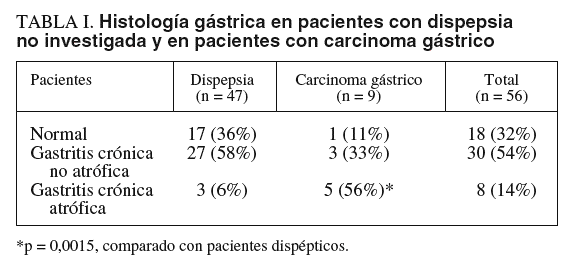
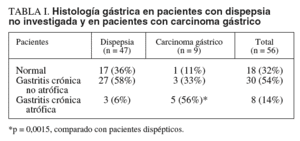
Treinta de los 47 pacientes con dispepsia (64%) y 6 de 9 pacientes con carcinoma gástrico (67%) tenían infección por H. pylori. En la tabla I se presenta la histología gástrica en pacientes dispépticos y en pacientes con carcinoma gástrico. La gastritis atrófica fue significativamente más frecuente en los pacientes con carcinoma gástrico que en los pacientes con dispepsia (el 56 frente al 6%; p = 0,0015).
Los valores medios de pepsinógeno I en pacientes con una mucosa gástrica normal (76,8 ± 23 µg/l), en pacientes con gastritis no atrófica (120,2 ± 47,3 µg/l) y en pacientes con gastritis atrófica (50,3 ± 51,5 µg/l) fueron significativamente diferentes (ANOVA: p < 0,0001). El análisis post hoc (Scheffe) mostró también diferencias significativas en los valores de pepsinógeno I de cada grupo histológico comparado con cada uno de los otros grupos. Los valores medios de gastrina-17 en los pacientes con una mucosa gástrica normal (2,6 ± 3,5 pmol/l), gastritis no atrófica (6 ± 6,3 pmol/l) y gastritis atrófica (21,8 ± 29,8 pmol/l) también fueron significativamente diferentes (ANOVA: p = 0,002). Sin embargo, en el análisis post hoc sólo fue significativa la diferencia en los valores de gastrina-17 de los pacientes con una mucosa gástrica normal y de los pacientes con gastritis atrófica (p = 0,003).
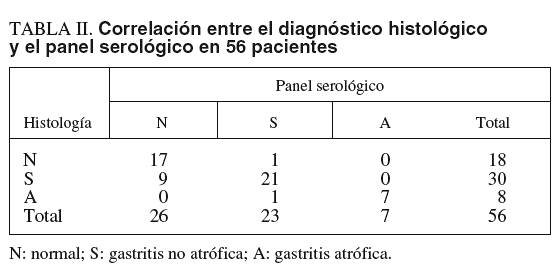
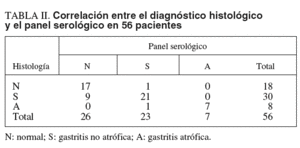
En la tabla II se presenta la concordancia entre el diagnóstico histológico y el diagnóstico del panel serológico. El grado de concordancia entre los dos métodos fue bueno (kappa ponderado = 0,68). La sensibilidad del panel serológico para el diagnóstico de gastritis atrófica fue del 87,5% (intervalo de confianza [IC] del 95%, 47,4-99,7), la especificidad del 100% (IC del 95%, 94-100), el valor predictivo positivo del 99,32% (IC del 95%, 56,1-100) y el valor predictivo negativo del 97,96% (IC del 95%, 87,8-99,9).
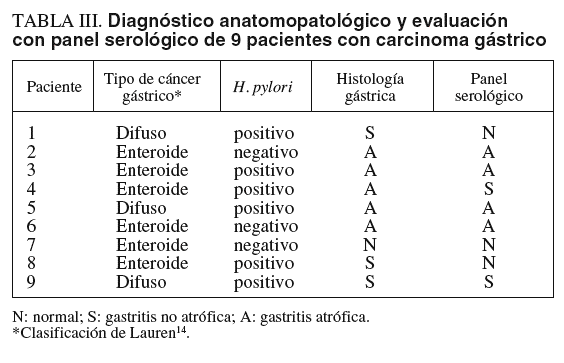
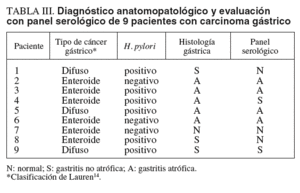
En la tabla III se presenta la concordancia en el diagnóstico histológico y serológico en los 9 pacientes con carcinoma gástrico. Seis pacientes tenían un carcinoma de tipo enteroide y 3 un carcinoma de tipo difuso14. El panel serológico evaluó como normal la mucosa de 3 pacientes con carcinoma gástrico (en las biopsias, 2 de ellos tenían una gastritis no atrófica y uno tenía una mucosa normal) y evaluó como gastritis no atrófica 2 casos más (en las biopsias uno tenía gastritis no atrófica y el otro tenía gastritis atrófica).
DISCUSIÓN
La prevalencia de gastritis atrófica en nuestra serie de pacientes dispépticos fue del 6%, muy inferior a la prevalencia del 49-67% descrita en áreas donde la incidencia de carcinoma gástrico es alta, como Japón, China o Sudamérica15-17. Una razón que explica la menor frecuencia de gastritis atrófica en nuestra serie es que su prevalencia en el mundo occidental está disminuyendo18. Otra razón es que la prevalencia de gastritis atrófica aumenta con la edad19,20, y la edad media de los pacientes de nuestra serie era muy baja (39 ± 15,4 años).
Como era de esperar, los valores de pepsinógeno I y gastrina-17 fueron significativamente menores en los pacientes con una gastritis atrófica que en los pacientes con una mucosa normal. Por otro lado, los valores de pepsinógeno I y gastrina-17 fueron mayores en los pacientes con gastritis no atrófica que en los pacientes con una mucosa normal. Esta pequeña elevación de los valores séricos de pepsinógeno I y gastrina-17 se ha descrito en varios estudios previos10,21 y se ha atribuido a un efecto del infiltrado inflamatorio presente en la mucosa con gastritis por H. pylori.
La gastritis atrófica aumenta el riesgo de carcinoma gástrico4-6, y la presencia de infección por H. pylori en pacientes con gastritis atrófica se considera una indicación de erradicación por la conferencia de consenso de Maastricht22. En este estudio, el panel serológico que combinaba los valores séricos de pepsinógeno I y II, gastrina-17 y anticuerpos anti-H. pylori coincidió exactamente con el diagnóstico histológico en el 80,4% de los casos. En este estudio, la sensibilidad y la especificidad del panel serológico para el diagnóstico de gastritis atrófica fueron, respectivamente, del 87,5 y el 100%, resultados muy similares a los de otros estudios publicados9-12. Basándose en estos resultados, el panel serológico podría ser una herramienta útil en el cribado de gastritis atrófica en grupos grandes de pacientes. El diagnóstico serológico sería superior a la histología en dos aspectos: a) evitaría en muchos casos la necesidad de realizar endoscopia, ahorrando costes y evitando molestias a los pacientes, y b) proporcionaría una evaluación del estado de toda la mucosa, evitando así el error de muestreo inherente a la toma de biopsias.
Hay controversia respecto a la utilidad de la erradicación de H. pylori para prevenir la aparición de cáncer gástrico una vez que el paciente ha desarrollado una gastritis atrófica23-25. Aun así, el diagnóstico serológico de gastritis atrófica tendría repercusiones prácticas. En primer lugar, haría recomendable la realización de una endoscopia alta para descartar enfermedades orgánicas graves que se asocian a gastritis atrófica, como la úlcera gástrica o el carcinoma gástrico. En segundo lugar, serviría para identificar un subgrupo significativo de pacientes con riesgo elevado de carcinoma gástrico. A pesar de ello, el panel serológico no debe considerarse un método de cribado del cáncer gástrico. En nuestro estudio el panel serológico no habría detectado 4 de los 9 casos de carcinoma gástrico, ya que se originaron sobre una mucosa no atrófica (3 casos) o incluso sobre una mucosa no inflamada (un caso). El pequeño número de casos de cáncer en nuestro estudio no permite extraer conclusiones sobre la frecuencia con la que el carcinoma gástrico aparece en una mucosa no atrófica. Sin embargo, algunos estudios recientes26 demuestran que en los países occidentales hasta un 40% de los carcinomas gástricos aparecen en pacientes sin evidencia de infección por H. pylori, y un 23% en pacientes con una mucosa gástrica normal.
Una pregunta importante respecto al uso de panel serológico en pacientes dispépticos es si presenta un valor añadido sobre los métodos diagnósticos no invasivos de H. pylori, como el test del aliento con urea-C13 o el test del antígeno fecal. En la estrategia test and treat se erradica la infección de todos los pacientes dispépticos que son H. pylori-positivos con uno de estos métodos27,28. Es bien conocido el hecho de que el rendimiento de las pruebas diagnósticas de H. pylori disminuye en presencia de una atrofia gástrica29. Por tanto, es muy probable que algunos casos H. pylori-negativos en los tests no invasivos fueran diagnosticados de gastritis atrófica por el panel serológico. De hecho, en este estudio hubo 2 casos negativos para H. pylori con todos los métodos usados (histología, ureasa y serología) que, sin embargo, presentaban carcinoma gástrico y gastritis atrófica en la histología y en el panel serológico (tabla III, casos 2 y 6). Por ello, creemos que hacen falta estudios con un mayor número de pacientes dispépticos para valorar el beneficio adicional que el panel serológico puede aportar sobre los métodos no invasivos de diagnóstico de infección por H. pylori, especialmente si se emplea la estrategia test and treat.
En conclusión, el panel serológico es un método con una gran sensibilidad y especificidad para el diagnóstico no invasivo de gastritis atrófica. Sin embargo, ha de tenerse en cuenta que el panel serológico no es un método de cribado del cáncer gástrico, ya que no es capaz de detectar los casos de carcinoma gástrico que se originan en un estómago no atrófico. Son necesarios estudios con un gran número de pacientes dispépticos para dilucidar si el panel serológico puede tener un valor añadido sobre los tests no invasivos de H. pylori, especialmente si se emplea la estrategia test and treat.
AGRADECIMIENTO
Este estudio ha sido financiado con la beca n.o 03015-00 de la Consejería de Sanidad, de la Junta de Comunidades de Castilla-La Mancha.