Drug-induced liver injury (DILI) es el término empleado para designar las lesiones hepáticas inducidas por fármacos. Su incidencia real es desconocida, considerándose minoritaria su notificación. Se estima que es responsable del 4-10% de ingresos hospitalarios por ictericia.
Se presenta el caso de una mujer de 78 años ingresada por ictericia. Antecedentes personales de HTA, insuficiencia mitral y aórtica grado II, dislipemia, hipotiroidismo y fibrilación auricular paroxística recurrente. Mantenía tratamiento con imidapril, bisoprolol, pravastatina, acenocumarol, levotiroxina y lansoprazol; y en los últimos 6 meses había iniciado tratamiento con dronedarona. En los dos últimos años, fosfatasa alcalina y GGT estaban elevadas menos de 2 veces el valor superior normal.
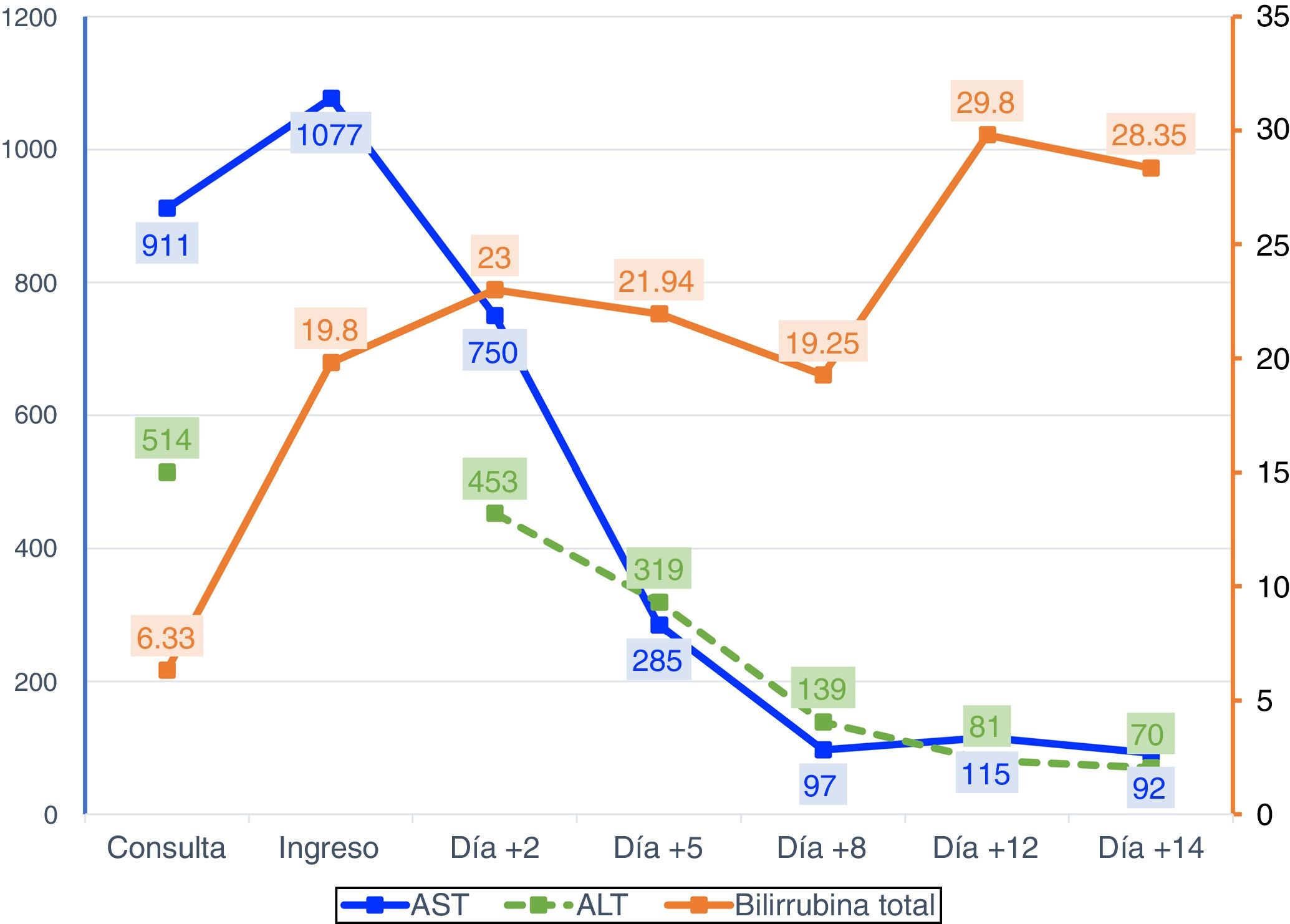
Dos semanas antes del ingreso, presentó astenia, anorexia y dolor en epigastrio. Acudió a consulta de Digestivo, remitida previamente por diarrea, aportando analítica con elevación de transaminasas. Una semana después, apareció ictericia y coluria sin prurito ni fiebre, por lo que acudió a urgencias. En la analítica urgente destacaba elevación de AST (1284 U/l) y de bilirrubina total (13,6mg/dl). La ecografía abdominal era normal. A los dos días de ingreso, la analítica hepática mostraba AST 750 U/l, ALT 453 U/l y BT 23mg/dl. En la analítica solicitada en consulta destacaba un aumento de gammaglobulina a expensas de IgG, ANA + 1/320 y anticuerpos antiperoxidasa tiroideos +; se descartaban hepatitis agudas virales y enfermedad de Wilson. Por sospecha de hepatitis autoinmune, se inició tratamiento con corticoides. Cuatro días después, se evidenció ligera mejoría de bilirrubina y transaminasas, pero desarrolló encefalopatía grado I e hiponatremia que mejoraron con albúmina, lactitol y rifaximina. A los diez días de estancia hospitalaria aumentó el grado de encefalopatía hepática, asociado a ascitis moderada sin signos ecográficos de hipertensión portal (fig. 1). No considerando el trasplante por edad avanzada, a los 18 días de ingreso se produce el éxitus tras un episodio de hematemesis. Tras obtener el consentimiento de los familiares, se realiza biopsia hepática posmortem, con resultado de hepatitis de patrón mixto citolítico y colestásico sugestivo de etiología tóxico-medicamentosa (fig. 2).
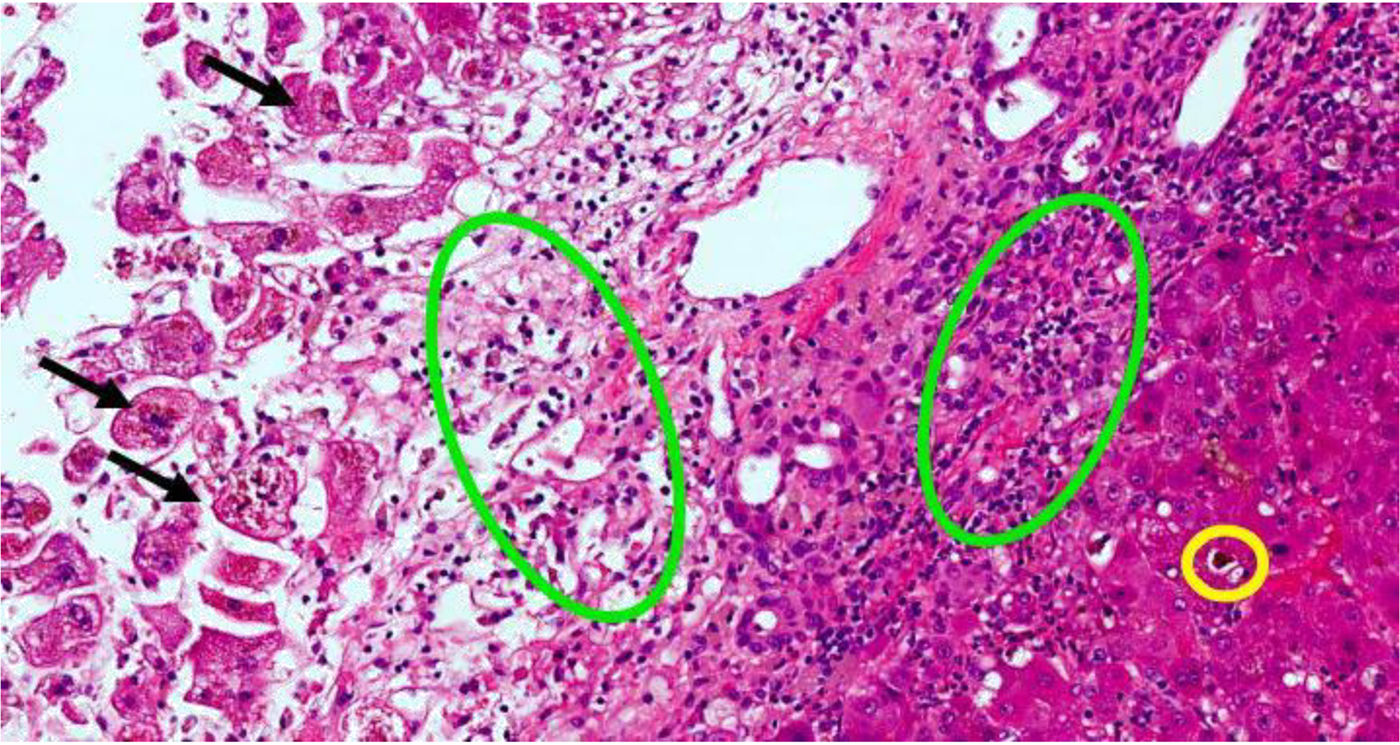
Biopsia hepática con hepatitis con patrón mixto citolítico y colestásico. Flechas negras son hepatocitos necróticos a nivel centrolobulillar. Círculos verdes indican áreas de colestasis. Círculo amarillo señala infiltrado inflamatorio de polimorfonucleares (neutrófilos) y eosinófilos. Los colores de la figura solo pueden apreciarse en la versión electrónica del artículo.
La expresión clínica de DILI es variada, desde formas asintomáticas hasta hepatitis aguda y fallo hepático fulminante. Para el diagnóstico de DILI por dronedarona, se consideró temporalidad, se descartaron otras etiologías, así como resto de medicamentos concomitantes1 y se aplicó la escala de causalidad fármaco-DILI (CIOMS) que tuvo como resultado «posible DILI». La paciente cumplía todos los factores de riesgo para fallo hepático fulminante asociado a DILI: daño hepatocelular, sexo femenino, altos niveles de BT y elevada ratio AST/ALT2. Inicialmente, considerando la presencia de ANA e hipergammaglobulinemia, se planteó el diagnóstico diferencial con hepatitis autoinmune inducida por fármacos (DIAIH), en cuyo caso dronedarona actuaría como desencadenante de enfermedad hepática autoinmune previa desconocida. Sin embargo, la no mejoría con corticoides así como los resultados de la biopsia hepática, eran compatibles con un origen medicamentoso asociado a autoanticuerpos, hecho ya descrito en otros casos de DILI por nitrofurantoína, minociclina, α-metildopa, hidralazina, diclofenaco, estatinas y algunos anti-TNFα3. La relación entre DILI y AIH puede ser muy estrecha, con diferentes escenarios clínicos, que es necesario aclarar en cada caso4.
Dronedarona, antiarrítmico de clase III, está indicada para el mantenimiento del ritmo sinusal tras cardioversión efectiva en pacientes con fibrilación auricular paroxística o persistente. Se trata de un derivado benzofurano no yodado relacionado estructuralmente con amiodarona. La ausencia de átomos de yodo tiene como objetivo reducir al mínimo la aparición de efectos adversos en órganos no diana, como tiroides. La adición del grupo metilsulfonamida persigue reducir la lipofilia y por lo tanto el potencial neurotóxico5.
Sin embargo, tras su autorización, se han notificado a nivel mundial casos de alteraciones de la función hepática y daño hepatocelular, lo que llevó a la EMA a la reevaluación del beneficio-riesgo de dronedarona, y a la emisión de nuevas recomendaciones de uso6. Su mecanismo de hepatotoxicidad aún no está claro. Probablemente sea similar al de amiodarona, inhibición de la beta-oxidación mitocondrial y desacoplamiento de la fosforilación oxidativa que conduce a la lesión celular. Tampoco puede descartarse la implicación de N-desbutil-dronedarona, su principal metabolito, así como su potencial inhibidor del citocromo P1.
En la revisión de la literatura hemos encontrado cuatro casos publicados de DILI por dronedarona7–10. Dos de ellos requirieron trasplante hepático urgente con evolución favorable7,8; en ambos, el fallo hepático se manifestó a los cinco o seis meses de comenzar el tratamiento con dronedarona, al igual que en el caso presentado. Un caso se expresó a los cuatro días del inicio del tratamiento, con malestar general, náuseas, dolor abdominal y vómitos, requiriendo ingreso en UCI con evolución favorable tras retirada del fármaco9. El cuarto caso se presentó como insuficiencia orgánica multisistémica, incluyendo hepatotoxicidad aguda a los dos días de comenzar este tratamiento, y pese a suspender el fármaco, el fallo hepático se hizo irreversible y acabó en éxitus10. Puesto que la fibrilación auricular es una patología de alta prevalencia y dronedarona se plantea como fármaco de elección en ella, es necesario insistir en la vigilancia de la función hepática, que se debe evaluar antes del inicio del tratamiento, una semana después, mensualmente durante 6 meses, en los meses 9 y 12, y posteriormente de forma periódica.