La enfermedad hepática por depósito de grasa (EHDG) no asociada al consumo de alcohol puede aparecer en el contexto de múltiples afecciones, pero, sin duda, la principal asociación etiológica es con el síndrome de resistencia a la insulina (RI). En esta revisión pretendemos sistematizar el proceso diagnóstico que debe incluir los siguientes aspectos básicos: a) el diagnóstico de sospecha de la EHDG, incluyendo la verificación de la abstinencia alcohólica, la exclusión de otras causas potenciales de esteatosis hepática y el diagnóstico de las potenciales enfermedades asociadas; b) el diagnóstico de la RI; c) el diagnóstico de las potenciales enfermedades asociadas; d) una adecuada valoración del riesgo vascular de estos pacientes; e) el diagnóstico del tipo y localización de la grasa y, finalmente, f) evaluar la severidad de la EHDG, que puede obtenerse mediante técnicas invasivas y no invasivas.
Non-alcoholic fatty acid disease (NAFLD) can develop in the context of multiple processes but the main etiologic association is undoubtedly with insulin resistance syndrome. The present review aims to provide a systematic diagnostic approach that should include the following basic elements: a) a suspected diagnosis of NAFLD, including confirmation of abstinence from alcohol, exclusion of other potential causes of liver steatosis and diagnosis of potential associated diseases; b) diagnosis of insulin resistance; c) diagnosis of potential associated diseases; d) adequate evaluation of vascular risk; e) diagnosis of the type and localization of fat, and finally, f) evaluation of the severity of NAFLD, which can be performed through invasive and non-invasive techniques.
El término de esteatohepatitis no alcohólica (EHNA) fue introducido por primera vez en 1980 por Ludwig, para definir una enfermedad caracterizada por cambios histológicos similares a los observados en individuos con hepatitis alcohólica, pero en los que el consumo de alcohol era nulo o no significativo. Este término debe quedar englobado en una entidad más amplia, la enfermedad hepática por depósito de grasa (EHDG) no asociada al consumo de alcohol. Este concepto incluye la esteatosis hepática simple, la esteatohepatitis no alcohólica propiamente dicha y, finalmente, la cirrosis hepática. Dado que la EHNA se asocia prácticamente siempre con un síndrome de resistencia a la insulina (RI) y las afecciones relacionadas con ésta, se ha sugerido que se trata de la manifestación hepática del síndrome metabólico1–4. La EHDG puede aparecer en el contexto de múltiples afecciones, entre las que se incluyen el uso de algunos fármacos, la cirugía derivativa de la obesidad mórbida y algunas enfermedades de aparición infrecuente como la enfermedad de Weber-Christian o la abetalipoproteinemia. Pero, sin duda, la principal asociación etiológica de la EHDG es con el síndrome de RI, cuyos criterios diagnósticos han cambiado recientemente. De hecho, es probable que la EHDG represente el componente hepático de un síndrome metabólico que en su expresión fenotípica completa estaría caracterizado por la presencia de RI, obesidad, diabetes mellitus tipo 2 (DM2), hipercolesterolemia, hipertrigliceridemia e hipertensión arterial (HTA). Un estudio observacional de amplio tamaño muestral ha demostrado que el síndrome metabólico es un importante factor de riesgo para la aparición de EHDG en la población general5. Los mecanismos que conducen al desarrollo de esteatosis hepática y, posteriormente, a la aparición de los fenómenos inflamatorios solo se conocen de forma parcial, aunque una visión patogénica moderna aboga por la hipótesis de los múltiples estímulos paralelos6. Inicialmente, se produce un incremento de los ácidos grasos en suero debido a una liberación de éstos de los tejidos adiposos y a un aumento de la RI. Posteriormente, se produce un excesivo aporte de ácidos grasos al tejido hepático que excede las necesidades fisiológicas. Posteriormente, contribuyen señales derivadas de la grasa periférica y de la central y del intestino. Más adelante, se producen fenómenos de peroxidación lipídica, generación de grandes cantidades de radicales libres de oxígeno, liberación de citocinas y adipocinas y, finalmente, fibrosis hepática.
Varias circunstancias motivan el creciente interés por esta enfermedad: la elevada prevalencia de esta entidad en el mundo occidental, su capacidad de progresión hacia formas histológicas agresivas y la asociación con enfermedades que incrementan el riesgo vascular. Aunque no se conoce la prevalencia real de la EHDG, existe el consenso general de que esta se ha incrementado de forma notable durante los últimos años, afectando a cerca de un tercio de la población adulta en los países desarrollados. El rango de prevalencia estimada oscila entre el 3 y el 46% de la población analizada, siendo esta extraordinaria variabilidad dependiente tanto de las herramientas utilizadas para su diagnóstico como de la población objeto de estudio7–9, por lo que las cifras de prevalencia pueden fluctuar de forma considerable. En este sentido, 2 de los últimos estudios publicados, uno poblacional efectuado en cerca de 100.000 adultos coreanos no diabéticos y otro prospectivo efectuando una exploración dirigida en 400 adultos norteamericanos, han demostrado que la prevalencia de la EHDG es incluso superior de la sospechada con anterioridad, con cifras cercanas al 50% de la población adulta americana. Como era de suponer, la prevalencia fue diferente en función de algunos datos básicos como el sexo (más frecuente en hombres), la raza (más frecuente en hispanos), el peso o los niveles de HbA1c. En este segundo estudio, además, se estimó de forma prospectiva (mediante biopsia hepática de todos los sujetos con esteatosis detectada en una ecografía hepática) la prevalencia de EHNA, objetivando dicha enfermedad inflamatoria en aproximadamente el 12% de los sujetos analizados, cifra más elevada que la observada en otros estudios efectuados con anterioridad10,11. Existen datos limitados acerca de la historia natural de los enfermos con EHDG debido a la naturaleza indolente del proceso y a la ausencia de grandes estudios prospectivos. La historia natural varía según el diagnóstico histológico inicial. Los pacientes con esteatosis simple presentan un curso benigno en contraste con cerca de un 23% de pacientes con EHNA que progresan a cirrosis en un periodo de 10-15 años. Por otra parte, un 30-40% de los pacientes con EHNA tienen en el momento del diagnóstico una fibrosis avanzada. De hecho, se acepta que la cirrosis criptogénica puede representar una fase tardía de la EHDG que ha perdido el patrón necroinflamatorio y esteatósico, habiéndose implicado la EHDG como factor etiológico en hasta un 70% de casos de cirrosis criptogénica12,13. No se conoce bien por qué en la mayoría de pacientes la EHDG detiene su progresión en la etapa más inicial mientras en otros progresa hacia la EHNA y en unos pocos hacia la cirrosis. Algunos pacientes con cirrosis debido a EHDG desarrollan carcinoma hepatocelular (CHC) en un periodo de 10 años14. Además de la muerte de causa hepática, la esperanza de vida es discretamente inferior a la de los controles de población normal a igualdad de edad y sexo debido al incremento de la mortalidad cardiovascular15,16.
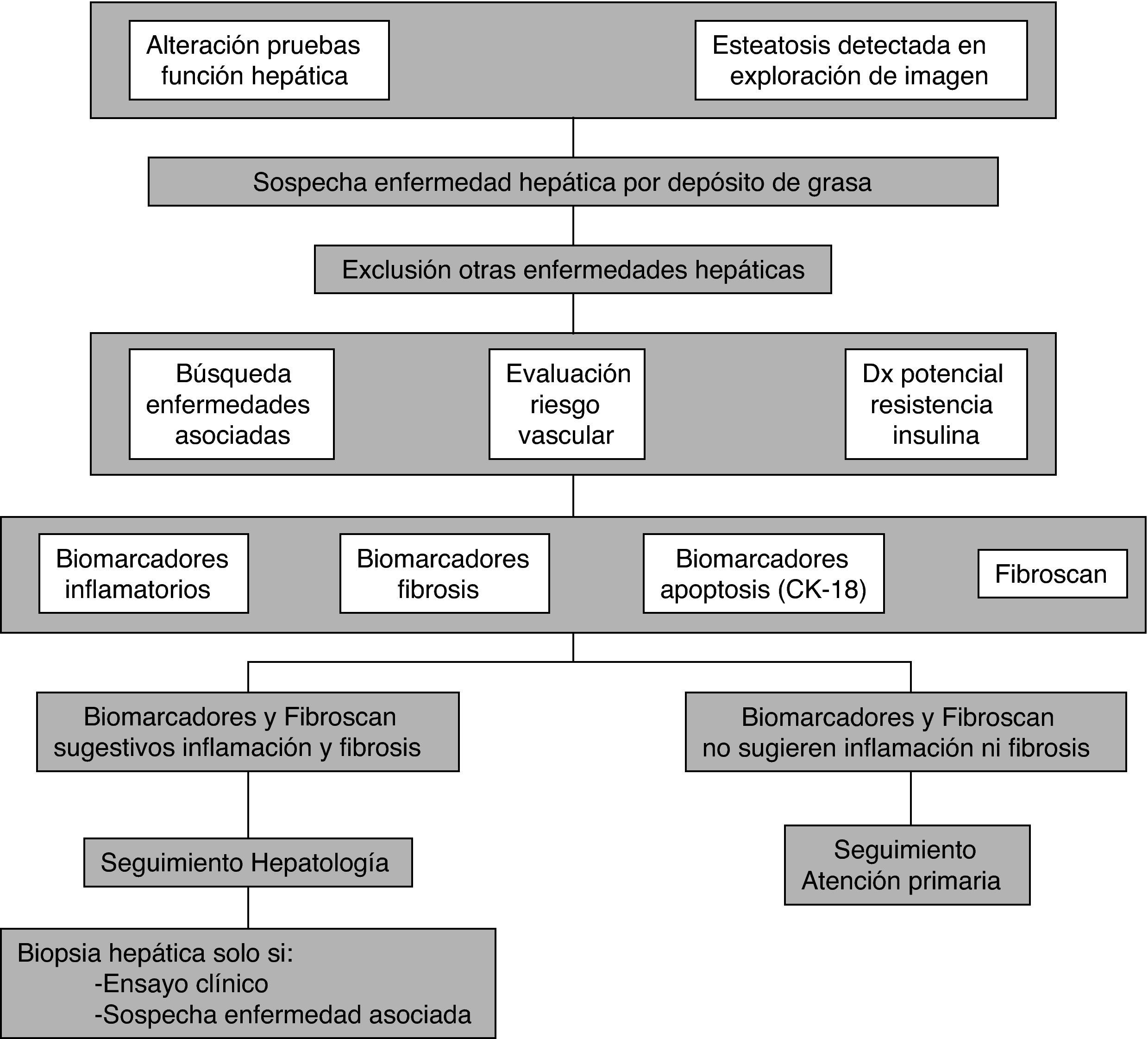
Diagnóstico de la enfermedad hepática por depósito de grasaEl diagnóstico de la EHDG se debe basar en la combinación de datos de la historia clínica y métodos de diagnóstico no invasivos. Entre éstos se incluyen biomarcadores indicativos de inflamación, apoptosis y fibrosis, métodos de imagen y elastografía de transición (FibroScan®). Tal y como comentaremos más adelante, la biopsia hepática se debe utilizar de forma restrictiva en situaciones clínicas muy particulares. Un adecuado proceso diagnóstico debe incluir los siguientes aspectos básicos: a) el diagnóstico de sospecha de la EHDG, incluyendo la verificación de la abstinencia alcohólica, la exclusión de otras causas potenciales de esteatosis hepática y el diagnóstico de las potenciales enfermedades asociadas; b) el diagnóstico de la RI; c) el diagnóstico de las potenciales enfermedades asociadas; d) una adecuada valoración del riesgo vascular de estos pacientes; e) el diagnóstico del tipo y localización de la grasa y, finalmente, f) evaluar la severidad de la EHDG, que puede obtenerse mediante técnicas invasivas y no invasivas.
Diagnóstico de sospechaLa mayoría de pacientes con EHDG están asintomáticos, estableciéndose el diagnóstico de sospecha por el hallazgo casual de una alteración de la biología hepática, una hepatomegalia o ante el hallazgo de esteatosis hepática detectada en una ecografía de rutina. Cuando aparece sintomatología, ésta es inespecífica. Una de las características definitorias de esta entidad, la ausencia de consumo de alcohol, es difícil de establecer con seguridad, motivo por el que se usan con frecuencia cuestionarios específicos o, incluso, combinaciones de datos analíticos. La analítica es, también, poco específica, siendo el hallazgo más constante una discreta elevación de las transaminasas, con un cociente GOT/GPT inferior a 1, aunque puede invertirse en fases avanzadas de la enfermedad. Ocasionalmente se observan anticuerpos antinucleares a título bajo. Es frecuente el hallazgo de una ferritina sérica elevada y un aumento de la saturación de transferrina. En adultos no diabéticos, existe una clara relación entre los niveles de HbA1c y el riesgo de EHDG, independientemente del grado de obesidad o de la existencia de otros componentes del síndrome metabólico10.
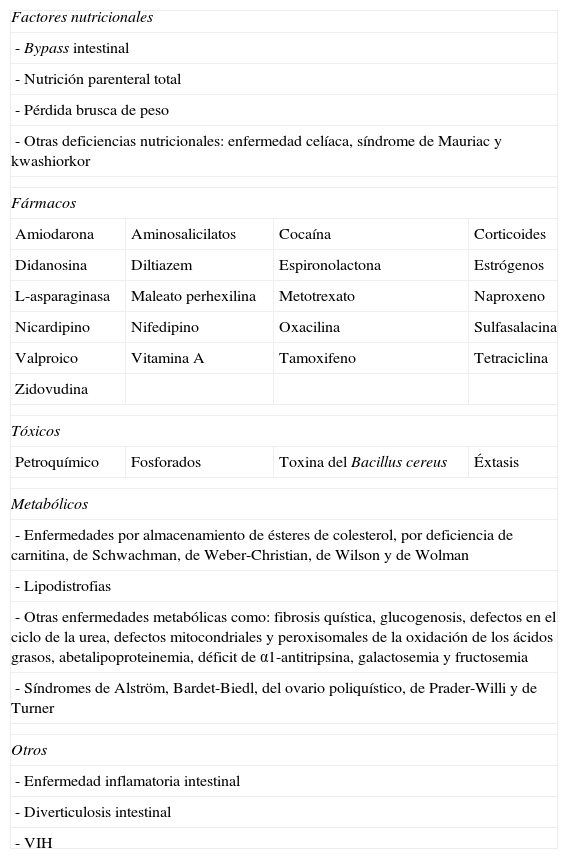
Exclusión de otras causas de enfermedadLa EHDG es una enfermedad, preferentemente de exclusión. Existen múltiples causas potenciales de EHDG secundaria, algunas de las cuales quedan reflejadas en la tabla 1.
Procesos asociados a una enfermedad hepática por depósito de grasa
| Factores nutricionales | |||
| - Bypass intestinal | |||
| - Nutrición parenteral total | |||
| - Pérdida brusca de peso | |||
| - Otras deficiencias nutricionales: enfermedad celíaca, síndrome de Mauriac y kwashiorkor | |||
| Fármacos | |||
| Amiodarona | Aminosalicilatos | Cocaína | Corticoides |
| Didanosina | Diltiazem | Espironolactona | Estrógenos |
| L-asparaginasa | Maleato perhexilina | Metotrexato | Naproxeno |
| Nicardipino | Nifedipino | Oxacilina | Sulfasalacina |
| Valproico | Vitamina A | Tamoxifeno | Tetraciclina |
| Zidovudina | |||
| Tóxicos | |||
| Petroquímico | Fosforados | Toxina del Bacillus cereus | Éxtasis |
| Metabólicos | |||
| - Enfermedades por almacenamiento de ésteres de colesterol, por deficiencia de carnitina, de Schwachman, de Weber-Christian, de Wilson y de Wolman | |||
| - Lipodistrofias | |||
| - Otras enfermedades metabólicas como: fibrosis quística, glucogenosis, defectos en el ciclo de la urea, defectos mitocondriales y peroxisomales de la oxidación de los ácidos grasos, abetalipoproteinemia, déficit de α1-antitripsina, galactosemia y fructosemia | |||
| - Síndromes de Alström, Bardet-Biedl, del ovario poliquístico, de Prader-Willi y de Turner | |||
| Otros | |||
| - Enfermedad inflamatoria intestinal | |||
| - Diverticulosis intestinal | |||
| - VIH | |||
El síndrome metabólico se puede definir como una asociación compleja de factores de riesgo vascular asociados con una dieta hipercalórica rica en grasa, inactividad física, obesidad abdominal y envejecimiento. Aunque existen múltiples alteraciones metabólicas secundarias a este síndrome, son prácticamente constantes la RI, el incremento en la disponibilidad de ácidos grasos libres y la profunda alteración del perfil de adipocinas en la grasa visceral con disminución de adipocinas protectoras como la adiponectina e incremento de otras con perfil inflamatorio como la leptina17. La RI es un factor patogénico fundamental del síndrome metabólico, pero ambos conceptos no son intercambiables, siendo uno de los problemas fundamentales la ausencia de criterios diagnósticos uniformes. En este sentido, la OMS estableció como criterio fundamental para definir el síndrome en 1999 la presencia de DM, intolerancia a la glucosa, alteración de la glucemia en ayunas o, en el caso de que el individuo tenga una tolerancia normal a la glucemia se exige demostrar la existencia de RI. Además de este criterio fundamental el paciente debe tener al menos 2 de los criterios apuntados en la parte superior de la tabla 2. Por otro lado, en EE.UU. en 2001 el National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP III) estableció unos criterios fácilmente utilizables en la clínica habitual, dado que no exigen la demostración de RI. Estos criterios también se exponen en la tabla 2. Durante el año 2005, la International Diabetes Federation (IDF) estableció como criterio fundamental para diagnosticar síndrome metabólico la obesidad central (tabla 2). Finalmente, durante el año 2009 se llegó a un consenso entre las principales sociedades científicas involucradas en el estudio del síndrome metabólico, en el que la característica fundamental fue que la obesidad central pasa de ser un requisito imprescindible en la definición de síndrome metabólico a ser un requisito más. Estos criterios se exponen en la tabla 218.
Criterios diagnósticos de síndrome metabólico
| A) Criterios diagnósticos del síndrome metabólico según la OMS 1999 |
| Criterio fundamental: diabetes mellitus, intolerancia a la glucosa, alteración de la glucemia en ayunas o, si el individuo tiene una tolerancia normal a la glucemia, resistencia a la insulina demostrada, más 2 de los siguientes: |
| 1. HTA en tratamiento o sin tratar >160/90mmHg |
| 2. Dislipidemia: Tg > 150mg/dl, HDL < 35mg/dl en hombres o < 40 en mujeres |
| 3. Obesidad general (IMC > 30kg/m2) o visceral (índice cintura abdominal/cadera > 0,9 en varones o > 0,85 en mujeres) |
| 4. Microalbuminuria > 30mg de albúmina/g de creatinina |
| B) Criterios diagnósticos de síndrome metabólico según el National Cholesterol Education Program Adult Treatment Panel III (NCEP-ATP III). No existe criterio prioritario |
| 1. Obesidad abdominal (cintura abdominal > 102cm en hombres o 88cm en mujeres) |
| 2. Triglicéridos superiores a 150mg/dl |
| 3. HDL < 40mg/dl en hombres o 50mg/dl en mujeres |
| 4. Presión arterial > 130/85mmHg |
| 5. Glucosa basal > 110mg/dl |
| C) Criterios diagnósticos de la International Diabetes Federation (IDF) 2005 |
| Criterio fundamental: obesidad central, definida como cintura abdominal > 94cm para varones y > 80cm para mujeres de origen europeo y además 2 de cualquier otro de estos factores: |
| 1. Triglicéridos elevados (de al menos 150mg/dl) o tratamiento específico para esta anomalía lipídica |
| 2. Colesterol HDL bajo (inferior a 40mg/dl en varones e inferior a 50mg/dl en mujeres), o tratamiento específico para esta anomalía lipídica |
| 3. Presión arterial elevada: sistólica de al menos 130mmHg, diastólica de al menos 85mmHg o tratamiento antihipertensivo en pacientes previamente diagnosticados |
| 4. Glucemia plasmática en ayunas elevada (de al menos 100mg/dl) o diabetes mellitus tipo 2 previamente diagnosticada) |
| Nuevos criterios diagnósticos del síndrome metabólico |
| Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity18 |
| - Obesidad central, definida en función del grupo étnico (cintura abdominal > 94cm para varones y > 80cm para mujeres de origen europeo). NO es criterio imprescindible, es un criterio más |
| - Triglicéridos elevados (de al menos 150mg/dl) o tratamiento específico para esta anomalía lipídica |
| - Colesterol HDL bajo (inferior a 40mg/dl en varones e inferior a 50mg/dl en mujeres), o tratamiento específico para esta anomalía lipídica |
| - Presión arterial elevada: sistólica de al menos 130mmHg, diastólica de al menos 85mmHg o tratamiento antihipertensivo en pacientes previamente diagnosticados |
| - Glucemia plasmática en ayunas elevada (de al menos 100mg/dl) o diabetes mellitus tipo 2 previamente diagnosticada) |
Se considera que existe RI cuando una cantidad normal de esta hormona produce una respuesta biológica inferior a la esperada. A nivel celular, esta resistencia puede deberse a una disminución de la sensibilidad a la insulina, a una sensibilidad a la insulina normal pero con disminución de la capacidad de respuesta máxima o a una combinación de ambos fenómenos. La técnica de referencia para su diagnóstico es el pinzamiento euglucémico hiperinsulinémico19, aunque este procedimiento es caro y complejo, por lo que no se utiliza de forma sistemática en la clínica diaria. La sensibilidad a la insulina también puede estimarse analizando las curvas de respuesta de glucosa e insulina tras la administración intravenosa de un bolo de glucosa. Existen varios modelos que se basan en este principio, siendo el más utilizado el modelo mínimo del metabolismo de la glucosa. Frente a estos modelos mínimos, se han desarrollado otras formas de medición de la RI basadas en las cifras basales de glucosa, insulina y/o péptido C, entre las cuales se encuentran el Homeostatic Model Assessment (HOMA), el HOMA1 y el HOMA IR. Un derivado del HOMA, el Quantitative Insulin Sensitivity Check Index (QUICKI) usa el logaritmo del producto de insulina x glucosa=1 / [log (insulina x glucosa)]20,21.
Diagnóstico de las potenciales enfermedades asociadasLa EHDG se asocia a múltiples enfermedades, entre las que destacan las relacionadas propiamente con el síndrome metabólico. En este sentido, se debe prestar una especial atención a la existencia de una DM, HTA, hiperlipidemia (particularmente una dislipidemia aterogénica con incremento de las concentraciones de triglicéridos y disminución de los valores de HDL) y obesidad. Además, cada día se reconocen más entidades capaces de inducir o asociarse con una EHDG, como la psoriasis, cuya asociación se ha descrito recientemente, o la apnea obstructiva del sueño, cuya severidad es paralela a la de la EHDG22,23. De hecho, la gravedad del síndrome de apnea obstructiva del sueño se ha postulado como un factor predictivo de fibrosis en los sujetos con EHDG24. El hecho de que sea una enfermedad de relativamente reciente descripción hace que el número de enfermedades potencialmente asociadas se incremente cada día, aunque existe una notable dificultad para diferenciar entre entidades realmente asociadas o enfermedades que coexisten dado que presentan factores etiológicos comunes. En este sentido, en el último congreso de la AASLD celebrado en octubre del 2010 en Boston, se ha comunicado el incremento de enfermedad renal crónica en los sujetos con EHDG o el aumento en la prevalencia de adenomas de colon tanto en mujeres como en hombres, lo que pudiera tener consecuencias de cara a un cribado del cáncer colorrectal en este amplio colectivo de sujetos25.
Valoración del riesgo vascularLa EHDG y, fundamentalmente, la EHNA, se puede considerar una enfermedad inflamatoria sistémica de bajo grado. Del mismo modo, la aterosclerosis también se considera una enfermedad inflamatoria de bajo grado; una y otra comportan múltiples mecanismos patogénicos. Varios estudios prospectivos que analizan la asociación entre la EHDG y la incidencia de eventos cardiovasculares mayores han demostrado un claro incremento del riesgo de eventos cardiovasculares tanto mortales como no mortales independiente de otros factores de riesgo vascular clásicos como edad, sexo, perímetro abdominal, HTA, etc.26–29. En la cohorte incluida en el estudio NAHNES III compuesta por 15.866 pacientes, de los cuales 2.862 presentaban una hepatopatía crónica, se ha demostrado que la DM2 y la RI eran predictores independientes de mortalidad global y de mortalidad relacionada con la enfermedad hepática en los pacientes con una hepatopatía crónica, no solo por grasa sino también de etiología viral o alcohólica15. Por otro lado, como ya mencionamos con anterioridad, los escasos trabajos que nos ilustran acerca de la historia natural de la enfermedad, demuestran que la principal causa de muerte en estos pacientes es la cardiovascular, pasando la causa de muerte hepática de la decimotercera en la población general a la tercera en este subgrupo de pacientes30.
Aunque los hepatólogos no estamos familiarizados con la búsqueda de factores de riesgo vascular para detectar la aterosclerosis subclínica, dado que la EHDG se caracteriza por el incremento del riesgo vascular, creemos que se debe prestar especial atención a este aspecto. En este sentido, entre las nuevas técnicas para la detección de la aterosclerosis subclínica, las más útiles son la medición del índice tobillo-brazo (ITB), la ecografía carotídea, la tomografía computarizada (TAC) y la resonancia magnética (RNM) de alta resolución31 para la detección de placas ateromatosas. Todas estas exploraciones son incruentas, y algunas de ellas muy sencillas de realizar, caso de la ecografía carotídea y el ITB. Estas exploraciones son especialmente útiles para pacientes con riesgo cardiovascular intermedio, situación en la que se encuentran una parte muy importante de la población con una EHDG32,33. Por otro lado, el riesgo de aterosclerosis acelerada también depende de otros factores como la disfunción endotelial o la liberación de moléculas inflamatorias proaterogénicas y procoagulantes. Además, se han descrito múltiples alteraciones del perfil lipídico. La disfunción endotelial es un paso inicial del desarrollo de la aterosclerosis; ésta puede definirse como una capacidad deteriorada de la arteria para dilatarse en respuesta a estímulos físicos y químicos, debido a la reducción de la liberación o a la mayor degradación del óxido nítrico (ON). La disfunción endotelial puede determinarse con facilidad de modo no invasivo valorando la vasodilatación mediada por flujo (FMD) después de la oclusión de la arteria braquial, usando ecografía de alta resolución. En la EHDG se ha descrito una disminución de la reactividad de la arteria braquial mediada por flujo, que es más intensa en los pacientes con EHNA34; un incremento del espesor de la íntima-media carotídea directamente proporcional al estadio de la EHNA e independiente de los factores de riesgo vascular clásicos35, un incremento del número de placas tanto calcificadas como no calcificadas en las coronarias36–38 o una disfunción diastólica en pacientes con HTA en relación con la severidad de la EHNA. Además, se ha documentado una elevación de la concentración plasmática de algunos factores proinflamatorios y proaterogéncios como la PCR ultrasensible, el PAI1 y el fibrinógeno o una disminución de adipocinas antiinflamatorias como la adiponectina39. Estos últimos resultados están ajustados en función de la grasa visceral, lo cual parece indicar que la enfermedad hepática desempeña un factor aterogénico independiente.
Por lo tanto, podemos concluir que la EHDG se asocia a un incremento del riesgo vascular, y que este incremento es primario e independiente de la asociación con el síndrome metabólico u otros factores de riesgo vascular presentes en estos pacientes. Sin que hasta el momento se puedan sacar conclusiones definitivas, cabe la posibilidad de que la EHNA no sea solo un marcador de enfermedad cardiovascular sino que esté involucrada en su patogenia. La demostración de que la grasa intrahepática, y no la visceral, se asocia con las complicaciones metabólicas de la obesidad y que el hígado es clave en la regulación del metabolismo lipídico y de la glucosa, éste debe ser considerado como uno de los factores iniciadores del síndrome metabólico más que su diana40–42.
Diagnóstico del tipo y la localización de la grasaEl tipo y la distribución corporal de la grasa tienen un papel clave en la patogenia de esta enfermedad. La pregunta clave es cuál es la capacidad de tejido adiposo subcutáneo (sensible a la insulina) para captar lípidos plasmáticos y almacenar energía. Si el tejido es sensible a la insulina, se produce una acumulación preferencial de energía en grasa periférica y glúteo/femoral (obesidad ginoide) que permite mantener un perfil metabólico normal. Por le contrario, si la grasa no es sensible a la acción de la insulina (obesidad tipo androide), se produce un depósito preferencial de grasa en las vísceras que conduce a una alteración metabólica severa43. Aunque el incremento de la grasa visceral se considera el marcador más sensible del síndrome metabólico, y por lo tanto se presenta en un gran número de pacientes con EHDG, no existe una clara relación entre el perímetro abdominal y el riesgo de desarrollo de fibrosis en paciente con EHDG, lo que indica que una vez que existe una EHDG, la presencia de grasa visceral no es un factor determinante de la severidad del daño hepático44,45. Pero además de la distribución corporal de la grasa, la propia distribución e intensidad de la acumulación de grasa en el interior del hepatocito (lo que podríamos denominar lipidograma hepatocitario) es un factor clave en el desarrollo de esta entidad. De forma concisa, podríamos decir que un depósito preferencial de triglicéridos es beneficioso para el hepatocito mientras que la acumulación de ácidos grasos libres condiciona fenómenos de lipotoxicidad. El depósito de colesterol libre, aunque poco importante desde el punto de vista cuantitativo, puede ejercer un efecto patogénico de primer orden46.
Marcadores clínicos y serológicos indicativos de esteatohepatitis no alcohólicaLa elevada prevalencia de la EHDG en la población general hace absolutamente inviable la práctica de una biopsia hepática de forma sistemática en todos los pacientes afectados de esta enfermedad. Por este motivo, durante los últimos años se han evaluado múltiples marcadores clínicos, antropométricos y serológicos útiles en el diagnóstico diferencial entre esteatosis hepática simple y EHNA, con o sin fibrosis asociada. Entre los factores clínicos que se asocian a progresión de la enfermedad se encuentran: edad > 50 años, GPT > x 2, GOT > GPT, triglicéridos > 1,7 mmol, HTA, RI marcada, obesidad central, IMC > 31 y/o DM247,48. Otros factores pronósticos son la existencia de hipoadiponectinemia, un cociente HOMA/adiponectina elevado, una historia familiar de EHDG y la presencia de elevada actividad necroinflamatoria en la biopsia hepática. La relación GOT/GPT > 1 presenta un valor predictivo positivo de cirrosis del 89% (en ausencia de consumo de alcohol) aunque no es útil para predecir los grados leves de fibrosis. Otros marcadores indirectos que se asocian a la presencia de fibrosis son la edad superior a 45 años, la presencia de DM2, una marcada RI, trombocitopenia y elevación del el ácido hialurónico49. Asimismo, se han relacionado con la fibrosis, la HTA, la hiperferritinemia, una marcada hipertrigliceridemia, la historia familiar de EHNA o de cirrosis criptogenética, la obesidad central, un IMC superior a 31 y un cociente HOMA/adiponectinemia elevado47,48. Los niveles séricos de endotelina-1 también se relacionan con el grado de fibrosis50. Por otro lado, la fibrosis hepática se puede predecir mediante la estimación de parámetros directamente relacionados con la fibrogénesis, solos o en combinación. Entre estos productos destacan enzimas implicadas en la síntesis (TGF-beta, colágeno I, III y IV, ácido hialurónico, elastina, laminina, undulina) y degradación del colágeno (metaloproteinasas, inhibidores de las metaloproteinasas, propéptido N-terminal del colágeno tipo III, propéptido carboxiterminal del colágeno II y IV, ridinolina, telopéptido carboxiterminal del colágeno I), proteínas de la matriz extracelular, moléculas resultantes del metabolismo del colágeno y citocinas profibrogénicas51. En nuestra experiencia, la fibrosis es más frecuente en sujetos mayores de 45 años, con cociente GPT/GPT >1 y con 3 o más criterios de síndrome metabólico52. El test individual de mayor valor predictivo es el ácido hialurónico, evaluado en pacientes con EHDG52. La laminina ha demostrado un excelente valor diagnóstico de fibrosis en los sujetos con NASH, sobre todo si los resultados se combinan con los obtenidos con el colágeno tipo IV. Otros marcadores como el colágeno tipo IV o el TGF-beta también pueden ser útiles53.
Diagnóstico de la enfermedad hepática por depósito de grasa mediante paneles de marcadoresLa combinación de marcadores serológicos y biomarcadores en modelos matemáticos ha mejorado la sensibilidad de los tests individuales. El FibroTest ha sido uno de los primeros modelos para la predicción del grado de fibrosis, que presenta aceptables valores predictivos positivo y negativo. La necesidad de pago para su cálculo y la utilización de marcadores que generalmente no se utilizan en la práctica diaria disminuyen su utilidad. Los índices de APRI y Forns comparten la utilización de variables comúnmente utilizadas en la práctica diaria para elaborar sus modelos predictivos pero se han desarrollado para pacientes con hepatitis por VHC. El índice del European Liver Fibrosis Group (ELF) valora la combinación de los niveles de AH, PIIINP, TIMP-1 y la edad. La sensibilidad para la detección de fibrosis significativa (> F2-F4) es del 90%, resultados recientemente validados54. Angulo et al55 han diseñado y validado otro modelo matemático basado en parámetros sistemáticos de laboratorio y variables clínicas habituales en la práctica clínica55. Aplicando este modelo, la biopsia hepática podría evitarse en el 75% de los casos. Finalmente, una revisión sistemática de los marcadores no invasivos asociados a fibrosis significativa en los pacientes con una EHDG identificó como variables independientes la DM, la edad, el HOMA-IR elevado, el cociente GOT/GPT elevado, las plaquetas disminuidas, el ácido hialurónico y el IMC.
Marcadores serológicos capaces de diferenciar entre esteatosis hepática simple y esteatohepatitis no alcohólicaAdemás de los marcadores que son capaces de detectar la presencia de fibrosis, en los últimos años se han evaluado diferentes biomarcadores (solos o agrupados en paneles) útiles para diferenciar entre pacientes con esteatosis hepática simple y, por lo tanto, con escasa capacidad de progresión, de aquellos pacientes con EHNA, independientemente de la presencia o ausencia de fibrosis. En este sentido, el análisis de los fragmentos de la citoqueratina 18 (CK-18), un marcador de apoptosis, ha demostrado una clara utilidad para diferenciar entre los sujetos con esteatosis simple de aquellos con EHNA, con una elevada sensibilidad y especificidad56. Además, la concentración sérica de la CK-18 se correlaciona, de forma moderada, con los cambios histológicos en la actividad de la EHNA57. Tanto la PCR ultrasensible como la petraxina 3 ayudan en la diferenciación entre EHDG y el EHNA, aunque también se pueden elevar en otras enfermedades caracterizadas por un estado inflamatorio crónico58,59.
También se han analizado diferentes combinaciones de variables clínicas y analíticas para el diagnóstico de EHDG y EHNA. Entre ellas destacan el SteatoTest y el NashTest (Biopredictive) comercializados en España por el grupo Ferrer. El NashTest incluye 13 parámetros (edad, sexo, IMC, colesterol, triglicéridos, GOT, GPT, GGT, bilirrubina, alfa 2 microglobulina, haptoglobina y apolipoproteína A1) que presenta una extraordinaria especificidad, aunque su sensibilidad es discreta. En el último congreso de la AASLD se ha demostrado una elevada concordancia entre el FibroTest y la existencia de fibrosis F3-F4 (r: 0,82, p < 0,0001) y una sensibilidad del SteatoTest superior al 90% en pacientes incluidos en un ensayo clínico, lo que pudiera disminuir la necesidad de biopsias incluso en pacientes muy seleccionados60,61. Otro modelo, que combina 5 variables (edad > 50; GOT > 45; IMC > 30; relación GOT/GPT > 0,8; ácido hialurónico > 55) predice la presencia de EHNA con elevada fiabilidad siempre que estén presentes 3 o más de estos factores62. Shimada et al63 han desarrollado otro modelo predictivo de EHNA en pacientes con esteatosis hepática basándose en la combinación de adiponectina, HOMA-IR y colágeno sérico de tipo IV; quizás el dato más interesante de este estudio es la posibilidad de establecer un diagnóstico precoz, ya que es capaz de detectar a cerca del 90% de los pacientes con EHNA63. En pacientes obesos, un sencillo score clínico (incluyendo HTA, DM2, SAOS, GOT > 27 UI/l, GPT > 27 UI/l y raza no negra) es capaz de predecir la presencia de EHNA en los pacientes obesos con una EHDG64. Finalmente, un test denominado NALFD Diagnostic Panel y publicado muy recientemente65, combinando variables clínicas y de laboratorio, y que presenta 3 variantes (modelo predictivo de EHNA, modelo predictivo de EHNA con cualquier grado de fibrosis y modelo predictivo de EHNA con fibrosis avanzada) también ha demostrado una excelente área bajo la curva tanto en la vertiente de EHNA (0,81) como de EHNA y fibrosis (0,80) y de EHNA con fibrosis avanzada (0,81).
Genómica y ciencias relacionadas: potencial utilidad en la esteatosis hepática no alcohólicaLa prevalencia de la EHDG y de la EHNA se ha incrementado de forma considerable en los últimos años como consecuencia de cambios profundos en nuestro estilo de vida. Sin embargo, existen claras diferencias en la prevalencia de la enfermedad en función de la raza, lo sugiere que además de los factores ambientales, algunos factores genéticos tienen un papel clave en la patogenia de la enfermedad. En efecto, se ha descrito sobreexpresión de algunos genes involucrados en la RI como el ENPP1, el IRS-1 o el PNPLA3; incluso relacionándolo con la severidad de la lesión hepática66–70. En este sentido, un reciente GWAS publicado en Gastroenterology ha demostrado la asociación entre algunos polimorfismos genéticos y el riesgo de desarrollo de formas avanzadas de esteatosis hepática, aunque los resultados se deben confirmar71. Aunque no se conoce con certeza el papel que el exceso de hierro puede desempeñar en la EHDG, se ha observado que las mutaciones del gen HFE se asocian a formas más avanzadas de EHDG72,73. Probablemente, en el futuro, algunos perfiles genéticos nos ayudarán a predecir el riesgo de la EHDG, aunque en la actualidad estamos lejos de intuirlo. El análisis simultáneo de la expresión de los miles de ARN mensajeros presentes en la célula (transcriptómica), el estudio de todas las proteínas presentes en una célula concreta en un momento determinado (proteómica) o el análisis detallado del estado metabólico de fluidos y preparados tisulares (metabolómica) podrán suministrar información relevante en el futuro, aunque ya empezamos a vislumbrar algunos resultados74,75.
Diagnóstico no invasivo de la enfermedad hepática por depósito de grasa mediante métodos de imagenLa ecografía es la técnica de imagen más utilizada en el diagnóstico de la esteatosis hepática, observándose un aumento de la ecogenicidad hepática que confiere al hígado un aspecto brillante. Esta técnica permite el diagnóstico de esteatosis con una elevada fiabilidad aunque es poco útil para precisar el estadio evolutivo de la enfermedad, es decir, el grado de fibrosis, aunque la utilización de nuevas técnicas ha mejorado la sensibilidad en el diagnóstico de cirrosis. Tanto la TAC como la RNM permiten evaluar con una precisión discretamente más elevada la presencia de esteatosis, aunque son claramente más costosas76. Pero sin duda, la técnica no invasiva que permite efectuar una aproximación más fiel al grado de fibrosis es, en la actualidad, la elastografía transitoria. La rapidez, fiabilidad y el gran volumen de tejido hepático analizado son sus principales ventajas. El FibroScan® tiene limitaciones en su realización como son la presencia de obesidad, espacios intercostales estrechos y ascitis. Un amplio estudio prospectivo objetivó que un IMC mayor de 28kg/m2 era el único factor independiente asociado con fallo de la exploración para la identificación de fibrosis. Por desgracia, este hallazgo es la norma en pacientes con EHDG77. En la EHDG falta determinar la posible interferencia sobre los resultados del depósito masivo de grasa en el hígado y su aplicabilidad en pacientes con EHDG y obesidad mórbida, si bien valores de elasticidad de 10kPa o superiores mostraron una sensibilidad del 88% y una especificidad del 72% para el diagnóstico de fibrosis significativa, incluso en pacientes con IMC > 40. La combinación de elastografía y resonancia en contraste de fases pudiera resolver las limitaciones de la elastografía de transición. El análisis digitalizado de la preparación histológica o el análisis informático de las imágenes de la TAC pueden predecir la fibrosis avanzada. Un artículo recientemente publicado en Journal of Hepatology revisa en profundidad estos aspectos77.
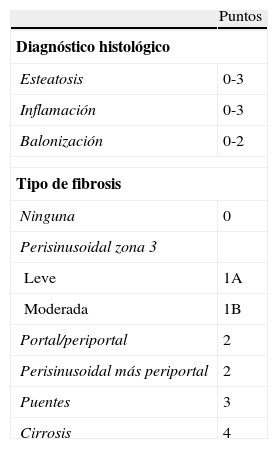
Diagnóstico histológico de la enfermedad hepática por depósito de grasaUna vez que se ha producido el diagnóstico de EHDG, dos son las preguntas clave: primera, ¿cuál es el grado de fibrosis hepática? Y segunda, ¿qué probabilidad tiene de progresar la enfermedad? En la actualidad, se considera la biopsia hepática como el método más eficaz para el diagnóstico de certeza de la EHDG, permitiendo establecer el diagnóstico preciso de la lesión (esteatosis, esteatohepatitis, cirrosis) y, por lo tanto, contribuye a calibrar de forma más precisa el pronóstico de la enfermedad. Tras la práctica de la biopsia se debe efectuar un estudio sistemático de la misma; en este sentido, Brunt et al publicaron en 1999 un sistema semicuantitativo para establecer el grado y estadio de la EHNA78 que fue redefinido y consensuado en el año 200579. Este índice valora el grado de esteatosis, la inflamación lobular y la balonización de los hepatocitos, siendo la fibrosis cuantificada de forma independiente (tabla 3). A pesar sus indudables ventajas, la necesidad de una biopsia es objeto de controversia. Ésta se debe a múltiples razones: 1) una probabilidad relativamente elevada de error de muestra; 2) una morbilidad y mortalidad no desdeñable, especialmente en pacientes asintomáticos, con un pronóstico en la mayoría de los casos bueno y con un tratamiento no bien establecido; 3) elevado coste económico; 4) obtención de una «foto fija», cuando la fibrosis es un proceso dinámico, y 5) quizás la razón de mayor peso es la imposibilidad, en la práctica clínica habitual, de efectuar una biopsia hepática a todos los pacientes con una sospecha de EHDG, debido al número extraordinariamente elevado de pacientes con esta enfermedad. Por estos motivos, en general es suficiente con un diagnóstico de sospecha y controlar periódicamente al paciente. Es probable que la combinación de marcadores serológicos, biomarcadores o modelos matemáticos que incluyan varias variables y métodos físicos como el FibroScan® o métodos de imagen pueda ser de gran utilidad para aumentar la exactitud diagnóstica del EHDG y del estadio de fibrosis eliminando la necesidad de biopsias hepáticas en muchos de los pacientes con la enfermedad80–82. Sin duda, las plataformas tecnológicas de genómica, proteómica y metabolómica aportarán datos imprescindibles para establecer el diagnóstico y el pronóstico de estos pacientes. Un editorial publicado durante el año 2009 y una controversia pendiente de publicación analizan los pros y las contras de la biopsia hepática y el lugar que puede ocupar en relación con otras exploraciones no invasivas83,84.
ConclusionesEn la actualidad, no existe un acuerdo unánime (consenso, recomendaciones de sociedades científicas, etc.), con respecto a los criterios de cribado de la EHDG. La valoración de las enfermedades asociadas, el riesgo vascular y la severidad de la enfermedad hepática mediante la combinación de varios tests no invasivos parece la actitud más sensata en la inmensa mayoría de los pacientes. De esta forma, solo aquellos sujetos con una sospecha fundada de presentar una EHNA, especialmente si presentan un perfil clínico-biológico indicativo de presentar una fibrosis avanzada, deben ser evaluados de forma prospectiva en una consulta de Hepatología (fig. 1). Estos pacientes deben evaluarse detenidamente respecto a la existencia de enfermedades asociadas y tratarlas de forma adecuada. No parece razonable efectuar una biopsia hepática de forma sistemática a estos pacientes con EHNA; ésta se debe reservar a aquellas situaciones en las que existan dudas razonables acerca de la potencial existencia de una enfermedad concomitante y, en aquellos casos, muy seleccionados, en los que se vaya a efectuar un ensayo terapéutico.
En el resto de los casos (la inmensa mayoría), el seguimiento se puede efectuar en los servicios de atención primaria o, si la importancia de las enfermedades asociadas lo demanda, en servicios hospitalarios específicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.