La cirugía constituye la primera línea de tratamiento curativo en el hepatocarcinoma (CHC). Sin embargo, una gran mayoría no se puede beneficiar de la misma debido al avanzado estadio tumoral, disfunción hepática severa o mala condición clínica. Por ello, se han introducido varias técnicas de ablación guiadas por imagen. Entre ellas, la radiofrecuencia percutánea (RFp) constituye una alternativa eficaz como tratamiento curativo.
Sin embargo, la localización de la lesión cerca de estructuras como el diafragma o el tracto gastrointestinal, limita esta técnica debido al riego de daño térmico colateral y a un tratamiento incompleto por mala visualización.
La introducción de ascitis artificial previa puede separar el CHC de los órganos adyacentes y mejorar la ventana acústica.
El objetivo de este estudio fue evaluar la viabilidad, seguridad y eficacia de la RFp con ascitis artificial para el tratamiento del CHC adyacente al diafragma.
Surgical resection is the first-line curative treatment of hepatocellular carcinoma (HCC). However most patients are unable to undergo surgical resection because of advanced tumoral stage, severe liver dysfunction or poor clinical status. Therefore, image-guided tumor ablation techniques have been introduced for the treatment of unresectable HCC. Among them, radiofrequency ablation (RFA) has been demonstrated to be an effective alternative curative therapy.
However, local ablative therapy for tumors located close to structures such as the diaphragm or gastrointestinal tract is technically challenging because of the risk of collateral thermal damage to nearby structures or incomplete treatment of the HCC resulting from poor visibility on sonography.
The introduction of artificial ascites can separate adjacent organs from the tumor and improve the sonic window.
The aim of this study was to evaluate the feasibility, safety and efficacy of RFA with artificial ascites for HCC adjacent to the diaphragm.
El carcinoma hepatocelular (CHC) constituye la neoplasia de hígado más frecuente. El tratamiento de elección en las lesiones únicas, sin hipertensión portal y con niveles de bilirrubina normales es la resección quirúrgica1. Sin embargo, menos del 5% de los pacientes con CHC cumplen los criterios para ser operados2. Por otra parte, como la falta de donantes limita el número de candidatos a trasplante hepático, han surgido otras terapias ablativas que constituyen una alternativa curativa para estos pacientes con buen grado funcional, no candidatos a cirugía o trasplante3,4.
Entre ellas, la RFp constituye una alternativa eficaz consiguiendo unas tasas de supervivencia al año y cuatro años del 96% (IC 95%: 92–98%) y 62% (IC 95%: 54–75%) respectivamente con una tasa menor de recurrencia local comparada con otras técnicas como la inyección percutánea de etanol (RR 0,37, IC 95%: 0,23–0,59)5.
Sin embargo, la RFp tiene limitaciones en cuanto a su aplicabilidad que dependen de las características de la lesión a tratar y de su localización. En tumores localizados superficialmente en la cúpula hepática, la RFp guiada por ecografía es difícil de realizar debido a la pobre visualización del tumor o del trayecto del electrodo y sobre todo por el riesgo de daño térmico de estructuras adyacentes como el diafragma.
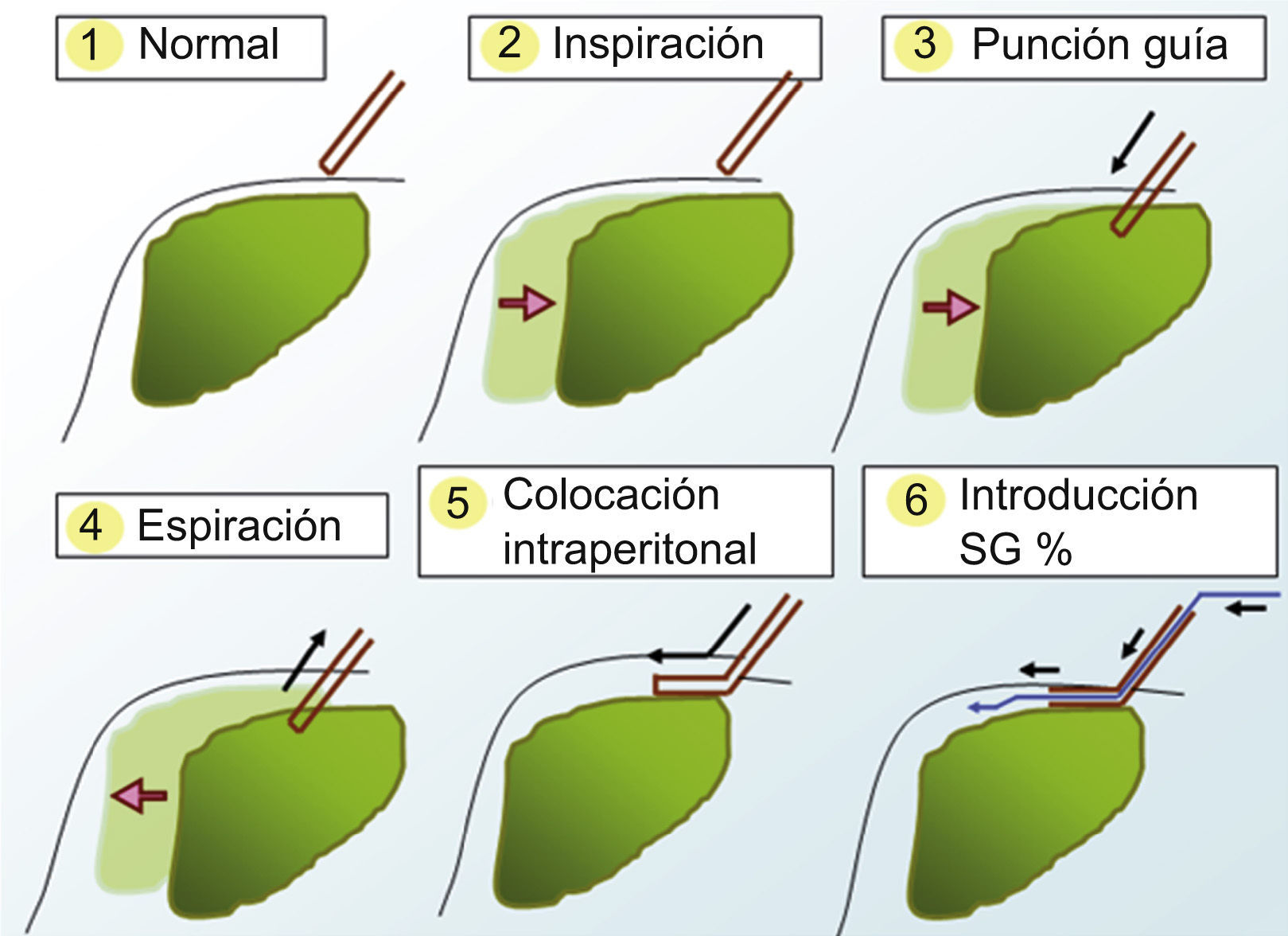
Varias técnicas se han desarrollado para intentar solventar este problema, entre ellas, la creación de ascitis artificial que permite separar el tumor de las estructuras adyacentes, evitando así su daño térmico. Hasta la fecha, no existe ninguna experiencia publicada en Europa ni América y todas las que hay proceden de series asiáticas. El objetivo de nuestro estudio fue evaluar la viabilidad, seguridad y eficacia de la radiofrecuencia percutánea con ascitis artificial para el tratamiento de CHC situados en la cúpula diafragmática hepática (fig. 1).
Observación clínicaEntre marzo del 2008 y febrero del 2009 un total de cinco pacientes (tres hombres y dos mujeres) con una edad media de 62,8±10,15 años con hepatocarcinoma único fueron tratados mediante ablación por radiofrecuencia percutánea previa infusión de ascitis artificial por su localización emergente en la superficie hepática en contacto con el diafragma (fig. 2). El diagnóstico de CHC se realizó según el esquema de la asociación americana para el estudio del hígado (AASLD)6. Ninguno de estos pacientes era candidato para cirugía o trasplante hepático, puesto que todos tenían cirrosis establecida con signos de hipertensión portal, pero cumplían las indicaciones de una alternativa terapéutica curativa siguiendo las recomendaciones del Barcelona Clinic Liver Cancer1. Según la clasificación de Child-Pugh, tres tenían un grado funcional A y dos tenía un grado B. La etiología de la cirrosis fue en un 60% por infección del virus de la hepatitis C y en el resto de origen enólico. El tamaño medio del CHC fue de 37,6±9,8mm, localizados en los segmentos viii (n=3) y vii (n=2) (tabla 1).
Características basales de los pacientes y resultados obtenidos tras el tratamiento
| Paciente | Sexo | Edad (años) | Etiología | Grado funcional (Child) | Tamaño (mm) | Segmento | Ascitis | Éxito técnica* | Complicaciones | Tumor residual o progresión local |
| 1 | M | 79 | VHC | A | 32 | VIII | Sí | Sí | No | No |
| 2 | H | 60 | Alcohol | B | 45 | VII | Sí | Sí | No | No |
| 3 | H | 51 | Alcohol | B | 52 | VIII | Sí | No1 | No | No |
| 4 | H | 63 | VHC | A | 30 | VII | Sí | Sí | No | No |
| 5 | M | 61 | VHC | A | 31 | VIII | Sí | Sí | No | No |
CHC: carcinoma hepatocelular; H: hombre; M: mujer; VHC: virus de la hepatitis C.
Todos los procedimientos se hicieron en quirófano bajo sedación anestésica y guiados por ecografía abdominal (Xario, Toshiba Medical System, Otawara, Japan).
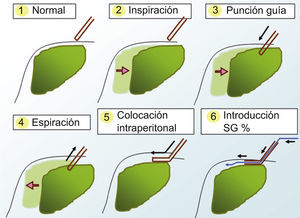
Tras administración de anestésico local en la zona de la punción con lidocaína al 2%, introducimos un catéter de 14 Fr en la porción hepática más próxima al tumor. Para realizar una adecuada selección del espacio peritoneal, se solicita al paciente que realice una inspiración profunda y mantenida, de tal forma que el parénquima hepático se desplace caudalmente y podamos avanzar el catéter en la porción subcapsular del parénquima hepático bajo visión directa ecográfica. Tras retirar el fiador central, volvemos a pedir al paciente que espire todo el aire y lo mantenga. En este momento el catéter queda posicionado en el espacio peritoneal por la retracción que ejerce el propio parénquima hepático al desplazarse cranealmente. Una vez que comprobamos ecográficamente la correcta colocación del catéter en el espacio peritoneal, se conecta a un sistema de infusión de suero glucosado al 5% a temperatura ambiente (fig. 1). Utilizamos suero glucosado al 5% (SG5%) porque al ser isoosmolar y no iónico, no interfiere en la radiofrecuencia y facilita su reabsorción posterior. No intentamos cambios posturales en el paciente para intentar desplazar el suero a la localización que nos interese. Instilamos SG5% hasta que comprobamos ecográficamente que el tumor se ha separado del diafragma al menos un centímetro y que existe una buena visualización para el trayecto de entrada del catéter de radiofrecuencia (fig. 3). En este momento, consideramos que la técnica de infusión de ascitis ha sido técnicamente exitosa y procedemos a la ablación del tumor mediante radiofrecuencia. Nosotros hemos usado un generador (Diagniscan Rita Medical, USA) con electrodos tipo expandibles Talón y XL (diámetro de ablación 4 y 7cm respectivamente) que poseen termopares para control temperatura. Con el paciente sedado y en decúbito supino, se procede a la inserción del electrodo en el centro de la lesión y al tratamiento mediante radiofrecuencia según el procedimiento habitual (fig. 4A). En el trayecto de retirada se realiza también ablación para minimizar el riesgo de sangrado e impedir la diseminación tumoral. La ascitis creada no se aspira ni se elimina por ningún procedimiento.
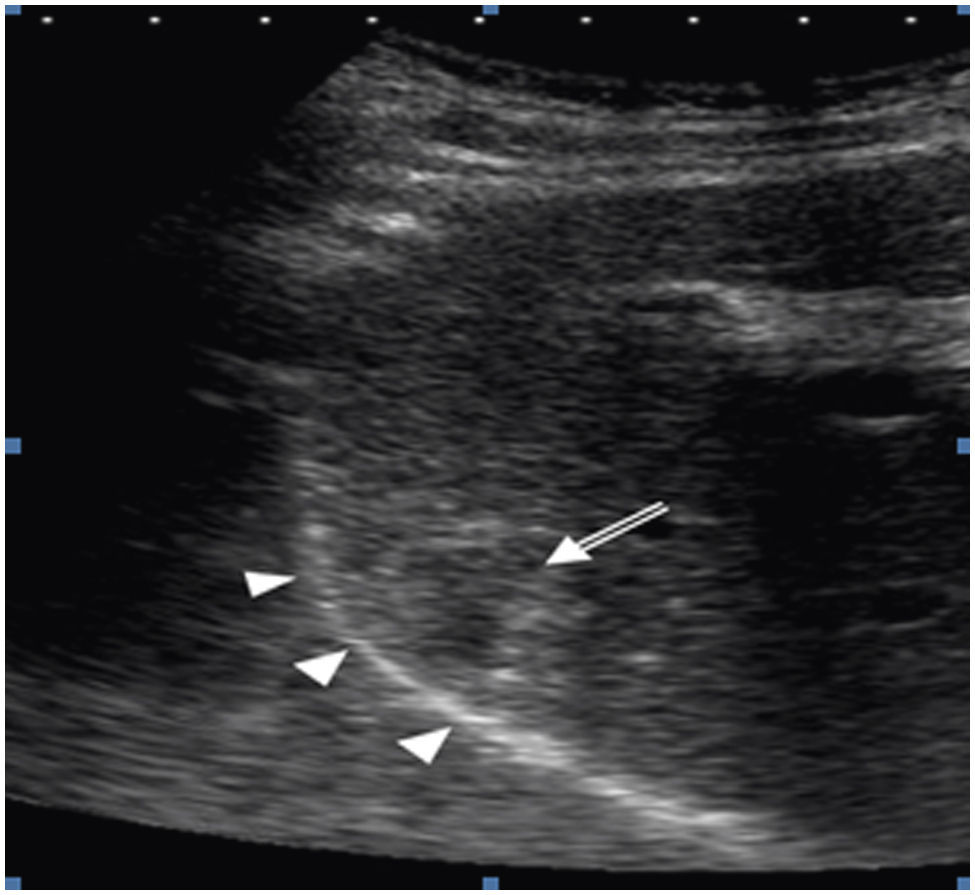
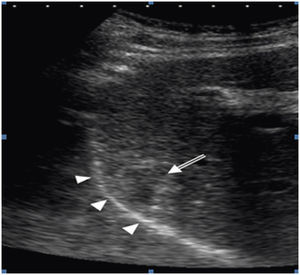
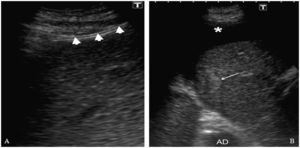
A la izquierda de la imagen (A) se observa el catéter (cabezas de flecha) correctamente posicionado en el espacio peritoneal. A la derecha (B) la imagen ecográfica muestra un área hipoecogénica que corresponde al líquido ascítico (asterisco) que separa la lesión (flecha) del diafragma. (AD: aurícula derecha).
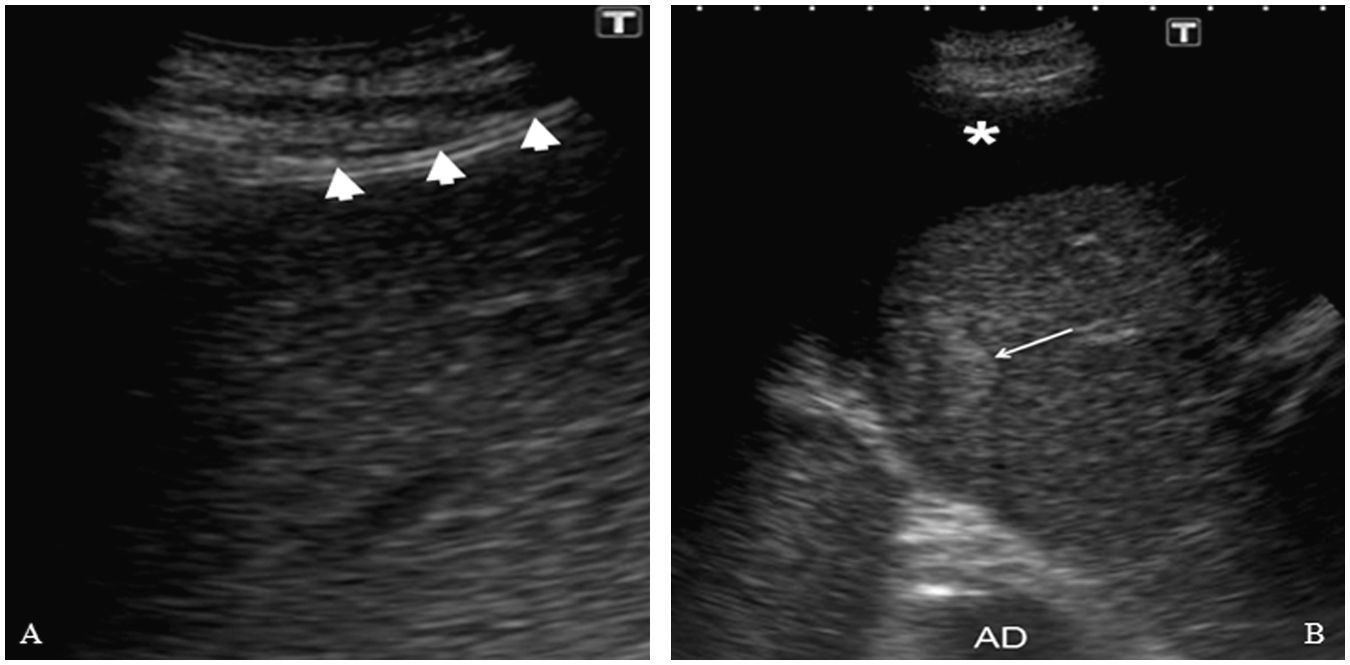
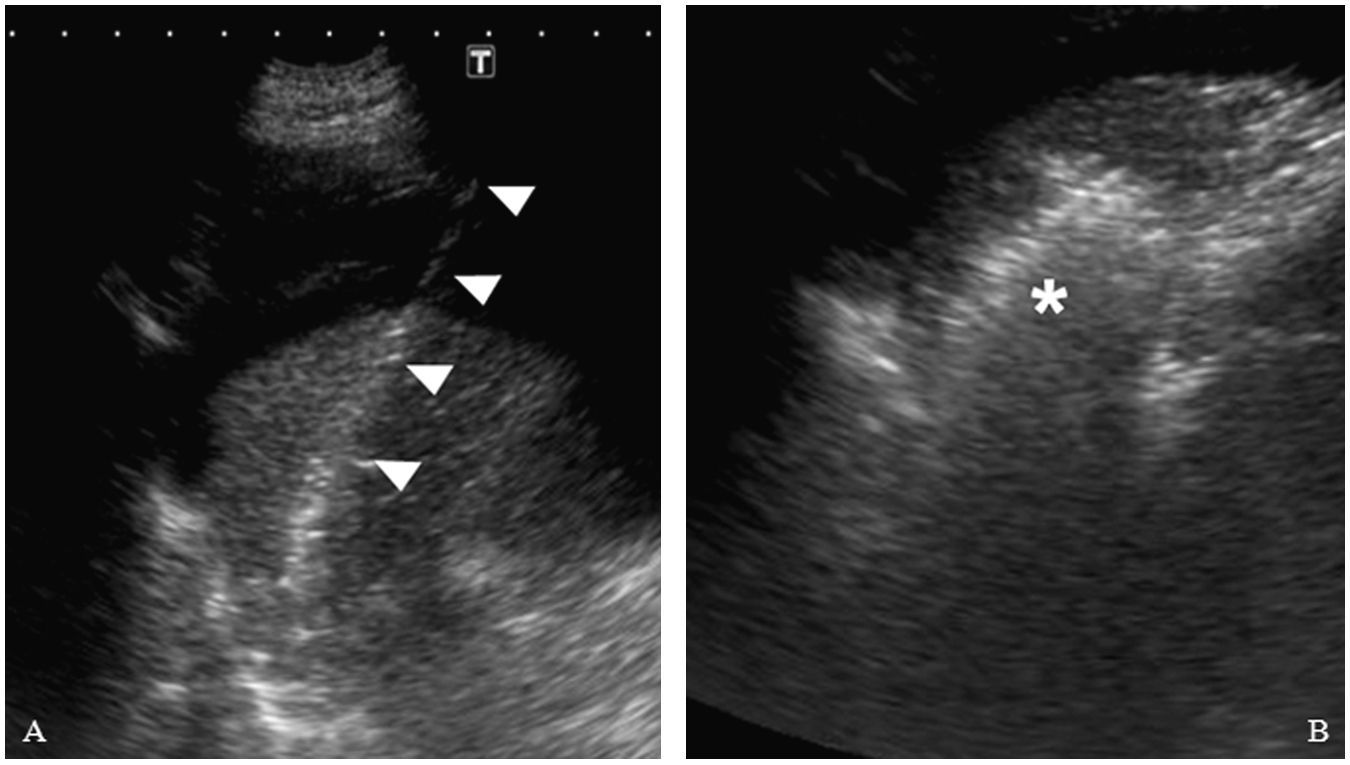
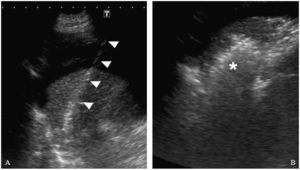
A) Introducción del catéter de radiofrecuencia (cabezas de flechas) en la lesión. En esta imagen se comprueba como la ascitis mejora la visualización del trayecto de entrada. B) Se observa un área hiperecogénica irregular que corresponde a la lesión tratada mediante radiofrecuencia (asterisco).
Inmediatamente después de la radiofrecuencia, se realiza ecografía abdominal para descartar complicaciones inmediatas (hemoperitoneo o daño térmico) (fig. 4B).
La viabilidad de la técnica fue definida por la posibilidad de seleccionar de forma adecuada el espacio peritoneal e infundir suero glucosado en el mismo.
La eficacia de la misma se estimó por la capacidad de la ascitis artificial para mejorar la visibilidad del tumor índice y la creación de un espacio suficiente entre la superficie hepática y el diafragma de al menos un centímetro.
Para valorar la seguridad, se comprobó la existencia de complicaciones menores (síntomas temporales sin secuelas clínicas que no precisaron terapéutica) o complicaciones mayores (síntomas que requirieron algún tipo de intervención, hospitalización o dejaron secuelas permanentes).
Para evaluar la seguridad y eficacia de la ablación por radiofrecuencia se lleva a cabo al mes una prueba con contraste: ecografía con contraste de segunda generación Sonovue® (Bracco International, Milan Italy), o tomografía computarizada (TC) (Aquilion 64, Toshiba, Tokyo, Japan) para comprobar la necrosis completa de la lesión. La eficacia de la ablación fue definida como la ausencia de tumor residual consistente en focos de realce periférico en la zona tratada o la presencia de un área de ablación incompleta (los márgenes deben superar en 0,5cm el tamaño de la lesión). Asimismo se descartan complicaciones tardías (hemoperitoneo, derrame pleural, lesión térmica de vecindad u otras) y se valora la persistencia o no de líquido ascítico.
La progresión local del tumor fue evaluada en el seguimiento a tres meses con TC como el crecimiento o realce con contraste de un área dentro de la zona previamente tratada o a menos de 2cm de sus bordes.
La evaluación de la supervivencia no se estimó objeto del presente estudio.
Análisis estadísticoPara el análisis estadístico se empleó el paquete informático SPSS para Windows versión 11.0 en español. Las variables cualitativas se expresan en porcentajes y las variables cuantitativas se expresan en media como medida de localización y desviación estándar como medida de dispersión.
ResultadosEn todos los pacientes se consiguió una adecuada selección del espacio peritoneal que permitió la correcta inserción del catéter. La infusión de ascitis artificial fue capaz de separar el tumor del diafragma en todos los pacientes excepto en uno, donde la existencia de un receso peritoneal impidió la progresión de la ascitis y por lo tanto, la separación de la superficie hepática del diafragma. En este caso, y de acuerdo con el servicio de cirugía hepatobiliar, se procedió a laparotomía con realización de ecografía intraoperatoria que permitió la inserción del electrodo de radiofrecuencia en el centro de la lesión y posterior tratamiento según protocolo habitual sin complicaciones inmediatas. La media del volumen de ascitis infundido fue de 1.100±630,47ml en un tiempo de 30±11,39min. No se detectaron complicaciones relacionadas con la técnica ni se comprobó en la ecografía realizada tras el procedimiento la presencia de derrame pleural, daño diafragmático o de estructuras adyacentes. No hubo cambios en el hemograma ni complicaciones cardiopulmonares secundarias a la sobrecarga de volumen (tabla 1).
Para evaluar la presencia de tumor residual al mes se utilizó en el 60% CT con contraste y en el resto ecografía abdominal con contraste de segunda generación. En ninguna de las lesiones tratadas se observó captación de contraste sugestiva de tumor residual. No se detectaron complicaciones tardías como hemoperitoneo, peritonitis o daño diafragmático. En todos los pacientes se comprobó la reabsorción de la ascitis infundida, sin que ninguno precisara uso de diuréticos ni paracentesis evacuadora. La realización al tercer mes de CT confirmó la ausencia de progresión local o recurrencia intrahepática.
DiscusiónLa RFp, que se asocia a excelente tasas de control del tumor, es ampliamente empleada debido a su seguridad y eficacia7–9. Sin embargo, cuando el tumor está localizado cerca de estructuras como el tracto gastrointestinal o el diafragma, es difícil llevar a cabo esta técnica debido al riesgo de daño térmico de las estructuras adyacentes o al tratamiento incompleto del tumor por una pobre visualización ecográfica10–12.
De esta manera, surgió el concepto de lesiones de «difícil tratamiento», que son aquellas lesiones que por su localización próxima (<5mm) a estructuras como el diafragma, tracto gastrointestinal o vía biliar, no son candidatas a terapias ablativas por el riesgo de daño térmico colateral de estas estructuras adyacentes13.
La separación del tumor de los órganos adyacentes, para prevenir el daño térmico y mejorar la visualización del camino del electrodo de RF, puede realizarse mediante varios procedimientos. Toyoda et al14 y Shibata et al15, publicaron una técnica que consistía en la realización de ablación por RF vía transpulmonar guiada por TC. La ablación fue completa en casi todos los casos pero hubo complicaciones mayores, incluidas neumotórax y derrame pleural en el 29–45% de los casos. También se ha utilizado la infusión de líquido en el espacio pleural para crear un derrame pleural artificial, bien de forma aislada16 o combinada con la creación de ascitis17, que permita separar las estructuras. Esta técnica consigue altas tasas de necrosis completa, asociando complicaciones menores en el 7% como neumonía, atelectasias o absceso hepático.
La inducción de ascitis artificial para el tratamiento percutáneo de lesiones localizadas en la superficie hepática fue utilizada por primera vez in vivo en un modelo experimental porcino, donde se comprobó que esta técnica evitaba el daño diafragmático en todos los casos18. Desde entonces, han surgido series de un número variable de pacientes que la han utilizado para el tratamiento de lesiones hepáticas cercanas al diafragma y tracto gastrointestinal17,19–22. Todas ellas proceden de grupos japoneses y coreanos (tabla 2), sin que se haya descrito esta técnica en Europa ni Estados Unidos.
Experiencia de la técnica en las series publicadas
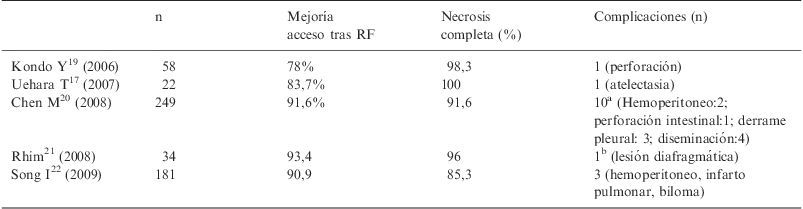
| n | Mejoría acceso tras RF | Necrosis completa (%) | Complicaciones (n) | |
| Kondo Y19 (2006) | 58 | 78% | 98,3 | 1 (perforación) |
| Uehara T17 (2007) | 22 | 83,7% | 100 | 1 (atelectasia) |
| Chen M20 (2008) | 249 | 91,6% | 91,6 | 10a (Hemoperitoneo:2; perforación intestinal:1; derrame pleural: 3; diseminación:4) |
| Rhim21 (2008) | 34 | 93,4 | 96 | 1b (lesión diafragmática) |
| Song I22 (2009) | 181 | 90,9 | 85,3 | 3 (hemoperitoneo, infarto pulmonar, biloma) |
Nuestro estudio, muestra que la infusión de ascitis artificial es una técnica factible si se realiza una adecuada selección del espacio peritoneal. Para ello, es imprescindible la colaboración del paciente y su realización guiada por ecografía. El tiempo de infusión de líquido ascítico fue superior al empleado en otras series (4,3–9min)21,22, debido probablemente a que en estos casos cambian el catéter por otro de mayor tamaño, como puede ser un acceso vascular que permita el paso de más volumen en menos tiempo.
En todos nuestros pacientes, la ascitis pudo separar la lesión del diafragma excepto en uno, donde la existencia de adherencias peritoneales impidieron la progresión del líquido al área hepática donde se encontraba el tumor. Esta es la principal limitación que se recoge en el resto de las series publicadas19–22. Las adherencias pueden ser congénitas o debidas a tratamientos previos (como resección quirúrgica, quimioembolización o ablación térmica previa). Kondo et al estudiaron la eficacia del uso de la ascitis artificial para el tratamiento de tumores hepáticos adyacentes al tracto gastrointestinal y recogieron una efectividad de la técnica del 78%. Las adherencias posquirúrgicas de los órganos abdominales fueron el principal factor restrictivo19. En la serie de Song et al, la causa más común de fallo de la técnica fueron las adherencias perihepáticas debido a antecedente de resección hepática o quimioembolización22. Este antecedente también se recoge en el estudio de Rhim, en el que 2 de los 3 fallos de la técnica fueron debidos a cirugía previa sobre el segmento vii21. Estos dos últimos autores recogen una segunda limitación de la técnica que es la localización del tumor en el área desnuda del hígado donde se refleja el peritoneo21,22. Por lo tanto, a la hora de indicar la técnica de creación de ascitis se deberían tener en cuenta estos dos factores que pueden limitar su efectividad.
En nuestro estudio no hubo ninguna complicación relacionada con la técnica ni con la radiofrecuencia posterior. En el estudio de Kondo et al se recoge un caso de perforación cólica en una paciente en la que no se había conseguido separar el hígado del colon19. En la serie de Uehara et al, en la que combinan la creación de derrame pleural y ascitis, se recoge un caso de atelectasia, sin objetivarse complicaciones cuando se emplea la ascitis artificial de forma aislada17. Chen et al realizan un estudio donde se compara el tratamiento de CHC de difícil localización (por sus relaciones anatómicas con el tracto gastrointestinal, diafragma, vesícula biliar o superficie hepática) con otros CHC no superficiales y de fácil acceso. Utilizan diversas técnicas para el tratamiento de estas lesiones entre las que incluyen la infusión de la ascitis artificial, obteniendo una tasa de complicaciones del 3,2% (n=10). No se especifica, sin embargo, a cuál de las estrategias terapéuticas corresponden tales complicaciones20. Rhim et al recogió tan solo un caso de lesión diafragmática en el que la técnica no fue eficaz por un receso peritoneal21. Por último, Song et al22 obtiene una tasa de complicaciones de 2,1%, comparable con las obtenidas del tratamiento de lesiones no superficiales mediante radiofrecuencia convencional23. En uno de los pacientes que presentó hemoperitoneo, tampoco se pudo conseguir separar la lesión del diafragma.
Tampoco se presentaron complicaciones relacionadas con la RFp. Tradicionalmente, se ha considerado que la presencia de ascitis puede lavar los factores trombogénicos en el sitio de la punción y que disminuye el efecto tampón que ejercería el peritoneo parietal sobre el hígado, aumentando el riesgo de hemorragia intraperitoneal24. Sin embargo, en nuestro estudio no hemos obtenido ningún caso de hemoperitoneo y, en estudios más amplios21,22, la tasa ha sido del 0,7%, que es similar a la de otras series de RFp convencional23. Más aún, los casos de hemoperitoneo que se recogen con esta técnica, son en pacientes en los que la inducción de ascitis falló en separar la lesión de las estructuras adyacentes. Por eso, nosotros recomendamos comprobar siempre por ecografía que la lesión a tratar se ha separado convenientemente, al menos 0,5cm, de las estructuras adyacentes. Si no es así, se debe desestimar la vía percutánea para evitar potenciales complicaciones como el hemoperitoneo.
En estos casos, la RF por laparoscopia puede ser una alternativa eficaz. En un reciente estudio recomiendan la RF por vía laparoscópica en lesiones de gran tamaño (>2cm) donde el tratamiento previo con quimioembolización puede limitar la técnica de creación de ascitis por formación de adherencias25. Sin embargo, es una técnica que requiere anestesia general, mayor entrenamiento del equipo que la realice y un adecuado material, no disponible en todos los centros, por lo que podría utilizarse en tumores previamente quimioembolizados o cuando la técnica percutánea falle.
En todos los casos de nuestro estudio donde la ascitis pudo separar la lesión se obtiene mejor ventana acústica que permite introducir de forma más segura y dirigida el electrodo de radiofrecuencia al centro de la lesión. En todos ellos se evidenció ausencia de tumor residual en las pruebas realizadas al mes sin progresión local o recurrencia intrahepática en el seguimiento posterior.
Aunque no hemos obtenido una reducción en la eficacia de la radiofrecuencia, esta puede ocurrir debido al efecto «disipador» del calor («heat sink») que pueda tener el líquido ascítico. El suero introducido a temperatura ambiente en el espacio peritoneal, que es menor que la corporal, podría enfriar las estructuras de alrededor, impidiendo que se alcanzaran temperaturas óptimas para la radiofrecuencia. Este fenómeno, que es bien conocido cuando existen vasos de gran calibre cerca de lesión a tratar26,27, podría disminuir la zona de la ablación y por tanto, favorecer la persistencia de tumor residual. En este sentido, se ha realizado un estudio en modelos experimentales de conejos, en el que se comparó un grupo control con la introducción de suero glucosado a temperatura ambiente y con suero calentado (45°C). Demostraron que no existían diferencias estadísticamente significativas en los tres grupos en cuanto al tamaño del área de la ablación (210,4±74,3, 158,3±78,8, 133±49,7mm2 respectivamente; p=0,188)28. En otro reciente estudio realizado en 28 pacientes donde se compara el volumen de ablación y la progresión local del tumor en pacientes tratados mediante RFp con ascitis y RFp convencional, se concluye que no existen diferencias estadísticamente significativas ni en cuanto al volumen del tumor tratado (p=0,871) ni en la progresión local del mismo (p=0,83)29.
No existen estudios que comparen la disminución de complicaciones con RF convencional y con la creación de ascitis en los tumores localizados en la cúpula hepática porque en los CHC de esta localización se desestima el tratamiento percutáneo por riesgo de daño de las estructuras adyacentes. Cuando lo comparan con un grupo control, estos son con tumores de localización central20. No obstante, en modelos animales, sí que se ha comprobado como la RFP sin creación previa de ascitis de lesiones superficiales, produjo en el 100% de los casos daño diafragmático comparado con la ausencia de daños colaterales en los que se infundió previamente ascitis18.
Nuestro estudio tiene varias limitaciones. El más importante es el escaso tamaño muestral del mismo, si bien, se trata de una técnica novedosa y sin experiencias previas publicadas en nuestro medio. Esto mismo hace que la curva de aprendizaje sea aún escasa y por lo tanto, nos hemos encontrado con ciertas dificultades en la técnica como el tiempo empleado en la infusión del líquido ascítico.
En conclusión, consideramos que la creación de ascitis artificial guiada por ecografía es una técnica sencilla, segura y eficaz para el tratamiento mediante RFp de hepatocarcinomas adyacentes al diafragma, que evita tratamientos de mayor riesgo en pacientes cirróticos (resección quirúrgica, RF intraoperatoria) o descenso en el escalón terapéutico (quimioembolización transarterial).
La existencia de adherencias (congénitas, posquirúrgicas) constituye una limitación de la técnica al impedir la distribución de la ascitis y por lo tanto debería evitarse, siendo una buena alternativa en este caso la realización de RF vía laparoscópica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.