El Consenso Latinoamericano de Estreñimiento Crónico se realizó con el objeto de proveer guías para mejorar la identificación, el diagnóstico y el tratamiento de este trastorno en la región. Dos coordinadores, y uno honorario, establecieron las líneas de consenso, basado en una revisión sistemática de la literatura médica de los últimos 10 años a partir de 1995. Participaron 17 miembros con el aval de sus respectivas sociedades locales de gastroenterología. Éstos revisaron y presentaron los temas con sus niveles de evidencia y grados de recomendación para discutirlos en una reunión plenaria. Tras un informe final de los miembros, los coordinadores prepararon las declaraciones finales para someterlas a votación en octubre de 2006. El consenso concluyó que el estreñimiento crónico tiene una prevalencia estimada del 5-21% en la región, con una relación mujer:varón de 3:1. El 75% de los sujetos que lo presenta utiliza algún tipo de medicamentos y más del 50% usa medicamentos caseros. Se recomendó un diagnóstico basado en los Criterios de Roma y los estudios diagnósticos sólo en pacientes mayores de 50 años o con algún signo de alarma. El uso de enema de colon se recomendó como investigación inicial en países con elevada frecuencia de megacolon idiopático y/o enfermedad de Chagas. En cuanto al tratamiento, se recomendó incrementar la fibra en la dieta a 25-30 g/día (grado C) y no se encontraron evidencias para ciertas medidas, como el ejercicio, el aumento de la ingesta de agua o las visitas programadas al excusado. El Psyllium recibió recomendación grado B y tratamientos farmacológicos, como tegaserod y polietilenglicol grado A. No se encontraron suficientes evidencias para recomendar la administración de lactulosa, pero no se desaprobó su uso cuando fuera necesario. Los estudios complementarios, como el tránsito colónico seguido de manometría anorrectal y defecografía, sólo se recomendaron para descartar la inercia colónica y/o la obstrucción funcional en pacientes que no respondieran al tratamiento. La biorretroalimentación se recomendó (grado B) en la disinergia del suelo pélvico.
The Latin-American Consensus on Chronic Constipation aimed to establish guidelines to improve the identification, diagnosis and treatment of this disorder in the region. Two coordinators and an honorary coordinator established the process and the topics to be discussed, based on a systematic review of the literature published in the previous 10 years, since 1995. Seventeen members participated with the support of their local gastroenterology societies. The members reviewed the different subjects based on the levels of evidence and grades of recommendation; the topics were then discussed in a plenary session. A written report was drafted and the coordinators prepared the final declarations to be submitted to a vote by all the members in October 2006. The consensus concluded that chronic constipation has an estimated prevalence of 5-21% in the region, with a female-to-male ratio of 3:1. Among individuals with constipation, 75% use some type of medication, with more than 50% using home remedies. A diagnosis based on Rome Criteria was recommended and diagnostic testing only in persons older than 50 years or with alarm symptoms. The use of barium enema as an initial investigation was recommended only in countries with a high prevalence of idiopathic megacolon or Chagas’ disease. Recommendations on treatment included an increase in dietary fiber of up to 25-30 g/day (grade C). No evidence was found to recommend measures such as exercise, increased water intake, or frequent visits to the toilet. Fiber supplements such as Psyllium received a grade B and pharmacological treatments such as tegaserod and polyethylene glycol, both grade A. There was insufficient evidence to recommend lactulose, but the consensus did not disadvise its use when necessary. Complementary investigations such as colonic transit followed by anorectal manometry and defecography were only recommended to rule out colonic inertia and/or obstructive defecation in patients not responding to treatment. Biofeedback was recommended (grade B) for those with pelvic dyssynergia.
El Consenso Latinoamericano de Estreñimiento Crónico nació en noviembre de 2005 con el objeto de mejorar el diagnóstico y el tratamiento en Latinoamérica y ofrecer recomendaciones para la identificación, el diagnóstico y el tratamiento del problema, basado en una revisión sistemática de la literatura médica por parte de expertos de toda la región. El Consenso no pretende ser un documento obligatorio, sino simplemente una guía para los médicos y profesionales de la salud que tienen a su cargo el manejo de pacientes con estreñimiento crónico (EC) en Latinoamérica.
METODOLOGÍAEl Consenso fue liderado por dos coordinadores de Latinoamérica expertos en trastornos funcionales gastrointestinales (TFGI) quienes, a su vez, nombraron un coordinador honorario basado en su experiencia y reconocimiento internacional en el tema. Los coordinadores lideraron el proceso y establecieron la metodología, que consistió en los aspectos siguientes: a) determinar los puntos de consenso; b) proponer los representantes (miembros) de cada país, que debían ser gastroenterólogos involucrados principalmente en academia, y/o líderes reconocidos en el tema de la motilidad y los TFGI; c) establecer los criterios de votación; d) liderar las reuniones de los miembros; e) participar en las votaciones, y f) presentar y publicar los resultados del consenso. El coordinador honorario sólo actuó como asesor pero sin derecho de voto.
Una vez determinados los candidatos por cada país, se les invitó a participar y se envió una carta a las respectivas sociedades/asociaciones de gastroenterología para solicitar su apoyo al consenso y el respaldo a los candidatos o, en su defecto, proponer a otros representantes. De esta forma, el Consenso obtuvo el apoyo de 13 sociedades/asociaciones de gastroenterología, incluida la Asociación Interamericana de Gastroenterología (AIGE), y contó con 17 miembros, además de los coordinadores. A cada miembro del Consenso se le asignó un tema para revisar, con base en la experiencia y el conocimiento previo de cada uno de ellos en los diferentes temas.
Los miembros del Consenso presentaron 3 meses más tarde un informe preliminar de su revisión a los coordinadores para que los primeros hicieran los comentarios pertinentes. Posteriormente, se realizó la reunión principal del Consenso en la ciudad de Los Ángeles (California) el 20 de mayo de 2006, donde cada miembro presentó su revisión con los niveles de evidencia y grados de recomendación, y se desarrolló la discusión de cada punto. Seis semanas más tarde enviaron su informe final a los coordinadores, quienes prepararon las declaraciones de cada tema para la votación, la cual se realizó por medio de una página en internet en octubre de 2006. Los resultados se presentaron por primera vez durante el XXX Congreso Panamericano de Gastroenterología, celebrado en Cancún (México) y se publican en el presente documento.
Búsqueda bibliográficaSe contrató a un médico no gastroenterólogo (S.V.) de Argentina quien realizó la búsqueda bibliográfica de los últimos 10 años desde 1995. Se consideraron los ensayos clínicos, las revisiones sistemáticas y generales, los metaanálisis y cada uno de los estudios incluidos en éstos, sin restricción de idioma y correspondientes a adultos mayores de 18 años de ambos sexos. Una primera búsqueda se realizó en la página Cochrane, seguida de una búsqueda en MEDLINE, Lilacs, Embase y Ovid, considerando los estudios latinoamericanos. Éstas se compararon con una búsqueda externa solicitada a la Biblioteca Central de Medicina de Argentina. Los términos de búsqueda fueron: estreñimiento crónico, tratamiento, terapéutica, laxantes estimulantes, osmóticos, formadores de bolo, ablandadores, sorbitol, lactulosa, magnesio, polietilenglicol, bisacodyl, cisapride, tegaserod y combinaciones de cada uno de éstos. Los artículos fueron clasificados por los coordinadores, según el tema correspondiente, y se colgaron en una página de internet disponible para todos los miembros en su consulta. Asimismo se les solicitó complementar la búsqueda con los datos disponibles en Latinoamérica desde 1995, con el objeto de realizar una evaluación crítica de las recomendaciones actuales para el EC y tratar de compararlas con recomendaciones de diferentes países de Latinoamérica –en caso de que dispusieran de ellas– utilizando publicaciones en revista médicas locales, así como en los libros de resumen de los congresos de gastroenterología, medicina interna y cirugía general y libros de texto. Finalmente, los coordinadores enviaron a cada miembro los criterios para la revisión de la literatura médica, que se enumeran a continuación.
Instrucciones para la revisión de la literatura médicaEstudios sobre epidemiología, impacto y calidad de vidaSe analizaron los criterios diagnósticos (criterios propios, Roma I, Roma II) utilizados para incluir a los pacientes con EC, la técnica empleada para determinar los casos (p. ej., cuestionarios autoaplicados o por entrevista), y el tamaño de la muestra; prevalencia, incidencia, frecuencia de los diferentes subgrupos de EC, distribución por sexos, grupos de edad, socioeconómicos, enfermedades asociadas, y edad promedio de la aparición de los síntomas. Se evaluó además si los criterios diagnósticos fueron adaptados adecuadamente para el idioma o la población/ país donde se aplicaron, y si el estudio fue basado en la comunidad (población general) o población remitida a un centro de atención médica y qué tipo de controles se utilizaron. Asimismo, se analizó el impacto económico en costes directos (honorarios médicos, gastos de hospitalización, servicios de urgencias, gastos por cuidados ambulatorios, laboratorio y gabinete, tratamientos farmacológicos y/o alternativos) y costes indirectos (ausentismo y presenteísmo, disminución en la calidad del tiempo libre y de vacaciones).
Estudios sobre diagnósticoSe determinaron los criterios de diagnóstico utilizados para incluir pacientes con EC, el método estudiado y la frecuencia de resultados anormales con dicho método y se describieron las enfermedades orgánicas con afectación gastrointestinal que puedan provocar estreñimiento. Se analizaron los beneficios que se esperaba obtener de los métodos diagnósticos analizados, qué porcentaje de casos nuevos se pueden detectar con esos métodos y cuál es el beneficio potencial de su uso, y se determinó si el método diagnóstico había sido estandarizado adecuadamente y en qué población se evaluó (centro de atención primaria o terciaria).
Estudios sobre tratamientosSe incluyeron sólo los tratamientos disponibles en Latinoamérica. El análisis se realizó de acuerdo con los criterios de Roma II1 y 2 criterios más del Consenso, que fueron la valoración de la frecuencia y la consistencia de las evacuaciones (tabla I). Se consideraron como de baja calidad los estudios con menos de 8 puntos, aceptables los que obtuvieron, al menos, 8-11 de los 16 puntos, y de alta calidad los estudios con, al menos, 12 de los 16 puntos.
Requerimientos utilizados por el Consenso para valorar la calidad metodológica de estudios clínicos en estreñimiento crónico
| Criterios de Roma para el diagnóstico de estreñimiento crónico |
| Estudios aleatorizados |
| Diseño de grupos paralelos, es decir, uno asignado a principio activo y otro a placebo (no debían utilizar el diseño cruzado) |
| Doble ciego |
| Que los pacientes hayan completado el tiempo predeterminado de seguimiento |
| Que no haya fase inicial de placebo |
| Que tengan una fase basal de observación para valorar los síntomas |
| Que la duración del tratamiento haya sido de un mínimo de 8-12 semanas o más |
| Fase de seguimiento para valorar los síntomas al terminar la fase de tratamiento |
| Que se haya valorado el cumplimiento terapéutico |
| Que los estudios describan el cálculo del tamaño de la muestra y que se haya incluido un número adecuado de pacientes |
| La variable principal medida debió ser la mejoría global o general de los síntomas de estreñimiento crónico |
| La variable principal medida debió ser valorada por el paciente y no por el investigador |
| Que haya una escala validada para medir la mejoría de los síntomas |
| Que se haya evaluado la mejoría en la frecuencia de las evacuaciones |
| Que se haya evaluado la mejoría en la consistencia de las evacuaciones |
Se analizaron los resultados de la cirugía en inercia colónica y estreñimiento obstructivo (obstrucción funcional del tracto de salida, disinergia del suelo pélvico), cada uno por separado, basado en las evidencias disponibles.
Terapias futurasSe hizo una descripción del agente y su modo de acción, y se mencionó si se encontraba disponible en Latinoamérica, ya que en el futuro podía estarlo.
Niveles de evidencia y grados de recomendaciónCon el objeto de obtener resultados comparables con los obtenidos en el Consenso Latinoamericano sobre el Síndrome de Intestino Irritable2,3, en el presente Consenso se utilizó la misma clasificación de los niveles de evidencia y grados de recomendación4.
Niveles de evidenciaNivel I. Representado por estudios controlados y aleatorizados de alta calidad. Tienen poca limitación en su diseño y minimizan el error tipo I. Es decir, si hay diferencias estadísticas entre el principio activo y el placebo, estos datos no parten de sesgos. Además, tienen suficiente poder para minimizar el error tipo II, es decir, si no hay diferencias estadísticas en los resultados, no se debe a un tamaño de muestra insuficiente.
Nivel II. Estudios controlados y aleatorizados de calidad intermedia. Tienen limitaciones en su diseño que ocasionan un error tipo II, y son susceptibles de presentar un error tipo II por un tamaño insuficiente de la muestra.
Nivel III-IV. Derivados de estudios no aleatorizados o series de casos. Generalmente, son estudios observacionales con muchos sesgos, incluso con error tipo I. No se hicieron recomendaciones para el tratamiento a partir de estos niveles de evidencia y sólo se utilizaron para hacer recomendaciones sobre métodos de diagnósticos, epidemiología, impacto y calidad de vida, ya que de estos temas, en general, sólo se dispone de datos basados en estudios observacionales.
Grado A. Apoyadas por estudios de nivel I. Son recomendaciones certeras basadas en la evidencia.
Grado B. Apoyadas por estudios de nivel II. Tienen limitaciones por el grado intermedio en el diseño de los estudios. Esta recomendación se puede convertir en grado A en el futuro, conforme se hagan disponibles mayores estudios de mejor calidad.
Grado C. Apoyadas por estudios observacionales de nivel III-IV. Son limitadas, pero representan la mejor evidencia en estudios epidemiológicos, impacto, calidad de vida y diagnóstico del estreñimiento crónico.
Se presentan a continuación cada uno de los temas revisados por el Consenso con las conclusiones y el grado de recomendación en letra itálica, y un breve resumen de la literatura médica. Finalmente, se presenta un algorritmo de diagnóstico y un tratamiento basado en las conclusiones.
Definición de estreñimiento crónico o funcionalSe definió el EC como un TFGI con una evolución al menos de 3-6 meses, caracterizada por evacuaciones infrecuentes, dificultad en su paso y tiempo prolongado para lograr la deposición. Se debe diferenciar del síndrome de intestino irritable con estreñimiento (SII-E), aunque pueden estar asociados (recomendación de grado C).
Se definió al EC como un TFGI, es decir, sin evidencia de enfermedad orgánica demostrable por exámenes de rutina con síntomas crónicos presentes al menos desde 3-6 meses antes y refractario a medidas simples, como cambios en la dieta. Las evacuaciones son infrecuentes, de menos de 3 por semana, caracterizadas por dificultad en el paso y por la presencia de un tiempo prolongado para lograr la evacuación. Son de consistencia duras o muy duras (bolitas, escíbalos o caprinas)5.
La dificultad en el paso se puede caracterizar por la sensación de pujo excesivo para lograr la evacuación, sensación de evacuación incompleta, bloqueo anorrectal y/o necesidad de maniobras digitales para lograr la evacuación. Puede acompañarse de sensación de «inflamación» o «hinchazón» abdominal después de varios días sin lograr evacuar, pero éste no es el síntoma principal6.
Se consideró que se pueden utilizar de manera indistinta los términos «estreñimiento» y «constipación», debido a que en varios países de Latinoamérica este último es el más empleado. El EC se diferencia del SII-E porque en este último el síntoma predominante es el dolor o malestar abdominal, si bien hay que mencionar que los dos trastornos pueden estar asociados. Se puede utilizar la escala de Bristol7, en la cual los grados 1 (evacuaciones duras en escíbalos como granos y con dificultad para el paso de éstas) y 2 (en salchichas pero caprinas) corresponden al estreñimiento y se correlacionan con el tránsito intestinal prolongado.
Aspectos epidemiológicosEn los pocos estudios disponibles en Latinoamérica se encontró una frecuencia de EC del 5-21%, con una relación mujeres:varones de 3:1 y se presenta a edades tempranas (recomendación de grado C).
El Consenso recomendó realizar estudios epidemiológicos basados en la comunidad en los demás países de Latinoamérica, utilizando criterios validados, como los Criterios de Roma, con un muestreo adecuado y predeterminado para evitar sesgos de selección y tamaños de muestra representativos.
En estudios internacionales se ha demostrado una frecuencia con un rango del 2-27%, por lo que se considera un trastorno frecuente. En Latinoamérica hasta el momento sólo se dispone de datos epidemiológicos de México y Nicaragua. En México, en un estudio realizado en voluntarios de población urbana, se encontró una frecuencia de acuerdo con los Criterios de Roma II del 18,8%8 y del 7,4% (intervalo de confianza del 95%, 5,3-10,1) en la comunidad9. En Nicaragua, también en un estudio realizado en la comunidad, la frecuencia fue del 21,1%10. En cuanto al sexo, es más frecuente en mujeres con una relación mujeres:varones de 3:1, y entre los pacientes que la padecen la frecuencia de mujeres es del 61-76%. La frecuencia de EC en mujeres y varones fue del 21 y el 15%, respectivamente. Por último, la edad promedio de los sujetos que lo padecen es de 38 ± 16 años8–10.
Calidad de vidaVarios estudios han mostrado una menor calidad de vida entre los pacientes con EC en comparación con la población general, independientemente de la autodeclaración o el diagnóstico mediante Criterios de Roma (recomendación de grado C).
No hay estudios sobre la calidad de vida en los pacientes con EC en Latinoamérica, por lo cual el Consenso recomendó traducir y validar instrumentos para valorar la calidad de vida de los pacientes en nuestra región.
La calidad de vida se ha evaluado mediante instrumentos como el PGWB, el SCL-90 y el SF-36, y otros instrumentos específicos, como el GSRS, el EBSQ, el PAC-SYM y el PAC-QOL11–14. Al menos un estudio ha señalado que, en comparación con la población general, los sujetos que autodeclaran tener EC y los diagnosticados mediante los Criterios de Roma II presentan una menor calidad de vida; sin embargo, no hubo diferencias entre estos grupos13. Al evaluar la calidad de vida de acuerdo con la presencia de tránsito lento o normal, los resultados son controvertidos. Por ejemplo, en un estudio, en el que se utilizó el PGWB y el GSRS, se ha indicado una peor calidad de vida de estos pacientes en comparación con los que presentan un tránsito lento11. No hay hasta el momento estudios de este tipo en Latinoamérica, y se han traducido y validado pocos instrumentos para este propósito, uno de los cuales es el SF-3615. En el único estudio realizado al respecto en nuestra región en pacientes que consultaron a un hospital de tercer nivel, se notificó una menor calidad de vida en los que presentaban un tránsito lento frente a los que tenían un tránsito normal16.
Impacto del estreñimiento crónico en LatinoaméricaNo hay información suficiente sobre el impacto del EC en Latinoamérica, excepto por el conocimiento del uso excesivo de laxantes estimulantes y suplementos de fibras. Sin embargo, los datos de los países desarrollados sugieren que impacta significativamente en términos de costes directos (utilización de medicamentos, consultas médicas y procedimientos diagnósticos) e indirectos (absentismo laboral) (recomendación de grado C).
El Consenso recomendó la realización de estudios para valorar el impacto del EC en Latinoamérica en términos de la utilización de recursos económicos y de salud.
El impacto del EC se evaluó por aspectos, económicos, clínicos y desencadenados sobre los profesionales de la salud encargados del tratamiento:
- –
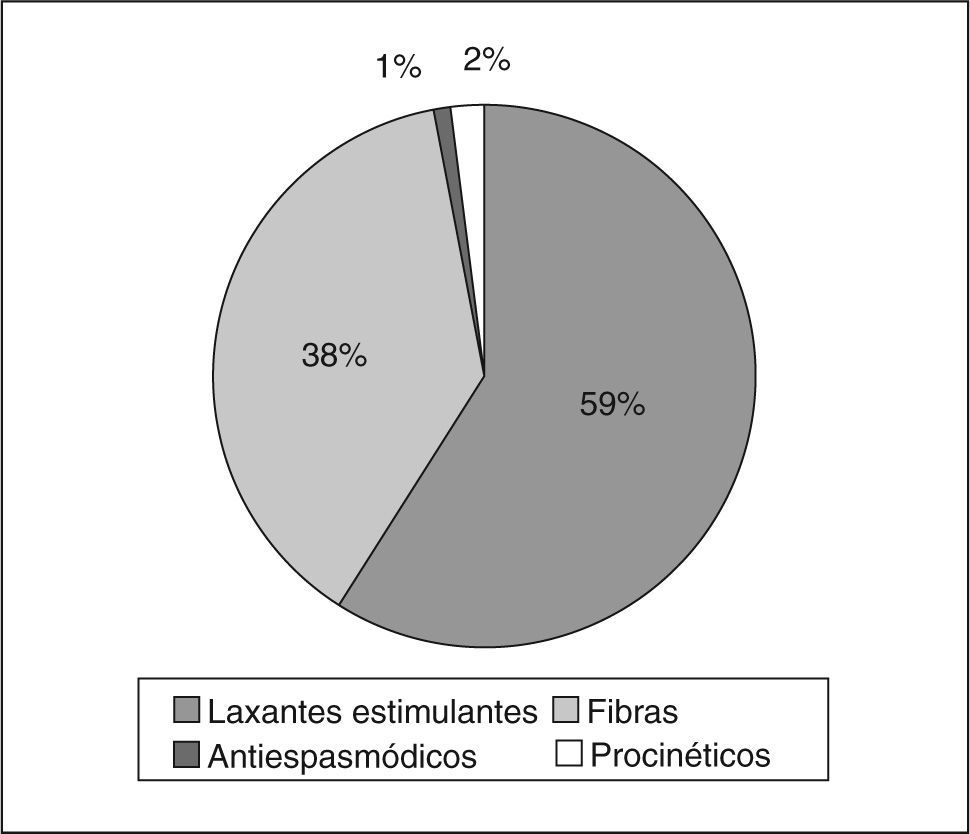
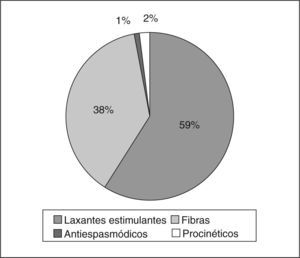
Económicos. Si bien el número de personas con EC que acuden al médico es bajo en relación con su prevalencia, hay datos que sugieren que alrededor del 30% de los sujetos que presentan EC buscan consulta médica17,18. El uso de medicamentos es un parámetro importante. Los estudios de participación del mercado en unidades vendidas en diversos países de Latinoamérica, como Argentina, Brasil, Chile, Colombia, Ecuador, México, Perú, Venezuela y otros del área centroamericana19, han determinado que hasta un 75% de las personas con EC toma algún producto para aliviar esta afección, de los cuales el 38% utiliza fibra o agentes formadores de bolo, el 59% laxantes estimulantes y/o irritantes, el 2% tegaserod, el 1% antiespasmódicos y aproximadamente el 0,18% otros procinéticos (fig. 1). El 20% toma tratamientos por prescripción médica, el 53% remedios caseros y el 27% se automedican19. Además, el consumo «oculto» de laxantes, como infusiones con senna o cáscara en sus diferentes presentaciones, es relevante en nuestra población, y el impacto económico de esta práctica es difícil de evaluar. Por todo lo anterior, se puede considerar que el gasto económico en medicinas, dietas y tratamientos diversos es significativo20,21.
Fig. 1.Medicamentos utilizados para el estreñimiento crónico en Latinoamérica. (Publicado con autorización de IMS AG, IMS PM e INTE™, antiespasmódicos y laxantes19.)
(0,05MB).
El uso de exámenes de laboratorio, endoscópicos y de imagen es mayor que en el paciente promedio con un alto coste económico22. No se dispone de datos en Latinoamérica de estos aspectos en pacientes con EC. Otro aspecto que produce un impacto económico es el ausentismo laboral o escolar, que en otras regiones se considera de 2,4 días por mes23. La disminución de la efectividad en el trabajo (presenteísmo) ha sido reportado en otras latitudes y en nuestra región es más difícil de medir, pues el empleo informal, el subempleo y el autoempleo son prácticas comunes, que representan un gran impacto en la productividad.
- –
Impacto clínico. Es importante considerar que ciertas circunstancias clínicas pueden tener un impacto negativo sobre el EC: infecciones urinarias, que son más frecuente en el EC; lesiones del nervio pudendo e incontinencia fecal; prolapso rectal; hemorroides y cirugías innecesarias en mujeres jóvenes. En pacientes mayores, las asas intestinales distendidas con contenido fecal pueden conllevar la aparición de un vólvulo de sigmoides y/o una colitis isquémica. Finalmente, la impactación fecal, de forma poco frecuente, puede predisponer a la aparición úlceras rectales y perforación rectal24.
- –
Profesionales de la salud. El profesional de la salud no está satisfecho con las medidas terapéuticas disponibles en la actualidad para el manejo del EC. Una encuesta que evaluó la opinión de 8.000 médicos generales sobre el típico paciente estreñido consideró que los pacientes que acuden a la consulta ya toman medicamentos, pero éstos no han sido efectivos (71%) o los síntomas han empeorado (74%). El médico considera que necesita nuevas opciones de tratamiento del EC (90%) y también que no dispone de medicamentos efectivos para estos pacientes (60%)20,21, situación en la que coincidieron los miembros del Consenso.
Se recomienda utilizar los Criterios de Roma II para el diagnóstico clínico y los estudios de investigación (recomendación de grado C).
El Consenso recomendó, además, traducir y validar en cada país de la región de Latinoamérica los cuestionarios con los nuevos Criterios de Roma III.
Actualmente se acepta utilizar los Criterios de Roma para permitir un diagnóstico positivo, es decir, basado en síntomas clínicos, en todos los TFGI y para estudios de investigación, con el objeto de estandarizar el manejo clínico y la investigación. Estos criterios no excluyen la definición de EC dada en el apartado anterior de definición.
Entre las ventajas de estos criterios se encuentra que mediante un análisis factorial se han identificado grupos de síntomas que concuerdan con los diagnósticos de EC según los criterios de Roma II y apoyan su validez6. Entre las limitaciones se encuentran la falta de conocimiento de los criterios por los médicos y la falta de valoración de la calidad de vida. Hasta el momento, el Cuestionario Modular de Roma II ha sido traducido y validado en México y Nicaragua de acuerdo con los criterios del Grupo de Roma8,10. Los más recientes Criterios de Roma III25 requieren una traducción al español y una validación para los diferentes países de Latinoamérica (tabla II).
Criterios de Roma III para el estreñimiento crónico
Dos o más de los siguientes criterios:
|
| Evacuaciones sueltas muy raramente presentes sin el uso de laxantes |
| Criterios insuficientes para el diagnóstico de síndrome de intestino irritable |
| Los criterios deben estar presentes durante los últimos 3 meses, con el inicio de los síntomas por lo menos 6 meses antes del diagnóstico. |
En la evaluación diagnóstica inicial de un paciente con EC está indicado una historia clínica y un examen físico completos. No hay evidencias para recomendar el uso sistemático de pruebas de laboratorio en pacientes menores de 50 años y sin signos de alarma (recomendación de grado C).
La evaluación diagnóstica inicial debe considerar las características epidemiológicas de cada población. De esto dependerá la indicación de un coprocultivo o un examen de parásitos, de pruebas tiroideas para descartar un hipotiroidismo, y una colonoscopia o un estudio radiológico del colon más rectosigmoidoscopia para descartar un cáncer de colon (recomendación de grado C).
Asimismo, el Consenso recomendó la realización de un estudio radiológico del colon como examen inicial en los países de Latinoamérica, donde el megacolon por enfermedad de Chagas y/o el megacolon idiopático tienen una alta prevalencia (recomendación de grado C).
Los pacientes con signos de alarma deben ser evaluados con hemograma y velocidad de sedimentación globular, química sanguínea, calcio sérico, pruebas de funcionamiento tiroideo, sangre oculta en heces y colonoscopia o estudio radiológico del colon con rectosigmoidoscopia flexible (recomendación de grado C).
En los pacientes mayores de 50 años con estreñimiento de novo y sin evidencias para explicar una causa secundaria (p. ej., uso de medicamentos anticolinérgicos, antidepresivos tricíclicos, antiparkinsonianos, etc.) deberán ser igualmente evaluados (recomendación de grado C).
Aunque son arbitrarios, ya que no hay estudios clínicos que los valide, el Consenso consideró los siguientes signos de alarma: pérdida de peso > 10% en menos de 6 meses sin una dieta que lo pueda explicar, historia familiar de cáncer o enfermedad inflamatoria intestinal, fiebre, síntomas nocturnos (como dolor abdominal), sangre en heces, anemia y estreñimiento de larga duración o refractario al tratamiento, todos hallazgos anormales en el examen físico que sugieran una enfermedad de base que explique el EC (recomendación de grado C).
Hay una gran variedad de factores que pueden asociarse al EC, como el uso de medicamentos, las neuropatías, las miopatías, la obstrucción mecánica y las enfermedades metabólicas, entre otros26,27. Por tanto, se acepta que uno de los aspectos más importantes en la evaluación inicial de los pacientes con esta afección es descartar una causa orgánica. Sin embargo, hay pocas evidencias científicas que justifiquen la realización de estudios diagnósticos extensos, ya que la mayoría de los pacientes responde adecuadamente a un manejo médico conservador22. En un estudio retrospectivo pequeño, de 51 pacientes referidos a un hospital universitario para una evaluación exhaustiva por EC, el 39% tenía una causa demostrable de su enfermedad y sólo un 24% de ellos se benefició de esta conducta22. Una historia clínica cuidadosa y un examen físico minucioso son esenciales para seleccionar el grupo de pacientes que requerirán estudios específicos cuando se tenga la sospecha de alguna enfermedad en particular5.
Se han recomendado estudios sistemáticos: hemograma con velocidad de sedimentación globular, glucosa y calcio sérico, electrólitos séricos, búsqueda de sangre oculta en heces y pruebas de función tiroidea. Sin embargo, la literatura médica actual no señala evidencias que apoyen esta conducta. De hecho, ningún estudio ha analizado la utilidad del uso sistemático de estas pruebas, aunque la actual falta de evidencias no necesariamente refuta el beneficio potencial. La probabilidad preprueba de que se obtenga un resultado alterado en estas pruebas en el EC es la misma que en la población general28.
Se ha sugerido también la realización de estudios invasivos tipo colon por enema, rectosigmoidoscopia flexible o colonoscopia, para evidenciar causas estructurales y, principalmente, descartar una neoplasia colónica. Se recomienda el uso de radiología del colon si se sospecha clínicamente la presencia de megacolon, megarrecto u obstrucción, o colonoscopia si se sospecha una lesión estructural o se desea una valoración total colónica y la toma de tejido para su análisis29–31. Sin embargo, efectuar estos procedimientos de forma sistemática no conlleva un cambio terapéutico significativo32–36. Las revisiones sistemáticas no han demostrado que utilizando estos métodos diagnósticos se pueda diferenciar a los pacientes con EC, incluidos los subtipos de éste, de los que presentan afecciones orgánicas33,35,36. Por tanto, en la mayoría de los pacientes que acuden a la consulta por EC, no recomendamos la realización sistemática de radiología, rectosigmoidoscopia flexible o colonoscopia.
Sin embargo, hay un subgrupo de pacientes que no se beneficia de medidas terapéuticas, que requieren una evaluación diagnóstica más amplia, en quienes está justificado efectuar pruebas de laboratorio y de gabinete para diferenciar el EC de otra causa secundaria. En este subgrupo se incluyen los pacientes mayores de 50 años, en quienes nunca se han efectuado pruebas de cribado para el cáncer de colon, o los que presenten signos de alarma33–35. El Consenso consideró una serie de signos de alarma arbitrarios que requieren validación, ya citados previamente. Las alteraciones de laboratorio deberán evaluarse, como la leucocitosis o la velocidad de sedimentación globular elevada, las pruebas bioquímicas anormales (glucosa, calcio, hormona estimulante de tiroides) y/o la sangre oculta en heces.
Medidas generales (reflejo condicionado, líquidos, dieta y ejercicio)Se recomienda un incremento de fibra en la dieta para completar 25-30 g/día en pacientes sin evidencia clínica de inercia colónica o estreñimiento obstructivo (recomendación de grado C).
Hay que aclarar que no se dispone de datos sobre el consumo diario de fibra en Latinoamérica para sustentar esta recomendación dietética, por lo que se recomienda realizar estudios de investigación que determinen este factor.
Hay pocas evidencias que apoyen el uso sistemático de medidas generales, como el ejercicio, el incremento en la ingesta de agua y un programa de educación para regular el reflejo condicionado en el manejo de los pacientes con EC.
Los estudios relacionados con medidas generales de tratamiento del EC, específicamente líquidos, ejercicio, dieta y reflejo condicionado, corresponden en su mayoría a niveles de evidencia IV, derivados de opiniones de expertos:
- –
Ingesta de líquidos. Por tratarse de una intervención de bajo coste y sin aparentes efectos colaterales, ésta ha sido una recomendación tradicional, pero la efectividad real no se ha evaluado adecuadamente, y los estudios en que ésta se ha realizado muestran resultados contradictorios o no significativos. De hecho, no se han efectuado estudios en adultos con EC. Se sugiere que esta recomendación podría ser útil cuando hay estados de deshidratación crónica asociada al EC o como complemento del uso de sustancias no absorbibles y osmóticamente activas que modifiquen la fisiología absortiva del colon37,38.
- –
Ejercicio. El papel del ejercicio en la mejoría de la función colónica es controvertido. Algunos estudios epidemiológicos indican una mayor prevalencia de EC en poblaciones sedentarias cuando se compara con individuos que realizan una actividad física regular. Los mecanismos fisiológicos que podrían explicar un aumento en el tránsito colónico asociado con el ejercicio no son totalmente claros e incluyen un aumento en la motilidad, modificaciones del flujo sanguíneo intestinal, y liberación de hormonas y péptidos gastrointestinales. La evidencia disponible muestra resultados contradictorios, de los que se podría deducir que el ejercicio puede mejorar el tránsito colónico sin que sea evidente su efectividad en el control de los síntomas del EC. No está claro hasta qué nivel de actividad física es necesario llegar para lograr el posible efecto beneficioso, tanto en la fisiología como en la respuesta clínica39,40.
- –
Dieta. Varios estudios observacionales han mostrado que la dieta baja en fibra se asocia con una mayor frecuencia de estreñimiento; por el contrario, las dietas ricas en fibra aumentan el volumen de las deposiciones y aceleran el tránsito colónico. La suplementación de fibra en la dieta de 25-30 g/día se ha recomendado durante mucho tiempo como una medida importante en el manejo de los pacientes con EC. Los resultados de algunas revisiones sistemáticas muestran que esta medida parece ser efectiva en pacientes con dietas bajas en fibra que no tengan una inercia colónica o una disfunción del suelo pélvico evidente. Un metaanálisis, que evaluó diversos estudios que compararon la fibra de la dieta con los laxantes en el tratamiento del EC, encontró que tanto los suplementos de fibra en la dieta como los diferentes laxantes producen, en algunos casos, un discreto incremento en el número de movimientos intestinales al día, y en otros un incremento significativo, resultados contradictorios a causa de las limitaciones metodológicas41.
- –
Reflejo condicionado. Busca que los pacientes con EC adquieran un hábito intestinal con un patrón regular similar al descrito por voluntarios sanos. Ésta es una recomendación tradicional que se basa en conceptos fisiológicos y estudios observacionales, en los que se ha encontrado que el inicio de la evacuación puede desencadenarse por un reflejo condicionado. Teniendo en cuenta que la actividad motora colónica es mayor al despertarse y después de las comidas, se ha considerado útil reeducar a los pacientes con EC para lograr un horario normal de evacuación, preferiblemente al despertarse y después de tomar el desayuno, durante períodos no superiores a 5 min y con una actividad de pujo moderada42.
La mayoría de los estudios que evaluaron los suplementos de fibra en el tratamiento del EC son antiguos y con importantes deficiencias metodológicas; sin embargo, las evidencias sugieren que pueden ser de utilidad en algunos pacientes el Psyllium (recomendación de grado B), el policarbófilo y la metilcelulosa (recomendación de grado C).
La fibra y los agentes formadores de bolo son los agentes que más se semejan a los mecanismos fisiológicos de la evacuación, y la mayoría de los pacientes responden a esta intervención43. Forman parte de este grupo los preparados que contienen Psyllium, metilcelulosa y policarbófilo. El Psyllium se comporta como las fibras alimentarias y sufre la acción de las bacterias colónicas, con la consecuente producción de meteorismo, distensión abdominal y flatulencia44. Los agentes sintéticos metilcelulosa y policarbófilo no son degradados por las enzimas bacterianas de la flora entérica, por lo que evitan la formación de gases intestinales. La principal ventaja de su uso es la ausencia de efectos colaterales sistémicos, y pueden utilizarse durante largo tiempo. Las contraindicaciones para su uso son: obstrucción y suboclusión intestinal, dolor abdominal, náuseas o vómitos de causa no clara (p. ej., abdomen agudo), hipersensibilidad (p. ej., Psyllium), flatulencia, distensión y meteorismo graves45. Los estudios realizados para comprobar la eficacia de los agentes formadores de bolo presentan, en su mayoría, fallos metodológicos importantes, como inclusión de un número pequeño de pacientes, corto período de seguimiento, falta de grupo control o no adopción de los criterios definidos por el Grupo de Roma para el abordaje de los TFGI46.
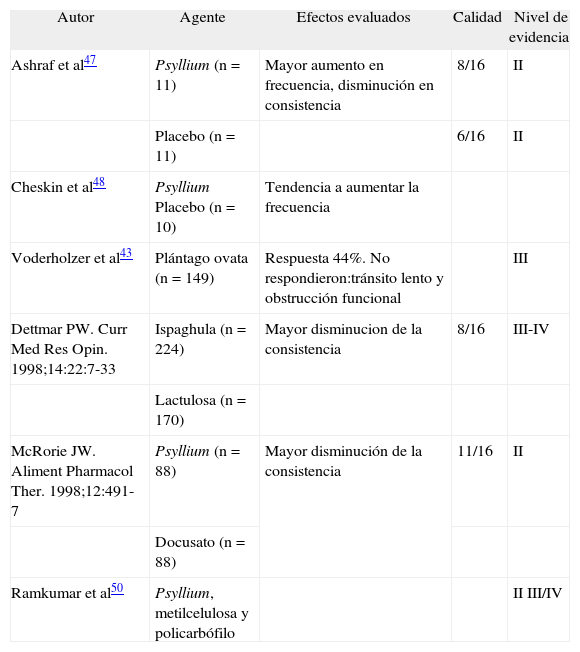
Los mejores estudios clínicos han demostrado que tanto la frecuencia como la consistencia de las evacuaciones mejoran con el Psyllium en comparación con placebo47,48, y el primero es superior al docusato para disminuir la consistencia de la materia fecal49. No se encontraron diferencias en la frecuencia y la consistencia de las evacuaciones entre los pacientes que utilizaron Psyllium, metilcelulosa y policarbófilo, y tampoco hubo efectos adversos significativos50 (tabla III).
Estudios que evaluaron la fibra y los agentes formadores de bolo en el estreñimiento crónico
| Autor | Agente | Efectos evaluados | Calidad | Nivel de evidencia |
| Ashraf et al47 | Psyllium (n = 11) | Mayor aumento en frecuencia, disminución en consistencia | 8/16 | II |
| Placebo (n = 11) | 6/16 | II | ||
| Cheskin et al48 | Psyllium Placebo (n = 10) | Tendencia a aumentar la frecuencia | ||
| Voderholzer et al43 | Plántago ovata (n = 149) | Respuesta 44%. No respondieron:tránsito lento y obstrucción funcional | III | |
| Dettmar PW. Curr Med Res Opin. 1998;14:22:7-33 | Ispaghula (n = 224) | Mayor disminucion de la consistencia | 8/16 | III-IV |
| Lactulosa (n = 170) | ||||
| McRorie JW. Aliment Pharmacol Ther. 1998;12:491-7 | Psyllium (n = 88) | Mayor disminución de la consistencia | 11/16 | II |
| Docusato (n = 88) | ||||
| Ramkumar et al50 | Psyllium, metilcelulosa y policarbófilo | II III/IV |
No hay evidencias para recomendar el uso de laxantes estimulantes o irritantes en el manejo del EC; sin embargo, se sugirió que en lugares de Latinoamérica donde no haya acceso a la fibra, laxantes osmóticos o agentes serotoninérgicos, los laxantes estimulantes pueden considerarse como una alternativa terapéutica (recomendación de grado C).
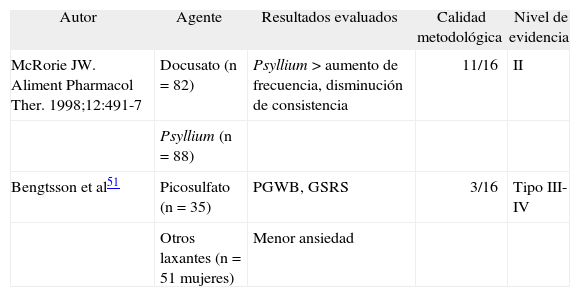
Este grupo de agentes se ha utilizado desde hace mucho tiempo. Son incluso prescritos formalmente o incluidos en formulaciones junto con fibras o infusiones; sin embargo, no hay estudios de buena calidad que hayan evaluado su eficacia en el EC. Hay solamente dos estudios publicados, ambos de baja calidad metodológica: uno con docusato, que puso de manifiesto la superioridad del Psyllium, y otro con picosulfato, que sólo evaluó la calidad de vida49,51 (tabla IV). No hay estudios con derivados antraquinónicos, como cáscara sagrada y senna. Por otra parte, los aspectos relacionados con los riesgos potenciales de su uso, como las lesiones degenerativas del sistema nervioso entérico, son controvertidos, pero tampoco hay evidencias de que éstas ocurran en humanos y no está clara la importancia de la melanosis coli por apoptosis de células epiteliales colónicas y el depósito de pigmentos en los macrófagos. El dolor abdominal y la necesidad de escalar las dosis según la tolerancia son factores limitantes de su uso; sin embargo, en muchas regiones de Latinoamérica permanecen como la única alternativa para el tratamiento del EC, por su bajo coste y facilidad de acceso, y representan, por lo menos, el 59% de las prescripciones para el EC19.
Estudios que evaluaron laxantes estimulantes en el estreñimiento crónico
| Autor | Agente | Resultados evaluados | Calidad metodológica | Nivel de evidencia |
| McRorie JW. Aliment Pharmacol Ther. 1998;12:491-7 | Docusato (n = 82) | Psyllium > aumento de frecuencia, disminución de consistencia | 11/16 | II |
| Psyllium (n = 88) | ||||
| Bengtsson et al51 | Picosulfato (n = 35) | PGWB, GSRS | 3/16 | Tipo III-IV |
| Otros laxantes (n = 51 mujeres) | Menor ansiedad |
El polietilenglicol (PEG) ha demostrado efectividad y seguridad en estudios bien diseñados en pacientes con EC (recomendación de grado A).
No hay estudios que evalúen la lactulosa en el manejo del EC durante los últimos 10 años y la única evidencia reciente sugiere que es menos efectiva que el PEG. Sin embargo, dado que los estudios previos se consideraron aceptables, el Consenso no desaprobó su uso cuando se requiera (recomendación de grado C).
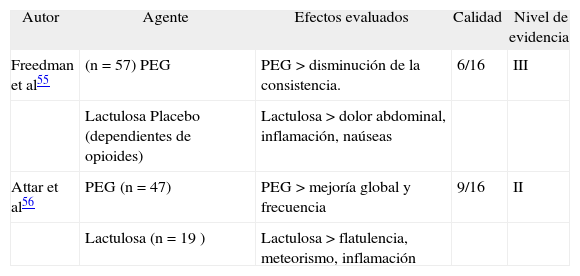
Los agentes de este grupo incluyen los azúcares no absorbibles (lactulosa), los agentes salinos (hidróxido de magnesio) y el PEG. Los estudios clínicos con lactulosa son antiguos y presentan limitaciones metodológicas; sin embargo, sugieren que es más efectiva que placebo52–56. Los estudios recientes compararon lactulosa con PEG y, si bien se puede decir que tienen una calidad metodológica intermedia, el PEG demostró ser más efectivo que la lactulosa y ésta presentó mayores efectos adversos55,56 (tabla V).
Estudios que evaluaron lactulosa en el estreñimiento crónico
| Autor | Agente | Efectos evaluados | Calidad | Nivel de evidencia |
| Freedman et al55 | (n = 57) PEG | PEG > disminución de la consistencia. | 6/16 | III |
| Lactulosa Placebo (dependientes de opioides) | Lactulosa > dolor abdominal, inflamación, naúseas | |||
| Attar et al56 | PEG (n = 47) | PEG > mejoría global y frecuencia | 9/16 | II |
| Lactulosa (n = 19 ) | Lactulosa > flatulencia, meteorismo, inflamación |
PEG: polietilenglicol.
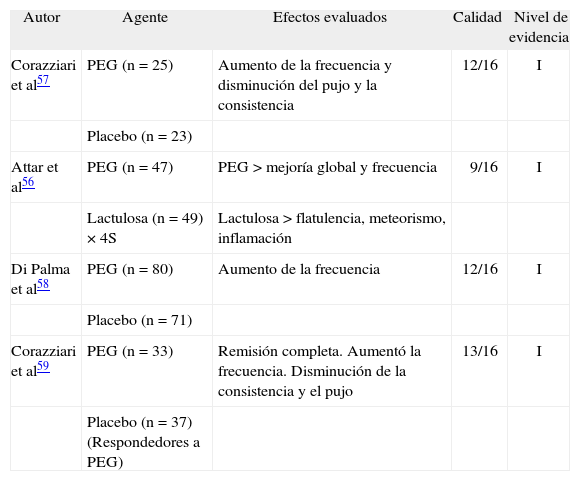
Algunos estudios bien diseñados han demostrado que el PEG es eficaz tanto en intervenciones a corto como a largo plazo (6 meses) (tabla VI). La dosis es de 17- 32 g/día, con un tiempo de inicio de acción rápido (0,5- 1 h) y el evento secundario mas frecuente es la incontinencia fecal debido a su potencia laxante57–59. Incluso un estudio comparó PEG con lactulosa, y demostró que el PEG en dosis de 13-39 g/día fue más efectivo y mejor tolerado en el EC56. Finalmente, no se han efectuado estudios clínicos con el hidróxido de magnesio en el EC.
Estudios que evaluaron la polietilenglicol en el estreñimiento crónico
| Autor | Agente | Efectos evaluados | Calidad | Nivel de evidencia |
| Corazziari et al57 | PEG (n = 25) | Aumento de la frecuencia y disminución del pujo y la consistencia | 12/16 | I |
| Placebo (n = 23) | ||||
| Attar et al56 | PEG (n = 47) | PEG > mejoría global y frecuencia | 9/16 | I |
| Lactulosa (n = 49) × 4S | Lactulosa > flatulencia, meteorismo, inflamación | |||
| Di Palma et al58 | PEG (n = 80) | Aumento de la frecuencia | 12/16 | I |
| Placebo (n = 71) | ||||
| Corazziari et al59 | PEG (n = 33) | Remisión completa. Aumentó la frecuencia. Disminución de la consistencia y el pujo | 13/16 | I |
| Placebo (n = 37) (Respondedores a PEG) |
PEG: polietilenglicol.
El tegaserod ha demostrado, en estudios clínicos bien diseñados según la metodología recomendada, cierta efectividad en el manejo del EC y una superioridad sobre placebo para mejorar la frecuencia y la consistencia de las evacuaciones (recomendación de grado A).
El Consenso no recomendó el uso de cisaprida debido a sus efectos adversos, además de que el único estudio efectuado en los últimos 10 años específico para el EC tenía una escasa calidad y mostró que el placebo fue similar a la cisaprida.
Entre estos agentes se encuentran la cisaprida, un agonista 5-HT4, y el tegaserod, un agonista parcial 5-HT4. Con respecto a la cisaprida sólo hay un estudio sobre el EC publicado durante los últimos 10 años, pero adolece de una escasa calidad y demostró igual efectividad que el placebo60. Por otra parte, hay que recordar que si bien este agente se encuentra disponible en Latinoamérica, ha sido retirado del mercado en varios países del mundo por causar arritmias graves.
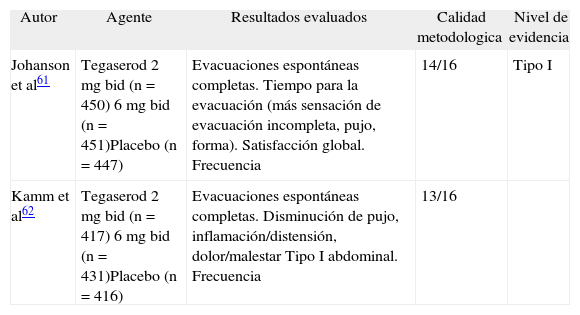
Por otra parte, el tegaserod se ha evaluado en 2 estudios61,62, de los cuales cabe mencionar que el primero tiene importancia para nuestros pacientes ya que fue realizado en el norte y el sur de América, e incluía pacientes de Argentina, Brasil, Chile, Colombia y Venezuela. Ambos estudios fueron muy bien diseñados, con una elevada calidad metodológica, y demostraron una superioridad del tegaserod sobre el placebo en la mejoría de la frecuencia y la consistencia de las evacuaciones. El tegaserod es una evidencia de tipo I para el EC (tabla VII).
Estudios que evaluaron Tegaserod en el estrenimiento cronico
| Autor | Agente | Resultados evaluados | Calidad metodologica | Nivel de evidencia |
| Johanson et al61 | Tegaserod 2 mg bid (n = 450) 6 mg bid (n = 451)Placebo (n = 447) | Evacuaciones espontáneas completas. Tiempo para la evacuación (más sensación de evacuación incompleta, pujo, forma). Satisfacción global. Frecuencia | 14/16 | Tipo I |
| Kamm et al62 | Tegaserod 2 mg bid (n = 417) 6 mg bid (n = 431)Placebo (n = 416) | Evacuaciones espontáneas completas. Disminución de pujo, inflamación/distensión, dolor/malestar Tipo I abdominal. Frecuencia | 13/16 |
EG: polietilenglicol.
Por otra parte, el Consenso analizó el perfil de seguridad de tegaserod; concluye que su efecto secundario más frecuente es la diarrea y recomienda tener precaución ante la presencia de diarrea grave. Sin embargo, en estudios en fase III no hubo diferencias entre los pacientes asignados a tegaserod o placebo en la supresión del tratamiento debido a la diarrea, y en el seguimiento a 12 meses poscomercialización el porcentaje de supresión del tegaserod a causa de la diarrea ha sido sólo del 2,3-3,5%61–63. El efecto secundario extraintestinal más frecuente es la cefalea; no hubo diferencias en cuanto a cirugías pélvicas o abdominales y no produce alteraciones en el intervalo QT62–64. En cuanto a la colitis isquémica, no se ha registrado ningún caso en los estudios controlados, y en la vigilancia poscomercialización ésta es similar a la frecuencia en la población general65. En el momento de la preparación de este documento, el Tegaserod fue suspendido provisionalmente del mercado en varios países del mundo tras revisar los datos de los estudios clínicos controlados, en los que se encontró un desequilibrio en los eventos cardiovasculares isquémicos en los pacientes asignados a tegaserod en comparación con los asignados a placebo, si bien la incidencia en el grupo de tegaserod fue similar a la población general. Hay que anotar que los eventos ocurrieron en pacientes mayores de 55 años y con riesgo de enfermedad cardiovascular66. Por el momento, está siendo evaluado por las agencias regulatorias, y se recomienda no utilizarlo en pacientes mayores de 55 años y/o en pacientes con una enfermedad cardiovascular activa o con riesgo de presentar hipertensión arterial o hipercolesterolemia.
Terapias alternativasNo hay evidencias para recomendar el uso de terapias alternativas (acupuntura, preparaciones herbales, masajes abdominales, homeopatía) en el manejo del EC.
En terapias psicológicas, sólo un estudio evaluó la terapia cognitiva conductual frente a educación en trastornos funcionales digestivos graves, pero no fue un estudio específico para el EC, por lo cual se consideró que no hay evidencias suficientes para recomendar su uso en el manejo de este trastorno.
Hay un solo estudio, de escasa calidad metodológica, sobre las preparaciones herbales en el EC, por lo cual no hay evidencias para recomendar su uso67. En cuanto a los masajes, los estudios disponibles también son de baja calidad68,69, por lo cual no se recomienda su uso. No hay estudios sobre la acupuntura o la homeopatía en adultos con EC. Finalmente, en cuanto a los tratamientos psicológicos, un solo estudio evaluó la terapia cognitiva conductual frente a la educación, desipramina y placebo en pacientes con TFGI graves, pero no fue un estudio específico para el EC70, por lo cual se consideró que tampoco hay evidencias suficientes para recomendar su uso.
Terapias futurasSe ha evaluado la utilidad en el manejo del EC de ciertos agentes, como el misoprostol y la colchicina; sin embargo, los estudios disponibles son de pequeño tamaño y no permiten derivar ninguna conclusión71–73. Asimismo, se ha evaluado la neurotrofina-3, un factor neurotrófico recombinante que muestra resultados satisfactorios, aunque con la limitación de la aplicación parenteral y los efectos adversos locales74. Este agente aún no ha sido aprobado para uso clínico. Recientemente, la Food and Drug Administration (FDA) aprobó el uso del lubiprostone, un activador de los canales de cloro que aumenta la frecuencia y la consistencia de las evacuaciones. En el momento de este Consenso, no se habían publicado estudios clínicos sobre este fármaco y no se encontraba disponible en Latinoamérica, por lo cual no se pudo realizar ninguna recomendación.
Tránsito colónicoEl tránsito colónico con marcadores radioopacos se considera un estudio complementario, indicado en los pacientes refractarios al tratamiento después de 12 semanas con fibra o agentes farmacológicos. En estos casos debe ser el primer estudio que se debe realizar para descartar la presencia de inercia colónica y/o estreñimiento obstructivo. Por otra parte, también se indica para la evaluación de nuevos fármacos para el tratamiento del EC. El protocolo del tránsito colónico deberá ser estandarizado en cada institución (recomendación de grado C).
El tránsito colónico es un estudio radiológico o de medicina nuclear que permite cuantificar el tiempo del movimiento del colon. Puede realizarse la técnica radiológica con marcadores radioopacos o con medicina nuclear. Si bien el tránsito con medicina nuclear se ha evaluado adecuadamente, éste sólo se utiliza en centros muy especializados; los altos costes de esta técnica no permiten que los países en vías de desarrollo lo incorporen a su práctica médica habitual, y sólo se deben realizar como parte de protocolos de investigación33,75.
Para efectos de este Consenso nos centramos en el tránsito con marcadores radioopacos, que es el más aceptado y disponible, el cual se considera un estudio simple, no invasivo, que produce una mínima radiación, reproducible y fácil de realizar e interpretar; puede demostrar de manera objetiva la presencia de estreñimiento, lo cual sirve además para instaurar una terapia individualizada33. Hay varios protocolos, y el más simple consiste en la ingesta de una sola cápsula con 24 marcadores, en la que se debe eliminar el 80% en la radiología del quinto día, el cual sirve como forma general de cribado. Por otra parte, las técnicas modificadas, como la ingesta de 24 marcadores cada día durante 3 días consecutivos y la realización de radiología el cuarto día y el séptimo –dividiendo el tránsito en proximal o colon derecho, distal o colon izquierdo y rectosigmoide– sirven para medir el tránsito por segmentos. Se considera normal un tránsito colónico total de 32- 70 h, y por segmentos se considera normal hasta 22 h en el colon derecho, 37 h en el izquierdo y 37 h en el rectosigmoide. Lo anterior permite determinar básicamente 2 grupos: pacientes con retraso del tránsito del colon derecho (inercia colónica) y pacientes con retraso del rectosigmoide (obstrucción del tracto de salida o defecación obstructiva). Finalmente, cabría determinar un tercer grupo con tránsito normal. No se deben utilizar durante los días previos al estudio laxantes o medicamentos que alteren el tránsito intestinal y/o colónico75–77.
Los estudios clínicos que han evaluado esta técnica diagnóstica, varían en los criterios diagnósticos de EC para la inclusión de los pacientes, no contemplan los criterios de Roma y no mencionan si son pacientes de atención primaria o terciaria. No utilizaron un patrón estándar de comparación, y en la mayoría de los casos el criterio de inclusión fue el mismo tránsito colónico retardado76–80. Además, los estudios son disímiles en cuanto al protocolo de tránsito colónico utilizado. Sólo 4 estudios cumplen el criterio de inclusión en cuanto a tiempo de publicación de este Consenso, y recientemente se ha realizado una revisión sistemática al respecto35,81–84. La mayoría ha mostrado que el 41-70% de los pacientes con EC presentan un estudio de tránsito colónico alterado, lo que significa que hay un porcentaje de sujetos con tránsito normal. No se han constatado diferencias en el tiempo de tránsito colónico según la edad, el sexo, la raza o la dieta84–86. Sólo un estudio evaluó la reproducibilidad del tránsito, que fue del 69%, y ésta fue mayor en sujetos con tránsito normal que con tránsito retardado84. Hasta el momento, no se han realizado estudios en Latinoamérica que evalúen la utilidad de esta técnica.
Debido a la disponibilidad de tratamientos a base de fibra y agentes farmacológicos en el tratamiento del EC, en la actualidad el tránsito colónico con marcadores radioopacos se considera un estudio complementario indicado en los pacientes refractarios a 12 semanas de tratamiento. Por otra parte, también se indica en la evaluación de nuevos fármacos para el tratamiento del estreñimiento crónico en estudios clínicos86. Sólo se recomienda el tránsito colónico como estudio inicial en los países donde el megacolon por enfermedad de Chagas o megacolon idiopá- tico, como Argentina, tienen una alta prevalencia. El protocolo utilizado deberá ser estandarizado en cada institución.
Manometría anorrectalSe recomienda realizar una manometría anorrectal como estudio diagnóstico complementario, principalmente para descartar una contracción paradójica-anismo-disinergia del suelo pélvico en los pacientes que no respondieron a tratamiento médico y que presentaron un retraso en el tránsito del rectosigmoide y/o colon izquierdo por tránsito colónico con marcadores radioopacos (recomendación de grado C).
La manometría anorrectal evalúa los cambios de la presión intraluminal de la región anorrectal por medio de catéteres perfundidos y balones conectados a sensores de presión. Más específicamente en el EC, por medio de la manometría anorrectal se puede medir la presión del esfínter anal en reposo, la contracción voluntaria máxima, el reflejo rectoanal inhibitorio, la sensibilidad rectal, la capacidad de relajación del suelo pélvico durante el pujo y la relación volumen/presión o capacitancia rectal5,86,87. En el EC se puede encontrar una presión elevada del esfínter anal en presencia de fisura anal y/o en anismo, y un reflejo rectoanal inhibitorio ausente en la enfermedad de Hirschsprung, pero la mayoría de los pacientes que presentan pérdida de este reflejo tienen megarrecto secundario al estreñimiento, lo que hace que la distensión del balón sea insuficiente para estimular las paredes del recto y desencadenar el reflejo. En disinergia del suelo pélvico se produce una contracción inapropiada o paradójica durante el pujo defecatorio; se puede encontrar hiposensibilidad rectal en pacientes con una lesión neurológica, pero también puede ser secundario al aumento de la capacitancia rectal88,89. La técnica y los parámetros evaluados por manometría anorrectal varían de un laboratorio a otro y deben ser estandarizados en cada uno; habitualmente incluyen la prueba de expulsión de balón que ayuda en el diagnóstico de obstrucción funcional, en particular la disinergia del suelo pélvico.
No hay estudios controlados que evalúen la manometría anorrectal; en los últimos 10 años se ha realizado el estudio de 5 series de casos89–92 además de una revisión sistemática35. Los estudios son disímiles en su metodología y en los parámetros evaluados. El primer estudio91 encontró que la manometría anorrectal modificó el manejo del 76% de los EC y que el 48% de éstos tenían estreñimiento obstructivo. Otro estudio no encontró diferencias en la presión de reposo y la contracción voluntaria máxima entre los pacientes estreñidos y los sujetos sanos, si bien la capacitancia y el volumen máximo tolerado fue mayor en el EC93. Un estudio encontró hiposensibilidad rectal en pacientes con inercia colónica79 y otro resaltó la presencia de reflejo rectoanal inhibitorio como criterio excluyente de la biopsia para descartar una enfermedad de Hirschsprung en el megarrecto92. Por otra parte, se identificaron 3 grupos de disinergia (contracción paradójica, propulsión inapropiada y relajación inapropiada), pero los Criterios de Roma II fueron insuficientes para identificar y subclasificar a los pacientes con contracción paradójica, y se concluye que se requiere conjuntar los síntomas con los hallazgos manométricos, la expulsión del balón y el tránsito colónico87. Cabe recordar que el concepto de disinergia ha surgido en los últimos 10 años y, según los Criterios de Roma II-III, se requieren los criterios de EC junto con criterios manométricos, electromiográficos o radiológicos de contracción paradójica, adecuada fuerza de expulsión y limitación en la evacuación. La manometría anorrectal es útil entonces como estudio complementario en pacientes con EC con síntomas de obstrucción del tracto de salida (esfuerzo excesivo para evacuar, y o necesidad de maniobras digitales), ante la sospecha de enfermedad de Hirschsprung, o con retraso en el rectosigmoide y/o colon izquierdo detectados por tránsito colónico94.
DefecografíaSe recomendó en pacientes con EC como prueba diagnóstica complementaria en los pacientes que no respondan al tratamiento convencional y que tengan un tránsito colónico retardado en el rectosigmoide (estreñimiento obstructivo) y manometría anorrectal previa normal y/o en pacientes con síntomas obstructivos (recomendación de grado C).
No se recomendó la defecografía como prueba única en la evaluación de la disfunción defecatoria. El Consenso reconoció que todavía la defecografía no es una técnica debidamente estandartizada y que es necesario mantener cierta prudencia en la interpretación de sus resultados, principalmente cuando se contempla una indicación quirúrgica como resultado de este estudio.
La defecografía es una prueba radiológica dinámica que ofrece información útil sobre los cambios anatómicos y funcionales de la porción anorrectal. Permite una valoración de las distintas fases de la evacuación, incluido el reposo, el esfuerzo defecatorio o pujo y la contracción esfinteriana voluntaria. Se realiza con el paciente sentado en una silla radiolúcida, y en proyección lateral se evalúa con fluoroscopia la dinámica de la evacuación utilizando un bario semisólido que simula la consistencia de las heces35. Los hallazgos defecográficos en la disinergia del suelo pélvico incluyen la disminución del ángulo anorrectal durante el esfuerzo defecatorio o contracción paradójica, el aumento de la contracción del músculo puborrectal y/o la imposibilidad para evacuar el bario semisólido. También permite detectar alteraciones anatómicas, como rectocele, sigmoidocele y enterocele, intususcepción, prolapso rectal y descenso perineal87.
Hemos hallado al menos 8 estudios en la literatura médica que han evaluado esta prueba en pacientes con EC durante los últimos 10 años35. Éstos presentan metodologías y resultados muy diversos: algunos indican una frecuencia de normalidad del 10-75%, y otros resultados anormales en el 25-90% de los casos. La frecuencia de disinergia del suelo pélvico, o anismo, varió del 13 al 37%, con una altísima reproducibilidad; sin embargo, recientemente se ha demostrado que la defecografía no confiere beneficios adicionales a los obtenidos mediante tránsito colónico, manometría anorrectal y test de expulsión con balón87. En conclusión, no hay evidencias suficientes para el uso sistemático de esta técnica diagnóstica en pacientes con EC, excepto en los pacientes con sospecha de contracción paradójica del suelo pélvico o anormalidades anatómicas, como enterocele y/o rectocele.
BiorretroalimentaciónSe recomendó como tratamiento para pacientes con contracción paradójica del suelo pélvico (recomendación de grado B). El Consenso reconoce que no se ha establecido un tipo de técnica estándar ni el número de sesiones necesarias.
La biorretroalimentación es un método de aprendizaje por medio del cual los pacientes reciben retroalimentación visual y auditiva de una función de la que usualmente no son conscientes, en este caso (disinergia del suelo pélvico) para reentrenar a los pacientes a relajar los músculos del suelo pélvico durante el pujo y coordinar esta relajación con maniobras abdominales para permitir el paso de la materia fecal. Se puede realizar por medio de electromiografía o con manometría. Para lograr un tratamiento satisfactorio, son indispensables una correcta explicación de las instrucciones por parte del terapeuta, un adecuado nivel de educación del paciente y cierta capacidad para comprender la técnica, la disposición del paciente a cooperar y mejorar, y una buena relación terapeuta-paciente95. La mayoría de los estudios que han evaluado esta modalidad terapéutica corresponde a series de casos o estudios retrospectivos de calidad entre baja y aceptable, que difieren en la técnica utilizada (electromiografía y/o manometría), número de sesiones, tiempo de seguimiento y parámetros de mejoría evaluados. La efectividad en estos estudios se ha descrito en un rango del 62-85%96–105. Además, en una revisión sistemática reciente se ha indicado una efectividad del 62,4% en 38 estudios de EC y disinergia del suelo pélvico95. Cabe destacar que recientemente se ha publicado el primer estudio controlado que comparó la biorretroalimentación con PEG asociado a 5 sesiones de consulta. Este estudio demostró una efectividad de la biorretroalimentación del 80% en comparación con los laxantes106. Asimismo, otro estudio aleatorizado de biorretroalimentación con una maniobra facticia confirmó la efectividad de este tratamiento107.
Papel del tratamiento quirúrgico en el estreñimiento crónicoNo hay estudios controlados que evalúen el tratamiento quirúrgico en el manejo del EC. Sin embargo, la colectomía total con ileorrectoanastomosis se puede considerar en pacientes con inercia colónica que no respondan a tratamiento médico y en ausencia de obstrucción funcional del tracto de salida, y de trastornos de la motilidad esofágica, gástrica y/o de intestino delgado (recomendación de grado C).
En alteraciones asociadas a disfunción defecatoria (rectocele, intususcepción, prolapso rectal y fisuras anales), la cirugía deberá ser individualizada (recomendación de grado C).
En la inercia colónica grave se puede considerar la resección colónica total más ileorrrectoanastomosis solamente en los pacientes que no respondan a tratamiento médico y en quienes se haya descartado una obstrucción funcional del tracto de salida y/o trastornos de la motilidad esofágica, gástrica y del intestino delgado. Además, cabe señalar que la manometría colónica también debe realizarse preoperatoriamente, ya que se ha indicado que los pacientes con hallazgos compatibles con neuropatía no responden al tratamiento habitual y requieren colectomía, a diferencia de los pacientes con cambios de miopatía que tienen una mejor respuesta a la cirugía108. Si bien es cierto que esta técnica no está disponible en la mayoría de los centros en Latinoamérica, a ser posible debe considerarse en la selección quirúrgica de los pacientes. En una revisión de 32 estudios no controlados, los pacientes han señalado su satisfacción con los resultados de la cirugía en un rango del 32-100%109. Más recientemente, un estudio realizado en 15 pacientes con EC que no respondieron al tratamiento, y en quienes se confirmó una inercia colónica, obtuvo resultados satisfactorios excepto en un caso, después de 38 meses de seguimiento110. Otro grupo reportó una colectomía con ileorrectoanastomosis en el 3% de pacientes con EC y, al ser evaluados prospectivamente a los 11 años, el 98% indicó una mejoría del estreñimiento y el 85% su satisfacción con el hábito intestinal. Además, la cirugía había producido mejoría, o por lo menos no había afectado a su actividad social, vida sexual, actividades domésticas y relaciones familiares111. Hay que mencionar que todas estas series formaban parte de estudios no controlados. Además, hay que mencionar que no se recomiendan las resecciones parciales de colon.
En las alteraciones asociadas a la disfunción del suelo pélvico debe individualizarse el papel de la cirugía. En el caso de rectocele, estará limitada a los de tamaño significativo (aunque esto es aún controvertido) y en mujeres que requieren de presión digital transvaginal para lograr la evacuación112–114.
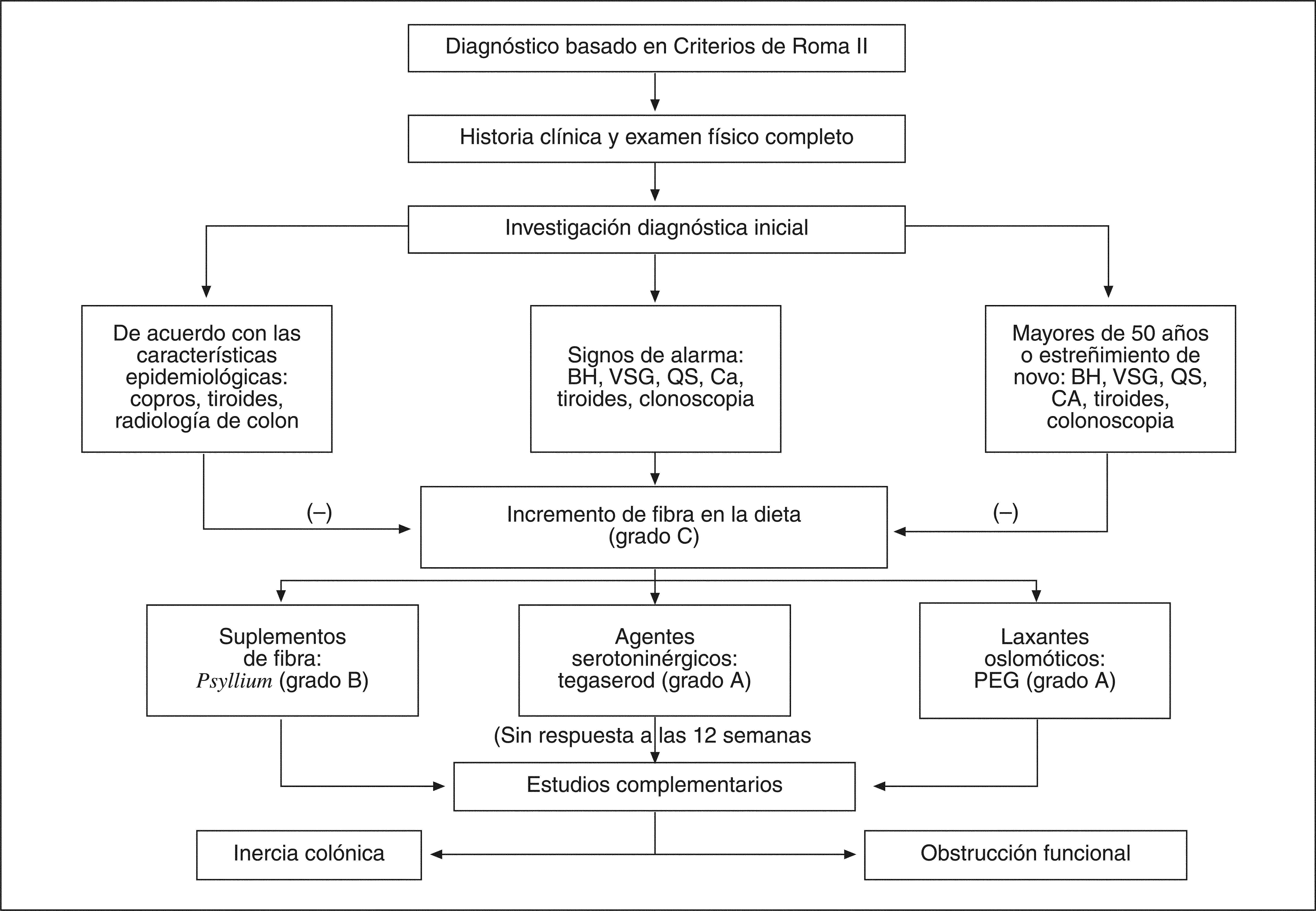
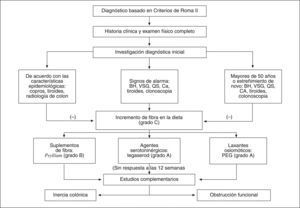
Algoritmo de diagnóstico y tratamientoPara conducir, se presenta un algoritmo que resume las recomendaciones de diagnóstico y tratamiento del Consenso Latinoamericano de Estreñimiento Crónico, con el objeto de ofrecer una guía rápida y sencilla de consulta (fig. 2).
AGRADECIMIENTOSEl Consenso Latinoamericano de Estreñimiento Crónico agradece el respaldo de las siguientes entidades:
Asociación Interamericana de Gastroenterología-AIGE, Asociación Colombiana de Enfermedades Digestivas, Asociación Guatemalteca de Gastroenterología, Asociación Hondureña de Gastroenterología, Asociación Mexicana de Gastroenterología, A.C. Asociación Panameña de Gastroenterología, Federación Brasilera de Gastroenterología, Sociedad Argentina de Gastroenterología, Sociedad Chilena de Gastroenterología, Sociedad Ecuatoriana de Gastroenterología, Sociedad de Gastroenterología del Perú, Sociedad de Gastroenterología del Uruguay, Sociedad Venezolana de Gastroenterología.
Al Dr. José María Remes Troche, investigador titular de tiempo completo de la Universidad Veracruzana, quien fungió como revisor técnico del presente documento.
Conflicto de interes: Queremos expresar nuestro agradecimiento a Novartis Latinoamérica por otorgar un aporte económico irrestricto para la realización de este Consenso.