INTRODUCCION
Habitualmente, el desarrollo de nuevos tratamientos oncológicos acontece tras la identificación en estudios básicos y/o experimentales de dianas terapéuticas implicadas en la patogenia de un determinado tumor. Sin embargo, la estrategia de inhibir la ciclooxigenasa 2 (COX-2) con el fin de prevenir o tratar diferentes neoplasias ha seguido un proceso inverso. Así, fueron en primer lugar las observaciones clínicas y los estudios de cohortes los que sugirieron que el uso de antiinflamatorios no esteroideos (AINE), un grupo de fármacos que inhiben la actividad de la enzima ciclooxigenasa, se asociaba con una menor incidencia de neoplasias colorrectales, entre otras. Esta evidencia clínica impulsó una importante labor de investigación en el laboratorio que condujo a la identificación de la diana molecular de estos fármacos, la isoforma COX-2, y su implicación en el proceso de transformación y progresión neoplásica. Por último, recientemente, el círculo de la investigación terapéutica oncológica se ha cerrado mediante el desarrollo de fármacos que inhiben selectivamente esta isoforma, los coxibs, con lo cual no tan sólo se ha confirmado la participación de COX-2 en estos procesos carcinogénicos, sino que se dispone de un nuevo grupo farmacológico para la prevención y/o tratamiento de determinadas neoplasias1.
Esta revisión abordará las evidencias epidemiológicas, experimentales y clínicas que apoyan la utilidad de los AINE y, más en concreto, los inhibidores selectivos de la COX-2, en la prevención y el tratamiento de determinadas tumores malignos, fundamentalmente el cáncer colorrectal (CCR).
EVIDENCIAS EPIDEMIOLOGICAS
La mayor parte de los estudios epidemiológicos publicados hasta la actualidad demuestran que el uso de aspirina u otros AINE se asocia con una reducción del riesgo de desarrollar CCR2. Las evidencias se basan en estudios de casos y controles, de cohortes y, más recientemente, de ensayos clínicos. De los 15 estudios observacionales publicados hasta la actualidad, 9 observan una disminución del riesgo de presentar esta neoplasia2. Además, 5 de los 6 estudios de cohortes también observan una reducción del 30-40% en la incidencia de CCR2. En uno de ellos, el consumo regular de aspirina en dosis bajas redujo la mortalidad por CCR3, mientras que en otro el beneficio era únicamente relevante cuando éste se mantenía durante un período superior a 10 años4. Sin embargo, este efecto beneficioso no se confirmó en un ensayo clínico aleatorizado5. En él, la administración de una dosis de 325 mg a días alternos no comportó ningún beneficio con relación al riesgo de presentar CCR. No obstante, es importante señalar que este estudio se interrumpió a los 4 años de seguimiento, dado que había diferencias a favor de aspirina en la prevención del infarto, objetivo primario del estudio5. Esta finalización precoz podía justificar la ausencia de diferencias en relación con la incidencia de CCR, sobre todo si se tiene en cuenta que el proceso de transformación y progresión tumoral es largo. En este sentido, recientemente, otro estudio controlado y aleatorizado ha demostrado que la administración de aspirina disminuye la probabilidad de presentar adenomas metacrónicos en pacientes con antecedente personal de CCR6. Asimismo, un estudio de cohortes realizado en el seno del Nurses' Health Study, con un seguimiento muy extenso, ha confirmado el efecto beneficioso de la administración de aspirina u otros AINE en relación con el riesgo de CCR, que es dependiente de la dosis administrada y de la duración del tratamiento7.
El efecto de los AINE también se ha evaluado en pacientes con adenoma colorrectal esporádico, una lesión precursora del CCR y aceptada universalmente como marcador del riesgo de carcinogénesis colorrectal. En consonancia con los resultados observados en el CCR, los 7 estudios observacionales publicados (5 estudios de casos y controles, y 2 de cohortes) también demuestran una disminución del riesgo de desarrollar esta lesión, tanto en relación con el consumo de aspirina como de otros AINE7-13. Además, en un estudio controlado y aleatorizado se demuestra que la administración de aspirina disminuye la probabilidad de desarrollar adenomas metacrónicos tras la polipectomía en pacientes con adenomas colorrectales14.
MECANISMOS DE ACCION DE LOS ANTIINFLAMATORIOS NO ESTEROIDEOS
La ciclooxigenasa es la enzima responsable del metabolismo del ácido araquidónico y su conversión a prostaglandina H2, precursor de los prostanoides (PGD2, PGE2, PGF2a, PGI2, TXA2). Recientemente, se han descrito 2 isoformas de la ciclooxigenasa, COX-1 y COX-2, con una homología del 60% y una afinidad y una capacidad para convertir el ácido araquidónico a PGH2 de rango similar15,16. Las características diferenciales de ambas isoformas se resumen en la tabla I. Entre ellas, destacan los mecanismos de regulación y el patrón de expresión. La isoforma COX-1 se expresa de manera constitutiva en prácticamente todos los tejidos del organismo y se le atribuye un papel regulador en la homeostasis fisiológica de los diferentes órganos o tejidos, que incluye la citoprotección gástrica, la vasodilatación renal y la producción de prostanoides proagregantes y tromboxano en las plaquetas17. Por el contrario, la isoforma COX-2 es inducible, lo que comporta que sea prácticamente indetectable en la mayoría de tejidos en condiciones basales, mientras que su expresión aumenta en respuesta a citocinas, factores de crecimiento y mitógenos.
La aspirina y otros AINE inhiben tanto COX-1 como COX-2, mientras que los coxibs (celecoxib, rofecoxib, valdecoxib y etoricoxib, entre otros) inhiben selectivamente la isoforma COX-2. Todos estos fármacos inducen la apoptosis mediante diversos mecanismos, algunos de ellos dependientes y otros independientes de ciclooxigenasa. La inhibición de COX-2 comporta un aumento de ácido araquidónico, el cual, a su vez, estimula la conversión de esfingomielina a ceramida, un mediador de la apoptosis18. La inhibición de COX-2 también puede inducir apoptosis a través de la alteración de la producción de prostaglandinas y de la disminución de factores angiogénicos19,20. Entre los mecanismos no dependientes de ciclooxigenasa destacan la inhibición de la activación del factor de transcripción NF-kB21, la interferencia de la unión del receptor hormonal nuclear PPARd22 y la disminución de la expresión del gen antiapoptótico BCL-XL23.
Diversos estudios experimentales han demostrado que la administración de celecoxib en modelos tumorales murinos disminuye la proliferación celular y aumenta la apoptosis. Este efecto no se halla limitado a las células neoplásicas puesto que se ha observado que este fármaco ocasiona una acción similar en las células endoteliales, lo que potencia su efecto antiangiogénico24,25.
IMPLICACION DE CICLOOXIGENASA 2 EN EL CANCER COLORRECTAL
Mediante estudios de expresión génica, tanto de ARN como de proteínas, se ha demostrado que hay una sobreexpresión de COX-2 en más del 85% de muestras de CCR humano, así como en aproximadamente el 50% de los adenomas colorrectales26-28. De manera similar, también se ha observado una sobreexpresión de esta isoenzima en adenomas desarrollados en modelos experimentales de poliposis adenomatosa (ratones Apc3tri716)29 o de carcinoma de colon inducido por carcinógenos químicos30. Además, en ambos modelos experimentales se ha demostrado que la administración de celecoxib induce una disminución de la incidencia (número de animales con lesión) y la multiplicidad (número de lesiones por animal) de neoplasias colorrectales31-33.
La sobreexpresión de COX-2, ya sea en las células epiteliales o en las de la estroma adyacente, justifica que las prostaglandinas derivadas puedan ejercer su efecto favorecedor del desarrollo tumoral en ambas localizaciones34. En la propia célula epitelial, las prostaglandinas modifican la expresión de genes reguladores clave, lo que comporta un aumento de su resistencia a la apoptosis y de su capacidad migratoria35. Paralelamente, la sobreexpresión estromal de COX-2 favorece la neovascularización, un hecho fundamental para el crecimiento tumoral, ya sea a través de su efecto en los fibroblastos o en las propias células endoteliales20.
La implicación de la COX-2 en el CCR también se ha demostrado en estudios clínicos. En este sentido, hay una correlación entre la sobreexpresión tumoral de esta enzima y el estadio de la lesión, su tamaño y la presencia de metástasis ganglionares36. La participación de COX-2 en el CCR no se halla limitada a esta observación, sino que ha sido posible correlacionar la sobreexpresión de COX-2 en muestras tumorales de pacientes afectados de esta neoplasia con una menor probabilidad de supervivencia37.
Por último, es importante señalar que la sobreexpresión de COX-2 no es un fenómeno universal en todas las formas de CCR. Así, recientemente se ha podido demostrar que, a diferencia de lo que ocurre en los tumores con mecanismo de reparación de los errores de replicación del ADN intacto, un porcentaje significativo de los que muestran una alteración de este sistema de reparación (puesta de manifiesto por la presencia de inestabilidad de microsatélites o pérdida de expresión de las proteínas reparadoras)38 no presentan sobreexpresión de COX-239. Además, este estudio ha podido demostrar que la pérdida de sobreexpresión de COX-2 en tumores inestables se asocia, de forma casi constante, con los casos esporádicos en los que la alteración del sistema de reparación se debe a la metilación del promotor del gen MLH1, mientras que los tumores asociados al síndrome de Lynch presentan sobreexpresión de esta isoenzima39. Estos resultados apoyan la potencial utilidad de los AINE en la prevención y/o tratamiento de esta forma hereditaria de CCR, al mismo tiempo que explican la ausencia de respuesta a estos fármacos en una pequeña proporción de tumores esporádicos.
UTILIDAD CLINICA DE LOS INHIBIDORES SELECTIVOS DE CICLOOXIGENASA 2
Las evidencias epidemiológicas, experimentales y clínicas mencionadas en los apartados anteriores apoyan la utilidad de los AINE y, más concretamente, los inhibidores selectivos de la COX-2 en la prevención y/o el tratamiento de diversas neoplasias. Este potencial clínico se ve reforzado por el bajo índice de efectos adversos gastrointestinales, una de las limitaciones habituales de los AINE clásicos, como consecuencia de su efecto selectivo sobre la isoforma inducible. En este sentido, la preservación de la actividad COX-1 que se consigue con estos fármacos permite reducir muy notablemente los efectos secundarios de los AINE no selectivos atribuibles a la disminución gástrica o renal de las prostaglandinas.
Poliposis adenomatosa familiar
La poliposis adenomatosa familiar (PAF) es una enfermedad hereditaria autosómica dominante, caracterizada por la presencia de múltiples pólipos adenomatosos (más de 100) a lo largo de todo el intestino grueso. El desarrollo de pólipos suele iniciarse a partir de la pubertad, aunque habitualmente no ocasionan clínica hasta los 30-35 años de edad. Se trata de una enfermedad con un alto potencial de malignización, de manera que si no se efectúa tratamiento quirúrgico, la práctica totalidad de pacientes desarrollará CCR antes de los 40 años de edad40. En 1991, fue posible identificar mediante estudios de ligamiento el gen responsable de la PAF, Adenomatous polyposis coli (APC), localizado en el brazo largo del cromosoma 5. Así, los individuos afectados de esta enfermedad presentan mutaciones germinales en este gen y una correlación genotipo-fenotipo, de tal manera que la localización de dicha mutación determina el espectro clínico de la enfermedad40.
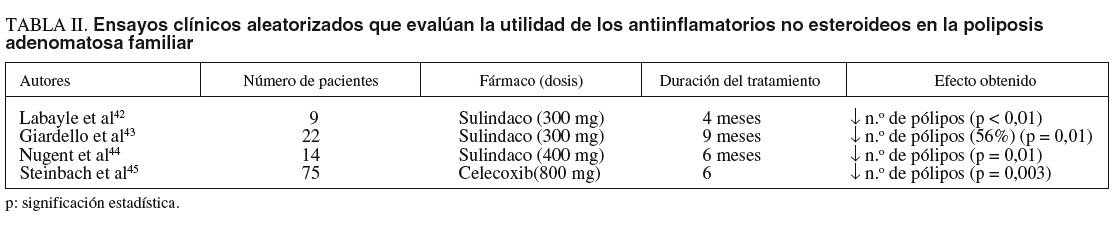
El tratamiento de la PAF es siempre quirúrgico y debe realizarse sin demora en los pacientes que hayan sobrepasado los 25 años de edad. Sin embargo, se ha descrito de forma consistente la regresión de los adenomas colónicos con el tratamiento prolongado con AINE, en especial con sulindaco41-44 y, más recientemente, celecoxib45 (tabla II). Este efecto beneficioso no se halla limitado a las lesiones colorrectales, sino que se ha observado un resultado similar en relación con los adenomas duodenales46. En estos estudios se ha conseguido una disminución significativa del número total y del tamaño de los pólipos, aunque la interrupción del tratamiento provoca la reaparición de las lesiones. Además, diversas evidencias sugieren que la administración de AINE, a pesar de promover la remisión de los pólipos, no comporta la desaparición absoluta del riesgo de desarrollar CCR en estos pacientes47, por lo que en la actualidad únicamente está aceptada su utilización como terapia adyuvante en pacientes con pólipos en el remanente rectal, pero no como alternativa a la cirugía.
Neoplasia colorrectal esporádica
Los resultados obtenidos en la PAF, tanto en modelos experimentales como en ensayos clínicos en humanos, han sugerido la posible utilidad de los inhibidores selectivos de la COX-2 en la prevención y/o el tratamiento del CCR esporádico.
De forma experimental, se ha observado que la administración de celecoxib en ratones con tumores inducidos por azoximetano disminuye la incidencia y la multi plicidad tumoral48. Es interesante señalar que este efec to ocurre tanto si el inhibidor se administra antes y después de la administración del carcinógeno (fases de iniciación/ postiniciación) como si éste se suministra exclusivamente en la fase de promoción/progresión48, lo cual indica una utilidad potencial de estos fármacos tanto en la prevención como en el tratamiento de estas neoplasias.
Uno de los aspectos más importantes en relación con el uso de los inhibidores selectivos de la COX-2 es su potencial implicación en la prevención del CCR. Este hecho se vería favorecido por su perfil de seguridad, posiblemente más favorable que el de los AINE no selectivos. En este sentido, recientemente se han publicado los resultados de 3 estudios multicéntricos controlados y aleatorizados dirigidos a evaluar la utilidad de celecoxib49,50 o rofecoxib51 en la prevención de la recurrencia de adenomas colorrectales tras su resección endoscópica (profilaxis terciaria). En todos ellos ha sido posible demostrar que los coxibs disminuyen la probabilidad de presentar nuevos adenomas y adenomas avanzados49-51 (tabla III), en consonancia con lo observado en estudios previos en los que se utilizaba aspirina u otros AINE.
El punto débil de estos relevantes estudios viene determinado por los efectos cardiovasculares secundarios asociados con los inhibidores selectivos de la COX-2, lo que limita inexorablemente su uso, en especial en indicaciones preventivas. Así, mientras todos los estudios confirman una disminución de la toxicidad gastrointestinal, hay un incremento significativo del riesgo de presentar fenómenos tromboembólicos cardíacos y cerebrales, que parece depender de la dosis administrada y la duración del tratamiento, así como de la predisposición individual a tener estas alteraciones52,53.