La discriminación entre enfermedades inflamatorias intestinales (EII) y trastornos funcionales gastrointestinales es compleja debido a que pueden presentar cuadros clínicos similares. La calprotectina fecal (CPF) es un marcador inflamatorio útil para este fin y permite seleccionar a los pacientes que más se pueden beneficiar de someterse a una colonoscopia. El objetivo fundamental de este estudio fue valorar la utilidad de la CPF para diferenciar entre enfermedades orgánicas y funcionales.
Material y métodosSe determinó la concentración de CPF de 264 pacientes que presentaban signos o síntomas gastrointestinales indicativos de enfermedad orgánica, y se calculó su precisión diagnóstica mediante el área bajo la curva a partir del diagnóstico final.
ResultadosLos pacientes con enfermedad orgánica presentaron valores de CPF mayores (mediana 254μg/g; intervalo de confianza [IC] 95%, rango intercuartil 105-588,5) que el grupo con enfermedad funcional (95μg/g; IC 95%, 47,25-243,92; p<0,0001), así como el grupo con EII (270,85μg/g; IC 95%, 96,85-674,00) obtuvo valores más elevados que el grupo con síndrome del intestino irritable (79,70; IC 95%, 36,50-117,25; p<0,0001). Para un valor de corte de 150μg/g se obtuvo un valor del área bajo la curva de 0,718 para discriminar entre enfermedad orgánica y funcional, y de 0,872 para discriminar entre síndrome del intestino irritable y EII.
ConclusiónEn este estudio se corrobora el alto valor de la CPF en la evaluación de pacientes con sospecha de EII. La mejor eficacia diagnóstica se consigue con un cut-off de 150μg/g para la discriminación entre EII y síndrome del intestino irritable.
Diagnostic discrimination between inflammatory bowel disease (IBD) and functional gastrointestinal disorders is complex, as they cause similar signs and symptoms. Faecal calprotectin (FC) is a useful marker in this context, and can be used to select patients who will most benefit from colonoscopy. The aim of this study was to evaluate the utility of FC in discriminating between organic disease and functional disorders.
Material and methodsThe study included 264 patients presenting with gastrointestinal complaints consistent with an organic pathology. FC levels were determined and diagnostic accuracy was assessed using the area under the curve obtained from the final diagnosis.
ResultsCalprotectin levels in organic bowel disease patients were significantly higher (median 254μg/g; 95% confidence interval [CI], interquartile range 105-588.5) than in functional disease patients (95μg/g; 95% CI, 47.25-243.92) (P<.0001). Similarly, in patients with IBD, the values obtained were higher (270.85μg/g; 95% CI, 96.85-674.00) than in those with irritable bowel syndrome (79.70μg/g; 95% CI, 36.50-117.25) (P<.0001). For a cut-off of 150μg/g, FC had an area under the ROC curve to discriminate between organic and functional disease of 0.718, and 0.872 to discriminate between irritable bowel syndrome and IBD.
ConclusionOur study supports the importance of FC as a marker in the evaluation of patients with IBD. The best diagnostic accuracy is obtained at a cut-off value of 150μg/g.
El dolor o malestar abdominal, acompañado de diarrea o estreñimiento, es una causa común de asistencia en las consultas de atención primaria y de gastroenterología1. Muchos síntomas clínicos presentes en el dolor abdominal de origen funcional son comunes con otros trastornos orgánicos2, principalmente con los de la enfermedad inflamatoria intestinal (EII), por lo que conviene diferenciar pronto a estos pacientes a fin de evitar estudios innecesarios.
El síndrome del intestino irritable (SII) es el trastorno funcional gastrointestinal más común, cuya prevalencia se sitúa en Europa en torno al 10-15%. En cambio, las EII son menos frecuentes, con una prevalencia en torno al 0,1-0,2% para la colitis ulcerosa (CU) y al 0,05-0,1% para la enfermedad de Crohn (EC)3. El SII tiene un curso benigno pero resulta molesto, doloroso y reduce en gran medida la calidad de vida del paciente4. Los síntomas más frecuentes son dolor abdominal, distensión y/o defecación alterada. La base fisiopatológica no está plenamente establecida, pero se han propuesto varios factores implicados: alteraciones en la motilidad intestinal, hipersensibilidad visceral, alteraciones psicológicas y mecanismos inflamatorios y postinfecciosos5. Alrededor de un 3% de las consultas de atención primaria y de un 16 a un 25% de las consultas de gastroenterología son debidas a esta afección6. En cambio, la EII es un trastorno inflamatorio crónico del tracto gastrointestinal que comprende 2 entidades mayores: la CU y la EC, cuyo curso evolutivo alterna brotes de actividad inflamatoria con períodos de remisión y que puede llegar a dar complicaciones graves, requiriendo en algunas ocasiones ingresos hospitalarios. La CU se caracteriza por una inflamación continua de la mucosa del colon, mientras que la EC presenta una afectación discontinua y de carácter transmural que puede implicar cualquier tramo del tracto digestivo, aunque con localización más frecuente en el íleon terminal y en el colon. En cuanto a su etiología, no hay nuevos datos relevantes sobre la de la EII7, pero se propone un origen multifactorial, resultado de una compleja interacción entre factores genéticos, ambientales y propios del sistema inmunitario de los pacientes.
La sospecha clínica de una EII motiva, generalmente, la práctica de un análisis de sangre, un análisis de materias fecales, una endoscopia (sigmoideoscopia o colonoscopia), una biopsia y estudios de imagen, que ayudan a excluir otras causas y a confirmar el diagnóstico.
La endoscopia sigue siendo el gold standard, ya que permite visualizar directamente la mucosa intestinal y obtener biopsias. Pero es un examen que tiene algunos riesgos y limitaciones, debido a que es un procedimiento invasivo, dependiente del operador, que resulta molesto, que requiere preparación y anestesia en pacientes pediátricos y que tiene un coste relativamente alto. Se estima que el resultado de más del 60% de las colonoscopias realizadas en pacientes jóvenes son normales y, por lo tanto, potencialmente evitables8.
Teniendo en cuenta la elevada demanda de consultas de gastroenterología e investigaciones endoscópicas, una prueba que permita a los médicos descartar con confianza una EII beneficiará a los pacientes y a los servicios de gastroenterología, ya que se evita la realización de pruebas invasivas prescindibles. El biomarcador ideal debería hacer mucho más eficiente el uso de la colonoscopia gracias a una elevada sensibilidad para no producir retrasos en el diagnóstico, y especificidad para evitar exploraciones innecesarias9. Varios marcadores no invasivos se han recomendado a este propósito, entre otros los típicos parámetros bioquímicos de inflamación, la velocidad de sedimentación globular y la proteína C reactiva, pero no son lo suficientemente sensibles ni específicos para estas afecciones10.
La determinación de calprotectina en heces se está afianzando en los últimos años como un nuevo marcador útil de EII. Varios estudios demuestran, además, que existe una asociación entre los niveles de calprotectina y el grado de inflamación; en consecuencia, puede usarse para monitorizar la respuesta al tratamiento y predecir el riesgo de recidivas11,12.
La calprotectina es una proteína abundante y ampliamente distribuida13 que se encuentra principalmente en leucocitos polimorfonucleares neutrófilos, monocitos y macrófagos reactivos14, que representa un 60% del contenido total de proteínas de su citoplasma15. Su función biológica no se conoce con exactitud, pero destaca su actividad protectora en procesos inflamatorios, infecciosos y proliferativos, en los que sus niveles plasmáticos se incrementan de 8 a 40 veces16. La concentración fecal es mayor, unas 6 veces la plasmática. Su resistencia al calor y a la degradación metabólica por enzimas bacterianas y por las propias proteasas intestinales hace posible que se elimine de forma intacta por las heces17. Su elevación se debe a un incremento en la permeabilidad de la mucosa que induce la migración de leucocitos polimorfonucleares neutrófilos y monocitos hacia la luz intestinal, donde tras realizar su actividad mueren liberando al medio gran cantidad de calprotectina.
Los estudios han demostrado que los niveles elevados no se ven afectados por la inflamación extraintestinal y solo se encuentra elevada en diferentes enfermedades de carácter inflamatorio con afectación intestinal2 (por ejemplo, fibrosis quística, artritis reumatoide, EC, CU e infecciones bacterianas) y neoplásicas (por ejemplo, cáncer colorrectal).
La calprotectina fecal (CPF) permite gestionar y controlar a los pacientes adecuadamente y evita la realización de pruebas innecesarias a los que presentan un trastorno funcional.
El objetivo fundamental de este estudio fue valorar la utilidad de la CPF para discriminar entre enfermedades intestinales de carácter orgánico y funcional, y entre la EII y el SII, estimando mediante el análisis de la curva ROC el rendimiento diagnóstico de esta prueba, valorando su sensibilidad (S), especificidad (E), valor predictivo positivo (VPP) y valor predictivo negativo (VPN) para diferentes puntos de corte.
Material y métodosEstudio observacional prospectivo de abril a agosto de 2015 de pacientes remitidos a la unidad de Digestivo y Digestivo infantil del Hospital Clínico Universitario Virgen de la Arrixaca (Murcia) a los que se les solicitó CPF por presentar síntomas y signos indicativos de enfermedad orgánica (dolor abdominal intenso e invalidante, diarrea crónica, cambios importantes en los hábitos intestinales, hematoquecia y estancamiento ponderal en niños). Se descartó a los pacientes con historia de cáncer o pólipos intestinales.
Se realizó un examen físico general y se obtuvo una historia clínica completa interrogando a todos los pacientes o familiares a cargo acerca de sus síntomas intestinales y extraintestinales, duración de estos, otras enfermedades del paciente, antecedentes de viajes, toma de medicamentos (antibióticos y antiinflamatorios no esteroideos), antecedentes familiares de enfermedades intestinales (EII, enfermedad celiaca o cáncer colorrectal) y hábitos tóxicos. Se sometió a todos los pacientes a las pruebas necesarias hasta obtener un diagnóstico definitivo, que incluyeron: análisis de sangre, exámenes coprológicos y coprocultivos (buscando infección, leucocitos, sangre oculta en heces y CPF) y la realización de estudios endoscópicos (colonoscopia y cápsula endoscópica) si procedía. Los pacientes tributarios de estudios endoscópicos fueron aquellos sin EII conocida y con: hematoquecia, dolor abdominal bajo intenso e invalidante de más de 2 meses de duración, cambios en los hábitos intestinales (predominantemente estreñimiento) de al menos 2 meses de duración, diarrea no complicada (excluyendo un origen infeccioso o malabsorción), así como pacientes en seguimiento por CU o EC con necesidad de una nueva evaluación endoscópica. Se excluyeron aquellos pacientes con colonoscopia incompleta o limpieza inadecuada. Los procedimientos utilizados en los pacientes fueron realizados tras la obtención del consentimiento informado.
Los pacientes fueron clasificados en 2 grupos según su diagnóstico:
- •
Enfermedad orgánica, que incluye: EII (EC y CU), alergias, enfermedad celiaca, fibrosis quística, diarrea aguda infecciosa, gastritis por H. pylori.
- •
Enfermedad funcional: SII, intolerancias alimentarias, enfermedad por reflujo gastroesofágico no erosivo, dispepsia funcional, sobrecrecimiento bacteriano, dolor abdominal funcional y dolor abdominal funcional secundario al consumo de antiinflamatorios no esteroideos.
Las muestras de heces se recogieron en frascos estériles y se remitieron al laboratorio en menos de 48h, donde se congelaron a −20°C hasta su análisis, que se llevó a cabo en menos de un mes. La CPF es estable en heces a temperatura ambiente al menos durante 72h y hasta 4 meses congelada a una temperatura inferior a −20°C. Se determinó la concentración de CPF medicante el kit de ELISA de la casa comercial Bühlmann (Basilea, Suiza) utilizando anticuerpo monoclonal contra la calprotectina. Las muestras se prepararon y analizaron de acuerdo con las instrucciones del fabricante.
El análisis estadísticoEl análisis de los datos se realizó con el paquete estadístico SPSS® v. 11. El test de Kolmogorov-Smirnov mostró que los valores de concentración de CPF no seguían una distribución normal. En consecuencia, los resultados se expresan en mediana y rango intercuartil.
No se encontraron diferencias en la distribución por la edad ni por el sexo (p=0,103 y p=0,239, respectivamente), por los que los datos se tratan de forma conjunta.
Los valores entre los distintos grupos se compararon con la prueba estadística de Kruskal-Wallis. Asumimos una diferencia estadísticamente significativa cuando p<0,05. Se evaluó el rendimiento diagnóstico, la S, la E, el VPP y el VPN.
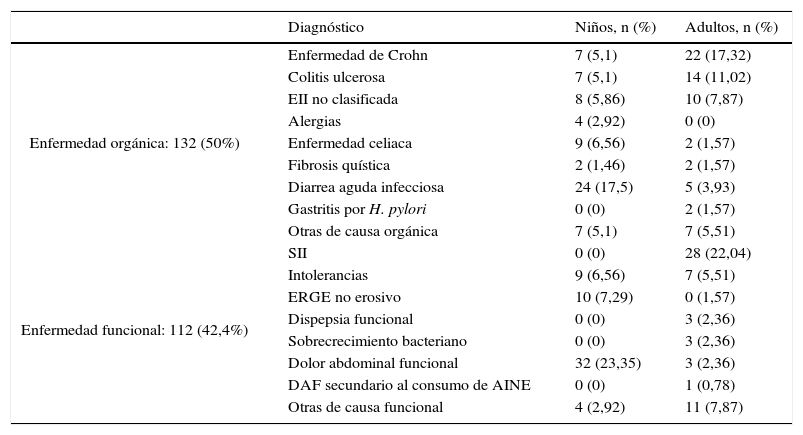
ResultadosEn el estudio llevado a cabo de abril a agosto de 2015 se incluyeron consecutivamente 127 adultos (80 mujeres y 47 hombres) con una edad media de 42,7 años, con edades comprendidas entre los 17 y los 82 años, y 137 niños (63 niñas y 74 niños) con una edad media de 6,7 años, con edades comprendidas entre los 2 y los 16 años, que consultaron en la Unidad de Aparato Digestivo por presentar algún síntoma de enfermedad gastrointestinal indicativo de organicidad. Quedaron excluidos del estudio 28 pacientes porque no entregaron la muestra de heces para la determinación de CPF o por tener una colonoscopia incompleta o una limpieza colónica inadecuada en el momento de la colonoscopia. El diagnóstico por grupos de edad se muestra en la tabla 1. No se encontraron diferencias en los valores de CPF entre niños y adultos ni por enfermedades ni en conjunto (p>0,05).
Clasificación de los pacientes según el diagnóstico final y el grupo de edad
| Diagnóstico | Niños, n (%) | Adultos, n (%) | |
|---|---|---|---|
| Enfermedad orgánica: 132 (50%) | Enfermedad de Crohn | 7 (5,1) | 22 (17,32) |
| Colitis ulcerosa | 7 (5,1) | 14 (11,02) | |
| EII no clasificada | 8 (5,86) | 10 (7,87) | |
| Alergias | 4 (2,92) | 0 (0) | |
| Enfermedad celiaca | 9 (6,56) | 2 (1,57) | |
| Fibrosis quística | 2 (1,46) | 2 (1,57) | |
| Diarrea aguda infecciosa | 24 (17,5) | 5 (3,93) | |
| Gastritis por H. pylori | 0 (0) | 2 (1,57) | |
| Otras de causa orgánica | 7 (5,1) | 7 (5,51) | |
| Enfermedad funcional: 112 (42,4%) | SII | 0 (0) | 28 (22,04) |
| Intolerancias | 9 (6,56) | 7 (5,51) | |
| ERGE no erosivo | 10 (7,29) | 0 (1,57) | |
| Dispepsia funcional | 0 (0) | 3 (2,36) | |
| Sobrecrecimiento bacteriano | 0 (0) | 3 (2,36) | |
| Dolor abdominal funcional | 32 (23,35) | 3 (2,36) | |
| DAF secundario al consumo de AINE | 0 (0) | 1 (0,78) | |
| Otras de causa funcional | 4 (2,92) | 11 (7,87) |
DAF: dolor abdominal funcional; EII: enfermedad inflamatoria intestinal; ERGE: enfermedad por reflujo gastroesofágico; SII: síndrome del intestino irritable.
De todos los pacientes estudiados, 132 (50%) fueron catalogados en enfermedad intestinal orgánica y 112 (42,4%) en enfermedad funcional gastrointestinal. El resto (20) corresponden a pacientes sin un diagnóstico definitivo por el momento. De los que tenían enfermedad orgánica hubo 68 con EII, de los cuales 29 presentaban EC, 21 CU y en los 18 restantes no se diferenció el tipo de EII. Del grupo con enfermedad de carácter funcional, 28 fueron catalogados como SII. El resto de los pacientes se muestran en la tabla 1.
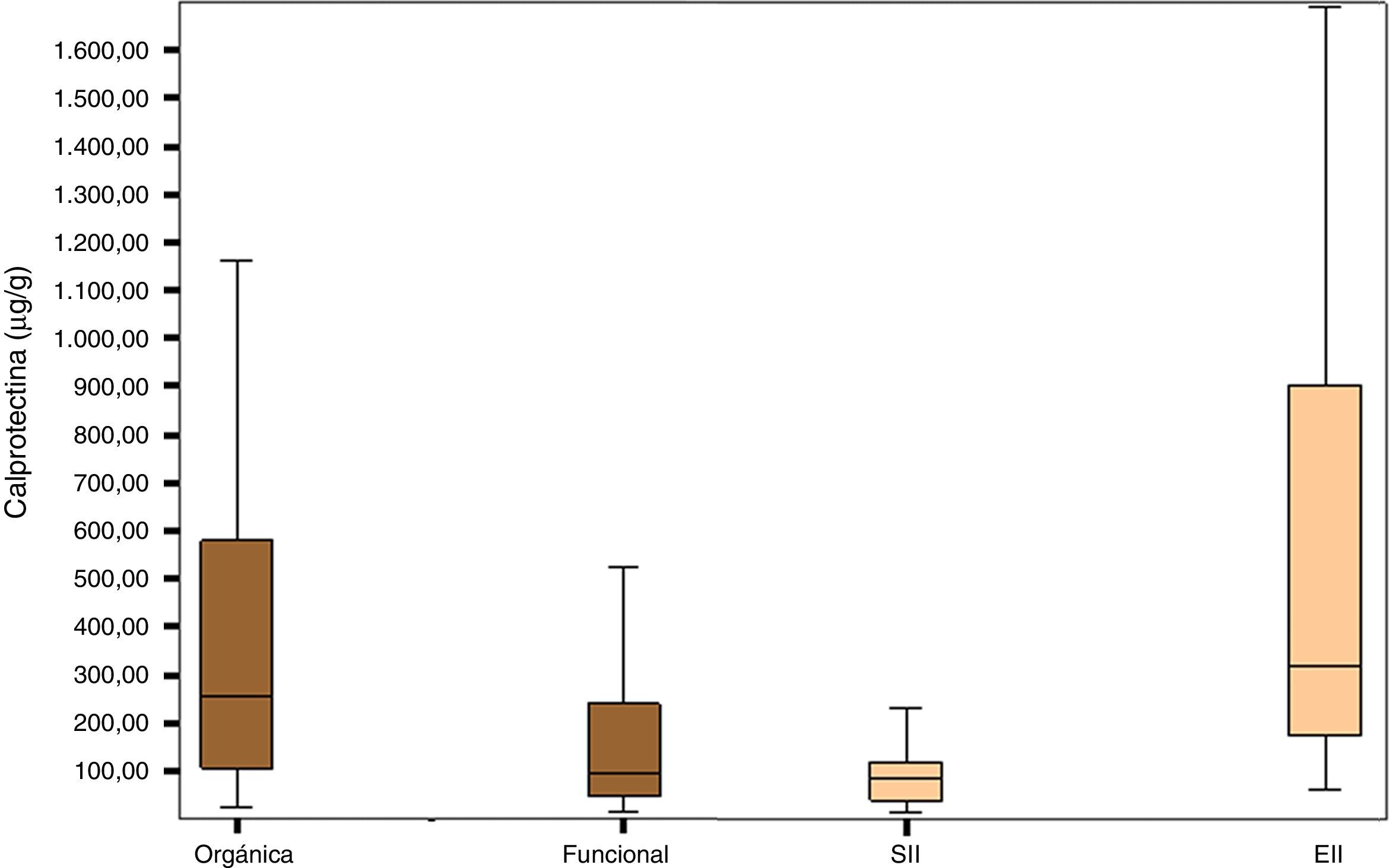
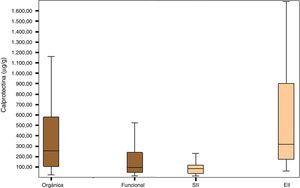
En la figura 1 está representada la distribución de los valores de CPF en los grupos de enfermedad orgánica, funcional, SII y EII.
El grupo de pacientes con enfermedad orgánica presentó valores de CPF (mediana; porcentaje del intervalo de confianza, rango intercuartil: 254μg/g; IC 95%, 105-588,5) mayores que el grupo con enfermedad funcional (95μg/g; IC95%, 47,25-243,92; p<0,0001), así como el grupo de pacientes con EII obtuvo valores de CPF significativamente más elevados (270,85μg/g; IC 95%, 96,85-674,00) que el grupo de pacientes con SII (79,70μg/g; IC 95%, 36,50-117,25); p<0,0001) (tabla 2).
Valores de mediana y rango intercuartil de calprotectina fecal (μg/g) en pacientes con enfermedad gastrointestinal orgánica y funcional
| Orgánica | Funcional | SII | EII | |
|---|---|---|---|---|
| n | 132 | 112 | 28 | 68 |
| Mediana | 254,3 | 95,00 | 79,70 | 270,85 |
| Rango intercuartil | 105-588,5 | 47,25-243,92 | 36,50-117,25 | 96,85-674,00 |
| p | p<0,0001 | p<0,0001 | ||
EII: enfermedad inflamatoria intestinal; SII: síndrome del intestino irritable.
Las concentraciones fueron significativamente más altas en el grupo de pacientes con otro tipo de enfermedad orgánica no EII (153μg/g; IC 95%, 82,5-340,5) respecto al grupo con enfermedad funcional (95μg/g; IC 95%, 47,25-243,92; p<0,0001).
Las concentraciones también fueron significativamente mayores en el grupo de pacientes con enfermedad orgánica no EII (153μg/g; IC 95%, 82,5-340,5; p=0,034) con respecto a los pacientes con otro tipo de enfermedad funcional no SII (101μg/g; IC 95%, 49-249,95).
No se encontraron diferencias estadísticamente significativas entre los valores de CPF en pacientes con EC respecto a los pacientes con CU (p=0,443). Tampoco hubo diferencias en el grupo de pacientes con otro tipo de enfermedad funcional no SII respecto al grupo con SII (p=0,123).
Ningún paciente diagnosticado de EII tuvo valores de CPF menores de 50μg/g; el valor más bajo fue de 60 en un adulto y de 73 en un niño. De los pacientes con SII, 16 (57%) obtuvieron un valor>50μg/g. De ellos, en 9 (33%) casos el valor se situó entre 50 y 100μg/g y en 7 (25%) casos fue mayor de 100μg/g, siendo el valor más alto de 396μg/g.
Los valores de CPF en los pacientes con intolerancias alimentarias, alergias alimentarias, enfermedad por reflujo gastroesofágico no erosivo, diarrea aguda infecciosa y celiaquía se muestran en la tabla 3.
Valores de mediana y rango intercuartil de calprotectina fecal (μg/g) en pacientes con enfermedades funcionales diferentes al síndrome del intestino irritable y orgánicas distintas de la enfermedad inflamatoria intestinal
| Intolerancias alimentarias | Alergias alimentarias | ERGE no erosivo | Diarrea aguda infecciosa | Celiaquía | |
|---|---|---|---|---|---|
| n | 16 | 4 | 12 | 29 | 11 |
| Mediana | 90 | 153 | 115,25 | 212,5 | 94 |
| Rango intercuartil | 38-299 | 145-226 | 66,5-247,7 | 96,15-386 | 43-653 |
ERGE: enfermedad por reflujo gastroesofágico.
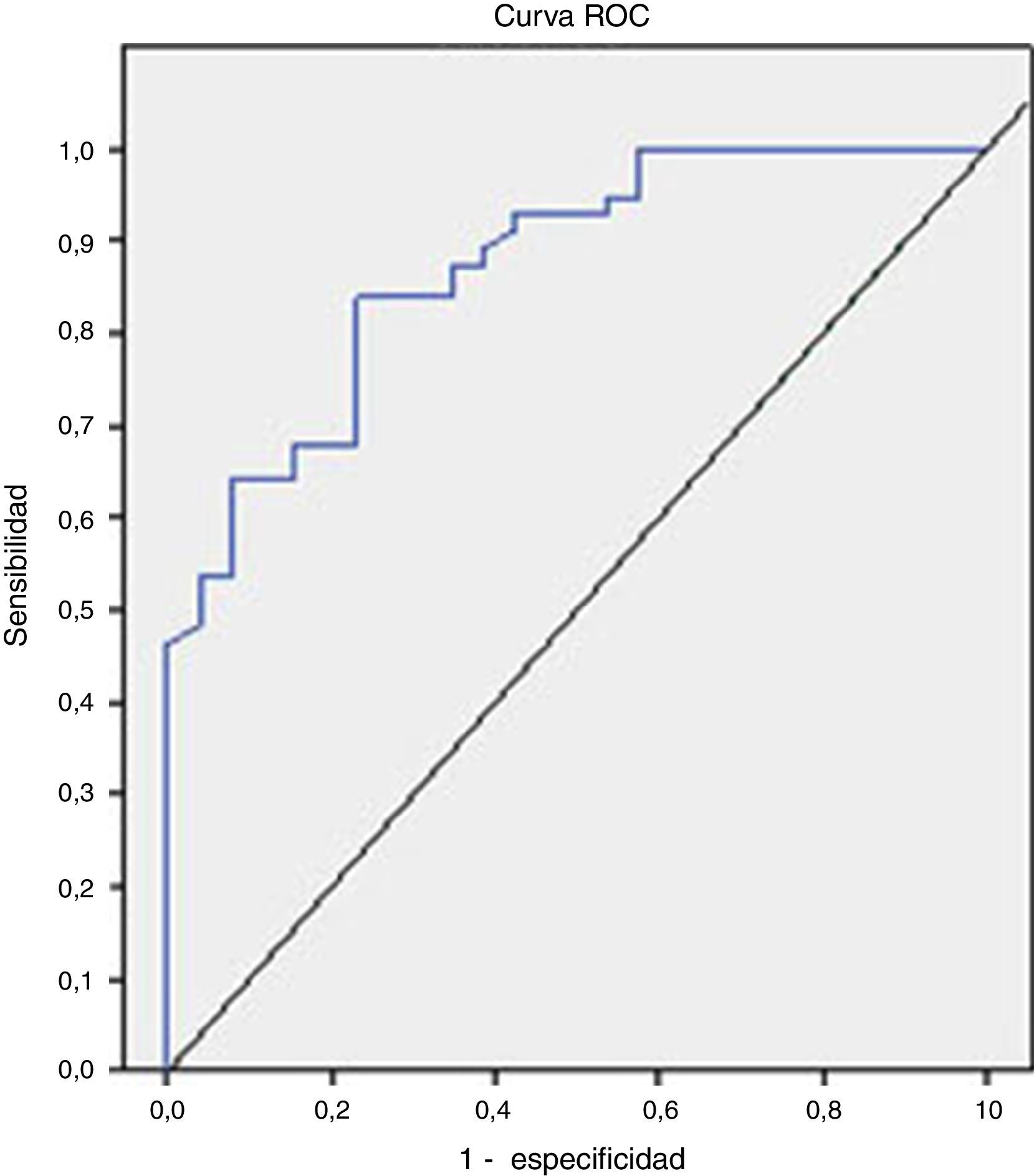
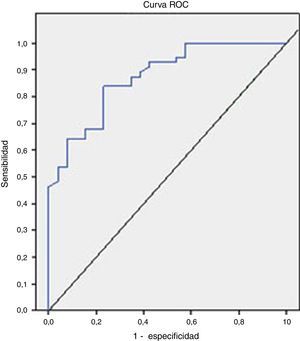
El análisis de la curva ROC que se representa en la figura 2 mostró un buen rendimiento diagnóstico de la CPF en la diferenciación de EII frente al SII, con un AUC=0,872 (IC 95%=0,795-0,949, S=100%, E=38,4%, VPP=77,7%, VPN=100%), bueno para EII frente al resto de las enfermedades funcionales (AUC=0,776), y moderado en la diferenciación de enfermed orgánica frente a funcional (AUC=0,718).
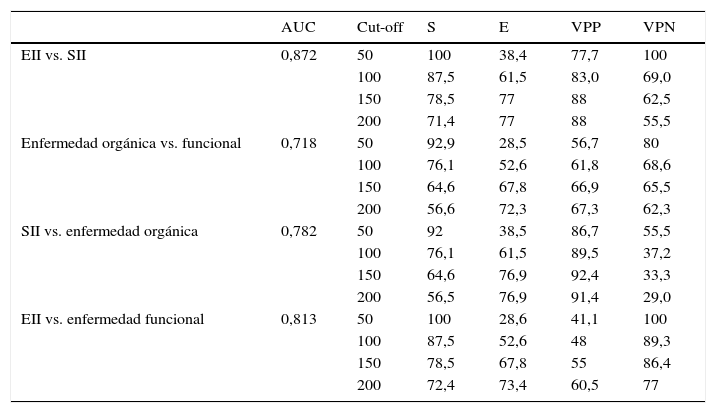
Los valores de S, E, VPP y VPN con diferentes cut-off están recogidos en la tabla 4.
Precisión diagnóstica para la calprotectina fecal con diferentes cut-off de acuerdo con el diagnóstico final
| AUC | Cut-off | S | E | VPP | VPN | |
|---|---|---|---|---|---|---|
| EII vs. SII | 0,872 | 50 | 100 | 38,4 | 77,7 | 100 |
| 100 | 87,5 | 61,5 | 83,0 | 69,0 | ||
| 150 | 78,5 | 77 | 88 | 62,5 | ||
| 200 | 71,4 | 77 | 88 | 55,5 | ||
| Enfermedad orgánica vs. funcional | 0,718 | 50 | 92,9 | 28,5 | 56,7 | 80 |
| 100 | 76,1 | 52,6 | 61,8 | 68,6 | ||
| 150 | 64,6 | 67,8 | 66,9 | 65,5 | ||
| 200 | 56,6 | 72,3 | 67,3 | 62,3 | ||
| SII vs. enfermedad orgánica | 0,782 | 50 | 92 | 38,5 | 86,7 | 55,5 |
| 100 | 76,1 | 61,5 | 89,5 | 37,2 | ||
| 150 | 64,6 | 76,9 | 92,4 | 33,3 | ||
| 200 | 56,5 | 76,9 | 91,4 | 29,0 | ||
| EII vs. enfermedad funcional | 0,813 | 50 | 100 | 28,6 | 41,1 | 100 |
| 100 | 87,5 | 52,6 | 48 | 89,3 | ||
| 150 | 78,5 | 67,8 | 55 | 86,4 | ||
| 200 | 72,4 | 73,4 | 60,5 | 77 |
AUC: área bajo la curva; E: especificidad; EII: enfermedad inflamatoria intestinal; S: sensibilidad; SII: síndrome del intestino irritable; VPN: valor predictivo negativo; VPP: valor predictivo positivo,.
No se encontró correlación de forma significativa entre los valores de CPF con el recuento de leucocitos (p=0,650), neutrófilos (p=0,067) y linfocitos (p=0,679) mediante un análisis univariado. Se observó una correlación, aunque débil, entre el valor de CPF y la sangre oculta en heces (ρ=0,392 p<0,05). Así mismo, se halló una correlación con los niveles plasmáticos de albúmina (ρ=−0,413; p<0,05).
DiscusiónEl diagnóstico de las EII se ha basado, clásicamente, en la valoración de la sintomatología digestiva. Los síntomas digestivos son muy frecuentes e inespecíficos, por ello, cuando se utilizan como único filtro para la indicación de una colonoscopia, los resultados son poco eficientes17. Por esta razón existe la necesidad en la práctica médica de una prueba simple que ayude a seleccionar aquellos pacientes con síntomas indicativos de enfermedad inflamatoria que precisen pruebas diagnósticas más complejas.
A pesar de que el estudio se ha realizado con un reducido número de pacientes, este trabajo está en la línea de estudios previos en población pediátrica y adulta, que muestran cómo una única determinación de CPF puede ayudar a los gastroenterólogos en el diagnóstico diferencial entre enfermedades gastrointestinales de carácter orgánico y funcional18. Hay que destacar que la población adulta estudiada es joven (la mediana de edad se sitúa en 42 años), y es en su mayoría del sexo femenino, siendo 80 (63%) las mujeres frente a 47 hombres (37%). Resaltamos, así mismo, que la prevalecía de diferentes enfermedades digestivas coincide con la literatura. De hecho, todos los pacientes diagnosticados de SII fueron adultos, de los cuales 22 (78,6%) fueron mujeres con una edad media de 37,6 años frente a 6 (11,4%) hombres, lo cual coincide con los datos epidemiológicos disponibles que anuncian que el SII afecta con más frecuencia a las mujeres, especialmente adultos menores de 45 años19. Destacamos también el elevado número de niños (24) con diarrea aguda infecciosa a los que se solicitó el test de CPF.
Se debe tener en cuenta que además de la EII, dolencias de muy distinta etiología, tales como infecciones, alergias a alimentos, fibrosis quística, gastritis, rectorragia, celiaquía mal controlada o terapia con antiinflamatorios no esteroideos, pueden dar resultados de calprotectina elevados20. En nuestros pacientes, las concentraciones de CPF fueron significativamente más altas en el grupo con EII en comparación al grupo con otro tipo de enfermedad orgánica. No obstante, nuestros resultados tampoco permiten establecer valores de CPF que discriminen entre ambos grupos de enfermedad.
El valor cut-off en niños entre 1-17 años y en adultos sanos se ha establecido por debajo de 50μg/g, de acuerdo con el límite indicado en el ensayo21. En niños menores de un año se han propuesto distintos valores de referencia, ya que en recién nacidos la permeabilidad intestinal está incrementada22. Por lo tanto, un resultado de la prueba con valores dentro del rango de normalidad (CPF<50μg/g heces) apoyaría el diagnóstico de enfermedad funcional como causa no inflamatoria de los síntomas23. Por lo general, se aconseja la derivación a un gastroenterólogo ante un valor de CPF mayor de 50, pero también cuando exista alta sospecha de EII, incluso con CPF dentro de la normalidad, por ejemplo, si hay un fuerte historial familiar. Tomando ese valor de referencia, nuestros datos confieren una S del 100% y una E del 38,4% para discriminar entre EII y SII. Según nuestros resultados, para optimizar la eficacia diagnóstica de la prueba sería aconsejable establecer como límite superior de referencia concentraciones de CPF mayores de 150μg/g heces, con el cual obtendríamos una aceptable S (78,5%) y aumentaríamos notablemente la E (77%). Establecemos como zona gris los valores de CPF comprendidos entre 50 y 150μg/g heces, caso en el que recomendamos repetir la determinación a las 4-6 semanas o ante un nuevo brote de los síntomas.
Teniendo en cuenta los resultados obtenidos en el análisis de la curva ROC, la CPF muestra un alto valor en el diagnóstico diferencial de la EII frente al SII y moderado para la diferenciación de enfermedad orgánica frente a funcional.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.