La insuficiencia renal aguda (acute kidney injury, AKI) constituye un evento devastador en la historia natural de la cirrosis. El diagnóstico diferencial de esta entidad se ve limitado por la falta de biomarcadores específicos de lesión renal en cirrosis.
La utilidad clínica de un biomarcador es determinada por su eficacia en el diagnóstico de AKI, y por su capacidad para aportar información que permita mejorar objetivos clínicos como el desarrollo de complicaciones y la supervivencia. La ausencia de biomarcadores ha complicado la elaboración de intervenciones dirigidas a mejorar el pronóstico de la insuficiencia renal en cirrosis, estos biomarcadores constituyen actualmente un área de intensa investigación en nefrología.
Recientes avances en genómica y proteómica han permitido la identificación de nuevos candidatos a biomarcadores séricos y urinarios de lesión renal; los más promisorios y con potencial aplicabilidad en cirrosis, como NGAL, KIM-1, cystatin-C, IL-18, L-FABP, N-acetyl glucosaminidase y netrin-1 son discutidos a continuación.
Acute kidney injury (AKI) is an ominous event in the natural history of cirrhosis. The differential diagnosis of this entity is hampered by the absence of specific biomarkers of tubular damage in cirrhosis.
The clinical usefulness of such biomarkers is determined by their effectiveness in the diagnosis of AKI and their ability to provide critical information to ameliorate clinical outcomes and survival. The lack of biomarkers has hindered the development of interventions aimed to improve the prognosis of kidney impairment in cirrhosis. Currently, biomarkers are an area of intense research in nephrology.
Emerging genomic and proteomic technologies have revealed novel plasma and urinary biomarkers of AKI. The present article discusses the most promising candidate biomarkers with potential application in cirrhosis, such as NGAL, KIM-1, cystatin-C, IL-18, L-FABP, N-acetyl glucosaminidase and netrin-1, are discussed below.
La insuficiencia renal aguda es un evento frecuente en pacientes con cirrosis, principalmente en estadios avanzados de la enfermedad hepática, cuando la disfunción circulatoria es evidente y afecta a la perfusión renal1,2. El desarrollo de esta complicación en la cirrosis implica un mal pronóstico, sin embargo en los últimos años pocos avances se han hecho en su prevención y las tasas de mortalidad permanecen inaceptablemente elevadas3–5.
Una de las dificultades es establecer el diagnóstico de forma precoz, para lo cual se han reportado iniciativas que proponen modificar la actual definición de insuficiencia renal en la cirrosis6,7. No obstante, estas propuestas siguen basando sus criterios en la determinación de creatinina sérica, la cual es un deficiente marcador de insuficiencia renal en cirrosis1,8, además la creatinina sérica carece de valor para el diagnóstico diferencial de la causa de insuficiencia renal. Los pacientes con cirrosis desarrollan insuficiencia renal aguda (AKI, acute kidney injury) secundaria a múltiples etiologías cuyo diagnóstico diferencial es importante establecer, debido a que el tratamiento y el pronóstico varían en función de la causa de la insuficiencia renal. Los biomarcadores convencionales de lesión renal como son la proteinuria y la fracción de excreción de sodio (FeNa) no han tenido el valor suficiente para ser considerados como parte del diagnóstico de AKI en la cirrosis.
La falta de biomarcadores específicos de AKI que ayuden a establecer el diagnóstico de forma precoz ha tenido un impacto negativo en la búsqueda de intervenciones dirigidas a mejorar el pronóstico de la insuficiencia renal en la cirrosis. Afortunadamente la aplicación de nuevas tecnologías en los campos de genómica y proteómica ha permitido identificar posibles candidatos a biomarcadores de insuficiencia renal. El desarrollo de nuevos biomarcadores de insuficiencia renal constituye actualmente un área prioritaria de intensa investigación9,10.
BiomarcadoresUn biomarcador es cualquier sustancia biológica sea molecular, bioquímica, anatómica o fisiológica, cuya característica fundamental es representar un proceso normal o patológico específico. Las variaciones en esos procesos biológicos deben ocasionar cambios en el biomarcador que pueden ser medidos y evaluados de forma objetiva11. Las características ideales de un biomarcador de insuficiencia renal están listados en la tabla 1.
Características de un biomarcador ideal en insuficiencia renal aguda
| Características de un biomarcador ideal en AKI |
| 1. No invasivo, detectándose con facilidad en muestras accesibles como sangre y orina |
| 2. Su determinación debe ser rápida y emplear métodos precisos que puedan disponerse con facilidad |
| 3. Ser muy sensible y específico de AKI |
| 4. Debe tener utilidad para establecer la causa y los mecanismos que conducen al desarrollo de la agresión renal, así como dar indicios de la duración del episodio de AKI |
| 5. Ser precoz y detectar cambios mínimos en el filtrado glomerular (incluso antes de agotar la reserva renal y que se incremente el valor de creatinina sérica) |
| 6. No solo debe indicar lesión, sino también alteraciones en la función renal |
| 7. Tener capacidad para predecir qué pacientes progresarán en el episodio de AKI y quiénes serán susceptibles de recuperarse |
| 8. Tener valor para determinar eventos como el desarrollo de complicaciones, necesidad de diálisis, duración de la estancia hospitalaria y mortalidad |
| 9. Útil para dirigir intervenciones que mejoren la función renal, además de monitorizar el curso y la respuesta al tratamiento establecido |
| 10. Sus niveles no deben verse afectados por la variabilidad biológica y la respuesta sistémica |
| 11. No deben ser costosos, lo que permitiría su aplicación universal |
El proceso para desarrollar un biomarcador ha sido dividido en varias fases que comprenden su descubrimiento en fases preclínicas, su posterior validación clínica y la comprobación del impacto de su determinación en la incidencia y complicaciones de una enfermedad12.
En la fase preclínica las muestras de tejidos o fluidos corporales de animales o humanos son cuidadosamente seleccionadas de modelos específicos de insuficiencia renal. En este caso, la orina es fácil de obtener y podría contener biomarcadores específicos del riñón, de hecho, la mayoría de biomarcadores se han estudiado en orina; sin embargo, los biomarcadores urinarios están expuestos a mayor degradación y su concentración puede cambiar en función del volumen urinario, el estado de hidratación y el uso de diuréticos. Para evitar el efecto de la dilución urinaria, muchos estudios de investigación expresan los biomarcadores ajustados por el valor de creatinina en orina, y aunque la tasa de excreción de creatinina urinaria puede verse alterada en pacientes con AKI, esta fórmula ha mostrado mejorar la capacidad de los biomarcadores para predecir eventos clínicos, aunque su rendimiento resulta algo menor que la concentración absoluta (no ajustada por creatinina) para evaluar una lesión renal establecida13.
Los biomarcadores séricos pueden obtenerse aún en pacientes anúricos y exhiben una mayor estabilidad, sin embargo pueden ser un reflejo de la respuesta sistémica y por tanto menos específicos de lesión renal, además sus concentraciones en sangre pueden verse influidas por una menor tasa de filtración renal en ausencia de lesión. La abundancia en la sangre de proteínas como albúmina e inmunoglobulinas puede causar dificultades en la búsqueda de marcadores séricos mediante técnicas de proteómica14.
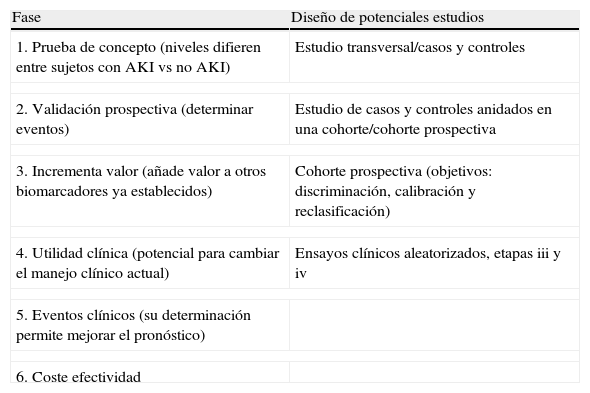
La utilidad clínica de un biomarcador o de un panel de ellos se determina no solo por su eficacia y fiabilidad en el diagnóstico de AKI o por su rendimiento para el diagnóstico diferencial, sino también por su capacidad para aportar información que permita asignar terapias específicas o mejorar eventos clínicos como el desarrollo de complicaciones, el requerimiento de diálisis o trasplante y la supervivencia intrahospitalaria y a largo plazo15,16. Las etapas de validación clínica en el caso de los biomarcadores de AKI se muestran en la tabla 2.
Etapas de validación clínica de un biomarcador
| Fase | Diseño de potenciales estudios |
| 1. Prueba de concepto (niveles difieren entre sujetos con AKI vs no AKI) | Estudio transversal/casos y controles |
| 2. Validación prospectiva (determinar eventos) | Estudio de casos y controles anidados en una cohorte/cohorte prospectiva |
| 3. Incrementa valor (añade valor a otros biomarcadores ya establecidos) | Cohorte prospectiva (objetivos: discriminación, calibración y reclasificación) |
| 4. Utilidad clínica (potencial para cambiar el manejo clínico actual) | Ensayos clínicos aleatorizados, etapas iii y iv |
| 5. Eventos clínicos (su determinación permite mejorar el pronóstico) | |
| 6. Coste efectividad | |
Adaptada de Hlatky et al.16.
En la cirrosis, la utilidad de un biomarcador será determinante para administrar mejor el tratamiento de pacientes que se puedan beneficiar de ellos, como es el caso de los vasoconstrictores en el síndrome hepatorrenal (SHR).
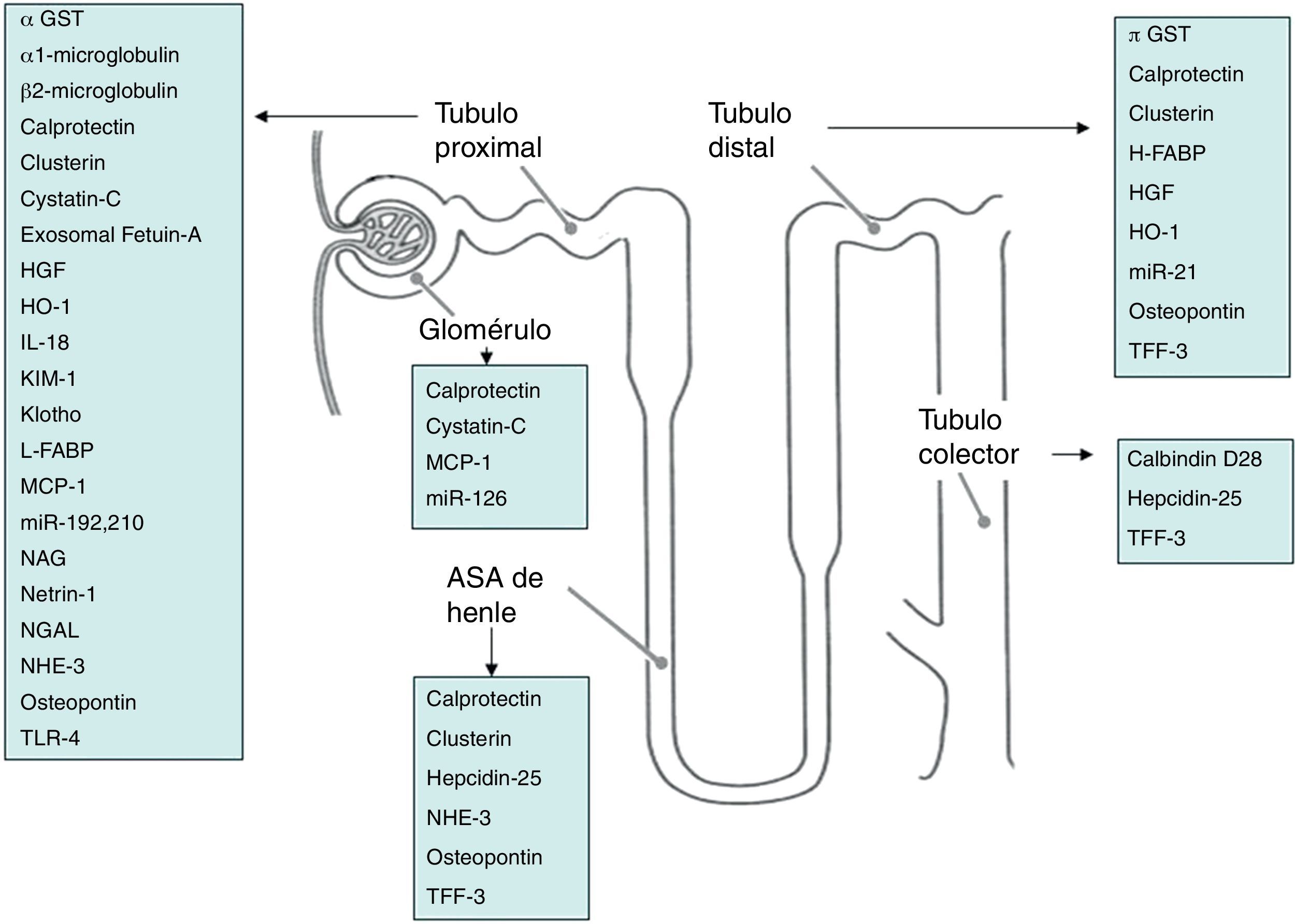
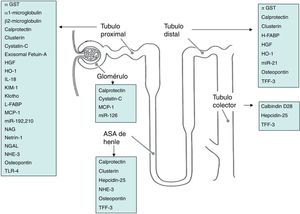
Nuevos biomarcadores de insuficiencia renal agudaNumerosas moléculas han sido identificadas como candidatos a biomarcadores, los cuales pueden ser clasificados dentro de 3 grupos fisiopatológicos, aunque algunas de ellas pueden tener más de un mecanismo:
- 1.
Enzimas o proteínas provenientes de células dañadas por procesos de necrosis o apoptosis o simplemente liberadas por un epitelio tubular disfuncional:
- •
Proteínas tubulares: renal tubular ephitelial antigens (RTE), megalina, NHE3 Na+/H+ exchanger (NHE3), osteopontin, clusterin.
- •
Enzimas tubulares: fosfatasa alcalina y gammaglutamil transpeptidasa (FA, y GGT, del borde en cepillo), isoformas de la glutatión transferasa (GSTα en el túbulo proximal y GSTπ en el distal), N-acetyl-D-glucosaminidase (NAG, enzima lisozomal del túbulo proximal).
- •
- 2.
Pequeñas moléculas (< 40kDa) cuya presencia en orina refleja la incapacidad de reabsorción por parte de un túbulo renal dañado: cystatin C, β2 microglobulin, α1 microglobulin, retinol binding protein (RBP).
- 3.
Proteínas cuya expresión se altera en el riñón en respuesta a los mecanismos causantes de lesión y que a consecuencia del daño, sus niveles aumentan o disminuyen exponencialmente: neutrophil gelatinase-associated lipocalin (NGAL), kidney injury molecule-1 (KIM-1), liver and heart fatty acid-binding protein (L-FABP y H-FABP, túbulos proximal y distal respectivamente), interleucina 18 (IL-18), monocyte chemoattractant protein (MCP-1), α-klotho protein, trefoil factor 3 (TFF3), heme oxygenase-1 (HO-1), netrin-1, IL-6, IP-10, fetuin-A, etc.
En la figura 1 se observan los biomarcadores agrupados según su localización en determinados segmentos de la nefrona.
Entre estos biomarcadores que actualmente se encuentran en fase de desarrollo, destacan los siguientes.
Neutrophil gelatinase-associated lipocalinLa neutrophil gelatinase-associated lipocalin (NGAL), también conocida como lipocalin 2 (lcn2) aislada inicialmente de los gránulos de los neutrófilos inmaduros, es una proteína de 25kDa que puede expresarse en diversos tejidos; su unión covalente a sideróforos (pequeñas moléculas quelantes de hierro) le confieren un papel en la inmunidad innata como agente bacteriostático17.
Por otro lado, NGAL es una de las proteínas que aumenta con mayor rapidez en modelos animales de AKI, tanto isquémicos como nefrotóxicos. En un modelo de lesión tubular mediada por cisplatino, se observó en tiempo real que la expresión de NGAL proviene de la nefrona dañada, principalmente de los túbulos localizados en la capa más externa de la médula renal. En este modelo de AKI, la expresión de NGAL en tejidos extrarrenales resultó insignificante18. La NGAL urinaria proviene principalmente de células del epitelio renal, sin embargo, al ser producida también por los leucocitos sus valores deben ser interpretados cautelosamente en el caso de infecciones del tracto urinario19.
Estudios en humanos con AKI mostraron un incremento en los valores de NGAL de 10 veces en plasma y 100 veces en orina, comparados con sujetos sin AKI; asimismo, las biopsias renales de pacientes con AKI mostraron una correlación entre la expresión de NGAL en los túbulos corticales y sus niveles en sangre y orina20. En un estudio prospectivo, en población pediátrica que había recibido un bypass cardiopulmonar, los pacientes con AKI presentaron elevaciones de NGAL en plasma y orina desde las primeras 2 h poscirugía, comparado con la creatinina sérica que tardó entre 1 y 3 días en elevarse. De este modo, NGAL resultó un poderoso predictor del desarrollo de AKI (AUC-ROC: 0,99 para la orina y 0,91 para el plasma)21. Esto ha sido confirmado en población adulta a la que se le ha practicado cirugía cardiaca, sin embargo en este grupo de pacientes el área bajo la curva para el diagnóstico de AKI varía ampliamente entre los distintos estudios (AUC-ROC: 0,61-0,80)22,23, lo que reflejaría una probable influencia de la edad, comorbilidades como la diabetes mellitus o una enfermedad renal subyacente en los niveles de NGAL de pacientes adultos que no experimentan AKI.
En unidades de cuidados críticos, el desarrollo de AKI es una complicación frecuente y secundaria a múltiples causas, principalmente la sepsis24. Esta población constituye un grupo heterogéneo de pacientes con AKI, en los cuales NGAL urinaria y plasmática han demostrado tener utilidad en predecir el desarrollo de AKI hasta 2 días antes del aumento en los niveles de creatinina sérica25–27. En un estudio de adultos en salas de urgencia, la medición de NGAL urinaria al ingreso tuvo un AUC de 0,95 para la predicción de AKI, además NGAL ha mostrado habilidad para distinguir las causas prerrenales de aquellas intrínsecas (estas últimas con evidente lesión tubular)28. En otro estudio reciente el valor de una única medición de NGAL urinaria para diagnosticar AKI-intrínseca en salas de urgencias se representó por un AUC de 0,81 para un punto de corte de NGAL de 104ng/ml29.
La concentración de NGAL urinaria resulta útil en la predicción de eventos como el inicio de hemodiálisis y la mortalidad intrahospitalaria, tanto para pacientes que han recibido cirugía cardiaca como para aquellos hospitalizados o en unidades de cuidados críticos. En esta población heterogénea de enfermos críticos, NGAL fue un buen marcador de mortalidad intrahospitalaria con un AUC-ROC en promedio de 0,7130. En un estudio reciente se demostró que pacientes sin insuficiencia renal, pero con valores altos de NGAL urinaria, tuvieron mayores requerimientos de hemodiálisis y alta mortalidad intrahospitalaria frente a pacientes del mismo grupo con NGAL baja31. Estos hallazgos indicarían que NGAL puede detectar episodios subclínicos de AKI o añadir información pronóstica, independientemente del diagnóstico de insuficiencia renal.
En pacientes con cirrosis, los valores de NGAL urinaria en pacientes con AKI y sin AKI resultan similares a los de la población no cirrótica, lo que convierte a NGAL en el primero de los nuevos biomarcadores de insuficiencia renal evaluados de forma prospectiva en cirrosis19,32. La NGAL urinaria es útil en el diagnóstico diferencial de la insuficiencia renal de pacientes con cirrosis, con los niveles más elevados en aquellos con AKI intrínseca, frente a otras etiologías como las prerrenales, la insuficiencia renal crónica estable y el SHR. En esta última entidad exclusiva de la cirrosis, los valores de NGAL están incrementados frente a pacientes con causas prerrenales, pero menores que los valores de pacientes con necrosis tubular aguda19. Al analizar con más detalle este grupo de pacientes con SHR, los pacientes con SHR asociado a infecciones tuvieron los valores más altos comparados con aquellos con SHR «clásico» (no asociado a infecciones). Estos datos resultan de algún modo reveladores debido a que el SHR se ha considerado un trastorno estrictamente funcional por la evidencia de una restitución de la función renal tras el trasplante hepático, sin embargo, tras el estudio de Herck y Sherlock33 en 1956, la correlación histológica de la hipótesis del SHR como un trastorno funcional ha sido deficiente34. Por otro lado, NGAL ha demostrado ser un factor pronóstico de mortalidad intrahospitalaria en pacientes con cirrosis32 y en otros eventos clínicos como la necesidad de diálisis, la progresión de AKI y la mortalidad tanto intrahospitalaria como a 3 meses35.
El advenimiento de los biomarcadores de lesión renal en la cirrosis permite plantear la hipótesis de que el SHR según la definición actual7 corresponda a un grupo heterogéneo de pacientes en los que pueden coexistir diferentes grados de lesión renal. En este caso, la NGAL sería útil para seleccionar aquellos pacientes que se beneficiarán de terapias específicas como el tratamiento con terlipresina y albúmina, diferenciándolos de pacientes con una lesión tubular manifiesta, en quienes la expansión con volumen esté probablemente contraindicada.
En conclusión, NGAL ha demostrado en diversos escenarios clínicos ser un biomarcador precoz de AKI, además de tener utilidad para el diagnóstico diferencial de sus causas y para predecir el pronóstico, no solo en la población general sino también en la cirrosis. Aunque estos datos deben interpretarse con precaución, principalmente en pacientes con infecciones del tracto urinario NGAL sería de utilidad para dirigir intervenciones específicas destinadas a mejorar la insuficiencia renal de pacientes con cirrosis.
Kidney injury molecule-1La kidney injury molecule-1 (KIM-1), también conocida como T cell immunoglobulin mucin domain-1 (TIM-1) o hepatitis A virus celular receptor-1 (HAVCR-1), es una glucoproteína transmembrana de 104kDa, cuya expresión aumenta intensamente en el túbulo proximal, principalmente en el segmento corticomedular S3 sensible a la hipoxia. Su expresión se produce en las zonas con mayor inflamación y daño tubulointersticial resultante de eventos de isquemia/reperfusión o nefrotoxicidad. Por este motivo se ha postulado que KIM-1 podría tener un papel en los eventos de diferenciación y reparación tisular36. Mediante una metaloproteinasa se produce el clivaje de su dominio extracelular de 90kDa que es excretado hacia la orina como fracción soluble, adicionalmente se ha observado que los valores de KIM-1 disminuyen tras intervenciones renoprotectoras37.
La KIM-1ha demostrado, encontrarse significativamente elevada en la orina de pacientes con AKI y correlacionarse con el aumento de su expresión en biopsias renales38; asimismo, KIM-1ha revelado tener valor para diferenciar AKI intrínseca o AKI de duración mayor de 48 h, de otras causas de AKI como las prerrenales o aquellas en las que la función renal es restituida en menos de 48 h29,38,39.
Sin embargo, KIM-1 tiene un menor rendimiento como marcador precoz de fallo renal. En una cohorte de pacientes adultos que habían recibido cirugía cardiaca, la elevación de los niveles de KIM-1 se registró a partir de las 2 h poscirugía; no obstante, alcanzó el pico máximo a las 24 h poscirugía cardiaca (AUC-ROC: 0,78 y 0,91, respectivamente)40, a diferencia de NGAL, cuya máxima concentración se alcanza durante las primeras 6 h. Estos datos fueron confirmados en población pediátrica en la que el AUC-ROC de KIM-1 para predecir el desarrollo de AKI fue de 0,83 a las 12 h poscirugía cardiaca41.
La KIM-1ha mostrado habilidad para predecir eventos clínicos como la progresión y el desarrollo de AKI en pacientes que han recibido cirugía cardiaca42, así como el requerimiento de diálisis o muerte intrahospitalaria. En una cohorte heterogénea de 201 pacientes adultos hospitalizados40, aquellos con valores de KIM-1 en el cuartil superior tuvieron 3,2 veces más riesgo de morir o requerir diálisis frente a pacientes de los otros cuartiles. En este estudio, la KIM-1 tuvo un AUC-ROC de 0,61 para predecir el evento combinado, frente al AUC-ROC de 0,71 para otros biomarcadores y 0,78 para la puntuación APACHE-II; sin embargo, al juntar KIM-1 y APACHE-II el AUC-ROC del modelo final fue incrementado a 0,8. Esta capacidad de KIM-1 para predecir mortalidad o necesidad de diálisis se ha confirmado en trabajos posteriores43. Por otro lado, en un reciente estudio multicéntrico, los niveles de KIM-1 urinarios han mostrado estar relacionados con el riesgo de desarrollar insuficiencia renal crónica, independiente del nivel de albuminuria44.
La KIM-1 representa una molécula atractiva para ser considerada como biomarcador de AKI en cirrosis, al poder diferenciar subtipos de AKI, además de no verse afectada por la enfermedad renal crónica ni por las infecciones del tracto urinario.
Pese a lo anterior, en la actualidad no existen estudios acerca del papel de KIM-1 en pacientes con cirrosis. En una reciente comunicación aceptada para su presentación en el Congreso Europeo de Hepatología EASL 2013, se estudiaron 265 pacientes con cirrosis en quienes se obtuvieron muestras al ingreso hospitalario para la determinación de KIM-1; en estos pacientes, KIM-1 no fue de utilidad para diagnosticar la presencia de AKI, además de no tener valor para diferenciar entre las distintas causas de insuficiencia renal en la cirrosis. Al comparar los valores de KIM-1 en cirrosis con un grupo de voluntarios sanos apareados por edad y sexo, se comprobó que los pacientes con cirrosis, aun en estadios iniciales, tienen aumentada la excreción urinaria de KIM-145. En este estudio prospectivo, KIM-1 no mostró tener utilidad como factor predictivo de mortalidad.
Por tanto, a diferencia de la población no cirrótica en la que la KIM-1 urinaria es un biomarcador precoz de AKI y con importante valor para el diagnóstico diferencial y el pronóstico, en la cirrosis, la KIM-1 no es un biomarcador útil para evaluar la insuficiencia renal aguda. Esto puede ser debido a que la cirrosis induce un aumento de la secreción urinaria de KIM-1 por mecanismos que actualmente se desconocen.
Cystatin CLa Cys-C es una pequeña molécula de 13kDa y al ser un inhibidor de la cisteína-proteasas tiene un rol en el catabolismo peptídico. Más del 99% de Cys-C es filtrada por el glomérulo y reabsorbida en su totalidad por el túbulo proximal. Los túbulos no presentan una secreción activa de Cys-C, por lo que habitualmente no se detecta en orina.
La Cys-C ha mostrado incrementarse con la edad, el sexo masculino, la raza blanca, el hábito tabáquico, la hipertensión arterial, la dislipidemia, la masa muscular, la obesidad, los niveles elevados de proteína C reactiva, la función tiroidea y la terapia inmunosupresora46,47.
Pese a ello los valores séricos de Cys-C han mostrado una buena correlación con la creatinina sérica y la estimación de la tasa del filtrado glomerular (TFG), especialmente en aquellos con malnutrición o cifras de creatinina basal bajas, como es el caso de los pacientes con cirrosis48. Recientes datos señalan que las fórmulas utilizadas para estimar la TFG en función de Cys-C sérica o combinaciones de Cys-C y creatinina sérica tendrían mayor precisión que aquellas que utilizan la creatinina sola49,50.
La Cys-C en sangre puede tener una mayor sensibilidad que la creatinina sérica para detectar cambios más sutiles y precoces en la función renal. Estudios en unidades de cuidados intensivos, en el departamento de urgencias y en pacientes expuestos a contrastes potencialmente nefrotóxicos, han mostrado que una elevación del 50% en el valor de Cys-C sérica predijo AKI hasta 2 días antes del aumento en los niveles de creatinina sérica, reforzando su valor como biomarcador precoz frente a la creatinina sérica51–53; sin embargo, otros estudios fallaron en confirmar la superioridad de Cys-C para la predicción de AKI54. Con estos datos podemos afirmar que Cys-C no ha demostrado ser mejor que otros biomarcadores para pronosticar AKI55, incluso la determinación del índice de resistencia de la arteria renal demostró mayor utilidad que la concentración de Cys-C sérica para predecir el desarrollo de AKI en una cohorte muy heterogénea de pacientes en la unidad de cuidados críticos56.
No obstante, la Cys-C sérica sí ha confirmado tener habilidad para la predicción de eventos como muerte o necesidad de diálisis57,58, duración de la estancia hospitalaria y requerimiento de cuidados intensivos o ventilación mecánica59.
La determinación de Cys-C en orina ha mostrado en algunos estudios correlacionarse con cambios en la TFG y predecir el desarrollo de AKI (AUC-ROC: 0,70 y 0,72)60,61. Sin embargo, los niveles urinarios de Cys-C muestran una menor habilidad que los niveles séricos para predecir mortalidad o necesidad de diálisis (AUC-ROC: < 0,66)61,62. En uno de los estudios mencionados, que incluyó 444 pacientes en 2 unidades de cuidados intensivos destacamos que aquellos pacientes con sepsis tuvieron valores urinarios más elevados de Cys-C, especialmente los que no sobrevivieron a los 30 días; estos niveles incrementados de Cys-C urinaria en pacientes sépticos fueron independientes de la presencia de AKI61.
En pacientes con cirrosis la TFG medida por radioisótopos (99mTc-DPTA) se correlacionó mejor con la concentración sérica de Cys-C frente a creatinina sérica, con coeficientes de Pearson de −0,52 vs −0,37, respectivamente63, y aunque las fórmulas basadas en Cys-C tienden a sobrestimar menos la TFG y a tener mayor precisión que las fórmulas basadas en creatinina, no se han encontrado diferencias significativas entre ambas aproximaciones64,65. Otro estudio en pacientes con cirrosis señala que Cys-C sérica tendría una mayor exactitud para detectar cambios en el filtrado glomerular para algunos subgrupos de pacientes como aquellos con una TFG < 70ml/min, mujeres y pacientes en estadio C de Child-Pugh66; sin embargo, la principal limitación de este estudio fue que la TFG fue estimada de forma indirecta a través de una fórmula basada en la excreción urinaria de creatinina67.
Los niveles de Cys-C en suero se correlacionan, al igual que la creatinina sérica, con parámetros de función hepática como la bilirrubina, la albúmina, el INR y los estadios avanzados de Child, sin embargo no aportan un valor pronóstico adicional al de la creatinina en cirrosis. En un estudio que incluyó 429 pacientes cirróticos, se desarrolló una fórmula que incluyó a la Cys-C como parte del MELD score (MELD-Cys); no se encontraron diferencias en cuanto a mortalidad a los 3 y 12 meses entre el MELD-Cys y el MELD score «clásico» (AUC-ROC: 0,90 vs 0,89). Hasta la fecha el papel de la Cys-C urinaria no ha sido evaluado en cirrosis.
Aunque los resultados de los estudios señalan que Cys-C sérica puede tener mayor precisión para estimar el GFR y ser probablemente más precoz que la elevación de creatinina sérica, no aporta información pronóstica en cirrosis y no queda claro su papel en la evaluación de AKI en sustitución de la creatinina sérica, teniendo en cuenta los costes más elevados. La Cys-C urinaria tiene un menor rendimiento pronóstico que otros biomarcadores, sin embargo, podría tener un papel en la evaluación de pacientes con AKI inducida por sepsis.
Interleucina 18La IL-18 es una citocina proinflamatoria cuya expresión aumenta en el túbulo proximal ante la presencia de AKI. La pro-IL-18 es activada por la caspasa-1 por diversos mecanismos, principalmente por isquemia y su forma activa es excretada por la orina. De este modo, pacientes con mayor lesión tubular (necrosis tubular aguda) tendrían altos niveles de IL-18, comparado con pacientes con otras causas de insuficiencia renal como las prerrenales o crónicas29,68. Los valores de IL-18 en sangre y orina están discretamente más elevados en pacientes con infecciones; sin embargo, las infecciones del tracto urinario no parecen afectar su papel como biomarcador de AKI68.
La IL-18 resultó ser un biomarcador precoz para predecir el desarrollo de AKI, con elevación en sus niveles hasta 2-3 días antes del incremento de creatinina sérica en pacientes sometidos a cirugía cardiaca, con un pico máximo entre 6 y 12 h poscirugía. Sin embargo, la habilidad de IL-18 para predecir AKI varía ampliamente entre los distintos estudios en el post-operatorio de cirugía cardiaca y en unidades de cuidados críticos69–72. Se ha señalado que un valor de corte de IL-18 > 100pg/ml selecciona pacientes que desarrollarán AKI con una idds ratio de 6,5,71.
Los niveles urinarios de IL-18 han demostrado aportar información pronóstica. En un estudio con 1.219 pacientes adultos sometidos a cirugía cardiaca, los valores elevados de IL-18 se asocian con una mayor estancia hospitalaria, alta mortalidad y mayor requerimiento de diálisis73. En 2 estudios de pacientes en unidades de cuidados intensivos, se observó que la determinación urinaria de IL-18 al ingreso hospitalario tuvo una utilidad modesta para predecir AKI en las siguientes 24 h (AUC-ROC: 0,62- 0,73); sin embargo, resultó un factor pronóstico independiente del score APACHE-II71, además de predecir el evento compuesto de muerte o necesidad de diálisis74.
En cirrosis, un estudio reciente que incluyó 168 pacientes cirróticos con sepsis severa, mostró niveles urinarios elevados de IL-18 en aquellos que desarrollaban insuficiencia renal (64%), principalmente en los casos de necrosis tubular aguda75. En este estudio se señala que IL-18 urinaria tendría un AUC-ROC de 0,88 para el diagnóstico de necrosis tubular aguda frente a las otras etiologías de AKI, además este subgrupo se caracterizó por una mayor dependencia de vasopresores y elevada mortalidad, comparado con las otras causas de AKI. En el análisis multivariado la concentración urinaria de IL-18 resultó ser un factor independiente de mortalidad intrahospitalaria.
En vista de lo anterior, la IL-18 urinaria es un biomarcador cuya principal utilidad no es predecir el desarrollo de AKI, sino establecer el diagnóstico diferencial de la causa de AKI y evaluar el pronóstico de pacientes con cirrosis. En cirrosis, los valores de IL-18 deben interpretarse con cuidado debido a que la presencia de encefalopatía y las infecciones pueden aumentar sus niveles; sin embargo, esto aparentemente no afectaría la capacidad de IL-18 urinaria para evaluar el pronóstico y establecer la presencia de lesión renal en pacientes cirróticos que desarrollan AKI asociado a infecciones.
Liver-fatty acid binding proteinLas fatty acid binding protein (FABP) son pequeñas proteínas citoplasmáticas de 14kDa que se expresan en todos los tejidos y se unen a ácidos grasos que luego serán transportados hacia la mitocondria para los procesos de β-oxidación. La producción sistémica de las FABP es reabsorbida en su totalidad por el túbulo proximal, sin embargo, en respuesta a la agresión, su expresión aumenta intensamente en el túbulo proximal (L-FABP) y en el distal (H-FABP), para posteriormente ser liberada hacia la orina. Otros mecanismos como la sepsis y la nefrotoxicidad por fármacos aumentan los niveles urinarios de L-FABP en modelos animales.
La L-FABP ha demostrado ser un marcador precoz de AKI en pacientes pediátricos en el post-operatorio de cirugía cardiaca; en estos pacientes una determinación de L-FABP urinaria a las 4 h poscirugía tuvo un AUC-ROC de 0,81 para el diagnóstico de AKI76. En adultos, L-FABP fue incluso más precoz con AUC-ROC de 0,84 y 0,82 a las 0 y 2 h poscirugía, sugiriendo que en esta población la combinación de NGAL y L-FABP mejora notablemente la predicción de AKI hasta alcanzar un AUC-ROC de 0,9123. En este estudio también se demostró que L-FABP puede predecir la progresión de AKI. Esto concuerda con otra comunicación en la que L-FABP urinaria reflejó mejor que NGAL e IL-18 la severidad de AKI y tuvo mayor habilidad para predecir el desarrollo de nuevos episodios de AKI69.
En cuanto al diagnóstico diferencial, L-FABP ha revelado en estudios recientes tener una mayor sensibilidad que NGAL para diferenciar pacientes con insuficiencia renal secundaria a hipovolemia de aquellos que no experimentan AKI, lo cual indica que L-FABP sería el biomarcador urinario con mayor sensibilidad para detectar episodios subclínicos de AKI77.
Los niveles urinarios de L-FABP son útiles para determinar el pronóstico; en un estudio señalado anteriormente, de 5 biomarcadores evaluados (NGAL, L-FABP, IL-18, N-acetyl-D-glucosaminidase y albúmina), solo L-FABP y NGAL se asociaron con mortalidad a 14 días. La combinación de ambos marcadores exhibió un AUC-ROC para predecir mortalidad de 0,9169. La L-FABP urinaria también ha mostrado ser un parámetro importante para evaluar el evento compuesto de muerte o necesidad de diálisis en pacientes hospitalizados78. En 145 pacientes con shock séptico y AKI, la L-FABP se encontró significativamente elevada en pacientes que murieron en los primeros 14 días de hospitalización, con un AUC-ROC para L-FABP urinaria de 0,99 frente a 0,92 del APACHE-II score y el 0,81 del SOFA score79. Sin embargo, series más largas de pacientes en contextos más heterogéneos han fallado en demostrar la utilidad de L-FABP en predecir el pronóstico y le otorgan un papel menor en distinguir AKI intrínseca (no transitoria) frente a otros biomarcadores urinarios como NGAL y KIM-129.
En conclusión, la L-FABP urinaria es un biomarcador precoz de AKI con una gran capacidad para detectar formas subclínicas de AKI. La utilidad de L-FABP ha sido demostrada en poblaciones donde otros biomarcadores como la NGAL tienen una eficacia limitada como es el caso de pacientes con sepsis. La L-FABP ha mostrado tener un excelente valor pronóstico en series homogéneas de pacientes, sin embargo su eficacia es menor en contextos más heterogéneos. La falta de especificidad de la L-FABP urinaria (se encuentra incrementada en enfermedades cardiovasculares, principalmente eventos isquémicos) y el hecho de que los pacientes con enfermedades hepáticas puedan tener niveles de L-FABP aumentados80 dificultan su empleo en la evaluación de AKI en pacientes con cirrosis.
N-acetyl-D-glucosaminidaseLa N-acetyl-D-glucosaminidase (NAG) es una enzima lisosomal cuyas isoenzimas A y B se localizan en el túbulo proximal. La tasa de excreción urinaria de NAG es constante debido a que su peso molecular (130kDa) previene la filtración de otras isoenzimas de NAG que son producidas en otros tejidos y liberadas a la circulación sanguínea. La actividad de NAG, principalmente de la isoenzima B, aumenta en respuesta a la lesión del túbulo renal, por lo que desde hace más de 30 años se propuso como biomarcador de insuficiencia renal81. Los niveles de NAG en orina aumentan en varias entidades como la toxicidad renal por fármacos y metales pesados, las enfermedades glomerulares, las infecciones del tracto urinario, el reflujo vesicoureteral, la litiasis renal, el rechazo del injerto renal, la hipertensión arterial y la diabetes mellitus, el carcinoma renal y algunas formas de vasculitis.
Algunos estudios han señalado que NAG puede tener un modesto valor predictivo para el desarrollo de AKI (AUC-ROC: 0,75-0,84)82,83. En cuanto al valor pronóstico de NAG, un trabajo reciente señala que la determinación de la actividad enzimática de NAG es un factor pronóstico independiente de muerte o necesidad de diálisis en 201 pacientes hospitalizados, principalmente para aquellos pacientes con valores urinarios de NAG superiores a 50 UI/g de creatinina (AUC-ROC: 0,71)40. Otro estudio en una cohorte más heterogénea con 339 pacientes en unidades de cuidados intensivos no confirmó el papel pronóstico de NAG69. No existen estudios específicos acerca del papel de NAG en pacientes con cirrosis y AKI.
Aunque NAG es un marcador sensible para diferenciar episodios establecidos de AKI, su poca especificidad y la falta de estudios que confirmen su valor pronóstico condicionan el uso de este tradicional biomarcador en pacientes con insuficiencia renal y por tanto limitan su aplicación en la evaluación de AKI en pacientes con cirrosis.
Netrin-1Netrin-1 (Ntn-1) es una laminina de 75kDa, inicialmente relacionada con el proceso de migración neuronal, y que en condiciones basales se expresa mínimamente en el epitelio del túbulo proximal. La Ntn-1 es normalmente indetectable en orina, sin embargo diversos modelos animales han mostrado un aumento de su expresión en el túbulo proximal, tan precoz como desde la primera hora posterior a la lesión renal, para luego ser liberada a la orina. Esta lesión está mediada por mecanismos como isquemia/reperfusión, toxicidad por fármacos y sepsis. Se ha postulado que Ntn-1 tendría un papel protector en AKI, ya que su deficiencia aumenta el grado de lesión histológica84.
En una cohorte de pacientes pediátricos que sometidos a cirugía cardiaca, la Ntn-1 se elevó en orina desde la segunda hora, con un pico a la sexta hora, manteniendo su elevación hasta las 48 h posteriores a la cirugía de bypass coronario85. En este estudio, la determinación urinaria de Ntn-1 a las 6 h mostró una excelente habilidad para predecir AKI (AUC-ROC: 0,86), además de correlacionarse con la duración y severidad de AKI, observando que a las 48 h pacientes con mayor grado de lesión renal (categoría F de la clasificación RIFLE) permanecían con valores altos, frente a las otras categorías (R e I del RIFLE) en las que a las 48 h el valor de Ntn-1 disminuyó. En otro estudio en un pequeño grupo de pacientes con diferentes causas de AKI, aquellos con AKI asociado a sepsis tuvieron los valores más altos frente a pacientes con AKI isquémico o nefrotóxico86.
La Ntn-1 es un biomarcador predictivo del desarrollo de AKI y probablemente específico de esta entidad. La Ntn-1 tendría un papel para evaluar la gravedad de la lesión renal y la recuperación de los pacientes con AKI durante el curso de la hospitalización; también podría ayudar en el diagnóstico diferencial de AKI asociada a infecciones, la cual representa la causa más prevalente de insuficiencia renal en pacientes con cirrosis87. Pese a estas características, la falta de estudios en cohortes más largas y heterogéneas de pacientes probablemente condicione su uso en el diagnóstico diferencial de la insuficiencia renal en la cirrosis.
Otros biomarcadoresMonocyte chemoattractant protein (MCP-1), calprotectin, klotho, hepatocyte growth factor (HGF), IL-6, inducible protein-10 (IP-10), clusterin, trefoil factor 3 (TFF-3), NH3 exchanger, hepcidin, Hsp 72, GST, retinol binding protein (RBP), osteopontin, α y β microglobulin, fetuin-alfa, toll-like receptor 4 en orina (TLR4-u), microRNA (principalmente miR-210), etc.
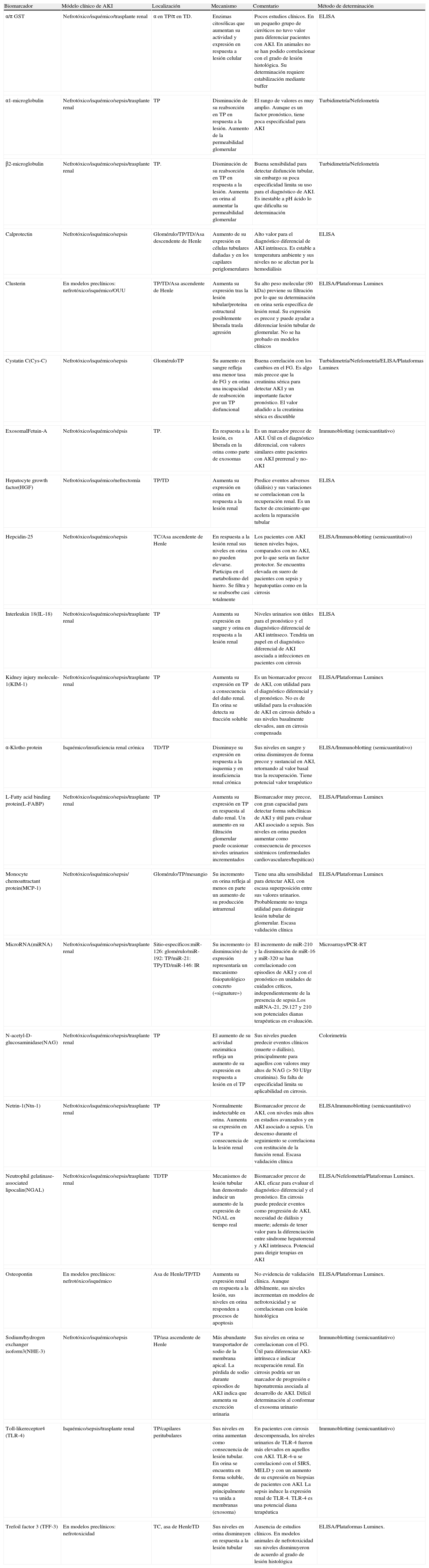
Las características y la evidencia acerca de los principales biomarcadores se resumen en la tabla 3. En esta lista se incluyen otras moléculas que han sido propuestas como candidatos a biomarcadores a partir de estudios translacionales y que tienen menor evidencia frente a las ya reseñadas, de algunas de las cuales no se cuenta con datos de estudios en humanos.
Principales candidatos a biomarcadores con potencial aplicación en cirrosis
| Biomarcador | Módelo clínico de AKI | Localización | Mecanismo | Comentario | Método de determinación |
| α/π GST | Nefrotóxico/isquémico/trasplante renal | α en TP/π en TD. | Enzimas citosólicas que aumentan su actividad y expresión en respuesta a lesión celular | Pocos estudios clínicos. En un pequeño grupo de cirróticos no tuvo valor para diferenciar pacientes con AKI. En animales no se han podido correlacionar con el grado de lesión histológica. Su determinación requiere estabilización mediante buffer | ELISA |
| α1-microglobulin | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | Disminución de su reabsorción en TP en respuesta a la lesión. Aumento de la permeabilidad glomerular | El rango de valores es muy amplio. Aunque es un factor pronóstico, tiene poca especificidad para AKI | Turbidimetría/Nefelometría |
| β2-microglobulin | Nefrotóxico/isquémico/sepsis/trasplante renal | TP. | Disminución de su reabsorción en TP en respuesta a la lesión. Aumenta en orina al aumentar la permeabilidad glomerular | Buena sensibilidad para detectar disfunción tubular, sin embargo su poca especificidad limita su uso para el diagnóstico de AKI. Es inestable a pH ácido lo que dificulta su determinación | Turbidimetría/Nefelometría |
| Calprotectin | Nefrotóxico/isquémico/sepsis | Glomérulo/TP/TD/Asa descendente de Henle | Aumento de su expresión en células tubulares dañadas y en los capilares periglomerulares | Alto valor para el diagnóstico diferencial de AKI intrínseca. Es estable a temperatura ambiente y sus niveles no se afectan por la hemodiálisis | ELISA |
| Clusterin | En modelos preclínicos: nefrotóxico/isquémico/OUU | TP/TD/Asa ascendente de Henle | Aumenta su expresión tras la lesión tubular/proteína estructural posiblemente liberada trasla agresión | Su alto peso molecular (80kDa) previene su filtración por lo que su determinación en orina sería específica de lesión renal. Su expresión es precoz y puede ayudar a diferenciar lesión tubular de glomerular. No se ha probado en modelos clínicos | ELISA/Plataformas Luminex |
| Cystatin C(Cys-C) | Nefrotóxico/isquémico/sepsis | GloméruloTP | Su aumento en sangre refleja una menor tasa de FG y en orina una incapacidad de reabsorción por un TP disfuncional | Buena correlación con los cambios en el FG. Es algo más precoz que la creatinina sérica para detectar AKI y un importante factor pronóstico. El valor añadido a la creatinina sérica es discutible | Turbidimetría/Nefelometría/ELISA/Plataformas Luminex |
| ExosomalFetuin-A | Nefrotóxico/isquémico/sépsis | TP. | En respuesta a la lesión, es liberada en la orina como parte de exosomas | Es un marcador precoz de AKI. Útil en el diagnóstico diferencial, con valores similares entre pacientes con AKI prerrenal y no-AKI | Immunoblotting (semicuantitativo) |
| Hepatocyte growth factor(HGF) | Nefrotóxico/isquémico/nefrectomía | TP/TD | Aumenta su expresión en orina en respuesta a la lesión renal | Predice eventos adversos (diálisis) y sus variaciones se correlacionan con la recuperación renal. Es un factor de crecimiento que acelera la reparación tubular | ELISA |
| Hepcidin-25 | Nefrotóxico/isquémico/sepsis | TC/Asa ascendente de Henle | En respuesta a la lesión renal sus niveles en orina no pueden elevarse. Participa en el metabolismo del hierro. Se filtra y se reabsorbe casi totalmente | Los pacientes con AKI tienen niveles bajos, comparados con no AKI, por lo que sería un factor protector. Se encuentra elevada en suero de pacientes con sepsis y hepatopatías como en la cirrosis | ELISA/Immunoblotting (semicuantitativo) |
| Interleukin 18(IL-18) | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | Aumenta su expresión en sangre y orina en respuesta a la lesión renal | Niveles urinarios son útiles para el pronóstico y el diagnóstico diferencial de AKI intrínseco. Tendría un papel en el diagnóstico diferencial de AKI asociada a infecciones en pacientes con cirrosis | ELISA |
| Kidney injury molecule-1(KIM-1) | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | Aumenta su expresión en TP a consecuencia del daño renal. En orina se detecta su fracción soluble | Es un biomarcador precoz de AKI, con utilidad para el diagnóstico diferencial y el pronóstico. No es de utilidad para la evaluación de AKI en cirrosis debido a sus niveles basalmente elevados, aun en cirrosis compensada | ELISA/Plataformas Luminex |
| α-Klotho protein | Isquémico/insuficiencia renal crónica | TD/TP | Disminuye su expresión en respuesta a la isquemia y en insuficiencia renal crónica | Sus niveles en sangre y orina disminuyen de forma precoz y sustancial en AKI, retornando al valor basal tras la recuperación. Tiene potencial valor terapéutico | ELISA/Immunoblotting (semicuantitativo) |
| L-Fatty acid binding protein(L-FABP) | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | Aumenta su expresión en TP en respuesta al daño renal. Un aumento en su filtración glomerular puede ocasionar niveles urinarios incrementados | Biomarcador muy precoz, con gran capacidad para detectar forma subclínicas de AKI y útil para evaluar AKI asociado a sepsis. Sus niveles en orina pueden aumentar como consecuencia de procesos sistémicos (enfermedades cardiovasculares/hepáticas) | ELISA/Plataformas Luminex |
| Monocyte chemoattractant protein(MCP-1) | Nefrotóxico/isquémico/sepsis/ | Glomérulo/TP/mesangio | Su incremento en orina refleja al menos en parte un aumento de su producción intrarrenal | Tiene una alta sensibilidad para detectar AKI, con escasa superposición entre sus valores urinarios. Probablemente no tenga utilidad para distinguir lesión tubular de glomerular. Escasa validación clínica | ELISA/Plataformas Luminex |
| MicroRNA(miRNA) | Nefrotóxico/isquémico/sepsis/trasplante renal | Sitio-específicos:miR-126: glomérulo/miR-192: TP/miR-21: TPyTD/miR-146: IR | Su incremento (o disminución) de expresión representaría un mecanismo fisiopatológico concreto («signature») | El incremento de miR-210 y la disminución de miR-16 y miR-320 se han correlacionado con episodios de AKI y con el pronóstico en unidades de cuidados críticos, independientemente de la presencia de sepsis.Los miRNA-21, 29.127 y 210 son potenciales dianas terapéuticas en evaluación. | Microarrays/PCR-RT |
| N-acetyl-D-glucosaminidase(NAG) | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | El aumento de su actividad enzimática refleja un aumento de su expresión en respuesta a lesión en el TP | Sus niveles pueden predecir eventos clínicos (muerte o diálisis), principalmente para aquellos con valores muy altos de NAG (> 50 UI/gr creatinina). Su falta de especificidad limita su aplicabilidad en cirrosis. | Colorimetría |
| Netrin-1(Ntn-1) | Nefrotóxico/isquémico/sepsis/trasplante renal | TP | Normalmente indetectable en orina. Aumenta su expresión en TP a consecuencia de la lesión renal | Biomarcador precoz de AKI, con niveles más altos en estadios avanzados y en AKI asociado a sepsis. Un descenso durante el seguimiento se correlaciona con restitución de la función renal. Escasa validación clínica | ELISAImmunoblotting (semicuantitativo) |
| Neutrophil gelatinase-associated lipocalin(NGAL) | Nefrotóxico/isquémico/sepsis/trasplante renal | TDTP | Mecanismos de lesión tubular han demostrado inducir un aumento de la expresión de NGAL en tiempo real | Biomarcador precoz de AKI, eficaz para evaluar el diagnóstico diferencial y el pronóstico. En cirrosis puede predecir eventos como progresión de AKI, necesidad de diálisis y muerte; además de tener valor para la diferenciación entre síndrome hepatorrenal y AKI intrínseca. Potencial para dirigir terapias en AKI | ELISA/Nefelometría/Plataformas Luminex. |
| Osteopontin | En modelos preclínicos: nefrotóxico/isquémico | Asa de Henle/TP/TD | Aumenta su expresión renal en respuesta a la lesión, sus niveles en orina responden a procesos de apoptosis | No evidencia de validación clínica. Aunque débilmente, sus niveles incrementan en modelos de nefrotoxicidad y se correlacionan con lesión histológica | ELISA/Plataformas Luminex. |
| Sodium/hydrogen exchanger isoform3(NHE-3) | Nefrotóxico/isquémico/sepsis | TP/asa ascendente de Henle | Más abundante transportador de sodio de la membrana apical. La pérdida de sodio durante episodios de AKI indica que aumenta su excreción urinaria | Sus niveles en orina se correlacionan con el FG. Útil para diferenciar AKI-intrínseca e indicar recuperación renal. En cirrosis podría ser un marcador de progresión e hiponatremia asociada al desarrollo de AKI. Difícil determinación al conformar el exosoma urinario | Immunoblotting (semicuantitativo) |
| Toll-likereceptor4 (TLR-4) | Isquémico/sepsis/trasplante renal | TP/capilares peritubulares | Sus niveles en orina aumentan como consecuencia de lesión tubular. En orina se encuentra en forma soluble, aunque principalmente va unida a membranas (exosoma) | En pacientes con cirrosis descompensada, los niveles urinarios de TLR-4 fueron más elevados en aquellos con AKI. TLR-4-u se correlacionó con el SIRS, MELD y con un aumento de su expresión en biopsias de pacientes con AKI. La sepsis induce la expresión renal de TLR-4. TLR-4 es una potencial diana terapéutica | Immunoblotting (semicuantitativo) |
| Trefoil factor 3 (TFF-3) | En modelos preclínicos: nefrotoxicidad | TC, asa de HenleTD | Sus niveles en orina disminuyen en respuesta a la lesión tubular | Ausencia de estudios clínicos. En modelos animales de nefrotoxicidad sus niveles disminuyeron de acuerdo al grado de lesión histológica | ELISA/Plataformas Luminex. |
Varias de estas moléculas requieren una mayor complejidad para su determinación como el empleo de buffer estabilizadores (GST); immunoblotting, particularmente para aquellas proteínas que no se encuentran en fase soluble sino que componen el exosoma urinario (NH3, TLR4-u, fetuin-A) o el empleo de plataformas de microarrays o polymerase chain reaction-reverse transcriptase (PCR-RT) (microRNA). Esta dificultad para su medición evita en la mayoría de casos su estandarización, resultando en moléculas poco atractivas para estudios de validación clínica que involucren grandes cohortes de pacientes.
ConclusionesLos biomarcadores de lesión renal constituyen actualmente un área de intensa investigación debido a la ineficacia de la creatinina sérica en la evaluación de la insuficiencia renal. Estos biomarcadores tienen la propiedad de caracterizar y fenotipificar los diferentes espectros de la enfermedad renal.
La mayoría de estos biomarcadores son útiles para predecir el desarrollo precoz de AKI y cuentan con un alto valor pronóstico cuando son evaluados en poblaciones homogéneas como en el post operatorio de cirugía cardiaca, sin embargo fallan en contextos más heterogéneos como las unidades de cuidados críticos o los departamentos de urgencias.
Los pacientes con cirrosis desarrollan insuficiencia renal secundaria a múltiples causas que deben establecerse de forma precoz debido a que el pronóstico varía en función de la causa de la insuficiencia renal. La NGAL urinaria ha demostrado tener un papel en el diagnóstico diferencial de la insuficiencia renal en la cirrosis, además de predecir el desarrollo de eventos como progresión de AKI, necesidad de hemodiálisis y mortalidad.
La NGAL podría tener un importante rol en seleccionar a pacientes con cirrosis que puedan beneficiarse de terapias específicas como es el caso del tratamiento con terlipresina y albúmina para el SHR, excluyendo a aquellos pacientes con una lesión tubular manifiesta en quienes estaría contraindicado el uso de expansores plasmáticos.
Los estudios de biomarcadores en cirrosis deben interpretarse con cautela debido a que los niveles de algunas moléculas como KIM-1, L-FABP o hepcidin-25 pueden estar alterados en pacientes cirróticos, aun en ausencia de enfermedad renal significativa.
En la actualidad no existe un biomarcador ideal de lesión renal en cirrosis, los esfuerzos deben dirigirse a estudiar los mecanismos fisiopatológicos que suponen los cambios en los niveles de los biomarcadores. Es probable que la determinación de un panel de ellos en intervalos de tiempo específicos, más que la medida individual, pueda ayudar a distinguir entre las distintas causas de insuficiencia renal y predecir el pronóstico de pacientes con cirrosis.
FinanciaciónEste trabajo ha sido financiado por un Fondo de Investigación Sanitaria (FIS PI080108 to MG). CIBEREHD está financiado por el Instituto de Salud Carlos III.
Conflicto de interesesLos autores no reportan conflictos de intereses.