Vibrio cholerae (V. cholerae) es un bacilo gramnegativo curvo, móvil, oxidasa y catalasa positivo, anaerobio facultativo y de hábitat marino1. Según la naturaleza del antígeno O del lipopolisacárido de su pared se distinguen hasta 200 serogrupos distintos, siendo el O1 y el O139 los causantes del cólera epidémico1. Los serogrupos no toxigénicos (no O1, no O139) se relacionan habitualmente con el desarrollo de gastroenteritis autolimitada tras la ingesta de marisco, en particular moluscos bivalvos filtradores, si bien la gravedad del cuadro puede llegar a asemejarse a la observada en el cólera2,3. Al margen de su potencial implicación en otitis externa, celulitis e infección de heridas, la capacidad enteroinvasiva de los serogrupos no toxigénicos es limitada y circunscrita a huéspedes con ciertas comorbilidades4.
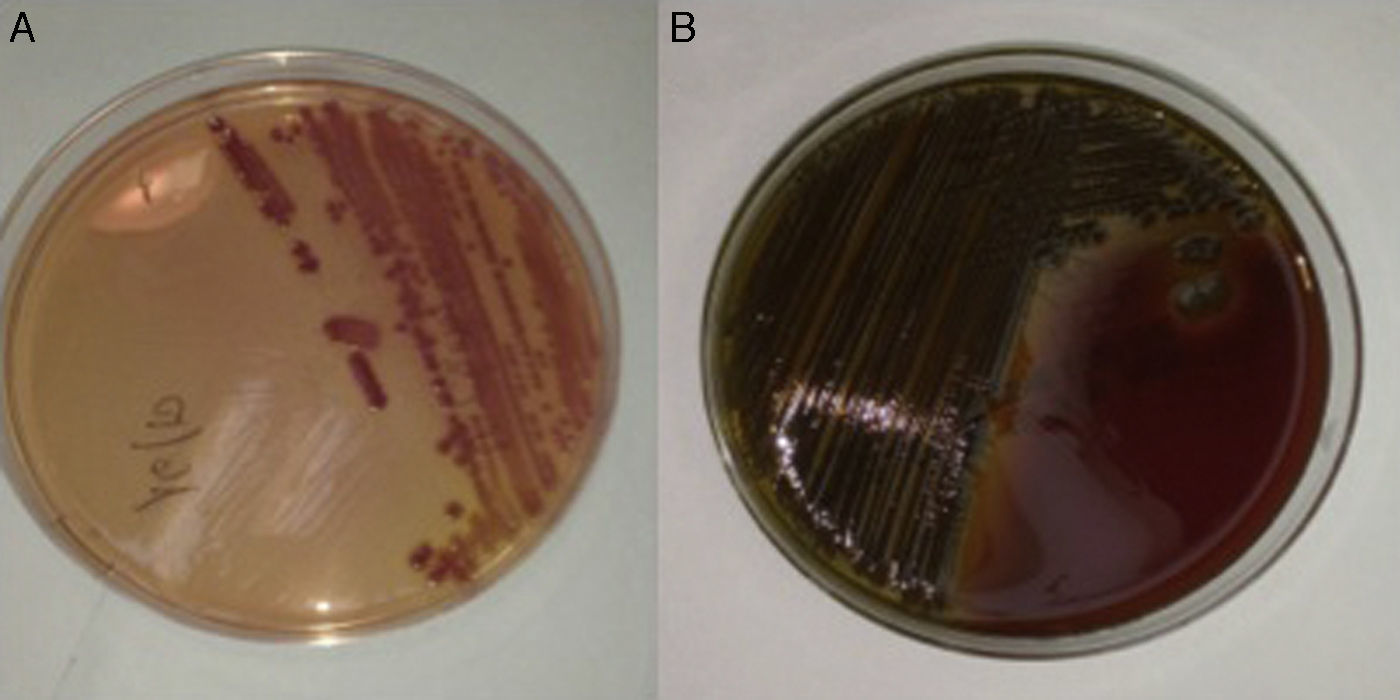
Presentamos el caso de un varón de 56 años con diagnóstico de diabetes mellitus tipo 2 y cirrosis hepática de etiología enólica en grado funcional A6 de Child-Turcotte-Pugh (9 puntos en escala MELD), que había desarrollado descompensaciones ascítico-edematosas, varices esofágicas y gástricas, y trombosis del eje venoso espleno-portal como complicaciones previas. Seguía tratamiento con espironolactona, furosemida, propranolol, tinzaparina e insulina glargina. Consultó en el servicio de urgencias por un cuadro de 24h de evolución, consistente en sensación distérmica con fiebre objetivada en domicilio (38,5°C), somnolencia, odinofagia y tos sin expectoración, así como disminución de la consistencia de las deposiciones. La exploración física mostró una temperatura axilar de 36,8°C (tras la toma de antipirético), tensión arterial de 113/59mmHg, frecuencia cardíaca de 87lpm y estigmas de hepatopatía crónica. Analíticamente destacaba la presencia de trombocitopenia (26,0×109 plaquetas/l), elevación de reactantes de fase aguda (proteínaC reactiva 14,9mg/dl; rango normal: 0,1-0,5), hipertransaminasemia (gamma-glutamil transpeptidasa [GGT] 114UI/l, fosfatasa alcalina 134UI/l) y discreta alteración de las pruebas de función hepática (bilirrubina total 2,7mg/dl, INR 1,29). El recuento leucocitario era normal (4,7×109 leucocitos/l). Una ecografía abdominal tan solo reveló una mínima cantidad de ascitis, al margen de los hallazgos compatibles con la hepatopatía crónica subyacente, en tanto que la radiografía de tórax no mostró consolidaciones. Asumiendo un posible diagnóstico de infección de tracto respiratorio se inició tratamiento empírico con levofloxacino (500mg cada 24h) y se concedió el alta del paciente tras la obtención de 2 sets de hemocultivos (sistema BacT/ALERT® 3D, bioMérieux, Marcy l’Etoile, Francia). A las 24h se aisló en uno de los sets un bacilo gramnegativo curvo, lactosa positivo en placa de agar-MacConkey, que formaba colonias de color verdoso, oxidasa positivas, en la placa de agar-sangre (fig. 1). Mediante métodos bioquímicos (sistema MicroScan WalkAway®, Siemens, California, EE.UU.), espectrometría de masas (Bruker Daltonics, Bremen, Alemania) y aglutinación directa (BD Difco™ Vibrio cholerae Antisera, Becton Dickinson, Sparks, Maryland, EE.UU.) se obtuvo la identificación de V. cholerae no toxigénico. En el antibiograma se comprobó la sensibilidad a aminopenicilinas y trimetoprima/sulfametoxazol. En ese momento el paciente se encontraba asintomático y afebril, por lo que se optó por mantener el tratamiento con levofloxacino hasta completar 10 días. Al ser interrogado refirió el consumo, unos días antes del inicio de los síntomas, de una cantidad importante de moluscos, incluyendo navajas (Ensis spp.) y berberechos (Cerastoderma edule) al vapor y mejillones (Mytilus galloprovincialis), así como carabineros (Aristaeopsis edwardsiana) a la plancha. Su cónyuge, que también había ingerido estos productos, había presentado coincidentemente un cuadro de gastroenteritis leve.
Si bien la relevancia clínica y de salud pública de los serogrupos no toxigénicos (también denominados no aglutinables o no coléricos) de V. cholerae fue cuestionada durante largo tiempo, su implicación en brotes de diarrea en sujetos inmunocompetentes tras la ingesta de marisco infectado ha sido documentada en varios países europeos2. Un estudio reciente demostró una elevada prevalencia de V. cholerae no toxigénico en gambas (17%) y mejillones (9%) recolectados en aguas costeras italianas5. Dado que su crecimiento óptimo requiere de entornos acuáticos salinos templados (>15°C), se ha sugerido que la elevación de la temperatura media del mar asociada al calentamiento global podría justificar el incremento en la incidencia de las infecciones producidas por este microorganismo, incluso en latitudes más septentrionales2,5.
La patogenicidad de V. cholerae no toxigénico puede verse incrementada por la presencia de un amplio repertorio de factores de virulencia, tales como enzimas extracelulares, enterotoxinas y hemolisinas5,6. Como consecuencia del estado de sobrecarga férrica y de la disminución de la capacidad de opsonofagocitosis y de aclaramiento retículo-endotelial (que favorecen a su vez la translocación bacteriana desde la luz del tubo digestivo), la cirrosis hepática es una de las comorbilidades más frecuentemente asociadas al desarrollo de infecciones enteroinvasivas por V. cholerae4,7. La literatura recoge ejemplos de bacteriemia, peritonitis bacteriana espontánea o endoftalmitis4,6–9. Muchos de estos casos proceden del Sudeste Asiático7–9, siendo anecdótica su descripción en España10. La mortalidad de los episodios de bacteriemia puede ser del 47%4. La mayor parte de los aislamientos de V. cholerae no toxigénico son susceptibles a las cefalosporinas de 3.ª generación, tetraciclinas, trimetoprima/sulfametoxazol y fluoroquinolonas2,7,8. Gracias a su actividad bactericida in vitro y buena biodisponibilidad oral, éstas últimas representan una excelente opción terapéutica, tal y como pone de manifiesto nuestra experiencia.
En conclusión, es esperable que los serogrupos no toxigénicos de V. cholerae se consoliden en el futuro como una causa emergente de infección gastrointestinal en nuestro medio. El paciente cirrótico constituye un huésped particularmente susceptible de desarrollar bacteriemia y otras formas de infección enteroinvasiva, que pueden acompañarse de una notable mortalidad. Esta asociación debe ser tenida en cuenta a fin de interrogar de forma dirigida acerca de prácticas alimentarias recientes y, eventualmente, iniciar un tratamiento antibiótico empírico ante un cuadro clínico sugerente. Por último, sería recomendable instruir a los pacientes con cirrosis sobre los riesgos que puede acarrear el consumo de marisco crudo o poco cocinado.
FinanciaciónMario Fernández Ruiz disfruta de un contrato de investigación clínica Juan Rodés (JR14/00036) del Instituto de Salud Carlos III, Ministerio de Economía y Competitividad.
Conflicto de interesesLos autores declaran que no existen conflicto de intereses en relación con el presente trabajo.