El tumor de células germinales del testículo es el tumor sólido más curable, con una tasa relativa de supervivencia global a los 10 años de más del 95%. La alta tasa de curación y la supervivencia a largo plazo de la mayoría de estos pacientes hace que se adquiera interés por los efectos adversos relacionados con el tratamiento. Los segundos tumores malignos representan uno de los efectos más graves, que comprometen el pronóstico de los sobrevivientes. El objetivo del presente trabajo es describir el caso de un paciente con cáncer de testículo tipo seminoma quien 20 años después presenta un segundo primario, y realizar una revisión de la literatura.
Se describe el caso de un paciente de 68 años, con antecedente de tabaquismo e índice tabáquico de 45, criptorquidia bilateral, operado de orquidopexia a los 39 años, diagnosticado de cáncer de testículo derecho con tumor retroperitoneal de 8×8cm en 1993, postoperado de orquiectomía radical y posteriormente tratado con quimioterapia, con respuesta completa al tratamiento. Veinte años después presenta intolerancia a la vía oral, epigastralgia, una endoscopia con evidencia de tumor gástrico Bormann III, cuyo reporte histopatológico fue de adenocarcinoma poco diferenciado, tipo difuso con células en anillo de sello, y una tomografía computarizada con evidencia de carcinomatosis peritoneal.
Los pacientes sobrevivientes de cáncer de células germinales, curados con el tratamiento —ya sea quimioterapia y/o radioterapia—, se enfrentan a los efectos a largo plazo del tratamiento, incluyendo toxicidad relacionada con la quimioterapia y la presentación de un segundo primario, inclusive con riesgo hasta 30 años después del diagnóstico del tumor primario.
The testicular germ cell tumour is the most curable solid tumour, with a relative overall survival rate of more than the 95% after 10 years. The cure rate and long term survival of the majority of the patients has led to an interest in the side effects related to the treatment. Second malignant tumours are one of the most serious side effects that compromise the prognosis of the survivors. The aim of the present study is describe the case of one patient with seminomatous type testicular cancer, who presented with a second primary after 20 years. A literature review is also presented.
The case concerns a 68 year-old patient, with a smoking history with a tobacco index of 45, bilateral cryptorchidism, and an orchidopexy at 39 years old. Cancer was diagnosed in the right testicle with an 8×8cm retroperitoneal tumour. In 1993, a radical orchiectomy was performed, followed by chemotherapy, with full response to the treatment. Twenty years later, he had oral intolerance, epigastralgia, with endoscopic evidence of a Bormann III gastric tumour. The histopathological report described a poorly differentiated adenocarcinoma, diffuse with signet ring cells. The computed tomography showed evidence of peritoneal carcinomatosis.
Surviving patients of germ cell cancer, cured with chemotherapy and/or radiotherapy, face the long-term effects of the treatment, including chemotherapy related toxicity and the appearance of a second primary, including a risk up to 30 years after diagnosis of primary tumour.
Los tumores de células germinales de testículo representan del 1 al 2% de todas las neoplasias en hombres. Es la neoplasia maligna más frecuente en hombres de 20 a 35 años de edad. Hace 50 años, un diagnóstico de cáncer testicular metastásico significaba un 90% de probabilidades de muerte dentro del primer año1,2.
El tumor de células germinales de testículo es el tumor sólido más curable, con una tasa relativa de supervivencia global a los 10 años de más del 95%. Se curan el 95% de todos los pacientes que han recibido el diagnóstico de cáncer testicular y el 80% de pacientes con enfermedad metastásica1,3.
Los avances en el tratamiento, en particular la quimioterapia basada en platino, han dado lugar a una ganancia promedio de varias décadas de vida en los pacientes con enfermedad avanzada. Desde la introducción de la quimioterapia basada en cisplatino a finales de 1970, la tasa de supervivencia a 5 años aumentó considerablemente, y es actualmente superior al 95%3,4.
Se comparó la combinación de cisplatino 20mg/m2 (días1-5) y bleomicina 30mg (días 2, 9, 16) con vinblastina 0.15mg/kg (día 1,2) o etopósido 100mg/m2 (día1-5) como tratamiento de primera línea para el cáncer testicular metastásico, con ventaja en la supervivencia con este último esquema en pacientes con peor pronóstico y mejor perfil de toxicidad. Desde 1987 la combinación de bleomicina, etopósido y cisplatino se utiliza como quimioterapia estándar en primera línea para pacientes con tumor de células germinales de testículo metastásico5.
Basados en la aparente mayor sensibilidad del seminoma a la quimioterapia y a la radiación, la Universidad de Texas MD Anderson Cáncer Center fue de las primeras en realizar protocolos de tratamiento para los pacientes con seminoma avanzado diferentes de los pacientes con tumor de células germinales no seminomatoso6.
Logothetis et al., del MD Anderson Cancer Center, realizaron un estudio para pacientes con seminoma avanzado con un régimen de combinación de cisplatino y ciclofosfamida, llegando a la conclusión de que la combinación era efectiva. El 92% de los pacientes habían sobrevivido libres de enfermedad durante períodos largos. Los principales efectos secundarios fueron los atribuidos al cisplatino, es decir, nefrotoxicidad, neurotoxicidad, y ototoxicidad, siendo esta una opción de tratamiento en pacientes con enfermedad avanzada7.
La alta tasa de curación y la supervivencia a largo plazo de la mayoría de los pacientes con cáncer testicular hace que se adquiera interés por los efectos adversos relacionados con el tratamiento. Los segundos tumores malignos representan uno de los efectos más graves, que compromete el pronóstico de los sobrevivientes de cáncer testicular8.
Warren y Gates definieron en 1932 que un segundo cáncer primario es aquel producido al menos a 2cm de distancia del tumor primario, con al menos 5 años de diferencia en el tiempo entre uno y otro, que no debe ser una metástasis del primero y ambos deben tener confirmación histológica. La idea original se relacionaba con cánceres primarios de la cavidad oral y orofaringe. En la actualidad el término se emplea para hacer referencia a los cánceres que se presentan en sobrevivientes de cáncer, asociados a las propias terapias oncológicas o debido a la persistente exposición a factores de riesgo o carcinógenos como el tabaco, el alcohol, los carcinógenos ambientales o a la presencia de alteraciones génicas o de la función inmune. De acuerdo con la información del Surveillance, Epidemiology and End Results (SEER), la incidencia de segundos tumores primarios alcanza hasta el 16% del total de cáncer9,10.
Los hombres que han recibido quimioterapia son un 80% más propensos a ser diagnosticados con otro tipo de cáncer en comparación con los hombres en la población general11.
El presente trabajo describe la presentación de un segundo primario en un paciente que se encontraba en vigilancia después de recibir tratamiento para cáncer testicular de tipo seminoma, tratado con quimioterapia, así como una revisión de la literatura sobre las segundas neoplasias relacionadas.
Presentación del casoPaciente de sexo masculino de 68 años de edad, con antecedente de tabaquismo desde los 20 años, con índice tabáquico de 45, actualmente suspendido; alcoholismo ocasional; criptorquidia bilateral, operado de orquidopexia a los 39 años, e hipertensión arterial diagnosticada a los 64 años de edad en tratamiento médico.
Fue visto por primera vez el 13 de octubre de 1993 por presencia de tumor testicular derecho, de consistencia pétrea, con reporte ultrasonográfico que describió testículo derecho con tumor sugestivo de malignidad, y testículo izquierdo atrófico. Se realizó un TC abdominal el 19 octubre de 1993, el cual evidenció un tumor retroperitoneal de 8×8cm con zonas de hipodensidad. Se sometió a orquiectomía radical derecha el 20 de octubre de 1993, con reporte histopatológico de seminoma puro con extensión a la túnica vaginal. Los marcadores tumorales preorquiectomía fueron: β-hCG: 14, AFP 2.9, DHL 170, y los posquirúrgicos: β-hCG: 12, AFP y DHL dentro de parámetros normales.
Se sometió a tratamiento con quimioterapia intravenosa. Por datos de insuficiencia renal obstructiva, se administró un ciclo a base de ciclofosfamida 1g y etoposido 400mg el 26 de octubre de 1993, con lo cual se resolvió favorablemente el daño renal. Posteriormente se administró el esquema de cicflofosfamida 1g/m2 s.c. (1,800mg) días 1 y 43, y cisplatino 100mg/m2 (180mg) secuencial días 1, 8, 15, 43 y 50, finalizando el 13 de enero de 19947. El estudio tomográfico de control del 07 de febrero del 1994 mostró respuesta completa, con marcadores tumorales negativos. Se decidió dejar al paciente en vigilancia desde entonces.
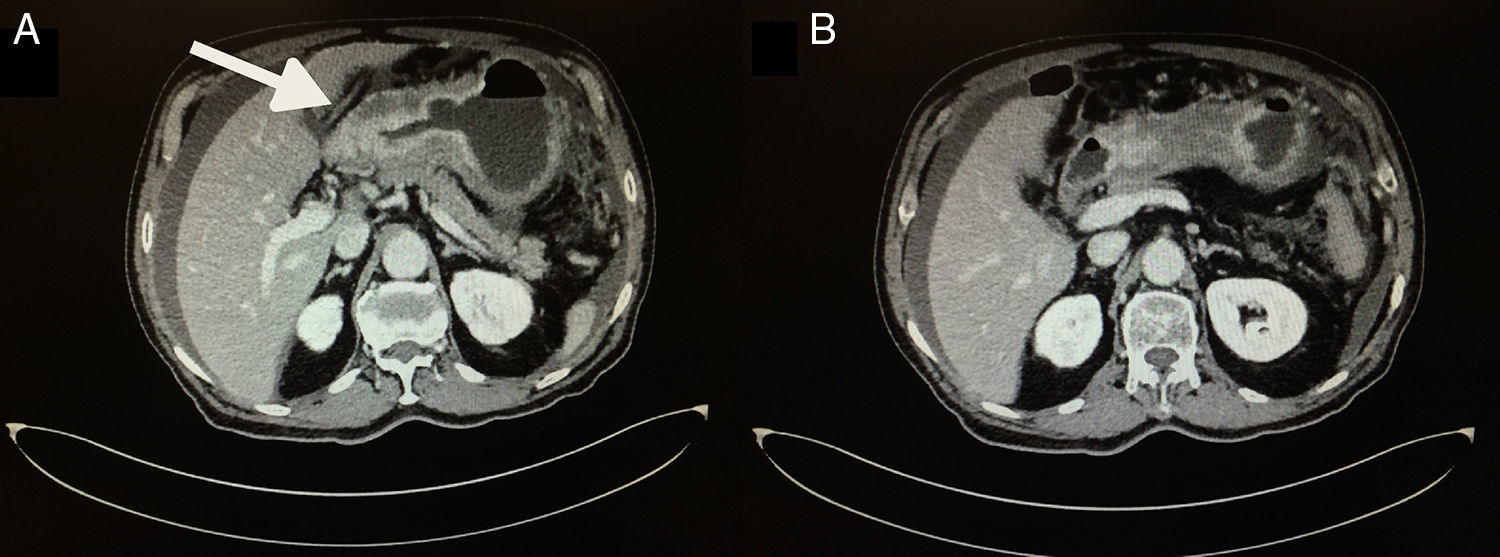
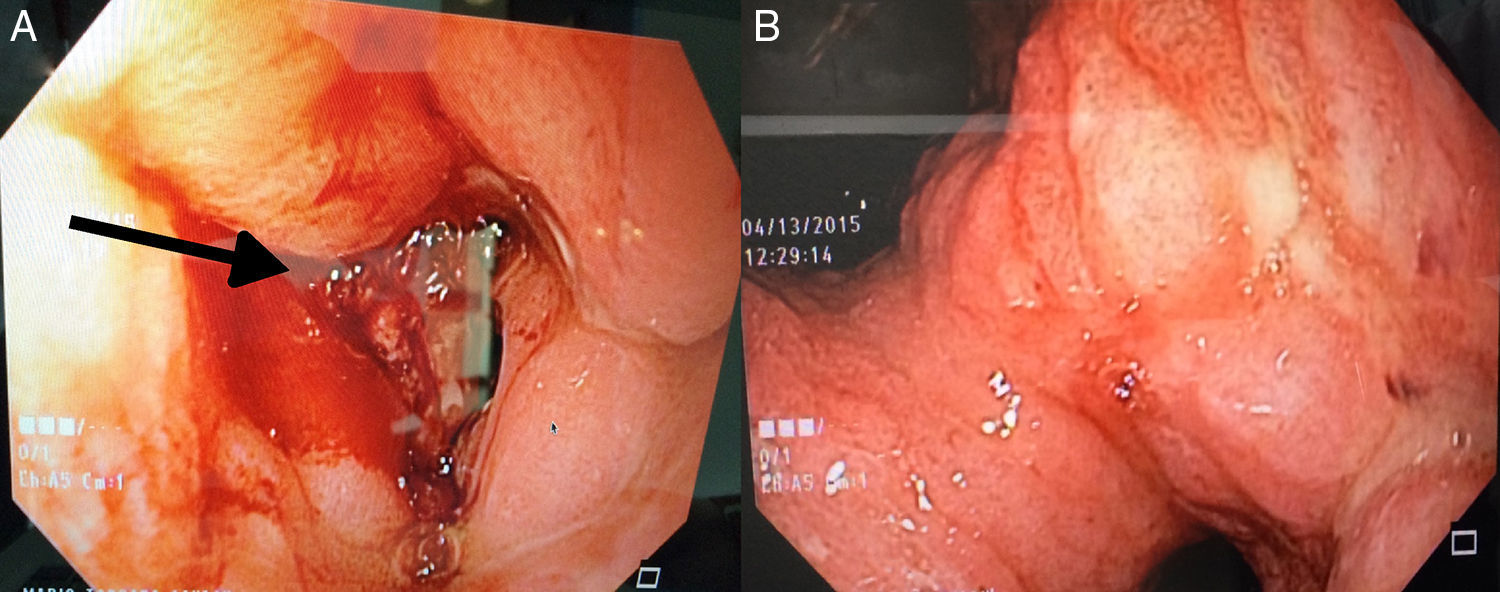
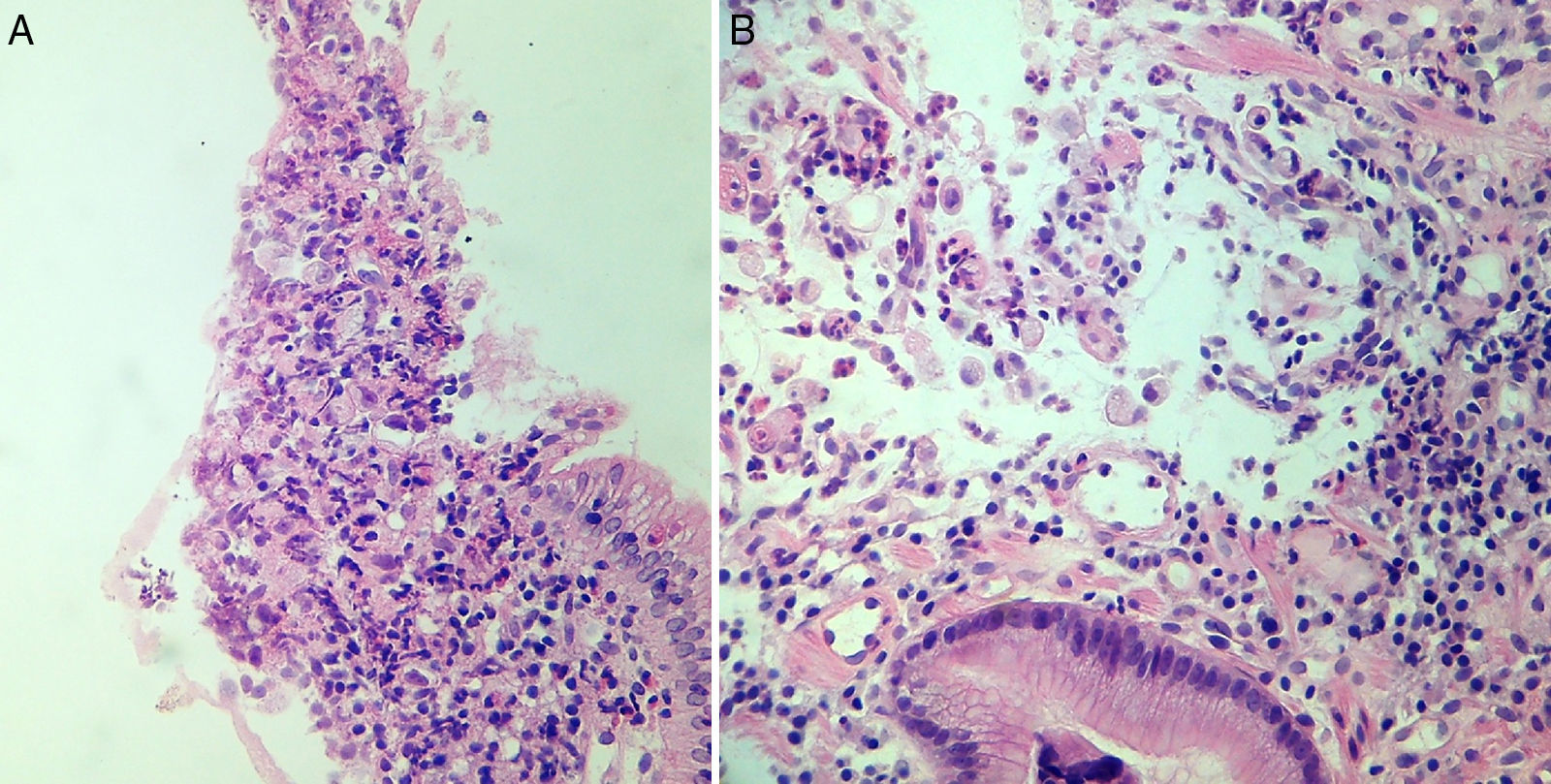
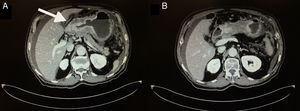
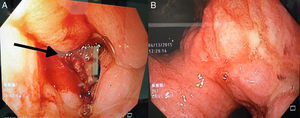
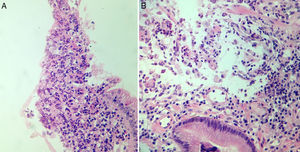
En marzo del 2015, a 252 meses de seguimiento, presenta un cuadro clínico caracterizado por dolor leve en epigastrio, intolerancia a la vía oral, náuseas y vómito, distensión abdominal, y pérdida de peso de 6kg en 20 días. Se le realizan estudios complementarios que reportan: a) Marcadores tumorales (01/04/15): AFP 1.82, ACE 1.98, CA 19-9<2.5, CA 125 399, PSA libre 0.070. b) Tomografía computarizada (08/04/2015): neoformación localizada en antro y píloro del estómago en relación con cáncer gástrico. Engrosamiento difuso del intersticio del pulmón en región apical izquierda con zona de fibrosis. Líquido en cavidad abdominal que se extiende por las correderas parietocólicas hasta el hueco pélvico. Carcinomatosis peritoneal de predominio en hipocondrio izquierdo (fig. 1). c) Endoscopia (14/04/15): tumor gástrico Bormann III en antro gástrico (fig. 2). d) Biopsia del tumor gástrico (IC: 15-04261): adenocarcinoma poco diferenciado (G3), de tipo difuso con células en anillo de sello (fig. 3).
El riesgo de cáncer testicular es de 8 a 10 veces mayor en el hermano de una persona con cáncer testicular y de 4 a 6 veces mayor en el hijo de una persona con cáncer testicular. El síndrome de Down y el síndrome de disgenesia testicular se encuentran también asociados1.
Una historia personal de tabaquismo de al menos 12 paquetes/año se asocia con el doble de riesgo de padecer cáncer testicular; sin ningún cambio en el riesgo después de dejar de fumar y sin diferencia entre exfumadores y los fumadores actuales2.
La criptorquidia ocurre en el 2 al 5% de los niños nacidos a término, siendo el factor de riesgo más importante para desarrollar cáncer testicular, asociándose además con alteración de la fertilidad. Entre los hombres que han tenido testículo no descendido, el riesgo de cáncer se incrementa de 2 a 8 veces. El 5-10% de todos los hombres con cáncer de testículo tienen antecedentes de criptorquidia1,2,12.
En un estudio realizado con 16,983 hombres con criptorquidia, que fueron tratados quirúrgicamente, el riesgo relativo de cáncer testicular fue de 2.23 cuando la orquidopexia se realizó antes de los 13 años de edad, en comparación con el 5.4 para los tratados con orquidopexia a los 13 años de edad o más12.
Histológicamente los tumores de células germinales se han clasificado en 2 grandes grupos: seminomatosos y no seminomatosos. El 80% de los seminomas son diagnosticados en etapa I, son altamente sensibles tanto a radioterapia como a quimioterapia y, por lo tanto, la curación es un resultado esperado en la mayoría de los casos, incluso con enfermedad metastásica en el momento de su presentación13.
Los seminomas se caracterizan por un comportamiento biológico menos agresivo que los no seminomas y su diseminación es predominantemente linfática. El primer escalón de los ganglios linfáticos que drenan el testículo derecho está situado en la región interaortocaval, seguido de los ganglios precavales y preaórticos. En el testículo izquierdo las primeras estaciones ganglionares incluyen preaórticos, ganglios del hilio renal izquierdo, seguidos por los ganglios interaortocavales. La propagación contralateral es común con los tumores del lado derecho, pero rara vez con tumores del lado izquierdo, y se asocia por lo general con enfermedad voluminosa5,13.
El seminoma se puede dividir en 3 categorías patológicas: clásico, espermatocítico y seminoma de células de sincitiotrofoblasto. El tipo espermatocítico es raro, ocurre en hombres de edad avanzada, y puede tener un mejor pronóstico. El tipo clásico y el sincitiotrofoblasto se comportan de manera similar, aunque este último se asocia con aumento en los niveles séricos de β-hCG13.
Aproximadamente el 85% de los pacientes se presentan con enfermedad en estadio I. Casi el 20% de los pacientes en esta etapa tienen metástasis ganglionar retroperitoneal oculta, con riesgo de progresión de la enfermedad si no se administra tratamiento adyuvante después de la orquiectomía. El tamaño del tumor primario de 4cm o más y la invasión de la rete testis han sido identificados como factores independientes asociados con un mayor riesgo de recaída en el análisis multivariado en muchos estudios retrospectivos13.
Durante mucho tiempo, los pacientes con seminoma en etapa clínica I fueron tratados con radioterapia adyuvante a ganglios retroperitoneales. En la actualidad es una modalidad que prácticamente ya no se usa. La vigilancia activa posterior a la orquiectomía con la administración de quimioterapia de salvamento únicamente en aquellos pacientes que recurren es una modalidad empleada por muchos. Otra modalidad incluye la administración de uno o 2 ciclos de carboplatino adyuvante. La supervivencia a largo plazo es casi del 100% independientemente de la modalidad de tratamiento utilizada. Los resultados del estudio SWENOTECA VII confirman la baja tasa de recaída para los pacientes sin factores de riesgo tratados solo con vigilancia activa de 2.9%, frente al 21.7% en los pacientes con 1-2 factores de riesgo. En un estudio de cohorte se observó la mediana de recaída en los pacientes con vigilancia activa a los 13.7 meses1,14,15.
Para pacientes que tienen enfermedad limitada a los ganglios retroperitoneales, etapa clínica II, el volumen tumoral influye en las decisiones de manejo. Para aquellos pacientes con enfermedad igual o menor a 3cm, la radioterapia a dosis de 30-36Gy en fraccionamiento clásico a ganglios paraórticos y pélvicos ipsilaterales es utilizada en la mayoría de los centros, ofreciendo una supervivencia a 5 años del 95-100%. Algunos centros prefieren utilizar quimioterapia en aquellos tumores mayores de 2cm de la misma manera que para tumores voluminosos o etapa clínica III. Los pacientes con enfermedad retroperitoneal voluminosa mayor de 3cm y los pacientes con etapa clínica III se tratan con poliquimioterapia basada en cisplatino (BEP por 3 ciclos o etopósido-cisplatino por 4 ciclos). La supervivencia libre de enfermedad a 5 años es alrededor del 95%1,13,16.
En el caso de recaída después de la quimioterapia, y si esta se produce menos de 3 meses después del ciclo de quimioterapia, la enfermedad todavía se considera sensible a la quimioterapia basada en platino para el tratamiento de rescate. El cisplatino es el fármaco fundamental que debe ser parte de cualquier quimioterapia de rescate. Los regímenes de salvamento de primera línea más utilizados son VIP (cisplatino, etopósido, ifosfamida), TIP (paclitaxel, ifosfamida, cisplatino) o VeIP (vinblastina, ifosfamida, cisplatino). La recaída después de quimioterapia basada en platino es muy rara, y alrededor del 50% de ellos se curan con quimioterapia de salvamento1,13.
Efectos del tratamientoLos sobrevivientes de cáncer testicular también corren el riesgo de recaída tardía de la enfermedad (definida la recaída como >2 años después de la remisión). Los efectos tardíos del cáncer testicular y su tratamiento incluyen segundas neoplasias malignas, enfermedades cardiovasculares, neurotoxicidad, nefrotoxicidad, toxicidad pulmonar, hipogonadismo, disminución de la fertilidad, trastornos psicosociales, fenómeno de Raynaud —posiblemente por deterioro cognitivo—, predisposición a la disfunción sexual, fatiga, depresión, eyaculación retrógrada, osteoporosis1,3,17.
Hasta un 60% de los pacientes con cáncer testicular son subfértiles en el momento del diagnóstico, aunque esto puede mejorar después de la orquiectomía. El tratamiento para el cáncer testicular también puede afectar la fertilidad. Aproximadamente el 25% de los pacientes presentan azoospermia después de someterse a la quimioterapia de combinación con un seguimiento de 2.5 años. La quimioterapia tiene un efecto tóxico en las células germinales, que puede causar un aumento de los niveles de la hormona folículo estimulante y hormona luteinizante y una disminución en los niveles de testosterona2,18.
Varios estudios muestran que el 80% de los pacientes pueden recuperar parte de la espermatogénesis 4 años después de la quimioterapia, si no tenían azoospermia (<1,000,000/ml) antes del tratamiento. Un menor número de ciclos de tratamiento se relacionaron positivamente con la recuperación. Se ha observado que el 19% de los pacientes son azoospérmicos 5 años después de recibir 4 ciclos de BEP, mientras que el 47% son azoospérmicos después de recibir 3 o más ciclos de un régimen de dosis intensivas. El 94% recuperan parte de la espermatogénesis 2 años después de recibir radioterapia. Por lo anterior, la criopreservación de esperma se debe considerar para los pacientes que desean tener hijos4,18.
El riesgo global de desarrollar cáncer de testículo contralateral es 12 veces mayor que la población general, significativamente mayor dentro de los 5 años del diagnóstico inicial; el riesgo de desarrollar cáncer de testículo contralateral más de 15 años después es del 1.9%1,2,19.
Los agentes quimioterapéuticos usados para tratar el cáncer testicular que se han asociado con la leucemia secundaria incluyen etopósido y cisplatino. El riesgo es mayor 5 a 10 años después del tratamiento. Kollmannsberger et al35. estimaron que el riesgo acumulado de leucemia entre los supervivientes de cáncer de testículo que recibieron etopósido, un inhibidor de la topoisomerasa II de ADN, es un factor de riesgo significativo para desarrollar leucemia; el riesgo parece estar correlacionado con la dosis total administrada. Con una dosis >2g/m2, la incidencia se eleva aproximadamente un 2,0% a 5 años2,3,17,18,35.
La exposición de la médula ósea a la radiación también puede causar leucemia mielógena aguda o linfocítica. Sin embargo, el riesgo de leucemia en pacientes tratados por cáncer de testículo ha disminuido debido a las dosis más bajas y al campo más estrecho utilizado en el tratamiento de radiación actual2,20.
La mortalidad por segundo primario después del cáncer testicular es similar al primer cáncer, a excepción de aquellos tumores que aparecen en el campo de radioterapia en pacientes con cáncer testicular que fueron diagnosticados durante 1973-1979, época en que las dosis de radioterapia para el tratamiento del cáncer de testículo eran altas y la irradiación del tórax era una opción en la práctica estándar. La mayoría de los tumores malignos inducidos por la radiación se encuentran dentro o cerca de los campos abdominales radiados (pulmón, vejiga, estómago, páncreas, y colon)2,4,19,21,22.
La acumulación de platino en órganos específicos puede, en parte, proporcionar una explicación fisiopatológica. Las mediciones de los tejidos de platino que fueron llevados hasta 17 meses después de la administración de régimen basado en platino encontraron concentraciones elevadas en la mayoría de los órganos, incluyendo el cerebro, los pulmones y el corazón. Entre 5.3-16.8 años después de la quimioterapia, la excreción urinaria de platino y los niveles séricos de platino eran de 100 a 1,000 veces mayores en los pacientes expuestos que en los no expuestos3,5.
En un estudio internacional donde evaluaron a 40,576 pacientes sobrevivientes de cáncer testicular que incluían los diagnosticados antes de la era cisplatino, con seminomas o tumores no seminomatosos a la edad de 35 años, el riesgo acumulado de cáncer sólido, 40 años más tarde (es decir, a los 75 años), fue del 36 y 31%, respectivamente, en comparación con el 23% de la población general. Para los pacientes de seminoma, el riesgo relativo de tumores sólidos (estómago, colon, páncreas, pulmón, y vejiga) fue mayor en las personas diagnosticadas después de 1975 (RR=2.3, IC 95%=2,0-2,7) que en los diagnosticados antes de 1975 (RR=1,9; IC 95%=1,6-2,1)23.
La radioterapia y quimioterapia aumenta el riesgo de desarrollar segundas neoplasias y enfermedades cardiovasculares en una medida similar a la de fumar. La radioterapia subdiafragmática aumenta considerablemente el riesgo de segundas neoplasias, pero no de las enfermedades cardiovasculares, mientras que la quimioterapia aumenta los riesgos de ambas, según lo publicado en un estudio de cohorte por Van den Belt-Dusebout et al. y en un estudio británico donde los pacientes tratados se encuentran con un aumento del riesgo de un evento cardiaco después del tratamiento, como la angina de pecho o el infarto al miocardio17,24.
Múltiples estudios de segundas neoplasias presentadas después del tratamiento de cáncer testicular se han realizado, como el llevado a cabo por Van Walraven et al., donde se presentaron segundas neoplasias malignas abdominales, siendo las más comunes tumores colorrectales y renales. Sin embargo, Robinson et al. estudiaron a 5,555 pacientes con cáncer testicular tipo seminoma y 3,733 pacientes con no seminomatosos, encontrando para los seminomas un riesgo significativo de cáncer de colon, tejidos blandos y vejiga 20 años después del diagnóstico y de cáncer de páncreas con una media de presentación entre los 10-19 años21,25-28.
Fung et al. evaluaron a 12,691 pacientes con cáncer testicular no seminomatoso, quienes se encontraban en vigilancia con más de 20 años de seguimiento y tratados con quimioterapia o cirugía, y encontraron 210 casos de segundos canceres sólidos, observando un aumento del riesgo del 40% de segundos cánceres después de la quimioterapia, con una media de latencia de 12.5 años, con un aumento de riesgo de 3 a 7 veces para cáncer de riñón, tiroides y tejidos blandos, así como en otros estudios donde se ha observado un riesgo persistentemente elevado de presentar segundas neoplasias malignas 15 años después del diagnóstico inicial8,29-31.
En un estudio realizado por Bokemeyer et al. se encontró que la incidencia acumulada de una neoplasia secundaria en los pacientes tratados con radioterapia y/o quimioterapia es significativamente mayor en comparación con los pacientes en protocolo de vigilancia (p=0.03); los pacientes con tumores testiculares de células germinales tienen un doble riesgo (rango 0.7-3.4) para el desarrollo de neoplasia secundaria. La radioterapia está asociada con un riesgo de 2 a 3 veces mayor de tumores sólidos secundarios que surgen en los campos de irradiación como el estómago, el páncreas, la vejiga, cáncer de células renales, y sarcomas (rango 1.3-7.5)11,32.
Un estudio, que evaluó las secuelas tardías de la quimioterapia a largo plazo en pacientes con cáncer de testículo, incluyó a 90 pacientes con una mediana de seguimiento de 58 meses después de la quimioterapia, en el cual la toxicidad sintomática frecuente fue el fenómeno Raynaud en el 30% de los pacientes (la bleomicina se cree que es el fármaco más importante en la patogénesis), ototoxicidad en el 21% y neuropatía periférica en el 17%. Las toxicidades fueron significativamente más frecuentes en los pacientes que habían recibido cisplatino a una dosis acumulativa mayor de 400mg/m2 (89% toxicidad gonadal, 66% ototoxicidad, 27% neurotoxicidad, 24% hipertensión arterial). La neuropatía periférica es la forma más común de la neurotoxicidad observada con quimioterapia basada en cisplatino, por lo que el cisplatino no debe ser mayor de 400mg/m2 para los pacientes que reciben quimioterapia primaria18,20,33.
Otro estudio observó que el 30% de los pacientes mostraron una función anormal del ventrículo izquierdo, con niveles elevados de la hormona folículo estimulante (FSH) y luteinizante (LH) en el 75% de los pacientes, asociándose a menudo con niveles bajos de testosterona. Se encontraron niveles de colesterol total en el 82% y niveles más altos de triglicéridos en el 44% de los pacientes; la mayoría de ellos tenían sobrepeso. Alrededor del 25% de los pacientes desarrollaron hipertensión arterial diastólica después de la quimioterapia. El aumento de los factores de riesgo persiste hasta 17 años después de la quimioterapia34.
ConclusiónLos pacientes sobrevivientes de cáncer de células germinales, curados con el tratamiento —ya sea con quimioterapia y/o radioterapia—, se enfrentan a los efectos a largo plazo del tratamiento, incluyendo la toxicidad relacionada con la quimioterapia y la presentación de un segundo primario, inclusive con un riesgo hasta 30 años después del diagnóstico del tumor primario, siendo una preocupación en el seguimiento la detección de la segunda neoplasia, ya que no siempre es posible detectarla en su etapa temprana y más cuando se presenta después de una década del seguimiento, como fue el caso del paciente que se expuso en el presente estudio.
En la revisión de la literatura el cáncer gástrico como segunda neoplasia es frecuente en pacientes que recibieron previamente radioterapia, sin embargo, como resultado de recibir tratamiento con quimioterapia, no hay estudios publicados.
FinanciaciónLos autores no recibieron patrocinio para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.