Introducción: la neoplasia intraepitelial cervical (NIC) es la lesión preinvasora más común del cuello uterino. Los cambios escamosos atípicos ocurren en la zona de transformación del cérvix con cambios leves, moderados o severos de acuerdo a la profundidad (NIC1, NIC2, NIC3). Los virus del papiloma humano (VPH) son un grupo de más de 100 virus DNA que infectan las células epiteliales humanas. Aproximadamente 15 de estos virus pueden causar lesiones intraepiteliales y cáncer cervicouterino. Hasta el 79% de las mujeres sexualmente activas adquieren la infección genital por VPH en algún momento de su vida, pero esta infección es usualmente transitoria y asintomática.
Objetivo: Analizar las características sociodemográficas, los factores de riesgo y los síntomas de presentación en pacientes con enfermedad preinvasora del cérvix.
Material y métodos: Estudio retrospectivo, observacional y descriptivo efectuado con los expedientes clínicos de las pacientes tratadas por NIC, entre los meses de marzo de 2002 a marzo de 2012.
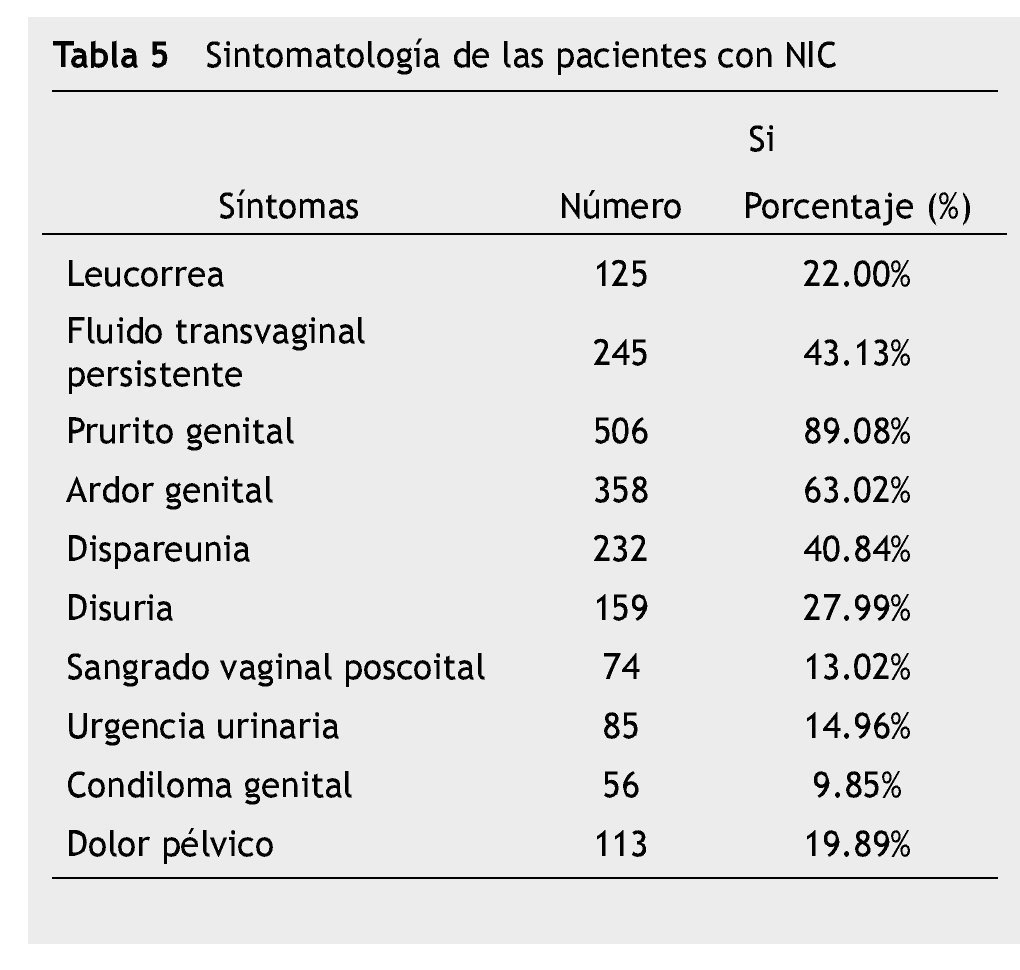
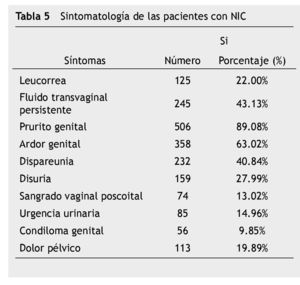
Resultados: Se incluyeron 568 pacientes, la edad más frecuente de NIC fue de 24-45 años, el inicio de vida sexual en promedio fue 16 años, y tuvieron múltiples parejas sexuales. Otros factores de riesgo encontrados fueron: multiparidad, enfermedades de transmisión sexual asociadas, tabaquismo, uso de anticonceptivos orales. Los síntomas de presentación fueron inespecíficos en el 85.22%, los más frecuentes prurito, ardor y fluido vaginal. Únicamente en el 9.85% se encontraron signos clásicos de infección por VPH, como verrugas o condilomas genitales del tracto genital inferior.
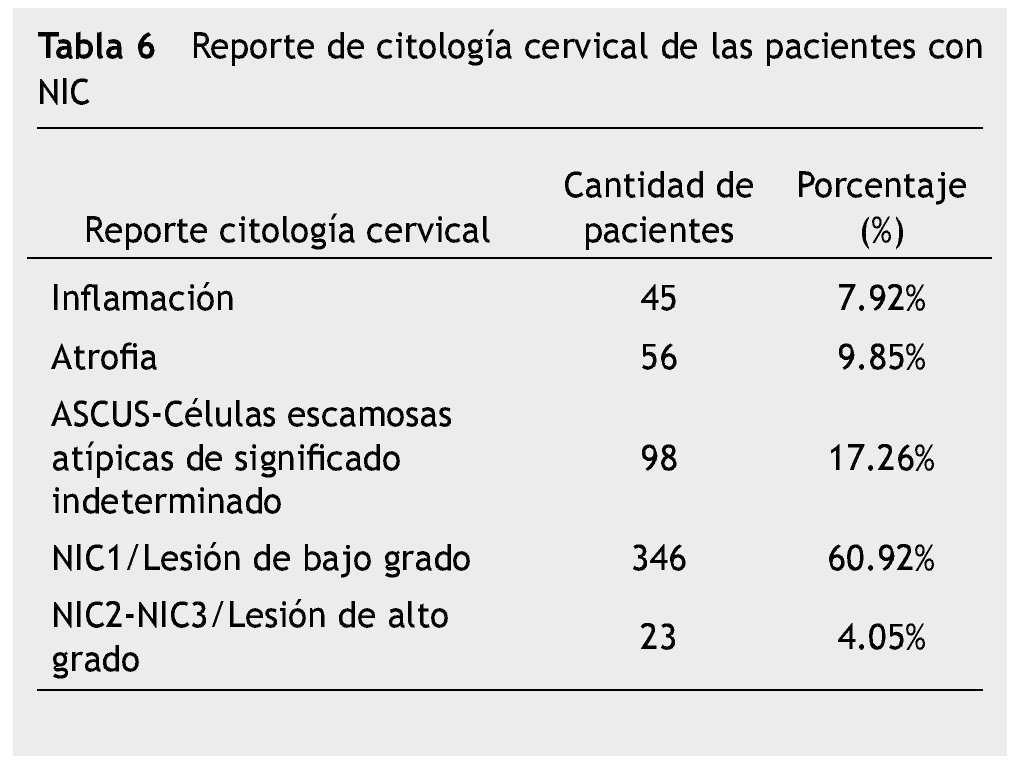
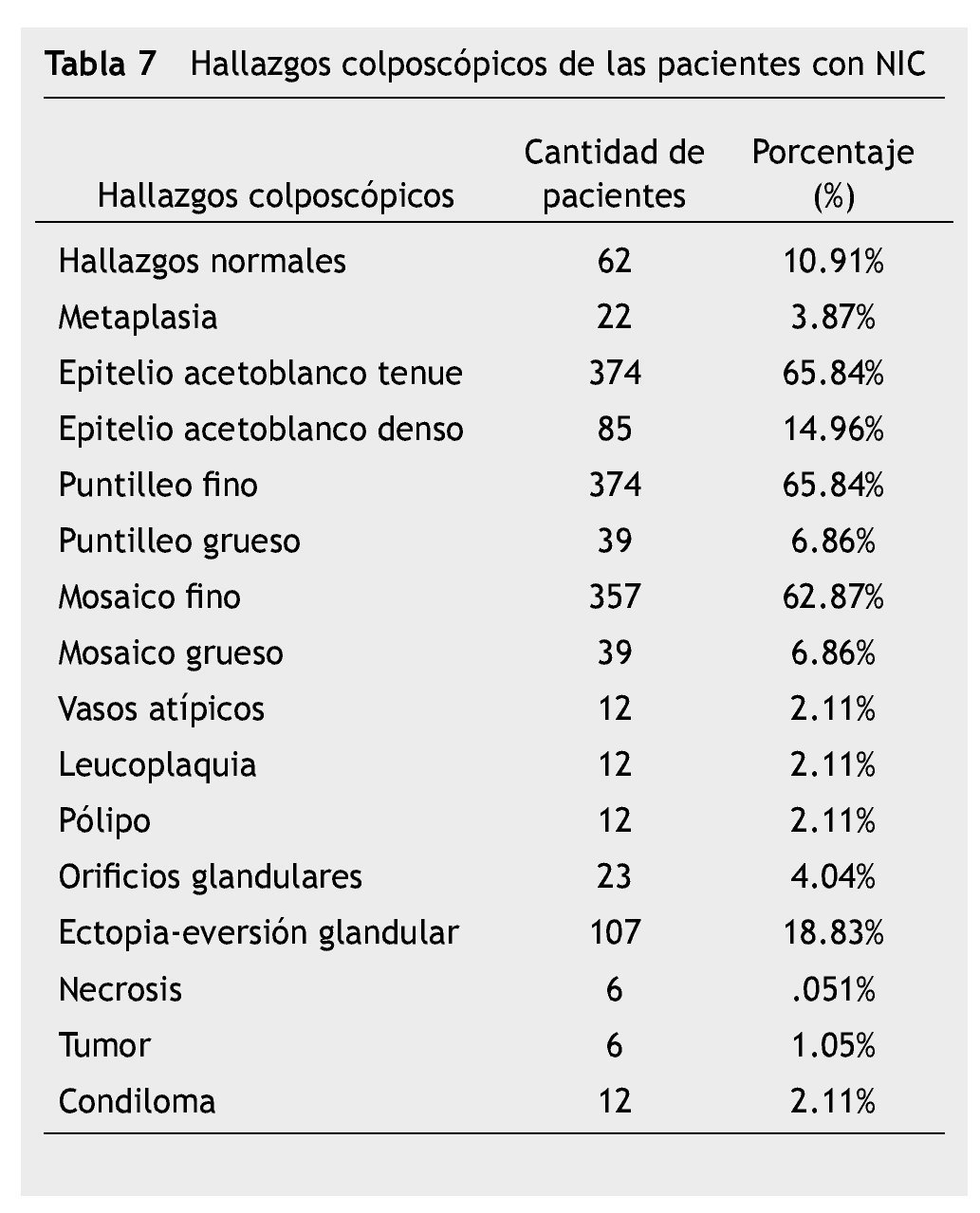
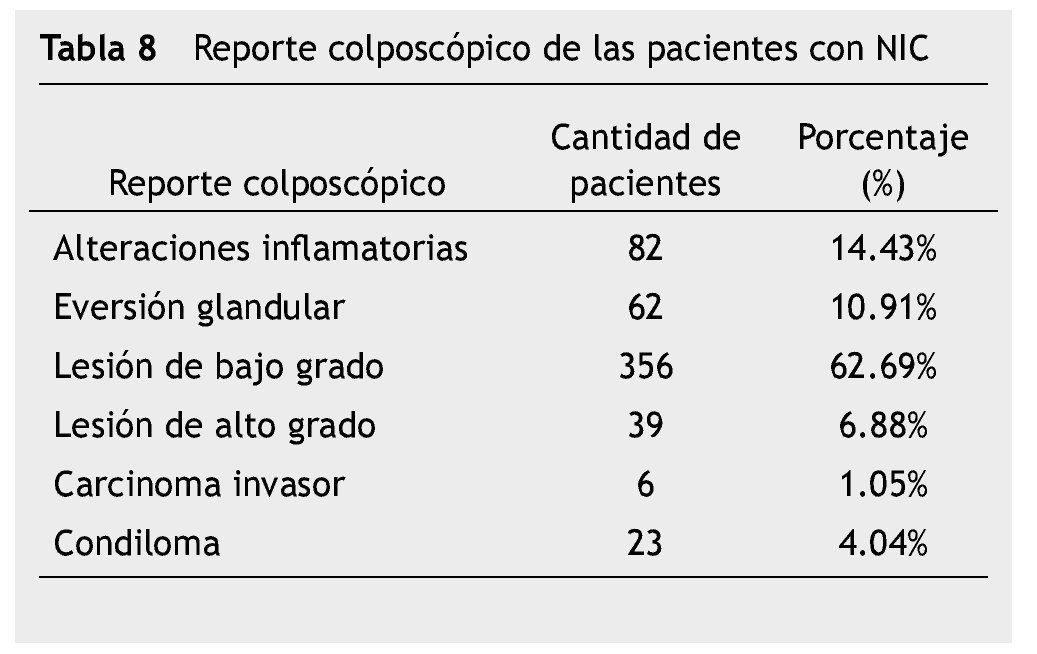
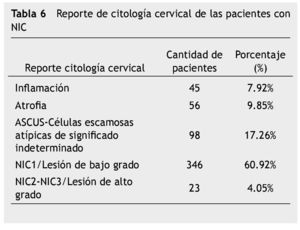
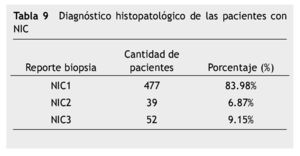
La citología cervicovaginal tuvo una sensibilidad de 64.47%, el diagnóstico de ASCUS fue detectado en el 17.26% de los casos. En la colposcopia se encontraron signos como lesión acetoblanca, puntilleo fino, mosaico fino y lesión yodo negativa en el 75% de las pacientes. La prueba de VPH (por PCR) se realizó en el 17.26% de los casos con ASCUS. El estudio histopatológico fue 83% NIC1, 6.87% NIC2 y 9.15% NIC3.
Conclusiones: la enfermedad preinvasiva del cérvix tiene los factores de riesgo similares al cáncer cervicouterino. El VPH es un factor necesario pero no el único para la progresión a cáncer invasor. La NIC inicialmente es asintomática, remite espontáneamente y puede ser detectada por citología y colposcopia, pero existen falsos positivos y falsos negativos. El estudio histopatológico de la biopsia cervical es necesario para diagnosticar lesión de alto grado, que son los verdaderos precursores del cáncer invasor.
Introduction: Cervical intraepithelial neoplasia (CIN) is the most common pre-malignant lesion. Atypical squamous changes occur in the transformation zone of the cervix with mild, moderate or severe changes described by their depth (CIN 1, 2, 3). Human papillomaviruses (HPVs) are a group of more than 100 DNA viruses that infect human epithelial cells. About 15 of these viruses can cause intraepithelial lesions and cervical cancer. Persistent high-risk HPV types can cause cancer of the lower genital tract if not treated. Up to 79% of sexually active women acquire a genital HPV infection during their lifetime, but the infection is usually transient and asymptomatic.
Objective: Analyze the sociodemographic characteristics, risk factors and presenting symptoms in patients with pre-invasive cervical disease.
Material and methods: A retrospective, observational and descriptive study of electronic files from patients with CIN from March 2002 to March 2012.
Results: Five hundred sixty eight patients were included, the most common age of CIN was 24-45 years, the age of first intercourse was 16 years, mostly had multiple sexual partners. Other risk factors found were: high parity, sexually transmitted diseases, tobacco smoking, and use of oral contraceptives. In 85.22% of cases presented with nonspecific symptoms such as itching, genital burning, and vaginal discharge. Only 9.85% of cases presented with classic signs of infection with HPV like genital warts in the lower genital tract.
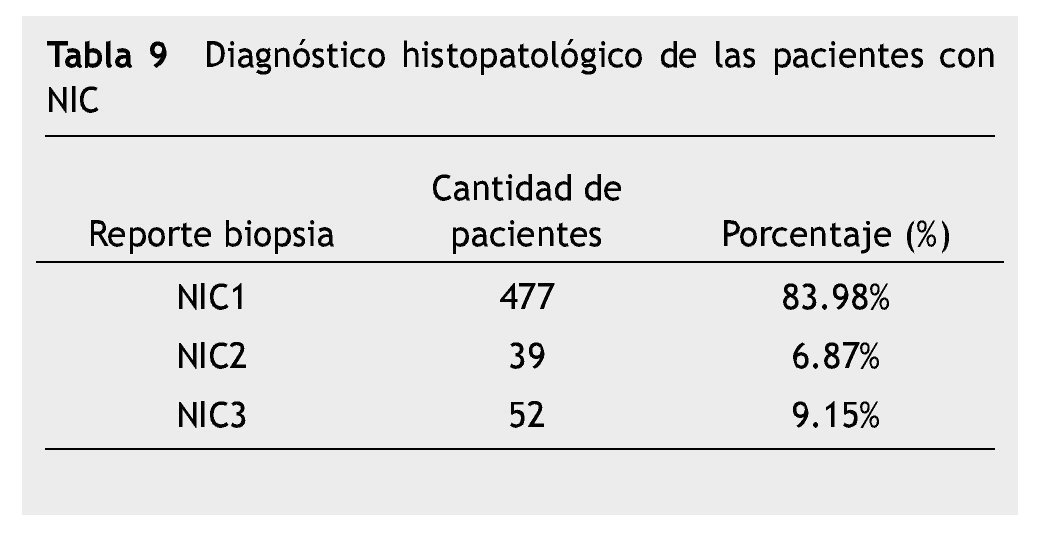
The cervicovaginal cytology had a sensitivity of 64.47%, the diagnosis of ASCUS was detected in 17.26%. The colposcopic study showed acetowhitening lesion, vessels of fine caliber, fine mosaic and iodine negative in 75% of cases that corresponded to low grade lesion. HPV testing (through polymerase chain reaction testing) was performed in 17.26% of cases with ASCUS. The histo-pathological study was 83.98% CIN1, 6.87% CIN2 and 9.15% CIN3.
Conclusions: The cervical pre-invasive lesion has similar risk factors for cervical cancer. The HPV is a necessary, but not the unique factor for the progression to invasive cancer.
CIN is initially asymptomatic, spontaneously refers, in latent phase can only be detected by HPV tests. When there are symptoms, they are nonspecific and can be detected by colposcopy and Pap smear, but there are false positives and false negatives. The histopathological study of cervical biopsy is needed to determine the high grade lesions, which are the true precursors of invasive cancer.
Introducción
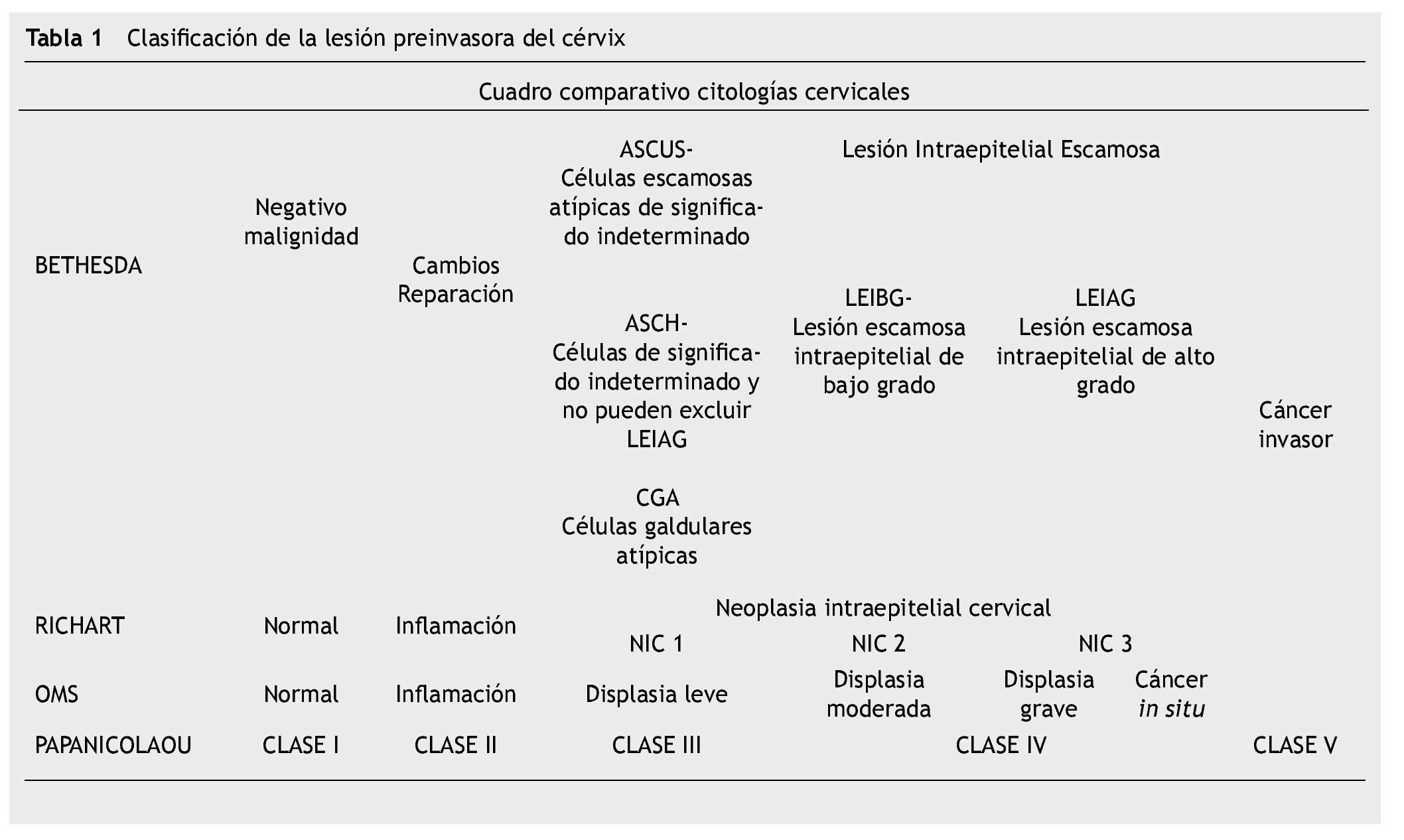
Las enfermedades preinvasivas del cérvix, son todas aquellas lesiones que preceden al cáncer invasor, también denominadas enfermedades o lesiones precursoras o premalignas. Se caracterizan microscópicamente por una serie de manifestaciones que van de la atipia celular a diversos grados de displasia o neoplasia intraepitelial cervical (NIC), antes de progresar a carcinoma invasor1-3. Se clasifica de acuerdo a la afección del epitelio y su espesor, existen diferentes nomenclaturas para designar el daño al epitelio4 (tabla 1).
En México, el cáncer cervicouterino fue la primera causa de muerte hasta el año 2005, a partir de 2006 es la segunda causa de muerte por cáncer en mujeres mexicanas5,6.
Se ha identificado al virus del papiloma humano (VPH), como la causa principal y necesaria del cáncer cerviouterino7. La infección por VPH se considera una infección frecuente entre las mujeres jóvenes, esta infección es transitoria, remite espontáneamente y en muy pocos casos progresa a casos más graves8. Se ha descrito una clasificación de lesiones de alto y bajo grado, para designar las lesiones que tienen mayor riesgo de persistencia y progresión a cáncer invasor9,10.
La infección por VPH, puede permanecer en periodo de latencia o subclínico, tiempo durante el cual puede adquirir un estado de persistencia o regresión de las lesiones (NIC o displasia), en el peor de los casos puede progresar a cáncer invasor11,12.
La mayoría de las pacientes con NIC presentan lesiones asintomáticas, dentro de los estudios diagnósticos para las lesiones preinvasivas del cuello uterino se encuentran la citología cervicovaginal, la colposcopia y la prueba de ADN del VPH. El estudio histopatológico mediante biopsia es la prueba definitiva para la confirmación diagnóstica13-16.
Las modalidades de tratamiento para la enfermedad cervical dependerán de la edad de la paciente, tipo de lesión, gestación, inmunidad, estado posmenopáusico. En todos los casos, el tratamiento se deberá individualizar, teniendo como opción los procedimientos ablativos y los procedimientos por escisión17-19.
En el presente estudio se analizan las características clínico-patológicas de la lesión preinvasiva del cuello uterino. Se identifican las características sociodemográficas, los factores de riesgo y las características clínicas de presentación en las pacientes con enfermedad preinvasiva del cuello uterino en un centro oncológico privado del Área Metropolitana de la Ciudad de México.
Material y métodos
Se realizó un estudio observacional, transversal, descriptivo y retrospectivo.
Se revisaron y analizaron los expedientes clínicos electrónicos de todas las pacientes con diagnóstico histopatológico de NIC o lesión escamosa intraepitelial de bajo y alto grado (LEIBG) (LEIAG), respectivamente, atendidas en la Clínica de Colposcopia del Centro Oncológico Betania®, en el lapso comprendido del 1° de marzo de 2002 al 1° de marzo de 2012. Todos los estudios anatomopatológicos fueron realizados en el laboratorio de Patología del Hospital Ángeles Metropolitano, se revisó el archivo electrónico de las pacientes estudiadas.
Se incluyeron a mujeres mayores de 20 años, con diagnóstico citológico, colposcópico e histopatológico de NIC o LEIBG, LEIAG.
Se excluyeron los casos con expediente clínico incompleto, o sin reporte citológico o histopatológico. Asimismo, se excluyeron a todas las pacientes con diagnóstico de carcinoma invasor.
Los criterios de eliminación del estudio fueron: examen colposcópico realizado fuera del Centro Oncológico Betania®. Asimismo, se eliminaron los expedientes de pacientes con reporte citológico e histopatológico realizados fuera del Departamento de Anatomía Patológica del Hospital Ángeles Metropolitano.
El reporte de citología cervical se hizo de acuerdo a la clasificación de Bethesda 2001. Se hizo correlación con la Norma Oficial Mexicana NOM-014-SSA2-1994 vigente (última actualización mayo 2007).Todos los estudios fueron revisados por un citopatólogo.
Se utilizaron 5 categorías: 1) Inflamación, 2) atrofia, 3) ASCUS-células escamosas atípicas de significado indeterminado, 4) lesión intraepitelial de bajo grado (VPH, displasia leve, NIC1) y, 5) lesión intraepitelial de alto grado (displasia moderada, displasia severa, carcinoma in situ, NIC2, NIC3). Los hallazgos colposcópicos se describieron de acuerdo a la nomenclatura de la International Federation for Cervical Pathology and Colposcopy (IFCP) de Barcelona 2002: hallazgos normales, metaplasia, epitelio acetoblanco tenue, epitelio acetoblanco denso, puntilleo fino, puntilleo grueso, mosaico fino, mosaico grueso, vasos atípicos, leucoplaquia, pólipo, orificios glandulares, ectopia, necrosis, tumor.
El test de Lugol de Schiller se describió en 2 categorías: 1) Yodonegativo y, 2) yodopositivo.
Para el reporte colposcópico se utilizó la clasificación de la IFCP de Barcelona 2002. Se hizo correlación con la Norma Oficial Mexicana NOM-014-SSA2-1994 vigente (última actualización mayo 2007).
• Alteraciones inflamatorias inespecíficas: estudio negativo a cáncer, pero con proceso inflamatorio.
• Lesión intraepitelial bajo grado: estudio anormal, con datos colposcópicos de lesión preinvasiva de bajo grado.
• Lesión intraepitelial de alto grado: estudio anormal, con cambios mayores sugestivos de lesión preinvasiva o premalignidad.
• Lesiones sugestivas de invasión.
• Otros hallazgos: erosión, atrofia, condilomas.
El reporte de biopsia cervical utilizó la clasificación de Bethesda haciendo correlación con la clasificación de Richart y de la Organización Mundial de la Salud (OMS). Todos los estudios fueron analizados por un solo patólogo, Departamento de Anatomía Patológica del Hospital Ángeles Metropolitano. Los reportes se adaptaron a la nomenclatura recomendada por la Norma Oficial Mexicana NOM-014-SSA2-1994 vigente (última actualización mayo 2007).
• Cervicitis aguda o crónica: inflamación del epitelio del cuello uterino.
• LEIBG: NIC confinada al tercio inferior del epitelio cervical. (NIC1) Se incluye a la infección por VPH, displasia leve.
• LEIAG: NIC2 o displasia moderada, NIC3 o displasia grave, cáncer in situ.
Se diseñó una hoja de recolección de datos: se obtuvieron las características sociodemográficas, factores de riesgo, características clínicas de presentación, hallazgos colposcópicos, reporte de citología y patología.
Se evaluaron las variables independientes: edad, escolaridad, estado civil, ocupación, lugar de origen, lugar de residencia.
Las variables dependientes que fueron estadísticamente analizadas fueron: tabaquismo, antecedentes personales patológicos, enfermedades de transmisión sexual, uso de anticonceptivos orales, sintomatología, reporte de citología cervical, hallazgos colposcópicos, prueba de Schiller, reporte de colposcopia y reporte de biopsia.
Se realizó correlación colpohistopatológica, comparando los diagnósticos colposcópicos e histopatológicos. De igual manera, se realizó correlación citológica-histopatológica.
Los resultados se presentaron en tablas y cuadros, el análisis de datos se efectuó mediante procedimientos de estadística descriptiva, utilizando el programa estadístico SPSS® Statistics versión 20.0.0 para Windows®.
Resultados
Se estudiaron 568 pacientes mayores de 20 años, con diagnóstico histopatológico de NIC o lesión escamosa intraepitelial cervical (LEIC).
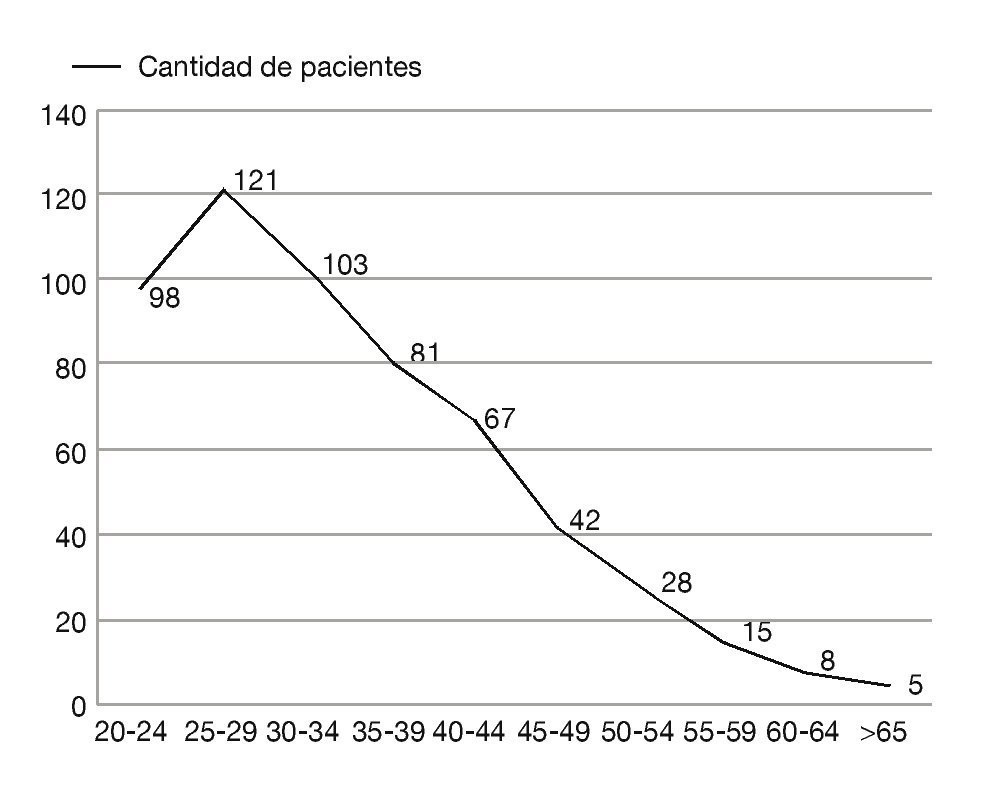
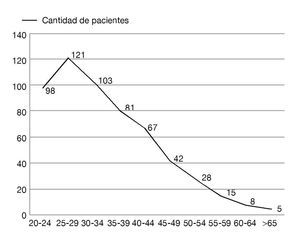
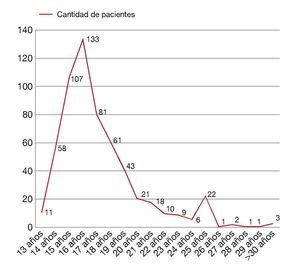
El rango de edad fue de 20-67 años, con una media de 27 años, el mayor porcentaje de casos de NIC se presentó en mujeres en edad reproductiva de 25 a 45 años (fig. 1).
Figura 1 Edad de las pacientes con NIC.
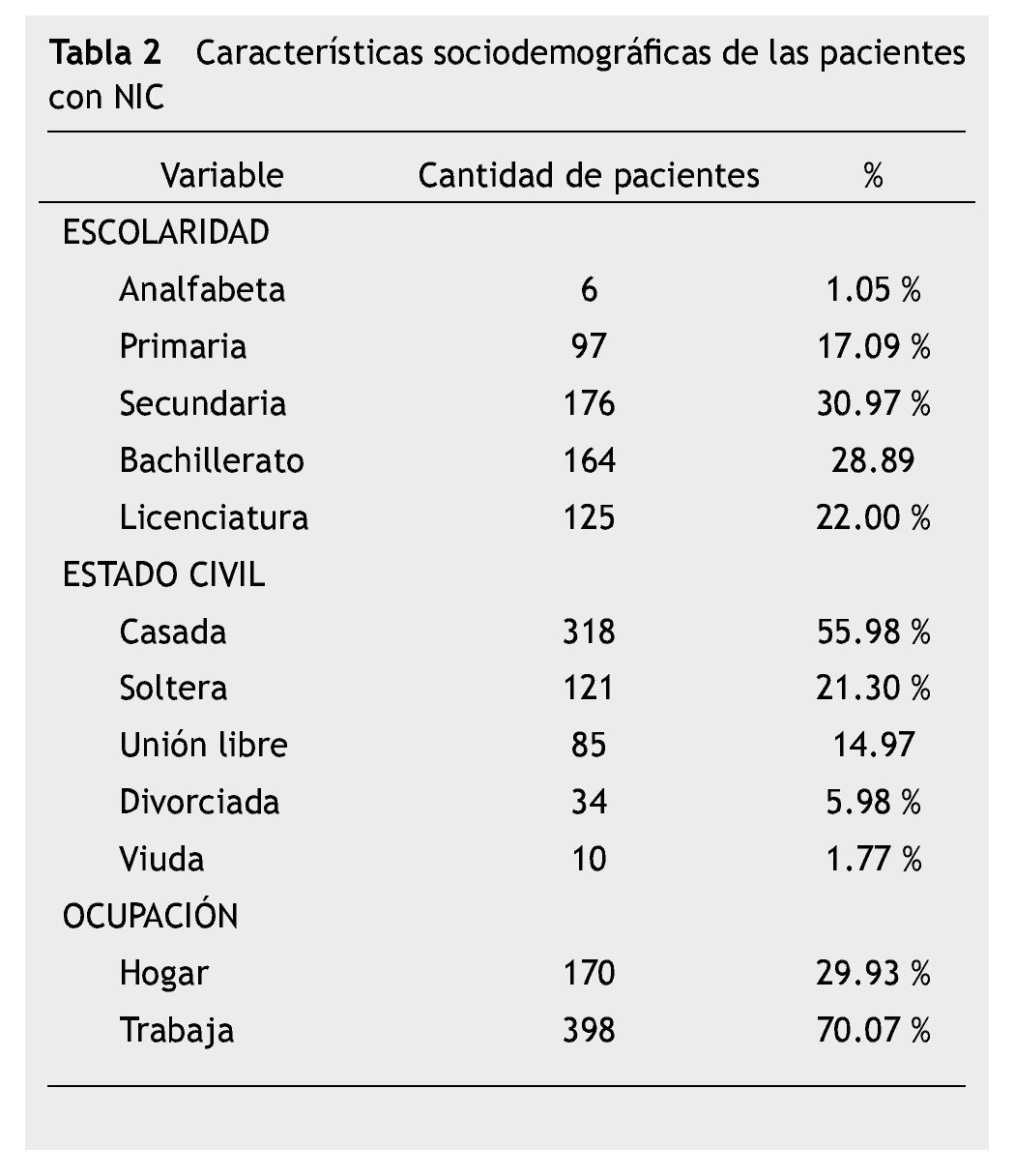
La mayoría de las pacientes tuvieron una escolaridad de secundaria, con un promedio de 7 años cursados.
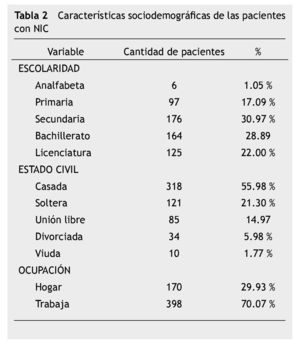
El 55.98% estaban casadas; sólo el 29.23% se dedicaban exclusivamente a laborares del hogar, en su mayoría eran económicamente activas (tabla 2).
Las mujeres atendidas eran residentes principalmente en la zona oriente del Valle de México: Delegación iztapalapa, Distrito Federal y los municipios de la Paz, Chimalhuacán, Chicoloapan, Ixtapaluca y Ciudad Netzahualcóyotl, pertenecientes al Estado de México.
En relación a los antecedentes, el 33.98% se reportaron con tabaquismo positivo; el 14.4% tuvieron alguna enfermedad asociada, siendo la diabetes mellitus tipo 2, la patología crónica más frecuente.
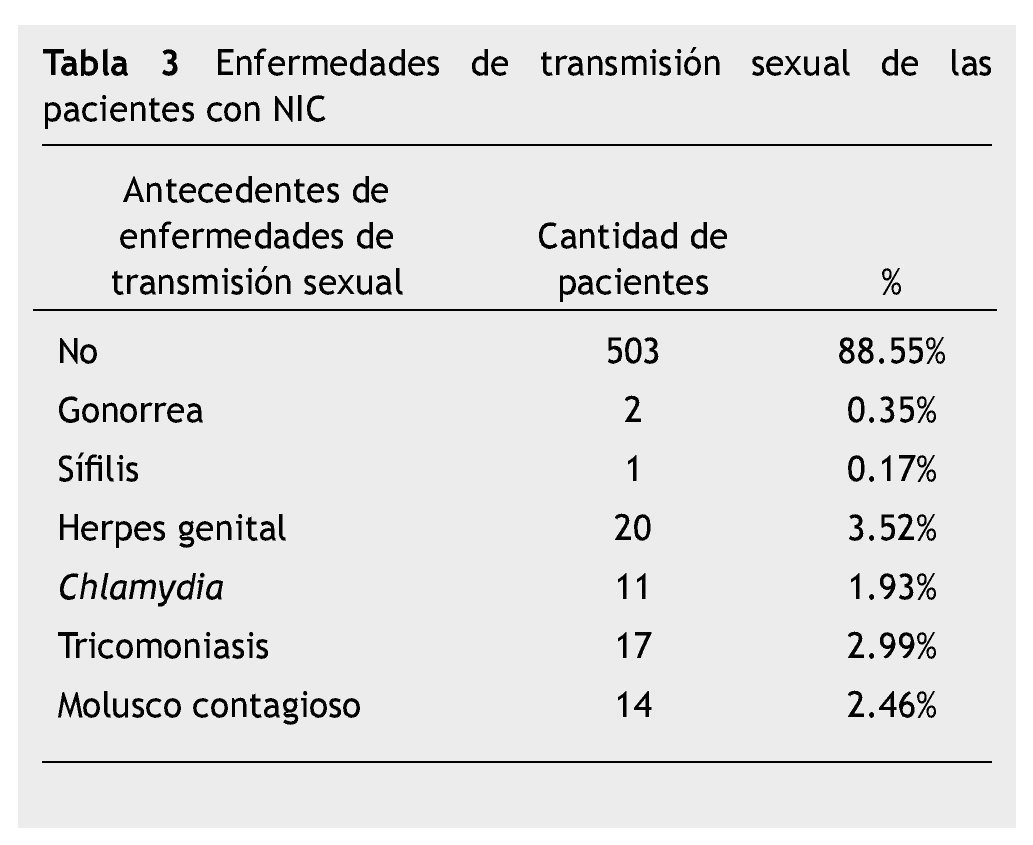
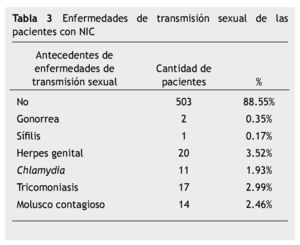
Solo el 11.45% tuvieron alguna otra enfermedad de transmisión sexual, siendo el herpes genital la patología más frecuente seguida de tricomoniasis, molusco contagioso y Chlamydia (tabla 3).
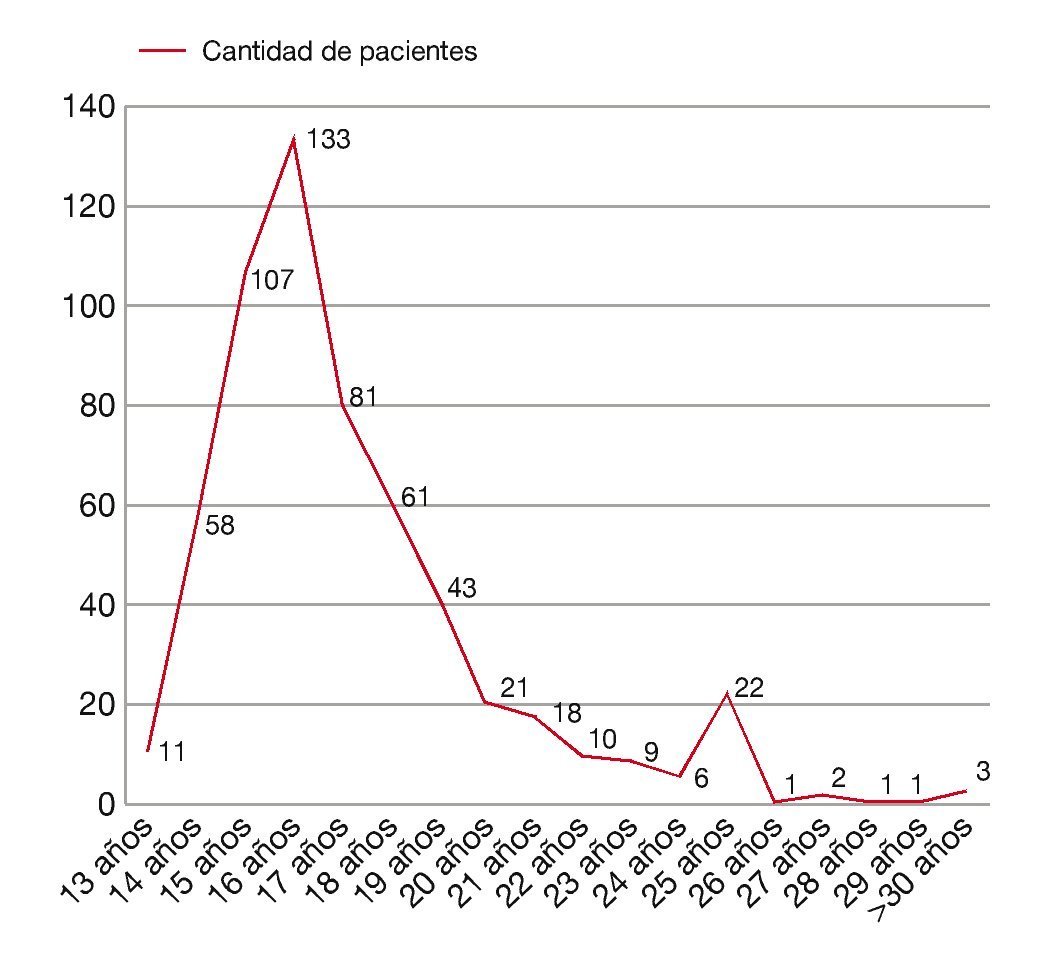
El inicio de vida sexual tuvo un rango de 13-35 años, con promedio de 16 años (fig. 2).
Figura 2 inicio de vida sexual de las pacientes con NIC.
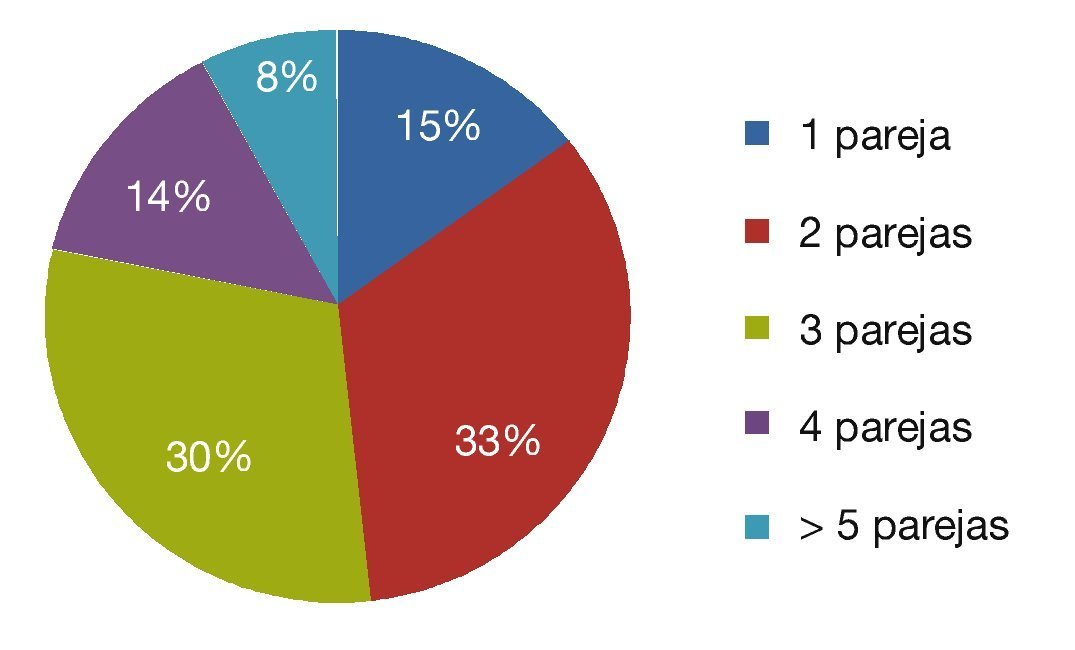
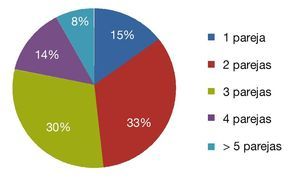
En el 14.99% de los casos tuvieron sólo un compañero sexual y en el 85.01% más de un compañero sexual (fig. 3).
Figura 3 Número de parejas sexuales en las pacientes con NIC.
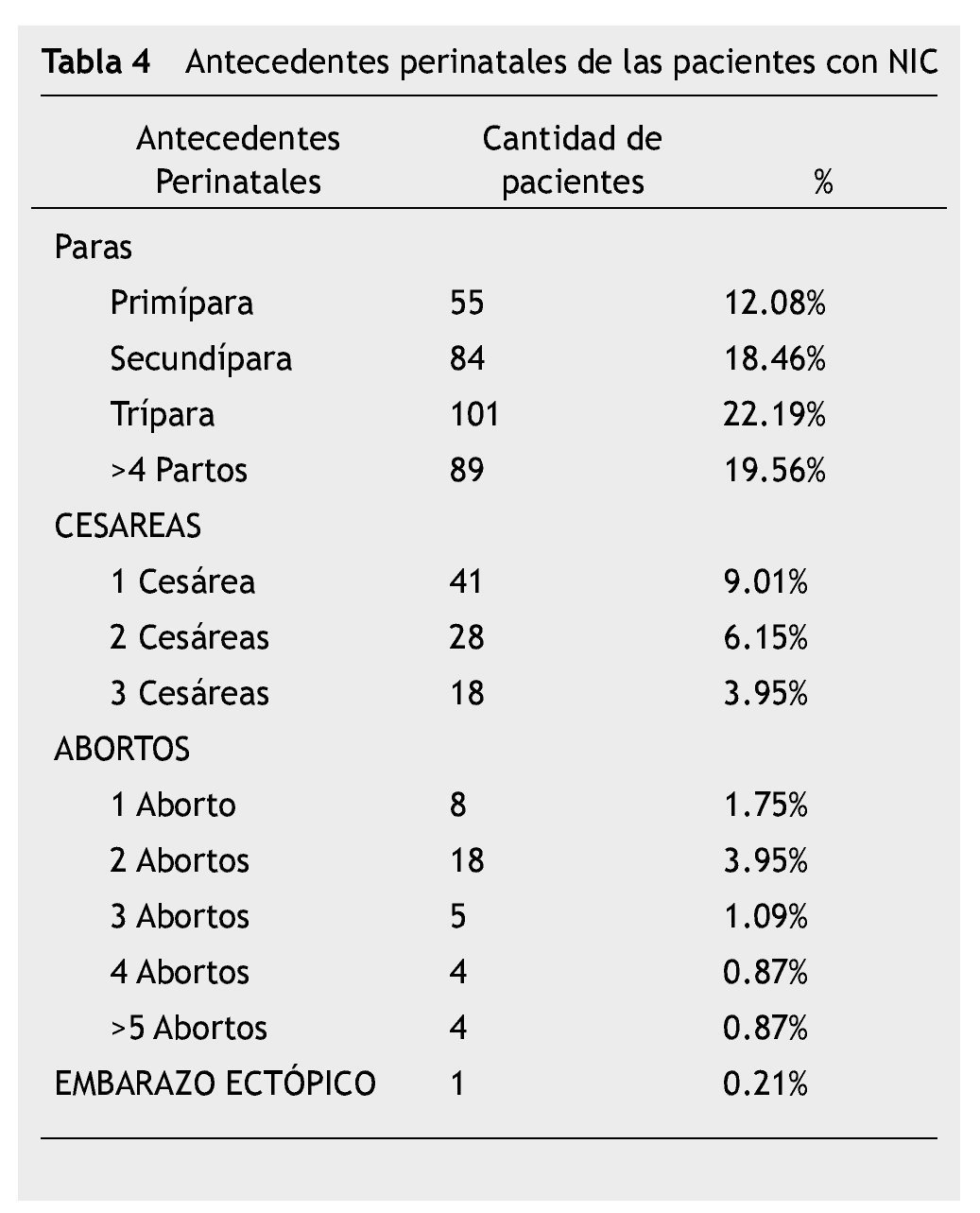
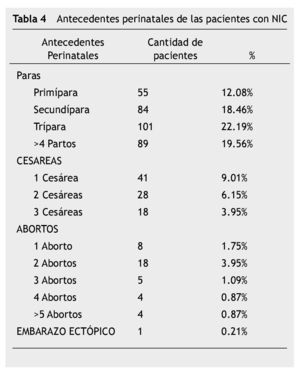
El 19.89% de los casos fueron nuligestas, el mayor porcentaje de casos con NIC se encontró en las mujeres con 2 y 3 gestas, en la modalidad de secundípara y trípara (tabla 4).
Los anticonceptivos orales fueron utilizados en el 30.99% de los casos.
Los síntomas más frecuentes de presentación fueron el prurito y ardor genital, seguido de fluido transvaginal persistente (tabla 5).
En relación al reporte de citología cervical, el 60.92% correspondió a LEIBG-NIC1, asociada a infección por VPH. Sin embargo, en el 17.25% fue ASCUS-células escamosas atípicas de significado indeterminado, lo cual ameritó evaluación colposcópica, toma de biopsia o estudio de VPH (tabla 6) (fig. 4).
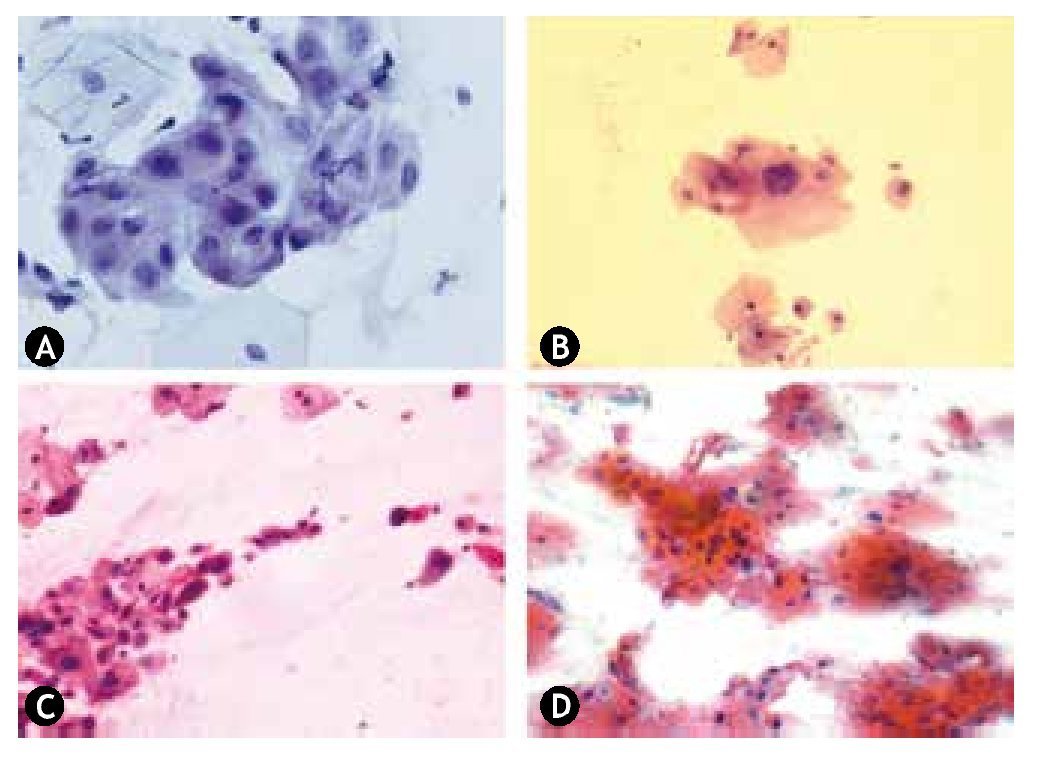
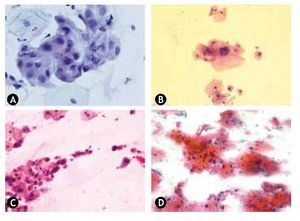
Figura 4 Citología en pacientes con NIC. A) Células escamosas atípicas de significado indeterminado (ASCUS), Papanicolaou. b) lesión escamosa intraepitelial de bajo grado (LEIBG)-NIC1, Papanicolaou. C) lesión escamosa intraepitelial de alto grado (LEIAG)-NIC2, Papanicolaou. D) lesión escamosa intraepitelial de alto grado (LEIAG) NIC3, Papanicolaou. Difícil en citología diferenciar NIC3 de carcinoma in situ.
La prueba del VPH se realizó sólo en 98 casos (17.26%) que fueron los casos con diagnóstico citológico de ASCUS. El procedimiento de detección del VPH por ADN fue por la técnica de PCR. En ninguno de los casos se utilizó la prueba de captura de híbridos.
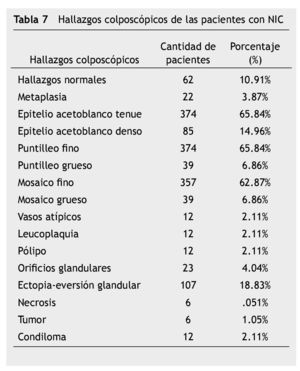
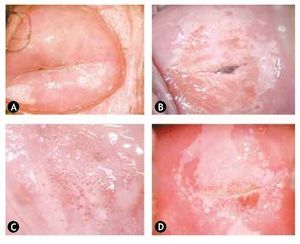
Los hallazgos colposcópicos más frecuentes fueron los relacionados a cambios menores o lesiones de bajo grado: epitelio acetoblanco tenue, puntilleo fino, mosaico fino (tabla 7) (figs. 5 y 6). En el 25% de los casos se encontraron asociados a hallazgos colposcópicos normales.
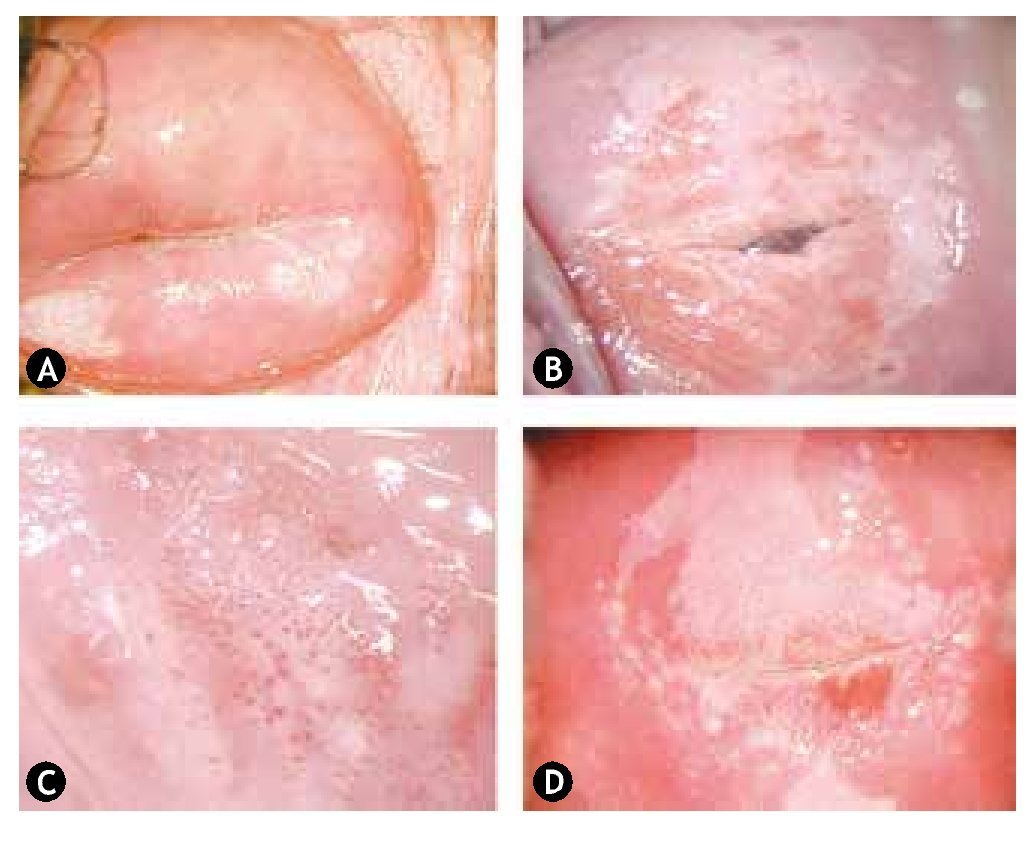
Figura 5 Hallazgos colposcópicos en lesión de bajo grado. A) Condiloma exofítico en cérvix y fondo de saco. B) Epitelio acetoblanco tenue. C) Puntilleo fino. D) Mosaico fino.
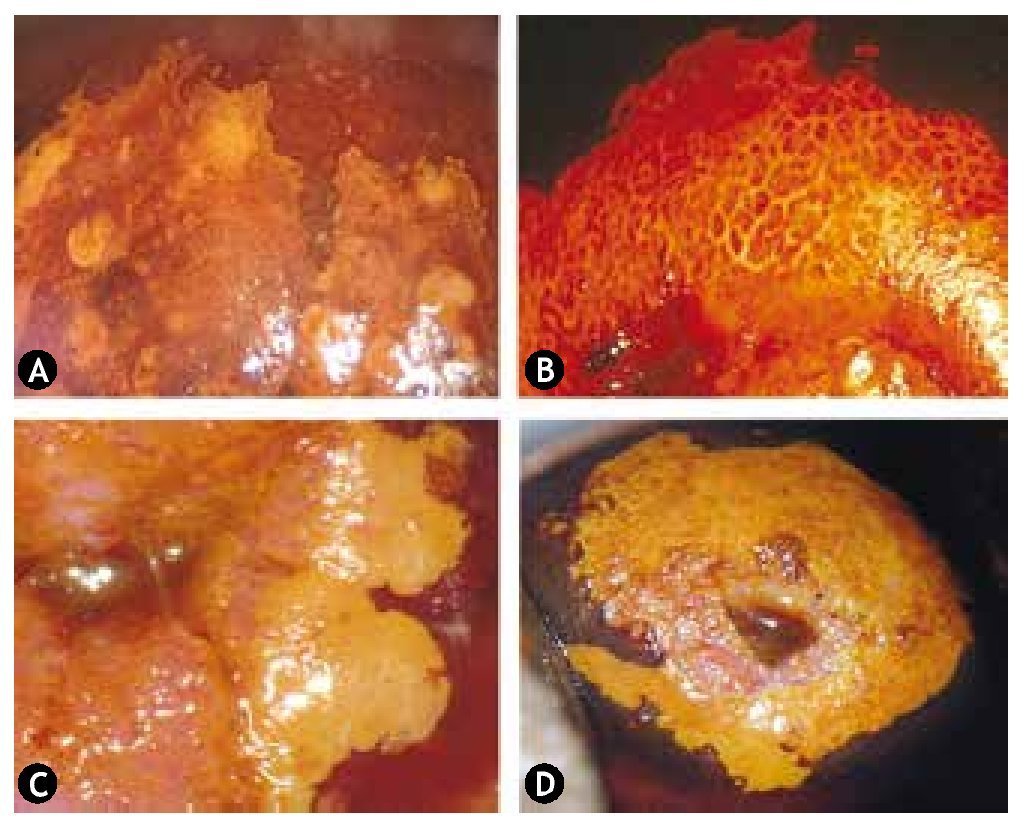
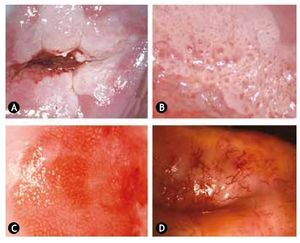
Figura 6 Hallazgos colposcópicos en lesión de alto grado. A) Epitelio acetoblanco denso. B) Puntilleo grueso. C) Mosaico grueso. D) Vasos atípicos.
La prueba de Schiller fue yodonegativa en el 76.06% de los casos con NIC (fig. 7).
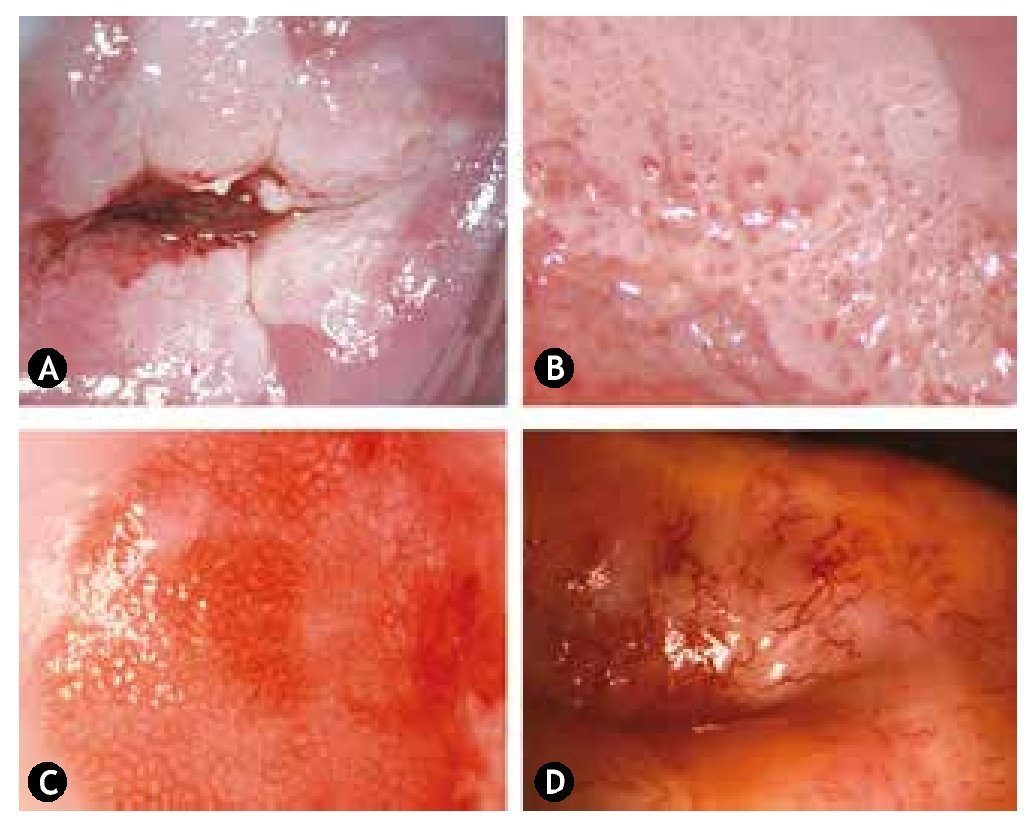
Figura 7 Test de Lugol (Schiller). A) y B) Yodonegativo parcial. C) y D) Yodonegativo total.
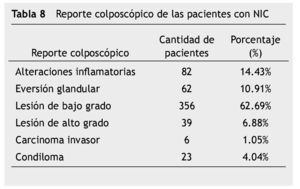
El reporte colposcópico más frecuente fue LEIBG en el 62.69% de los casos, seguido de alteraciones inflamatorias inespecíficas 14.45% y erosión cervical en 10.91% (tabla 8).
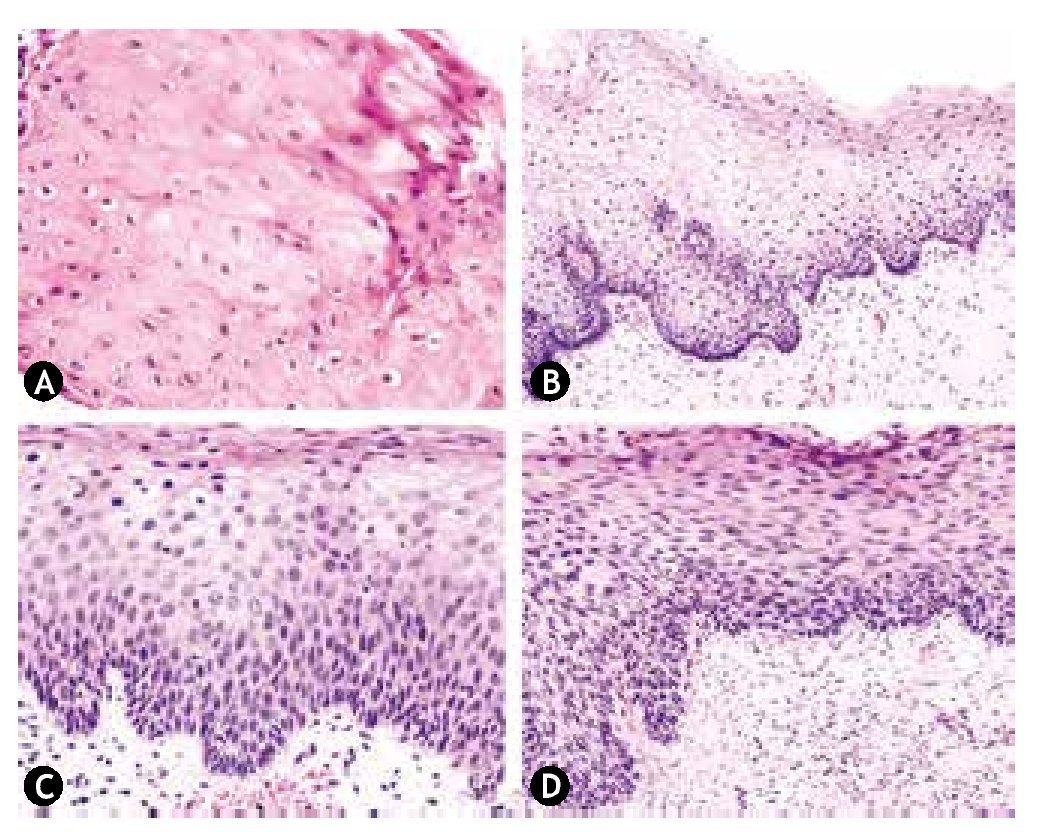
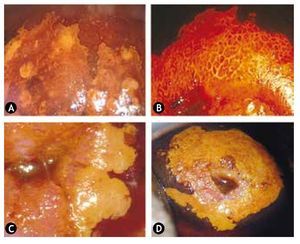
El diagnóstico histopatológico fue de LEIBG-NIC1 en el 83.98% casos y, de LEIAG en el 16.02% que correspondió a NIC2; NIC3, carcinoma in situ (tabla 9) (fig. 8).
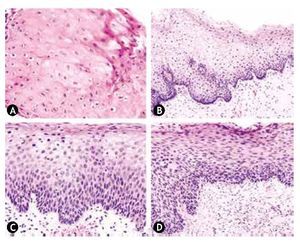
Figura 8 Diagnóstico histopatológico de neoplasia intraepitelial cervical (NIC). A) Coilocitosis. Corte histológico con hematoxilina & eosina. B) lesión de bajo grado (NIC1), corte histológico con hematoxilina & eosina. Hay coilocitos y desarreglo arquitectural del estrato basal. C) lesión de alto grado (NIC2), corte histológico con hematoxilina & eosina. Desarreglo arquitectural de dos tercios del epitelio. Presencia de coilocitos en el tercio superior del epitelio. D) lesión de alto grado (NIC3), corte histológico con hematoxilina & eosina. Prácticamente la totalidad del epitelio mostró proliferación anormal de células atípicas.
Discusión
La enfermedad preinvasiva del cuello uterino engloba una serie de manifestaciones: desde la atipia celular a diversos grados de displasia o NIC, antes de progresar a cáncer invasor.
En 1988, el National Cancer Institute realizó el primer panel de expertos para proponer un nuevo esquema de presentación de los resultados de la citología cervical20. Estas recomendaciones fueron denominadas "sistema Bethesda". Se celebraron 2 talleres más en 1991 y 2001, para proporcionar un sistema de terminología uniforme que condujera a guías de tratamiento21,22.
Una de las innovaciones del sistema Bethesda fue la sustitución de los términos precancerosos previos, por 2 niveles de: LEIBG y lEigA. El sistema Bethesda fue diseñado para la notificación citológica, pero sirve también para comentar resultados citopatológicos. En la tabla 1 se presenta la correlación entre la terminología de displasia, NIC y sistema Bethesda de las lesiones precursoras.
A partir de la década de los años 80 se ha identificado al VPH como una causa necesaria, pero no suficiente para desarrollar cáncer cervicoterino23-28.
Se ha informado que el cáncer cervicouterino invasor se asocia con la presencia de VPH en 99.7% de los casos29.
El VPH es la infección de transmisión sexual más común en las mujeres30. El 50% de las mujeres sexualmente activas están infectadas con algún tipo(s) de VPH, que puede promover el desarrollo de cáncer31. Alrededor del 79% de las mujeres sexualmente activas pueden adquirir la infección genital por VPH en toda su vida, pero la infección es habitualmente transitoria y asintomática32.
Se notifica una prevalencia de 38% de infección por VPH en mujeres sanas jóvenes33. Esa misma infección puede remitir con el tiempo34,35. El pico de prevalencia de la infección por VPH en mujeres ocurre cerca de los 20 años. Después de los 20 años la prevalencia declina, aunque ocurre un segundo pico en mujeres posmenopáusicas en algunas áreas geográficas. Esto podría ser atribuido a la persistencia viral, o posiblemente nuevas adquisiciones36,37. El intervalo entre la infección y el diagnóstico de cáncer es de 10 a 20 años38.
En México, la frecuencia de la infección por VPH es variable. Se ha reportado una prevalencia de estudiantes universitarios en uno y otro sexo del 14.4% con predominio en mujeres39. En mexicanas adolescentes sexualmente activas con infección subclínica detectada por PCR, la frecuencia encontrada es de 20%, con incremento del riesgo a 50%-60% cuando tienen o han tenido varias parejas sexuales40.
Lazcano41 en el 2001, demostró un pico máximo de presentación en mujeres menores de 25 años, reportando una prevalencia de 16.7% de ADN-VPH en este grupo de edad. En nuestro estudio encontramos una mayor prevalencia de NIC en mujeres menores de 30 años, esta frecuencia disminuyó en mujeres mayores. Diversos estudios han mostrado una alta prevalencia de los tipos de VPH de alto riesgo en mujeres menores de 30 años, que disminuye considerablemente con la edad42. Se ha documentado que ha menor edad es más alta la frecuencia de ADN positivo del VPH de alto riesgo, hasta en el 60% de las mujeres de 30 años de edad y más jóvenes con una LEIBG, en comparación con el 46% de las mujeres mayores43. En nuestro estudio la edad media de las pacientes con NIC1 fue de 36 años; para las lesiones de alto grado NIC2, NIC3, la edad media fue de 41 años, lo cual corresponde a lo reportado en otras publicaciones nacionales44-47.
Las pacientes estudiadas mostraron todos los factores de riesgo, que se han documentado para cáncer cervicouterino y VPH: baja escolaridad, bajo nivel socioeconómico, tabaquismo, antecedentes de enfermedades de transmisión sexual, inicio de vida sexual temprana, múltiples parejas sexuales, multiparidad y uso de anticonceptivos orales. Los factores de riesgo analizados en este estudio corresponden a los reportados por las publicaciones internacionales y los establecidos en la Norma Oficial Mexicana2,48-50.
Se ha mencionado que existen otros determinantes de progresión a cáncer cervicouterino, entre estos se incluye: tipo viral oncogénico, persistencia de la infección, carga viral por unidad celular, factores genéticos, el sistema inmune del paciente, virus de inmunodeficiencia humano (VIH), otras enfermedades asociadas y medicamentos que causen inmunosupresión que favorezcan su degeneración51-53.
En relación a las enfermedades de transmisión sexual, la frecuencia encontrada no corresponde a lo reportado por la literatura54, nosotros hayamos que las pacientes con NIC tuvieron el antecedente de coinfección por herpes tipo 2, seguido de infección por Chlamydia trachomatis.
Se ha reportado que la infección por herpes tipo 2, es un predictor independiente de infección por VPH, probablemente por la inflamación asociada a la infección que contribuye al riesgo de adquirir VPH55; sin embargo, la sola infección por herpes puede reflejar actitudes de riesgo.
Es de interés mencionar que nosotros detectamos un número importante de mujeres que presentaron infección por molusco contagioso. Esto se explica porque se ha encontrado un incremento a nivel mundial por esta infección, que se ha favorecido por el calor, la humedad, la mala higiene, pero en la mayoría de los casos se asocia a las relaciones sexuales. Se ha observado que a través de las décadas, las pacientes con molusco contagioso han ido aumentando y es cada vez más frecuente la asociación con alguna inmunosupresión como el ViH56-59. Actualmente, la infección por molusco contagioso es considerada una infección de transmisión sexual, especialmente en los jóvenes y en general en la población sexualmente activa60,61.
El inicio de vida sexual en nuestras pacientes se situó en promedio a los 16 años, en el 54.45%, fueron menores de 17 años, lo cual confirma que la infección por el VPH se adquiere en la adolescencia, muy rápidamente después de iniciar su actividad sexual. Se ha documentado que la prevalencia de la infección por VPH entre las mujeres de 20 años23,24,42 es del 22%-24%.
El promedio de inicio de las relaciones sexuales en los Estados unidos de Norteamérica es de 16.4 años62; en México según la encuesta gente Joven de la Fundación Mexicana para la Formación Familiar (MEXFAM)63 aplicada en 1999, la edad promedio de la primera relación sexual fue de 15.2 años en hombres y 15.3 años en mujeres en el grupo de 13 a 19 años de edad.
En el 2000, el instituto Mexicano de la Juventud64, reportó que el 60% de los hombres y 51% de las mujeres del grupo de 15 a 29 años de edad eran sexualmente activos.
Se ha documentado que el inicio temprano de la vida sexual, incrementa el riesgo de infección por VPH y se relaciona con el mayor número de compañeros sexuales, que cada nueva pareja sexual aumenta 10 veces el riesgo. Tener un compañero sin circuncidar y el uso inconstante o inadecuado del preservativo, aumenta el riesgo de transmisión65.
Se ha observado un incremento en el riesgo de lesiones preinvasivas y cáncer cervicouterino, cuando las mujeres iniciaron su vida sexual activa antes de los 20 años de edad26, lo cual también puede deberse a la inmadurez del cuello uterino como mencionan algunos autores.
La exposición al VPH es muy común en la adolescencia después del inicio de las relaciones sexuales, como por ejemplo se ha encontrado que hasta el 38% de las mujeres universitarias han resultado positivas a la prueba del ADN del VPH por PCR, pero sólo el 13% desarrollan cambios citológicos por alguna lesión de bajo grado por el VPH66.
En nuestro estudio, el 85% de las pacientes tuvieron más de una pareja sexual (3 en promedio). El riesgo de infección aumenta con el número total de parejas sexuales y con el número de parejas sexuales del compañero actual67.
La infección por VPH es inicialmente asintomática y la transmisión ocurre antes que la expresión del virus se manifieste por signos o síntomas. La infección por VPH puede ser latente, subclínica o clínica2. Cuando hay manifestaciones puede encontrarse condilomas (verrugas) genitales o lesiones intraepiteliales de bajo o alto grado. Más del 90% de las personas infectadas con VPH de bajo y alto grado son negativas a la infección en los siguientes 2 años. Cuando se trata de una infección latente, sólo puede ser identificada por técnicas de biología molecular. En caso de una infección subclínica se puede observar por colposcopia68,69.
Los condilomas genitales pueden causar síntomas intensos como prurito, hemorragia e infección secundaria causada por lesiones superficiales debido al rascado. La prevalencia de condilomas genitales, la manifestación más visible de una infección por VPH, es de aproximadamente 1% en los norteamericanos sexualmente activos70. Los pacientes que tienen síntomas clínicos representan un pequeño grupo de la gran población con infección latente.
La persistencia de los virus de alto riesgo del VPH, puede causar lesiones intraepiteliales, los cuales pueden progresar a cáncer del tracto genital inferior si no son tratados28,71.
El grupo pequeño en el que no es posible controlar la infección por VPH, está en riesgo de progresión a malignidad72.
Aunque la literatura reporta que las infecciones por el VPH son asintomáticas, nosotros encontramos síntomas inespecíficos que son equivalentes a alguna alteración infecciosa del tracto genital inferior. Sólo en el 14.78% de los casos la paciente fue asintomática. En contraparte, el 85.22% presentó algún síntoma y de éstos, el más frecuente fue el prurito y ardor genital seguido de fluido transvaginal persistente. Sólo en el 9.85% de los casos encontramos manifestaciones específicas de infección del VPH, que correspondió a condiloma genital.
En años recientes se ha notificado la existencia de más de 100 tipos de VPH, siendo las variantes 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68 las consideradas como de alto riesgo (AR) -o tipos carcinógenos- por encontrarse asociados al cáncer cervicouterino en más del 95% de los casos, así como a otros tumores y cáncer73. Asimismo, este tipo de virus de alto riesgo se encuentra asociado a lesiones intraepiteliales cervicales de alto y bajo grado, así como a tumores o cáncer del tracto genital inferior.
Aunque existen 15 tipos que han sido clasificados como de alto riesgo, sólo 8 producen la mayoría de los cánceres cervicales74,75 (en orden de frecuencia): VPH 16, 18, 45, 33, 31, 52, 58 y 35.
Una minoría de infecciones por VPH de AR persisten durante 5-20 años, y éstos son los verdaderos precursores del cáncer. La infección persistente por los VPH AR es un paso necesario para el desarrollo de algunos cánceres76. Por otra parte, se informa que otros tipos de VPH, como el 6, 11, 42, 43 y 44, muestran una débil asociación con cáncer cervicouterino denominándose, por tanto, tipos de bajo riesgo77.
Los tipos de bajo riesgo incluyen al tipo 6 y 11 que son responsables de aproximadamente el 90% de los condilomas exofíticos en los genitales externos, vagina y cérvix, así como de muchos casos de papilomatosis respiratoria recurrente, y de menos del 15% de las lesiones cervicales de bajo grado en la zona de transformación78. Las infecciones mixtas con tipos de bajo y alto riesgo son comunes en mujeres con NiC78,79.
El resultado de citología cervical fue reportado de acuerdo al sistema Bethesda 2001, nosotros encontramos hasta en el 17.26% de los casos con NIC un reporte de ASCUS que corresponde a células escamosas atípicas de significado indeterminado. En el ASCUS, las células tienen algunas características LEIBG. Los núcleos están algo hipertrofiados y son hipercromáticos. Sin embargo, las células no muestran alteraciones citológicas suficientes como para que puedan clasificarse como diagnóstico de LEIBG14. Además, se observó una cantidad considerable de inflamación que puede contribuir a los cambios citológicos. Por esa razón, el Departamento de Anatomía Patológica clasificó estos casos como ASCUS, pero en el estudio histopatológico confirmo NIC.
Una mujer con un diagnóstico citológico de ASCUS durante un cribado por citología de cuello uterino rutinario, tiene una probabilidad del 5% al 16% de tener NIC2 o 3, confirmado mediante biopsia durante la colposcopia80. La prevalencia agrupada de NIC2 y 3 confirmada mediante biopsia en mujeres con ASCUS es del 9.7%.
Debido a la frecuencia subyacente de NIC2 o 3 en mujeres con ASCUS, se han considerado algunas recomendaciones de prueba diagnóstica adicional o de seguimiento para estas mujeres, tal es el caso de la American Society for Colposcopy and Cervical Pathology (ASCCP)81 en su última guía Clínica del 2012.
En nuestra serie encontramos una sensibilidad de la citología cervical (porcentaje de mujeres enfermas con resultado positivo en la prueba) de 64.47%, lo cual corresponde a lo reportado en la literatura mundial que indica un rango de 30%-80%, con una media de 47% y que se considera de forma global una sensibilidad aceptable82.
Por otra parte, la citología convencional para la detección de lesiones precursoras del cáncer cervical se ha encontrado en la literatura una alta tasa de especificidad (porcentaje de mujeres libres de enfermedad con resultado negativo en la prueba)83 con rango de 79% a 100%, media 95%. En nuestra investigación no se determinó la especificidad porque no fue el objetivo del estudio.
La prueba de ADN de los VPH de alto riesgo, se realizó únicamente en las pacientes con interpretación de la citología de células epidermoides atípicas de significado indeterminado. En todos los casos que se solicitaron fue de acuerdo a las recomendaciones por la ASCCP83.
La prueba de VPH que se realizó fue por la técnica de PCR, el 100% de los casos fueron positivos para los VPH de alto riesgo. El uso de la prueba del VPH, se destaca en las guías consensuadas para el tratamiento de las mujeres con alteraciones cervicales citológicas de 2006, la última actualización es del 2012 propuesta por la ASCCP81,84. La principal ventaja de la prueba del ADN de los VPH de alto riesgo, es su alta sensibilidad para detectar carcinomas cervicales epidermoides y sus precursores.
Debido a que la infección por VPH aparece muchos años antes que la neoplasia, la prueba del ADN del VPH ofrece la posibilidad de reducir mucho más la incidencia de cáncer si se aplica razonablemente y extensamente. Algunos de los usos reconocidos de la prueba del ADN del VPH incluyen el manejo de mujeres con citología de Papanicolaou (Pap), que muestre células epidermoides atípicas de significado indeterminado (ASCUS), el seguimiento tras el tratamiento a modo de prueba de curación y el cribado rutinario basado en la población de las mujeres en riesgo.
La prueba del VPH puede detectar del 30% al 100% más precursores del cáncer cervical que la citología convencional y, del 20% al 50% más precursores de cáncer que la citología de Pap en medio líquido15,85,86.
Debido a que la alta incidencia de cáncer cervicouterino no ocurre hasta los 40 años, la prueba para detectar infección persistente por VPH es más útil entre los 30 y 40 años de edad87.
Se ha documentado la utilidad clínica de las pruebas del VPH para identificar a las mujeres en riesgo de NIC de alto grado prevalente y futura.
La estrategia de la Secretaría de Salud en México a través del Centro Nacional de Equidad de género y Salud Reproductiva, es que en mujeres menores de 25 años se debe realizar sólo citología y ser conservador con los resultados, y dejar como primer paso la detección de ADN-VPH en mujeres mayores de 30 años. Si es positiva a virus de alto riesgo se realizara citología cervical, de ser anormal se realizará colposcopia88. Se deberá consultar las últimas recomendaciones para la prueba del VPH, debido a que la Norma Oficial Mexicana únicamente lo menciona como un complemento de la citología cervical48. Sin embargo, en el contexto del cribado normal la citología es ligeramente más específica que la prueba del ADN del VPH para detectar la presencia de patología cervical de alto grado15.
En relación a los hallazgos colposcópicos en las pacientes con NIC, predominaron los cambios menores, en su mayoría correspondieron a lesiones de bajo grado. Nosotros utilizamos la terminología de Barcelona 2002 propuesta por la IFCPC. Actualmente, existe una nueva nomenclatura que fue aceptada en el Congreso Mundial de Río de Janeiro, Brasil 2011; por lo que deberá considerarse esta nueva terminología para los futuros reportes colposcópicos89. En el 76% de los casos las pacientes con NIC mostraron ser yodonegativas después de la aplicación de Lugol. Muchas lesiones de grado alto y bajo no contienen glucógeno y "rechazan" el yodo cuando este se aplica. Se produce un patrón de captación de color amarillo mostaza que indica la carencia de glucógeno celular2.
Nosotros utilizamos la solución de Lugol en la evaluación de las lesiones cervicales de alto y bajo grado. El epitelio neoplásico y las lesiones de alto grado son yodonegativas, tras la aplicación de la solución de Lugol. Sin embargo, se debe tener en mente que otras patologías podrían simular una lesión yodonegativa como es el caso de epitelio columnar normal, la metaplasia inmadura y la leucoplaquia que contiene poco o ninguna cantidad de glucógeno y que no reaccionan con la aplicación de Lugol: por esa razón muchos colposcopistas no utilizan la prueba de Schiller de forma rutinaria en la evaluación colposcópica74.
La literatura es limitada en relación a la utilidad de ácido acético vs. solución de Lugol en la evaluación colposcópica90.
Es bien aceptado que la solución de Lugol es de utilidad en el examen colposcópico, y para realizar la biopsia dirigida91.
Muwonge et al.92 recientemente sugirió que el ácido acético como prueba única, es menor efectivo en el diagnóstico que si se combina con la solución de Lugol. Con una sensibilidad del 92.9% y especificidad de 83.5% cuando se utiliza combinado ácido acético y Lugol.
La lesión de bajo grado fue el reporte colposcópico más frecuente, seguido de lesión de alto grado. Encontramos una sensibilidad de 89.6%, lo cual equivale a lo reportado en la literatura con sensibilidad de 87%-99%, que se considera alto, aunque su especificidad se reporta baja (23%-87%)93. La mayor sensibilidad y menor especificidad de la colposcopia puede explicarse debido a una sobre-interpretación de las lesiones de bajo grado.
En el reporte histopatológico definitivo de las pacientes con NIC, se encontró una prevalencia mayor de NIC1, que corresponde a la infección por VPH y representa una LEIBG.
Nuestros hallazgos en relación a la frecuencia de NIC, corresponden a las publicaciones nacionales como es el caso del Dr. Torres Lobatón, quien en el año 2007 reportó la frecuencia de las etapas clínicas y su correlación con la edad del cáncer cervicouterino en el Hospital general de México44,94. En relación a las lesiones preinvasivas, correspondió a NIC1 el 75.2%, NIC2 el 7.2% y NIC3 el 17.4%.
En otras publicaciones nacionales siempre se ha encontrado una mayor frecuencia en las lesiones de bajo grado (NIC1), en comparación con lesiones de alto grado (NIC2 y NIC3)95,96.
Se ha documentado un aumento en la frecuencia de NIC en años recientes. Al comparar la información generada en el Hospital general de México con lo reportado en 1984 se ha reportado un incremento de 32.5% a 61% en los diagnósticos de NIC y un descenso de 67.4% a 38.9% en el de cánceres invasores44.
La terminología de las lesiones histológicas no siempre siguen la nomenclatura de Bethesda, y por lo tanto, estas lesiones siguen siendo denominadas NIC. El término de "lesión intraepitelial epidermoide de bajo grado" incluye a las lesiones citológicas anteriormente denominadas como de displasia leve, neoplasia intraepitelial del cuello uterino de grado 1 (NIC1), y cambios producidos por el VPH o cambios celulares compatibles con coilocitosis97,98.
La NIC1 es habitualmente la manifestación de una infección vírica y tiene un potencial premaligno muy bajo. La mayor parte de las citologías de la LEIBG se normalizara espontáneamente o se mantendrá sin cambios a lo largo del tiempo. Su progresión a cáncer es poco frecuente99.
Melnikow100 realizó un meta-análisis de 27,000 mujeres dando las tasas ponderadas de progresión a LEIAG y a cáncer invasor a los 24 meses, según el reporte de citología cervical. Reportando una regresión a la normalidad a los 24 meses del 47.4% en las lesiones de bajo grado, con una progresión a lesiones de alto grado del 20.8% y una progresión a cáncer invasor a los 24 meses de 0.2%. En las lesiones de alto grado se encontró una menor regresión a la normalidad a los 24 meses (35%), con una persistencia de 23.4% y una progresión a cáncer invasor a los 24 meses de 1.4%.
Varios estudios han abordado la historia natural del NIC con un énfasis particular en la regresión, persistencia y progresión por ejemplo para NIC1 el 57%-60% de los casos tiene regresión, sólo el 32% persisten, el 10%-15% progresan a NIC3 y únicamente el 1%-1.9% progresa a cáncer invasor101-103.
En nuestro estudio encontramos una menor frecuencia de LEIAG representando sólo el 16.02%. Este tipo de lesiones son las únicas que realmente se consideran enfermedades precursoras del cáncer cervicouterino invasor. La NIC3 se considera una afección precursora de cáncer, aunque no todas las lesiones evolucionaran a cáncer cervicouterino104.
La probabilidad de regresión en NIC2 es del 43%, persistencia 35%, progresión a NIC3 del 22% y probabilidad de progresión carcinoma invasor del 1.5%.
En NIC3 se ha reportado probabilidad de regresión en 32%, probabilidad de persistencia en 56% y probabilidad de progresión a carcinoma invasor mayor del 12%74,101,105,106.
Conclusiones
Las lesiones preinvasivas son las patologías precursoras del cáncer invasor, existen diferentes clasificaciones, que son equivalentes para nombrar a todas estas entidades que son causadas por el VPH.
Las lesiones precursoras son más frecuentes en las mujeres jóvenes con una mayor incidencia entre los 25-45 años, la frecuencia disminuye conforme avanza la edad, esto traduce que la infección se adquiere en la adolescencia. Los factores de riesgo para la NIC (o LEIBG o LEIAG) son las mismas que para el cáncer cervicouterino; en nuestro estudio destacan factores de riesgo como inicio de vida sexual temprana, múltiples parejas sexuales, multiparidad, tabaquismo, enfermedades de transmisión sexual asociadas y nivel socioeconómico bajo.
La NIC en la mayoría de los casos es asintomática, teniendo una fase subclínica que sólo puede detectarse por estudios moleculares como la prueba de VPH (PCR y captura de híbridos). Cuando la lesión es subclínica se presenta con síntomas inespecíficos que corresponden a algún proceso infeccioso del tracto genital inferior y puede detectarse por estudio de Pap y colposcopia. En menos del 10% de los casos se puede encontrar manifestaciones clínicas del VPH como son condilomas en el tracto genital inferior, que corresponde a una lesión de bajo grado.
La colposcopia junto con la citología cervicovaginal son la piedra angular para el diagnóstico inicial y el seguimiento postratamiento.
La citología cervical tiene su utilidad como el mejor método de screening para la población, existen cambios citológicos que indican lesión de alto y bajo grado, pero puede haber falsos negativos y falsos positivos. La lesión precursora del cérvix puede diagnosticarse como ASCUS hasta en el 17.6% de los casos. Es importante que la comunidad médica incorpore a la práctica los nuevos lineamientos de tamizaje y abordaje en las pacientes con citología cervical anormal. La colposcopia muestra una mayor sensibilidad en el diagnóstico de las lesiones precursoras del cérvix, es frecuente encontrar signos colposcópicos que equivalen a lesiones de bajo grado como son epitelio acetoblanco tenue, puntilleo fino, mosaico fino y son yodonegativas. Sin embargo, puede presentar también falsos negativos y falsos positivos.
La prueba del VPH ha tenido mayor aceptación para el diagnóstico y seguimiento de las lesiones precursoras mostrado una mayor sensibilidad que la colposcopia y Pap, incluso puede ser complementaria de los otros estudios. Se deben consultar las últimas recomendaciones para la prueba del VPH para cierto grupo de pacientes y en situaciones especiales.
El estudio histopatológico es el método definitivo para confirmar la presencia de NIC. La LEIBG-NIC1, es el diagnóstico histopatológico más frecuente; las lesiones del alto grado LEIAG-NIC2 y 3, se encuentran en el 16.2% de los casos y son los verdaderos precursores para la neoplasia invasora del cérvix.
Se debe individualizar cada caso en particular de acuerdo con los riesgos potenciales, valorar la confirmación de la lesión, su extensión y determinar los factores de riesgo de persistencia y progresión de las lesiones.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Financiamiento
Los autores no recibieron patrocinio para llevar a cabo este artículo.