El cáncer de mama es un problema de salud pública mundial. La mastografía continúa siendo el estándar de oro en el tamizaje y evaluación inicial de esta entidad, sin embargo, dista mucho de ser un método perfecto. La mastografía por emisión de positrones es una herramienta de reciente introducción, altamente sensible y específica de lesiones malignas. Puede detectar tumores más pequeños, en etapas más tempranas que el resto de los métodos convencionales de imagen; es de gran utilidad en la estadificación y planeación quirúrgica de la enfermedad y disminuye el número de procedimientos innecesarios, así como la morbimortalidad de las mujeres con cáncer de mama.
Breast cancer is a global public health problem. Mammography remains the reference standard in screening and the initial assessment for this neoplasia. However, it is far from being a perfect method. Positron Emission Mammography (PEM) is an emerging nuclear method, highly sensitive, and specific for malignant lesions. It detects smaller tumours, and in earlier stages than other conventional imaging methods. It is has a great value, not only for staging the disease, but also for surgical planning. It reduces the number of unnecessary procedures, as well as the morbidity and mortality in women with breast cancer.
Actualmente el cáncer de mama es la neoplasia maligna más frecuente en la mujer a nivel mundial1-4. La detección y el tratamiento oportunos reducen la morbimortalidad de quienes lo presentan2,3. Una adecuada estadificación es fundamental para brindar la mejor terapéutica posible y evitar las recidivas tumorales, así como mejorar el pronóstico de las pacientes2,5. La mastografía continúa siendo la modalidad de elección para el tamizaje y diagnóstico, sin embargo, muestra baja sensibilidad y especificidad en mujeres con tejido mamario heterogéneamente o extremadamente denso4,6-8. Cerca del 10 al 15% de los cánceres no son detectados por métodos de cribado convencionales, por lo que se utiliza complementariamente el ultrasonido y en algunos casos la resonancia magnética7,9.
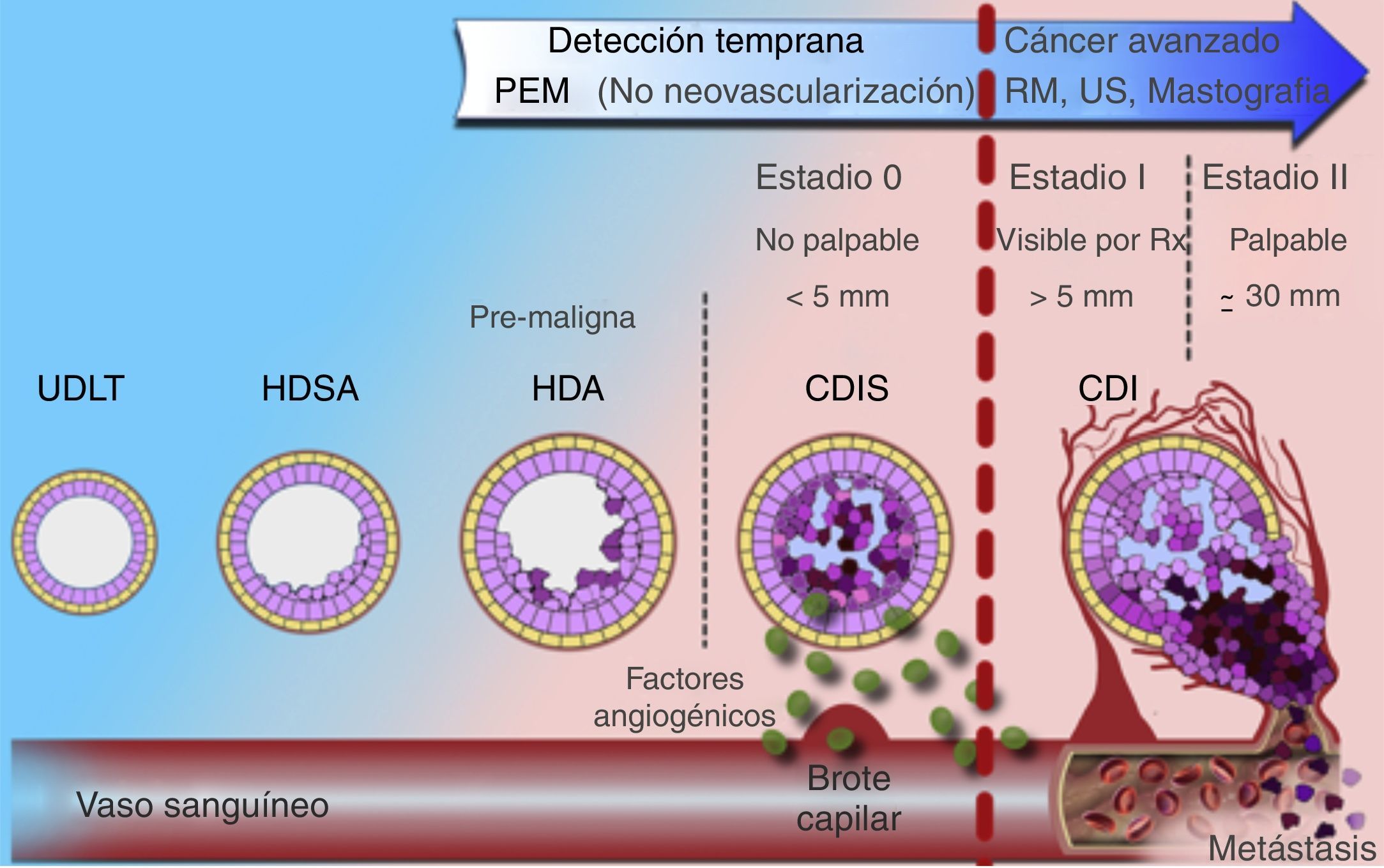
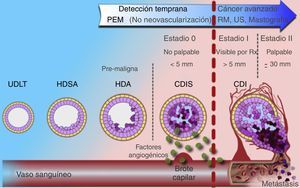
El desarrollo de mejores detectores en los equipos de centelleo hizo a la medicina nuclear una opción viable para la evaluación del cáncer de mama10. La mastografía por emisión de positrones (PEM), también conocida como «PET de mama de alta resolución», es una modalidad de imagen con alta sensibilidad y especificidad en el diagnóstico del carcinoma mamario ductal in situ e invasor4,11-14. La resolución espacial y la naturaleza biomolecular de la PEM permiten detectar cánceres más pequeños, en etapas más tempranas debido a que el metabolismo tumoral se incrementa de forma previa a la neovascularización demostrada mediante resonancia magnética y a la formación de calcificaciones visibles mastográficamente en cánceres generalmente in situ (fig. 1)5,7-9.
Modelo de evolución del carcinoma mamario. Utilidad de PEM en etapas tempranas de la enfermedad (estadio 0) frente a los demás métodos de imagen.
CDI: carcinoma ductal invasivo; CDIS: carcinoma ductal in situ; HDSA: hiperplasia ductal sin atipia; HDA: hiperplasia ductal atípica; UDLT: unidad ducto-lobulillar terminal.
Explicar de forma simple los principios y los aspectos importantes de la PEM. Enumerar las ventajas y desventajas, las indicaciones y contraindicaciones del método, describir los hallazgos radiológicos y el léxico utilizado.
Material y métodosSe efectuó revisión bibliográfica actualizada, con selección de casos representativos en PEM y su correlación con otros métodos de imagen.
ResultadosLa PEM es un método sensible y específico en el diagnóstico del cáncer mamario y su etapificación, ya que detecta multifocalidad, multicentricidad, bilateralidad y estado axilar para una adecuada planeación quirúrgica, y por ende, disminución en la cantidad de procedimientos innecesarios, así como una reducción en la morbimortalidad de las mujeres que lo presentan.
DiscusiónAntecedentesLa tomografía por emisión de positrones con tomografía computada de cuerpo completo (WB PET-CT) se introdujo en la década de los 707.
El primer estudio sobre WB PET-CT se publicó en 19892.
En 1993 Thompson et al. propusieron un equipo de PET específicamente diseñado para la glándula mamaria y el primer estudio clínico se llevó acabo en 19967.
La FDA aprobó la PEM en 2003 y la biopsia guiada por PEM en 200815,16.
En nuestra institución iniciamos esta metodología en agosto del 2013 y hemos realizado hasta noviembre del presente año 389 estudios.
Base biomolecular de la medicina nuclearLos estudios por imagen molecular utilizan la fisiopatología de las células diana para radiotrazarlas intencionalmente. Se emplean moléculas transportadoras por su habilidad de incorporarse al metabolismo celular a través de vías fisiológicas existentes2. Es posible diferenciar el tejido neoplásico del sano, debido a que las células tumorales captan significativamente más radiofármaco dada su sobreexpresión de proteínas transportadoras de glucosa, glucólisis incrementada y actividad anormal de la hexocinasa5,8,16,17.
El radiofármaco más utilizado es la 2-[18F]-flúor-2-desoxi-D-glucosa (18FDG), un análogo radiactivo de la glucosa que emite positrones y se obtiene al combinar el isótopo flúor-18 con una molécula de desoxiglucosa. Tras inyectarse por vía endovenosa, la 18FDG es acarreada por transportadores de glucosa (GLUT) al citoplasma, donde se fosforila en 18FDG-6-fosfato. Dicha molécula queda atrapada al no poder continuar las vías metabólicas de la glucosa y se acumula progresivamente en la célula. Este «atrapamiento metabólico» se traduce en un incremento gradual de la señal en la neoplasia maligna y se diferencia de la captación basal en el tejido normal8,17,18.
Podemos recurrir a otros radiofármacos más específicos como el 16α-[18F]-flúor-17ß-estradiol (18FES). Su principal utilidad es la monitorización de tumores malignos con receptores de estrógenos positivos. Los receptores de estrógenos y progesterona son proteínas intracelulares involucradas en la progresión del cáncer de mama, aproximadamente el 60% de los tumores los expresan. En el núcleo celular el estradiol se une a los receptores de estrógenos activando vías de señalización que inducen la proliferación del epitelio ductal y estimulan el crecimiento tumoral. El 18FES puede predecir la probabilidad de respuesta terapéutica en el tratamiento con moduladores selectivos de los receptores estrogénicos (SERM), es decir, las lesiones que responden a tamoxifeno tienen mayor captación de 18FES2,19,20.
Principios físicosEl equipo de PEM detecta rayos gamma que provienen del radiofármaco acumulado en el interior de la mama, de forma contraria a lo que ocurre en una mastografía, donde los rayos X generados en el equipo atraviesan el tejido mamario.
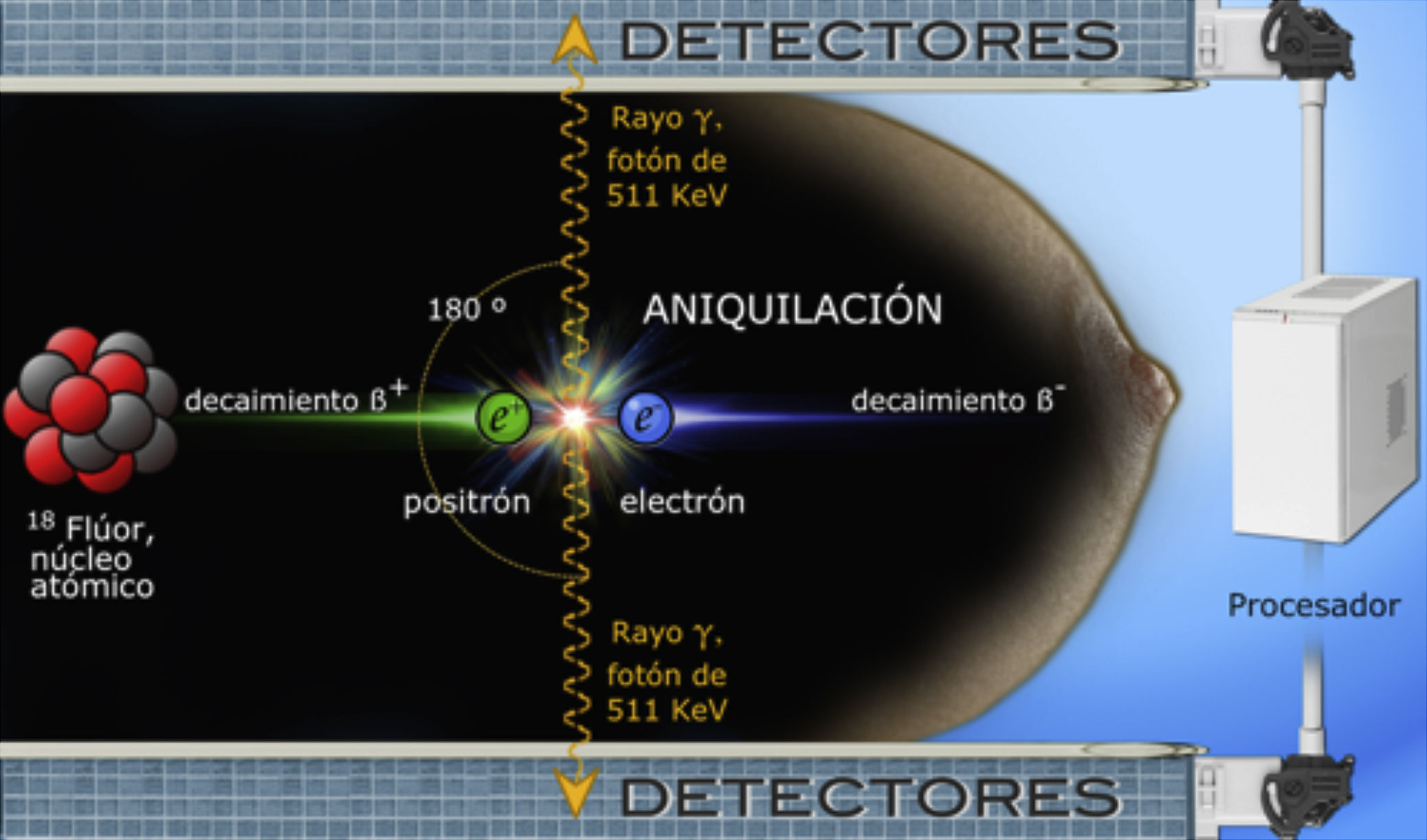
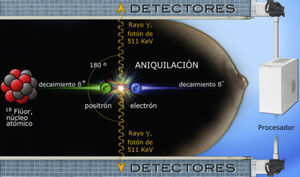
El núcleo atómico del flúor-18 es inestable y a medida que decae emite positrones. Cuando un positrón (e+) y un electrón (e−) colisionan, ocurre un fenómeno de aniquilación que produce 2 fotones de rayos gamma dirigidos en sentido opuesto, cada uno con energía de 511 keV (kiloelectronvoltio); estos rayos impactan simultáneamente los detectores de centelleo colocados a cada lado de la mama, son convertidos en luz visible, digitalizados y reconstruidos por el software en imágenes diagnósticas (fig. 2)17,21, las cuales son tomográficas en proyecciones análogas a las de mastografía; el grosor de cada corte es igual al espesor de la mama dividido entre 12, lo cual permite localización detallada y tridimensional de los sitios de captación11,12,22.
Ilustración esquemática de un evento de aniquilación dentro del tejido mamario. El equipo de PEM no detecta los positrones emitidos por el radiotrazador, sino los rayos gamma producidos al colisionar electrones y positrones. El decaimiento ß+ se refiere a la emisión de partículas beta desde un núcleo inestable para equilibrar su relación de protones y neutrones.
Se han diseñado equipos con diferente geometría de los cabezales y detectores de distintos cristales de centelleo a fin de lograr la mejor sensibilidad y resolución posibles8,21-23. La configuración coplanar es la más popular, provee la mejor resolución de contraste y espacial por plano, además puede ajustar la distancia y la presión de sus cabezales para adaptarse al tamaño de cada mama. Consiste en 2 detectores montados sobre las paletas de compresión, capaces de rotar para adquirir varias proyecciones14,21.
Protocolo de adquisiciónComo todos los métodos de imagen, la comunicación con la paciente, una apropiada preparación y el aspecto técnico de la adquisición son fundamentales para un estudio diagnóstico óptimo (tabla 1)3,5,7,11,19,22,24,25. Puede realizarse este protocolo conjuntamente con WB PET-CT, cuando existe sospecha de enfermedad metastásica, para una adecuada etapificación a distancia. Pasado el tiempo de captación tisular se realiza WB PET-CT y después se continúa con las imágenes del PEM (evaluación locorregional)12,25.
Protocolo de PEM
| 1. Ayuno de 4-6 h previo a la inyección del radiofármacoa 2. Consentimiento informado de los riesgos y beneficios del procedimientob 3. Determinar la glucosa sérica (cifra máxima de 130 mg/dL) 4. Inyección intravenosa de ≈185 MBq (5 mCi) en el brazo contralateral a la lesión, o en la pierna si hay enfermedad bilaterald 5. Reposo de la paciente 60-90min previos al estudio (tiempo de captación tisular) 6. Escanear el sitio de la inyección durante 30-90 sd 7. Escanear las mamas 5-10min por proyección: cráneo-caudal y medio-oblicua-lateral, bilateralmente (opcional proyecciones laterales y axilares)c 8. Biopsia opcional (requiere 30-60min adicionales) 9. Evitar contacto interpersonal (< 1,5 m) en las 6 h siguientes 10. Hidratación incrementada para acelerar la depuración del radiofármaco |
El equipo de PEM está diseñado específicamente para la exploración mamaria y, aunque funciona bajo los mismos principios de un PET convencional, ofrece mayor resolución espacial, requiere menos 18FDG, acorta los tiempos de adquisición y es más sensible a la radiación emitida, por lo que detecta lesiones más pequeñas, debido a que los detectores están en íntimo contacto con las glándulas mamarias; además, emplea cristales de centelleo especializados3,7,21. Ventajas y desventajas del método (tablas 2 y 3, fig. 3)2,5,12.
PEM: ventajas
| Alta resolución espacial (detecta lesiones <2mm, no visibles por otros métodos) La captación de 18FDG no se ve afectada por cambios hormonales ni por la densidad mamaria No requiere compresión mamaria, solo inmovilización (10-15 lb vs. 35-45 lb de la mastografía convencional) Mayor especificidad que la resonancia magnética Dispositivo compacto, suministro eléctrico convencional (tomacorriente de 120 voltios) El movimiento respiratorio no es una problemática en la adquisición Aporta menor dosis de radiación que WB PET-CT Se puede realizar la biopsia en el mismo estudio de PEM Apropiada en pacientes que no pueden realizarse resonancia magnética Provee información adicional a la de la RM, cuando esta no es concluyente |
PEM: desventajas
| No muestra el detalle anatómico de otros métodos de imagen Falsos positivos (procesos inflamatorios, necrosis grasa, papilomas y algunos adenomas)a Falsos negativos (en tumores malignos con baja actividad metabólica o muy pequeños, así como aquellos localizados adyacentes al músculo pectoral mayor) El metabolismo alterado de la glucosa puede modificar la visibilidad de la captación de un cáncer. Provee radiación ionizante de forma sistémica. Poca disponibilidad del método y elevado costo |
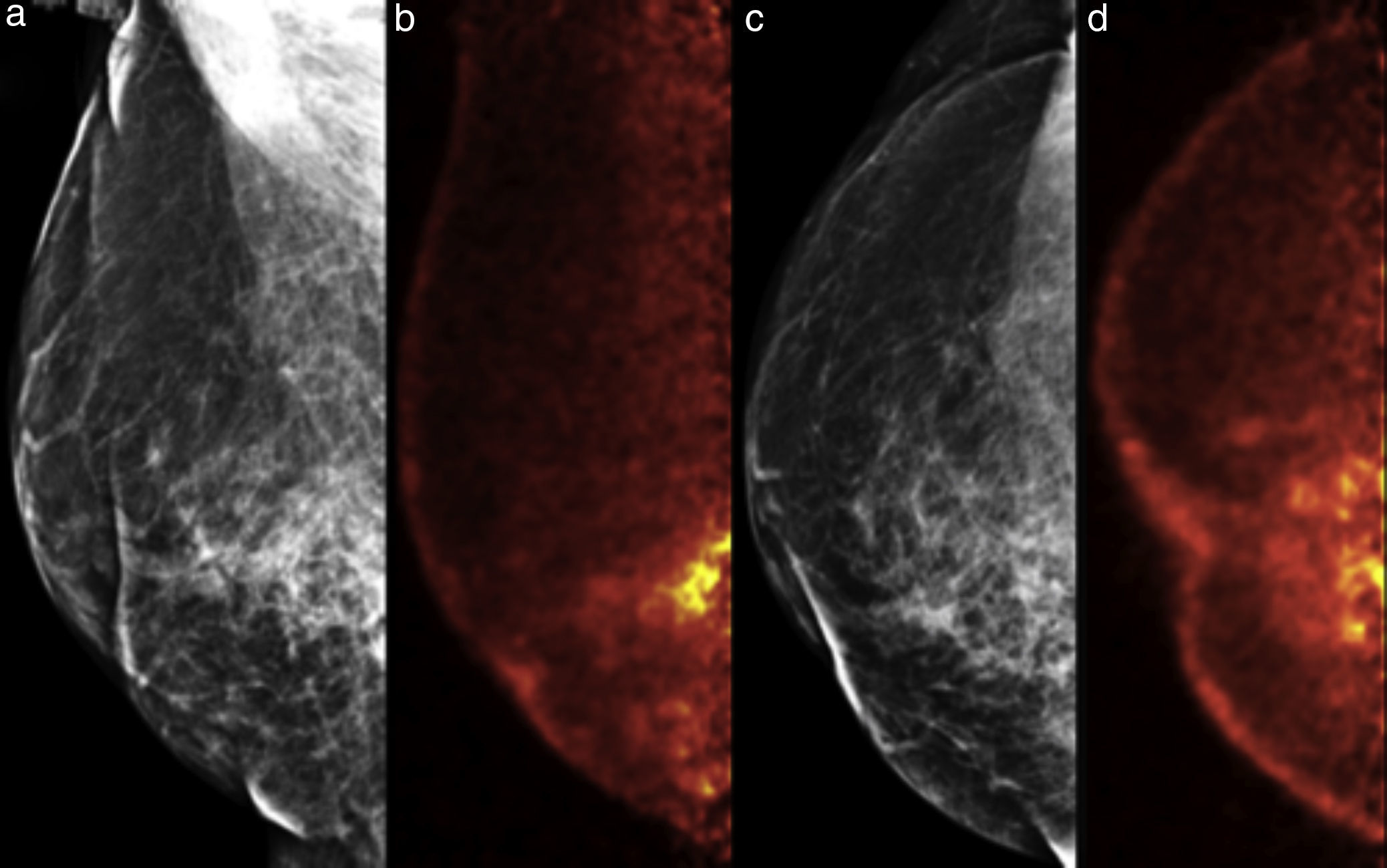
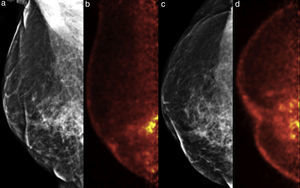
Ejemplo de un caso falso positivo. Mujer de 68 años, carcinoma ductal invasivo derecho hace 3 años, ahora con mastalgia y elevación de marcadores tumorales. a y c) Mastografía digital MLO y CC, respectivamente; distorsión de la arquitectura y cambios por mastoplastia. b y d) PEM: múltiples lesiones hipercaptantes en el cuadrante inferointerno, LTB 6.15. El estudio histopatológico reportó múltiples zonas de necrosis grasa.
La PEM y la resonancia magnética (RM) tienen una precisión diagnóstica similar. La RM es un poco más sensible, pero menos específica en la detección de multifocalidad o multicentricidad (tabla 4)4,7,8,14,17. La detección de malignidad incrementa cuando ambos métodos se utilizan conjuntamente5,9,26.
Mastografía por emisión de positrones vs. resonancia magnética
| PEM | RM | |
|---|---|---|
| 91% | Sensibilidad para detectar CDIS | 79-83% |
| 79-91% | Sensibilidad para detectar CDI | 89.1-93% |
| 93-95% | Sensibilidad detectando cáncer contralateral | 93-95% |
| 79.9-93% | Especificidad | 65.6-86.3% |
| 66% | Valor predictivo positivo | 53% |
| 89% | Precisión diagnóstica | 88% |
| 3% | Tasa de biopsias innecesarias | 9.3% |
CDIS: carcinoma ductal in situ.
CDI: Carcinoma ductal invasivo.
Al realizar una PEM deben considerarse los beneficios, así como los potenciales riesgos inherentes a la dosis de radiación. En una mastografía el tejido mamario es el único expuesto a radiación ionizante, mientras que en la PEM todos los órganos del cuerpo son irradiados al inyectar el radiofármaco. La dosis efectiva promedio en un estudio de PEM con 5 mCi (milicurio) de 18FDG es discretamente superior a la dosis anual por exposición a radiación cósmica, aproximadamente 3.5 milisievert (mSv) contra 3.1 mSv, respectivamente. En contraste, la dosis efectiva de una mastografía digital bilateral (proyecciones CC y MLO) es de 0.44 mSv8,24,25. Con la PEM la vejiga recibe la mayor dosis de radiación y es el órgano con mayor riesgo de cáncer radioinducido10,17.
Indicaciones y contraindicacionesVéanse la tabla 5 y las figuras 4 y 52,3,8,13,17.
PEM: indicaciones y contraindicaciones
| Indicaciones |
| Pacientes con diagnóstico de cáncer mamario y planeación de tratamiento quirúrgico conservador (descartar multifocalidad y/o multicentricidad) para definir límites quirúrgicos |
| Distinguir enfermedad recurrente o residual de cambios posquirúrgicos |
| Monitorización de la respuesta a quimioterapia neoadyuvante |
| Estudio alternativo en pacientes que no pueden realizarse RM |
| Contraindicaciones |
| Pacientes diabéticas con glucosa plasmática en ayuno >130 mg/dL |
| Embarazo/lactancia |
| No indicado como método de tamizaje |
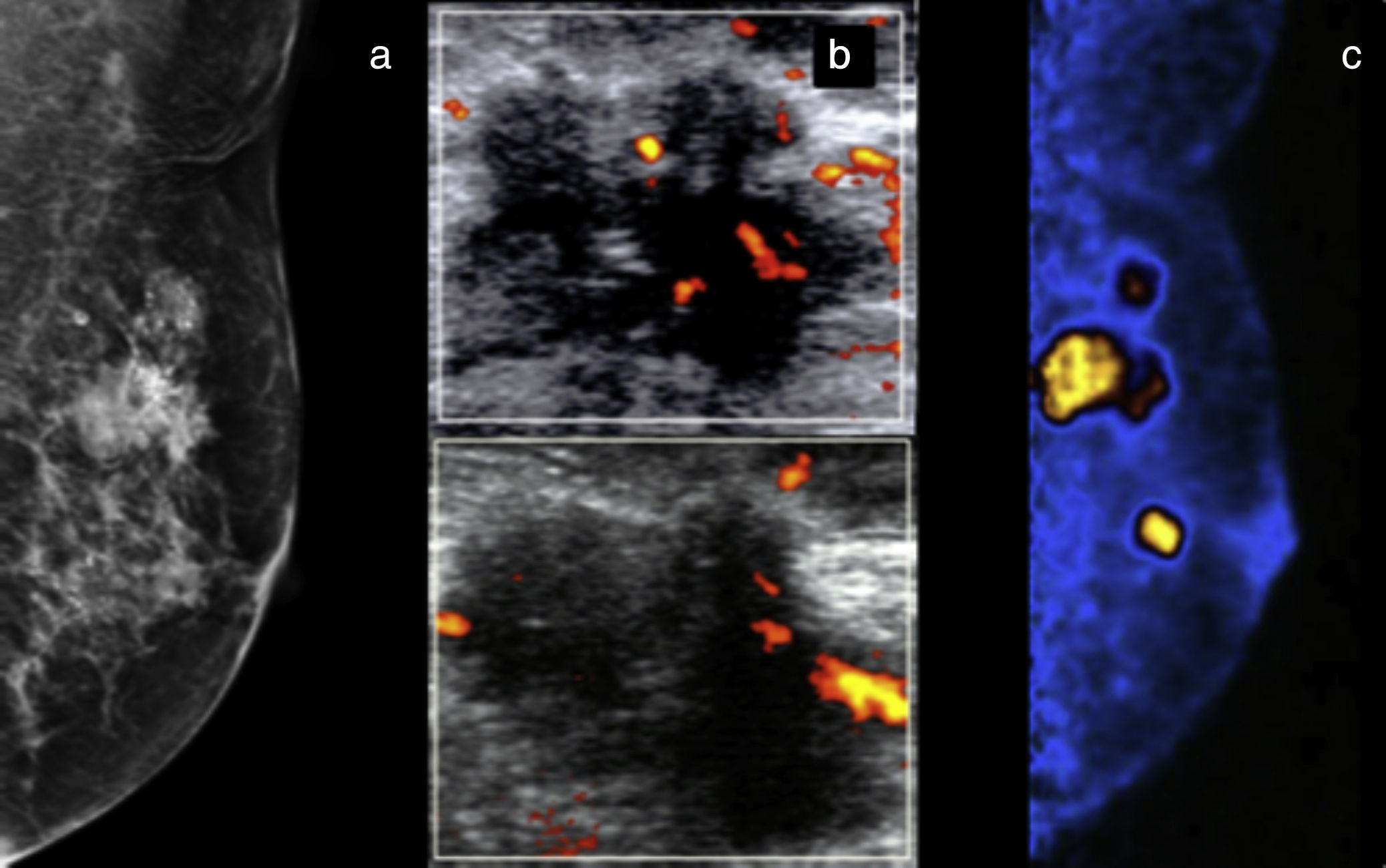
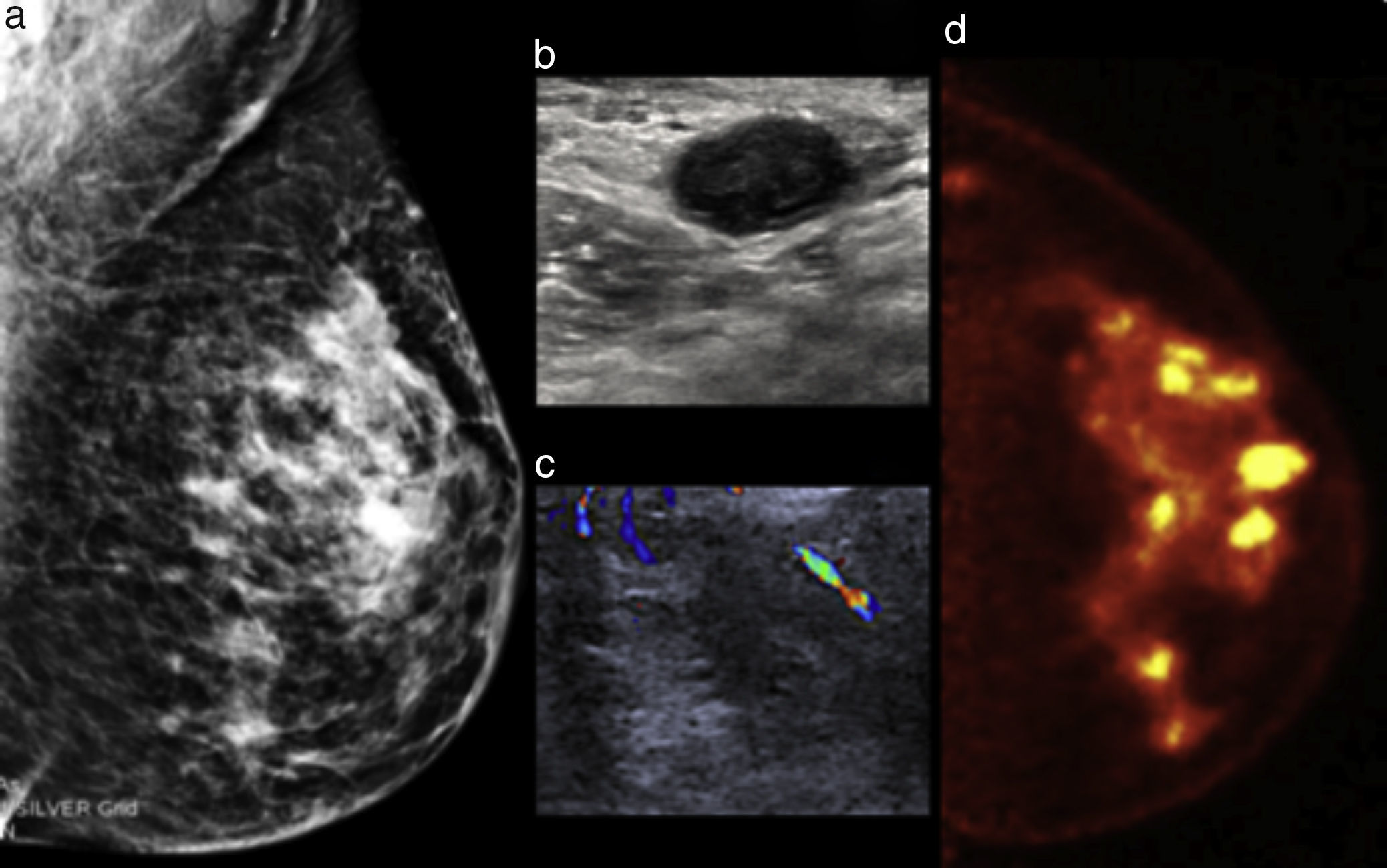
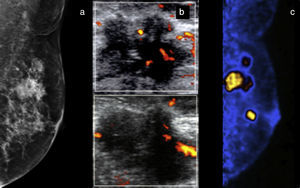
Mujer de 70 años con masa palpable izquierda y retracción cutánea. a) Mastografía digital; masas irregulares espiculadas en el cuadrante superoexterno con calcificaciones pleomórficas: BI-RADS 5. b) US Doppler: muestra presencia de vascularidad central. c) PEM: se corroboran lesiones hipercaptantes y se identifican otras masas hipermetabólicas en el mismo cuadrante, LTB 10.19. Diagnóstico de multifocalidad.
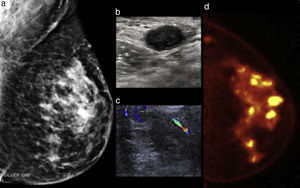
Mujer de 51 años con masa palpable izquierda. a) Mastografía digital con distorsión de la arquitectura en el cuadrante superoexterno asociada a microcalcificaciones. b) US modo B y Doppler (c) muestran ganglios linfáticos sospechosos. d) PEM: múltiples masas hipercaptantes en los cuadrantes interno y externo, LTB 8.57. BI-RADS 5; diagnóstico de multicentricidad.
El primer paso en la interpretación es la identificación del «foco caliente»; posteriormente, deben determinarse el tamaño y la cuantificación de la captación del radiofármaco de cada lesión. La localización se especifica de acuerdo con el radio que ocupa en la topografía mamaria (análogo a las manecillas del reloj) y la distancia a la que se encuentra del pezón6,11,12.
La captación del radiofármaco se mide trazando una region of interest (ROI) circular o rectangular sobre la lesión, localizado en el punto de máxima captación, es decir, el valor PEM de captación máxima (PUVmax). El valor PEM de captación media (PUVmean) se refiere a la captación fisiológica del fondo, que se obtiene al trazar un ROI en un área normal del tejido mamario11,12,22.
El índice lesión-fondo (LTB) es la relación que existe entre el PUVmax del tumor y el PUVmean de la captación fisiológica de fondo. El software del visualizador DICOM lo calcula automáticamente y se utiliza para el análisis semicuantitativo de la lesión. El parámetro convencional para la caracterización de las lesiones es el LTB; sin embargo, algunos estudios afirman que el PUVmax es un indicador superior para el análisis semicuantitativo11,22.
Aunque el sistema BI-RADS® aún no incluye PEM, es necesario utilizar terminología estandarizada para describir los hallazgos, lograr interpretaciones consistentes y facilitar la comunicación entre el radiólogo y el médico tratante3. El léxico propuesto es análogo al BI-RADS® de RM incluye nomenclaturas para la localización, las características, el tamaño, la captación de la lesión (cualitativa y semicuantitativa) y de la homogeneidad del fondo. La evaluación cualitativa de la captación de fondo se clasifica como: mínima, leve, moderada o intensa y se debe especificar si es homogénea o heterogénea11,12.
Reporte radiológico. Conducta diagnósticaEl reporte radiológico debe incluir: técnica del estudio, limitaciones, glucosa sérica, sitio de inyección y dosis de 18FDG, duración del tiempo de captación tisular (período de reposo de la paciente), proyecciones mastográficas adquiridas, tiempos de escaneo, valores de captación, impresión diagnóstica, categoría BI-RADS® y recomendaciones8,11,12.
Las áreas de captación anormales (focos calientes) deben incluir la medición de los 3 diámetros de la lesión; si existen áreas sospechosas en piel y ganglios axilares, deben describirse. No existe un valor de corte absoluto en la captación de una lesión para determinar si esta es maligna; sin embargo, un LTB ≥ 2.5 tiene mayor asociación con malignidad. Los cánceres mamarios de alto grado tienen valores PUVmax significativamente más elevados que los de bajo grado11,22.
Una lesión positiva es aquella que tiene captación incrementada en comparación con la del parénquima adyacente y se considera sospechosa de malignidad; una negativa no tiene captación del radiofármaco. Siempre deberá correlacionarse con estudios de imagen convencionales4,7,9,11. Una lesión de morfología irregular tiene un alto valor predictivo de malignidad11,12.
La categorización con el sistema BI-RADS® se sustenta en la captación semicuantitativa, así como en la morfología de la lesión, y debe asignarse conjuntamente con los hallazgos de los estudios de imagen primarios. La categoría 3 (probablemente benigna) no es apropiada; cuando exista duda es preferible asignar BI-RADS® 4 y realizar biopsia4,9,11. Una PEM negativa en un tumor sospechoso no excluye continuar estudiando la lesión. Algunos carcinomas lobulillares caracterizados por baja actividad metabólica e hipovascularidad no se visualizan con PEM7.
Biopsia guiada por mastografía por emisión de positronesLa biopsia mamaria guiada por imagen es el estándar de referencia para la evaluación histológica de las lesiones. Dado que el 15% de los tumores solo se visualizan con PEM, la biopsia guiada por este método debe ponerse en práctica7,11,13. En el 89% de los casos es posible realizarla el mismo día del estudio inicial25. El navegador estereotáxico del equipo apunta automáticamente hacia el objetivo de interés, lo cual permite una adecuada localización y muestreo de la lesión hipercaptante; al finalizar, se coloca un clip de titanio (fig. 6)4,5,25.
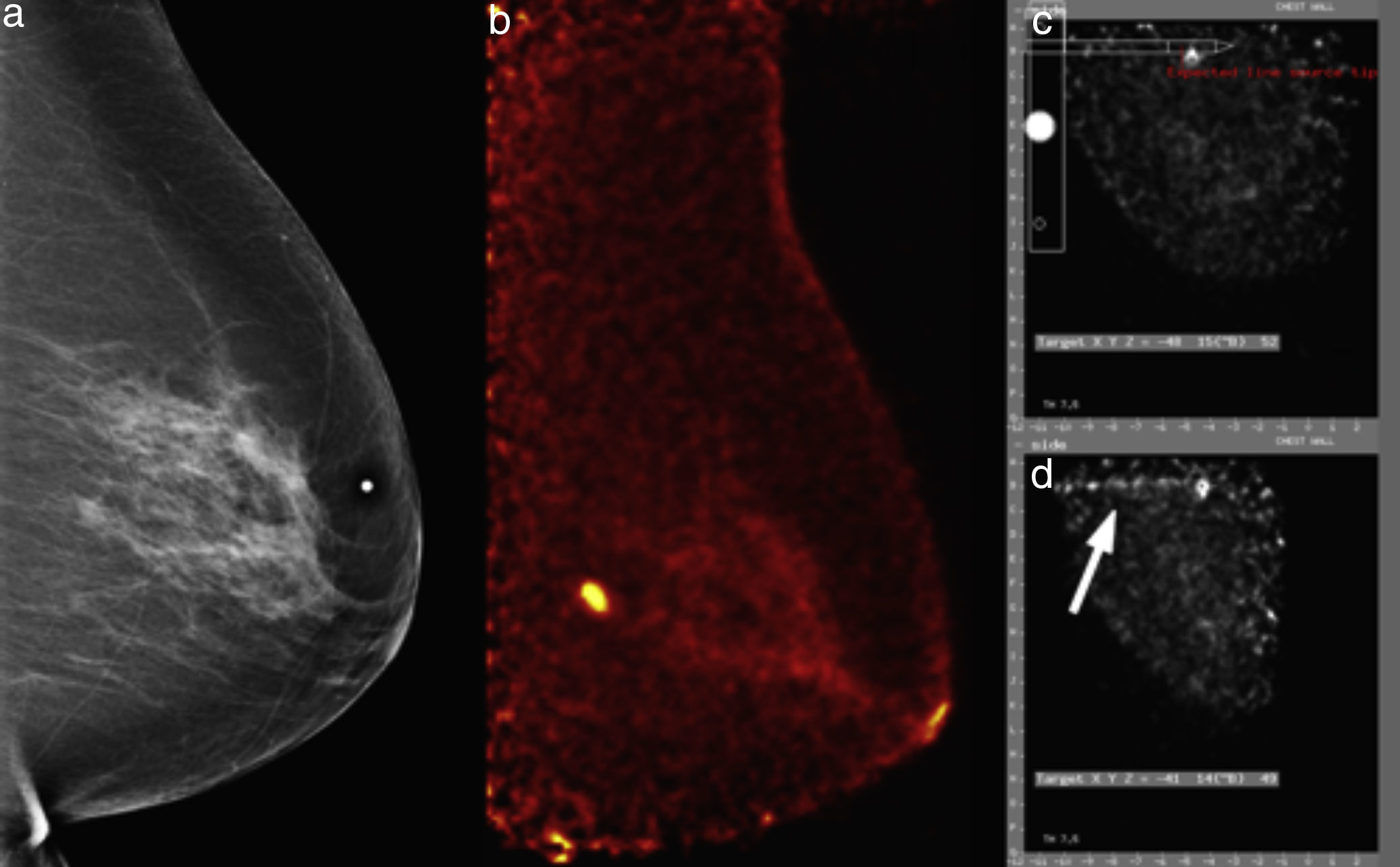
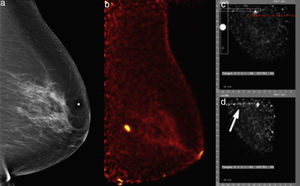
Mujer de 60 años, nulípara, estudio de escrutinio. a) Mastografía digital: pequeña masa ovoidea microlobulada en cuadrante superointerno, BI-RADS 4C. b) PEM: lesión hipercaptante de 5mm, LTB 8.56. Se realiza biopsia por PEM asistida por el software del equipo. c) Posicionamiento estereotáxico de la lesión. d) Confirmación de la guía de germanio en sitio (flecha blanca). El estudio histopatológico confirmó carcinoma ductal invasivo triple negativo.
Se efectuará la biopsia por PEM únicamente en aquellas lesiones visibles sólo por este método, de lo contrario, se prefieren los métodos primarios (mastografía y ultrasonido).
ConclusiónA pesar de los continuos avances en el diagnóstico y el tratamiento, el cáncer de mama es aún un alarmante problema de salud pública mundial. La mastografía convencional continúa siendo la piedra angular en la detección y el diagnóstico del carcinoma mamario, sin embargo, nuevas tecnologías proveen valiosa información del aspecto molecular del tumor, con la consiguiente detección de lesiones pequeñas, en etapas más tempranas, con adecuada etapificación y mejor planeación quirúrgica, así como disminución de la morbimortalidad.
La PEM es una herramienta altamente sensible y específica, útil para la etapificación del cáncer mamario, sobre todo en aquellas pacientes programadas para cirugía conservadora, así como para valorar recurrencia vs. cambios posquirúrgicos y monitorización de la respuesta quimioterapéutica neoadyuvante; lo anteriormente mencionado contribuye a un abordaje más preciso del tratamiento del cáncer mamario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.