El cáncer cervicouterino es una de las neoplasias que ocupa las primeras causas de muerte en la mujer a nivel mundial, especialmente en países subdesarrollados. Los factores de riesgo asociados guardan estrecha relación con conductas como el inicio de la vida sexual a edad temprana, la multiparidad, la promiscuidad sexual y, especialmente, las infecciones de transmisión sexual como la causada por el virus del papiloma humano (VPH).
Aunque tradicionalmente se ha relacionado al VPH-16 y 18 con los principales agentes etiológicos de lesiones precancerosas, estudios recientes sobre la prevalencia del VPH en la población mexicana han identificado que la distribución del tipo de virus es diferente en distintas regiones del país, especialmente en el sur del mismo. En cuanto al tipo de VPH más prevalente en mujeres mexicanas, se identificó al 16 en dos de cada tres mujeres.
En la última década se han logrado importantes avances en el campo de la inmunización, lo cual ha permitido que se disponga de dos vacunas para brindar protección contra esta infección de transmisión sexual. Evidencia científica surgida de estudios clínicos ha permitido que esta medida preventiva no solo beneficie a la mujer, sino también extender los beneficios al hombre como protagonista del mecanismo de transmisión y de esta manera en un futuro mediato se observe una disminución en la incidencia y la mortalidad por este tipo de cáncer.
Cervical cancer is considered to be one of the leading causes of death in women worldwide, especially in developing countries. Associated risk factors are closely related to behaviour, such as an early start of sexual life, multiparity, sexual promiscuity and, more specifically, sexually transmitted infections, such as those caused by the human papillomavirus (HPV).
Although HPV-16 and 18 have traditionally been regarded as the main aetiological agents of pre-cancerous lesions, recent studies on HPV prevalence in the Mexican population have found that the distribution of virus types is different in different regions of the country, especially in southern regions. With regard to the most prevalent type of HPV in Mexican women, type 16 was identified in two out of every three women.
In the last decade, important advances have been achieved in the field of immunisation. This has allowed for two vaccines to be available to offer protection against this sexually transmitted infection. Scientific evidence from clinical trials has allowed for this preventive action to benefit not only women, but also to extend this benefit to men –as participants in the transmission mechanism–, in order to decrease the incidence and mortality associated with this cancer in the medium-term.
El principal factor etiológico del cáncer cervicouterino es el virus del papiloma humano (VPH). Se sabe que el 70% de los casos son causados principalmente por los tipos 16 y 18, en tanto que los otros tipos de alto riesgo corresponden al VPH 31, 33, 45 y 581. En fechas recientes, en México se han realizado estudios donde se ha podido identificar que existen diferencias regionales en cuanto a la prevalencia del tipo de VPH2, hallazgo que permitirá el desarrollo de nuevas vacunas para la protección específica de la población femenina del sudeste mexicano.
La prevención representa una oportunidad en el caso del cáncer cervicouterino, ya que debido al periodo de evolución que existe entre la lesión primaria y la etapa invasiva, es factible tomar medidas para prevenirlo, detectarlo y tratarlo de manera oportuna y específica, y que además permitan proporcionar una mejor calidad de vida a las pacientes en este grupo poblacional. El desarrollo de vacunas profilácticas permitirá disminuir las tasas de mortalidad por este padecimiento en un futuro mediato, además de que su reciente indicación en la población masculina también será un parteaguas en el control del cáncer cervicouterino.
El presente trabajo tiene como objetivo revisar el avance del conocimiento relativo a aspectos epidemiológicos, de prevención y detección oportuna del cáncer cervicouterino con fines de divulgación y para promover la prevención de este devastador padecimiento.
Magnitud del cáncer cervicouterinoEl cáncer cervicouterino es una de las principales causas de muerte a nivel mundial, con cifras que alcanzan 266,000 fallecimientos de mujeres cada año, los cuales suceden en su mayoría en países de ingresos bajos y medios1. Hasta el 86% de los casos y el 88% de las muertes ocurren en países en vías de desarrollo3. En América Latina, los países más afectados son Nicaragua, Honduras, El Salvador y Bolivia, con tasas de incidencia superiores a 35 por 100,000 habitantes. En cuanto a la mortalidad, Puerto Rico es el único país que ha mantenido una tasa de 4 muertes por 100,000 en las últimas cuatro décadas3.
En México, el cáncer cervicouterino ocupa el segundo lugar entre las neoplasias en la mujer y constituye uno de los principales problemas de salud pública, con una incidencia del 15.5% y una mortalidad del 12.8%4. Se refiere que, en 2008, 10,186 mujeres mexicanas desarrollaron cáncer de cuello uterino y 5,061 fallecieron a causa de este mal5. GLOBOCAN reportó que la incidencia de cáncer de cuello uterino en mujeres de 39 años de edad es del 16.7%, considerando esta cifra tan alta como las de otros países en desarrollo2. Al interior del país se observa una disparidad en las tasas de mortalidad, donde la población de la región norte es la menos afectada, con tasas que van de 5.3 a 7.9, en tanto que la región central registra tasas de 10.8-12.6 y la región sur es la que destaca, con tasas hasta de 15.4-17.53. Estas cifras muestran un panorama epidemiológico que refleja diferencias importantes que pueden tener su explicación en factores socioculturales como el analfabetismo, la natalidad y accesibilidad a los servicios de salud, los cuales deberán estudiarse con mayor profundidad.
Estudios recientes permiten identificar que las diferencias en las tasas de mortalidad también se ven reflejadas en la distribución de los tipos del VPH5. En un metaanálisis con 8,706 casos se encontró que la prevalencia del VPH muestra particularidades en las regiones norte, centro y sur de México. En el norte del país se identificaron con mayor frecuencia los serotipos 16, 58, 18 y 33 del VPH, mientras que en la región central se registraron los tipos 16, 18, 45 y 58 del VPH. En la región sur se observó la presencia de los tipos 16, 18, 31 y 58 del VPH. Estos hallazgos son de enorme relevancia puesto que permitirán diseñar políticas de prevención específicas para cada grupo poblacional, especialmente con el desarrollo de vacunas.
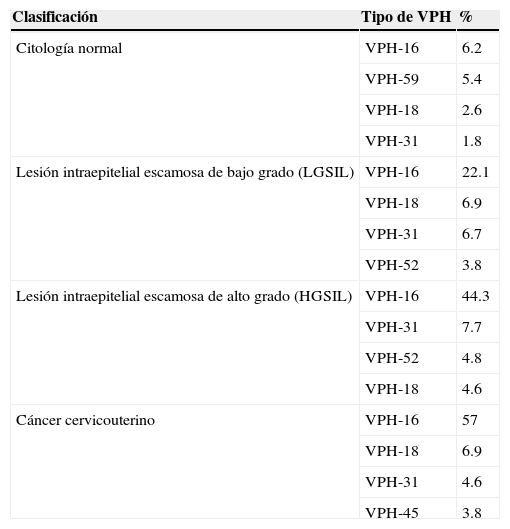
Respecto a la prevalencia del tipo del VPH por grado de lesión, se realizó un estudio en pacientes de clínicas que atienden displasias en diferentes estados de la República Mexicana, en el que se incluyeron 2,956 muestras, identificándose el VPH en 1,986, lo cual representó el 67.1%4. La prevalencia del VPH con base en la clasificación de las pacientes en el momento de incluirlas en el estudio fue: 1) citología normal: se encontró VPH en 344 de 1,020 muestras (33.8%); 2) lesión intraepitelial escamosa de bajo grado: se identificó VPH en 720 de 931 muestras (77.3%); 3) lesión intraepitelial escamosa de alto grado: se observó VPH en 445 de 481 muestras (92.4%); 4) cáncer cervicouterino: se registró VPH en 477 de 524 muestras (91.2%) (tablas 1 y 2).
Prevalencia de VPH oncogénico por tipo de lesión en mujeres mexicanas
| Clasificación | Tipo de VPH | % |
|---|---|---|
| Citología normal | VPH-16 | 6.2 |
| VPH-59 | 5.4 | |
| VPH-18 | 2.6 | |
| VPH-31 | 1.8 | |
| Lesión intraepitelial escamosa de bajo grado (LGSIL) | VPH-16 | 22.1 |
| VPH-18 | 6.9 | |
| VPH-31 | 6.7 | |
| VPH-52 | 3.8 | |
| Lesión intraepitelial escamosa de alto grado (HGSIL) | VPH-16 | 44.3 |
| VPH-31 | 7.7 | |
| VPH-52 | 4.8 | |
| VPH-18 | 4.6 | |
| Cáncer cervicouterino | VPH-16 | 57 |
| VPH-18 | 6.9 | |
| VPH-31 | 4.6 | |
| VPH-45 | 3.8 |
Fuente: Salcedo et al.4.
Prevalencia de VPH de bajo riesgo por tipo de lesión en mujeres mexicanas
| Clasificación | Tipo de VPH | Rango de % |
|---|---|---|
| Lesión intraepitelial escamosa de alto grado (HGSIL) | VPH- 54, 6, 83, 69, 70 | 2.7-1.0 |
| Cáncer cervicouterino (CC) | VPH-11VPH-6 | 0.80.6 |
Fuente: Salcedo et al.4.
Los autores extrajeron conclusiones interesantes que requieren profundizar en el estudio de este padecimiento, entre ellas, el hallazgo de que el VPH 16 estuvo presente en 2 de cada 3 pacientes con cáncer cervicouterino (57%). El VPH-18 solo se detectó en < 8% de los casos de cáncer cervicouterino. Su baja prevalencia se puede deber al daño que ocasiona el VPH-18 en la estructura celular, lo cual ocasiona su muerte y por ende su eliminación, además de la inestabilidad genómica generada por la expresión del genoma del VPH-18.
Otro estudio que es importante mencionar es el referente al análisis de la prevalencia por tipo específico de VPH y de VPH con coinfección, realizado en 902 mujeres mexicanas clasificadas en tres grupos: sin lesiones del cuello uterino (controles), con lesiones premalignas y un tercer grupo con cáncer cervicouterino2. El estudio se llevó a cabo en clínicas ginecológicas de las ciudades de Monterrey, Guadalajara, Tepic, Ciudad de México, Metepec y Tlaxcala. Se aplicó un cuestionario a las participantes a fin de conocer su historia sexual y reproductiva y se les tomaron muestras del epitelio del cuello uterino para realizar pruebas de escrutinio y de genotipificación del VPH. Los resultados mostraron la presencia de infección por VPH en el 12.4% en el grupo de control, en el 46.0% de las muestras de neoplasia intraepitelial grado 1 y en el 100% de las muestras de neoplasia intraepitelial grado 3 y de cáncer cervicouterino. El VPH-16 fue el genotipo más prevalente y se detectó en todos los grupos: 3.1, 9.8 y 40.0%, respectivamente.
Factores de riesgoDurante la pubertad y el embarazo, la zona del ectocérvix se amplía, lo cual facilita la exposición al VPH y, por tanto, la infección. Esta situación explica por qué el inicio de la vida sexual activa y el primer embarazo a edades tempranas, así como la multiparidad, son de los factores de riesgo más fuertemente asociados al desarrollo de cáncer cervicouterino, además del hecho de tener múltiples parejas que a su vez tienen parejas con múltiples parejas. A este respecto, se encontraron en la población mexicana como factores de riesgo asociados a neoplasia intraepitelial grado 3 y cáncer cervicouterino los siguientes: edad ≥ 18 años, > 6 embarazos y ≥ 3 partos2.
Existen condiciones que promueven la persistencia de la infección por VPH como1:
- •
El tipo de VPH.
- •
El estado inmunitario, puesto que las personas con afecciones inmunitarias son más propensas a desarrollar infecciones persistentes por VPH y progresión acelerada a lesiones premalignas y cáncer.
- •
Coinfección con otras infecciones de transmisión sexual como herpes simple, clamidia y gonorrea.
- •
Tabaquismo.
- •
Uso de anticonceptivos orales durante más de cinco años.
La identificación del virus del papiloma humano como principal agente etiológico del cáncer cervicouterino ha permitido desarrollar diferentes medidas para su detección y prevención. Existen pruebas convencionales como la citología cervicovaginal, la cual ha permitido reducir la mortalidad en países desarrollados. Un ejemplo de esto es Europa y los Estados Unidos, donde se han realizado estudios acerca de la calidad de la prueba y cuyos resultados indican que tiene un 53% de sensibilidad (IC del 95%: 48.6-57.4%)3. Sin embargo, en América Latina la situación es distinta, puesto que a pesar de que la citología cervicovaginal está disponible incluso de manera gratuita en los servicios públicos de salud, como es el caso de México, no se han observado sus efectos en la disminución de la mortalidad por cáncer cervicouterino. Al respecto se señala que «el éxito no reside en la sensibilidad de la prueba, sino en la repetición constante de la misma y en el seguimiento sistematizado de mujeres con anormalidades citológicas»3. Dicha aseveración muestra la realidad de la situación en esta región del mundo.
Es así que la prevención del cáncer cervicouterino deberá contemplar líneas de acción dirigidas a la disminución de la incidencia, la morbilidad y la mortalidad, principalmente en grupos de mujeres de bajos recursos, en quienes se ha identificado inequidad en el acceso a programas de escrutinio, prevención y tratamiento.
Por tal motivo, la OMS recomienda que los programas nacionales para la prevención y control del cáncer cervicouterino deben tener la siguiente organización6:
- •
Desarrollo de políticas nacionales y establecimiento de una estructura.
- •
Planeación de un programa que incluya un sistema efectivo de referencia.
- •
Programa de implementación.
- •
Programa de monitorización y evaluación que incluya todos los niveles de atención.
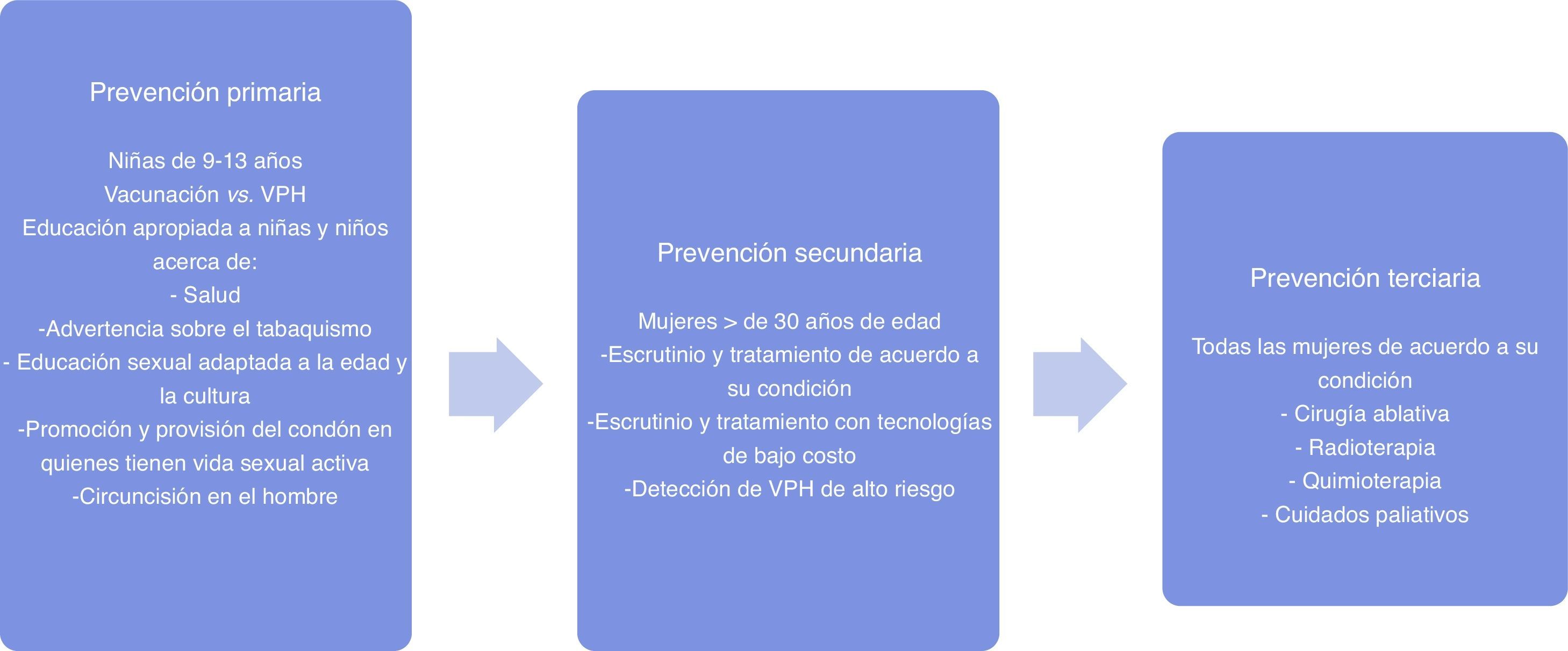
El objetivo principal de los programas de prevención y control del cáncer cervicouterino consiste en reducir la carga de la enfermedad por medio de la prevención y detección oportuna de la infección por el virus del papiloma humano, tratamiento de las lesiones premalignas y provisión de cuidados paliativos a las pacientes afectadas, como se describe en la figura 1.
Educación para la saludEl primer factor en la prevención es representado por la educación para la salud, definida como: el intercambio de información con el propósito de aumentar la conciencia y el conocimiento acerca de cómo mantenerse sano y prevenir enfermedades, incluyendo información sobre los recursos que están disponibles y los beneficios de acceder a los servicios de salud7. Al respecto, el Consenso para la Prevención del Cáncer Cervicouterino en México8, celebrado en 2011, propuso dos recomendaciones generales: a) prevención primaria consistente en educación para la prevención del cáncer cervicouterino e inmunización universal y b) prevención secundaria de la enfermedad por medio de la detección temprana de infecciones o lesiones que pudieran favorecer la carcinogénesis.
En lo que se refiere a la educación para la salud, existen recomendaciones precisas para incrementar el conocimiento acerca del cáncer cervicouterino, entre las que se encuentran7:
- •
Informar a la población acerca del cáncer cervicouterino, sus causas e historia natural.
- •
Promover la vacuna contra el VPH en las niñas.
- •
Promover el escrutinio en las mujeres.
- •
Asegurar que las mujeres con resultados positivos reciban tratamiento cuanto antes.
- •
Aumentar el conocimiento acerca de los signos y síntomas del cáncer de cuello uterino y alentar a las mujeres a buscar atención si los experimentan.
- •
Abordar la ignorancia, el miedo, la vergüenza y el estigma relacionados con el VPH y el cáncer de cuello uterino.
El otro factor de prevención consiste en la inmunización. En la actualidad se encuentran disponibles dos vacunas que brindan protección contra el VPH-16 y el VPH-18, los cuales son causantes del 70% de los casos de cáncer cervicouterino (bivalente) y la que protege además contra el VPH-6 y el VPH-11, los cuales son causa del 90% de las verrugas genitales (tetravalente)9. En Estados Unidos, la vacuna ha sido monitorizada tras su comercialización, tanto por agencias federales como por los laboratorios que la producen, desde junio de 2006 hasta marzo de 2014, y durante este periodo se han aplicado aproximadamente 67 millones de dosis de la vacuna tetravalente. En el caso de la bivalente se han administrado 719,000 dosis a partir de octubre de 2009 y hasta marzo de 2014. Los efectos adversos documentados a partir de junio de 2006 y hasta marzo de 2014 han sido 25,176, lo cual demuestra que las vacunas contra el VPH son seguras9.
En cuanto a la duración exacta de la inmunidad inducida por la vacunación, aún continúa en seguimiento, pero es tranquilizador que en los 10 años posteriores al inicio de su administración no se ha registrado disminución de la inmunidad en las mujeres que recibieron la vacuna1. Existen estudios que refieren que después de 7.3 años de su aplicación, no se habían presentado casos de infección o lesiones citohistológicas asociadas a VPH-16/1810. Otro estudio realizado en 201111 que incluyó a 3,819 mujeres sin historial de enfermedad del cuello uterino o verrugas genitales en los cinco años previos a la inclusión, mostró en sus resultados que la vacuna produce una respuesta inmunitaria robusta en mujeres de 24-45 años de edad y que la seropositividad de cada uno de los cuatro tipos del VPH excedió del 97% cuatro semanas después de la tercera dosis. Al mes 48, las mujeres estudiadas seguían siendo seropositivas. Los autores concluyeron que la vacuna tetravalente es altamente eficaz en la prevención de enfermedades del aparato genital en mujeres de 45 años de edad con base en los cuatro años de seguimiento.
En otro estudio, con base en el resultado del análisis de tres estudios clínicos aleatorizados, a doble ciego y controlados con placebo para evaluar la eficacia profiláctica de la vacuna tetravalente en sujetos que previamente habían sido infectados con ≥ 1 de los serotipos contenidos en la vacuna, los autores identificaron seropositividad a VPH 6/11/16/18 en el 8.1, el 2.0, el 11.3 y el 3.7%, respectivamente, de la población de estudio12. Los sujetos fueron seguidos por un lapso de 40 meses y ninguno de los que recibieron la vacuna tetravalente desarrollaron enfermedad relacionada con los tipos virales contenidos en la vacuna identificados al momento de ser reclutados como seropositivos y ADN-negativos.
Con la finalidad de evaluar la respuesta inmunitaria contra los tipos 6, 11, 16 y 18 del VPHN tras la administración de la vacuna tetravalente en 52 mujeres (19 vacunadas contra VPH-16 y 33 con placebo) que habían recibido previamente la vacuna monovalente contra VPH-16, se realizó un estudio entre 2006 y 2009 en Washington, Estados Unidos13. Los resultados mostraron que el 89.5% de las mujeres inmunizadas con la vacuna monovalente y el 9.5% de las que recibieron el placebo presentaron seropositividad al VPH-16. Tras la administración de la primera dosis de la vacuna tetravalente, se observó un considerable incremento en los niveles de anticuerpos receptores del VPH-16 en ambos grupos. La seroconversión contra VPH 6, 11 y 16 resultó positiva pero no sucedió lo mismo con el VPH-18.
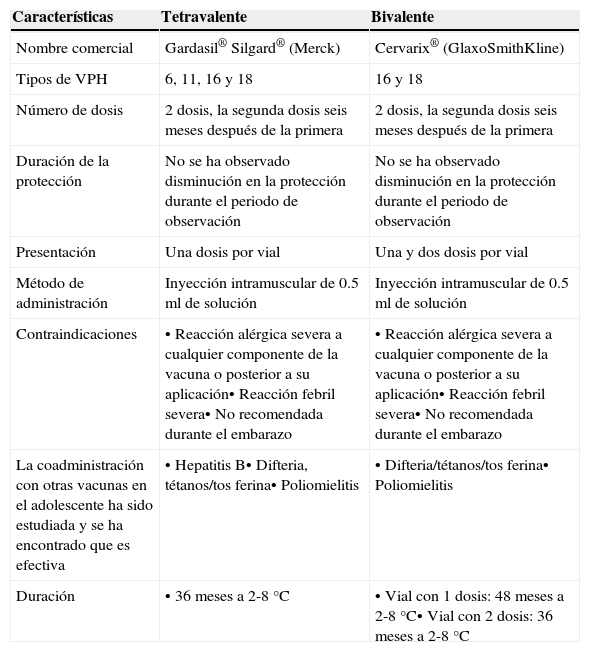
Con la finalidad de continuar la vigilancia posterior al otorgamiento de la licencia a la vacuna contra el VPH, en 2008, el Grupo de Expertos en Vacunas y Recomendaciones en Inmunización14 recomendó a los países considerar el establecimiento de un sistema de vigilancia para monitorizar el impacto de la vacunación en la prevalencia de los diferentes tipos de VPH, la incidencia de anormalidades y lesiones premalignas, la incidencia y mortalidad por cáncer invasivo y la incidencia de verrugas anogenitales en el caso de la vacuna tetravalente. En el seguimiento, diferentes autoridades de países del occidente de Europa recomendaron realizar estudios de vigilancia. En Estados Unidos, los Centros para el Control y Prevención de Enfermedades están monitorizando la seguridad y la efectividad de la vacuna tetravalente por medio de protocolos de estudio que tienen como objetivo evaluar la duración de la protección de la vacuna tetravalente, las repercusiones en la incidencia de verrugas anogenitales, la seguridad, la inmunogenicidad a largo plazo, las actitudes acerca de la vacunación contra el VPH y la carga de la enfermedad, entre otros aspectos (tabla 3)14.
Características de las vacunas contra el VPH
| Características | Tetravalente | Bivalente |
|---|---|---|
| Nombre comercial | Gardasil® Silgard® (Merck) | Cervarix® (GlaxoSmithKline) |
| Tipos de VPH | 6, 11, 16 y 18 | 16 y 18 |
| Número de dosis | 2 dosis, la segunda dosis seis meses después de la primera | 2 dosis, la segunda dosis seis meses después de la primera |
| Duración de la protección | No se ha observado disminución en la protección durante el periodo de observación | No se ha observado disminución en la protección durante el periodo de observación |
| Presentación | Una dosis por vial | Una y dos dosis por vial |
| Método de administración | Inyección intramuscular de 0.5ml de solución | Inyección intramuscular de 0.5ml de solución |
| Contraindicaciones | • Reacción alérgica severa a cualquier componente de la vacuna o posterior a su aplicación• Reacción febril severa• No recomendada durante el embarazo | • Reacción alérgica severa a cualquier componente de la vacuna o posterior a su aplicación• Reacción febril severa• No recomendada durante el embarazo |
| La coadministración con otras vacunas en el adolescente ha sido estudiada y se ha encontrado que es efectiva | • Hepatitis B• Difteria, tétanos/tos ferina• Poliomielitis | • Difteria/tétanos/tos ferina• Poliomielitis |
| Duración | • 36 meses a 2-8°C | • Vial con 1 dosis: 48 meses a 2-8°C• Vial con 2 dosis: 36 meses a 2-8°C |
Adaptado de: Comprehensive cervical cáncer control. A guide to essential practice. Chapter 4.15.
La OMS recomienda la vacunación contra el VPH por considerarla segura y eficaz para proteger contra el cáncer cervicouterino y emite las siguientes recomendaciones15:
- •
Está indicada en niñas de 9-13 años. Las niñas que reciben una primera dosis de la vacuna contra el VPH antes de la edad de 15 años pueden utilizar dos dosis.
- •
El intervalo entre las dos dosis debe ser de seis meses. No existe un intervalo máximo entre ambas dosis; sin embargo, se sugiere un intervalo no mayor de 12 a 15 meses. Si el intervalo entre las dosis es inferior a cinco meses, se debe administrar una tercera dosis al menos seis meses después de la primera dosis.
- •
Los individuos inmunocomprometidos, incluidos aquellos que cursan con infección por VIH, así como las mujeres de 15 años y mayores también deben recibir la vacuna y necesitan tres dosis (a los 0, 1-2, y 6 meses calendario) para estar completamente protegidos.
- •
La vacuna contra el VPH funciona mejor si se administra antes del inicio de la actividad sexual.
- •
Todas las niñas en el grupo de edad o en la clase de la escuela/grado/año identificadas como población objetivo por el programa nacional deben recibir la vacuna contra el VPH.
- •
Las niñas que ya son sexualmente activas también pueden recibir la vacuna contra el VPH, aunque tal vez su eficacia sea menor.
- •
No se recomienda la aplicación de la vacuna en mujeres embarazadas. En caso de embarazo durante el lapso de aplicación de la vacuna, deberá suspenderse su aplicación hasta el término del embarazo.
- •
En el caso de que la vacuna se aplique en una mujer embarazada de manera inadvertida, no se requiere intervención alguna, debido a que no contiene virus vivos y no se han observado problemas de salud en las mujeres ni en los niños en los casos en que se ha aplicado de manera incidental.
La OMS15 también emitió recomendaciones clave para los países acerca de la vacunación contra el VPH:
- •
Los países deben considerar la introducción de la vacunación contra el VPH cuando: el cáncer del cuello del útero u otras enfermedades relacionadas con el VPH, o ambos, constituyan una prioridad de salud pública.
- •
La introducción de vacunas es programáticamente factible cuando: puede asegurarse una financiación sustentable; la relación costo-eficacia de las estrategias de vacunación en el país o región ha sido considerada.
- •
La vacunación contra el VPH debe ser introducida como parte de una estrategia global coordinada para prevenir el cáncer de cuello uterino y otras enfermedades relacionadas con el VPH.
- •
La introducción de la vacuna contra el VPH no debe socavar o desviar fondos destinados al desarrollo o mantenimiento de programas de detección eficaces para el cáncer de cuello uterino.
- •
La vacunación contra el VPH produce una respuesta inmunitaria superior a la que produce la infección natural. A este respecto, los resultados de estudios muestran que existe una mayor producción de anticuerpos en niñas menores de 15 años que en aquellas que son vacunadas después de esta edad1.
- •
Las vacunas bivalente y tetravalente producen altos niveles de protección contra el cáncer por los tipos 16 y 18 del VPH en el 93-99% de las mujeres, lo cual en un futuro reducirá de manera significativa los índices de casos nuevos de cáncer invasivo. En el caso de la tetravalente, además previene contra las verrugas anogenitales asociadas a VPH 6 y 11.
- •
La vacuna tetravalente ha sido evaluada ampliamente por medio de protocolos distintos y en diferentes contextos, lo cual ha permitido establecer su seguridad y eficacia14.
Los autores del presente trabajo no recibieron ningún patrocinio para llevarlo a cabo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.