En México el cáncer de mama ocupa el primer lugar en mortalidad por neoplasias en mujeres mayores de 25 años, representando 70% los tumores localmente avanzados. La decisión terapéutica se basa en la actividad ganglionar, el estatus de receptores del tumor, tamaño del tumor primario y el estadio al momento del diagnóstico. Un nuevo predictor es el gen HER-2/neu, que ha evolucionado a un marcador pronóstico y objetivo terapéutico. La literatura reporta una tasa de expresión en un rango del 9% al 74%, con una media de riesgo relativo para sobrevida de 2.74.
ObjetivoDeterminar la prevalencia de HER-2/neu positivo en cáncer de mama localmente avanzado.
Material y métodosEstudio retrospectivo, de cohorte histórica. Se incluyeron los expedientes de pacientes con cáncer de mama localmente avanzado, de género femenino mayores de 18 años atendidas de junio de 2008 hasta enero de 2014, con inmunohistoquímica para receptores de estrógeno, progesterona y HER-2/neu positivo, que establezca el sitio de metástasis.
ResultadosDe los 182 expedientes incluidos se encontró expresión de HER-2/neu en un 19.7%, con recaída en el 36%. El principal sitio fue óseo, representando el 30.7%, de este el 15.3% con recaída en los primero 12-24 meses, seguido de pulmón y múltiples sitios en un 23%, al sistema nervioso central 15% y al locorregional en un 7.7%.
ConclusionesLa frecuencia de HER-2/neu en pacientes con cáncer de mama localmente avanzado fue del 19.7%, con mayor recaída a nivel óseo. Se observó una mayor recaída en la histología lobulillar, el estado de los receptores y el estado menopáusico.
Breast cancer is the first cause of death due to malignancies in women over 25 years old, with 70% of the tumours being locally advanced. The therapeutic decision is based on lymph node activity, receptor status, size of the primary tumour, and the clinical stage at the time of diagnosis. A new predictor is the HER-2/neu gene, which has emerged as a prognostic marker and therapeutic target. Literature reports an expression range from 9% to 74%, with an average relative risk of 2.74 for overall survival.
ObjectiveTo determine the prevalence of HER-2/neu gene in patients with locally advanced breast cancer.
Material and methodsA retrospective study, historical cohort was conducted on females older than 18 years of age with the diagnosis of locally advanced breast cancer, who were attended from June 2008 to January 2014. They had to have immunohistochemistry performed for hormonal receptors and positivity for HER-2/neu, as well as a known site of metastasis.
ResultsOf the 182 files included, an expression of 19.7% of HER-2/neu was found, with a tumour recurrence in 36%. The major site was bone, with 30.7%, of which 15.3% had a recurrence within 12-24 months, followed by lung and multiple sites in 23%, central nervous system in 15%, and locoregional in 7.7%.
ConclusionsThe frequency of HER-2/neu in locally advanced breast cancer was 19.7%, with a major site of relapse to bone. There was also an increased occurrence with lobular histology, the type of receptor status, and menopause.
El cáncer de mama es el segundo cáncer más frecuente en todo el mundo, y por mucho el cáncer más frecuente en el género femenino, con una estimación de 1.67 millones de nuevos casos diagnosticados en 2012 (25% de todos los cánceres). Es el cáncer más común en mujeres tanto en países desarrollados (794,000 casos) como subdesarrollados (883,000 casos). Las tasas de incidencia varían por regiones, desde 27 por 100,000 habitantes en África y Asia Oriental, hasta 96 en Europa Occidental. El cáncer de mama representa la quinta causa de muerte de todos los cánceres, representando 324,000 muertes, 14.3% del total1. En México el cáncer de mama actualmente ocupa el primer lugar como causa de muerte por neoplasias malignas en las mujeres de más de 25 años. En el año 2009 el número de defunciones registradas fue de 4,964, con una tasa de mortalidad de 17.0 por 100,000 mujeres de 25 y más años, lo que representa un incremento del 30% en los últimos 20 años. El porcentaje promedio de diagnósticos, de acuerdo con el estadio clínico, es el siguiente: estadios 0 y i, 7.4%; estadio ii, 34.4%; estadios iii y iv, 42.1%; no clasificable, 16.1%; ocupando hasta en un 70% al momento del diagnóstico los tumores localmente avanzados el cual abarca estadios clínicos IIB hasta el IIIC2,3.
Las decisiones del tratamiento individualizado actualmente se basan en la actividad ganglionar, el estatus de receptores de estrógenos y progesterona en el tumor, el tamaño del tumor primario y el estadio al momento del diagnóstico. A pesar de estos factores se carece de predictores que con mayor exactitud determinen el pronóstico de la enfermedad. Por ello se tiene la necesidad de nuevos marcadores, entre ellos factores que involucran la amplificación y sobreexpresión de protooncogenes. Uno de estos genes, el gen HER-2, fue descubierto inicialmente como resultado de estudios con ADN de neuroglioblastomas procedentes de ratas, inducidos por el carcinógeno etinil-nitrosa-urea. Este gen ha sido clonado por diversos grupos recibiendo nombres como neu, c-erbB-2, HER-2 o HER-2/neu4.
El oncogén del receptor del factor de crecimiento epidérmico humano (HER-2) codifica un receptor de la tirosina cinasa transmembranal, miembro de la familia de receptores del factor de crecimiento epidérmico humano (HER-1/EGFR, HER-2, HER-3 y HER-4), el cual ha evolucionado a un marcador mayor pronóstico para el cáncer de mama invasivo y como objetivo terapéutico para el mismo. En numerosos estudios se ha confirmado que la amplificación o la expresión de sus productos se encuentra expresada en el 10% al 40% de los casos de cáncer de mama primario. Se ha reportado en un metaanálisis, con una participación de 39,730 pacientes, una tasa positiva para expresión de HER-2 con un promedio de 22.2% (rango del 9% al 74%) y riesgo relativo de sobrevida global de 2.74 (intervalo: 1.39 a 6.93), con una mediana de 2.33; para sobrevida sin enfermedad la media de riesgo relativo fue de 2.04 y mediana de 1.85,6. En México, en un estudio que incluyó 893 pacientes de 24 a 94 años, realizado en el Hospital de Ginecología y Obstetricia 3, se reportó la sobrexpresión de HER-2 en el 16.7%7.
El gen del receptor del factor de crecimiento epidérmico humano (HER-2, HER-2/neu, c-erb B-2) fue descubierto por primera vez por Weinberg et al. en 1984, localizado en el cromosoma 17q21, el cual codifica la proteína del receptor tirosín cinasa transmembranal6,8. Slamon et al. lo describieron primero como un oncogén de amplificación en el cáncer de mama7. Este tipo de receptores participan en la comunicación entre célula y célula, y entre célula y estroma, en el proceso de transducción de señales, por el cual los factores de crecimiento externos afectan la transcripción de varios genes, que tienen como finalidad la activación enzimática, afectando la proliferación, sobrevida, motilidad y adhesión celular mediante las vías de transducción de señales como la vía de la proteína cinasa activada por RAS/mitógeno, la vía de la cinasa del fosfatidilinositol 3¿ (PI3K)/Akt, la vía del transductor y activador de la transcripción de la cinasa y señal de Janus, y la vía de la fosfolipasa C gamma5,6.
La activación del receptor depende de la unión del ligando a un receptor (receptor del factor de crecimiento epidérmico), el receptor se dimeriza con varios miembros de la familia (HER-2, HER-3, HER-4), el cual activa la fosforilación y la cascada de señalización. El receptor HER-2 es el compañero preferido para la dimerización, son más estables y su señal más potente que los otros. La sobreexpresión de este gen y de su proteína (HER-2) se ha visto en el 10-34% de los cánceres de mama invasivos, con una gran relación entre la proliferación celular, la motilidad celular, el grado de invasión del tumor, las metástasis regionales y a distancia, la angiogénesis acelerada, la disminución de la apoptosis, la relación con un grado histológico intermedio o alto, la carencia de receptores de estrógeno y progesterona5,9. Seshadri et al., en un estudio que incluyó 1,056 muestras de cáncer de mama, en las cuales se realizó amplificación de HER-2, se confirmó una correlación entre el número de ganglios involucrados, el estadio clínico, el subtipo histológico, la ausencia de receptores hormonales asociados al grado de amplificación de dicha proteína, así como una disminución en la sobrevida libre de enfermedad, esta última independiente del estatus ganglionar, tamaño tumoral o estatus de receptores estrogénicos8. Tandon et al., en 1989, en 728 muestras, con seguimiento de 50 meses, analizaron los niveles de HER-2, y se correlacionaron con la sobrevida libre de enfermedad, siendo estadísticamente significativa la reducción de la sobrevida cuanto más altos estos eran4. Además, en algunos estudios, pacientes con sobreexpresión del gen HER-2/neu están relacionados con una mala respuesta a la terapia endocrina, de forma específica con tamoxifeno, aun en pacientes con tumores con receptores hormonales positivos9.
El estatus positivo de HER-2/neu en relación con las diversas enfermedades mamarias, entre las que se encuentra el carcinoma ductal in situ en el subtipo de alto grado con enfermedad multifocal y con necrosis de comedón; en el carcinoma lobular invasivo se presenta una menor tasa de positividad (<10%); en la enfermedad de Paget prácticamente positivos en todos los casos; raros casos de carcinomas mucinosos positivos a HER presentan un curso clínico agresivo; el cáncer de mama hereditario relacionado con mutaciones de las líneas germinales en BRCA 1 o BRCA 2 presentan menor incidencia de positividad a HER-2/neu que la enfermedad esporádica. En el estatus de HER-2 entre el tejido del tumor primario y el metastásico se ha encontrado una fuerte consistencia, con reportes de tasas de discordancia de 20-30%5.
El cáncer de mama metastásico HER-2/neu positivo conserva el fenotipo del tumor primario, así como la expresión ausente para receptores de progesterona y estrógenos, el grado de moderado a alto, aneuploidía del ADN y la histología ductal mayor que la lobular, con sitios principales de diseminación antiguamente reportados a vísceras como ganglios linfáticos, médula ósea, pulmones, hígado, glándulas suprarrenales y ovarios. Actualmente, con el advenimiento de la terapia dirigida contra el HER-2/neu positivo, los principales sitios de metástasis se reportan al sistema nervioso central, con disminución de la incidencia a las vísceras; esto sustentado por la incapacidad de ciertas terapias biológicas para atravesar la barrera hematoencefálica5. Actualmente el cáncer de mama se estima que representa el segundo tumor causante de metástasis cerebrales, siendo diagnosticadas en aproximadamente el 6% al 16% del cáncer de mama metastásico, en autopsias incrementando hasta en un 18% al 30%10.
Parte de la mayor incidencia de metástasis al sistema nervioso central (SNC) puede ser la mayor afinidad del cáncer de mama que sobreexpesa HER-2/neu por el SNC. Otra alternativa es que la terapia actual con trastuzumab prolonga tanto la sobrevida hasta el punto de que son factibles las metástasis al SNC, asociado a una enfermedad metastásica tardía. Otro de los factores de riesgo asociados es el estatus negativo del cáncer de mama para receptores de estrógenos. Estudios han demostrado la incapacidad de trastuzumab para atravasar la barrera hematoencefálica, la cual limita la penetración de moléculas de aproximadamente 200Da (trastuzumab 185kDa)10,11.
En un seguimiento de 8 años después del tratamiento primario de cáncer de mama, la incidencia de metástasis al SNC fue de 1.7% en pacientes HER-2/neu negativo, mientras que en aquellos positivos representó hasta el 8%. En otro estudio, en el cual se analizaron 198 pacientes, el intervalo entre el diagnóstico del tumor primario y las metástasis cerebrales fue una media de 32.3 meses11.
Tratamiento dirigido contra HER-2/neu y tratamiento del cáncer de mama HER-2/neu positivoTrastuzumabEl trastuzumab es un anticuerpo monoclonal murino humanizado IgG creado mediante técnicas recombinantes, que se une específicamente a la porción extracelular del receptor transmembranal de HER-2/neu. Inicialmente fue diseñado y lanzado al mercado en 1998, en un principio para pacientes con cáncer de mama avanzado en recaída que sobreexpresaban las proteínas HER-2/neu como tratamiento adyuvante y en el metastásico. Tiene varios mecanismos de acción, entre los que se encuentra la prevención en la activación de HER-2 y la proliferación en la señalización, efectos antiangiogénicos, citotoxicidad celular e interferencia con la reparación del ADN5,12.
El trastuzumab como monoterapia ha demostrado tener una respuesta del 35% como primera línea en el cáncer de mama metastásico, en comparación con una tasa de respuesta del 15% como segunda línea10. La adición de trastuzumab a quimioterapia (antraciclina más ciclofosfamida o un taxano) ha demostrado mayor tiempo hasta la progresión de la enfermedad (mediana 7.4 contra 4.6 meses; p<0.001); mayor tasa de respuesta objetiva (50% contra 32%, p<0.001), duración más prolongada de la respuesta (mediana 9.1 contra 6.1 meses, p<0.001), una tasa menor de defunciones a un año (22% contra 33%, p=0.008), una mayor duración de la sobrevida (mediana del tiempo de sobrevida 25.1 frente 20.3, p=0.01) y un riesgo 20% menor de muerte5,9,10.
En estudios fase iii, al utilizar varios fármacos citotóxicos en diversas combinaciones, dosis y orden de administración, al agregarse 12 meses con trastuzumab a la quimioterapia adyuvante, el tiempo de sobrevida libre de enfermedad fue de 33% a 52% mayor y el tiempo de sobrevida global fue de 34% a 41% mayor. Este incremento en la sobrevida libre de enfermedad fue independiente de las variables de edad, estatus ganglionar, estatus hormonal o tamaño del tumor en todos los estudios. En un estudio el trastuzumab como monoterapia alcanzó una tasa de respuesta total de >30% en los tumores positivos por inmunohistoquímica 3+ o FISH en cáncer metastásico13.
En la actualidad hay un interés creciente por el descubrimiento de biomarcadores que sirvan como predictores negativos de la respuesta a este tratamiento, no para detectar pacientes que tendrán respuesta al tratamiento, sino aquellos pacientes que se beneficiarán poco del mismo. La resistencia se ha definido como el fallo para lograr una respuesta completa patológica o una casi respuesta completa patológica. Estos biomaracores aun en protocolos de estudio, no validados, entre los que se encuentran6: número elevado de copias del gen HER-2, diseminación de proteína HER-2/neu, estatus de dimerización, estatus del receptor Fc y respuesta de citotoxicidad celular dependiente de anticuerpos (CCDA), deficiencia de PTEN y activación de la vía P13K, sobreexpresión de IGF-IR, sobreexpresión de MUC4: la expresión de MUC4 induce un obstáculo estérico de la unión de trastuzumab al receptor p185neu (HER-2), expresión de HER-2-p95, fenotipo basal, sobreexpresión de CD44, sobreexpresión del factor de crecimiento del endotelio vascular, miARN: la asociación de la expresión de miARN específicos con la respuesta al tratamiento hormonal y citotóxico sugiere que los biomarcadores de miARN de trastuzumab pudieran ser descubiertos pronto.
LapatinibLapatinib es un inhibidor dual de molécula pequeña (<1kDa) de las cinasas de tirosina del RFCE y de HER-2. Fue aprobado por la FDA en 2007 para usarse junto con capecitabina para el tratamiento de cáncer de mama metastásico HER-2 positivo que hubiera progresado a pesar del tratamiento estándar. En estudio fase iii la adición de lapatinib a capecitabina produjo una mediana más prolongada del tiempo hasta la progresión de 8.5 semanas (27.1 semanas contra 18.6 semanas para capecitabina sola; p=0.00013). Las tasas de respuesta fueron de 23.7% y 13.9%, respectivamente (p=0.017)5,11.
El principal objetivo de desarrollo de este fármaco es la eficacia potencial en caso de afectación del SNC en pacientes con cáncer de mama metastásico HER-2 positivo que progresan con esquemas basados en trastuzumab; el tratamiento de éxito de trastuzumab en la enfermedad visceral en el cáncer de mama metastásico ha enmascarado el problema clínico de la enfermedad progresiva en el SNC en pacientes HER-2 positivas, problema clínico no encontrado en la era previa al trastuzumab5.
Predicción de respuesta según el estatus de HER-2 y receptores a estrógenos y progestágenosLa relación entre cáncer de mama e influencia hormonal data de 1896, cuando Sir George Thomas Beatson (1848-1933), de Escocia, publicó en la revista Lancet un caso de disminución de tamaño de carcinoma de la glándula mamaria después de realizar oforectomía bilateral. En un estudio realizado en población mexicana, que determinó el estatus de receptores hormonales tanto en mujeres premenopáusicas como posmenopáusicas, se demostró que la frecuencia de receptores hormonales en población <50 años es similar a la población >50 años (66.6% contra 71.1%, en forma respectiva, con una diferencia estadística no significativa p=0.119). Esto teniendo implicaciones pronósticas, con mayor beneficio en aquellas que podrían recibir hormonoterapia, demostrándose un impacto en la sobrevida libre de enfermedad. En el mismo estudio también se determinó con la asociación del gen HER-2/neu, que se registró en el 31.7% de las pacientes con RH negativos, contra 22.6% en los RH positivos (p=0.003)9.
Existe una asociación reportada entre la alta prevalencia de RE y RPr negativos y la sobreexpresión del gen HER-2. Además, en algunos estudios, pacientes con sobreexpresión del gen HER-2 están relacionados con una mala respuesta a la terapia endocrina, de forma específica con tamoxifeno, aun en pacientes con tumores con receptores hormonales positivos. En mujeres con tumores con RE positivos, el uso de tamoxifeno se asocia con una reducción en el riesgo de recurrencia del 50% y una mortalidad del 28%; en pacientes que no se definió su estado en cuanto a los receptores hormonales, la reducción en el riesgo de recurrencia es del 37% y una mortalidad del 21% y, por último, en aquellas con tumores con RE negativos no se encontró ningún beneficio en la recurrencia ni en la mortalidad9.
HipótesisPor tratarse de un estudio descriptivo, cualitativo, no se formula hipótesis.
ObjetivoGeneralDeterminar la prevalencia de HER-2/neu positivo en pacientes con cáncer de mama localmente avanzado.
Específicos- 1.
Determinar los sitios de metástasis en pacientes con HER-2/neu positivo en cáncer de mama localmente avanzado.
- 2.
Establecer si el tratamiento con antraciclinas, taxanos y trastuzumab tiene correlación con la disminución del riesgo de recaída.
Al ser un estudio retrospectivo no se requiere determinar un tamaño de muestra. Se trata de un estudio descriptivo, retrospectivo, cualitativo, correlacional, de cohorte histórica.
Grupo de estudioExpediente clínico del género femenino, portadoras de cáncer de mama, con fecha de diagnóstico de cáncer de mama en el periodo de tiempo comprendido entre 2008 a 2014, con fecha de diagnóstico de metastásis, tipo de tratamiento y esquema utilizado.
Criterios de inclusiónPacientes de género femenino mayores de 18 años, con diagnóstico de cáncer de mama en estadios clínicos IIB a IIIC, diagnóstico corroborado histopatológicamente con reporte completo, realización de inmunohistoquímica para receptores de estrógeno, receptores de progesterona y HER-2/neu positivo, con quimioterapias previas y terapia dirigida anti HER-2/neu, pacientes donde se establezca el sitio de metástasis, diagnóstico en un periodo de tiempo de 5 años entre el año 2008 y 2014.
Criterios de exclusiónPortadores de otro tipo de neoplasias (no cáncer de mama), portadores de cáncer de mama con otra neoplasia primaria (sincrónicos), diagnóstico de cáncer de mama bilateral, estudio histopatológico incompleto, estudio inmunohistoquímico ausente o incompleto.
Criterios de eliminaciónPacientes que hayan perdido la derechohabiencia al ISSSTE, inicio de tratamiento dirigido contra el cáncer de mama fuera de esta institución.
Descripción general del estudioSe trata de una cohorte histórica de pacientes con cáncer de mama, diagnosticadas y tratadas entre los años 2008 a 2014 en el Hospital Regional General Ignacio Zaragoza del ISSSTE, en el servicio de oncología médica, de los cuales se determinaron cuántos se encontraban en estadio clínico localmente avanzado, y de estos la positividad de HER-2/neu. Se registraron en la hoja de recolección de datos de variables a investigar de cada expediente revisado.
Se revisaron 188 expedientes de pacientes con el diagnóstico de cáncer de mama localmente avanzado. De los 188 expedientes se eliminaron 5, de estos 4 por haber sido diagnosticadas y tratadas de forma inicial de manera extrainstitucional, y una por haber suspendido el seguimiento en la consulta de oncología médica; se excluyó un expediente por presentar 2 primarios de mama sincrónicos, analizándose de forma total 182 pacientes. Posteriormente se registraron en la hoja de recolección de datos las variables a investigar de cada expediente revisado. Una vez obtenidos los datos se examinaron individualmente la distribución de cada una de las variables, utilizando gráficas circulares y barras, para mostrar la información recolectada.
ResultadosDe los 182 expedientes incluidos con diagnóstico de cáncer de mama clasificados en estadio clínico como localmente avanzado, se encontró que de estos 36 pacientes (19.7%) expresaban el oncogén HER-2/neu, mientras que 146 pacientes (80%) eran negativas para este oncogén (tabla 1).
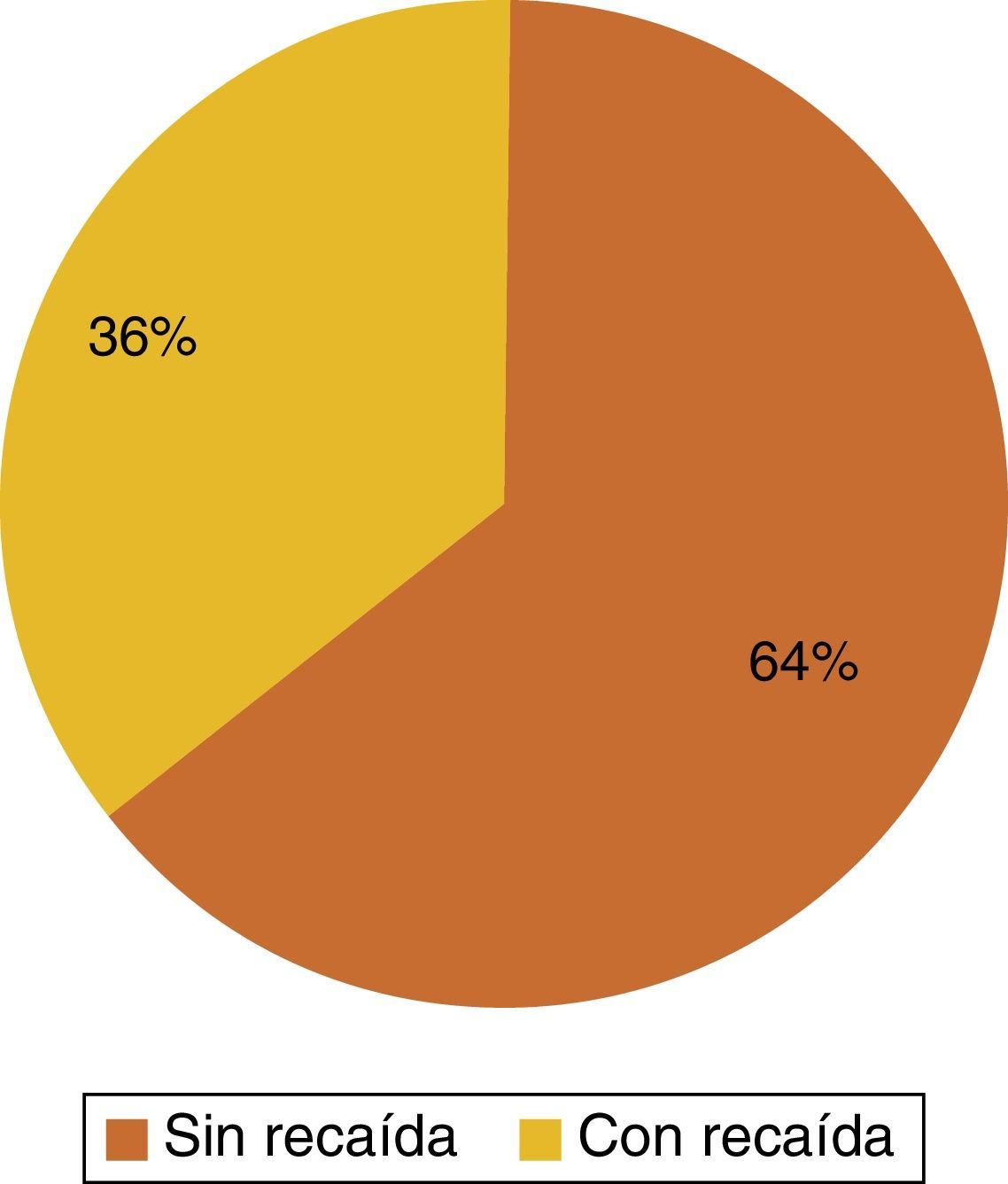
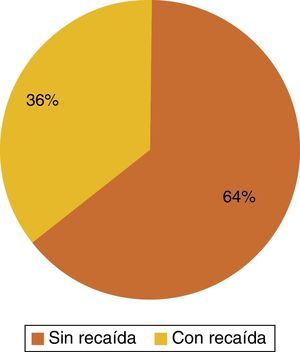
De las 36 pacientes con HER-2/neu positivo se observó recaída a diferentes sitios de metástasis en 13 pacientes, representando el 36% de los casos, mientras que en el 64% (23 pacientes) a su seguimiento a 5 años no han presentado recaída hasta el momento de este estudio (fig. 1).
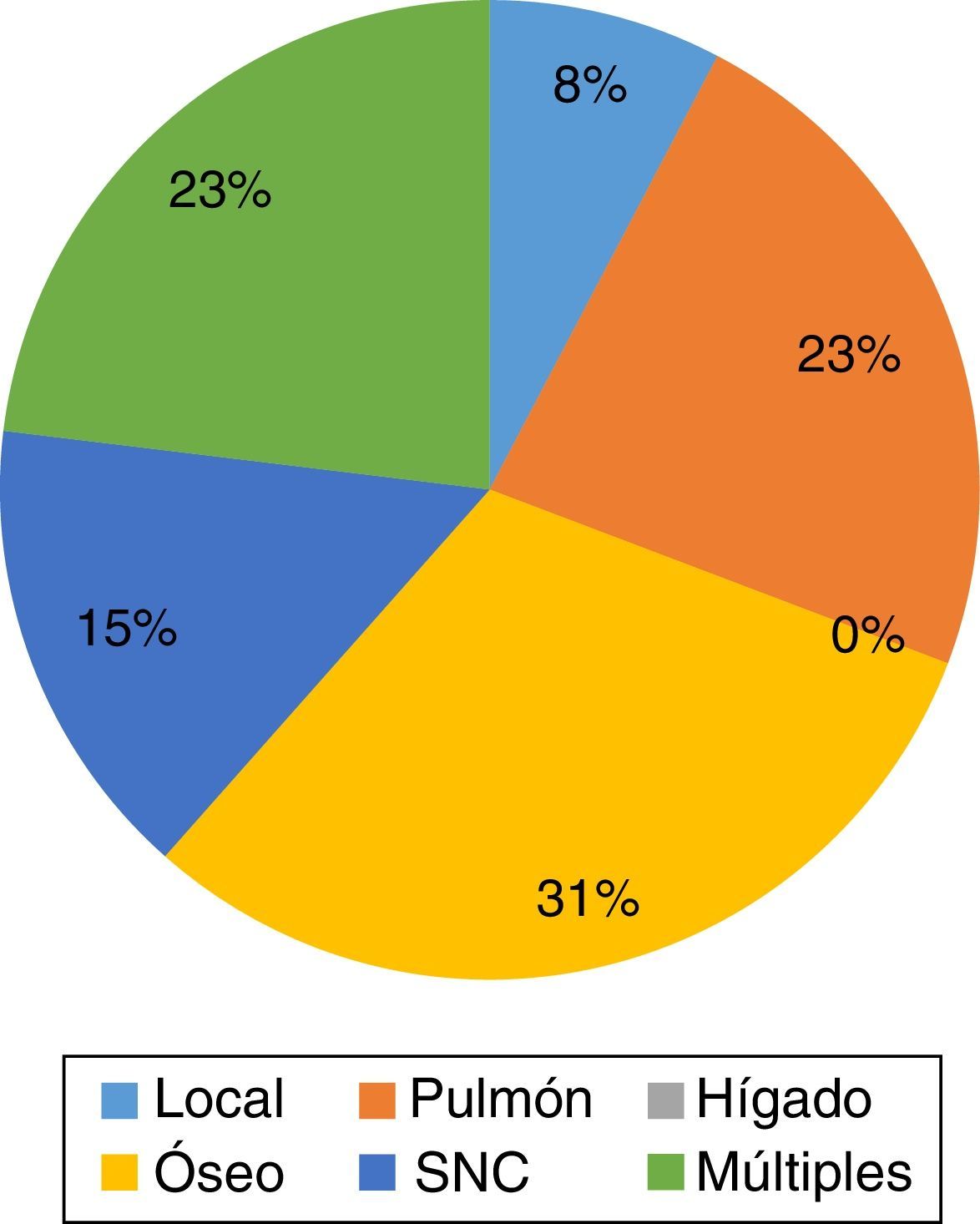
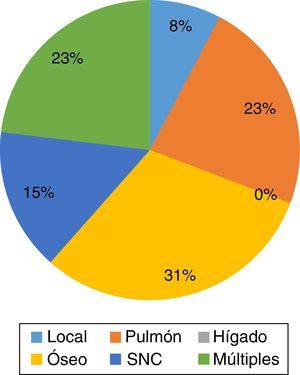
En cuanto a los sitios de metástasis en pacientes con cáncer de mama localmente avanzado, en presencia de HER-2/neu positivo, se observó que el sitio principal de recaída fue óseo, con un total de 4 casos, representando un 30.7% del total de recaídas, seguido de pulmón y múltiples sitios con un total de 3 pacientes cada uno (23%), a SNC 2 casos (15%) y locorregional en un caso (7.7%), sin observarse recaída a nivel hepático de forma única (fig. 2).
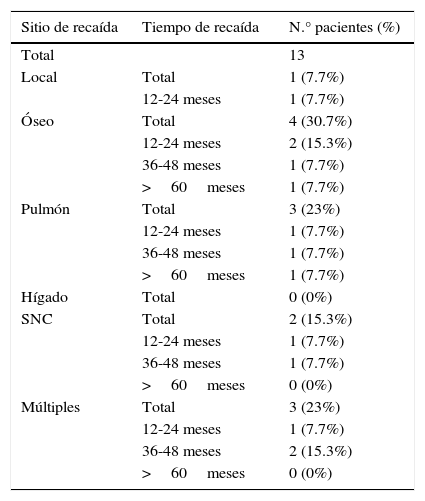
En relación con el sitio de recaída y el tiempo de metástasis, se demostró que el 15.3% se presentó en un rango de 12-24 meses a nivel óseo, y a su vez en múltiples sitios a los 36-48 meses correspondió el mismo porcentaje (tabla 2).
Relación sitio de recaída y tiempo de metástasis
| Sitio de recaída | Tiempo de recaída | N.° pacientes (%) |
|---|---|---|
| Total | 13 | |
| Local | Total | 1 (7.7%) |
| 12-24 meses | 1 (7.7%) | |
| Óseo | Total | 4 (30.7%) |
| 12-24 meses | 2 (15.3%) | |
| 36-48 meses | 1 (7.7%) | |
| >60meses | 1 (7.7%) | |
| Pulmón | Total | 3 (23%) |
| 12-24 meses | 1 (7.7%) | |
| 36-48 meses | 1 (7.7%) | |
| >60meses | 1 (7.7%) | |
| Hígado | Total | 0 (0%) |
| SNC | Total | 2 (15.3%) |
| 12-24 meses | 1 (7.7%) | |
| 36-48 meses | 1 (7.7%) | |
| >60meses | 0 (0%) | |
| Múltiples | Total | 3 (23%) |
| 12-24 meses | 1 (7.7%) | |
| 36-48 meses | 2 (15.3%) | |
| >60meses | 0 (0%) |
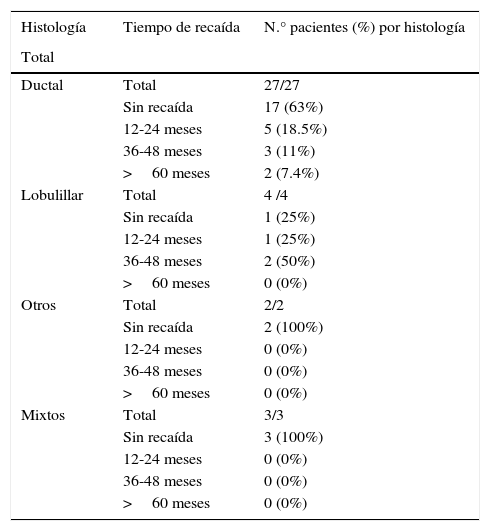
En cuanto a la histología se observó el reporte de histología ductal en 27 casos (75%), y 4 casos (11%) de histología lobulillar de los 36 pacientes, otro tipo de histología encontrada fue en solo 5.5% como mucinoso y poco diferenciado, y con una histología mixta en un 8% (tabla 3).
Histología y tiempo de recaída total de pacientes
| Histología | Tiempo de recaída | N.° pacientes (%) por histología |
|---|---|---|
| Total | ||
| Ductal | Total | 27/27 |
| Sin recaída | 17 (63%) | |
| 12-24 meses | 5 (18.5%) | |
| 36-48 meses | 3 (11%) | |
| >60 meses | 2 (7.4%) | |
| Lobulillar | Total | 4 /4 |
| Sin recaída | 1 (25%) | |
| 12-24 meses | 1 (25%) | |
| 36-48 meses | 2 (50%) | |
| >60 meses | 0 (0%) | |
| Otros | Total | 2/2 |
| Sin recaída | 2 (100%) | |
| 12-24 meses | 0 (0%) | |
| 36-48 meses | 0 (0%) | |
| >60 meses | 0 (0%) | |
| Mixtos | Total | 3/3 |
| Sin recaída | 3 (100%) | |
| 12-24 meses | 0 (0%) | |
| 36-48 meses | 0 (0%) | |
| >60 meses | 0 (0%) |
De los 27 pacientes que presentaron la histología ductal, 17 pacientes (63%) no han presentado recaída en comparación con un 37% con recaída; de estos el mayor porcentaje, 18.5%, recayó en un periodo de 12-24 meses, seguido de un 11% de 36-48 meses y un 7.4% en más de 60 meses.
En cuanto a las 4 pacientes que presentaron histología lobulillar, solo una paciente (25%) no ha presentado recaída, en comparación con un 75% de recaída en los 12-24 meses (25%), y de 36-48 meses en el 50%.
En cuanto a la histología, mucinosos y poco diferenciados, se obtuvo un 5.5%, solo 2 casos del total de pacientes, el 100% no ha presentado recaída, la histología mixta con 3 pacientes (8%), el 100% tampoco ha mostrado recaída en el periodo de seguimiento a 5 años (tabla 3).
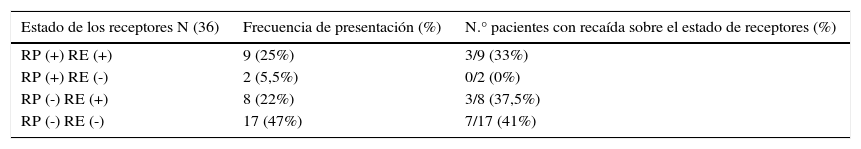
Según el estado de los receptores se reportó con mayor frecuencia en un 47% (17 casos) el estado de receptores de progesterona y estrógenos negativos, seguido de receptores de progesterona y estrógenos positivos en un 25% (9 casos), receptores de progesterona negativos y estrógenos positivos en un 22% y receptores de progesterona positivos y estrógenos negativos en 5.5%. De estos, se observó una mayor recaída en el estado de los receptores de progesterona y estrógenos negativo con 7 casos (41%), y sin evidencia de recaída en el estado de receptores de progesterona positivos y estrógenos negativos (tabla 4).
Recaída según el estado de los receptores
| Estado de los receptores N (36) | Frecuencia de presentación (%) | N.° pacientes con recaída sobre el estado de receptores (%) |
|---|---|---|
| RP (+) RE (+) | 9 (25%) | 3/9 (33%) |
| RP (+) RE (-) | 2 (5,5%) | 0/2 (0%) |
| RP (-) RE (+) | 8 (22%) | 3/8 (37,5%) |
| RP (-) RE (-) | 17 (47%) | 7/17 (41%) |
De acuerdo con el estado menopáusico se observo un mayor porcentaje de HER-2/neu positivo en mujeres posmenopáusicas, 64%, y con un 39% de recaídas en este rango de edad, mientras que solo se reportó un 11% de mujeres premenopáusicas, con un frecuencia de recaída del 31% (tabla 5).
DiscusiónGracias a los resultados obtenidos en este estudio se observó que la frecuencia de HER-2/neu en pacientes con cáncer de mama localmente avanzado fue del 19.7%, el cual concuerda con la prevalencia reportada en la literatura con un promedio de 22.2%6, así como en estudios nacionales, de un 16.7%8.
En cuanto a HER-2/neu Slamon et al. descubrieron la amplificación de HER-2/neu y metástasis a ganglios, teniendo un mayor índice de recurrencia y una disminución en la supervivencia. Por lo tanto, HER-2/neu positivo y receptores de estrógeno negativos se han correlacionado con un intervalo libre de enfermedad corto y una sobrevida media peor. Comparándolo con nuestro estudio el estado de receptores estrógenos y progesterona negativos se presentó con mayor frecuencia, representando un riesgo de recaída, con una frecuencia de hasta un 41%, superior a los reportados con los otros subtipos de estado de receptores14. Por lo tanto, el estado de los receptores incrementa la posibilidad de respuesta a terapia hormonal, por lo que el periodo libre de enfermedad y la sobrevida son mayores15.
En este trabajo el riesgo de recidiva sistémica y local a lo largo del tiempo mostró una tendencia en un pico de alrededor 2 años, siendo la actividad ósea con un 30.7%; esto relacionado con el estado de los receptores, HER-2/neu positivo, el estado menopáusico, en nuestra casuística, las recidivas viscerales han tenido un tiempo medio de superviviencia inferior al de las metástasis óseas, ya que las defunciones fueron mayores, 3 con recaída a nivel visceral (8.3), sin defunciones reportadas con recaída ósea. Por lo tanto, en nuestra revisión el diagnóstico temprano de la recidiva no se asocia con una mejora de la supervivencia.
Estos resultados corroboran la evidencia de que el cáncer de mama es una enfermedad heterogénea, y que los tumores HER-2/neu positivo son una entidad distinta.
Se determinó que la histología ductal representó la mayor prevalencia con un 75%, y de estos sin evidencia de recaída hasta en un 63% de los casos a un seguimiento de 60 meses; mientras que el subtipo lobulillar, con una frecuencia del 11%, presentó un riesgo incrementado de recaída hasta en un 75% dentro de los primeros 48 meses del diagnóstico.
La asociación con el estado menopáusico concordó con el reportado en la literatura, considerando que el cáncer de mama hereditario se presenta en su mayoría en mujeres premenopáusicas, estas tienen menor incidencia de HER-2/neu positivo; en este estudio se observó la mayor frecuencia en mujer posmenopáusicas en el 64%, en comparación con el 36% en mujeres premenopáusicas. De la misma forma, se presentó mayor frecuencia de recaída en las mujeres posmenopáusicas de hasta un 25% versus el 11% en premenopáusicas.
ConclusionesCon este estudio se establece que el diagnóstico temprano de la recidiva no se asocia a una mejoría en la sobrevida.
Se conoció el patrón de recidiva de los diferentes grupos de riesgo y su evolución.
De este estudio se puede derivar el establecer el impacto de la sobrevida global en las etapas localmente avanzadas con recaída y terapias anti HER-2/neu.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Quisiera agradecer, de manera especial, a todos aquellos que han contribuido estando a mi lado durante esta travesía. A mi familia por el apoyo constante y su confianza depositada en mí, espero que mis actos los hagan sentirse orgullosos. A mis compañeros y amigos por sus consejos en los momentos de crisis. A cada uno de nuestros profesores, por su tiempo, dedicación y entusiasmo, al enseñarnos el secreto de amar esta profesión. Por su gran calidad humana, por el estímulo brindado a seguir adelante, para sembrar en nosotros raíces profundas, el deseo y la pasión por la medicina, pero sobre todo por la exigencia para dar lo mejor de nosotros. Agradezco sobre todo el apoyo brindado por la Dra. Ana María Landa Fernández para la realización de este trabajo, por tener las puertas abiertas de su consultorio para resolver mis inquietudes y por su preocupación constante por la calidad de este trabajo.