Existen pocos casos reportados en la literatura de enfermedades trofoblásticas gestacionales en mujeres posmenopáusicas, y existen menos reportes aún de coriocarcinoma en esta etapa. En este artículo presentamos el caso de una paciente con diagnóstico de coriocarcinoma uterino, cuyo último evento obstétrico fue 14 años antes del padecimiento actual.
ConclusionesLos estudios de polimorfismo de microsatélites de ADN son los más específicos para confirmar el origen gestacional del tumor. Actualmente se estudia el índice de pulsatilidad de la arteria uterina como predictor de resistencia a metotrexato, fármaco de primera línea en el tratamiento de esta neoplasia.
There are few cases reported in the literature on gestational trophoblastic disease in postmenopausal women, and there are even fewer reports of choriocarcinoma at this stage. The case is presented of a patient diagnosed with uterine choriocarcinoma, whose last obstetrical event was 14 years before the current condition.
ConclusionsStudies of DNA microsatellite polymorphism are the most specific to confirm gestational tumour origin. Pulsatility index of the uterine artery used as a predictor of resistance to methotrexate, first-line drug in the treatment of this cancer, is currently being studied.
El coriocarcinoma es una proliferación bifásica del trofoblasto y sincitiotrofoblasto, con una morfología similar al trofoblasto primitivo de la etapa prevellosa placentaria. Una de sus características histológicas es la ausencia de vellosidades coriónicas1. Su incidencia es de un caso por 20,000 a 25,000 embarazos en los países occidentales2, y en México se calcula una incidencia promedio de un caso por 10,000 embarazos3. Se divide en 2 tipos: gestacional y no gestacional. Existen pocos casos reportados en la literatura de enfermedades trofoblásticas gestacionales en mujeres posmenopáusicas, y existen menos reportes aún de coriocarcinomas en esta etapa. El motivo de esta revisión es presentar un caso de coriocarcinoma en una mujer de 49 años de edad, cuyo último evento obstétrico fue hace 14 años.
Caso clínicoSe trata de una mujer de 49 años de edad, con asma bronquial desde los 21 años de edad e hipertensión arterial sistémica de 7 años de diagnóstico. Grupo y Rh: O positivo.
Sin vida sexual desde hace 4 años. G4P3Cl; último evento obstétrico hace 14 años, sin complicaciones.
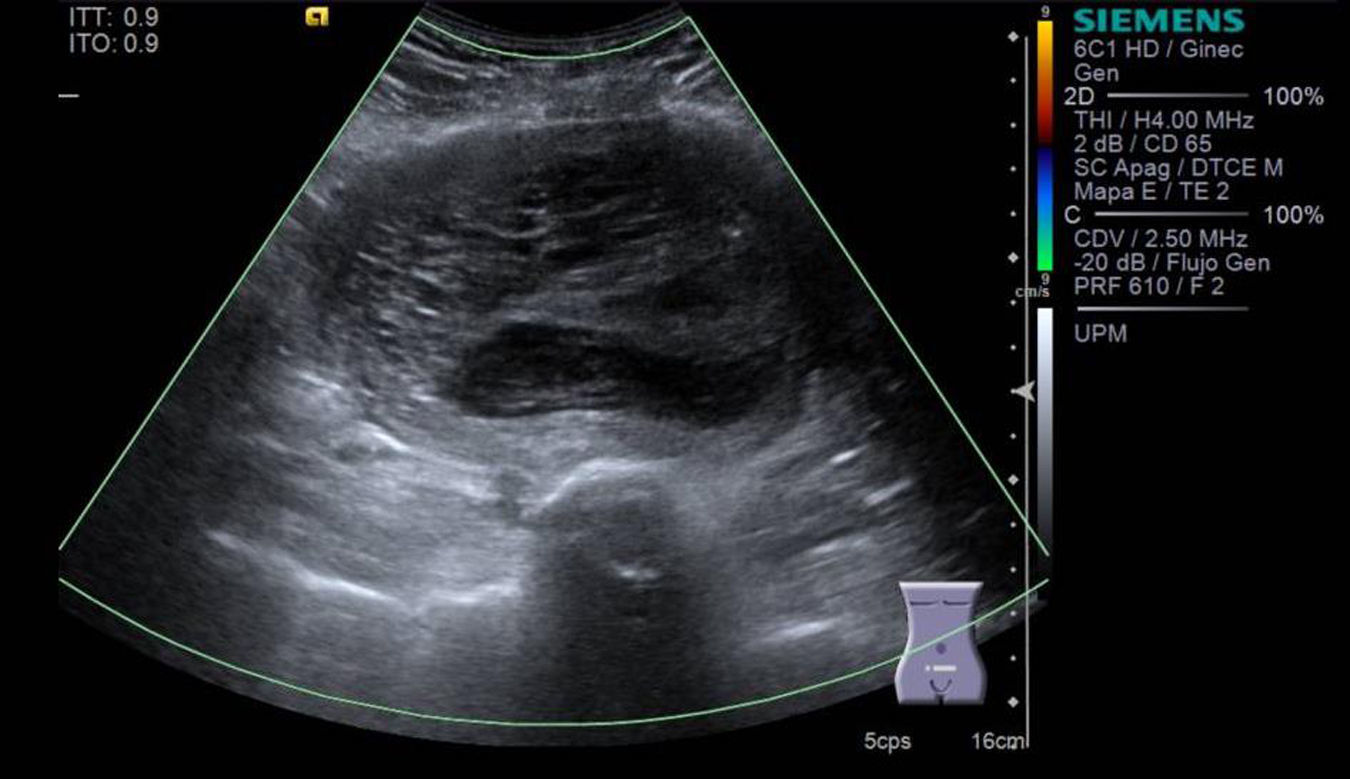
Acude por hiperpolimenorrea ininterrumpida de 4 meses de evolución, en tratamiento con progestina y ergotrate, sin mejoría. En la exploración vaginal se observa un aumento de las dimensiones uterinas. Se realiza ultrasonido pélvico con diagnóstico de miomatosis con probable degeneración quística (fig. 1). Se realiza histerectomía total abdominal con salpingooforectomía izquierda.
El reporte histopatológico da el diagnóstico de coriocarcinoma uterino en pared anterior y posterior de la cavidad endometrial. La invasión miometrial es menor del 50%. No hay invasión linfovascular ni leiomioma subseroso. El ovario y el salpinge izquierdos no presentan alteraciones. Inmunohistoquímica: con CK AE1/AE3 en citoplasma de células trofoblásticas, positivo para hormona gonadotropina en células de sincitiotrofoblasto; el antígeno carcinoembrionario es negativo.
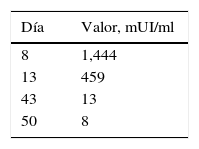
Se realizan estudios de extensión, encontrando pruebas de función hepática, CA-125 y perfil tiroideo dentro de parámetros normales. Cuantificación seriada de la fracción beta de la hormona gonadotropina coriónica, con descenso progresivo de los valores (tabla 1). Protocolo de imagen sin evidencia de metástasis a distancia o actividad tumoral. Se administra metotrexato (MTX) como terapia adyuvante y a su término la cuantificación de la fracción beta de la gonadotropina coriónica humana es de 2.2mUI/ml.
DiscusiónEl coriocarcinoma gestacional tiene una mayor prevalencia en mujeres en edad reproductiva y puede presentarse un año después de un embarazo molar (50%) o no molar: aborto (25%) o embarazo de término (20%); por lo general es intrauterino, aunque también puede surgir en el sitio de presentación de un embarazo ectópico4. En el caso específico de la mola hidatiforme, se considera que entre un 2 y un 3% derivará en un coriocarcinoma5.
Los coriocarcinomas no gestacionales pueden surgir de células germinales del ovario, pero también pueden provenir de otros cánceres epiteliales, como los de pulmón, estómago e intestino (retroperitoneal), o de diferenciación trofoblástica dentro de carcinomas de endometrio. Únicamente se han publicado 15 casos de tumores uterinos malignos con diferenciación coriocarcinomatosa, de los cuales 13 dependían de cuerpo uterino (9 adenocarcinomas endometrioides, 2 adenocarcinomas serosos y 2 carcinosarcomas)6–16 y el resto correspondían a cánceres cervicales17,18.
Tsukamoto et al.19 publicaron 3 casos de pacientes posmenopáusicas con coriocarcinoma, con períodos comprendidos entre el último embarazo y el desarrollo del tumor de 11, 15 y 18 años. O’Neill et al.20 y Okamoto et al.21 reportaron la aparición de coriocarcinomas en 2 mujeres, 22 y 23 años después del último embarazo, respectivamente; y Desai et al.2 describen el caso de una mujer de 73 años de edad que desarrolló un coriocarcinoma 38 años después de su último embarazo y 23 años tras su menopausia. Hasta el momento se desconoce cuál es el mecanismo molecular detrás del largo periodo de latencia entre el desarrollo de un coriocarcinoma y el último embarazo2.
InmunohistoquímicaEl análisis de inmunohistoquímica es útil para la clasificación del coriocarcinoma. La inmunorreactividad para fracción beta de la gonadotropina coriónica humana confirma su diagnóstico. Los marcadores OCT-3/4, CD-30 y AFP se expresan en células pluripotenciales no diferenciadas, incluyendo células germinales2,22–24. AE1/AE3 son una combinación de 2 anticuerpos para citoqueratina; su tinción suele ser positiva en esta neoplasia2,23,25.
Los estudios de polimorfismo de ADN han demostrado ser los más específicos para confirmar el origen gestacional del tumor. Estos estudios comparan el polimorfismo de microsatélites entre el ADN de la paciente, su pareja y el tumor, mediante el examen de polimorfismos en la longitud de los fragmentos de restricción usando locus específicos en los microsatélites2,26.
Presentación clínicaLa presentación clínica es variable y depende del evento gestacional que originó la enfermedad, así como de su extensión y diagnóstico histológico. Cuando un coriocarcinoma se asocia con un embarazo no molar previo, los signos y síntomas están asociados a la invasión del tumor en el útero o los sitios de metástasis27.
Estas se producen por diseminación hematógena a los pulmones (80%), la vagina (30%), el cerebro (10%) y el hígado (10%)28. La radiografía simple de tórax es el método de imagen recomendado por la Federación Internacional de Ginecología y Obstetricia (FIGO) para evaluar metástasis pulmonares. Sin embargo, hasta el 41% de los pacientes con metástasis pulmonares en la tomografía computarizada tienen una radiografía de tórax normal29. La tomografía computarizada es el método más adecuado para evaluar los sitios de metástasis, a excepción de la vaginal y las lesiones cerebrales, que son detectados con mayor precisión usando resonancia magnética. La tomografía por emisión de positrones se utiliza para detectar sitios de la enfermedad metabólicamente activos, no encontrados en otros estudios de imagen30.
Clasificación y estadificaciónLa FIGO publicó en 2002 la clasificación para las neoplasias trofoblásticas gestacionales (NTG), en la cual combina su antiguo sistema de clasificación anatómica con una puntuación modificada basada en los factores de riesgo definidos por la OMS (tabla 2). Según este sistema, los tumores se pueden clasificar en 2 grupos: NTG de bajo riesgo, si la puntuación es menor o igual a 6; y de alto riesgo, si la puntuación es mayor o igual a 727,29,31,32. El tratamiento se define de acuerdo con la puntuación total de los factores de riesgo, lo cual representa la posibilidad de que la paciente puede desarrollar resistencia a la primera línea de tratamiento con un solo agente de quimioterapia32,33.
Clasificación de la Federación Internacional de Ginecología y Obstetricia para las neoplasias trofoblásticas gestacionales
| Estadio I | Enfermedad confinada al útero |
| Estadio II | NTG que se extiende fuera del útero, pero se limita a las estructuras genitales (anexos, vagina, ligamento ancho) |
| Estadio III | NTG que se extiende a los pulmones con o sin implicación del tracto genital conocida |
| Estadio IV | Todos los demás sitios, metastásica |
| Sistema de puntuación pronóstico para las NTG según la FIGO y modificado por la OMS | ||||
|---|---|---|---|---|
| Factor pronóstico | Score | |||
| 0 | 1 | 2 | 3 | |
| Edad (años) | <40 | >40 | - | - |
| Gestación previa | Mola | Aborto | Embarazo de término | - |
| Intervalo entre la última gestación y la quimioterapia (meses) | <4 | 4-6 | 7-12 | >12 |
| hCG (IU/l) | <103 | 103-104 | 104-105 | >105 |
| Número de metástasis | 0 | 1 a 4 | 5 a 8 | >8 |
| Sitio de metástasis | Pulmón | Bazo, riñón | Gastrointestinal | Cerebro, hígado |
| Tamaño del tumor | - | 3-5cm | >5cm | - |
| Falla a la quimioterapia previa | - | - | 1 agente | 2 o más agentes |
FIGO: Federación Internacional de Ginecología y Obstetricia; hCG: gonadotropina coriónica humana; NTG: neoplasia trofoblástica gestacional; OMS: Organización Mundial de la Salud.
Las pacientes con NTG de bajo riesgo (la enfermedad no metastásica fase i y la enfermedad metastásica con puntajes FIGO/OMS menor de 727–29 deben ser tratadas con un solo agente, ya sea MTX o actinomicina D32. Esta última se ha utilizado como terapia de primera línea en caso de compromiso renal o hepático, o cuando existe contraindicación para la administración de MTX y como terapia de segunda línea cuando la paciente desarrolla resistencia al MTX.
Estudios recientes evidencian que un índice de pulsatilidad de la arteria uterina menor o igual a 1 predice un aumento en el riesgo de resistencia a MTX en mujeres con NTG de bajo riesgo; esto puede ser útil para planear su primera línea de tratamiento27.
Las pacientes con NTG de alto riesgo (FIGO etapas ii-iii, con puntuación mayor de 7 y estadio iv) deben ser tratadas con quimioterapia multiagente, con o sin cirugía adyuvante y con radioterapia. El régimen de etopósido, actinomicina D, MTX, ciclofosfamida y vincristina –EMA-CO–, en estos casos, es el esquema de primera línea debido a su baja toxicidad y alta tasa de respuesta. El riesgo general de recurrencia es de 3 a 9% en el primer año después del tratamiento27,32. Alrededor del 5% de las pacientes con NTG de bajo riesgo sin metástasis y entre el 10 y el 15% de las que presentan metástasis desarrollan resistencia al esquema primario de quimioterapia, por lo que se han propuesto varios regímenes de rescate (tabla 3)34, aunque no está claro cuáles son más eficaces y menos tóxicos35. La FIGO recomienda el esquema EMA-EP (etopósido, MTX, actinomicina D, etopósido, cisplatino), ya que su tasa de respuesta completa es mayor entre las pacientes que desarrollan resistencia (81.8%) que en aquellas con recurrencia de la enfermedad (42.9%)36.
Regímenes de quimioterapia de rescate para la neoplasia trofoblástica gestacional resistente o recurrente
| EMA-EP | Etopósido, metotrexato, actinomicina D, etopósido, cisplatino |
| MBE | Metotrexato, bleomicina, etopósido |
| BEP | Bleomicina, etopósido, cisplatino |
| TP/TE | Paclitaxel, cisplatino/paclitaxel, etopósido |
| FA | 5-fluorouracilo, actinomicina D |
| FAEV | Floxuridina, actinomicina D, etopósido, vincristina |
| VIP/ICE | Ifosfamida, cisplatino, etopósido |
Los coriocarcinomas de células germinales derivados del tracto genital en una mujer posmenopáusica con ovarios normales visualizados por tomografía computarizada y ultrasonido son extremadamente raros. Cuando esta neoplasia se presenta después de la menopausia es difícil descartar la posibilidad de diferenciación trofoblástica dentro de un carcinoma endometrial, y los estudios de polimorfismo de microsatélites de ADN se convierten en la herramienta más eficaz para confirmar o descartar el origen gestacional del tumor. En la actualidad, las investigaciones se centran en cómo predecir el riesgo de resistencia a MTX a través del índice de pulsatilidad de la arteria uterina, estudio no invasivo y de fácil acceso que, al hacerse extensivo, permitiría planear de forma oportuna y acertada el tratamiento de primera línea de las pacientes, acortando el tiempo de espera de respuesta a tratamiento y disminuyendo los costos institucionales.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.