El estudio de los ganglios linfáticos supone el factor pronóstico más importante en el cáncer colorrectal sin metástasis. La técnica del ganglio centinela identifica el ganglio que mejor predice el estado ganglionar de un paciente y permite realizar en él técnicas de estudio intensivo que mejoran la estadificación. El objetivo del trabajo es estudiar la eficacia de la técnica del ganglio centinela en la estadificación del cáncer de colon.
MétodosEstudio prospectivo con 45 pacientes diagnosticados preoperatoriamente de cáncer de colon en estadios 0, i y ii. Realizamos la técnica del ganglio centinela ex vivo y con azul de metileno. El ganglio centinela se estudia realizando secciones múltiples y técnicas de inmunohistoquímica, además de hematoxilina-eosina. Se realizó un estudio comparativo con un grupo control de 45 pacientes que fue estudiado de forma convencional mediante sección única y tinción de hematoxilina-eosina.
ResultadosIdentificamos el ganglio centinela en el 98% de los casos, con una tasa de falsos negativos de 0. La supraestadificación se encuentra entre el 4,8 y el 23,8% de los pacientes. En aquellos con menos de 12 ganglios estudiados, la supraestadificación se encuentra entre el 10,5 y el 36,8%.
ConclusionesEl estudio del ganglio centinela realizado ex vivo y con azul de metileno predice el estado ganglionar de los pacientes con cáncer de colon. Esta técnica supraestadifica pacientes al estadio iii, que recibirán tratamiento quimioterápico que podría mejorar su pronóstico. El beneficio de esta técnica es mayor en pacientes con menos de 12 ganglios.
The study of lymph nodes is the most important prognostic factor in colorectal cancer without metastasis. The sentinel lymph node technique identifies the lymph node that best predicts the patient's lymph node status and allows the performance of techniques of intensive study that improve staging. The aim of this study was to evaluate the efficacy of the sentinel lymph node technique in the staging of colon cancer.
MethodsWe performed a prospective study of 45 patients preoperatively diagnosed with colon cancer in stages 0, i and ii. We carried out the sentinel lymph node technique ex vivo and with methylene blue. The sentinel lymph node was studied through multiple sections and immunohistochemical techniques in addition to hematoxylin and eosin staining. We performed a comparison with a control group of 45 patients who were studied through a single section and hematoxylin and eosin staining.
ResultsWe identified the sentinel lymph node in 98% of the patients, with a false-negative rate of 0. Overstaging was found to occur in 4.8 to 23.8% of the patients. In patients in whom less than 12 lymph nodes were studied, overstaging was between 10.5 and 36.8%.
ConclusionsStudy of sentinel lymph nodes carried out ex vivo and with methylene blue predicts the lymph node status of patients with colon cancer. This technique overstages patients to stage iii, who will receive chemotherapy, which could improve their prognosis. The benefit of this technique is greater in patients, in whom less than 12 lymph nodes are studied.
Gongoil linfatikoen azterketa da metastasirik gabeko kolon-uzkiko minbiziaren pronostikorako faktore nagusia. Gongoil zelatariaren teknikaren bidez, pazientearen gongoil-egoera hobekien iragartzeko gongoila zein den identifikatzen da, gongoil horretan estadifikazioa hobetzeko ikerketa intentsiborako teknikak baliatzeari begira. Lanaren bidez, koloneko minbiziaren estadifikazioan gongoil zelatariaren teknikak zenbaterainoko eraginkortasuna duen aztertu nahi da.
MetodoakProspekzio-azterketa, ebakuntza egin aurretik 0, i eta ii estadioetako koloneko minibizia diagnostikatu zaien 45 pazienterekin. Gongoil zelatariaren teknika ex vivo egiten da, metileno-urdinez. Gongoil zelataria ikertzeko, epai anitz egin eta immnunohistokimikako teknikak erabiltzen dira, hematoxilina-eosinaz gainera. Ikerketa konparatibo bat egin zen 45 pazienterekin; ikerketa hori modu konbentzionalean egin zen, epai bakarra eta hematoxilina-eosinazko tindatzea eginez.
EmaitzakKasuen %98n identifikatu dugu gongoil zelataria, 0ko negatibo faltsuen tasarekin. Supraestadifikazioa pazienteen %4,8 eta %23,8 bitartean dago. Hamabi gongoiletik behera ikertu zaizkien pazienteetan supraestadifikazioa %10,5 eta %36,8 bitartean dago.
OndorioakEx vivo eta metileno-urdinez egindako gongoil zelatariaren ikerketak koloneko minbizia duten pazienteen gongoil-egoera aurreikusten du. Teknika horrek iii estadiora supraestadifikatzen ditu pazienteak, eta beren diagnostikoa hobetu lezakeen kimioterapiako tratamendua hartuko dute. Teknika honen onura handiagoa da 12 gongoil baino gutxiago dituzten pazienteetan.
El estadio tumoral, incluyendo una evaluación adecuada de las metástasis ganglionares, constituye el factor pronóstico más importante en el cáncer colorrectal (CCR)1. Dependiendo de la estadificación TNM, los pacientes tienen una tasa de supervivencia diferente. Así, estadios precoces (i y ii) presentan tasas de supervivencia entre el 93 y el 82%, mientras que la presencia de metástasis ganglionares (estadio iii) disminuye la supervivencia a un 59% a los 5 años2.
La afectación ganglionar es el factor pronóstico aislado más importante en el CCR. La AJCC recomienda estudiar al menos 12 ganglios para lograr una correcta estadificación3. Para mejorar esta en pacientes con CCR se ha propuesto la realización de técnicas de estudio intensivo en los ganglios. Sin embargo, el gran consumo de recursos que se precisaría para su realización en todos los ganglios no lo hace viable.
El concepto de ganglio centinela (GC) se basa en la progresión organizada de células tumorales por el drenaje linfático desde el tumor primario hasta ese primer ganglio4. Así, el GC es el que mayor riesgo tiene de metástasis y el que mejor puede predecir el estado ganglionar del paciente. La identificación del GC permite realizar técnicas intensivas rentabilizando su uso. El objetivo principal del estudio es determinar la eficacia de la técnica del GC realizada ex vivo y con colorante en la estadificación del cáncer de colon.
MétodosEstudio prospectivo, transversal, cruzado y unicéntrico en el que se estudia la eficacia del estudio del GC en la estadificación del cáncer de colon. Se incluyeron 45 pacientes del área sanitaria del Hospital Txagorritxu en Álava. La selección de la cohorte fue prospectiva desde febrero hasta agosto de 2009 incluyendo todos los casos sin realizar aleatorización. El diagnóstico se realizó basándose en la colonoscopia, la TAC abdominal y la radiografía de tórax. La técnica del GC fue realizada por 5 cirujanos. Los criterios de inclusión fueron: cáncer de colon, cirugía electiva, cirugía curativa y mayor de 18 años. Se excluyeron el estadio iv, la cirugía urgente y paliativa y el cáncer de recto.
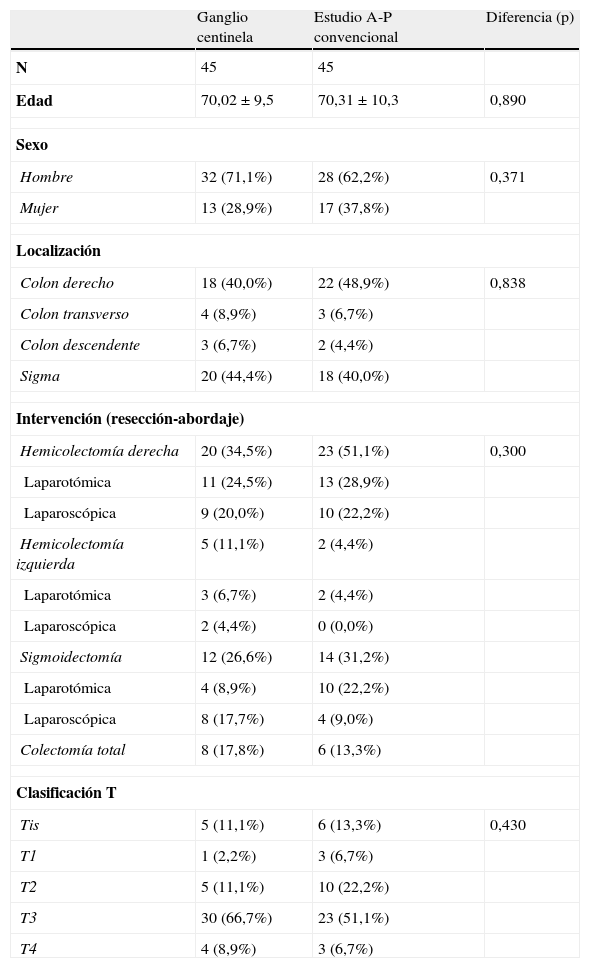
Realizamos de forma adicional un estudio comparativo con una muestra control en la que solo se realizó estudio anatomopatológico convencional. Este grupo comprendió 45 pacientes intervenidos consecutivamente desde febrero de 2009 hacia atrás en el tiempo. Fueron intervenidos por los mismos cirujanos y cumplían los mismos criterios del estudio del GC. La homogeneidad de las 2 muestras y sus características se reflejan en la tabla 1.
Características de los pacientes del grupo con estudio del ganglio centinela y del grupo control y demostración de la homogeneidad de ambas muestras al lograrse diferencias de p mayores de 0,05
| Ganglio centinela | Estudio A-P convencional | Diferencia (p) | |
| N | 45 | 45 | |
| Edad | 70,02±9,5 | 70,31±10,3 | 0,890 |
| Sexo | |||
| Hombre | 32 (71,1%) | 28 (62,2%) | 0,371 |
| Mujer | 13 (28,9%) | 17 (37,8%) | |
| Localización | |||
| Colon derecho | 18 (40,0%) | 22 (48,9%) | 0,838 |
| Colon transverso | 4 (8,9%) | 3 (6,7%) | |
| Colon descendente | 3 (6,7%) | 2 (4,4%) | |
| Sigma | 20 (44,4%) | 18 (40,0%) | |
| Intervención (resección-abordaje) | |||
| Hemicolectomía derecha | 20 (34,5%) | 23 (51,1%) | 0,300 |
| Laparotómica | 11 (24,5%) | 13 (28,9%) | |
| Laparoscópica | 9 (20,0%) | 10 (22,2%) | |
| Hemicolectomía izquierda | 5 (11,1%) | 2 (4,4%) | |
| Laparotómica | 3 (6,7%) | 2 (4,4%) | |
| Laparoscópica | 2 (4,4%) | 0 (0,0%) | |
| Sigmoidectomía | 12 (26,6%) | 14 (31,2%) | |
| Laparotómica | 4 (8,9%) | 10 (22,2%) | |
| Laparoscópica | 8 (17,7%) | 4 (9,0%) | |
| Colectomía total | 8 (17,8%) | 6 (13,3%) | |
| Clasificación T | |||
| Tis | 5 (11,1%) | 6 (13,3%) | 0,430 |
| T1 | 1 (2,2%) | 3 (6,7%) | |
| T2 | 5 (11,1%) | 10 (22,2%) | |
| T3 | 30 (66,7%) | 23 (51,1%) | |
| T4 | 4 (8,9%) | 3 (6,7%) | |
La variable principal fue la modificación de la estadificación debida al estudio del GC. Otras variables fueron la edad y sexo del paciente, localización y clasificación T y N tumoral, número total de ganglios y de GC, número de ganglios infiltrados en el estudio convencional y en el estudio del GC, así como el tipo de afectación.
Los procedimientos cumplen los principios de la Declaración de Helsinki de 1964, enmendada en 2008 en Seúl. Este estudio ha sido aprobado por el Comité Ético de Investigación Clínica del Hospital Txagorritxu.
Identificación del ganglio centinelaSe realiza ex vivo, tras la resección de la pieza quirúrgica. Infiltramos peritumoralmente y en la subserosa 1-2ml de azul de metileno dependiendo del tamaño del tumor. Realizamos un masaje durante 5-10 minutos, consiguiendo que el colorante se disemine por los conductos linfáticos y tiña los ganglios. La disección del mesocolon se inicia próxima a la tumoración, siguiendo los trayectos teñidos. Consideramos GC a los primeros 1-4 ganglios teñidos y a los que, aun sin estar teñidos, llega directa y claramente un conducto linfático que sí lo está5.
Estudio intensivo del ganglio centinelaPrevia fotografía, se realizaron cortes de 2mm de grosor. En ganglios menores de 5mm se realizó un único corte. Tras fijación en formol tamponado al 4% durante 24h, se realizaron 6 secciones de 4μm. Se aplicaron secuencialmente técnicas de tinción de hematoxilina-eosina y de inmunohistoquímica con citoqueratina (CAM 5.2), de forma que 3 secciones fueron estudiadas con cada técnica.
Interpretación del estudio anatomopatológicoSegún la clasificación de la AJCC6 se consideró metástasis la afectación mayor de 2mm, micrometástasis entre 2mm y 0,2mm y grupos tumorales de colonias y células aisladas la afectación igual o menor de 0,2mm. La presencia de metástasis y micrometástasis modificó la estadificación al considerarse pN1 y pN1(mi) respectivamente. Las lesiones de 0,2mm o menores no la modificaron, debiendo ser consideradas pN0(i+). El resto de ganglios se estudió de forma convencional mediante sección única y tinción con hematoxilina-eosina.
Análisis estadísticoSe describieron las variables cuantitativas mediante medias y desviaciones estándar y las cualitativas mediante frecuencias y porcentajes. La homogeneidad de las muestras se comprobó mediante las pruebas de la t de Student y Chi cuadrado. Esta última prueba se utilizó también para la comparación entre proporciones de ganglios infiltrados y supraestadificación. La relación entre el T tumoral, localización, tipo de cirugía y abordaje quirúrgico, y la obtención de menos de 12 ganglios se analizó mediante la U de Mann-Whitney de forma univariante y mediante regresión logística para la relación multivariante. Se ha establecido la significación estadística en 0,05.
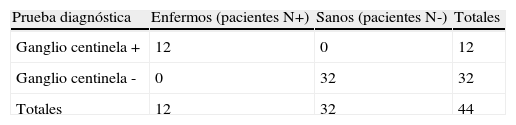
ResultadosLa identificación del GC se logró en 44 (98%) de los 45 pacientes. El GC predice el estado ganglionar total en todos los casos con una sensibilidad y especificidad del 100% (tabla 2).
Valoración de la prueba diagnóstica (tabla 2×2) y parámetros obtenidos a partir de la misma
| Prueba diagnóstica | Enfermos (pacientes N+) | Sanos (pacientes N-) | Totales |
| Ganglio centinela + | 12 | 0 | 12 |
| Ganglio centinela - | 0 | 32 | 32 |
| Totales | 12 | 32 | 44 |
| Valor | IC inferior | IC superior | |
| Porcentaje total de falsos negativos | 0,0% | 0,0% | 0,0% |
| Sensibilidad | 100,0% | 100,0% | 100,0% |
| Especificidad | 100,0% | 100,0% | 100,0% |
| Valor predictivo positivo | 100,0% | 100,0% | 100,0% |
| Valor predictivo negativo | 100,0% | 100,0% | 100,0% |
| Proporción de falsos positivos | 0,0% | 0,0% | 0,0% |
| Proporción de falsos negativos | 0,0% | 0,0% | 0,0% |
| Exactitud | 100,0% | 100,0% | 100,0% |
| Probabilidad preprueba (prevalencia) | 27,3% |
IC: intervalo de confianza.
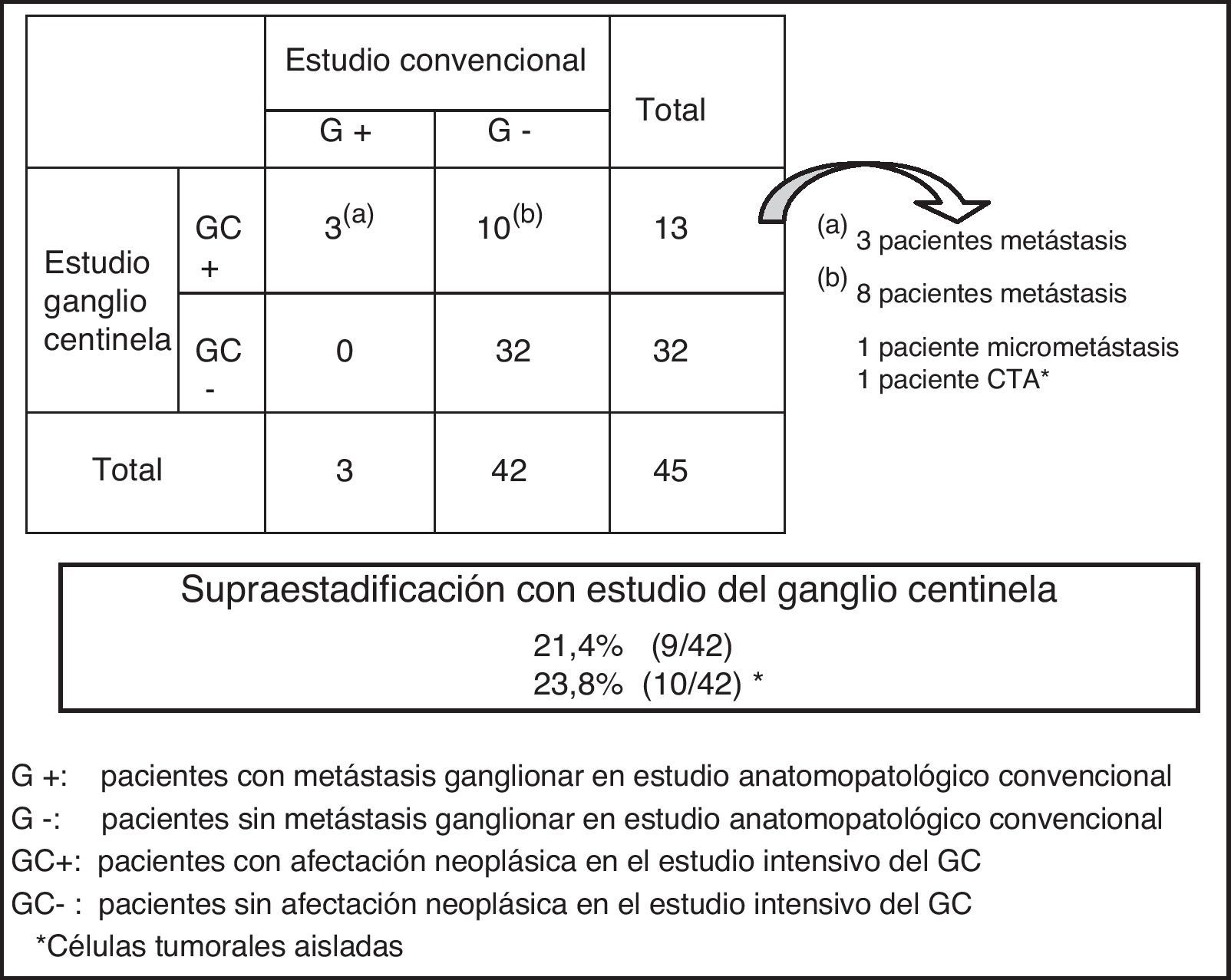
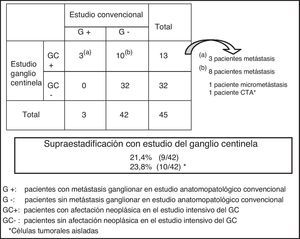
El análisis del GC en pacientes con metástasis ganglionar en el estudio convencional (G+) detectó metástasis ganglionar en todos los casos (fig. 1). Por tanto, la tasa de falsos negativos o ausencia de metástasis en los GC con al menos otro ganglio afectado fue 0. El estudio del GC en pacientes sin metástasis ganglionar en el estudio convencional (G-) demostró afectación ganglionar en 10 (23,8%) de los 42 pacientes, siendo metástasis en 8, micrometástasis en uno y células tumorales aisladas (CTA) en otro paciente (fig. 1). Así, la supraestadificación lograda con la técnica del GC fue del 21,4%. Incluyendo el caso con CTA, se incrementaría al 23,8%.
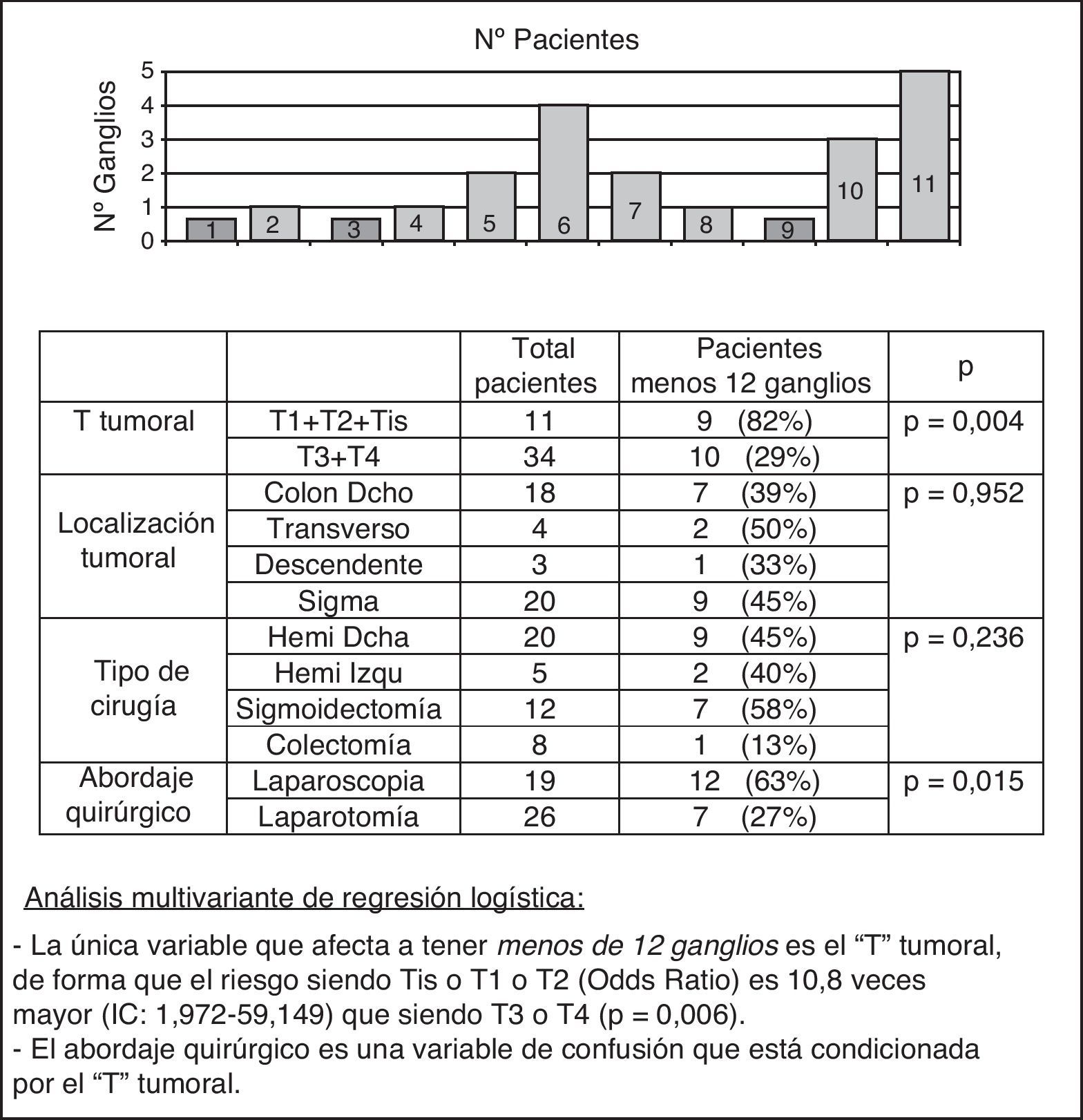
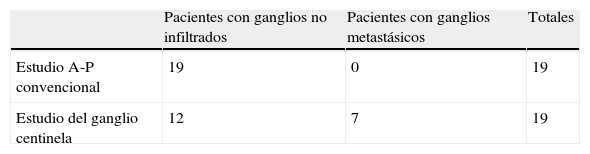
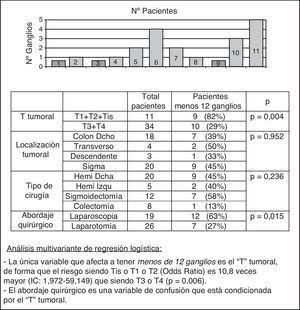
Se identificaron menos de 12 ganglios en 19 (42%) de los 45 pacientes. Todos ellos fueron estadificados N0 por el estudio convencional. Sin embargo, el estudio del GC demostró afectación ganglionar en 7 (37%) de los 19 pacientes, logrando una supraestadificación del 37% (tabla 3). En la figura 2 se puede ver cuáles son las variables que se relacionan con la obtención de menos de 12 ganglios. Tras el análisis multivariante se obtuvo que la única variable que se relacionaba significativamente con este hecho era el T tumoral con una OR de 10,8 (p=0,006).
Supraestadificación lograda con el estudio del ganglio centinela en pacientes con menos de 12 ganglios en el estudio anatomopatológico
| Pacientes con ganglios no infiltrados | Pacientes con ganglios metastásicos | Totales | |
| Estudio A-P convencional | 19 | 0 | 19 |
| Estudio del ganglio centinela | 12 | 7 | 19 |
Supraestadificación: 37% (7 pacientes de 19).
En el grupo control se detectaron metástasis ganglionares en 9 (21%) de los 45 pacientes. En el grupo con estudio del GC se detectó infiltración ganglionar en 12 (28%) de los 45 pacientes o en 13 (30%) de los 45 pacientes si incluimos las CTA. Por tanto, el estudio del GC encontró un 7-9% más de pacientes con infiltración ganglionar (p=0,616). Considerando exclusivamente los pacientes con menos de 12 ganglios identificados, en el grupo control se detectaron metástasis ganglionares en uno (11%) de 9 pacientes, mientras que en el grupo con estudio del GC se identificaron metástasis ganglionares en 7 (37%) de 19 pacientes. Esto supone una supraestadificación del 26% de estos casos (p=0,214).
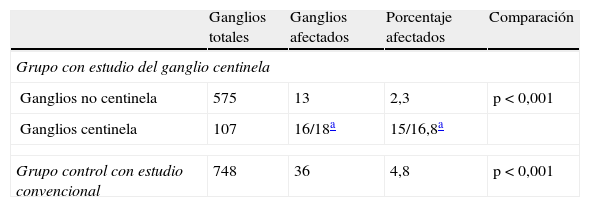
El número total de ganglios en el grupo con estudio del GC fue 682, con una media de 15 ganglios (rango: 2-43). El número de GC identificados fue 107, con una media de 2,43 GC por paciente (rango: 1-4). El estudio de los GC detectó infiltración en 16 (15%) de 107 GC o en 18 (17%) de 107 GC considerando las CTA. El estudio convencional detectó metástasis en 13 (2%) de los 575 ganglios no centinelas. Así, el estudio del GC detecta mayor afectación ganglionar que el estudio convencional de los ganglios no centinela (p<0,001) (tabla 4).
Comparación de la infiltración metastásica ganglionar según el tipo de estudio anatomopatológico
En el grupo control encontramos metástasis en 36 (4,8%) de 748 ganglios. Así, el estudio del GC detectó un 11,5-13,6% más de ganglios infiltrados que el estudio convencional del grupo control (p<0,001) (tabla 4).
DiscusiónEl 50% de enfermos con CCR se encuentra en estadios iniciales sin metástasis ganglionares y son tratados con cirugía potencialmente curativa. Sin embargo, un 20-30% morirán por su enfermedad en los primeros 5 años3. Este elevado porcentaje puede explicarse en parte por la infraestadificación que sufren estos pacientes al no lograrse un estudio ganglionar correcto. Debemos tener en cuenta que el tratamiento con quimioterapia de los enfermos con ganglios infiltrados ha mejorado su supervivencia disminuyendo la mortalidad más del 30%7. Existen estudios8–12 que demuestran que la supervivencia aumenta al incrementar el número de ganglios estudiados, especialmente si estos son negativos. La AJCC considera necesarios al menos 12 ganglios para una correcta estadificación del CCR. Un número menor de ganglios puede suponer infraestadificación y peor pronóstico al no beneficiarse del tratamiento adyuvante.
El número de ganglios detectados en la pieza quirúrgica depende de múltiples factores, entre ellos las limitaciones del estudio anatomopatológico. Así, a la dificultad intrínseca de la técnica se añade que el 70% de los ganglios infiltrados miden menos de 5mm, siendo probable que no sean detectados13. Además, el estudio mediante sección única permite el análisis únicamente del 1% del tejido ganglionar, por lo que lesiones tumorales de pequeño tamaño con localización subcapsular pueden pasar inadvertidas14. En el 40% de nuestros pacientes no se logró el número de ganglios mínimo exigible. Estos resultados no dependen de la localización tumoral, tipo de cirugía ni del abordaje quirúrgico (fig. 2). Sin embargo, en más del 80% de los pacientes clasificados Tis, T1 y T2 se encontraron menos de 12 ganglios. Posteriormente al estudio presentado, y sin más cambios que la realización del estudio anatomopatológico siempre por los 2 mismos patólogos, logramos que los casos con menos de 12 ganglios fueran 11 (14%) pacientes en 80 casos.
Todo lo anterior nos lleva a la necesidad de estudiar de forma más intensiva el componente ganglionar con el fin de evitar la infraestadificación de los pacientes «N0». Numerosos estudios5,14–17 ofrecen resultados de supraestadificación del 10-20% con el empleo de técnicas de inmunohistoquímica y de RT-PCR. La realización de secciones múltiples mejora la estadificación hasta un 9%18. La técnica del GC aporta un ganglio que puede predecir con fiabilidad el estado ganglionar total de un paciente, permitiendo su estudio con técnicas intensivas sin un importante consumo de recursos.
El empleo de radioisótopos es la norma en el cáncer de mama y el melanoma. Sin embargo, está descrito que el empleo de colorante es una buena alternativa19. Desde nuestro punto de vista, la técnica con colorante es más sencilla ya que no precisa la colaboración de servicios como Medicina Nuclear y Digestivo. Además, evitamos al paciente el riesgo de una colonoscopia necesaria para infiltrar el radiotrazador. Por ello, y dada la no existencia de estudios que confirmen que el empleo de radiotrazadores logra mejores resultados20, creemos que el empleo de colorantes como el azul de metileno es la técnica más recomendable en el estudio del GC en el CCR.
El drenaje linfático aberrante y una mejor circulación linfática cuando la pieza no ha sido resecada son los argumentos a favor de la técnica in vivo. El primero supone la existencia de metástasis ganglionares fuera de los límites de la resección estándar. Sin embargo, su frecuencia es baja, oscilando entre el 2-8%, no siendo pocos los grupos que ni siquiera la detectan20–22. En lo referente al drenaje linfático en la pieza extirpada, la experiencia en el cáncer de mama y el melanoma sirven para confirmar que un masaje sobre la zona infiltrada permite una diseminación adecuada del colorante por la circulación linfática23. Además, la resección quirúrgica interrumpe el mecanismo neurológico que regula la constricción de los conductos linfáticos, facilitando la circulación linfática24. Wong et al.25 publicaron en 2001 la primera serie larga de pacientes estudiados con técnica del GC ex vivo. Los resultados logrados en este estudio y en otros publicados posteriormente son similares a los obtenidos cuando se emplea la técnica in vivo24–26. En nuestro trabajo realizamos la técnica ex vivo. Como argumentos a favor de este procedimiento podemos decir que evita el riesgo de perforación y diseminación de células tumorales por la manipulación de la neoplasia en el paciente, evita reacciones anafilácticas del contraste, no modifica la técnica quirúrgica y permite su realización por un cirujano ajeno a la intervención, permitiendo una curva de aprendizaje más corta. Además, la principal ventaja es, desde nuestro punto de vista, su mayor sencillez, lo cual tiene una especial importancia en neoplasias de gran tamaño o localizadas en el recto, y en la cirugía laparoscópica. Así, grupos que emplean habitualmente la técnica in vivo, la realizan ex vivo en los casos anteriormente citados27,28.
La tasa de identificación del GC varía entre el 58 y el 100%, refiriendo la mayoría de los autores24–30 valores superiores al 95%. La tasa de falsos negativos se encuentra entre el 0 y el 10%. Estos resultados dependen fundamentalmente de la experiencia del equipo que realiza la técnica, así como de la cantidad de colorante infiltrada16. Sin embargo, no parece influir el tipo de técnica, ya sea in vivo o ex vivo, bien con radiotrazadores, bien con colorantes24,31. En el cáncer de mama y el melanoma los parámetros de validación recomiendan al menos un 95% de tasa de identificación del GC y una tasa de falsos negativos del 5% o menor32. La curva de aprendizaje de la técnica del GC en el CCR es desconocida, pero parece menor que en el cáncer de mama, siendo precisos entre 5 y 10 casos por cirujano14,33,34. En nuestro estudio, con 9 casos por cirujano, logramos identificar el GC en el 98% de los casos y una tasa de falsos negativos de 0. Estos valores se encuentran dentro de los parámetros de validación requeridos y anteriormente citados.
La supraestadificación lograda en nuestro trabajo se encuentra entre el 5 y el 24%, valores que coinciden con los publicados por grupos14–17,30 con más experiencia. El valor mínimo del rango es debido a los pacientes con micrometástasis y lesiones menores en el GC, mientras que el valor máximo corresponde a los casos con afectación neoplásica linfática exclusiva del GC. En la comparación con el grupo control, la supraestadificación lograda es del 9% a favor del estudio del GC, valor que se encuentra dentro del rango anterior. Considerando a los pacientes con menos de 12 ganglios estudiados logramos una supraestadificación entre el 11 y el 37%. En la comparación con el grupo control la supraestadificación fue del 26%, valor que se encuentra dentro del rango anterior.
Concluimos que la técnica del GC realizada ex vivo y con azul de metileno predice el estado ganglionar de todos nuestros pacientes con cáncer de colon. La técnica del GC supraestadifica, pasando al estadio iii pacientes que el estudio convencional determinaba como estadios 0, i y ii, permitiendo que accedan a un tratamiento quimioterápico que podría mejorar su pronóstico. Esta supraestadificación lograda es aún mayor en pacientes con menos de 12 ganglios, que son los que tienen mayor riesgo de infraestadificación.
Son precisos estudios con mayor casuística y con mayor seguimiento para determinar la influencia del estudio del GC en el pronóstico de los pacientes con CCR.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.