La enfermedad inflamatoria intestinal (EII) es una entidad crónica, que cursa "en brotes" y se caracteriza por la aparición de inflamación intestinal en respuesta a un agente etiológico desconocido en personas genéticamente predispuestas. Incluye 2 procesos, la colitis ulcerosa (CU), en la que la inflamación se encuentra limitada a colon y recto, y la enfermedad de Crohn (EC), en la que aquélla puede afectar a cualquier tramo intestinal, desde la boca hasta el ano. En la EC la localización más frecuente es la ileocólica (40-55%), seguida de la ileal (30-40%) y la cólica (15-25%). Existen rasgos diagnósticos clínicos, radiológicos, endoscópicos e histológicos que permiten diferenciar la EII de otras enfermedades y entre los 2 subtipos1. Dichos aspectos serán abordados en el presente artículo. Asimismo se comentarán aspectos generales del tratamiento inicial de ambas entidades, en función de su localización y gravedad, sin tener en cuenta la EC fistulizante ni los pacientes corticodependientes o corticorresistentes.
Orientación diagnóstica
Diagnóstico clínico
En la CU o la EC de colon, la presentación habitual suele ser la aparición de diarrea, consistente en varias deposiciones diarias líquidas, frecuentemente con restos de sangre roja mezclada, precedidas de dolor abdominal cólico, generalmente en hipogastrio y flancos, en los cuadros de mayor gravedad con fiebre y mayor número de deposiciones.
En otras ocasiones, el paciente refiere síntomas o signos aislados. En caso de afectación rectal leve, la enfermedad se puede manifestar como rectorragia terminal repetida. Si el paciente presenta actividad en íleon terminal, puede aparecer dolor fijo en la fosa ilíaca derecha como único síntoma2.
Diagnóstico de laboratorio
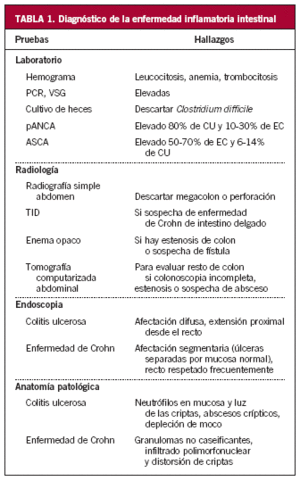
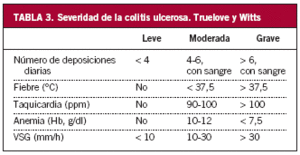
La evaluación de un paciente con EII debe incluir la realización de hemograma, velocidad de sedimentación eritrocitaria (VSG), bioquímica de sangre, que incluya determinación de electrolitos, pruebas de función hepática, hierro, ferritina, transferrina y proteína C reactiva (PCR). Característicamente, podemos encontrar anemia ferropénica, leucocitosis, trombocitosis, elevación de las cifras de PCR, VSG o alfa-1-glucoproteína, en mayor o menor medida según la gravedad del brote (tabla 1).
Algunos marcadores serológicos también pueden ser útiles en el diagnóstico. Los anticuerpos anticitoplasma de los neutrófilos (pANCA) se encuentran elevados en la mayoría de los pacientes con CU y en el 10-30% de quienes presentan una EC del colon. Los anticuerpos anti-Saccharomyces (ASCA) se encuentran presentes en el 50-70% de los casos de EC y en el 6-14% de los que presentan CU3.
Debe realizarse cultivo de heces y determinación de toxina de Clostridium difficile en ellas.
Diagnóstico endoscópico
Sin embargo, el diagnóstico definitivo de afección colorrectal lo establece la endoscopia digestiva baja con toma de biopsias.
Si el cuadro es leve o moderado, se puede explorar con seguridad todo el colon4. Pero si el paciente presenta síntomas o signos de actividad severa, se debe realizar únicamente rectosigmoidoscopia para minimizar el riesgo de perforación.
La exploración endoscópica permite diferenciar entre los dos tipos de EII y determinar la extensión y gravedad de la actividad inflamatoria5.
Diagnóstico endoscópico de la colitis ulcerosa
La CU se caracteriza por una afectación difusa consistente en edema, eritema, friabilidad, fragmentación del reflejo luminoso, borramiento del dibujo vascular acompañado, en las formas leves, de múltiples úlceras puntiformes y, en las severas, de úlceras de mayor tamaño, más o menos excavadas. Habitualmente comienza en el recto distal y se extiende proximalmente de una manera difusa, en la proctitis sólo afecta al recto; en la proctosigmoiditis, al recto y el sigma; en la colitis izquierda, a descendente, sigma y recto; en la extensa, hasta el ángulo hepático, y en la pancolitis, o CU universal, a la totalidad del colon y el recto6.
No es necesario repetir la exploración endoscópica cada vez que el paciente presente un brote de actividad, puesto que éste se sospecha por la clínica. Sólo es necesario si la respuesta al tratamiento no es óptima, ya que permite descartar sobreinfección por CMV o extensión proximal de la enfermedad en colitis distales.
Diagnóstico endoscópico de la enfermedad de Crohn
En la EC, por el contrario, la actividad no es difusa, sino segmentaria, y en ella se aprecian en la mucosa úlceras de diferentes tamaños, desde pequeñas úlceras aftoides (milimétricas, redondeadas, con halo eritematoso) hasta grandes úlceras geográficas y confluentes, separadas por áreas de mucosa normal. Con frecuencia el recto está respetado y, si hay afección ileal, se puede acceder al íleon por la válvula ileocecal y observar estos hallazgos en la mucosa de intestino delgado. En la CU puede haber ileítis por reflujo en los últimos 5 cm de íleon hasta en el 10-20% de los casos pero, a diferencia de la EC, se caracteriza únicamente por la aparición de eritema, pérdida del dibujo vascular e incluso erosiones, aunque sin úlceras, y en el estudio anatomopatológico no se observan los hallazgos característicos de EC que más adelante se comenta.
En fases avanzadas, tanto de la CU como de la EC, puede observarse una disminución de la haustración del colon (haustras menos marcadas), lo que le confiere una morfología tubular, y presencia de seudopólipos o pólipos inflamatorios.
Cápsula endoscópica
Esta técnica, aprobada por la FDA e introducida en nuestro país en 2001, consiste en que el paciente ingiere una cámara, en forma de cápsula ovalada, que realiza fotogramas de todo el intestino. Permite evaluar fundamentalmente el intestino delgado, puesto que por el esófago pasa rápidamente, y sólo se valora adecuadamente la transición esofagogástrica, en el estómago suele quedar retenida en el antro, enfocando únicamente el píloro, y en el colon la visualización no es posible por la existencia de heces.
Su única contraindicación son las estenosis intestinales, en las que podría quedar atrapada la cápsula, por lo que es recomendable descartar su existencia mediante un estudio radiológico antes de realizar la exploración. Algunos de los hallazgos encontrados son aftas, erosiones, úlceras o denudación vellositaria que, aunque inespecífica, suele ser el hallazgo más precoz7.
Diagnóstico histológico
Diagnóstico histológico de la colitis ulcerosa
Los hallazgos histopatológicos de la CU incluyen intenso infiltrado de neutrófilos en la mucosa y en la luz de las criptas, abscesos crípticos y depleción de moco. En la fase quiescente, la mucosa presenta un infiltrado inflamatorio menos denso y las criptas se encuentran acortadas y ensanchadas8.
Diagnóstico histológico de la enfermedad de Crohn
En la EC se produce una inflamación transmural. Los nódulos linfoides submucosos penetran en la mucosa produciendo las características úlceras aftoides, descritas en la endoscopia. En la submucosa existe fibrosis y proliferación histiocítica y en la mucosa, infiltrado polimorfonuclear, abscesos crípticos, con distorsión de la arquitectura críptica y granulomas no caseificantes que, aunque son diagnósticos, se encuentran sólo en el 10-30% de los casos8.
Es recomendable tomar muestras para biopsia tanto de las áreas afectadas como de la mucosa macroscópicamente normal, que puede presentar edema y aumento de mononucleares en la lámina propia.
Diagnóstico radiológico
Radiografía simple de abdomen
En la radiografía simple de abdomen, si el cuadro es leve o moderado, no se suele encontrar datos que respalden el diagnóstico de la enfermedad. Sin embargo, permite descartar la existencia de complicaciones, como perforación o megacolon tóxico, caracterizado por dilatación aguda del colon9,10.
Enema opaco
En general, no es recomendable solicitar este estudio si se sospecha EII, dado que el contraste tarda en eliminarse e interfiere con la exploración endoscópica. Otras limitaciones de la técnica son que no detecta lesiones superficiales, puede subestimar la extensión de la enfermedad y no se correlaciona bien con su actividad. En pacientes con afección grave puede desencadenar la aparición de megacolon tóxico.
Si se realiza, las alteraciones que se observan son, en fases iniciales, granularidad o nodularidad de la mucosa y disminución de la distensibilidad, y en fases avanzadas, engrosamiento de las haustras y ulceraciones11-13.
Tránsito de intestino delgado
Esta técnica se utiliza cuando se sospecha afección de intestino delgado por EC. En estadios iniciales se observan úlceras aftoides. Si la enfermedad avanza, aumentan de tamaño, confluyen y toman una morfología serpiginosa. Como se ha comentado, a diferencia de la CU, la inflamación es transmural, lo que puede desembocar en la aparición de fístulas o estenosis intestinales. La sensibilidad y la especificidad de la técnica en estos 2 hallazgos son superiores a las del estudio endoscópico. Si la estenosis afecta a un largo segmento, se la conoce como "signo de la cuerda"13-15.
Tomografía computarizada abdominal
En la CU esta exploración puede ser de gran ayuda para determinar la extensión de la inflamación en los pacientes en que la colonoscopia esté contraindicada y permite descartar masas en caso de estenosis colónicas. En la EC está indicada cuando se sospecha complicaciones como la aparición de abscesos13.
Diagnóstico diferencial
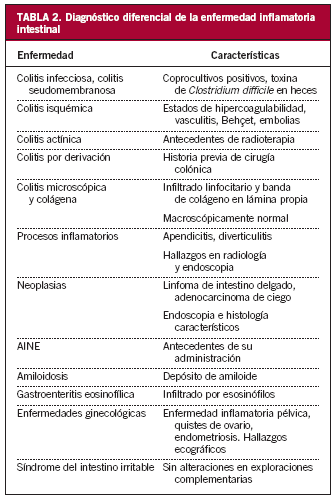
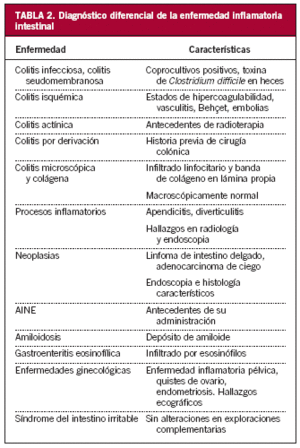
Es preciso realizar diagnóstico diferencial con otras enfermedades que pueden manifestarse con signos y síntomas similares a los de la EII mediante una cuidadosa historia clínica y exploración física, así como con las pruebas complementarias referidas con anterioridad (tabla 2).
Colitis infecciosa
Las infecciones intestinales pueden tener una presentación similar a la EII. Sin embargo, la historia clínica y el cultivo de heces permiten realizar un correcto diagnóstico.
Aproximadamente el 40% de las tuberculosis intestinales afectan al íleon semejante a la EC. En el estudio anatomopatológico se observan granulomas caseificantes en el 30-50% de los casos y la sensibilidad de la PCR en la biopsia intestinal es del 70-90%16.
Otros agentes infecciosos que se debe descartar son C. difficile, Campilobacter yeyuni, Yersinia enterocolitica, Entamoeba histolytica e Histoplasma capsulatum.
Síndrome del intestino irritable
En esta entidad el paciente puede referir dolor, distensión abdominal y diarrea. Sin embargo, no hay deterioro del estado general ni alteraciones en los estudios complementarios17.
Isquemia intestinal
Estados de hipercoagulabilidad, como la deficiencia de proteína C o de proteína S, el síndrome antifosfolipídico, algunas vasculitis (como el lupus eritematoso sistémico, la púrpura de Schönlein-Henoch o el síndrome de Churg-Strauss), los anticonceptivos orales, la malrotación intestinal o las embolias pueden originar isquemia ileal clínicamente indistinguible de una EC. La enfermedad de Behçet también puede afectar al tracto gastrointestinal, más frecuentemente a nivel ileocecal, aunque suele acompañarse de úlceras orales, oculares o genitales.
Colitis actínica
En la colitis por radiación o actínica, el paciente refiere haber recibido sesiones de radioterapia, incluso años antes del comienzo del cuadro, con mayor frecuencia para el tratamiento de tumores ginecológicos o de próstata.
Colitis por diversión o derivación
La colitis por diversión o derivación, caracterizada por la exclusión de un segmento de colon o recto del tránsito intestinal, se produce en pacientes sometidos a colostomía o ileostomía.
Colitis microscópica y colágena
En ambas entidades, de etiología desconocida, se observa en el estudio anatomopatológico un infiltrado linfocitario acompañado en la segunda de depósito de una gruesa banda de colágeno en la lámina propia. Se caracterizan porque, a diferencia de la EII, la diarrea es líquida, abundante, sin elementos anormales y el paciente, generalmente mujeres de mediana edad, no presenta síntomas asociados. El aspecto macroscópico de la mucosa en la endoscopia es normal y sólo se llega al diagnóstico si se toman muestras aleatorias de la mucosa18,19.
Procesos inflamatorios
El cuadro que con más frecuencia simula una ileítis es la apendicitis. En ocasiones la diverticulitis cecal puede producir engrosamiento de la pared, semejante a una EII20,21.
Afecciones ginecológicas
Cuadros ginecológicos como la enfermedad inflamatoria pelviana, los quistes ováricos, el embarazo ectópico o la endometriosis pueden iniciarse como episodios intermitentes de dolor abdominal.
Neoplasias
Neoformaciones de localización ileal (como el carcinoide, el linfoma no hodgkiniano, el linfosarcoma) o cecal, como el adenocarcinoma, pueden tener una forma de presentación parecida a la EC22.
En otras ocasiones las metástasis de cáncer de mama, piel, estómago o páncreas pueden afectar al íleon.
Otros
La infiltración del íleon por depósito amiloide, en la amiloidosis, o por eosinófilos, en la gastroenteritis eosinofílica, y la toma de antiinflamatorios no esteroideos puede dar origen a ulceración, obstrucción, perforación o sangrado23,24.
Orientación terapéutica
El tratamiento en la EII debe ir dirigido, por un lado, a inducir la remisión, es decir, a frenar y curar la inflamación intestinal, lo cual depende de la extensión y la gravedad de la enfermedad, y, por otro, a mantener la remisión obtenida25.
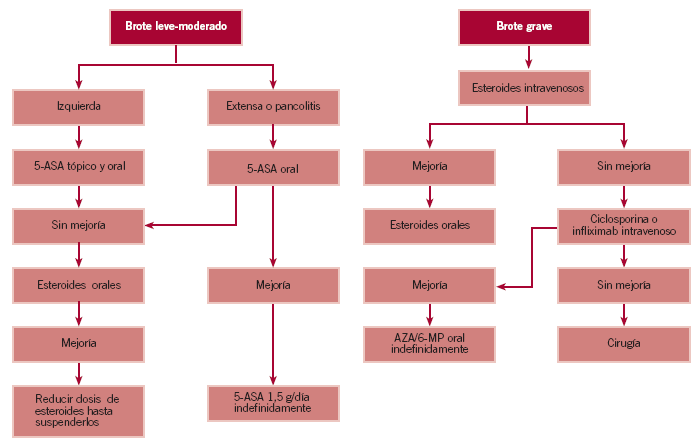
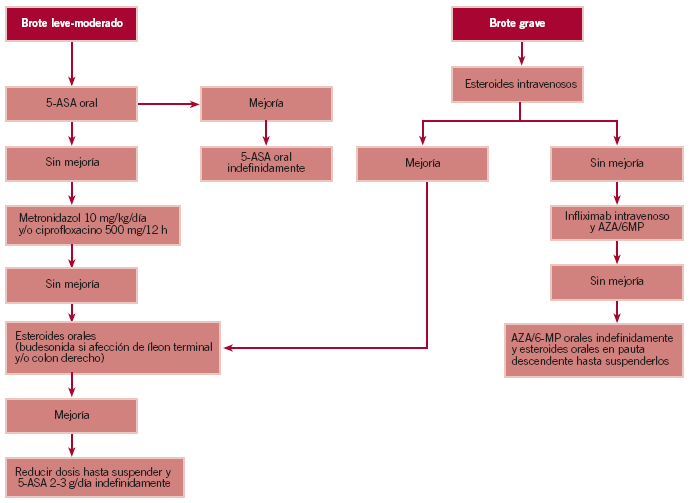
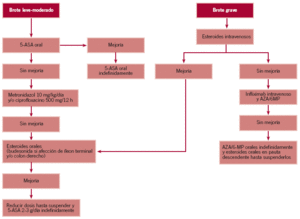
Tratamiento del brote en la colitis ulcerosa (fig. 1)
Figura 1. Tratamiento de la colitis ulcerosa.
La gravedad del brote se determina fundamentalmente por la clínica. Si un paciente presenta fiebre, deshidratación, hipotensión, más de 10 deposiciones diarias, rectorragia severa o peritonismo, debe ser ingresado. En caso contrario se le puede tratar ambulatoriamente (tabla 3)26.
Brote leve-moderado
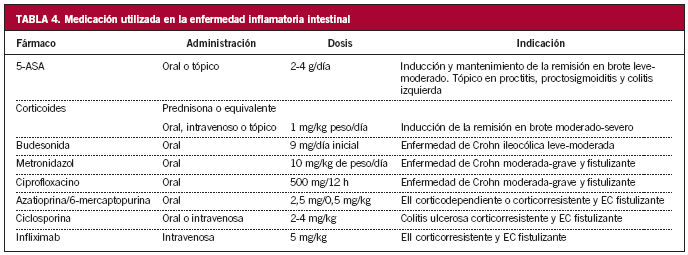
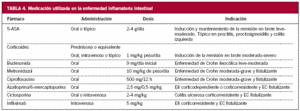
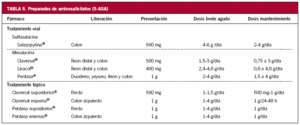
Si se trata de un brote leve o moderado, el tratamiento para inducir la remisión depende de cuál sea la extensión de la enfermedad (tablas 4 y 5).
Proctitis ulcerosa
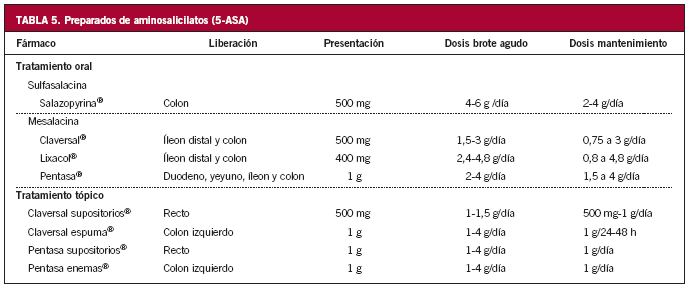
El tratamiento más efectivo, y con menos efectos secundarios, para inducir la remisión es la administración de aminosalicilatos (mesalacina) tópicos, en supositorios o enemas27-29.
En caso de no obtenerse respuesta, se debe realizar coprocultivos para descartar infecciones concomitantes, así como una rectosigmoidoscopia, para valorar si la afección mucosa se ha extendido proximalmente, hecho que se produce hasta en el 30% de los pacientes inicialmente diagnosticados de proctitis30-33.
Colitis izquierda
El primer escalón en el tratamiento debe ser la administración de mesalacina en enemas. En este caso los supositorios no alcanzan la flexura esplénica, aunque pueden mejorar los síntomas si se añaden al tratamiento34.
Los aminosalicilatos por vía oral como único tratamiento son menos efectivos y tardan más en hacer efecto, pero el tratamiento combinado (tópico y oral) es más efectivo que el tratamiento tópico aislado35-37.
Si el paciente no mejora con el tratamiento, es necesaria la administración de corticoides, preferiblemente en enemas y, si es necesario, por vía oral, como se explica a continuación.
Colitis extensa y pancolitis
En este caso el tratamiento tópico no es efectivo, por lo que el primer paso debe ser aumentar la dosis de 5-ASA, 3-4 g de sulfasalacina o 2,4-4,8 g de mesalacina. Sin embargo, la administración tópica de 5-ASA o esteroides puede ser de ayuda en reducir los síntomas distales, como tenesmo o urgencia fecal.
Si a pesar de administrar 5-ASA a dosis óptimas no se obtiene mejoría, se debe administrar corticoides sistémicos. La dosis inicial suele ser 20-40 mg/día de prednisona, hasta que se alcanza la remisión, y posteriormente se va reduciendo gradualmente. Por ejemplo, 5 mg cada semana hasta llegar a 20 mg y, a partir de entonces, 2,5 mg cada semana o 5 mg cada 2 semanas. La dosis máxima de mesalacina debe mantenerse durante este tiempo.
Brote grave
En este caso el paciente debe ser ingresado con dieta absoluta y recibir tratamiento con sueroterapia y esteroides intravenosos, a dosis de 32-48 mg de metilprednisolona o 300-
400 mg de hidrocortisona. Dosis superiores no suponen un mayor beneficio y aumentan los efectos secundarios.
Generalmente, los aminosalicilatos se mantienen por vía oral, pero se debe evitar los antidiarreicos y analgésicos opiáceos para no desencadenar un megacolon tóxico. Estos fármacos, por el contrario, pueden ser utilizados en los brotes leves-moderados.
La adición de enemas de hidrocortisona puede aliviar los síntomas distales.
Cuando el paciente comienza a mejorar, se sustituyen los esteroides intravenosos por esteroides orales y se inicia dieta pobre en residuo. Si continúa evolucionando favorablemente, se puede reducir gradualmente la dosis, como se ha explicado previamente, hasta suspenderlos.
Por el contrario, si pasada una semana de tratamiento adecuado con corticoides no se obtiene ninguna mejoría, se considera que el paciente tiene resistencia a ese tratamiento y se debe iniciar otro con ciclosporina (CyA) intravenosa, a dosis de 2-4 mg/kg/día. Es necesario mantener concentraciones del fármaco en suero de 350-550 ng/ml, para lo cual se precisa monitorizarlas diariamente, y puede originar graves efectos secundarios, principalmente nefrotoxicidad38-43. Por ello, una alternativa propuesta, y que parece ser eficaz, es la administración de infliximab intravenoso44-46. Si a pesar de la admimistración de uno de estos dos tratamientos se sigue sin conseguir beneficio terapéutico, la proctocolectomía es la única opción.
Cuando se inicia la administración de CyA, generalmente se mantienen los esteroides intravenosos y se debe comenzar el tratamiento con azatioprina (AZA) o 6-mercaptopurina (6-MP) vía oral47.
Una vez el paciente es dado de alta, se puede mantener la CyA oral en concentraciones de 200-350 ng/ml. Otra opción que parece ser igualmente eficaz es suspender la CyA y administrar junto al tratamiento esteroideo únicamente AZA/
6-MP oral48,49.
Tratamiento de mantenimiento de la colitis ulcerosa
Una vez alcanzada la remisión, la probabilidad de recidiva de la CU a los 6-12 meses, sin tratamiento, puede llegar hasta el 75%. Por ello es necesario que el paciente continúe con tratamiento con aminosalicilatos orales, habitualmente a dosis de 1,5 g diarios. Si mantiene la remisión completa durante al menos 2 años, se puede intentar suspender el tratamiento, aunque lo habitual es que se mantenga de manera indefinida50.
Los corticoides orales o tópicos son ineficaces en el mantenimiento de la remisión.
Como se ha comentado en el tratamiento del brote grave, una opción tras la inducción de la remisión con CyA intravenosa para mantenerla es introducir AZA, a dosis de 2,5 mg/kg/día, en lugar de CyA oral (6-8 mg/kg). Esta alternativa parece incluso superior y presenta menos riesgo de infecciones oportunistas48-52.
En los pacientes corticodependientes o corticorresistentes en que se inicia tratamiento con tiopurínicos (AZA/6-MP), aunque no está claramente establecida la duración óptima, generalmente se instaura de forma indefinida, puesto que son eficaces en prevenir la recidiva y existe riesgo de recaída cuando se los retira51,52.
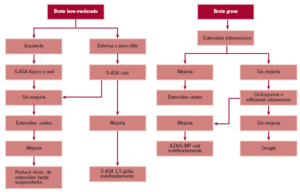
Tratamiento del brote en la enfermedad de Crohn (fig. 2)
Figura 2. Tratamiento de la enfermedad de Crohn.
Una forma estandarizada de determinar la gravedad en la EC es el CDAI (Crohn's Disease Activity Index) que puntúa 6 datos subjetivos y objetivos, con una puntuación máxima total de 600 puntos. Se considera que el paciente está en remisión si el índice se encuentra por debajo de 150 puntos, tiene actividad moderada si está entre 200 y 450, y grave si la puntuación se encuentra por encima de esa cifra. Sin embargo, en la práctica la evaluación global del paciente suele ser suficiente para determinar su gravedad53. Se debe indicar el ingreso hospitalario si está deshidratado, tiene anemia severa o presenta algún signo que indique la existencia de complicaciones, como fiebre y peritonismo, que deben hacer sospechar la presencia de un absceso abdominal, o la intolerancia a la dieta, con náuseas, vómitos y dolor abdominal, que puede indicar que el paciente tiene una estenosis intestinal54,55.
Brote leve-moderado
Al igual que en la CU, el manejo del paciente depende que cuál sea el tramo intestinal afectado (tablas 4 y 5).
Enfermedad de Crohn del colon
En este caso el tratamiento es muy similar al comentado en la CU, aunque las dosis necesarias para el mantenimiento de la remisión son superiores en la EC que en aquélla, como se indica más adelante.
Por otro lado, la antibioterapia con metronidazol a dosis de 10-20 mg/kg/día o 500 mg de ciprofloxacino/12 h puede ser efectiva en algunos pacientes con EC que no mejoran con aminosalicilatos56,57.
Si no se observa mejoría ni con 5-ASA ni con antibióticos, se comienza tratamiento con 20-40 mg/día de prednisona, y posteriormente se va reduciendo paulatinamente la dosis hasta su retirada.
En caso de que la actividad inflamatoria se encuentre localizada en íleon terminal y colon derecho, es recomendable la utilización de budesonida oral (Entocort®), corticoide efectivo en la EC en esa localización con menos efectos secundarios indeseables sistémicos que los esteroides tradicionales. Habitualmente se comienza con 9 mg/día en una sola dosis (3 comprimidos de 3 mg) durante 8-10 semanas y se reduce paulatinamente en intervalos de 3 mg58-60.
Enfermedad de Crohn de intestino delgado
En estos pacientes la mesalacina debe ser el primer escalón terapéutico, a dosis de 3 a 4,8 g/día. Si no se obtiene mejoría en 2-4 semanas, puede añadirse ciprofloxacino o metronidazol, a las dosis descritas con anterioridad, y si a pesar de ello el paciente no mejora o empeora, se comienza con esteroides.
Enfermedad de Crohn esofagogastroduodenal
En este caso los aminosalicilatos no son efectivos, puesto que se liberan más distalmente, por lo que suele ser necesaria la administración de esteroides. El omeprazol, a dosis de 40 mg/día, puede ser útil como coadyuvante en la inducción y el mantenimiento de la remisión.
Brote grave
Si el paciente presenta signos o síntomas de actividad severa, debe ser ingresado y recibir esteroides intravenosos.
En los casos que no mejoran después de una semana de tratamiento esteroideo a dosis óptimas, la CyA no es eficaz, por lo que se plantea el tratamiento con infliximab intravenoso. Este anticuerpo anti-TNF habitualmente se administra a dosis de 5 mg/kg a las 0, 2 y 6 semanas, aunque la duración de la remisión suele ser de 2-3 meses, por lo que posteriormente se suele requerir reinfusiones del fármaco cada 8 semanas61,62. Al igual que en la colitis ulcerosa debe iniciarse tratamiento con AZA/6-MP52,63.
Tratamiento de mantenimiento de la enfermedad de Crohn
La tendencia a la recidiva en la EC es superior que en la CU y, sin embargo, el tratamiento de mantenimiento con 5-ASA no parece disminuir significativamente la probabilidad de recidiva64. A pesar de ello se suele mantenerlos de manera indefinida, a dosis superiores a las establecidas en CU, habitualmente 2-3 g/día, puesto que en algunos estudios han demostrado ser útiles en la prevención de la recaída en algún subgrupo de pacientes65.
AZA/6-MP son efectivas en mantener la remisión a dosis de 2-2,5 mg/kg/día. Al igual que en la CU no está establecida la duración del tratamiento66.
Budesonida oral no es eficaz en el mantenimiento de la remisión67.