Revisión
Los autores de este artículo, todos ellos dermatólogos, nos ofrecen una revisión práctica de la patogénesis, la epidemiología, los factores de riesgo, la clínica, el diagnóstico, el tratamiento y la prevención de la infección por molusco contagioso, una enfermedad viral bastante frecuente. La información facilitada puede ser de gran utilidad al farmacéutico, ya que le permitirá ofrecer a las personas que le consultan en el mostrador información precisa y actualizada sobre los distintos aspectos de la infección, en especial los relacionados con las medidas preventivas y los tratamientos farmacológicos.
El molusco contagioso es una lesión contagiosa frecuente, que está causada por un virus de la familia pox-virus, Molluscipoxvirus molusco contagioso. Este virus produce una erupción papular benigna autolimitada que se manifiesta en forma de pápulas múltiples umbilicadas. Esta enfermedad viral común se limita a las membranas superficiales y mucosas. La transmisión requiere el contacto directo con los individuos infectados o la contaminación mediante objetos contaminados (fomites). De forma general se piensa que infecta a los humanos exclusivamente, pero hay informes aislados de molusco contagioso en pollos, gorriones, palomas, chimpancés, canguros, un perro y un caballo. La infección se distribuye por todo el orbe y tiene una incidencia más alta en los niños, los adultos sexualmente activos y los individuos immunodeficientes.
PATOGÉNESIS
Como se ha señalado, la infección se produce por el contacto con personas infectadas, fomites o por autoinoculación, diseminándose localmente por extensión del virus de las lesiones hacia áreas adyacentes de la piel.
Los estudios epidemiológicos realizados sugieren que la transmisión podría estar relacionada con factores tales como la humedad, el calor y la falta de higiene. La enfermedad es rara en menores de 1 año, debido quizá a la inmunidad transmitida por la madre y al largo período de incubación. En climas calurosos en los que el contacto con otros niños es estrecho y la higiene personal más pobre, la propagación dentro de las guarderías no es infrecuente (con un pico máximo de incidencia entre los 2 y 4 años, según autores). En climas fríos en los que la propagación dentro de las guarderías es rara, las infecciones son más frecuentes en pacientes de más edad.
El baño público en piscinas ha sido relacionado con infecciones en la infancia, con un pico de incidencia entre los 8 y 12 años, según diferentes estudios. Un pico de incidencia más tardío en adultos jóvenes se atribuye a transmisión sexual, como sugiere la frecuente localización pubiana de las lesiones en estos casos.
El tiempo medio de incubación varía entre 2 y 7 semanas, pudiendo extenderse hasta 6 meses.
Infección
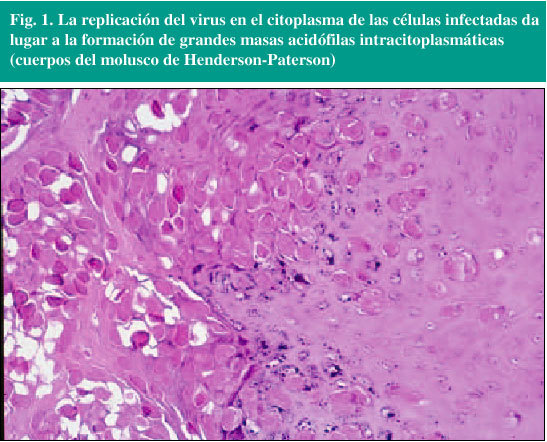
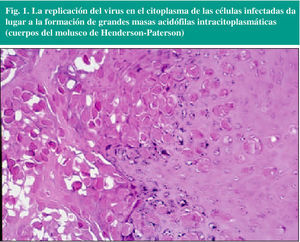
El virus del molusco contagioso afecta inicialmente a las células de la capa basal de la epidermis, donde se duplica la tasa de división celular con respecto a la piel no lesionada. El virus se replica en el citoplasma de los queratinocitos (fig. 1), y existe un incremento aparente del número de receptores para el factor de crecimiento epidérmico en los mismos, lo que se traduce histológicamente en forma de una hipertrofia e hiperplasia de la epidermis. La acumulación de cuerpos de inclusión (correspondientes a acúmulos de partículas virales) en el citoplasma conduce a la rotura celular e infección de las células adyacentes, dando lugar a extensos cuerpos hialinos que se conocen como «cuerpos de molluscum». Las células distorsionadas y destruidas se encuentran en gran número cerca de la superficie epidérmica (capa córnea), en el centro de la lesión, envueltas por una red fibrosa.
Fig. 1. La replicación del virus en el citoplasma de las células infectadas da lugar a la formación de grandes masas acidófilas intracitoplasmáticas (cuerpos del molusco de Henderson-Paterson)
La infección por el virus causa una hiperplasia e hipertrofia de la epidermis, con presencia de partículas virales libres en todas las capas de la epidermis.
CAUSAS, INCIDENCIA Y FACTORES DE RIESGO
Desde hace mucho tiempo, es bien conocida la distribución mundial del virus de Molluscum, aunque la incidencia de la enfermedad no ha sido realmente estudiada.
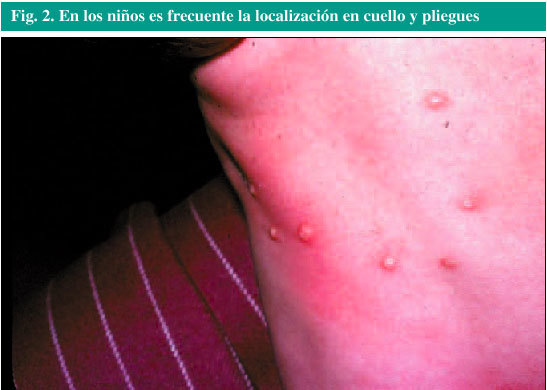
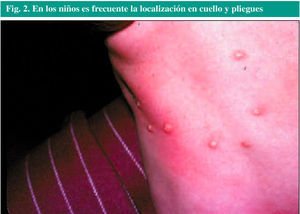
La enfermedad es más prevalente en los niños. Las lesiones características (fig. 2) se observan frecuentemente en la cara, el cuello, las axilas, los brazos y las manos, pero pueden aparecer en cualquier parte del cuerpo, excepto en las palmas de manos y pies. En ocasiones se ven en los genitales.
Fig. 2. En los niños es frecuente la localización en cuello y pliegues
En los adultos, los moluscos aparecen en la región genital y perigenital como una enfermedad de transmisión sexual. En las personas con inmunodepresión causada por el virus de la inmunodeficiencia humana pueden observarse formas extensas y fulminantes de molusco contagioso, que frecuentemente afectan a la cara. La enfermedad es endémica, con una incidencia más alta dentro de las instituciones y comunidades donde existe hacinamiento y mala higiene. Durante los últimos 30 años su incidencia ha aumentado, principalmente como enfermedad de transmisión sexual, y en particular como resultado de la propagación de la infección del virus de la immunodeficiencia humana (VIH). Entre el 5 y el 20% de los pacientes con VIH presentan infección sintomática por virus de molusco contagioso (MCV). Hay cuatro subtipos principales de molusco: MCV I, MCV II, MCV III, y MCV IV. Todos los subtipos causan lesiones clínicas similares en el área genital y en áreas no genitales. Los estudios efectuados demuestran que MCV I parece ser el subtipo más prevalente (75-90%), excepto en los individuos immunocomprometidos. Sin embargo, existen variaciones regionales en el predominio de un subtipo dado y diferencias entre los subtipos individuales en diversos países.
MANIFESTACIONES CLÍNICAS
El MCV produce una erupción papular formada por múltiples lesiones umbilicadas. La lesión del molusco empieza con una pequeña pápula que luego se agranda formando un nódulo coloreado perlado con un carácter opalescente. El nódulo, a menudo, tiene un hoyuelo o depresión central que le confiere un aspecto umbilicado blanco, ceroso.
El tamaño de la pápula es inconstante, dependiendo de la fase de desarrollo, pero normalmente miden entre 2 y 6 mm y no son dolorosas. Además, las pápulas pueden inflamarse espontáneamente, en ocasiones precediendo a su autorresolución o después de traumatismos, y presentar cambios de tamaño, forma y color.
El rascado u otras formas de irritación local hacen que el virus se extienda en línea o formando grupos (véase la imagen de apertura de este artículo). En la madurez del molusco, la punta del nódulo se puede abrir con una aguja estéril y se ve un núcleo de aspecto céreo que puede extruirse mediante una suave presión. En los pacientes immunodeprimidos las pápulas pueden tener un diámetro mayor de 1 cm y presentar una diseminación considerable.
Cualquier superficie cutánea puede verse afectada, pero los sitios predominantes son las axilas, el pliegue antecubital, el hueco poplíteo y las ingles, aunque existen algunos casos descritos en la boca o la conjuntiva. La autoinoculación es frecuente.
En los adultos el MCV afecta a las ingles, el área genital y los muslos, y a menudo es adquirido sexualmente.
En alrededor de un 10% de los casos se desarrolla una dermatitis eccematosa alrededor de las lesiones, que desaparece con la resolución de la infección. Se ha descrito una asociación entre el molusco contagioso y la dermatitis atópica. Se postula que el incremento en la susceptibilidad a la infección cutánea viral podría estar en relación con la solución de continuidad ocasionada por la piel eccematosa, que constituiría una puerta de entrada, y con factores inmunológicos, por una alteración funcional de los linfocitos T.
En pacientes con síndrome de inmunodeficiencia adquirida, en los que la prevalencia de la infección oscila, según se ha descrito, entre el 10 y el 20%, las lesiones pueden ser extensas y refractarias al tratamiento. La presentación de la enfermedad en los pacientes con infección por el virus de la inmunodeficiencia humana es atípica. El número de lesiones puede sobrepasar el centenar, y en contraste con los individuos seronegativos, las lesiones suelen localizarse en la región facial, cuello y tronco, pudiendo simular otras infecciones, como criptococosis, histoplasmosis, coccidiomicosis o pneumocistosis cutánea. La gravedad de la infección por molusco se correlaciona con el recuento de linfocitos T CD4+ (colaboradores).
El molusco contagioso es una infección crónica. Las lesiones pueden permanecer inmodificadas o también pueden ir apareciendo nuevas lesiones durante meses o años, aunque en los individuos no inmunocomprometidos al final desaparecen sin dejar cicatrices. Las lesiones primarias pueden ser confundidas con herpes pero, a diferencia de lo que ocurre en este caso, no son dolorosas.
El aspecto clínico del molusco contagioso es suficiente para que el dermatólogo haga el diagnóstico en la mayoría de los casos
ANÁLISIS Y PRUEBAS
El aspecto clínico del molusco contagioso es suficiente para que el dermatólogo haga el diagnóstico en la mayoría de los casos. Aunque no puede cultivarse en el laboratorio, el examen histopatológico del material de curetaje (legrado con una cucharilla) o la biopsia de la lesión también pueden ayudar al diagnóstico en los casos que no son clínicamente obvios. El centro blanco espeso puede teñirse con tinciones de Giemsa, Gram, Wright, o Papanicolaou para demostrar los cuerpos de inclusión. La microscopía electrónica también se ha usado para demostrar las estructuras del poxvirus y los métodos de immunohistoquímica permiten el reconocimiento de molusco contagioso en el tejido fijado. También se ha utilizado la hibridación in situ para MCV, pero en general todas estas técnicas no son necesarias para hacer un diagnóstico adecuado.
En conclusión, el médico debe examinar las lesiones y basándose en su apariencia, descartar otros problemas. En caso de duda, el diagnóstico puede confirmarse con el estudio histopatológico.
DIAGNÓSTICO DIFERENCIAL
Las lesiones de molusco contagioso deben diferenciarse de la verruga vulgar, el condiloma acuminado, la varicela, el herpes simple, papilomas, epiteliomas, pioderma, criptococosis cutánea, quistes de inclusión epidérmicos, carcinoma basocelular, granuloma anular papular, queratoacantoma, liquen plano, siringomas y otros tumores anexiales.
PREVENCIÓN
Es preciso evitar el contacto directo con las lesiones y tener cuidado en las relaciones sexuales, utilizando el preservativo, que puede ayudar en la prevención de esta infección viral. Los preservativos pueden prevenir la expansión del virus cuando se usan de forma adecuada, siendo la mejor protección ante la enfermedad cuando la pareja sexual es desconocida, y para la prevención del contagio, no sólo del molusco contagioso sino también de otras enfermedades infecciosas.
TRATAMIENTO
El molusco contagioso es una enfermedad autolimitada que se resuelve sin tratamiento en el individuo immunocompetente; sin embargo, en los pacientes atópicos y en los individuos inmunocomprometidos puede prolongarse su evolución.
En ocasiones las lesiones se erosionan y pueden sobreinfectarse como consecuencia del rascado por el propio paciente, lo que puede dar lugar a la formación de cicatrices. Además, algunas escuelas y guarderías no admiten a los niños con lesiones visibles.
En las personas con un sistema inmunitario normal, las lesiones desaparecen espontáneamente en un período de meses o años. En las personas inmunodeficientes, y especialmente en pacientes con sida, las lesiones pueden ser diseminadas y de gran tamaño. Las lesiones individuales pueden extirparse por métodos cruentos, mediante curetaje, congelación, electrofulguración o incluso láser, o mediante la aplicación de cáusticos. Algunos pacientes buscan la asistencia médica por razones cosméticas y por el miedo de inocular a otros individuos. La decisión terapéutica debe efectuarse de forma personalizada. Puede ser necesario efectuar tratamientos repetidos por el hecho de que existen lesiones subclínicas inaparentes en el momento de la primera visita y sucesivas. La mayoría de los tratamientos comúnmente empleados son de naturaleza destructiva y se describen más abajo, aunque la práctica de «esperar y ver» puede ser la mejor opción en gran parte de los casos. En los niños, debe evitarse someter al paciente a un tratamiento demasiado traumático para una condición benigna autolimitada; el dolor y sangrado al curetaje causan una honda impresión en los pacientes y sus cuidadores, y los anestésicos tópicos no son totalmente eficaces en muchos casos. En opinión de los autores, ni la sedación ni la anestesia general están justificadas en la mayoría de los casos para tratar este tipo de lesiones. Cuando los pacientes desean librarse de las pápulas, hay varios métodos de destrucción terapéutica para ayudar a acelerar la resolución de la infección. La decisión sobre el tratamiento depende de las necesidades del paciente, lo recalcitrante de su enfermedad y la probabilidad de que los tratamientos produzcan una alteración de la pigmentación o dejen cicatrices. Recientemente se han probado tratamientos antivirales e inmunomoduladores, sobre todo en pacientes immunocomprometidos cuyas infecciones son difíciles de erradicar.
Los tratamientos empleados pueden clasificarse en destructores e inductores de respuesta inmunitaria. Las terapias destructoras podrían realizarse en atención primaria en pacientes inmunocompetentes. Son criterio de derivación a consulta especializada dermatológica la presencia de lesiones exten- sas, rebeldes a tratamientos convencionales y en pacientes inmunodeprimidos.
A continuación se hace un breve resumen de las diferentes opciones terapéuticas.
TERAPIA DESTRUCTORA DE LESIONES
En este apartado cabe hablar de la criocirugía, la extrusión, el curetaje, la electrodesecación, la aplicación de cantaridina, podofilina, podofilotoxina o hidróxido de potasio y el láser de colorante pulsado.
Criocirugía
Consiste en la congelación de la cúpula de las lesiones con spray de nitrógeno líquido durante unos segundos. Habitualmente se asocia con escaso dolor. Esta técnica debe conseguir una congelación rápida y descongelación lenta en dos ciclos para la destrucción de las lesiones, evitando contactar con la zona circundante. Es una forma de tratamiento común, rápida y eficaz. Tiene el inconveniente de que se necesitan varias sesiones (con un intervalo de 2 a 3 semanas) para su resolución. Con frecuencia da lugar a hiper o hipopigmentación residuales y puede dejar cicatrices.
Extrusión
Es un método fácil para eliminar las lesiones, extrayendo su contenido con una pinza, una aguja, una hoja de bisturí, una lanceta, un palillo o cualquier otro instrumento capaz de incidir el centro umbilicado y permitir la expulsión de su contenido. Debido a su simplicidad, este método puede enseñarse a pacientes, padres y cuidadores para tratar las nuevas lesiones. Sus inconvenientes radican en que no es tolerado por los niños pequeños y si se realiza de forma inadecuada, el problema puede complicarse con sobreinfecciones añadidas.
Curetaje
Es el tratamiento más antiguo. Consiste en la extirpación de la lesión mediante el curetaje de la base de la pápula. Puede usarse con y sin electrodesecación o empleo de estípticos. Puede resultar doloroso, y se recomienda la aplicación a las lesiones de una crema anestésica tópica antes del procedimiento para disminuir en cierta medida el dolor (aunque el principal inconveniente del método es la ansiedad que produce la manipulación y el sangrado en el paciente, sus padres o cuidadores si se trata de un niño, así como en el personal sanitario). Este método tiene la ventaja de proporcionar una muestra del tejido para confirmar el diagnóstico.
Electrodesecación
Indicada en lesiones refractarias al tratamiento, asociada al curetaje. Consiste en la electrofulguración con bisturí eléctrico. Requiere anestesia local y a veces incluso se debe considerar la anestesia general, por lo que habitualmente no se indica en niños.
Cantaridina
Es un extracto del escarabajo Cantharis vesicatoris. Se trata de una enzima que penetra en la epidermis e induce vesiculación por acantólisis. Se aplica mezclada en colodión flexible con el extremo romo de un aplicador en cada lesión, evitando contactar con la piel sana. Se reevalúa la eficacia del tratamiento a las 2-4 semanas, repitiéndolo según la evolución de las lesiones. Debe probarse en lesiones individuales antes de tratar un gran número de lesiones. No debe usarse en la cara. Si el tratamiento es bien tolerado, debe repetirse todas las semanas hasta que las lesiones desaparezcan. Normalmente se requieren de 1 a 3 tratamientos.
Esta opción ha resultado efectiva en lesiones individuales, reduciendo la propagación del virus, pero no hay evidencia de que influya en el curso de la infección. Es un método no doloroso en el momento de la aplicación, a diferencia del curetaje y la crioterapia.
Respecto a los efectos secundarios, se forman ampollas con mucha frecuencia y también se puede presentar temporalmente dolor de leve a moderado, eritema, prurito, infección bacteriana secundaria, sensación de quemazón, hipo o hiperpigmentación postin- flamatoria y cicatrices frecuentes.
Podofilina y podofilotoxina
En suspensión al 25% en tintura de benjuí o alcohol para ser aplicada una vez por semana. Este tratamiento requiere algunas precauciones. Algunos de los efectos colaterales que puede causar incluyen el daño erosivo severo en la piel normal adyacente, marcando con cicatrices. Además puede tener efectos sistémicos como la neuropatía periférica, daño renal, íleon adinámico, leucopenia y trombocitopenia, sobre todo si se usa en las superficies mucosas. La podofilotoxina es una alternativa más segura al podofilino y puede ser usada por el paciente en su casa. Están contraindicadas absolutamente en el embarazo.
Hidróxido de potasio
Una buena opción de tratamiento de primera línea es la aplicación de solución acuosa de hidróxido de potasio (KOH) al 10%, que se aplica tópicamente dos veces al día en todas las lesiones con un palillo (no una torunda). El tratamiento se suspende cuando se obtiene una reacción inflamatoria o la erosión superficial de las lesiones, con formación de costras. La resolución se produce en un promedio de 30 días. Son complicaciones ocasionales de este tratamiento la formación de hipo e hiperpigmentación transitoria o persistente, la sobreinfección y, ocasionalmente, cicatrices. Un estudio en pacientes pediátricos que empleaba solución de KOH al 5% ha demostrado una eficacia similar con muchos menos efectos adversos.
Láser de colorante pulsado (585 nm)
El mecanismo de acción del láser de 585 nm es la fotodermólisis. Dependiendo del tamaño de las lesiones, se pueden utilizar diferentes intensidades. Se realiza en una sesión. Las lesiones suelen desaparecer entre 2 semanas y 3 meses después del tratamiento. Es un método habitualmente no doloroso, bien tolerado por los pacientes y no suele dejar cicatriz ni producir sangrado.
Los estudios muestran que un 96-99% de las lesiones se resuelve después de un tratamiento. El láser de colorante pulsado es rápido y eficaz, aunque su coste puede ser un inconveniente.
TRATAMIENTO ANTIVÍRICO: CIDOFOVIR
El cidofovir es un análogo del nucleótido monofosfato de desoxicitidina que posee un amplio espectro de actividad contra los virus ADN. Se ha utilizado por vía intravenosa o tópica (crema al 1-3%).
En la actualidad el cidofovir sólo está autorizado para ser administrado por vía intravenosa para el tratamiento de la retinitis por citomegalovirus.
Se ha empleado en pacientes infectados por el virus de la inmunodeficiencia humana con lesiones extensas y recalcitrantes de molusco contagioso que no respondían a los tratamientos convencionales. En estos individuos no existe la tendencia a la resolución espontánea, y persisten las lesiones durante años, aunque existe una gran mejoría en los pacientes que reciben tratamiento antirretroviral de alta actividad.
Se ha utilizado por vía intravenosa a dosis de 2-5 mg/kg por semana durante 2 semanas y posteriormente a estas mismas dosis, cada 2 semanas hasta la desaparición de las lesiones, en combinación con otros antirretrovirales. Respecto al tratamiento tópico con cidofovir al 3% aplicado 2 veces al día durante dos semanas en pacientes con VIH sometidos a tratamiento antirretroviral sin respuesta a otros tratamientos, se ha observado remisión al cabo de 2-4 semanas de finalizar el tratamiento. Probablemente el tratamiento tópico sería adecuado en la mayoría de los casos de infección por virus del molusco contagioso en inmunodeprimidos, debiendo reservarse el tratamiento intravenoso para casos muy recalcitrantes y graves.
Los resultados han sido esperanzadores, ya que existe una relación temporal entre la instauración del tratamiento con cidofovir y la desaparición de las lesiones. Además, cidofovir tiene actividad conocida o predecible contra el virus del molusco, a diferencia de los inhibidores de la transcriptasa inversa y los inhibidores de la proteasa, que contribuyen de forma indirecta mejorando la función inmunitaria en estos pacientes. Sin embargo, a pesar de los buenos resultados, es necesario realizar nuevos ensayos clínicos para corroborar esta hipótesis.
Está contraindicado en pacientes con insuficiencia renal, tratados con medicamentos nefrotóxicos, en presencia de hipersensibilidad al fármaco y durante el embarazo.
TERAPIAS INDUCTORAS DE RESPUESTA INMUNE
La principal indicación de este tipo de agentes son las infecciones por molusco contagioso en pacientes inmunodeprimidos.
Imiquimod
Se trata de un modificador de la respuesta inmunitaria. Actúa eliminando la infección viral. El mecanismo de acción no está completamente claro, pero estudios experimentales metodológicamente correctos sugieren que está involucrado en la estimulación del sistema inmunitaria celular a través de la producción de citocinas. Se han demostrado sus propiedades inmunoadyuvantes en modelos animales, probablemente debido a su capacidad para inducir la producción de interferón alfa, factor de necrosis tumoral (TNF) e interleucina 1 y 6. Podría contribuir a la regresión de las lesiones por incremento del tráfico de células T a la epidermis, aumentando la citotoxicidad de las células natural killer y estimulando la proliferación de las células B.
Se necesita un tiempo largo de tratamiento para que sea eficaz clínicamente, en torno a 10 semanas de promedio. La respuesta inflamatoria previa a la desaparición de las lesiones y la baja tasa de recidiva sugieren que interviene la estimulación de una respuesta inmunitaria mediada por células específicas para verrugas o molusco. Se ha aprobado el uso de imiquimod para el tratamiento de los condilomas acuminados con tres aplicaciones semanales, pero no para el tratamiento del molusco, aunque ha sido empleado con éxito variable en pacientes pediátricos, sanos o enfermos, y en adultos con inmunodeficiencia crónica. Su forma de aplicación permite la autoadministración y es un tratamiento escasamente traumático (no produce dolor, quemadura ni herida tras su aplicación), lo que es de gran importancia en la población pediátrica; sin embargo, la principal consideración es el coste económico de esta terapia y el carácter impredecible de su eficacia, lo que obliga a seleccionar adecuadamente a los pacientes según el lugar de localización y la falta de respuesta a tratamientos alternativos.
Se administra en forma de crema a una concentración del 5% para el tratamiento de verrugas comunes y molusco contagioso resistente a terapias previas. Se aplica una vez al día, 5 veces por semana, durante aproximadamente 9 semanas. Debe usarse en pacientes con menos de 100 lesiones para evitar efectos secundarios sistémicos. Entre los efectos adversos más frecuentes, se ha observado una reacción inflamatoria local en forma de eritema que ocurre entre las 2 y 4 semanas del tratamiento. Otros efectos secundarios asociados son: erosiones, prurito e infecciones bacterianas secundarias.
Cimetidina
La cimetidina por vía oral se ha usado con éxito en las infecciones extensas por molusco contagioso.
Desde hace años ha despertado interés su potencial como fármaco modulador de la respuesta inmunitaria, posiblemente bloqueando los receptores de algunos subtipos de linfocitos T e inhibiendo la inmunosupresión producida por la histamina. El mecanismo de acción de este fármaco consiste en el incremento de la inmunorreactividad a través de la inhibición de los linfocitos T supresores. La cimetidina puede aumentar la actividad de las células natural killer, así como la citotoxicidad celular dependiente de anticuerpos. Aunque el uso de esta terapia no está aprobado, la cimetidina ha sido utilizada en diferentes series para el tratamiento del molusco contagioso de localización facial y para casos extensos y recalcitrantes donde otros tratamientos resultan muy agresivos, están contraindicados o han fracasado.
Resulta un tratamiento seguro e indoloro, lo que constituye una ventaja para su uso pediátrico. Se ha usado a dosis de 30-40 mg/kg/día, en 2 o 3 tomas, durante un período de 2 a 3 meses.
Debido a que la cimetidina interactúa con muchas medicaciones sistémicas, se recomienda una revisión de las otras medicaciones del paciente.
CONCLUSIONES
En general, debe considerarse el tratamiento activo del molusco cuando:
La resolución de la enfermedad sea lenta, de más de 4 meses.
Las lesiones sean sintomáticas, produciendo un deterioro de la calidad de vida del paciente.
Si existe asociación con eccema, principalmente en pacientes con dermatitis atópica.
La elección del tratamiento dependerá de los siguientes factores:
La edad del paciente. Los niños habitualmente son menos colaboradores y presentan una mayor sensibilidad cutánea, lo cual debe tenerse en cuenta a la hora de la elección y el seguimiento de un determinado tratamiento.
Del número de lesiones. Cuanto más numerosas son, más frecuente es que se demande el tratamiento, aunque éste es más difícil y fastidioso.
De la localización de dichas lesiones. Debe tenerse precaución con las situadas en las mucosas. *
BIBLIOGRAFÍA GENERAL
Cronin TA Jr, Resnik BI, Elgart G, Kerdel FA. Recalcitrant giant molluscum contagiosum in a patient with AIDS. J Am Acad Dermatol 1996;35(2 Pt 1):266-7.
Cunningham BB, Paller AS, Garzón M. Inefficacy of oral cimetidine for non-atopic children with molluscum contagiosum. Pediatr Dermatol 1998;15(1):71-2.
Dahl MV. Imiquimod: an immune response modifier. J Am Acad Dermatol 2000; 43(1 Pt 2):S1-5.
Dohil M, Prendiville JS. Treatment of molluscum contagiosum with oral cimetidine: clinical experience in 13 patients. Pediatr Dermatol 1996;13(4):310-2.
Fernández Vozmediano JM, Manrique A. Actualización del tratamiento de las infecciones por papovavirus y poxvirus. Actualidad Dermatológica 2000;701-5.
Hengge UR, Esser S, Schultewolter T, Behrendt C, Meyer T, Stockfleth E, et al. Self-administered topical 5% imiquimod for the treatment of common warts and molluscum contagiosum. Br J Dermatol 2000;143(5):1026-31.
Hengge UR, Goos M, Arndt R. Topical treatment of warts and mollusca with imiquimod. Ann Intern Med 2000; 132(1):95.
Hughes PS. Treatment of molluscum contagiosum with the 585-nm pulsed dye laser. Dermatol Surg 1998;24(2):229-30.
Ibarra V, Blanco JR, Oteo JA, Rosel L. Efficacy of cidofovir in the treatment of recalcitrant molluscum contagiosum in an AIDS patient. Acta Derm Venereol 2000;80(4):315-6.
Katoh J, Tsuchiya K, Sato W, Nakajima M, Iida Y. Cimetidine and immunoreactivity. Lancet 1996;348(9024):404-5.
López Estebaranz JL. Epidemiología y estructura molecular del virus Molluscum contagiosum. Piel 1998;3:6-8.
Meadows KP, Tyring SK, Pavia AT, Rallis TM. Curación del molusco contagioso recalcitrante en pacientes infectados por el virus de la inmunodeficiencia humana tratados con cidofovir. Arch Dermatol 1997;8(6):27-31.
Sharma AK. Cimetidine therapy for multiple molluscum contagiosum lesions. Dermatology 1998;197(2):194-5.
Silverberg NB, Sidbury R, Mancini AJ. Childhood molluscum contagiosum: experience with cantharidin therapy in 300 patiens. J Am Acad Dermatol 2000;43(3):503-7.
Sterling JC, Kurtz J. Viral infections. En: Rook A. Textbook of Dermatology. 6th ed. Oxford: Blackwell Science, 1998; p. 995-1095.
Toro JR, Wood LV, Patel NK, Turner ML. Topical cidofovir: a novel treatment for recalcitrant molluscum contagiosum in children infected with human inmunodeficiency virus 1. Arch Dermatol 2000; 136(8):983-5.
Tyring SK, Arany I, Stanley MA, Tomai MA, Miller RL, Smith MH, et al. A randomized, controlled, molecular study of condylomata acuminata clearance during treatment with imiquimod. J Infect Dis 1998;178(2):551-5.
Waugh MA. Molluscum contagiosum. Dermatol Clin 1998;16(4):839-41.
Yen-Moore A, Van der Straten M, Carrasco D, Evans TY, Tyring SK. Cutaneous viral infections in VIH-infected individuals. Clin Dermatol 2000;18(4):423-32.