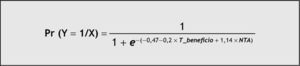Construir un modelo para predecir el riesgo de rechazo agudo al trasplante renal considerando variables relacionadas con el tratamiento inmunosupresor instaurado, el receptor, el donante y el órgano trasplantado.
MétodoEstudio de cohortes en una población de 68 pacientes con trasplante renal en tratamiento con tacrolimus en triple terapia. La predicción del riesgo de rechazo agudo se realizó mediante un análisis de regresión logística utilizando como variables explicativas la edad, sexo, presencia de retrasplante, número de incompatibilidades HLA, tiempo de isquemia fría, necrosis tubular aguda, inducción con basiliximab o timoglobulina y tipo de tratamiento. También se evaluó la contribución de variables asociadas a la determinación de la concentración sanguínea de tacrolimus, entre ellas la media de la concentración sanguínea, el número de valores por debajo e incluidos en el intervalo terapéutico predefinido, y el tiempo que dichos valores permanecían en las condiciones referidas.
ResultadosEl análisis de regresión logística indica que el riesgo de rechazo agudo depende de la necrosis tubular aguda (odds ratio [OR]=3; intervalo de confianza [IC] del 95 %, 0,7a 13,2) y del tiempo que las concentraciones sanguíneas de tacrolimus permanecen dentro del intervalo terapéutico (OR=0,8; IC del 95 %, 0,7 a 0,9).
El modelo final presenta un poder de discriminación óptimo (AUCroc: 77 %; IC del 95 %, 62a 92 %). Para el punto de corte seleccionado (probabilidad igual o superior a 0,24) el modelo presenta una sensibilidad del 83 % (IC del 95 %, 74 a 90 %) y una especificidad del 71 % (IC del 95 %, 61a 80 %).
ConclusionesEn pacientes con trasplante renal, la presencia de necrosis tubular aguda junto al tiempo de permanencia de las concentraciones sanguíneas en el intervalo terapéutico de tacrolimus predeterminado, permiten la identificación de pacientes con mayor probabilidad de aparición de un episodio de rechazo agudo durante las primeras 2 semanas postrasplante.
Create a model to predict the risk of acute rejection of kidney transplant considering variables related to the immunosuppressant agent used, the receiver, the donor and the transplanted organ.
MethodsCohort study in a population of 68 patients with kidney transplants being treated with tacrolimus triple therapy. Predicting the risk of acute rejection was carried out with a logistic regression analysis using age, sex, re-transplant status, number of HLA incompatibilities, cold ischaemia time, acute tubular necrosis, induction with basiliximab or thymoglobulin and treatment type as explanatory variables. The contribution of variables associated with determining the blood concentration of tacrolimus was also evaluated; these variables include the average blood concentration, the number of values below and included in the pre-defined therapeutic interval, and the time during which those values remained within that interval.
ResultsThe logistic regression analysis indicates that the risk of acute rejection depends on the acute tubular necrosis (OR: 3; CI 95 %, 0.7 to 13.2) and on the time that the blood concentrations of tacrolimus remains within the therapeutic interval (OR: 0.8; CI 95 %, 0.7 to 0.9).
The final model presents an optimal discrimination power (AUCroc:77 %; CI 95 %, 62 % to 92 %). For the selected cut-off point (probability greater than or equal to 0.24) the model shows a sensitivity of 83 % (CI 95 %, 74 to 90 %) and a specificity of 71 % (CI 95 %, 61 to 80 %).
ConclusionsIn patients with kidney transplants, the presence of acute tubular necrosis, together with the time the blood concentration of tacrolimus remained within the predetermined therapeutic interval, permitted the identification of patients with a higher probability of having an acute rejection episode during the first two weeks following the transplant.
El trasplante renal es el tratamiento de elección para una parte de los pacientes con insuficiencia renal crónica terminal, ya que mejora su calidad de vida y disminuye la mortalidad de los mismos. En España, el número de trasplantes renales ha aumentado considerablemente, alcanzando una cota de 2.212 trasplantes en el año 20071.
Tras el trasplante renal, si el donante y el receptor no son idénticos genéticamente, el sistema inmunitario del receptor reconoce al órgano trasplantado como un elemento extraño, desencadenando una respuesta inmunitaria de rechazo contra el nuevo órgano denominada rechazo agudo. La respuesta de rechazo agudo, mediada principalmente por inmunidad celular, suele aparecer durante el primer mes postrasplante2 y predecirá la aparición de rechazo crónico, comprometiendo la supervivencia del injerto a largo plazo3. El objetivo de la terapia inmunosupresora es controlar la respuesta inmunológica contra el órgano trasplantado; de este modo, con los nuevos inmunosupresores la incidencia de rechazo agudo ha disminuido en los últimos años hasta situarse entre un 20 y un 25 % en función del esquema de inmunosupresión4. Actualmente, las pautas de inmunosupresión se basan en una triple terapia formada por la asociación de un inhibidor de la calcineurina, a un inhibidor de la división celular o de la proteína mTor y un corticoide; su objetivo es conseguir un efecto aditivo, que con la posterior reducción progresiva de las dosis se consigue minimizar la toxicidad inherente a esta terapia5.
El estrecho índice terapéutico de los inhibidores de la calcineurina, junto a su complejo comportamiento farmacocinético y su elevada variabilidad inter e intraindividual, definen las características que exigen su monitorización farmacocinética para individualizar las dosis de acuerdo con las concentraciones sanguíneas y con ello optimizar la posología. Así, varios autores han confirmado la asociación entre las concentraciones sanguíneas infraterapéuticas de ciclosporina6, tacrolimus7 o micofenolato de mofetilo8 y el riesgo de aparición de un episodio de rechazo agudo. Por otro lado, es necesario conocer y controlar diversos factores que pueden llevar a un aumento de la variabilidad inter e intraindividual del comportamiento cinético de estos fármacos, entre ellos la presencia de variabilidad genética con influencia en la biodisponibilidad y el metabolismo, interacciones farmacológicas, grado de funcionalidad renal y hepática, el sexo y la edad de los pacientes, entre otros factores. Además, el riesgo de rechazo agudo no sólo depende de las variables posológicas de la terapia inmunosupresora, sino que también está influido por diferentes variables clínicas dependientes del receptor, del donante o del propio órgano trasplantado, como la edad9, el sexo9, la compatibilidad inmunológica9,10, la presencia de retrasplantes11,12, la presencia de necrosis tubular aguda12-14, la procedencia del injerto (donante vivo o cadáver)9 o el tiempo de isquemia fría9,12. El estudio de la influencia de estas variables podrá ayudar a predecir el riesgo de rechazo agudo en el paciente con trasplante renal.
En la actualidad, el tacrolimus es el inhibidor de la calcineurina más utilizado porque presenta menor incidencia de efectos adversos y una eficacia similar o superior a ciclosporina en supervivencia a corto plazo15-17. El intervalo terapéutico establecido para asegurar su máxima eficacia y mínima toxicidad se corresponde con un ámbito de concentraciones mínimas de 5 a 15 ng/ml18. La frecuencia de monitorización y el seguimiento farmacocinético en el postrasplante inmediato dependerán del tiempo tras el trasplante y de la situación clínica del paciente. Así, durante el primer mes se recomienda realizar monitorización de la concentración sanguínea con una periodicidad de 3 determinaciones semanales, que se aumenta progresivamente hasta una vez por semana en el tercer mes postrasplante19.
En la práctica clínica, la prevención y, en su caso, el diagnóstico precoz y el tratamiento del rechazo agudo constituyen objetivos prioritarios de los equipos interdisciplinares de trasplante renal, entre otras razones porque sigue siendo el principal factor de riesgo de desarrollo de rechazo crónico, determinando la función renal y el fracaso del injerto a medio y largo plazo. En este contexto, el objetivo del presente trabajo ha sido construir un modelo que permita predecir el riesgo de rechazo agudo en los pacientes con trasplante renal durante las primeras 2 semanas postrasplante, a partir de variables relacionadas con el tratamiento farmacoterapéutico recibido y variables clínicas relacionadas con el receptor, el donante o el propio órgano trasplantado. La identificación temprana de estas variables y la cuantificación de su influencia permitirán desarrollar un índice pronóstico capaz de clasificar a los pacientes en función del riesgo de presentar un rechazo agudo renal en las primeras 2 semanas postrasplante. De este modo, los pacientes identificados con mayor riesgo de aparición de rechazo agudo serán candidatos a una intensificación en su seguimiento clínico habitual y en la monitorización farmacocinética de tacrolimus, así como a una modificación de la dosis diaria de tacrolimus con el objetivo de mantener las concentraciones sanguíneas en el límite superior del intervalo terapéutico (alrededor de 15 ng/ml), evitando los valores infraterapéuticos y minimizando el riesgo de aparición de un episodio de rechazo agudo.
MétodoPacientes y tratamiento inmunosupresorLa población de estudio está compuesta por pacientes con trasplante renal realizado en un hospital universitario (cobertura anual de 24.676 pacientes y 152.819 estancias hospitalarias), durante los años 2005 y 2006, y tratados con triple terapia que incluye tacrolimus.
Los pacientes que recibieron injertos procedentes de donantes de edad avanzada (> 60 años) o en riesgo elevado de necrosis tubular aguda recibieron inducción con timoglobulina a razón de 1,5 mg/kg/día por vía intravenosa, hasta un máximo de 3 dosis administradas en días alternos, o bien 2 dosis de 25 mg de basiliximab por vía intravenosa; en ambas situaciones se administró la primera dosis antes del trasplante. El tratamiento por vía oral con tacrolimus se inició en las primeras 24 h postrasplante y los pacientes recibieron entre 0,15-0,30 mg/kg/día cada 12 h. Posteriormente, las dosis se individualizaron en función de los resultados de concentración sanguínea. Cuando no era posible la administración por vía oral de tacrolimus, se recurrió a la vía intravenosa, manteniendo la equivalencia de dosis oral: intravenosa de 5:1. Junto con tacrolimus, los pacientes recibieron tratamiento con prednisona a 20 mg diarios, con reducción progresiva a 15 mg al mes, 10 mg a los 2 meses y 5 mg a partir del sexto mes; micofenolato de mofetilo 1 dosis inicial de 1 g cada 12 h, que posteriormente se individualizó en función de los resultados de concentración sanguínea, o sirolimus 1 dosis de choque de 6 mg seguida de 2 mg diarios, que posteriormente se individualizó en función de los resultados de concentración sanguínea, o everolimus 1 dosis inicial de 0,75 mg cada 12 h, que posteriormente se individualizó en función de los resultados de concentración sanguínea. La combinación de tacrolimus con sirolimus o everolimus (combinaciones no autorizadas por la Agencia Española de Medicamentos y Productos Sanitarios) se realizó en el contexto de ensayos clínicos que fueron aprobados por el Comité Ético de Investigación del propio hospital.
Las muestras de sangre se tomaron en el momento previo a la dosis de la mañana, es decir, condiciones de concentración sanguínea mínima (Cmin). En nuestro hospital, se ha establecido como intervalo terapéutico el ámbito de Cmin de 10 a 15 ng/ml para las 6 primeras semanas postrasplante y de 5 a 10 ng/ml a partir de ese tiempo postrasplante.
Tipo de estudio y recogida de informaciónEstudio de cohortes en el que se registran los datos correspondientes a las características antropométricas (edad y sexo), clínicas (rechazo agudo, necrosis tubular aguda, tiempo de isquemia fría, número de incompatibilidades HLA y presencia de un trasplante previo) y farmacoterapéuticas (tipo tratamiento inmunosupresor e inducción con anticuerpos), desde el inicio del trasplante renal. El tiempo de seguimiento inicialmente establecido fue durante los primeros 14 días postrasplante, al corresponderse este período postrasplante con el de máxima probabilidad de rechazo agudo, o bien hasta la aparición de un episodio de rechazo agudo cuando éste tenía lugar antes de finalizar este período. Se diagnosticó necrosis tubular aguda en los pacientes que tras el trasplante renal debutaron con función renal subóptima y requirieron diálisis, descartando causas de origen vascular u obstrucción de las vías urinarias; asimismo, en los pacientes en los que se mantuvo esta situación durante una semana se realizó una biopsia del riñón para descartar la aparición de un episodio de rechazo agudo.
El registro electrónico de la monitorización farmacocinética (pKClin®) permitió validar y extraer la información correspondiente a la pauta posológica de tacrolimus y el valor de las Cmin. Únicamente se consideraron válidas las Cmin extraídas en el momento previo a la siguiente dosis y nunca transcurridas más de 14 h después de la última administración. La determinación en sangre total de tacrolimus se realizó mediante un ensayo de inmunoanálisis MEIA (Microparticle Enzyme Immunoassay) para tacrolimus y sus metabolitos (Abbott, IMx.).
Análisis estadísticoSe realizó un análisis de regresión logística; se definió como variable respuesta la aparición de un episodio de rechazo agudo. Las variables explicativas estudiadas fueron: edad (años), sexo, presencia de un trasplante previo, número de incompatibilidades HLA, tiempo de isquemia fría (horas), presencia de necrosis tubular aguda (NTA), inducción con anticuerpos (sin inducción, inducción con basiliximab o inducción con timoglobulina), tipo de tratamiento (triterapia con tacrolimus asociado a corticoides y micofenolato de mofetilo, sirolimus o everolimus). Para cuantificar la contribución de la Cmin de tacrolimus sobre la probabilidad de rechazo agudo se definieron un conjunto de variables relacionadas con ésta y con el tiempo que permanece en el paciente esa condición de Cmin de tacrolimus:
- 1.
Concentración sanguínea media en ng/ml (Csm).
- 2.
Número de determinaciones dentro de intervalo terapéutico (N_beneficio).
- 3.
Tiempo en días dentro de intervalo terapéutico (T_beneficio).
- 4.
Número de determinaciones por debajo de intervalo terapéutico (N_ineficacia).
- 5.
Tiempo en días por debajo de intervalo terapéutico (T_ineficacia).
Los valores de las variables cuantitativas se han presentado mediante los índices respectivos en función de la simetría de su distribución: media ± desviación estándar (distribución simétrica), y mediana y distancia intercuartílica (distribución asimétrica). Los valores de las variables categóricas se han expresado como frecuencias relativas expresadas en porcentajes.
Para el desarrollo del modelo de regresión logística20,21 se realizó un cribado de las variables explicativas, a partir del análisis de regresiones univariantes, para seleccionar los potenciales factores pronóstico que se incluirían en el modelo multivariante (valores de p < 0,25). Con las variables resultantes, se exploraron los diferentes modelos multivariantes con los métodos de inclusión y exclusión secuencial, fijando los valores p de significación para la inclusión y exclusión de variables en 0,1 y 0,2, respectivamente. En segundo lugar, se introdujeron los términos de interacción para comprobar si mejoraban los índices de ajuste (cambios significativos del logaritmo de la verosimilitud). Finalmente, se calcularon los indicadores de sensibilidad, especificidad, clasificaciones correctas y curva ROC para los modelos seleccionados (fig. 1). La elección del modelo final se realizó en función del área de la curva ROC y de las ventajas e inconvenientes teórico-prácticos de cada modelo. El análisis estadístico se realizó con el programa SPSS versión 12 (SPSS Inc,Chicago, IL).
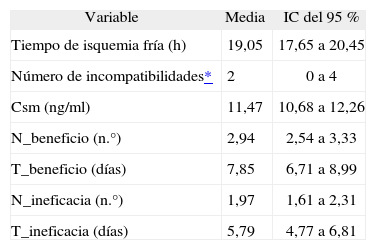
ResultadosSe incluyó en el estudio a un total de 68 pacientes (38 % mujeres y 68 % varones), con una edad media de 51,69 años (IC del 95 %, 48,24 a 68,15), de los cuales 16 pacientes (23 %; IC del 95 %, 15 a 32 %) presentaron un episodio de rechazo agudo. El tiempo medio de seguimiento en nuestra población fue de 14 días (IC del 95 %, 13 a 15 días); no obstante, en los pacientes que presentaron rechazo agudo, el tiempo medio de aparición de un episodio de rechazo agudo fue de 9 días (IC del 95 %, 7 a 12 días). En las tablas 1 y 2 se presentan las medidas de tendencia central (media o mediana) para las variables cuantitativas y la frecuencia relativa para las variables categóricas predictoras evaluadas, junto con su IC del 95 %.
Características descriptivas de las variables cuantitativas
| Variable | Media | IC del 95 % |
| Tiempo de isquemia fría (h) | 19,05 | 17,65 a 20,45 |
| Número de incompatibilidades* | 2 | 0 a 4 |
| Csm (ng/ml) | 11,47 | 10,68 a 12,26 |
| N_beneficio (n.°) | 2,94 | 2,54 a 3,33 |
| T_beneficio (días) | 7,85 | 6,71 a 8,99 |
| N_ineficacia (n.°) | 1,97 | 1,61 a 2,31 |
| T_ineficacia (días) | 5,79 | 4,77 a 6,81 |
Csm: concentración sanguínea media; IC: intervalo de confianza; N_beneficio: número de determinaciones dentro de intervalo terapéutico; N_ineficacia: número de determinaciones por debajo de intervalo terapéutico;
T_beneficio: tiempo en días dentro de intervalo terapéutico;
T_ineficacia: tiempo en días por debajo de intervalo terapéutico.
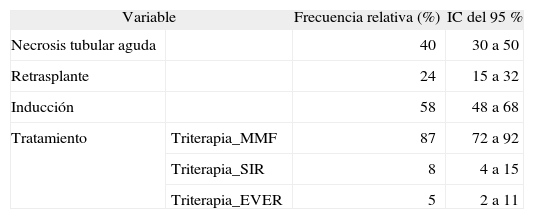
Características descriptivas de las variables categóricas
| Variable | Frecuencia relativa (%) | IC del 95 % | |
| Necrosis tubular aguda | 40 | 30 a 50 | |
| Retrasplante | 24 | 15 a 32 | |
| Inducción | 58 | 48 a 68 | |
| Tratamiento | Triterapia_MMF | 87 | 72 a 92 |
| Triterapia_SIR | 8 | 4 a 15 | |
| Triterapia_EVER | 5 | 2 a 11 | |
IC: intervalo de confianza; EVER: everolimus; MMF: micofenolato de mofetilo; SIR: sirolimus.
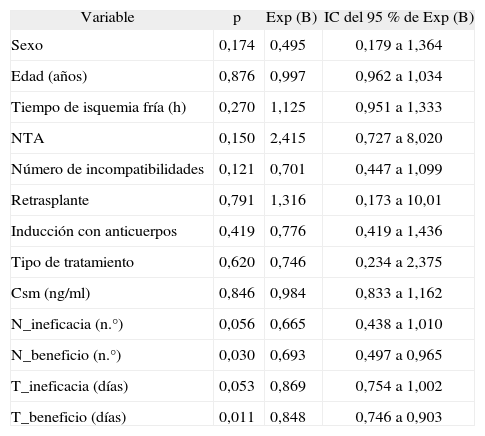
En la construcción del modelo predictivo, la selección univariante de las variables recayó en el sexo, NTA, N_beneficio y T_beneficio porque presentaban una p < 0,25 y un valor correcto en el signo del coeficiente. En la tabla 3 se presentan los resultados de las regresiones univariantes sobre las variables clínicas y las variables dependientes del tratamiento.
Regresiones univariantes sobre las variables clínicas y dependientes del tratamiento
| Variable | p | Exp (B) | IC del 95 % de Exp (B) |
| Sexo | 0,174 | 0,495 | 0,179 a 1,364 |
| Edad (años) | 0,876 | 0,997 | 0,962 a 1,034 |
| Tiempo de isquemia fría (h) | 0,270 | 1,125 | 0,951 a 1,333 |
| NTA | 0,150 | 2,415 | 0,727 a 8,020 |
| Número de incompatibilidades | 0,121 | 0,701 | 0,447 a 1,099 |
| Retrasplante | 0,791 | 1,316 | 0,173 a 10,01 |
| Inducción con anticuerpos | 0,419 | 0,776 | 0,419 a 1,436 |
| Tipo de tratamiento | 0,620 | 0,746 | 0,234 a 2,375 |
| Csm (ng/ml) | 0,846 | 0,984 | 0,833 a 1,162 |
| N_ineficacia (n.°) | 0,056 | 0,665 | 0,438 a 1,010 |
| N_beneficio (n.°) | 0,030 | 0,693 | 0,497 a 0,965 |
| T_ineficacia (días) | 0,053 | 0,869 | 0,754 a 1,002 |
| T_beneficio (días) | 0,011 | 0,848 | 0,746 a 0,903 |
Csm: concentración sanguínea media; IC: intervalo de confianza; N_beneficio: número de determinaciones dentro de intervalo terapéutico; N_ineficacia: número de determinaciones por debajo de intervalo terapéutico; NTA: necrosis tubular aguda; T_beneficio: tiempo en días dentro de intervalo terapéutico; T_ineficacia: tiempo en días por debajo de intervalo terapéutico.
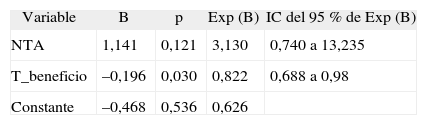
Con los métodos de inclusión secuencial y exclusión secuencial, se obtuvieron 2 modelos: modelo A (donde se mantuvieron las variables NTA e T_beneficio) y modelo B (donde se mantuvo la variable T_beneficio). El proceso exploratorio de ambos modelos puso de manifiesto que el modelo A era el de mayor validez predictiva (mayor curva ROC) (tabla 4).
Modelo final de regresión logística
| Variable | B | p | Exp (B) | IC del 95 % de Exp (B) |
| NTA | 1,141 | 0,121 | 3,130 | 0,740 a 13,235 |
| T_beneficio | –0,196 | 0,030 | 0,822 | 0,688 a 0,98 |
| Constante | –0,468 | 0,536 | 0,626 |
IC: intervalo de confianza; NTA: necrosis tubular aguda;
T_beneficio: tiempo dentro de intervalo terapéutico.
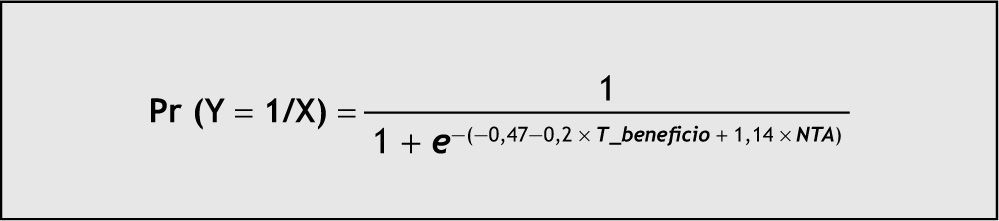
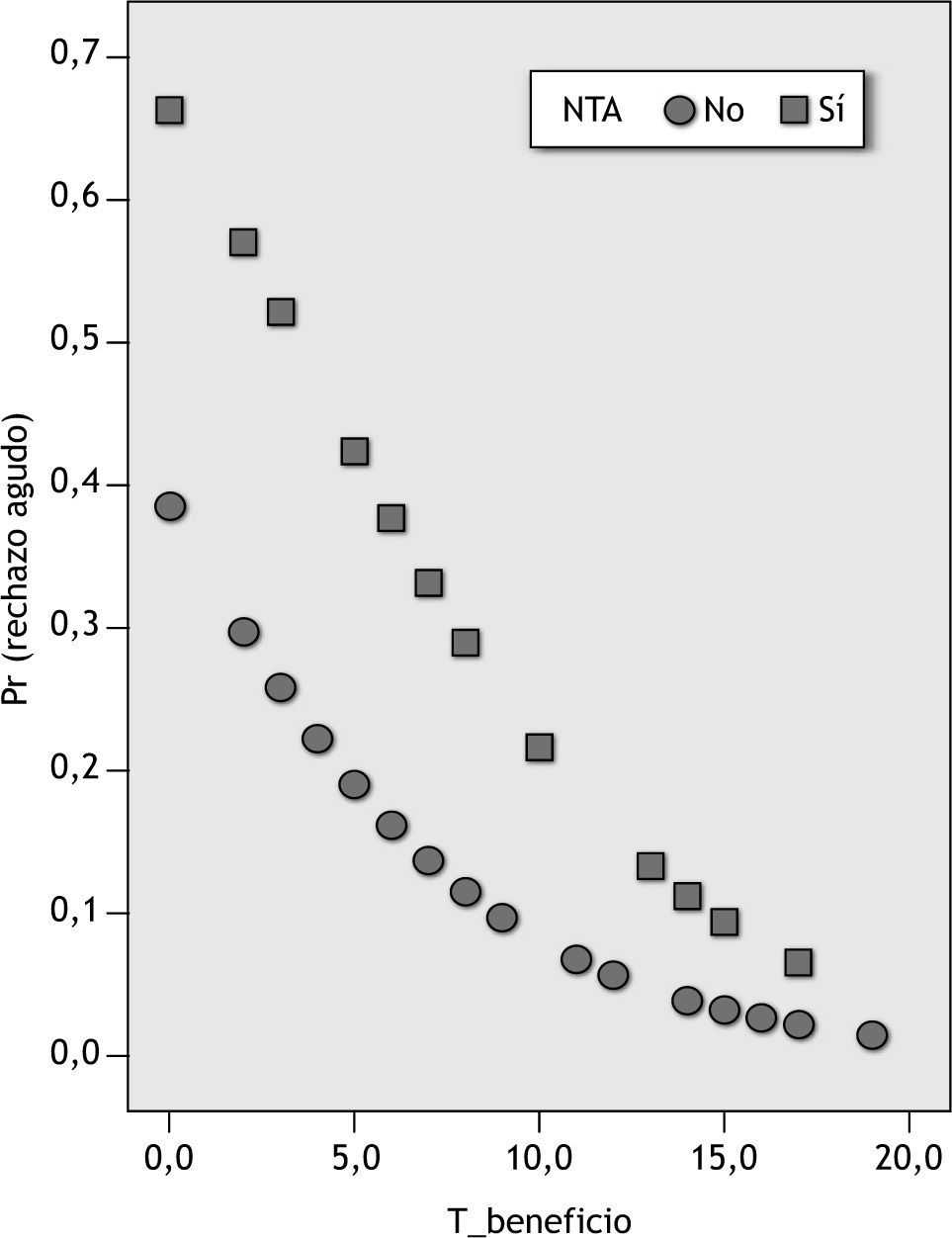
La ecuación predictiva del modelo seleccionado (fig. 2) se representa mediante el modelo de regresión logística y proporciona la probabilidad de aparición de un episodio de rechazo agudo en las dos primeras semanas postrasplante (fig. 3) en función de las variables explicativas: tiempo dentro de intervalo terapéutico, que reduce el riesgo de aparición de un episodio de rechazo agudo por presentar un coeficiente inferior a la unidad, y necrosis tubular aguda (NTA), incluida en el modelo final porque mejora su poder predictivo.
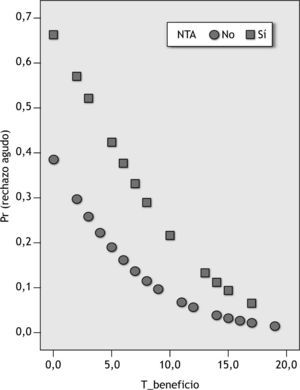
Probabilidad de aparición de un episodio de rechazo agudo en función del tiempo de permanencia dentro del intervalo terapéutico (T_beneficio) y la presencia o ausencia de necrosis tubular aguda (NTA) (en las abscisas se representan las variables NTA y T_beneficio y en las ordenadas la probabilidad de aparición de un episodio de rechazo agudo).
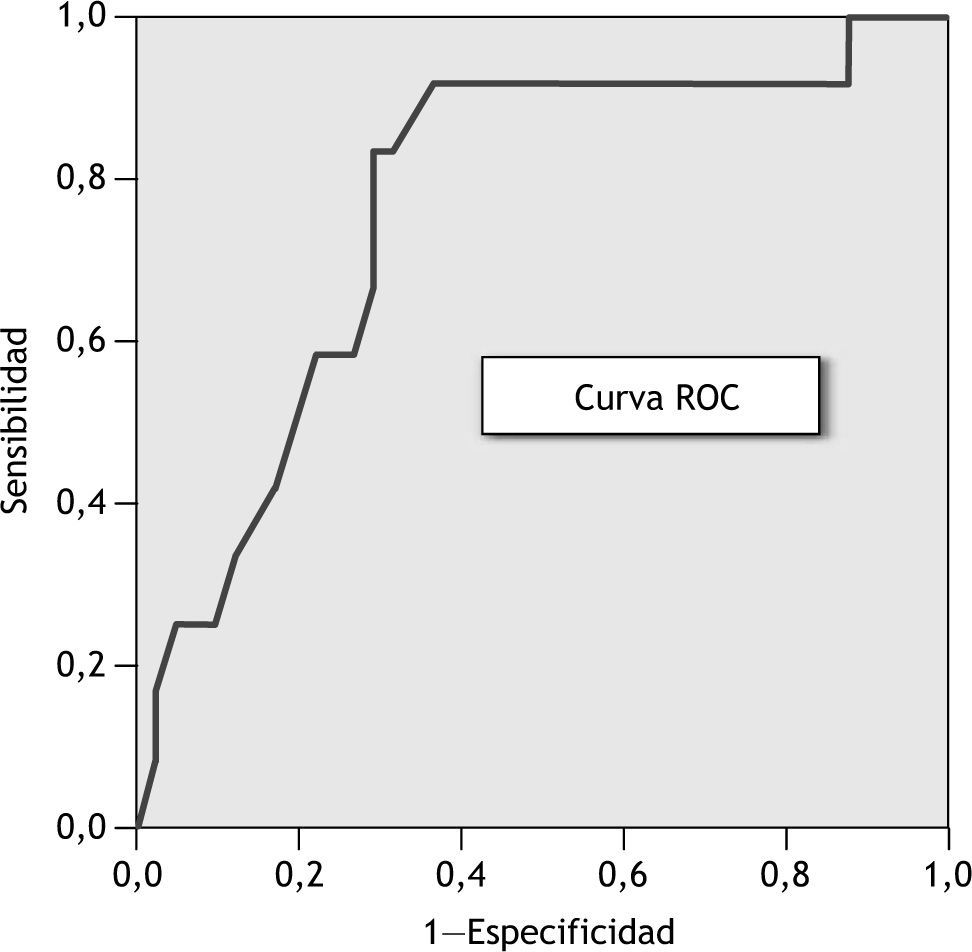
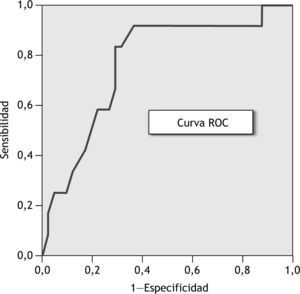
El área bajo la curva de rendimiento diagnóstico (AUCROC) es del 77 % (IC del 95 %, 62 a 92) y el punto de corte óptimo en la curva ROC (fig. 4), o punto que ofrece la mejor relación entre sensibilidad y especificidad, se corresponde con un valor de probabilidad de rechazo agudo ≥ 0,24; valor que se utiliza para clasificar a los pacientes en 2 grupos de riesgo frente al rechazo agudo:
- 1.
Pacientes con probabilidad de rechazo agudo igual o superior al punto de corte seleccionado con diagnóstico de rechazo agudo según el modelo de regresión logística.
- 2.
Pacientes con probabilidad de rechazo agudo inferior al punto de corte seleccionado, diagnosticados de no rechazo agudo según el modelo de regresión logística.
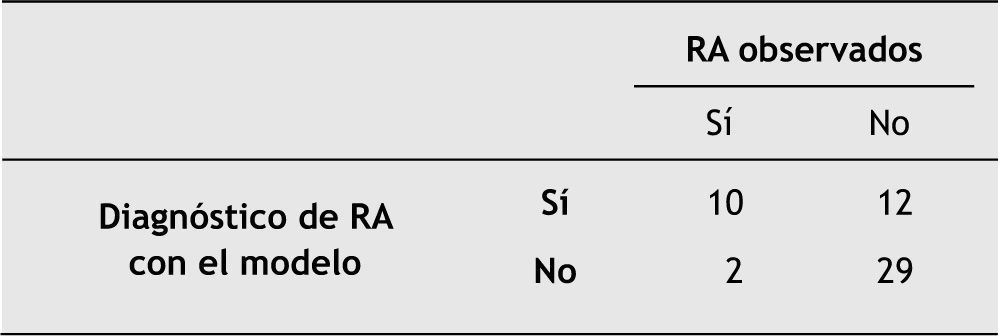
En la figura 5 se representa la tabla de contingencia resultante tras aplicar el modelo de predicción de aparición de un episodio de rechazo agudo a nuestra población de estudio.
Para el punto de corte seleccionado (0,24), el modelo propuesto presenta una sensibilidad del 83 % (IC del 95 %, 74 a 90) y una especificidad del 71 % (IC del 95 %, 61 a 80 %), con un valor predictivo positivo de 46 % (IC del 95 %, 36 a 56) y un valor predictivo negativo de 94 % (IC del 95 %, 87 a 98).
DiscusiónLas actuales pautas de inmunosupresión han permitido reducir la incidencia de rechazo agudo en la población con trasplante renal a un 20-25 %4; el rechazo agudo es el principal predictor de rechazo crónico y de pérdidas del injerto renal3. Además, hay que tener en cuenta que la incidencia de rechazo agudo depende tanto de factores relacionados con la terapia inmunosupresora como de factores clínicos.
El 83 % (IC del 95 %, 74 a 90) de nuestra población de estudio presentó una pauta de inmunosupresión triple basada en tacrolimus y micofenolato de mofetilo. Al contrario de lo publicado en la bibliografía consultada22,23, en nuestro estudio no se ha observado una relación estadísticamente significativa entre el tipo de pauta de inmunosupresión y el rechazo agudo, posiblemente porque teníamos una población de pacientes reducida para los subgrupos en tratamiento con sirolimus y everolimus.
El 58 % (IC del 95 %, 48 a 68) de nuestros pacientes recibía terapia de inducción con basiliximab o timoglobulina; no se observó una relación estadísticamente significativa con el rechazo agudo, al contrario de lo que ocurre en el estudio publicado por Nashan et al24, en el cual se estudió la incidencia de rechazo agudo en 376 pacientes y se observó que los pacientes que recibían basiliximab presentaban una reducción del 32 % en la aparición de rechazo agudo respecto a placebo (diferencia: 14,2 %; IC del 95 %, 3 a 24; p: 0,012).
La monitorización de las concentraciones sanguíneas de los fármacos inmunosupresores es una metodología útil para establecer relaciones entre respuesta farmacocinética y rechazo agudo en los pacientes con trasplante renal6-8. Así, para ciclosporina, Perico et al6 encontraron diferencias estadísticamente significativas entre la concentración en sangre al segundo día postrasplante y la aparición de rechazo agudo durante los primeros 6 meses postrasplante. Para el micofenolato de mofetilo, Borrows et al25 observaron diferencias estadísticamente significativas entre las concentraciones medias y la aparición de rechazo agudo en el primer mes postrasplante. En un reciente estudio, Le Meur et al8 confirmaron que este fármaco es más eficaz y seguro cuando su dosificación se individualiza de acuerdo con el valor de concentración plasmática en vez de utilizar dosis fijas de micofenolato de mofetilo. En este caso, se alcanzan AUC menores que en el grupo de dosis individualizadas; se encontraron diferencias estadísticamente significativas en la aparición de rechazo agudo en el primer año postrasplante (el 20 frente al 8 %, respectivamente).
Para tacrolimus, numerosos autores7,26,27 han estudiado la relación entre las concentraciones infraterapéuticas de tacrolimus y el riesgo de rechazo agudo. Bottinger et al26 estudiaron la relación entre el valor de la concentración en sangre de tacrolimus el mismo día del rechazo y el rechazo agudo; no se observó ninguna relación estadísticamente significativa. Otros autores han estudiado la relación de la concentración sanguínea de tacrolimus con el rechazo agudo a partir del valor medio de concentraciones sanguíneas de tacrolimus en el primer mes postrasplante7,27. Así, en el estudio realizado por Silva et al27 no se ha confirmado relación con el rechazo agudo; por el contrario, en el estudio realizado por Staatz et al7 se encontró una diferencia estadísticamente significativa (concentración media de tacrolimus en el grupo que con rechazo agudo 5,09 ng/ml comparado con 9,02 ng/ml en el grupo que no presenta rechazo agudo; p = 0,04).
La limitación principal de estos estudios es la utilización de concentraciones medias de tacrolimus como variable principal relacionada con el riesgo de rechazo, ya que enmascaran valores mínimos de concentración relacionados con mayor riesgo de rechazo agudo. En este sentido, en el análisis univariante el valor medio de la concentración en sangre en nuestra población de pacientes no ha presentado una relación estadísticamente significativa de esta variable con el rechazo agudo. Por ello, un paso más en esta dirección es considerar el tiempo de exposición, ya que teóricamente cuanto mayor es el tiempo de exposición a valores infraterapéuticos, menor es el AUC del fármaco y, potencialmente, mayor es el riesgo de rechazo agudo en el paciente.
Otro factor que se ha considerado es la frecuencia de episodios infraterapéuticos, es decir, el número de episodios en los que el paciente presenta concentraciones sanguíneas por debajo de intervalo terapéutico; teóricamente, a mayor número de episodios por debajo de intervalo terapéutico durante el período de estudio el paciente presentará un mayor riesgo de rechazo agudo. De este modo, en los análisis univariantes se han encontrado relaciones estadísticamente significativas entre las variables de frecuencia N_beneficio y el rechazo agudo.
El tiempo de seguimiento de nuestra población para el estudio de la incidencia de rechazo agudo fue de 14 días, por cuanto se ha observado en nuestro ámbito que en más del 90 % de los pacientes que presentan rechazo agudo éste tiene lugar durante las primeras 2 semanas postrasplante. De este modo, la población estudiada presenta una incidencia de rechazo agudo del 23 % en este período (IC del 95 %, 15 a 32 %), similar a la encontrada en el estudio realizado por Mayer et al4, en el que se encontraba una incidencia de rechazo agudo del 25,9 % en el grupo de 303 pacientes tratados con tacrolimus.
El 38 % de nuestra población de estudio son mujeres, distribución equivalente a las poblaciones observadas en otros estudios9,19. En nuestra población no existe una relación estadísticamente significativa entre el sexo y el rechazo agudo, resultado que coincide con el observado por Bum et al10. Por el contrario, en el estudio realizado por Herzenberg et al9, al dividir la población en 2 grupos en función de la presencia o no de rechazo agudo, en el grupo de pacientes con rechazo agudo se observó un mayor porcentaje de mujeres (59 %) respecto al grupo de pacientes que no presenta rechazo (27 %), con diferencias estadísticamente significativas (χ2 = 9,14; p = 0,003).
La edad media de nuestra población de estudio es de 51,69 años (IC del 95 %, 48,24 a 68,15), ligeramente superior a la población incluida en otros estudios9,13; no obstante, en nuestro estudio no se encontró una asociación estadísticamente significativas entre la edad y la aparición de rechazo agudo, al igual que en la bibliografía evaluada. Las variables presencia de retrasplante y número de incompatibilidades HLA han presentado en diversos estudios una estrecha relación con el rechazo agudo9,10,11; sin embargo, en nuestro estudio no se encontró una asociación estadísticamente significativa entre estas covariables y la aparición de rechazo agudo.
Con relación al tiempo de isquemia fría o tiempo de conservación del órgano trasplantado fuera del organismo, al aumentar éste, y consecuentemente el daño secundario, se favorece el rechazo13. Así, los órganos trasplantados en nuestra población de estudio se han sometido a un tiempo medio de isquemia fría de 19 h (IC del 95 %, 17,65 a 20,45); no se observó una relación estadísticamente significativa con el rechazo agudo.
Por otro lado, la necrosis tubular aguda es la principal implicada en la disfunción inicial del injerto14, ya que a causa del daño del tubular se produce un incremento en la expresión de moléculas HLA, y con ello un mayor estado inflamatorio. En nuestro estudio, el 40 % de los pacientes presentaron un episodio de necrosis tubular aguda, aunque no se ha confirmado una relación estadísticamente significativa con el rechazo agudo (OR = 2,41; IC del 95 %, 0,73 a 8,02; p = 0,15), al igual que en los estudios realizados por Mauiyyedi et al13 y Moreso et al14.
El análisis estadístico de regresión logística indica que el riesgo de rechazo agudo en nuestros pacientes está relacionado con 2 variables respuesta: NTA (variable farmacodinámica) y T_beneficio (variable farmacocinética). Al igual que ocurre en el modelo univariante, la prueba de la razón de verosimilitud confirmó que la variable T_beneficio fue la que aportó mayor explicación al modelo (p = 0,03). Por otro lado, la introducción de la variable NTA mejora el poder predictivo del modelo, porque presenta un área ROC mayor. Así, a partir de la ecuación de regresión, podemos deducir que el valor de probabilidad de aparición de rechazo agudo en nuestros pacientes se triplica (IC de l95 %, 0,7 a 13,2) por la presencia de un episodio de NTA y, por el contrario, se multiplica por 0,8 (IC del 95 %, 0,69 a 0,98) al aumentar en una unidad de tiempo, expresado en días, el valor de la variable T_beneficio. Del mismo modo, al representar la probabilidad de aparición de un episodio de rechazo agudo en función de las variables predictivas T_beneficio y presencia de un episodio NTA, observamos que los pacientes con NTA serán los más sensibles a la variable T_beneficio (fig. 3).
Para evaluar la validez del modelo de regresión logística, se han utilizado las curvas de rendimiento diagnóstico (curvas ROC). El AUCROC del 77 % (IC del 95 %, 62 a 92) nos indica que el modelo presenta un poder de discriminación óptimo. A partir de la interpretación de la curva ROC, se ha seleccionado como punto de corte óptimo el valor de probabilidad 0,24. De este modo, cuando la probabilidad de aparición de rechazo agudo estimada con el modelo de regresión logística sea igual o superior a 0,24, el paciente se diagnosticará con alto riesgo de presentar un episodio de rechazo agudo.
Los valores de sensibilidad y especificidad encontrados para el punto de corte seleccionado indican que la NTA y la T_beneficio se comportan como herramientas útiles para la preselección de pacientes con riesgo de aparición de rechazo agudo, por presentar una especificidad próxima al 75 % según criterio de validez de Doménech28. El valor predictivo positivo es bajo, en decir, nuestro modelo tendría escasa utilidad cuando el resultado es positivo; no obstante, en nuestro caso se pueden aceptar falsos positivos ya que la sospecha de rechazo agudo no va a provocar un daño psicológico grave en el paciente, aunque su seguimiento supondrá un coste añadido que debería evaluarse en estudios posteriores. Por otro lado, el valor predictivo negativo es alto, de modo que tendremos mayor seguridad que al excluir un paciente de nuestro seguimiento no presente un episodio de rechazo agudo.
Este estudio permite concluir que la NTA junto con la variable T_beneficio son herramientas útiles en la identificación de pacientes con alto riesgo de aparición de un episodio de rechazo agudo. Por tanto, la aparición de rechazo agudo en un paciente dependerá tanto de variables clínicas, no modificables o prevenibles, como de variables relacionadas con el tratamiento farmacoterapéutico que sí son potencialmente prevenibles con una adecuada monitorización o aplicación de los conocimientos farmacocinéticos a la individualización posológica y seguimiento del tratamiento inmunosupresor en los pacientes. No obstante, será necesario realizar una validación externa de nuestro modelo con otro grupo de pacientes de características similares, para evaluar su aplicabilidad en esta población.