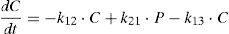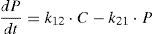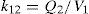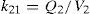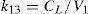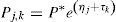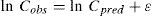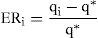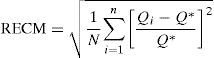Desarrollar y validar internamente un modelo farmacocinético poblacional para cisplatino y evaluar su capacidad predictiva para la personalización de su dosificación en pacientes oncológicos.
MétodosLas concentraciones plasmáticas de cisplatino determinadas en cuarenta y seis pacientes oncológicos se utilizaron para caracterizar los parámetros farmacocinéticos de un modelo farmacocinético bicompartimental implementado en el programa NONMEN VI. La capacidad para identificar los parámetros farmacocinéticos se evaluó mediante bootstrap paramétrico. La validación interna del modelo se realizó mediante bootstrap no-paramétrico, standardized visual y numerical predictive checks. La capacidad predictiva del modelo final se evaluó en términos de exactitud y precisión durante el primer (a priori) y segundo (a posteriori) ciclo de quimioterapia.
ResultadosEl aclaramiento poblacional de cisplatino es de 1,03 L/h, con una variabilidad interpaciente del 78,0%. El volumen de distribución estimado en estado estacionario es de 48,3 L, con unas variabilidades inter e intrapaciente del 31,3 y 11,7%, respectivamente. La validación interna ha confirmado que el modelo farmacocinético poblacional resulta adecuado para describir la evolución temporal de las concentraciones plasmáticas de cisplatino y su variabilidad en la población de estudio. La exactitud y la precisión de la predicción a posteriori de las concentraciones plasmáticas de cisplatino mejoran un 21 y un 54% respecto a la predicción a priori.
ConclusiónEl modelo farmacocinético poblacional desarrollado caracteriza adecuadamente la evolución temporal de las concentraciones plasmáticas de cisplatino en la población de estudio y puede utilizarse de forma exacta y precisa para optimizar las pautas posológicas de cisplatino en pacientes oncológicos.
To develop and internally validate a population pharmacokinetics model for cisplatin and assess its prediction capacity for personalising doses in cancer patients.
MethodCisplatin plasma concentrations in forty-six cancer patients were used to determine the pharmacokinetic parameters of a two-compartment pharmacokinetic model implemented in NONMEN VI software. Pharmacokinetic parameter identification capacity was assessed using the parametric bootstrap method and the model was validated using the nonparametric bootstrap method and standardised visual and numerical predictive checks. The final model's prediction capacity was evaluated in terms of accuracy and precision during the first (a priori) and second (a posteriori) chemotherapy cycles.
ResultsMean population cisplatin clearance is 1.03 L/h with an interpatient variability of 78.0%. Estimated distribution volume at steady state was 48.3 L, with inter- and intrapatient variabilities of 31,3% and 11,7%, respectively. Internal validation confirmed that the population pharmacokinetics model is appropriate to describe changes over time in cisplatin plasma concentrations, as well as its variability in the study population. The accuracy and precision of a posteriori prediction of cisplatin concentrations improved by 21% and 54% compared to a priori prediction.
ConclusionThe population pharmacokinetic model developed adequately described the changes in cisplatin plasma concentrations in cancer patients and can be used to optimise cisplatin dosing regimes accurately and precisely.
Cisplatino es un fármaco alquilante de bajo peso molecular cuyo efecto citotóxico se deriva, principalmente, de la inhibición de la síntesis de ADN1. Cisplatino se intercala en la doble hélice del ADN y establece enlaces intra e intercatenarios2,3, detiene el ciclo celular en la fase G2 y activa la apoptosis.
La administración de cisplatino está indicada en tumores metastásicos de testículo y ovario, cáncer avanzado de vejiga, carcinoma de células escamosas de cabeza y cuello y en carcinoma de pulmón (microcítico y no microcítico)4. Entre las pautas posológicas de cisplatino más empleadas en monoterapia está la administración intravenosa de 50-100mg/m2 cada 3 semanas en perfusión de 2 a 7 horas de duración. Las pautas posológicas empleadas en combinación con otros agentes varían según protocolo y oscilan entre 75-100mg/m2 cada 3 o 4 semanas. En el caso de tumor testicular metastásico, el esquema habitual de cisplatino en combinación con otros antineoplásicos es de 20mg/m2 en perfusión intravenosa de 30 minutos cada 24h durante 5 días consecutivos. Este esquema se repite cada 3 semanas durante un mínimo de 3 ciclos4.
A las dosis habitualmente empleadas en clínica, las mayores concentraciones de platino se alcanzan en hígado, próstata y riñón, son algo menores en vejiga, músculo, testículo, páncreas y bazo, y las concentraciones más bajas se alcanzan en intestino, cápsulas suprarrenales, corazón, pulmón, cerebro y cerebelo4. Por tanto, cisplatino presenta un elevado volumen de distribución que en estado de equilibrio estacionario es aproximadamente 63,7 L5. El volumen de distribución determinado en compartimento central oscila alrededor de 20 L, con una variabilidad interindividual cercana al 50%5,6. Tras la administración intravenosa, las concentraciones plasmáticas disminuyen de forma biexponencial como consecuencia de su amplia distribución a tejidos y de su excreción renal7. Su semivida en la fase rápida de disposición (fase alfa) es de 10-40 minutos y se estima que el aclaramiento renal está alrededor de 0,7 L/h, con una variabilidad interindividual que varía entre el 16 y el 54%5,8. No obstante, cisplatino se une a diversas proteínas (glutatión y albúmina), aminoácidos (metionina y cisteína) y nucleótidos formando complejos de peso molecular superior a 50 KDa9. La unión a proteínas es >90% y la fase de eliminación beta es prolongada. De hecho, tan solo entre el 27 y el 45% de la dosis administrada se elimina en un período de 84 a 120 horas4. Sin embargo, diversos estudios han demostrado que pacientes tratados con una dosis estándar de cisplatino presentan concentraciones detectables en plasma y tejidos años después de su administración10–13. Cisplatino también es excretado en una pequeña proporción en la bilis y en saliva.
Entre los efectos adversos más importantes que limitan las dosis de cisplatino utilizadas en la práctica clínica se encuentra la toxicidad renal, auditiva y hematológica. No obstante, también se han documentado diversas toxicidades de menor incidencia a nivel gastrointestinal, así como alteraciones de los electrolitos séricos, hiperuricemia, neurotoxicidad y toxicidad ocular4.
La toxicidad renal es dosis-dependiente y acumulativa, constituye el principal efecto adverso limitante de la dosis y se ha observado en el 28% - 38% de los pacientes tratados con una dosis única de cisplatino de 50mg/m2. Diversos estudios sugieren que el cisplatino acumulado en el riñón induce de manera directa la necrosis y apoptosis de las células tubulares del riñón14–16. Asimismo, con el objetivo de reducir la nefrotoxicidad resulta fundamental la hidratación intravenosa con sueros salinos y la administración de manitol o furosemida previa a la administración de cisplatino. No obstante, puede aparecer nefrotoxicidad aún después de utilizar estas medidas de prevención17,18.
La ototoxicidad se ha observado en el 31% de los pacientes tratados con una dosis única de cisplatino de 50mg/m2, y se manifiesta por tinnitus y/o pérdida de audición en las frecuencias altas (4.000 a 8.000Hz). Por tanto, deben realizarse pruebas audiométricas antes y durante el tratamiento4. La mielosupresión se ha detectado en aproximadamente el 30% de los pacientes tratados con cisplatino4. La leucopenia y la trombocitopenia son más pronunciadas a dosis mayores de 50mg/m2. Se recomienda administrar cisplatino cuando el recuento de plaquetas sea mayor de 100.000×109/L y el de leucocitos mayor de 4.000×109/L.
La monitorización de las concentraciones plasmáticas de cisplatino se justifica principalmente por tres razones; 1) es un fármaco con un margen terapéutico estrecho, 2) presenta una elevada variabilidad en su farmacocinética5, y 3) existe correlación entre sus concentraciones en plasma y su eficacia19 y toxicidad9,20. Las características farmacocinéticas y farmacodinámicas de cisplatino justifican la monitorización de sus concentraciones plasmáticas aunque su implementación rutinaria en la práctica clínica es escasa debido a la necesidad de disponer de una técnica analítica que presente adecuada precisión, exactitud, especificidad y selectividad para la determinación de cisplatino en muestras biológicas de pacientes. La espectrofotometría de emisión atómica mediante plasma acoplado inductivamente (ICP-AES) es una técnica que, debido a su selectividad dada por la longitud de onda de emisión del platino, cumple estos criterios y, por tanto, resulta adecuada para la determinación de cisplatino.
En cuanto a la individualización posológica, la metodología bayesiana es una de las técnicas más empleadas para la estimación de los parámetros farmacocinéticos individuales. La aplicación de esta técnica con garantía de éxito requiere la estimación exacta y precisa de los parámetros farmacocinéticos de cisplatino a partir de los datos correspondientes a la población específica de pacientes subsidiarios de ajuste posológico21. La farmacocinética de cisplatino se ha descrito en la literatura mediante modelos farmacocinéticos lineales basados en uno20 dos5,6 o tres8 compartimentos, y se ha utilizado la metodología no lineal de efectos mixtos para caracterizar tanto la tendencia central como la variabilidad inter e intraindividual en los parámetros cinéticos de cisplatino, así como sus relaciones con covariables demográficas y clínicas19,22,23.
Por tanto, el objetivo del presente trabajo ha sido desarrollar y validar internamente un modelo farmacocinético poblacional para cisplatino, y evaluar su capacidad predictiva en la personalización de su dosificación en pacientes oncológicos a partir de la monitorización de las concentraciones plasmáticas de cisplatino mediante ICP-AES.
MétodosCriterios de selección de pacientesSe incluyeron en el estudio pacientes oncológicos adultos subsidiarios de recibir tratamiento con cisplatino, con edad comprendida entre 18 y 80 años, con una expectativa de vida superior a tres meses, función medular normal (recuento de leucocitos>4×109/L, recuento de neutrófilos>1,5×109/L y recuento de plaquetas>150×109/L), función renal normal (creatinina sérica<1,5mg/dL) y una función hepática conservada (bilirrubina<1,2mg/dL, AST y ALT ≤ 40 U/L). Se excluyeron del estudio las mujeres lactantes o en periodo gestacional y aquellos pacientes que presentasen alguna de las siguientes situaciones: estado general mayor de 2 según la escala ECOG, o inferior a 60% en la escala Karnofsky, radioterapia extensa previa, trastornos psiquiátricos o de cualquier otro tipo que comprometiese la capacidad para otorgar el consentimiento informado verdadero para la participación en el estudio, cualquier circunstancia que impidiese que el tratamiento y su seguimiento se realizase según el protocolo establecido, como puede ser la progresión de enfermedad y haber participado en un estudio clínico al menos 30 días antes.
El presente estudio se ha realizado con un total de 46 pacientes oncológicos que recibieron tratamiento con cisplatino intravenoso en un régimen de administración bisemanal, con una dosis media de 49,2mg/m2 (14–100mg/m2) y con una duración de la perfusión de entre 1 y 4 horas (duración media= 2,2h). El tumor primario fue melanoma (n=4), carcinoma de pulmón (n=10), cérvix (n=4), vesical (n=4), mama (n=3), laringe (n=3), próstata (n=3), estómago (n=2), esófago (n=2), ovario (n=2), endométrio (n=1), colon (n=1), paladar (n=1), páncreas (n=1), vulva (n=1), seno piriforme (n=1) y linfoma no Hodking (n=1). Cisplatino se administró en terapia combinada con otros antineoplásicos entre los que se incluyeron docetaxel (50%), 5-fluorouracilo (31%), irinotecan (24%), paclitaxel (17%) o etopósido (12%) entre otros, según el tipo de tumor primario a tratar.
Toma de muestras y técnica analíticaLa monitorización de las concentraciones plasmáticas de cisplatino forma parte integral del tratamiento farmacoterapéutico que reciben los pacientes oncológicos en el centro donde se realizó el estudio. En todos los casos se obtuvo el consentimiento informado del paciente tras una entrevista personal donde se le informó verbalmente y por escrito de los potenciales riesgos y beneficios del tratamiento y su monitorización. Por tanto, los datos de concentraciones plasmáticas de cisplatino utilizadas para el desarrollo del modelo farmacocinético han sido datos derivados de la práctica clínica asistencial.
En los dos primeros ciclos de quimioterapia se tomaron muestras sanguíneas 5 minutos antes del fin de la perfusión y tras 1 y 4 horas desde el fin de la perfusión. Estos tiempos fueron seleccionados en base a la teoría de muestreo óptimo y los modelos farmacocinéticos previamente publicados en la literatura biomédica. Las muestras de sangre se extrajeron del brazo contralateral al que se administró la quimioterapia y se recogieron en tubos de plástico con heparina como anticoagulante (Sarstedt®). Las muestras se centrifugaron durante 10 minutos a 3.500rpm y el plasma se congeló a -80°C hasta su valoración.
La determinación de concentraciones plasmáticas de cisplatino total se realizó mediante ICP-AES. La técnica analítica empleada fue validada en el rango de concentraciones plasmáticas de cisplatino entre 0,5 y 30mg/L donde se obtiene una adecuada exactitud (error relativo < 7,7%) y precisión (CV < 9,5%). Los detalles específicos sobre la validación de la técnica analítica se describen en el anexo 1.
Análisis farmacocinéticoProgramas informáticosEl análisis farmacocinético se realizó con el programa informático NONMEM VI versión 2.0 (ICON, Hanover, MD, USA)24 con la aproximación de primer orden condicional (FOCE) con interacción. La compilación del programa se realizó con el programa DIGITAL Visual Fortran versión 6.6C. Los gráficos y el resto de análisis estadísticos, incluyendo la evaluación de los modelos ajustados con NONMEM, se realizaron con el programa S-Plus 6.1 Professional Edition para Windows (Insightful, Seattle, WA, USA).
Modelo farmacoestadísticoTras el análisis exploratorio gráfico de los datos obtenidos y la evaluación de la literatura científica, se seleccionó un modelo farmacocinético bicompartimental, con distribución y eliminación de primer orden descrito por Urien et al.5. Este modelo se parametrizó en términos de aclaramiento (CL, L/h), volumen de distribución central (V1, L), flujo entre el compartimento central y el periférico (Q2, L/h) y volumen del compartimento periférico (V2, L). A continuación se muestran las ecuaciones diferenciales que describen la evolución de las concentraciones de cisplatino en el compartimento central y periférico:
donde C y P son las concentraciones plasmáticas de cisplatino en el compartimento central y periférico, respectivamente, y k12, k21 y k13 son las microconstantes de distribución, de retorno y de eliminación, respectivamente.En este modelo, se asumió que la variabilidad inter e intraindividual seguían una distribución log-normal según la ecuación:
donde Pj,k es el parámetro farmacocinético individual para el paciente j-ésimo en la ocasión k-ésima, P* es el valor típico poblacional, ηj es una variable que cuantifica la diferencia entre el valor del parámetro para cada individuo y el valor típico poblacional del parámetro y τk es una variable que cuantifica el efecto aleatorio interocasión que distingue el valor del parámetro farmacocinético en cada ciclo del valor del parámetro típico individual. ηj y τk son variables independientes y aleatorias y que siguen una distribución normal de media cero y varianza ωP2 y πP2, respectivamente. La magnitud de la variabilidad inter e intraindividual se representa aproximadamente con los coeficientes de variación (CV) en porcentaje. La variabilidad residual se evaluó utilizando un modelo de error aditivo tras la transformación logarítmica de las concentraciones observadas y las correspondientes predicciones del modelo, de acuerdo a la ecuación:donde Cobs es la concentración observada de cisplatino en plasma, Cpred es la concentración predicha por el modelo, y ¿ es una variable aleatoria independiente con distribución normal con media cero y varianza σ2, que describe la diferencia del logaritmo de la concentración observada y el logaritmo de la predicción del modelo, es decir, el valor residual y que se expresa aproximadamente como CV%32.En base a la literatura, el aclaramiento de cisplatino es de 0,7 L/h y su variabilidad interindividual es del 40%.5 Por tanto, el tamaño de muestra necesario para estimar el aclaramiento medio poblacional con una precisión del 15% y una confianza del 95% es de 27 pacientes, inferior al tamaño de muestra reclutado en este estudio (N=46).
Análisis de datosCon objeto de evaluar el efecto que la estrategia de toma de muestras tiene sobre la capacidad para identificar los parámetros del modelo farmacocinético poblacional de cisplatino se realizó un bootstrap paramétrico (PBT) del modelo de Urien y et al.5 (estrategia frecuentista. Método A). Se utilizaron los parámetros del modelo de Urien y et al. para generar 100 bases de datos diferentes aunque con idéntica estructura a la base de datos original. Cada una de las réplicas de la base de datos original, se analizó con el modelo y se obtuvieron los correspondientes parámetros farmacocinéticos poblacionales de tendencia central y variabilidad. En cada caso, a partir de estas estimaciones, se calculó la media, el error estándar y el intervalo de confianza del 95% de cada parámetro y se comparó con el valor del parámetro del modelo utilizado en la simulación de las bases de datos. Si el parámetro farmacocinético es identificable a partir de la base de datos disponible, el modelo farmacoestadístico empleado y la metodología de análisis utilizada, el intervalo de confianza del 95% de cada parámetro debería incluir el valor del parámetro estimado por el modelo seleccionado a partir de la base de datos original. Otra aproximación consiste en emplear la información a priori en el contexto de modelos bayesianos poblacionales y realizar un PBT con el modelo bayesiano poblacional (estrategia bayesiana: Método B). Así, se puede implementar en NONMEM mediante la subrutina $PRIOR con la opción NWPRI. Esta subrutina implementa una función de penalización derivada de los datos a priori mediante una distribución normal para los parámetros de efecto fijo y una distribución de Wishart invertida para los efectos aleatorios. Además, se definió la incertidumbre a priori de los parámetros de efecto fijo y los grados de libertad de los efectos aleatorios tal y como describen Gisleskog y col25. Este método no incluye la información a priori para el error residual. Si ambos métodos (A y B) resultaran inadecuados para la identificación y por tanto, para la correcta estimación de los parámetros del modelo, podría ser debido a que la población de estudio es sensiblemente diferente a la referida en la literatura. Por tanto, cualquier intento de estimar los parámetros del modelo de Urien et al. con exactitud y precisión sería vano y la estimación de los parámetros del modelo debería realizarse directamente a partir de la base de datos original (Método C). Así, sería necesario un incremento de la función mínima objetivo (ΔFMO) superior a 10,83 (p<0,001) para la inclusión de variabilidad inter e intraindividual en un parámetro de efecto fijo.
Validación del modeloLa validación interna del modelo final se realizó mediante tres técnicas diferentes y complementarias como son el bootstrap no paramétrico (NPBT), el standardized visual predictive check (SVPC) y el numerical predictive check (NPC). En el NPBT se consideró que el modelo final no presentaba sesgos si las estimaciones de los parámetros del modelo desarrollado con la base de datos original se encontraban dentro del intervalo de confianza del 95% construido con bases de datos generadas mediante muestreo de pacientes con reemplazamiento con el programa WINGS para NONMEM VI (N. Holford, Version 616, Auckland, New Zealand). En el SVPC, se obtuvieron los percentiles de cada concentración plasmática de cisplatino observada con respecto a la distribución simulada a partir de los valores de los parámetros de efecto fijo y aleatorio estimados por el modelo final y se comparó la proporción de concentraciones de cisplatino cuyos percentiles se encontraban por debajo de los percentiles 20, 50 y 80 26. Por último, en el NPC a partir de bases de datos simuladas con el modelo farmacocinético seleccionado, se estratificaron las concentraciones plasmáticas en cuatro grupos en función del tiempo de muestreo. En cada grupo se calculó el valor medio y el CV (%) de las concentraciones plasmáticas de cisplatino simuladas en cada replica, así como los respectivos intervalos de confianza del 95% de ambos parámetros a partir de los parametros de cada replica. Estos resultados se compararon con la media y el CV (%) de las concentraciones observadas para cada tiempo (NPC).
Evaluación de la capacidad predictivaLa capacidad predictiva del modelo se evaluó en términos de exactitud y precisión de las concentraciones plasmáticas de cisplatino según la teoría de errores de predicción de Sheiner y Beal27. Como parámetro de exactitud se calculó la media del error relativo medio de predicción (ERM) existente entre las concentraciones plasmáticas observadas y las correspondientes predicciones del modelo. Como parámetro de precisión se calculó la raíz cuadrada del error cuadrático medio de predicción (RECM). Los valores de ERM y RECM del modelo se calcularon mediante las ecuaciones 8 y 9, respectivamente:
donde, Qi representa la estimación de la concentración plasmática obtenida en el i-ésimo paciente y Q* representa el valor de la concentración plasmática obtenido en ese mismo paciente. Además, se comprobó si el ERM difería significativamente (p<0,05) del valor de cero a través del cálculo de los intervalos de confianza del 95% de dicho valor.El análisis de la exactitud y la precisión se realizó por separado para los dos primeros ciclos de tratamiento. Las concentraciones plasmáticas predichas por el modelo para el primer ciclo de quimioterapia se obtuvieron en base a los parámetros típicos poblacionales (predicción a priori) puesto que no se disponía de información farmacocinética previa del paciente. Las concentraciones plasmáticas predichas por el modelo para el segundo ciclo de quimioterapia se generaron en base a los parámetros farmacocinéticos individuales del paciente (predicción a posteriori) obtenidos mediante estimación bayesiana individual a partir de las concentraciones plasmáticas observadas en el primer ciclo y el modelo poblacional desarrollado. De esta forma es posible evaluar el efecto de la monitorización de las concentraciones plasmáticas en la optimización farmacoterapéutica de cisplatino en pacientes oncológicos.
Esta metodología ha sido empleada con anterioridad para caracterizar la farmacocinética de doxorubicina y gemcitabina en pacientes oncológicos28,29.
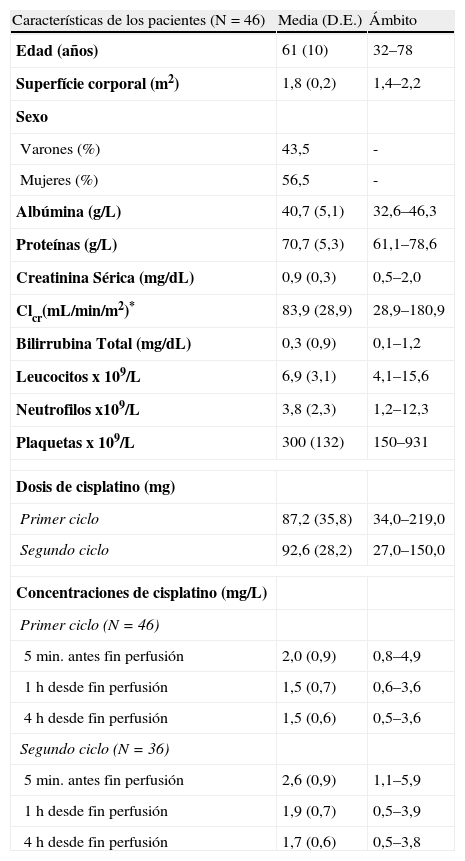
ResultadosEn la tabla 1 se resumen las características de la población al inicio del estudio. En el presente estudio han monitorizado un total de 82 ciclos de quimioterapia que han supuesto la cuantificación de la concentración plasmática de cisplatino en 237 muestras. Todas las concentraciones plasmáticas de cisplatino determinadas presentaron valores superiores al límite de cuantificación.
Resumen de las características basales de los pacientes y su tratamiento con cisplatino
| Características de los pacientes (N=46) | Media (D.E.) | Ámbito |
| Edad (años) | 61 (10) | 32–78 |
| Superfície corporal (m2) | 1,8 (0,2) | 1,4–2,2 |
| Sexo | ||
| Varones (%) | 43,5 | - |
| Mujeres (%) | 56,5 | - |
| Albúmina (g/L) | 40,7 (5,1) | 32,6–46,3 |
| Proteínas (g/L) | 70,7 (5,3) | 61,1–78,6 |
| Creatinina Sérica (mg/dL) | 0,9 (0,3) | 0,5–2,0 |
| Clcr(mL/min/m2)* | 83,9 (28,9) | 28,9–180,9 |
| Bilirrubina Total (mg/dL) | 0,3 (0,9) | 0,1–1,2 |
| Leucocitos x 109/L | 6,9 (3,1) | 4,1–15,6 |
| Neutrofilos x109/L | 3,8 (2,3) | 1,2–12,3 |
| Plaquetas x 109/L | 300 (132) | 150–931 |
| Dosis de cisplatino (mg) | ||
| Primer ciclo | 87,2 (35,8) | 34,0–219,0 |
| Segundo ciclo | 92,6 (28,2) | 27,0–150,0 |
| Concentraciones de cisplatino (mg/L) | ||
| Primer ciclo (N=46) | ||
| 5min. antes fin perfusión | 2,0 (0,9) | 0,8–4,9 |
| 1h desde fin perfusión | 1,5 (0,7) | 0,6–3,6 |
| 4h desde fin perfusión | 1,5 (0,6) | 0,5–3,6 |
| Segundo ciclo (N=36) | ||
| 5min. antes fin perfusión | 2,6 (0,9) | 1,1–5,9 |
| 1h desde fin perfusión | 1,9 (0,7) | 0,5–3,9 |
| 4h desde fin perfusión | 1,7 (0,6) | 0,5–3,8 |
D.E.: Desviación estándar. *Calculado según la fórmula MDRD.
Las variables continuas están expresadas como media (d.e) mientras que las variables categóricas están expresadas en porcentaje (%).
Con objeto de evaluar el efecto que la estrategia de toma de muestras tiene en la capacidad para identificar los parámetros del modelo farmacocinético poblacional de cisplatino se realizó un bootstrap paramétrico (PBT) del modelo de Urien et al.5 mediante una aproximación frecuentista (método A) y una aproximación bayesiana poblacional (método B). En ambos caso, la estimación de los parámetros farmacocinéticos de efecto fijo resultó ser similar a la estimada por el autor. Sin embargo, la estimación de los parámetros farmacocinéticos de efecto aleatorio resultó ser, en algunos casos, un 50% superior respecto a los valores referidos en la literatura5 y sus errores estándar relativos (RSE) aumentaron hasta un 105%. Estos resultados evidencian la imposibilidad de identificar correctamente todos los parámetros de efecto fijo y de efecto aleatorio del modelo descrito por Urien et al.5 a partir de los datos experimentales del presente estudio y por ello se recurrió al método C.
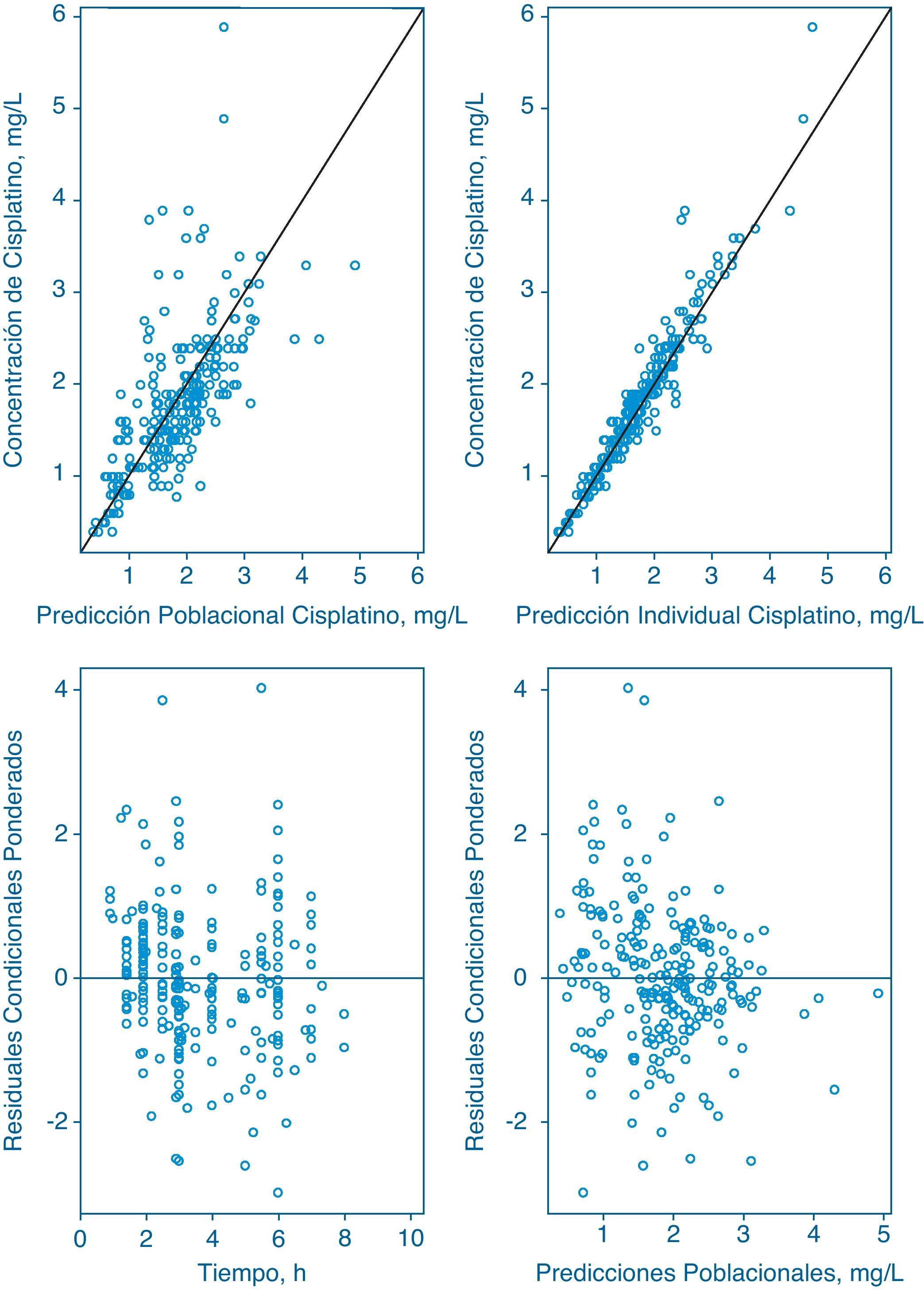
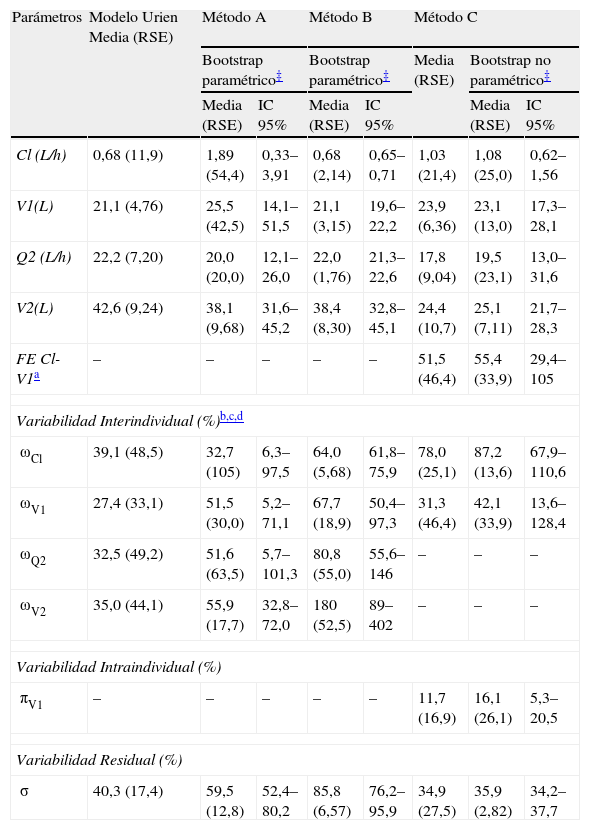
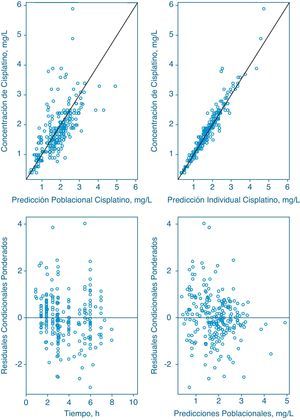
. El análisis de datos con el método C reveló que modelo bicompartimental mejoró significativamente el valor de la función mínima objetiva respecto al modelo monocompartimental (AFMO=-68.2, gl=2, p<0,001). Además, únicamente fue estadísticamente significativa la inclusión de variabilidad interindividual en Cl y V1 (ΔFMO=-82,7, gl=2, p<0,001) y la inclusión de variabilidad interocasión en V1 (ΔFMO=-58,3, gl=2, p<0,001). Se utilizaron métodos estadísticos y gráficos para determinar posibles correlaciones entre las variabilidades interindividuales determinadas. Así, la correlación entre Cl y V1 fue relevante y se incluyó en el modelo. Posteriormente, se evidenció que dicho coeficiente de correlación no era distinto de 1 y por tanto, se fijó a este valor y se incluyó un factor de expansión para cuantificar la relación existente entre las variabilidades interindividuales de Cl y V1. El modelo desarrollado describe adecuadamente la evolución temporal de las concentraciones plasmáticas de cisplatino. Los gráficos de bondad de ajuste se incluyen en la figura 1, donde los residuales ponderados condicionados muestran una distribución normal alrededor de su media teórica, 0, y no presentan signo alguno de sesgo sistemático, circunstancia que confirma la idoneidad del modelo de error de la varianza residual. Asimismo, los parámetros determinados por los métodos A, B y C y los resultados del PBT se muestran en la tabla 2 con el método C, tanto los parámetros de efecto fijo como los de efecto aleatorio son perfectamente identificables y disminuye en un 13,4% el valor de la variabilidad residual respecto al modelo de Urien et al.5. Por tanto, se seleccionó como modelo final y se realizó la validación del mismo.
Gráficos de Bondad de ajuste del modelo desarrollado. Los paneles superiores muestran las concentraciones plasmáticas observadas de cisplatino total frente a la predicción poblacional (izquierda) e individual (derecha) del modelo. Los paneles inferiores muestran los residuales condicionales ponderados frente al tiempo (izquierda) y frente a la predicción poblacional (derecha). La línea negra representa la línea identidad.
Parámetros farmacocinéticos poblacionales y análisis bootstrap paramétrico de los tres métodos
| Parámetros | Modelo Urien Media (RSE) | Método A | Método B | Método C | ||||
| Bootstrap paramétrico‡ | Bootstrap paramétrico‡ | Media (RSE) | Bootstrap no paramétrico‡ | |||||
| Media (RSE) | IC 95% | Media (RSE) | IC 95% | Media (RSE) | IC 95% | |||
| Cl (L/h) | 0,68 (11,9) | 1,89 (54,4) | 0,33–3,91 | 0,68 (2,14) | 0,65–0,71 | 1,03 (21,4) | 1,08 (25,0) | 0,62–1,56 |
| V1(L) | 21,1 (4,76) | 25,5 (42,5) | 14,1–51,5 | 21,1 (3,15) | 19,6–22,2 | 23,9 (6,36) | 23,1 (13,0) | 17,3–28,1 |
| Q2 (L/h) | 22,2 (7,20) | 20,0 (20,0) | 12,1–26,0 | 22,0 (1,76) | 21,3–22,6 | 17,8 (9,04) | 19,5 (23,1) | 13,0–31,6 |
| V2(L) | 42,6 (9,24) | 38,1 (9,68) | 31,6–45,2 | 38,4 (8,30) | 32,8–45,1 | 24,4 (10,7) | 25,1 (7,11) | 21,7–28,3 |
| FE Cl-V1a | – | – | – | – | – | 51,5 (46,4) | 55,4 (33,9) | 29,4–105 |
| Variabilidad Interindividual (%)b,c,d | ||||||||
| ωCl | 39,1 (48,5) | 32,7 (105) | 6,3–97,5 | 64,0 (5,68) | 61,8–75,9 | 78,0 (25,1) | 87,2 (13,6) | 67,9–110,6 |
| ωV1 | 27,4 (33,1) | 51,5 (30,0) | 5,2–71,1 | 67,7 (18,9) | 50,4–97,3 | 31,3 (46,4) | 42,1 (33,9) | 13,6–128,4 |
| ωQ2 | 32,5 (49,2) | 51,6 (63,5) | 5,7–101,3 | 80,8 (55,0) | 55,6–146 | – | – | – |
| ωV2 | 35,0 (44,1) | 55,9 (17,7) | 32,8–72,0 | 180 (52,5) | 89–402 | – | – | – |
| Variabilidad Intraindividual (%) | ||||||||
| πV1 | – | – | – | – | – | 11,7 (16,9) | 16,1 (26,1) | 5,3–20,5 |
| Variabilidad Residual (%) | ||||||||
| σ | 40,3 (17,4) | 59,5 (12,8) | 52,4–80,2 | 85,8 (6,57) | 76,2–95,9 | 34,9 (27,5) | 35,9 (2,82) | 34,2–37,7 |
RSE: Error estándar relativo. IC: Intervalo de confianza.
El shrinkage calculado para ωCl, ωV1, ωQ2 y ωV2 del método A fue 0,99, 0,55,0,99 y 0,66, respectivamente.
El shrinkage calculado para ωCl, ωV1, ωQ2 y ωV2 del método B fue 0,69, 0,64,0,36 y 0,34, respectivamente.
Los resultados del NPBT se muestran en la tabla 2. Las estimaciones de los parámetros de efecto fijo y de efecto aleatorio son similares a las del modelo final, y sus correspondientes RSE son inferiores al 34%, en ambos casos. De las mil réplicas analizadas durante el NPBT todas minimizaron con éxito. Las estimaciones poblacionales del modelo final fueron similares a la media de las réplicas generadas por el NPBT y estaban dentro del intervalo de confianza del 95%. Estos resultados demuestran la adecuada exactitud y precisión de los parámetros estimados.
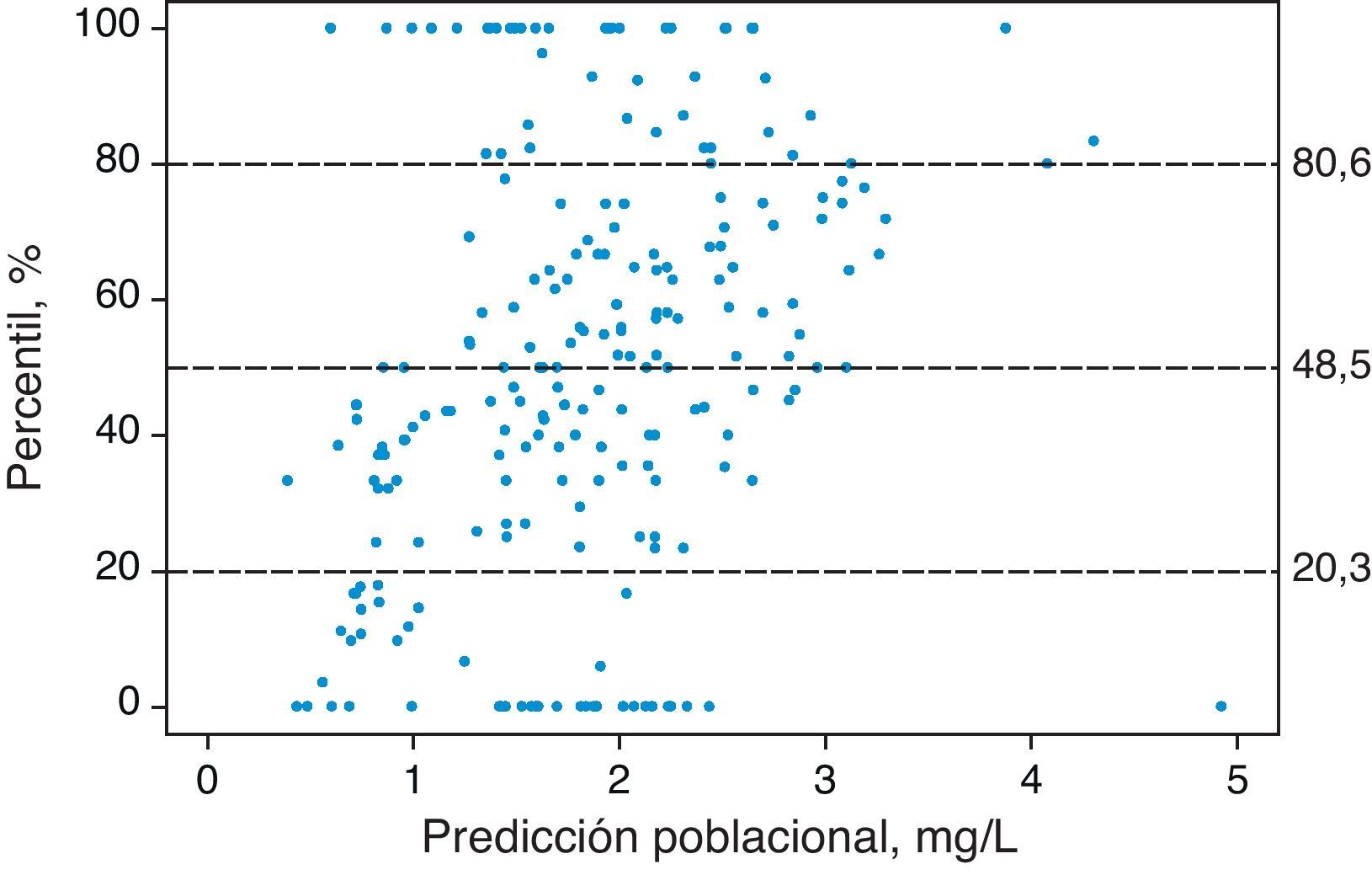
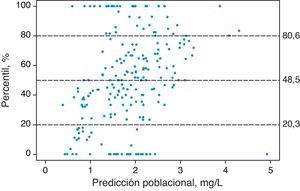
En la figura 2 se presentan los resultados del VPC donde se evidencia que no existen diferencias entre las concentraciones plasmáticas de cisplatino observadas y las simuladas. De hecho, el 20,3%, 48,5% y el 80,6% de las concentraciones experimentales del primer y segundo ciclo quedaron por debajo de los percentiles 20, 50 y 80, respectivamente. Estos resultados confirman que el modelo describe adecuadamente los datos observados en la población de pacientes de estudio, tanto en el primer ciclo como en el segundo ciclo de tratamiento.
Standarized Visual Predictive Check del modelo final. Los puntos representan los percentiles para cada concentración plasmática de cisplatino observada y las líneas horizontales discontinuas representan los percentiles 20, 50 y 80 calculados a partir de las concentraciones plasmáticas de cisplatino simuladas.
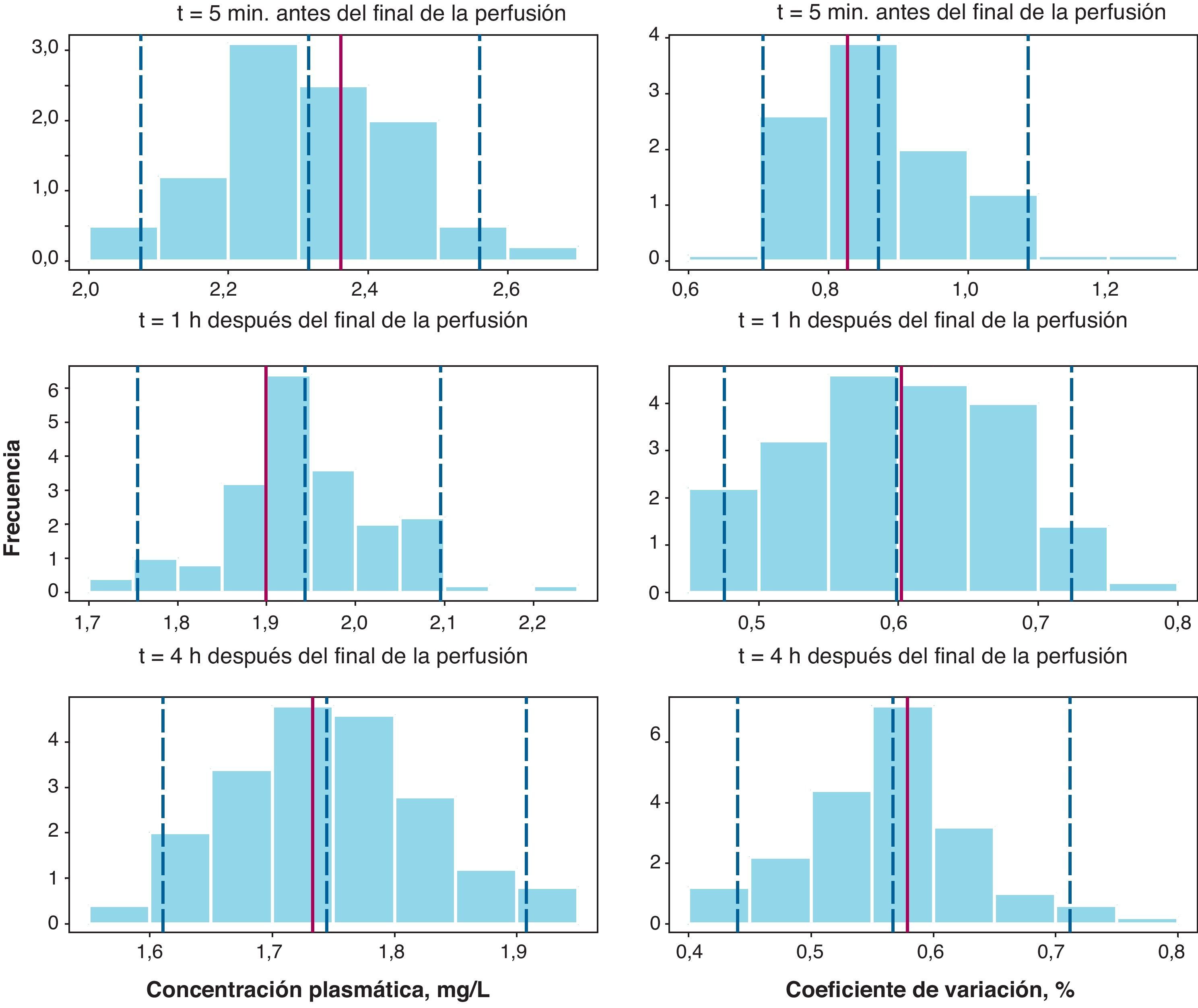
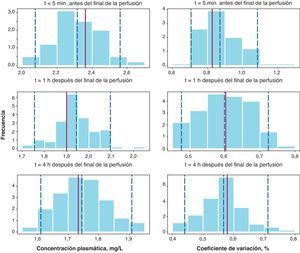
Los resultados del NPC (fig. 3) muestra que la concentración plasmática media y su correspondiente CV (%) se incluyen dentro del intervalo de confianza en todos los casos. Por tanto, estos resultados en su conjunto confirman la validez del modelo desarrollado para describir tanto las concentraciones plasmáticas medias de cisplatino como su variabilidad.
Numerical Predictive Check para la media de concentraciones plasmáticas de cisplatino a cada uno de los tiempos de recogida de muestra (paneles de la izquierda) junto con sus coeficientes de variación (paneles de la derecha). Las líneas verticales discontinuas representan los percentiles 5, 50 y 95 de la distribución simulada y la línea vertical roja continua representa la correspondiente observada en la muestra de paciente analizada.
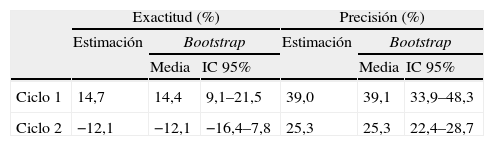
Por último, los resultados de la evaluación de la capacidad predictiva del modelo seleccionado se resumen en la tabla 3. La predicción de las concentraciones plasmáticas de cisplatino a priori presentó un sesgo sistemático promedio inferior al 15% ya que el intervalo de confianza 95% no incluyó el valor cero. La información individual del paciente, obtenida tras la monitorización de las concentraciones plasmáticas de cisplatino en el primer ciclo de quimioterapia, añadió valor en la capacidad predictiva del modelo por cuanto que el ERM mejoró un 21% y eliminó el sesgo sistemático en la predicción de las concentraciones plasmáticas de cisplatino. El RECM en el segundo ciclo se estimó cercano al 20%, valor necesario para que la estrategia de toma de muestras se considere precisa30. Respecto al primer ciclo de quimioterapia, el RECM mejoró un 54% en el segundo ciclo, e indica una mejora en la precisión de la predicción de las concentraciones plasmáticas de cisplatino. La ausencia de sesgo, junto con la precisión alcanzada durante el segundo ciclo de quimioterapia, justifica la utilización de la optimización farmacoterapéutica para reducir la variabilidad en la farmacocinética de cisplatino.
Capacidad predictiva del modelo final en primer y segundo ciclo de quimioterapia
| Exactitud (%) | Precisión (%) | |||||
| Estimación | Bootstrap | Estimación | Bootstrap | |||
| Media | IC 95% | Media | IC 95% | |||
| Ciclo 1 | 14,7 | 14,4 | 9,1–21,5 | 39,0 | 39,1 | 33,9–48,3 |
| Ciclo 2 | −12,1 | −12,1 | −16,4–7,8 | 25,3 | 25,3 | 22,4–28,7 |
IC: Intervalo de confianza.
El primer objetivo de este trabajo ha sido desarrollar un modelo farmacocinético poblacional para caracterizar la evolución temporal de las concentraciones plasmáticas de cisplatino en pacientes oncológicos. Así, se ha determinado que la farmacocinética de cisplatino se describe adecuadamente mediante un modelo bicompartimental con distribución lineal al compartimento periférico y eliminación lineal desde el compartimento central. Este modelo se ha empleado en la literatura con anterioridad para describir la evolución temporal de las concentraciones plasmáticas de cisplatino5. Tras la revisión de los modelos farmacocinéticos de cisplatino total recogidos en la literatura, se seleccionó el modelo descrito por Urien et al.5 como modelo de referencia puesto que el tamaño de muestra del estudio (N=43) es mayor que el descrito por Hanada et al. (N=27)6. Además, en el trabajo de Urien et al.5 se recogieron un mayor número de muestras por paciente y los tiempos de muestreo fueron más prolongados que en el estudio realizado por Hanada et al.6.
El valor típico del volumen de distribución en compartimento central ha sido de 23,9 L, valor comparable al determinado por Urien et al.5 (21,2L) y superior al estimado por Hanada et al.6 (12,2L). El volumen de distribución en estado estacionario estimado ha sido de 48,3 L que claramente excede el volumen de agua corporal total, lo que refleja la elevada distribución a los tejidos periféricos y concuerda con la afinidad de cisplatino por su target intracelular, el ADN1. Las variabilidades inter e intraindividuales en el volumen central son ligeramente superiores a valores previamente publicados5,6. La variabilidad interindividual es superior a la intraindividual, circunstancia que justifica el potencial valor añadido de la personalización farmacoterapéutica. La inclusión de la variabilidad intraindividual en el modelo reduce un 13,4%, la variabilidad residual. Por tanto, estudios posteriores tendrán por objetivo la detección de variables tiempo-dependientes que expliquen la variabilidad intraindividual.
Por otra parte, el aclaramiento plasmático poblacional estimado ha sido de 1,03 L/h, valor ligeramente superior al determinado por Urien et al.5. Estas diferencias pueden ser debidas a la inclusión del aclaramiento de creatinina y de la superficie corporal como covariables del aclaramiento en el modelo farmacocinético descrito por Urien et al.5. Sin embargo, en el presente estudio, el análisis exploratorio gráfico del efecto de la edad, sexo, superficie corporal, aclaramiento de creatinina, ALT, AST, bilirrubina total, fosfatasa alcalina y tipo de tumor de la base de datos no sugieren correlación alguna entre las covariables y los parámetros farmacocinéticos. Además, dado el muestreo reducido empleado en el presente estudio, no se ha realizado un análisis formal de los efectos de las covariables en los parámetros farmacocinéticos, aspecto que se evaluará posteriormente cuando el número de pacientes monitorizados sea mayor y se disponga de suficiente poder estadístico para evaluar estas correlaciones. Además, el valor de regresión a la media de la variabilidad interindividual para Cl fue de 0,102 y de las variabilidades intraindividuales de V1 fueron 0,29 y 0,31 para ciclo 1 y ciclo 2, respectivamente. Estos resultados permiten la utilización de Estimadores Bayesianos Empíricos de los parámetros del modelo para explorar las posibles correlaciones con las covariables de los pacientes31.
Los resultados de la validación interna, realizada mediante bootstrap no-paramétrico, standardized visual y numerical predictive checks, han confirmado que el modelo seleccionado describe adecuadamente la evolución temporal de las concentraciones de cisplatino y su variabilidad y, por lo tanto, puede utilizarse para la optimización farmacoterapéutica de los tratamientos oncológicos con cisplatino.
Para evaluar el efecto que la optimización farmacoterapéutica puede tener en la individualización de pautas posológicas de cisplatino, se ha determinado la capacidad predictiva del modelo seleccionado en términos de exactitud y precisión. Los resultados indican que el modelo presenta sesgo en la predicción de las concentraciones plasmáticas en el primer ciclo. Sin embargo, en el segundo ciclo, al introducir los datos de concentraciones plasmáticas del paciente determinadas tras el primer ciclo de quimioterapia, el sesgo desaparece y la precisión aumenta significativamente. La evaluación del número máximo de ciclos de quimioterapia que sería necesario monitorizar para obtener la máxima exactitud y precisión posible se tiene que explorar con más profundidad y será objeto de un futuro trabajo, no obstante, la monitorización de dos ciclos podría ser suficiente desde un punto de vista clínico.
En conclusión, el modelo farmacocinético poblacional caracteriza adecuadamente la evolución temporal de las concentraciones plasmáticas de cisplatino y su variabilidad en la población de estudio y puede utilizarse de forma exacta y precisa como base de un algoritmo bayesiano para optimizar las pautas posológicas de cisplatino en pacientes oncológicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Anexo. Material adicional
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doixxxxxxxxx.
NOTA: La Dra. Amelia Ramón López ha realizado el presente trabajo durante una estancia de investigación en la Unidad de Farmacoterapia Personalizada, en el marco de un convenio de colaboración entre USP Hospital San Jaime y la Universidad Miguel Hernández.