Los pacientes ingresados en las UCI reciben simultáneamente numerosos fármacos, con una disponibilidad de accesos venosos limitada que obliga a infundir conjuntamente varias perfusiones a través de una misma luz del catéter. La furosemida es una solución sin capacidad tamponante que precipita con facilidad. A pesar de la recomendación de la ficha técnica de que no debe infundirse con otros medicamentos, existen estudios en la bibliografía que demuestran su compatibilidad físicoquímica con otros fármacos. No obstante, las concentraciones estudiadas no siempre coinciden con las utilizadas en la práctica clínica.
ObjetivosEstudiar y verificar la compatibilidad física de la furosemida en mezcla i.v.
Material y métodoEstudio experimental in vitro en el que se procedió a mezclar la furosemida con 12 fármacos a proporción 1:1 obteniendo un total de 40 muestras evaluándose a distintos tiempos (minutos 0–15–30–60–120) las siguientes variables: pH de la mezcla, determinación de cambios en el color, turbidez y precipitación. Para ello se emplearon métodos de observación visuales, medición del pH y absorción por espectrofotometría a 450–620nm.
ResultadosSe realizaron un total de 40 muestras, 13 simples, 12 dobles y 15 triples. Fueron compatibles aquellas mezclas que no presentaron cambios físicos, variación en el pH y cambios en los valores de absorbancia.
ConclusiónLa furosemida es compatible físicamente con las soluciones de bicarbonato, heparina, insulina, morfina, nitroglicerina, nimodipino y tiopental e incompatible con amiodarona, cisatracurio, haloperidol, midazolam y urapidil.
Patients in the intensive care units simultaneously receive concomitantly many drugs, with limited venous accesses. Thus, several different perfusions must be administered jointly through the same catheter. Furosemide is a solution with no buffer capacity that is easily precipitated. In spite of the recommendation on its data sheet stating that it should not be used with other drugs, studies found in the bibliography suggest that it has physicochemical compatibility with other drugs. However, the concentrations studied do not always coincide with those used in the clinical practice.
ObjectivesTo study and verify the physical compatibility of furosemide in intravenous mixture.
Material and methodAn experimental study in vitro, in which furosemide was mixed with 12 drugs at a 1:1 proportion was performed. A total of 40 samples were obtained and the following variables were evaluated at different intervals, 0, 15, 30, 60 and 120min: ph of mixture, color changes, presence of turbidity and precipitation. To do so, visual observation procedures, ph measurements and spectrophotometer absorption at 450 and 620nm were used.
ResultsForty samples, 13 simples, 12 doubles and 15 triples, were obtained. Those mixtures that did not show physical changes, pH variation and absorption variation were considered compatible.
ConclusionFurosemide is physically compatible with bicarbonate solution, heparin, insulin, morphine and nitroglycerin and incompatible with amiodarone, cisatracurium, haloperidol, midazolam and urapidil.
Los pacientes ingresados en las UCI reciben simultáneamente numerosos fármacos, con una disponibilidad de accesos venosos limitada que obliga a infundir conjuntamente varias perfusiones a través de una misma luz del catéter, hecho que puede favorecer la aparición de incompatibilidades.
La compatibilidad farmacológica es un fenómeno físico químico que debe estudiarse in vitro. Los términos compatibilidad y estabilidad van interrelacionados, dependen de factores como la temperatura y luz de exposición, componentes del fármaco: excipientes, concentración del mismo, pH y diluyente. La compatibilidad viene determinada por la ausencia de manifestaciones físicas de inestabilidad como la presencia de gas, cambio de color, turbidez o precipitación de la mezcla1–6. El fenómeno de incompatibilidad ocurre cuando un fármaco es mezclado con otros dando como resultado un producto inapropiado para su administración. Estas alteraciones producen modificaciones físicas como formación de partículas y precipitación pudiendo ocluir el catéter. Si estos alcanzan el torrente circulatorio o se produce formación de gas aumenta el riesgo de embolismo. Además, se producen modificaciones en el efecto del principio activo del fármaco7 como la formación de componentes tóxicos que ocasiona fracaso terapéutico3,8.
Se eligió la furosemida debido a la elevada incidencia de su uso en la UCI. Un estudio multinacional mostró el uso de dicho fármaco en el 63% de los pacientes críticos9,10. Uchino11 confirmó que el 70% de los pacientes de la UCI con insuficiencia renal aguda recibieron tratamiento con diuréticos y de estos la furosemida fue prescrita en el 98,3% de los casos.
La furosemida es un diurético no osmótico con una potente acción. Las ventajas con respecto a la administración en bolo i.v. son: mayor efecto diurético, diuresis constante, niveles plasmáticos estables disminuyendo la inestabilidad hemodinámica, el riesgo de desequilibrios metabólicos y la ototoxicidad12,13.
En la práctica diaria la furosemida se administra por una luz única, limitando las vías de administración i.v., lo que obliga a buscar nuevas estrategias de administración conjunta de fármacos. Su ficha técnica recomienda que no deba mezclarse ni infundirse con otros medicamentos, puesto que es una solución sin capacidad tamponante. Al diluirla o infundirla a través de una misma luz de un catéter con otros fármacos debe tenerse especial cuidado en asegurar que el pH sea neutro o ligeramente alcalino para evitar la precipitación de la mezcla14.
Existen estudios en la bibliografía que demuestran su compatibilidad física con otros fármacos, aunque las concentraciones estudiadas no siempre coinciden con las utilizadas en la práctica clínica. La concentración de los fármacos es uno de los factores determinantes de la compatibilidad de una mezcla. Algunos autores han demostrado que a mayor concentración de fármaco mayor riesgo de precipitación7,15–21.
Con este estudio pretendemos mejorar la seguridad en el uso del medicamento, puesto que la administración de la terapia i.v. es una tarea enfermera.
ObjetivosEstudiar y verificar la compatibilidad física de la furosemida en mezcla i.v.
Material y métodoEstudio de diseño experimental realizado in vitro en el laboratorio del Hospital Universitario Son Dureta durante el periodo comprendido entre los meses de octubre 2008–enero 2009.
La furosemida i.v. Seguril®, está disponible a una concentración de 10mg/ml. Se escogieron los fármacos más utilizados en la práctica clínica administrados en perfusión continua con la furosemida. Se excluyeron las drogas vasoactivas porque se administran por una luz única, su potente y rápida acción ocasiona que cualquier mínima variación en la administración desencadene inestabilidad hemodinámica. Tampoco se ha estudiado el remifentanilo, ya que, en nuestra unidad se administra de forma protocolizada por una luz única debido a efectos adversos irreversibles como la PCR. Se excluyeron el propofol y la nutrición parenteral debido a su componente lipídico y elevado riesgo de contaminación microbiológica en la administración con otros fármacos.
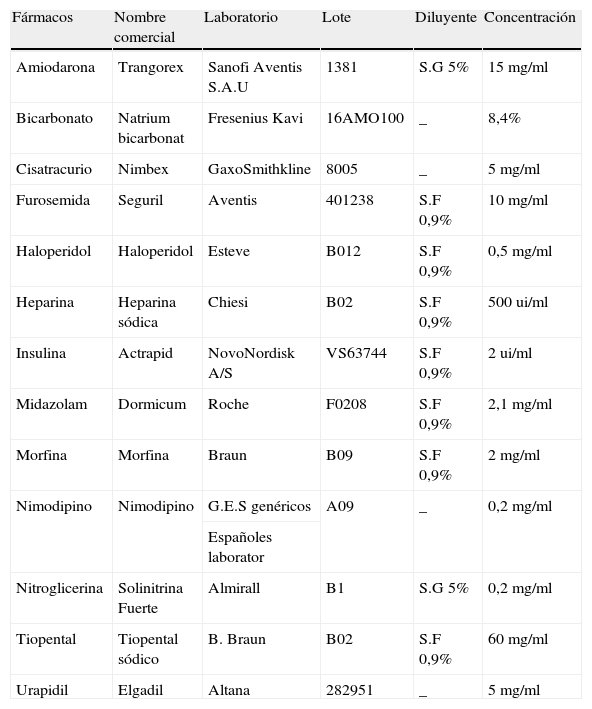
Los fármacos estudiados están detallados en la tabla 1, especificándose su nombre genérico, comercial, lote, laboratorio, concentración de la perfusión estudiada, así como el diluyente utilizado.
Fármacos a estudio
| Fármacos | Nombre comercial | Laboratorio | Lote | Diluyente | Concentración |
| Amiodarona | Trangorex | Sanofi Aventis S.A.U | 1381 | S.G 5% | 15mg/ml |
| Bicarbonato | Natrium bicarbonat | Fresenius Kavi | 16AMO100 | _ | 8,4% |
| Cisatracurio | Nimbex | GaxoSmithkline | 8005 | _ | 5mg/ml |
| Furosemida | Seguril | Aventis | 401238 | S.F 0,9% | 10mg/ml |
| Haloperidol | Haloperidol | Esteve | B012 | S.F 0,9% | 0,5mg/ml |
| Heparina | Heparina sódica | Chiesi | B02 | S.F 0,9% | 500ui/ml |
| Insulina | Actrapid | NovoNordisk A/S | VS63744 | S.F 0,9% | 2ui/ml |
| Midazolam | Dormicum | Roche | F0208 | S.F 0,9% | 2,1mg/ml |
| Morfina | Morfina | Braun | B09 | S.F 0,9% | 2mg/ml |
| Nimodipino | Nimodipino | G.E.S genéricos | A09 | _ | 0,2mg/ml |
| Españoles laborator | |||||
| Nitroglicerina | Solinitrina Fuerte | Almirall | B1 | S.G 5% | 0,2mg/ml |
| Tiopental | Tiopental sódico | B. Braun | B02 | S.F 0,9% | 60mg/ml |
| Urapidil | Elgadil | Altana | 282951 | _ | 5mg/ml |
El estudio se realizó en las mismas condiciones de temperatura y luz ambiental en las que se trabaja en la UCI, ya que son factores que influyen en la estabilidad y compatibilidad de las mezclas. El estudio se llevó a cabo a temperatura ambiente y bajo condiciones normales de luz fluorescente.
Para establecer el intervalo de tiempo estudiado calculamos el tiempo de contacto de las perfusiones mediante la ecuación de continuidad22, que relaciona la longitud y el diámetro del catéter con la velocidad del líquido. Para evitar sesgos debidos a las diferentes densidades de los líquidos solo incluimos perfusiones de igual densidad que el agua; este factor obligó también a excluir perfusiones como el propofol y la nutrición parenteral. El tiempo de contacto oscilaba entre 1–26min. Se estableció el intervalo del estudio de 0–120min para que existiera un margen de seguridad.
Las mezclas se examinaron a los 0–15–30–60–120min porque las incompatibilidades no siempre ocurren inmediatamente tras realizar la mezcla.
Las muestras fueron preparadas en las concentraciones y diluyente utilizados en nuestra práctica diaria en una jeringa de 50ml de prolipopileno con conexión luer lock Alaris® 30602N, exceptuando la nitroglicerina que fue preparada en recipiente de vidrio. Las muestras de bicarbonato y nimodipino fueron extraídas de su recipiente original. Posteriormente, se realizaron las mezclas en los tubos de ensayo de plástico para medir el pH, inyectando inicialmente 5ml de furosemida y posteriormente 5ml del otro fármaco. De la cantidad resultante se extraían 3ml para las cubetas de plástico transparentes de espectrofotometría. Con los 7ml restantes se determinaba el pH. La proporción utilizada era de 1:1. Según Allen23 esta es la proporción de la mezcla que se produce en el punto de inyección en Y al infundir 2 perfusiones simultáneas.
Al revisar la bibliografía evidenciamos las diferentes metodologías utilizadas en los estudios de compatibilidad: algunos basaban sus resultados en la observación visual, otros se fundamentaban en la variación del pH y otros en la variación de las absorbancias. Al elaborar el diseño y para aumentar su validez interna, el equipo investigador consensuó los parámetros a estudio.
Se elaboró una hoja de recogida de datos en las que se registraron las siguientes variables:
- •
Observación directa por todos los investigadores de cambios visuales. Se anotaba el color e intensidad de cada una de las muestras durante el intervalo de tiempo estudiado. La turbidez se clasificó con una escala donde 0=no existencia de turbidez, X=ligera, XX=moderada, XXX=muy turbio. Formación de precipitado o aparición de partículas en el fondo de las cubetas y presencia de burbujas. En caso de opiniones divergentes se repitió la muestra en busca del consenso. Al realizar las mezclas los cambios de color y turbidez fueron inmediatos, pasando de incoloro a blanco opaco. No hubo formación de gas. Todas las muestras que experimentaron cambios de color y turbidez presentaron formación de precipitado. Por tanto, registramos la existencia o no de los mismos.
- •
Medición del pH: se evaluó si había una variación de pH mayor de 0,50 desde el minuto 0–120 con el PH meter GLP 21 CRISON (a 18°C)8,19,24.
- •
Análisis espectrofotométrico: método analítico que utiliza los efectos de la interacción de las radiaciones electromagnéticas con la materia (átomos y moléculas) para medir la absorción o la transmisión de luz por las sustancias. Las muestras se analizaron a una longitud de onda (λ) de 450nm para detectar cambios de color y turbidez y a 620nm para detectar turbidez y precipitación de la muestra16. El espectrofotómetro utilizado fue el UV-1700 Pharmaspec SHIMADZU (a 20°C).
Para evitar errores debidos al azar los aparatos de medición de pH y espectrofotométrica fueron calibrados a diario según las recomendaciones del fabricante.
Se determinaron las variables a estudio de cada fármaco individualmente (muestra simple); de la furosemida con otro fármaco (mezcla doble) y de la furosemida con 2 fármacos (mezcla triple), todo ello a partes proporcionales.
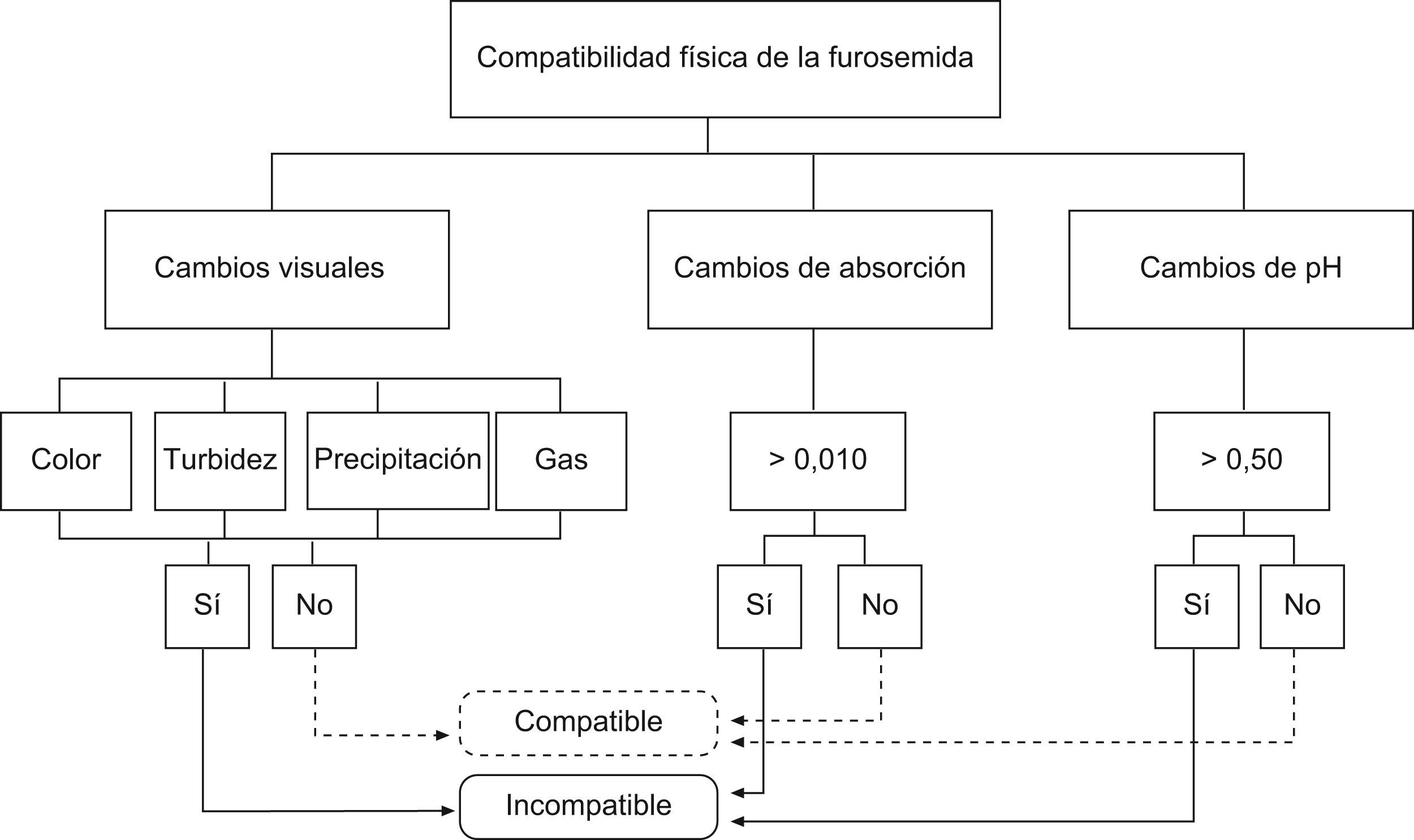
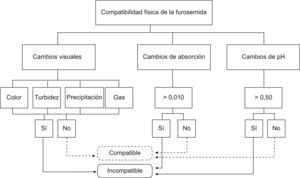
Se consideraron compatibles las mezclas que físicamente no presentaban cambios de color, formación de gas, turbidez y precipitación. Con una variación del pH de la mezcla inferior a 0,50 y con valores espectrofotométricos que no superaran los 0,010nm24,25 de variabilidad de la mezcla en ambas longitudes de ondas durante el periodo de estudio. En el algoritmo se detallan los criterios de compatibilidad (fig. 1). Para que una muestra fuera considerada compatible debía cumplir todos los criterios de compatibilidad, si uno de ellos era incumplido se consideraba la muestra incompatible.
ResultadosSe realizaron un total de 40 muestras, 13 simples, 12 dobles y 15 triples. Estas muestras se analizaron a los 0–15–30–60–120min para determinar la compatibilidad de cada una de ellas a lo largo del tiempo.
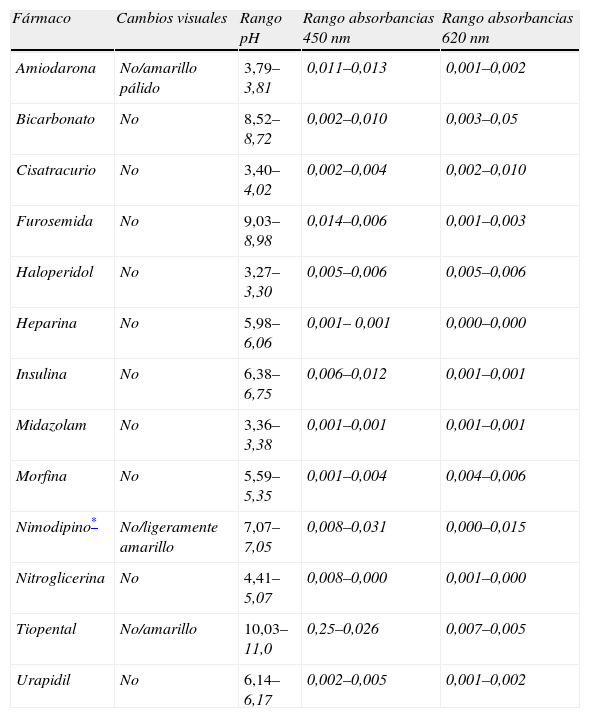
Muestras simples (tabla 2). Todas fueron incoloras excepto la amiodarona, nimodipino y tiopental que son de color amarillo pálido. No presentaron cambios visuales durante el periodo de estudio. Las muestras de color amarillo tienen absorbancias mayores que las transparentes a 450nm. Existen cambios de absorbancia >0,010 en el nimodipino en ambas longitudes de onda. El pH oscilaba de 11 (tiopental) a 3,27 (haloperidol). No existen cambios significativos de pH durante los 120min. En la tabla 3 se detallan los resultados de las distintas variables a lo largo del periodo de estudio de la furosemida.
Muestras simples
| Fármaco | Cambios visuales | Rango pH | Rango absorbancias 450nm | Rango absorbancias 620nm |
| Amiodarona | No/amarillo pálido | 3,79–3,81 | 0,011–0,013 | 0,001–0,002 |
| Bicarbonato | No | 8,52–8,72 | 0,002–0,010 | 0,003–0,05 |
| Cisatracurio | No | 3,40–4,02 | 0,002–0,004 | 0,002–0,010 |
| Furosemida | No | 9,03–8,98 | 0,014–0,006 | 0,001–0,003 |
| Haloperidol | No | 3,27–3,30 | 0,005–0,006 | 0,005–0,006 |
| Heparina | No | 5,98–6,06 | 0,001– 0,001 | 0,000–0,000 |
| Insulina | No | 6,38–6,75 | 0,006–0,012 | 0,001–0,001 |
| Midazolam | No | 3,36–3,38 | 0,001–0,001 | 0,001–0,001 |
| Morfina | No | 5,59–5,35 | 0,001–0,004 | 0,004–0,006 |
| Nimodipino* | No/ligeramente amarillo | 7,07–7,05 | 0,008–0,031 | 0,000–0,015 |
| Nitroglicerina | No | 4,41–5,07 | 0,008–0,000 | 0,001–0,000 |
| Tiopental | No/amarillo | 10,03–11,0 | 0,25–0,026 | 0,007–0,005 |
| Urapidil | No | 6,14–6,17 | 0,002–0,005 | 0,001–0,002 |
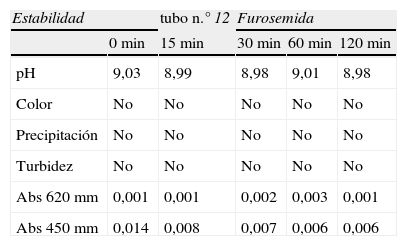
Ficha de recogida de datos de la furosemida a lo largo del periodo de estudio
| Estabilidad | tubo n.° 12 | Furosemida | |||
| 0min | 15min | 30min | 60min | 120min | |
| pH | 9,03 | 8,99 | 8,98 | 9,01 | 8,98 |
| Color | No | No | No | No | No |
| Precipitación | No | No | No | No | No |
| Turbidez | No | No | No | No | No |
| Abs 620mm | 0,001 | 0,001 | 0,002 | 0,003 | 0,001 |
| Abs 450mm | 0,014 | 0,008 | 0,007 | 0,006 | 0,006 |
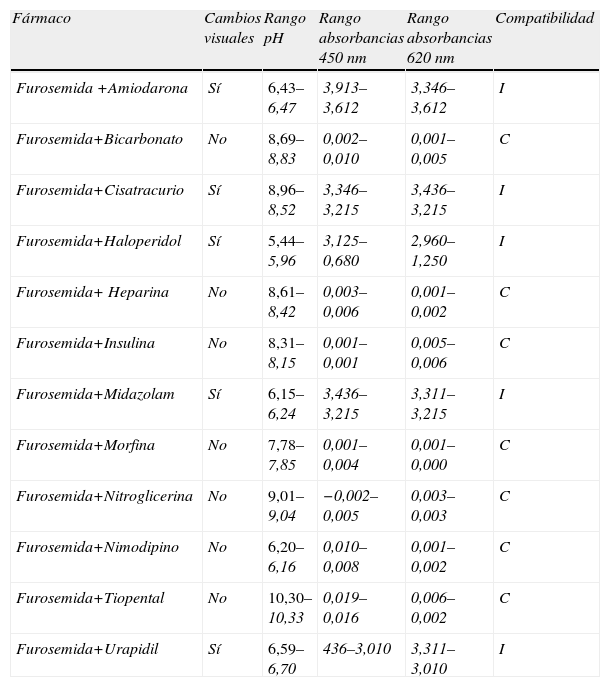
Mezclas dobles (tabla 4). Existen cambios visuales inmediatos de color, turbidez y formación de partículas entre los 60–120min en las mezclas de la furosemida con amiodarona, cisatracurio, haloperidol, midazolam y urapidil. El rango de variabilidad de estas muestras durante el periodo de estudio fue mayor a 0,010nm, llegando incluso a superar los 3,000nm. La furosemida mezclada con fármacos que tienen un pH <4 presenta turbidez y precipitación. El urapidil, con un pH >6 precipita con la furosemida. En la tabla 5 se muestra la secuencia de las mediciones de una mezcla compatible y otra incompatible.
Mezclas dobles
| Fármaco | Cambios visuales | Rango pH | Rango absorbancias 450 nm | Rango absorbancias 620 nm | Compatibilidad |
| Furosemida +Amiodarona | Sí | 6,43–6,47 | 3,913–3,612 | 3,346–3,612 | I |
| Furosemida+Bicarbonato | No | 8,69–8,83 | 0,002–0,010 | 0,001– 0,005 | C |
| Furosemida+Cisatracurio | Sí | 8,96–8,52 | 3,346–3,215 | 3,436–3,215 | I |
| Furosemida+Haloperidol | Sí | 5,44–5,96 | 3,125–0,680 | 2,960–1,250 | I |
| Furosemida+ Heparina | No | 8,61–8,42 | 0,003–0,006 | 0,001–0,002 | C |
| Furosemida+Insulina | No | 8,31–8,15 | 0,001–0,001 | 0,005–0,006 | C |
| Furosemida+Midazolam | Sí | 6,15–6,24 | 3,436–3,215 | 3,311–3,215 | I |
| Furosemida+Morfina | No | 7,78–7,85 | 0,001–0,004 | 0,001–0,000 | C |
| Furosemida+Nitroglicerina | No | 9,01–9,04 | −0,002–0,005 | 0,003–0,003 | C |
| Furosemida+Nimodipino | No | 6,20–6,16 | 0,010–0,008 | 0,001–0,002 | C |
| Furosemida+Tiopental | No | 10,30–10,33 | 0,019–0,016 | 0,006–0,002 | C |
| Furosemida+Urapidil | Sí | 6,59–6,70 | 436–3,010 | 3,311–3,010 | I |
C: compatible; I: incompatible.
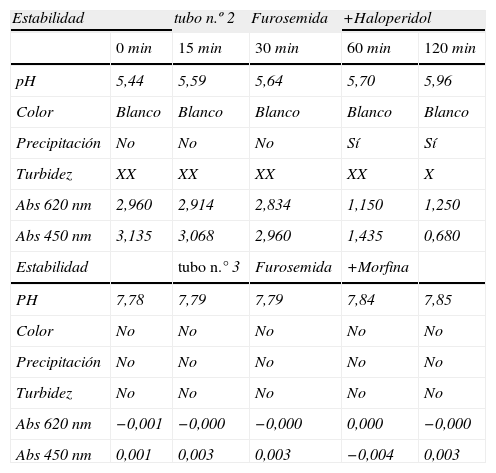
En la tabla superior se presenta la secuencia de las mediciones de una mezcla incompatible
| Estabilidad | tubo n.º 2 | Furosemida | +Haloperidol | ||
| 0min | 15min | 30min | 60min | 120min | |
| pH | 5,44 | 5,59 | 5,64 | 5,70 | 5,96 |
| Color | Blanco | Blanco | Blanco | Blanco | Blanco |
| Precipitación | No | No | No | Sí | Sí |
| Turbidez | XX | XX | XX | XX | X |
| Abs 620nm | 2,960 | 2,914 | 2,834 | 1,150 | 1,250 |
| Abs 450nm | 3,135 | 3,068 | 2,960 | 1,435 | 0,680 |
| Estabilidad | tubo n.° 3 | Furosemida | +Morfina | ||
| PH | 7,78 | 7,79 | 7,79 | 7,84 | 7,85 |
| Color | No | No | No | No | No |
| Precipitación | No | No | No | No | No |
| Turbidez | No | No | No | No | No |
| Abs 620nm | −0,001 | −0,000 | −0,000 | 0,000 | −0,000 |
| Abs 450nm | 0,001 | 0,003 | 0,003 | −0,004 | 0,003 |
En la tabla inferior se presenta la secuencia de las mediciones de una mezcla compatible.
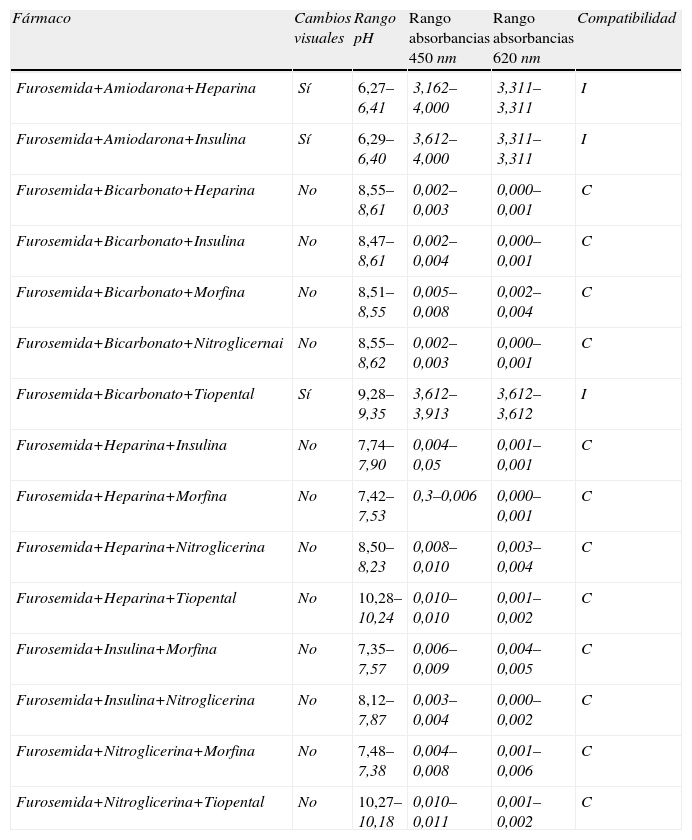
Mezclas triples (tabla 6). Se observó que cuando 2 fármacos eran incompatibles al añadir un tercero la mezcla resultante también era incompatible. Por ello, se seleccionaron 13 mezclas triples cuyos fármacos habían resultado compatibles en las muestras dobles. Visualmente 12 mezclas no presentaron cambios, únicamente la compuesta por furosemida, bicarbonato y tiopental que mostró un precipitado blanco turbio al minuto 0.
Mezclas triples
| Fármaco | Cambios visuales | Rango pH | Rango absorbancias 450nm | Rango absorbancias 620nm | Compatibilidad |
| Furosemida+Amiodarona+Heparina | Sí | 6,27–6,41 | 3,162–4,000 | 3,311–3,311 | I |
| Furosemida+Amiodarona+Insulina | Sí | 6,29–6,40 | 3,612–4,000 | 3,311–3,311 | I |
| Furosemida+Bicarbonato+Heparina | No | 8,55–8,61 | 0,002–0,003 | 0,000–0,001 | C |
| Furosemida+Bicarbonato+Insulina | No | 8,47–8,61 | 0,002–0,004 | 0,000–0,001 | C |
| Furosemida+Bicarbonato+Morfina | No | 8,51–8,55 | 0,005–0,008 | 0,002–0,004 | C |
| Furosemida+Bicarbonato+Nitroglicernai | No | 8,55–8,62 | 0,002–0,003 | 0,000–0,001 | C |
| Furosemida+Bicarbonato+Tiopental | Sí | 9,28–9,35 | 3,612–3,913 | 3,612–3,612 | I |
| Furosemida+Heparina+Insulina | No | 7,74–7,90 | 0,004–0,05 | 0,001–0,001 | C |
| Furosemida+Heparina+Morfina | No | 7,42–7,53 | 0,3–0,006 | 0,000–0,001 | C |
| Furosemida+Heparina+Nitroglicerina | No | 8,50–8,23 | 0,008–0,010 | 0,003–0,004 | C |
| Furosemida+Heparina+Tiopental | No | 10,28–10,24 | 0,010–0,010 | 0,001–0,002 | C |
| Furosemida+Insulina+Morfina | No | 7,35–7,57 | 0,006–0,009 | 0,004–0,005 | C |
| Furosemida+Insulina+Nitroglicerina | No | 8,12–7,87 | 0,003–0,004 | 0,000–0,002 | C |
| Furosemida+Nitroglicerina+Morfina | No | 7,48–7,38 | 0,004–0,008 | 0,001–0,006 | C |
| Furosemida+Nitroglicerina+Tiopental | No | 10,27–10,18 | 0,010–0,011 | 0,001–0,002 | C |
C: compatible; I: incompatible.
La compatibilidad farmacológica de la furosemida está documentada principalmente en la literatura americana. La mayoría de investigaciones obtienen sus datos de estudios in vitro mediante métodos visuales15,18,20,26.
Las concentraciones de los fármacos utilizados en la práctica diaria suelen ser superiores a los estudiados en la bibliografía consultada, excepto la furosemida que coincide con la estudiada. Por ello, la comparación de los resultados debe ser exhaustiva. En la UCI existe un protocolo para la preparación de las infusiones farmacológicas; se eligieron las concentraciones más altas, puesto que a mayor concentración de fármaco, mayor riesgo de incompatibilidad2,16,20. De ahí surgió la necesidad de verificar la compatibilidad física de la administración en Y-site de los fármacos en perfusión continua a diferente concentración.
Existe concordancia con la bibliografía en la compatibilidad de la furosemida con la heparina, tanto a concentraciones superiores (1.000UI/ml)20,27 como inferiores (100UI/ml)18 a la nuestra. Y en la compatibilidad de la furosemida con la nitroglicerina, siendo inferior la concentración estudiada (0,2mg/ml) a la referida en la bibliografía (0,4mg/ml)18.
El tiopental resulta compatible con la furosemida, al igual que en el Handbook of Injectable Drugs28. No coincidimos con Nemec en este resultado, ya que considera incompatible la mezcla.
Coincidimos con Chiu18 en la compatibilidad de la furosemida con la morfina a igual concentración, aunque la literatura es discordante; algunos autores la consideran incompatible29,30.
Chalmers15 afirma la incompatibilidad de la furosemida con la amiodarona, a pesar de que su concentración (6mg/ml) es inferior a la estudiada (15mg/ml).
Trissel20 estudió la compatibilidad visual del cisatracurio a diferentes concentraciones (0,1–2–5mg/ml) resultando compatible a concentración 0,1mg/ml e incompatible con el resto formando inmediatamente nebulosas «cloudiness».
El midazolam a igual concentración resulta incompatible18. Mantong31 estudió una concentración inferior de midazolam (1mg/ml) confirmando el resultado.
No consta información en la bibliografía consultada de la administración en Y-site de la furosemida con las soluciones de haloperidol, insulina, nimodipino y urapidil. En la bibliografía la compatibilidad de la furosemida con el bicarbonato está estudiada en mezcla en jeringa29.
Coincidimos con otros autores3,5,6,15,19,22,32 en recomendar mezclar fármacos con un pH similar, ya que las soluciones ácidas han resultado incompatibles con las alcalinas.
El rango de pH de las mezclas estudiadas no presenta cambios significativos durante el periodo de estudio. Tras consultar la bibliografía, definir los criterios de compatibilidad no ha sido fácil, los autores coinciden en determinar la compatibilidad en los criterios visuales, color, turbidez, precipitación, incluso la variabilidad de las absorbancias. Sin embargo, no existe un único consenso en la variabilidad del pH de la muestra. Nemec8 considera incompatible cambios superiores a 0,2, en cambio Yamashita19 plasma valores superiores a 2. Honisco25 determina la compatibilidad de pH >0,1 y Dasta24 y Patel33, cambios pH>0,5.
La lectura de las absorbancias confirma la incompatibilidad visual de las muestras, aunque la bibliografía es escasa a la hora de tener unos valores de referencia.
Las absorbancias de las muestras amarillas son mayores que las transparentes a 450nm16. Esta longitud de onda es la que detecta el color. Existen cambios de absorbancia >0,010 en el nimodipino en ambas longitudes de onda. Según la ficha técnica34 es ligeramente fotosensible, no precisa medidas protectoras si se administra bajo luz natural tenue o artificial durante 10h y durante el ensayo se mantuvo bajo luz fluorescente en tubos de ensayo transparentes.
Limitaciones del estudio: al ser la composición y concentración de los fármacos factores responsables de la compatibilidad de la mezcla, este ensayo solo será útil en aquellas unidades que utilicen los fármacos y concentraciones estudiadas.
Implicación para la práctica clínica: conocer y verificar la compatibilidad i.v. de la furosemida permite su administración conjunta con otros fármacos, disminuye la necesidad de instaurar un mayor número de accesos vasculares en el paciente crítico y reduce los riesgos asociados a la coadministración de la terapia i.v.
ConclusionesLa furosemida es compatible físicamente con el bicarbonato, heparina, insulina, morfina, nitroglicerina, nimodipino y tiopental e incompatible con amiodarona, cistracurio, haloperidol, midazolam y urapidil.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos al servicio de laboratorio del hospital por la facilitación de medios y uso de sus instalaciones. A los doctores P. Ventayol del servicio de farmacia y a J.M. Raurich de la unidad de cuidados intensivos.