Introducción
El género Rickettsia está constituido por diferentes especies de bacterias gramnegativas y se enmarca dentro de la familia Rickettsiaceae (que además incluye a Coxiella, Ehrlichia y Bartonella). Todas las especies del género tienen en común la necesidad de ser parásitos intracelulares, su corta viabilidad fuera de los reservorios y vectores que infectan, y la dificultad para ser cultivadas en el laboratorio. Su ciclo vital salvaje se mantiene al infectar distintas especies de hospedadores (en general mamíferos) y vectores (en general garrapatas y pulgas). A excepción de R. prowazekii, el ser humano constituye tan sólo un huésped accidental; a pesar de ello el impacto mundial de las enfermedades producidas por estos microorganismos continúa siendo considerable debido a su elevada prevalencia en numerosas áreas y morbilidad1,2. Además, el interés general por este género ha aumentado en los últimos años por su potencial capacidad para ser utilizadas como armas biológicas3.
La patogenia es muy similar a todas ellas, y consiste en una vasculitis de pequeño vaso por infección directa de las células endoteliales, que origina un infiltrado linfohistiocitario perivascular. Las rickettsias, al contactar con las células endoteliales, inducen su propia fagocitosis y, una vez dentro del citosol, escapan del fagosoma y proliferan por fisión binaria simple, siendo finalmente expulsadas por exocitosis para seguir infectando células contiguas. La infección se inicia en la zona de inoculación, y posteriormente se extiende célula a célula y por la circulación venosa, lo que finalmente produce una pléyade de cientos de focos parcheados de vasculitis multisistémica. Según la distribución de las rickettsias se puede producir neumonitis intersticial, miopericarditis, lesiones vasculíticas cutáneas (el clásico exantema), meningitis linfocitaria, así como afectación hepática, renal y gastrointestinal. Además una de las principales consecuencias del daño endotelial es el aumento de la permeabilidad capilar que puede desencadenar edema, hipotensión-shock distributivo, hipoalbuminemia e insuficiencia prerrenal secundaria. También es relativamente frecuente el consumo de plaquetas, y la subsiguiente trombopenia, si bien el desarrollo de fenómenos hemorrágicos y coagulación intravascular diseminada es raro4-6.
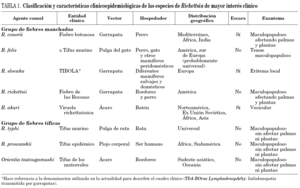
La clasificación más utilizada es la que divide las rickettsiosis en dos grupos: el de las fiebres manchadas y el de las fiebres tíficas. Las especies, áreas geográficas, hospedadores, vectores y entidades clínicas que producen se detallan en la tabla 1. Dependiendo del área geográfica, así como del tipo de hospedadores y vectores, diferentes especies de los dos grupos comentados se han distribuido y ocupado los nichos ecológicos. Así, en América la especie más frecuente del grupo de las fiebres manchadas es R. rickettsii; sin embargo, en la cuenca mediterránea lo es R. conorii. En nuestro entorno las dos entidades más frecuentes son la fiebre botonosa mediterránea y el tifus murino; a las que les dedicaremos un espacio preferente en la actual revisión, sin dejar de revisar otras rickettsiosis de interés por emergentes, o por su alta incidencia en otras áreas.
Rickettsiosis del grupo de las fiebres manchadas
Las fiebres manchadas constituyen un grupo de zoonosis transmitidas por garrapatas y causadas por diversas rickettsias muy relacionadas entre sí. Este grupo de enfermedades presenta una distribución universal. El prototipo en nuestra área geográfica es la fiebre botonosa.
Fiebre botonosa mediterránea
La fiebre botonosa es la rickettsiosis exantemática más frecuente en los países de la cuenca mediterránea, donde la enfermedad es endémica. En la década de 1970 y buena parte de la de 1980 se apreció un resurgimiento de la enfermedad en estos países (España, Francia, Italia, Israel)7,8. Esta tendencia al aumento del número de casos se ha detenido, e incluso invertido, en los últimos años.
El agente causal es R. conorii. Puede parasitar diversos ácaros, que actúan como vectores. En la cuenca mediterránea, el vector principal de la enfermedad es la garrapata del perro (R. sanguineus), aunque en otras zonas geográficas puedan transmitirla otras garrapatas ixódidas. Se estima que hasta el 20% de las garrapatas están infectadas por R. conorii, si bien no experimentan daño alguno. Las garrapatas también actúan como reservorio de la enfermedad debido a su capacidad de transmitir las rickettsias por vía transovárica y transestadial.
Los huéspedes habituales son pequeños mamíferos roedores y perros. El hombre es un huésped accidental en el ciclo biológico de las garrapatas. La mayoría de los pacientes refieren contacto con perros. En ocasiones la enfermedad aparece por picadura de garrapatas que se hallan en el suelo. Con alguna excepción, los estudios de seroprevalencia realizados en población humana sana en zonas endémicas muestran una positividad del 8-26%9. La fiebre botonosa aparece fundamentalmente en la época estival, con una incidencia máxima en el mes de agosto, coincidiendo con el ciclo biológico de la garrapata que infesta al perro desde el inicio del verano. La enfermedad afecta a ambos sexos, con un ligero predominio en los varones, y a todas las edades, con predilección por las dos primeras décadas de la vida. Aunque se consideraba clásicamente como una enfermedad rural, cada vez es más frecuente en las zonas urbanas.
El período de incubación suele ser de 4-20 días. En la mayoría de los casos no puede determinarse con exactitud, ya que en general la picadura de la garrapata pasa inadvertida. La lesión de inoculación es indolora y rara vez pruriginosa. Está presente en el 70-85% de los casos y puede ser múltiple, aunque no es frecuente. En los niños predomina en la cabeza, y en los adultos, en las extremidades. Consiste en una lesión ulcerosa, recubierta por una escara negra y rodeada de un halo eritematoso. Recibe el nombre de mancha negra o tache noire. Las manifestaciones clínicas se instauran de forma abrupta, con fiebre alta, con escalofríos o sin ellos, cefalea, torpor mental, fotofobia, intensa afectación del estado general, mialgias y artralgias, sobre todo en las extremidades inferiores. A partir del tercer o cuarto día aparece, en casi todos los casos, un exantema generalizado, maculopapuloso, que afecta a palmas y plantas, y que constituye una de las manifestaciones más características de la enfermedad. En ocasiones puede ser purpúrico. En los niños la sintomatología suele ser menos intensa que en los adultos. En la tabla 2 se resumen las principales manifestaciones clínicas de la enfermedad10,11. Aproximadamente un tercio de los pacientes tiene manifestaciones digestivas (vómitos, diarrea o dolor abdominal). A pesar de que el hígado es palpable en el 25-45% de los casos, el curso de la afección hepática es subclínico. La afección muscular en esta entidad es más frecuente de lo que se consideraba, incluso en las formas benignas de la enfermedad12. De forma excepcional, se han descrito monoartritis o poliartritis. Suelen afectar las grandes articulaciones y pueden darse en fase aguda o comportarse como una artritis reactiva13.
La velocidad de sedimentación globular (VSG) suele estar moderadamente aumentada. Las alteraciones analíticas más comunes son la leucopenia (en ocasiones, leucocitosis) y la tendencia a la anemia y la plaquetopenia. En el 18-38% de los casos se refiere hipoalbuminemia, que a veces se acompaña de edemas en las piernas, secundarios al aumento de permeabilidad vascular. Puede aparecer hiponatremia. La elevación de las enzimas hepáticas es frecuente (50% de los casos) y constituye la manifestación más común de afectación hepática. Un alto porcentaje de pacientes (35%) presenta una elevación de las enzimas musculares específicas (creatincinasa y aldolasas). En algunos enfermos hay proteinuria, alteraciones en el sedimento urinario o aumentos moderados de la creatinina sérica, aunque es excepcional la insuficiencia renal aguda. En el curso de la fiebre botonosa se han descrito alteraciones en los factores de la coagulación. También se han referido incrementos de la adenosindesaminasa (ADA) y de la neopterina. El factor de necrosis tumoral (TNF), sus receptores y la interleucina 6 (IL-6) aumentan en la fase aguda de la enfermedad y este aumento es mayor en las formas graves14-16.
R. conorii requiere, para su cultivo, la inoculación en animales (cobayo) o el empleo de células VERO o fibroblastos L.929. Por medio de centrifugación (Shell vial) se puede detectar R. conorii en muestras de sangre, en menos de 72 h. En la actualidad estas técnicas sólo están disponibles en centros de investigación. Con respecto al diagnóstico serológico, parece demostrado que la mejor técnica en cuanto a disponibilidad, sensibilidad, especificidad y rapidez es la inmunofluorescencia indirecta (IFI). Esta técnica permite, además, investigar de forma independiente la presencia de anticuerpos específicos IgM, a fin de distinguir entre infección actual y seropositividad residual. Son títulos significativos a partir de 1/80. A pesar de tratarse de una prueba específica, puede (aunque a títulos bajos) existir positividad cruzada con R. typhi, R. rickettsii y otras del grupo de las fiebres manchadas. Dado que los métodos serológicos ofrecen resultados tardíos, los datos clínicos y epidemiológicos siguen constituyendo la base del diagnóstico inicial. Otras técnicas, como el immunoblot y la reacción en cadena de la polimerasa (PCR), pueden ser de ayuda para una rápida confirmación diagnóstica. La tinción directa de muestras de tejido infectado, incluyendo la lesión de inoculación, por el método de Giménez, pone de manifiesto las rickettsias, pero no las diferencia de otros microorganismos. Por PCR, inmunofluorescencia directa (IFD) o cultivo es posible identificar de forma específica R. conorii17.
En la fase inicial, sólo los antecedentes epidemiológicos, su aparición estival y el hallazgo de la mancha negra puede orientar el diagnóstico. Una vez que aparece el exantema, la fiebre botonosa debe diferenciarse del sarampión, la meningococemia, la sífilis secundaria, la vasculitis leucocitoclástica y las toxicodermias. Si no existe mancha negra, deben considerarse otras rickettsiosis exantemáticas, especialmente el tifus murino. En estos últimos años hay que añadir en el diagnóstico diferencial algunos casos de primoinfección por el VIH que cursan con fiebre y exantema.
Si bien se trata, por lo general, de una enfermedad benigna, que cura sin secuelas, existen con cierta frecuencia (7,5%) formas graves. Se han descrito casos letales hasta en el 2,5% de los pacientes, aunque en general la mortalidad es muy baja o nula. La gran mayoría de los casos mortales no recibieron tratamiento antibiótico adecuado o éste fue iniciado muy tardíamente (más de 7 días desde el inicio de la fiebre).
La sensibilidad in vitro de R. conorii a las tetraciclinas y en particular a la doxiciclina (concentración inhibitoria mínima [CIM] 0,25 y 0,06 μg/ml, respectivamente) es elevada, al igual que al cloranfenicol (CIM, 0,25 μg/ml) y rifampicina (CIM, 0,25 μg/ml). Las quinolonas, en especial ciprofloxacino, ofloxacino y pefloxacino (CIM < 1 μg/ml), con notable penetración intracelular, son también efectivas. Los macrólidos muestran in vitro una sensibilidad heterogénea. Así, mientras que la eritromicina con CIM de 3-8 μg/ml debe considerarse ineficaz, la josamicina y la claritromicina (CIM, 1 μg/ml) pueden ser una alternativa.
El tratamiento actual de la fiebre botonosa se basa en pautas cortas de doxiciclina, con las que son prácticamente nulos los posibles efectos adversos en los niños menores de 8 años, ya que estos efectos se relacionan, sobre todo, con la dosis total administrada durante la infancia. Estudios realizados con pautas cortas de doxiciclina oral en un solo día (200 mg/12 h en adultos y 5 mg/kg/12 h en niños) han mostrado igual efectividad que las pautas clásicas de clorhidrato de tetraciclina (500 mg/6 h y 30-40 mg/ kg/día en niños durante 15 días)18. En caso de intolerancia digestiva puede administrarse por vía intravenosa. La josamicina (1 g/8 h en adultos y 50 mg/kg/12 h en niños, durante 5 días) y la claritromicina (500 mg/12 h en adultos y 15 mg/kg/12 h en niños, durante 5 días) también han demostrado ser una buena alternativa en alérgicos a las tetraciclinas y en embarazadas19,20. El ciprofloxacino (500 mg/12 h, 5 días) y el ofloxacino (200 mg/12 h durante 7-10 días) han demostrado también ser eficaces en los adultos y bien tolerados, aunque no superiores a la doxiciclina21. Su posible toxicidad en el embarazo y en los niños limita su uso.
Las medidas de profilaxis consisten fundamentalmente en desparasitar los animales (en particular los perros) mediante el uso de repelentes, evitar el contacto con garrapatas y animales parasitados por éstas y desinfectar los lugares frecuentados por animales infestados. No hay evidencia de la utilidad de la quimioprofilaxis tras la picadura de una garrapata.
Otras rickettsiosis del grupo de las fiebres manchadas
Algunas fiebres manchadas que reciben otros nombres, según la zona geográfica en que se presentan, son producidas también por R. conorii, mientras que en otras regiones se han identificado nuevas rickettsias patógenas del grupo de las fiebres manchadas como R. sibirica, R. japonica, R. australis, Israeli tick typhus Rickettsia, Astrakhan fever Rickettsia, R. africae, R. honei, R. felis, R. slovaca y R. mongolotimonae. Otras rickettsias del mismo grupo, como R. canada, R. rhipicephali, R. parkeri, R. montana, R. bellii, R. helvetica, R. massiliae y R. Bar 29 se consideran, hasta el momento, como no patógenas. R. Bar 29 fue aislada de garrapatas recogidas en Cataluña, y actualmente existen datos indirectos que sugieren que podría tratarse de una especie patógena para el hombre22,23. R. rickettsii, R. akari y R. slovaca producen enfermedades con algunas características diferenciales respecto a la fiebre botonosa.
Fiebre manchada de las Montañas Rocosas
El agente etiológico es R. rickettsii, una bacteria intracelular obligada que en la naturaleza reside en las células de ciertas garrapatas ixódidas. En esta enfermedad, Ricketts describió, en 1909, los microorganismos que luego recibirían en su honor la denominación de Rickettsia. Genética e inmunológicamente, R. rickettsii guarda una estrecha relación con otros miembros del grupo de las fiebres manchadas. La epidemiología de la enfermedad está relacionada con la garrapata huésped que constituye al mismo tiempo el reservorio y el vector. Diferentes especies de garrapatas, en distintas regiones geográficas (Dermacentor variabilis y D. andersonii en EE.UU., R. sanguineus en México y Amblyomma cajennense en América del Sur) transmiten la enfermedad. Actualmente se comunican en Estados Unidos 600-1.200 casos anuales.
Al inicio de la enfermedad las manifestaciones clínicas son poco específicas. Su período de incubación es de aproximadamente 7 días, pero puede oscilar entre 2 y 14 días. Son frecuentes el malestar, la fiebre, la cefalea y las mialgias. Durante los días siguientes las manifestaciones reflejan la afección sistémica: anorexia, náuseas, vómitos, diarrea, dolor abdominal, fotofobia y tos. El exantema no suele aparecer hasta el cuarto día; macular al inicio, evoluciona luego a papular y petequial. El 10% de los pacientes no presentan exantema. La afección palmoplantar suele ser tardía. En el 25% de los casos aparecen conjuntivitis, insuficiencia respiratoria grave, ictericia y afección del sistema nervioso central (SNC), siendo ésta el principal factor de morbilidad. La muerte en pacientes no tratados adecuadamente suele ocurrir en la segunda semana, aunque existen casos fulminantes, por lo general en individuos de raza negra con déficit de glucosa-6-fosfato-deshidrogenasa. Puede haber anemia, y la plaquetopenia es frecuente, sobre todo en los casos graves. La coagulación intravascular diseminada es rara. Otras alteraciones biológicas son la hiponatremia y la elevación de la lactato deshidrogenasa (LDH), la creatinfosfocinasa (CPK) y las transaminasas24-26.
El diagnóstico diferencial debe realizarse con las mismas entidades indicadas para la fiebre botonosa. Para la confirmación diagnóstica se utilizan las mismas técnicas que en dicha enfermedad. Los títulos diagnósticos son de 1/64 para la inmunofluorescencia. Se ha utilizado la técnica de PCR para detectar ADN de R. rickettsii en muestras de sangre de pacientes con formas graves27.
La mortalidad es del 3-7% y ocurre en los pacientes no tratados de forma temprana y adecuada. Los pacientes que sobreviven quedan inmunizados. La fiebre manchada de las Montañas Rocosas responde al tratamiento con tetraciclinas y cloranfenicol, tanto por vía oral como intravenosa. Se mantiene hasta 48 h después de la apirexia. Cuando existe afección del SNC se prefiere el cloranfenicol. R. rickettsii es también sensible a la rifampicina, el ciprofloxacino y el ofloxacino.
Viruela rickettsiósica
Descrita inicialmente en Nueva York en 1946 y luego en otras ciudades de Estados Unidos, Sudáfrica, Corea y la ex Unión Soviética, es una rickettsiosis producida por R. akari. La transmisión de R. akari al hombre es accidental y la produce el ácaro del ratón (Allodermanyssus sanguineus). En el lugar de la inoculación se produce una pápula que progresa a escara. El signo inicial es la aparición de una pápula en el lugar de la picadura. En ella se desarrolla una vesícula central. El período de incubación es de unos 10 días. La pápula se transforma en una escara negra. Es frecuente la adenopatía regional y son características la fiebre remitente y las cefaleas intensas. A los 2-6 días del inicio de la fiebre, aparece el exantema, maculoso y luego papuloso, en cuyo centro se desarrolla una vesícula.
La lesión inicial primaria sugiere fiebre botonosa, tifus de las malezas, sífilis primaria o ántrax cutáneo. La erupción cutánea puede confundirse con varicela, otras rickettsiosis, meningococemia o sarampión atípico. El diagnóstico es serológico, por IFI, que presenta reacciones cruzadas con R. rickettsii. No hay casos mortales. El tratamiento de elección es la doxiciclina durante 2-5 días28.
Linfoadenopatía transmitida por garrapatas (TIBOLA)
Se trata de una nueva rickettsiosis transmitida por garrapatas descrita por Lakos en Hungría en 199729. El agente causal es con casi completa seguridad una rickettsia del grupo de las fiebres manchadas, R. slovaca. Aunque no se ha cultivado de los pacientes sí se pudo identificar por técnicas de PCR. El vector es Dermacentor marginatus, que parasita diferentes animales como cabras, ovejas y jabalíes, entre otros, por lo que el contagio humano se produce en contacto con la naturaleza. Predomina en las épocas de otoño e invierno. Es frecuente en niños. El mayor número de casos se ha recogido en Hungría, aunque también hay casos en otros países como Francia. En España de han diagnosticado un número importante de casos durante los últimos años, sobre todo en La Rioja y en Cataluña, donde se han diagnosticado 24 casos30,31.
El cuadro clínico consiste fundamentalmente en la aparición de una escara necrótica rodeada de un halo más claro, principalmente en el cuero cabelludo. Se acompaña de una adenopatía regional dolorosa, fiebre y astenia. En la zona de la escara, tras la resolución del cuadro, suele persistir una alopecia residual. Por el momento el diagnóstico es fundamentalmente clínico-epidemiológico. La serología específica tan sólo es positiva en un pequeño número de casos. La PCR puede ser útil para detectar R. slovaca en la escara. Aunque el tratamiento no está bien establecido, se emplean las tetraciclinas o en su defecto los macrólidos.
Rickettsiosis del grupo de las fiebres tíficas
Tifus murino o endémico
Es la antropozoonosis causada por R. typhi. Fue Maxcy quien en 1926 estableció las diferencias entre éste y el tifus epidémico. Posteriormente, en 1931 Dyer et al, y Zinsser et al aislaron el microorganismo de pulgas de ratas capturadas en la vecindad de pacientes y en cerebro de ratas, respectivamente. Su distribución es universal, siendo endémico en extensas áreas geográficas de los cinco continentes. Sin embargo, su importancia clínica y sanitaria se ha subestimado a pesar de constituir en la actualidad un paradigma de enfermedad infecciosa emergente32,33. En España hay evidencias de la existencia de casos de tifus murino en las provincias de Sevilla, Huelva, Murcia y las Islas Canarias34-37.
La importancia de esta rickettsiosis en todo el mundo queda reflejada en la elevada frecuencia con que se encuentran anticuerpos específicos frente a R. typhi en diferentes estudios seroepidemiológicos, variando la seroprevalencia encontrada por diferentes autores entre el 3-36%38,39. En España, se han constatado tasas de seroprevalencia entre el 4-8,7%40,41. Asimismo su relevancia clínica en nuestro entorno se comprobó en los resultados de un estudio prospectivo reciente sobre la etiología de la fiebre de duración intermedia adquirida en la comunidad (FDI)34, realizado durante 17 años en Sevilla, en el que el tifus murino supuso casi el 7% de los 926 pacientes evaluados. Se estima que la incidencia real del tifus murino como causa de FDI puede ser aún mayor (casos de curso leve, tratados en atención primaria que no se derivan a atención especializada), pero este extremo se desconoce en la actualidad.
El ciclo de transmisión del tifus murino también es una cuestión discutida en la actualidad. Está demostrado, tras trabajos clásicos, que los reservorios esenciales de R. typhi lo constituyen las ratas peridomésticas Rattus rattus y R. norvegicus, siendo el vector la pulga de la rata Xenopsylla cheopis. La pulga se infecta al ingerir sangre de ratas infectadas: R. typhi se multiplica en sus células intestinales y se excreta por las heces, a partir de donde se infectan nuevas ratas, penetrando a través de pequeñas excoriaciones de la piel. La pulga infectada, además, puede transmitir el microorganismo por vía transovárica a toda su descendencia. La transmisión a humanos es accidental por la contaminación del lugar de la picadura o de excoriaciones cutáneas con heces de la pulga. Recientemente, se ha demostrado que la pulga del gato (Ctenocephalides felis) puede desempeñar un importante papel en el ciclo biológico y en la transmisión de R. typhi a seres humanos. Diferentes observaciones en áreas con casos de tifus murino, encontraron que tanto gatos como otros mamíferos peridomésticos tenían títulos elevados de anticuerpos frente a R. typhi. Asimismo, la pulga encontrada con más frecuencia fue C. felis, no se detectó la presencia de X. cheopis42,43. La presencia de casos endémicos de tifus murino en muchas áreas donde no se han detectado ratas ni pulgas de rata infectadas, y las características particulares de este nuevo reservorio (se calculan por millones los hogares con gato/s como animal/es de compañía) y de C. felis (distribución universal y gran avidez por picar a seres humanos), hacen pensar en la importancia sanitaria y de transmisión del tifus murino a seres humanos de este nuevo ciclo biológico de R. typhi recientemente descrito: gato/animales peridomésticos-pulga del gato-gato/animales peridomésticos44. En nuestra área34, en el 81% de los casos de tifus murino no se identificó la fuente de transmisión y, por otro lado, también se han observado elevadas tasas de seroprevalencia de infección por R. typhi en múridos y animales domésticos y peridomésticos (perros y gatos)45; por lo tanto, la importancia de éste u otros posibles ciclos biológicos de R. typhi, en los que estén involucrados otros reservorios/vectores, constituye una cuestión de gran interés.
La mayor parte de los casos de tifus murino se producen entre los meses de mayo a octubre, coincidiendo con los períodos de mayor actividad del vector transmisor; sin embargo, tan sólo entre el 3-30% de los pacientes recuerda la picadura de algún insecto en los días previos a la instauración de la enfermedad. La clínica comienza de forma inespecífica tras 7-14 días de período de incubación, siendo los síntomas más frecuentes fiebre, artromialgias, cefalea y exantema. Este se produce en el 60-70% de los casos, suele aparecer al quinto día del inicio de los síntomas y durar una media de 4 días; en general es maculopapuloso tenue, afecta al tronco y las extremidades y respeta las palmas y plantas34. Los síntomas y signos más frecuentes encontrados en el tifus murino se detallan en la tabla 3. El curso clínico en la mayoría de los casos es benigno con desaparición de la fiebre y restantes síntomas en 10-14 días; la defervescencia con tratamiento específico se produce en 2-4 días. El porcentaje de complicaciones organoespecíficas (neumonitis, hepatitis, meningoencefalitis, insuficiencia renal) no suele superar el 10%, y los casos graves (desarrollo de shock refractario, dificultad respiratoria, fracaso multiorgánico, diátesis hemorrágica por coagulopatía de consumo, o afectación neurológica grave) se producen tan sólo en torno al 2-4%; la mortalidad del tifus murino oscila entre el 0-1%34,46,47. Diferentes factores se han asociado a un curso más grave de la enfermedad, entre los que que encuentran la edad, la presencia de diferentes enfermedades hematológicas (hemoglobinopatías), alteraciones analíticas precoces como insuficiencia renal, hipoalbuminemia, hiponatremia e hipopotasemia, el inicio tardío de tratamiento eficaz y el tratamiento con cotrimoxazol34,46.
Las alteraciones del laboratorio más frecuentes se producen en la bioquímica hepática mostrando entre el 70-95% de los pacientes datos de hepatolisis moderada así como elevación de la gammaglutamiltranspeptidasa y la fosfatasa alcalina; sin embargo, la hepatitis y la colestasis francas son menos frecuentes. El daño microvascular (aumento de permeabilidad y fenómenos de coagulopatía de consumo) se refleja en las alteraciones hidroelectrolíticas (hipoalbuminemia, hipopotasemia, hiponatremia e hipocalcemia), y en el discreto/moderado alargamiento de tiempos de coagulación y la trombopenia que comúnmente se observan en los casos de tifus murino. Las series blanca y roja suelen permanecer sin alteraciones, si bien en torno al 20% de los pacientes desarrollan leucocitosis (con linfocitosis en su mayoría), y el otro 20% leucopenia34,46.
La técnica diagnóstica que se utiliza habitualmente por su disponibilidad y elevadas sensibilidad y especificidad es la IFI; no obstante, pueden producirse reacciones cruzadas entre especies con similitudes antigénicas17. Una cuadriplicación de títulos de IgG entre los sueros obtenidos en fase aguda y a las 2-4 semanas, o bien un título único mayor o igual que 1/512 se consideran diagnósticos. Otra técnica indirecta novedosa y más específica es el immunoblot, si bien su uso en el tifus murino está aún en fase de investigación. La clásica reacción de Weil-Felix, que utilizaba diferentes antígenos de Proteus spp. para la detección de anticuerpos, actualmente no se recomienda. Las técnicas de diagnóstico directo (visualización y cultivo), otrora prácticamente en desuso, han experimentado un significativo avance con el advenimiento de la PCR (que es capaz de detectar rickettsias en sangre, así como en otros tejidos afectados) y los procedimientos de cultivo rápido (técnica de shell-vial); probablemente en el futuro estas se constituyan en las herramientas esenciales para el diagnóstico precoz del tifus murino; actualmente sólo se encuentran disponibles en determinados laboratorios de referencia17. Por todo lo que hemos comentado, hoy en día, la herramienta más útil para el diagnóstico y tratamiento precoces lo constituye un alto índice de sospecha clínica ante cuadros clínicos compatibles; no obstante, dada la relativa inespecificidad de los síntomas, el diagnóstico diferencial es amplio e incluye otras rickettsiosis, síndrome del shock tóxico, meningococemia, fiebre tifoidea, sífilis secundaria, leptospirosis, algunas virasis exantemáticas, síndrome mononucleósico atípico, y, en el caso de los niños, la enfermedad de Kawasaki.
El tratamiento de elección del tifus murino lo constituyen las tetraciclinas, en concreto la doxiciclina en dosis de 100 mg cada 12 h durante 7-10 días; como alternativas que han mostrado eficacia in vitro, y en series cortas se pueden utilizar quinolonas a las dosis habituales34,48, y en el caso de embarazadas, debe valorarse cada caso individualmente pudiendo utilizarse el cloranfenicol. En edad pediátrica se han utilizado con éxito el cloranfenicol e incluso las tetraciclinas49. Los macrólidos (sobre todo la josamicina) han resultado activos in vitro a las concentraciones habituales alcanzadas en tejidos para otras infecciones, pero, al contrario que con otras rickettsiosis, no existe aún experiencia clínica clara que apoye su uso para el tifus murino. La profilaxis se basa en medidas de pre-exposición (campañas de desratización y desinsectación de áreas donde se han producido casos), si bien en nuestro país no es una enfermedad de declaración obligatoria.
Rickettsia felis
A pesar de que en la actualidad se considere dentro del grupo de las fiebres manchadas, nos permitimos describirla aquí por sus similitudes ecológicas con R. typhi y por producir en seres humanos un cuadro superponible al tifus murino. Fruto de investigaciones durante 5 años, Azad et al50 identificaron esta nueva especie en 1996, en gatos, zarigüeyas y sus pulgas, en áreas de California con elevada incidencia de tifus murino50. Inicialmente considerada una rickettsia del grupo de las fiebres tíficas por la similitud de sus antígenos de superficie de romp-A, romp-B y LPS, y sus características citopatológicas sobre células Vero con los de R. typhi, estudios ulteriores del gen de la citratosintasa y de la proteína de superficie de 16 kDa la han situado más cerca del grupo de las fiebres manchadas. Estudios epidemiológicos, utilizando técnicas de biología molecular, descubrieron que más del 50% de las pulgas de la especie C. felis recogidas de diferentes mamíferos, incluyendo gatos y perros, estaban infectadas por R. felis50. Se transmite al ser humano por la picadura de la pulga del gato (C. felis) infectada. El papel patogénico en seres humanos se demostró inicialmente identificando R. felis mediante técnicas de biología molecular a partir de muestras de sangre de un paciente de Los Ángeles, California, que padeció un cuadro febril agudo catalogado como tifus murino51. Posteriormente se han descrito nuevos casos aislados en humanos en Europa Occidental y Norteamérica que cursaron clínicamente de forma indistinguible al tifus murino52,53. Con respecto a nuestro país, en el sur de España se ha identificado R. felis en un porcentaje importante de C. felis capturadas de perros y gatos de la provincia de Cádiz, y muy recientemente se ha realizado un estudio de seroprevalencia en Sevilla que mostró tasas de infección pasada en población sana del 6,5%54,55. Dado lo reciente de su descripción, aún no se conocen en profundidad su incidencia y características clínicas, pero considerando su epidemiología (reservorio en gatos-perros-mamíferos peridomésticos ampliamente presentes en nuestros hogares) y su vector transmisor (C. felis pica con avidez a los humanos), presumiblemente un número que aún desconocemos de casos de FDI y también algunos de los que se diagnostican como tifus murino pueden deberse a R. felis.
Tifus exantemático epidémico
Causada por R. prowazekii, el tifus epidémico ha producido más muertes a lo largo de la historia que todas las guerras, y su incidencia puede servir como indicador de los desatinos del ser humano. Efectivamente, su epidemiología hace que los brotes se multipliquen en situaciones de hambruna, hacinamiento, falta de saneamiento e higiene y catástrofes. El único reservorio de R. prowazekii (salvo en el este de Estados Unidos donde se ha descubierto que una especie de ardilla voladora puede albergar durante largos períodos la rickettsia en un ciclo salvaje) es el ser humano. Se transmite por el piojo corporal (Pediculus humanus corporis), que se infecta al alimentarse de una persona rickettsiémica, y lo vuelve a transmitir al defecar sobre la piel material contaminado con rickettsias. Para su transmisión se requiere un estrecho contacto personal o con ropa con piojos; por ello, las situaciones que favorezcan el hacinamiento y la proliferación de piojos facilitan la aparición de brotes. El piojo infectado fallece a las 2-3 semanas por obstrucción del tubo digestivo y, al contrario que R. typhi, no transmite las rickettsias a su descendencia, lo que confiere a esta enfermedad su carácter epidémico. Por otro lado, la persona infectada mantendrá de por vida algunas rickettsias, que pueden replicarse posteriormente en situaciones concretas (inmunodepresión, inanición, etc.) desencadenando un cuadro similar al tifus exantemático, de curso más benigno denominado enfermedad de Brill-Zinsser; estas personas son las que se confieren en posibles reservorios de nuevos brotes de tifus exantemático en ulteriores situaciones y entornos predisponentes1.
Aunque pueda parecer una enfermedad del pasado, sigue vigente en brotes epidémicos a lo largo de todo el planeta donde por desgracia continúan produciéndose catástrofes humanitarias56,57, y ha cobrado especial importancia por su potencial uso como arma biológica3.
La enfermedad se suele producir en estaciones frías y comienza de forma abrupta, tras un período de incubación de una semana, con fiebre elevada mantenida, postración, cefalea y artromialgias. El exantema suele aparecer en torno al quinto día en las áreas axilares y el tronco para después extenderse a extremidades, es maculopapular confluente (raramente purpúrico) y respeta palmas y plantas. Entre las complicaciones más frecuentes se encuentran la neumonitis y las complicaciones neurológicas (meningoencefalitis y coma). La recuperación en casos no complicados se produce en torno a los 14 días, pero con tratamiento específico la defervescencia no supera las 48 h. La mortalidad descrita es muy variable, si bien en condiciones adversas puede llegar al 40%. La enfermedad de Brill-Zinsser, cuyo mecanismo patogénico se ha comentado previamente, se presenta con características similares al tifus exantemático pero su curso es mucho más benigno.
El diagnóstico se realiza mediante técnicas indirectas. La más utilizada, por su buena sensibilidad y especificidad, es la IFI. Al igual que para otras rickettsiosis, el diagnóstico directo mediante detección de rickettsias por PCR o técnicas de cultivo rápido constituirá en el futuro una alternativa a las técnicas indirectas.
El tratamiento de elección del tifus exantemático es la doxiciclina (100 mg/12 h) o la tetraciclina (25 mg/kg/día dividido en cuatro dosis), que deben mantenerse al menos hasta 3 días después de desaparecer los síntomas. Como alternativa se puede utilizar el cloranfenicol (50 mg/kg/día dividido en cuatro dosis). La prevención del tifus exantemático se basa en evitar la proliferación del piojo corporal ante situaciones predisponentes; para ello se suelen utilizar diferentes insecticidas como el lindane. También se encuentra disponible una vacuna con rickettsias inactivadas que está indicada sólo en grupos de especial riesgo. En nuestro país es una enfermedad de declaración obligatoria.
Tifus de las malezas
Está producido por Orientia tsutsugamushi a la que previamente se denominaba R. tsutsugamushi. Es endémico en toda Asia del Este, y regiones adyacentes del Pacífico, donde constituye un problema de salud pública, estimándose el número de casos anuales en un millón, y el número de personas en riesgo de mil millones58. Asimismo con el aumento del número de viajeros internacionales a estas áreas, hemos asistido a un aumento en el número de casos importados. El vector y probablemente el mayor reservorio lo constituyen las poblaciones de diferentes especies de ácaros (principalmente Leptotrombidium deliense) que habitan en áreas de transición entre selvas y claros y que transmiten la infección por vía transovárica a toda su descendencia, perpetuando de este modo el ciclo de O. tsutsugamushi. Su ciclo incluye también diferentes especies de múridos que se infectan al ser picados por los ácaros, mientras que el ser humano constituye tan sólo un huésped accidental. La infección comienza en la zona de la picadura con una pápula que se convierte en escara desarrollándose adenopatías regionales que posteriormente se generalizan en el 50% de los casos; tras esta fase (10-12 días entre el período de incubación y los síntomas locales) comienza el período rickettsiémico de forma abrupta con fiebre elevada, cefalea y artromialgias; también son frecuentes la inyección conjuntival, el dolor retroocular y la tos seca. El exantema suele aparecer en torno al quinto día de la enfermedad afectando a tronco y raíz de miembros, y es de características maculopapulares. La gravedad del cuadro varía según las características del huésped y la virulencia de la cepa; las complicaciones son similares a las comentadas para el tifus murino, oscilando la mortalidad en distintas series entre el 0 y el 30%59,60. El diagnóstico se confirma mediante estudios indirectos siendo la técnica más utilizada la IFI; se están evaluando otras técnicas de diagnóstico indirecto (análisis de inmunoabsorción ligado a enzimas [ELISA] e immunoblot) y directo (PCR)61. Los antibacterianos clásicamente utilizados en el tratamiento son tetraciclina, doxicilina o cloranfenicol durante 3-7 días, si bien existe evidencia de la equivalencia del uso de monodosis de 200 mg de doxiciclina. Asimismo, en un ensayo clínico reciente, se ha evaluado azitromicina, que mostró una eficacia similar a la de 7 días de tratamiento con doxiciclina62.