El principal objetivo que debemos perseguir en una mujer gestante con infección por el VIH es la prevención de la transmisión vertical (TV); por ello, es fundamental realizar tratamiento antirretroviral (TAR) en todas ellas, independientemente del número de linfocitos CD4 que tengan. Es obligatorio ofrecer a toda embarazada la información adecuada y la realización de la serología frente al virus de la inmunodeficiencia humana (VIH) en la primera visita.
MétodosSe reunió a un panel de expertos designados por la Secretaría del Plan Nacional sobre el Sida (SPNS) y las diferentes sociedades científicas participantes, que incluyó médicos especialistas en medicina interna con experiencia en el ámbito del VIH, ginecólogos/as y pediatras y psicólogos, actuando 4miembros del panel como coordinadores. Se revisó información científica hasta noviembre de 2012. Como apoyo a las recomendaciones se utilizaron 2niveles de evidencia: la fuerza de la recomendación según opinión del experto (A, B, C) y el nivel de evidencia empírica (I, II, III), ambos niveles basados en los criterios de la Infectious Disease Society of America, ya utilizada en documentos previos de la SPNS.
Resultados y conclusionesEste documento pretende revisar los conocimientos científicos actuales y, en función de ello, elaborar una serie de recomendaciones con respecto al TAR, tanto desde el punto de vista de la salud individual de la madre como con el objetivo de minimizar en lo posible el riesgo de TV, atendiendo, además, a otros cuidados de salud de la embarazada con infección por el VIH. Se discuten y evalúan, asimismo, otras estrategias capaces de reducir la TV (cesárea programada, tratamiento del niño…) y distintos aspectos relacionados con el tema (pautas de TAR, toxicidad del mismo, controles durante la gestación y puerperio, etc.).
The main objective in the management of HIV-infected pregnant women is prevention of mother-to-child transmission; therefore, it is essential to provide universal antiretroviral treatment, regardless of CD4 count. All pregnant women must receive adequate information and undergo HIV serology testing at the first visit.
MethodsWe assembled a panel of experts appointed by the Secretariat of the National AIDS Plan (SPNS) and the other participating Scientific Societies, which included internal medicine physicians with expertise in the field of HIV infection, gynecologists, pediatricians and psychologists. Four panel members acted as coordinators. Scientific information was reviewed in publications and conference reports up to November 2012. In keeping with the criteria of the Infectious Diseases Society of America, 2levels of evidence were applied to support the proposed recommendations: the strength of the recommendation according to expert opinion (A, B, C), and the level of empirical evidence (I, II, III). This approach has already been used in previous documents from SPNS.
Results and conclusionsThe aim of this paper was to review current scientific knowledge, and, accordingly, develop a set of recommendations regarding antiretroviral therapy (ART), regarding the health of the mother, and from the perspective of minimizing mother-to-child transmission (MTCT), also taking into account the rest of the health care of pregnant women with HIV infection. We also discuss and evaluate other strategies to reduce the MTCT (elective Cesarean, child's treatment…), and different aspects of the topic (ARV regimens, their toxicity, monitoring during pregnancy and postpartum, etc.).
La infección por el virus de la inmunodeficiencia humana (VIH) tiene una gran repercusión sobre la reproducción: desde el momento de la concepción por el riesgo de transmisión sexual, hasta la posible infección del niño y su necesidad de tratamiento antirretroviral (TAR). Una correcta identificación de la mujer infectada puede evitar la transmisión materno-fetal (TMF), y por ello, deben dedicarse los mayores esfuerzos a asesorar a las mujeres con deseo de concepción, protegerlas durante el embarazo y, de esta manera, evitar que nazcan niños infectados por el VIH.
En el momento actual disponemos de conocimientos suficientes sobre los mecanismos que influyen en la transmisión vertical (TV) y disponemos de datos sobre la eficacia de diferentes estrategias dirigidas a evitarla. Así, si identificamos precozmente la infección en la embarazada, podemos prevenir casi en su totalidad la transmisión de la madre al niño, siempre que aseguremos la información adecuada y el acceso al control obstétrico y al tratamiento.
El problema presenta, pues, 2vertientes muy diferentes: por un lado, en países con acceso al TAR y con alta cobertura del control prenatal, el éxito del TAR y las noticias difundidas por los medios de comunicación sobre los diferentes métodos (TAR, cesárea…) para disminuir la TV han reavivado el interés por la procreación entre las personas con VIH, tanto en parejas en las que ambos miembros están infectados como en parejas serodiscordantes, y en ellas se deben aplicar todos los conocimientos disponibles para minimizar el riesgo de transmisión. Por otro lado, es imprescindible desarrollar estrategias para disminuir el riesgo de TV en el mundo subdesarrollado.
Estas recomendaciones, dirigidas a todos los profesionales que atienden a las mujeres embarazadas y a sus recién nacidos, persiguen fundamentalmente 4objetivos:
- 1.
Evitar que la mujer llegue al parto sin conocer su condición de infectada por el VIH. Para ello, es imprescindible recomendar la realización de serología frente al VIH a toda embarazada en el primer trimestre (idealmente antes de quedarse embarazada), debiendo repetirse en el tercer trimestre, con el fin de identificar las seroconversiones producidas durante el embarazo. Si la mujer llegara al parto sin que se haya determinado su seroestado VIH, es necesario realizar un test rápido de manera urgente para determinar la necesidad de llevar a cabo las oportunas intervenciones terapéuticas, entre ellas una cesárea programada, ya que puede disminuir la TV en un 50%.
- 2.
Revisar y evaluar los conocimientos actuales, y, en función de ello, elaborar una serie de recomendaciones con respecto al TAR, tanto desde el punto de vista de la salud individual de la madre como con el objetivo de minimizar en lo posible el riesgo de TV, atendiendo, además, a otros cuidados de salud de la embarazada con infección por el VIH. Se discuten y evalúan, asimismo, otras estrategias capaces de reducir la TV (cesárea programada, tratamiento del niño…).
- 3.
Elaborar una serie de recomendaciones para el adecuado seguimiento del niño expuesto, tanto al VIH como a los fármacos antirretrovirales (FARV).
- 4.
Evaluar las diferentes opciones existentes para la procreación. Dados los favorables cambios en el pronóstico de la infección por el VIH, y el deseo reproductivo de muchas parejas, es preciso evaluar las diferentes opciones para la procreación, desde la perspectiva de prevención de la infección si ambos están infectados o de la transmisión en parejas serodiscordantes.
En el documento se insiste en la necesidad de una aproximación multidisciplinar a la paciente que debe incluir, al menos, al ginecólogo, al infectólogo, al pediatra y a la matrona, y con relativa frecuencia se ha de incorporar, además, a profesionales de atención primaria, psicólogos, psiquiatras y recursos sociales. Por otro lado, con el objetivo ideal de alcanzar la transmisión «cero» del VIH a los niños, es fundamental que los cuidadores principales (al menos el infectólogo, el ginecólogo y el pediatra) tengan experiencia en el manejo de estas situaciones.
MetodologíaPara la elaboración de este documento se constituyó un grupo de expertos/as designados por la Secretaría del Plan Nacional sobre el Sida (SPNS), la Junta Directiva del Grupo de Estudio de Sida (GeSIDA), la Sociedad Española de Ginecología y Obstetricia (SEGO) y la Sociedad Española de Infectología Pediátrica (SEIP), siendo el papel de las 4instituciones de coordinación.
Este grupo está compuesto por especialistas de medicina interna, ginecología y obstetricia y pediatría con experiencia en el ámbito del VIH y 4miembros del panel que actúan como coordinadores. Cada miembro del panel ha emitido un informe de conflicto de intereses depositado en la SPNS y todos ellos han aceptado participar de forma voluntaria y altruista.
Cada redactor/a realiza una revisión de la evidencia científica (última revisión, enero de 2013) disponible de cada uno de los aspectos que se incluyen en el documento, y con ella escribe su capítulo, que es discutido y revisado por el revisor asignado. Una vez compilado el documento, se remite a todos los miembros del Panel para su discusión. Posteriormente se realiza una reunión de consenso de todo el panel y se somete a la revisión externa, exponiéndose durante un periodo de tiempo en la web de las entidades promotoras para que los y las profesionales a los que va dirigido y cualquier persona interesada pueda incorporar matices o cambios, decidiendo el Panel a posteriori su inclusión o no.
La clasificación de la fuerza y la calidad de las recomendaciones se han realizado aplicando el sistema utilizado por la Sociedad Americana de Enfermedades Infecciosas (IDSA) y el Servicio de Salud Pública de Estados Unidos.
Fuerza de la recomendaciónNivel A. Buen nivel de evidencia para apoyar la recomendación de uso.
Nivel B. Moderado nivel de evidencia para apoyar la recomendación de uso.
Nivel C. Escasa evidencia para apoyar la recomendación.
I. Evidencia procedente de al menos un ensayo clínico aleatorizado.
II. Evidencia procedente de al menos un ensayo no aleatorizado, bien diseñado, o bien de estudios de cohortes o analíticos de casos y controles (preferiblemente de más de un centro), o de series temporales, o de resultados concluyentes obtenidos en estudios experimentales no controlados.
III. Evidencia de opiniones de expertos/as, basadas en la experiencia clínica o en estudios descriptivos.
Para la realización de los capítulos se ha realizado una búsqueda bibliográfica en las siguientes bases de datos: Medline, Pubmed, UpToDate y MD Consult, incluyendo artículos desde el año 2000 a 2012.
Los descriptores (en inglés y español) que se han utilizado para las búsquedas relacionadas con los diferentes capítulos son: VIH-1, sida, embarazo, parto, reproducción asistida, anticoncepción, test rápido, TV, salud reproductiva, prevención, TAR, cesárea, carga viral y parto, FARV, lactancia, fórmulas lácteas adaptadas.
Asimismo, se han revisado las conclusiones de los principales congresos relacionados con el VIH y se han localizado monografías y/o libros que trataran sobre el tema. También se han utilizado buscadores generalistas (Google y Yahoo!), tanto en español como en inglés.
Los idiomas en los que se seleccionaron los artículos fueron el inglés y el español, y las referencias utilizadas para la elaboración de estas recomendaciones incluyen revisiones sistemáticas, guías clínicas, ensayos clínicos, guías de práctica clínica, estudios de investigación cuantitativa, así como libros escritos por personas expertas sobre los temas elaborados.
Está prevista la actualización del presente documento con carácter periódico siendo cada uno de los autores responsable de realizar su capítulo.
Recomendaciones previas al embarazo. Consejo preconcepcional. Planificación familiar y reproducción asistidaConsejo preconcepcionalLa mejoría en el control de la infección y la eficacia de las terapias antirretrovirales (ARV) han cambiado las expectativas de vida del paciente infectado por el VIH, y ello ha conllevado un incremento del número de parejas que desean tener descendencia. El objetivo del consejo preconcepcional en la mujer infectada por el VIH es intentar planificar la gestación en la mejor situación clínica posible, minimizando los riesgos para la mujer, la pareja y el feto. El consejo preconcepcional debe incluir los siguientes puntos1:
- -
Contracepción efectiva mientras se obtiene un estado óptimo para la gestación (control virológico e inmunológico, buen seguimiento clínico y un buen cumplimiento del tratamiento). Debe evitarse la gestación no planificada, que puede llegar a representar el 50% de las gestaciones en el mundo desarrollado.
- -
Consejo sobre hábitos saludables, evitando el uso de tóxicos, incluyendo la actualización de vacunas.
- -
Optimizar el control clínico. Evaluación del estadio clínico, inmunológico, carga viral (CV), TAR y adherencia al mismo. La paciente debe recibir el TAR según las recomendaciones para el tratamiento del adulto infectado, con pautas que tengan en cuenta la experiencia de su uso durante la gestación y su potencial teratogenicidad, excluyendo los fármacos de uso restringido durante el embarazo, como el efavirenz. Se realizará también la valoración y el ajuste de tratamientos para profilaxis de infecciones oportunistas.
- -
Informar del riesgo de transmisión vertical, estrategias de prevención, potenciales efectos adversos de la medicación durante el embarazo sobre la madre y el feto y sobre los riesgos de complicaciones obstétricas.
- -
Prevenir la transmisión sexual mediante el uso del preservativo, si los miembros de la pareja son serodiscordantes para el VIH o tienen un patrón virológico diferente.
- -
Información y consejo especializado sobre las diferentes opciones reproductivas para conseguir una gestación con el mínimo riesgo de transmisión horizontal al miembro no infectado de la pareja.
- -
Valoración básica de la fertilidad. En caso de historia sugestiva o ausencia de antecedentes genésicos previos puede ser aconsejable realizar un estudio básico de fertilidad. Varios estudios epidemiológicos sugieren que las pacientes infectadas tendrían una fertilidad disminuida2.
Un menor número de linfocitosT CD4 se ha relacionado con una menor incidencia de gestación espontánea en un estudio realizado en 473mujeres en Costa de Marfil3. La infección por el VIH se ha asociado con disfunción ovárica4, mayor prevalencia de infecciones del tracto genital superior y de obstrucción tubárica5,6. Parece existir también un factor ovocitario secundario a toxicidad del TAR7 y que puede justificar las menores tasas de gestación descritas cuando se realiza una fecundación in vitro (FIV)8. Recientemente se ha descrito una reducción significativa de ADN mitocondrial en ovocitos de mujeres infértiles en TAR9.
La infección por el VIH y/o el TAR se asocian también a alteraciones seminales en el hombre infectado2,10,11. Se recomienda la realización de un seminograma, sobre todo en casos sin antecedentes genésicos previos.
Un estudio de cohortes recientemente publicado muestra un mayor tiempo de infertilidad en parejas con algún miembro infectado por el VIH que acceden a técnicas de reproducción asistida12. El proyecto reproductivo no debería ser innecesariamente retrasado en las personas con infección estable por el VIH, por lo que la valoración de la fertilidad debería ser un parámetro a tener en cuenta.
Particularidades de las técnicas de reproducción asistida en personas con el virus de la inmunodeficiencia humanaEl acceso de las personas infectadas por el VIH a técnicas de reproducción asistida puede deberse a 2motivos principales: como tratamiento de infertilidad, o bien para evitar la transmisión horizontal en el caso de parejas serodiscordantes.
Anteriormente la infección por el VIH se consideraba una contraindicación formal y éticamente inaceptable. Actualmente ya no hay discusión ética, y la mayor parte de sociedades médicas reconocen el derecho de acceso de las personas infectadas por el VIH a técnicas de reproducción asistida13,14.
Por otra parte, los laboratorios de reproducción asistida deben disponer de las instalaciones adecuadas para trabajar con muestras contaminadas sin riesgo para los demás pacientes. El personal sanitario debe estar específicamente entrenado para el manejo de este tipo de muestras (ovocitos, espermatozoides o embriones), que deben ser tratadas como potencialmente infectadas. Se debe disponer de tanques de congelación independientes para los embriones supernumerarios y la técnica de sellado debe ser lo más cuidadosa posible. Los equipos implicados en el manejo clínico deben ser conocedores de la patología infecciosa y trabajar conjuntamente con los infectólogos.
En cuanto a las opciones reproductivas, debemos diferenciar las parejas con infección por el VIH según si el miembro infectado es el hombre, si es la mujer o si son los dos. Cuando solo un miembro de la pareja está infectado, se estima que la tasa de transmisión del VIH es de 1 de cada 500 a 1.000 relaciones sexuales desprotegidas15. Esta tasa aumenta exponencialmente cuando la CV de la persona infectada es elevada, o bien cuando existen úlceras, inflamaciones o abrasiones genitales en el miembro de la pareja no infectado. El riesgo de transmisión sexual es mucho menor en pacientes en TAR combinado con CV indetectable16 y en parejas en las que el miembro infectado recibe TAR, como demostró el estudio HTPN052, en el que la administración de TAR al miembro de la pareja infectado redujo la transmisión horizontal (27seroconversiones en 877parejas en las que se retrasó el TAR hasta que la cifra de CD4+ era inferior a 250células/mm, frente a una seroconversión en 886parejas en las que se inició el TAR de inmediato)17.
Hombre infectado por el virus de la inmunodeficiencia humanaLavado seminal con técnica de reproducción asistida asociada. El VIH no se ha detectado directamente en los espermatozoides, pero sí en el plasma seminal y en los linfocitos y macrófagos del semen. En 1992, Semprini et al.18 describieron una técnica de lavado seminal basada en gradientes de densidad seguidos de un proceso de swim-up. De esta forma se consigue aislar los espermatozoides del resto de componentes seminales. En esta muestra purificada se realizan técnicas de PCR para comprobar la negatividad al VIH (tanto ADN como ARN). Si las muestras ya purificadas resultan positivas para el VIH (<1%), son rechazadas. Posteriormente se realiza con la muestra lavada una inseminación intrauterina (IIU) o bien una fecundación in vitro con o sin microinyección espermática (FIV-ICSI). Aunque se basan en estudios observacionales, las técnicas de lavado espermático parecen seguras y efectivas, con más de 4.000ciclos publicados en la literatura sin que se haya descrito ningún caso de seroconversión materna ni neonatal19,20. Las tasas de embarazo conseguidas en parejas serodiscordantes mediante IIU o FIV-ICSI (15-30 y 45-50% por ciclo, respectivamente) son superponibles a las que se obtienen en parejas estériles que se someten a las mismas técnicas21.
Antes de aplicar las técnicas de reproducción asistida se considerarán los siguientes requisitos:
- •
Infección por el VIH estable, con o sin TAR. No existen niveles de CV o CD4 limitantes, pero debe considerarse como objetivo que la infección esté estabilizada. Se solicitará un informe infectológico completo que incluya: Estado inmunovirológico del paciente, estabilidad clínica y pronóstico de la infección, TAR actual, antecedentes de infecciones oportunistas u otras complicaciones asociadas al VIH, otros tratamientos concomitantes (metadona, tratamientos frente a VHC).
- •
No contraindicación para el tratamiento reproductivo por otras causas (por ejemplo, por uso de ribavirina en los últimos 6meses).
- •
Realizar un estudio básico de fertilidad a ambos miembros de la pareja a fin detectar la existencia de otros problemas e indicar la técnica más adecuada (tabla 1).
Tabla 1.Estudio previo a la aplicación de técnica de reproducción asistida asociada a lavado seminal
Hombre Analítica general con serologías (VHC, VHB y lúes) CV y poblaciones linfocitarias Seminograma basal y pruebas de funcionalismo espermático Cultivos uretrales (gonococo, Chlamydia, herpes) Mujer Analítica general con serologías (VHC, VHB y lúes) Perfil hormonal basal (FSH, LH, estradiol en el tercer día del ciclo) Cultivos endocervicales (gonococo, Chlamydia, herpes) Citología cervicovaginal actualizada Histerosalpingografía Ecografía transvaginal Ver listado de abreviaturas en el anexo 3.
- •
Consentimiento informado específico firmado por ambos miembros de la pareja, detallándose los riesgos de la técnica a realizar y el concepto de reducción (no de eliminación) del riesgo de infección por el VIH.
La elección de la técnica de IIU o FIV-ICSI se realizará según la valoración global de la pareja (edad, antecedentes patológicos, resultados de los exámenes de fertilidad) y se recomienda asociar inducción de la ovulación para optimizar el rendimiento de las técnicas. Durante el ciclo de reproducción asistida, a la mujer se le realizará una determinación de Ac-VIH y una CV para el VIH, repitiéndose esta a los 15días de la IIU o FIV para descartar una infección secundaria al procedimiento. Se intentará que la PCR de la muestra seminal y la IIU o la FIV sean realizadas el mismo día de la obtención de la muestra. En caso de no ser posible, se hará de forma diferida y se usará la muestra congelada, sabiendo que los resultados reproductivos pueden ser inferiores.
Aunque probablemente no existe el riesgo cero de transmisión sexual, las técnicas de reproducción asistida con lavado seminal se consideran hoy en día la forma de concepción más segura cuando el miembro infectado es el hombre13,14. Por tanto, deben considerarse como el método de elección en nuestro medio.
Concepción naturalEl riesgo de transmisión heterosexual cuando el hombre está en TAR combinado y mantiene cargas virales plasmáticas indetectables es muy bajo22. En un metaanálisis reciente, el riesgo de transmisión se calcula en una de cada 79 personas-año en personas tratadas con CV inferior a 400copias/ml23. En este contexto, algunos autores proponen permitir relaciones sexuales desprotegidas durante los días fértiles en las parejas que cumplen los siguientes requisitos: miembro infectado en TAR con buen cumplimiento, CV indetectable durante más de 6meses, ausencia de otras enfermedades de transmisión sexual y estudio previo de fertilidad normal24,25.
Sin embargo, es conocida la discordancia entre la CV en plasma y en semen26. Hasta el 10% de hombres con CV plasmática (CVP) indetectable pueden tener virus en semen27,28, por lo que debe considerarse el riesgo residual de transmisión sexual aun con CV indetectable. Asimismo, los fracasos terapéuticos, los blips de CV y la presencia de infecciones intercurrentes deberían tenerse en consideración16.
Por todo ello, la concepción natural no debe considerarse por el momento como primera opción reproductiva a recomendar en nuestro medio, en el que hay acceso a técnicas de reproducción asistida para parejas serodiscordantes, si bien es cierto que algunas parejas optarán por la concepción natural, dadas las dificultades en el acceso a aquellas. En el caso de que la pareja decida proseguir con la concepción natural, sabiendo que no se puede garantizar la ausencia de transmisión, deberán seguir las siguientes recomendaciones:
- •
Miembro infectado en TAR combinado con buen cumplimiento y CV indetectable durante más de 6meses.
- •
Realizar cultivos uretrales en el hombre y endocervicales en la mujer para descartar infecciones de transmisión sexual asociadas.
- •
Realizar estudio previo de fertilidad (tabla 1).
- •
Restringir las relaciones sexuales no protegidas a los períodos potencialmente más fértiles, que se pueden establecer mediante un test de ovulación.
- •
No prolongar las relaciones no protegidas durante más de 12meses.
El uso periconcepcional de tenofovir o tenofovir+emtricitabina en personas no infectadas para prevenir la transmisión sexual está actualmente en estudio. Vernazza et al.29 han publicado recientemente el uso de tenofovir vía oral 36 y 12h antes de relaciones sexuales dirigidas en 53parejas, sin documentar ningún caso de seroconversión. Otros estudios proponen una dosis oral diaria hasta 28días después de la última exposición de riesgo30,31. El uso de gel vaginal de tenofovir parece disminuir también la transmisión sexual. Aun así, existen múltiples dudas todavía sobre su eficacia, seguridad, adherencia al tratamiento o riesgo de aparición de resistencias en caso de seroconversión32,33. Por tanto, será necesario esperar a los resultados de los estudios que se encuentran actualmente en curso, y por el momento no es una opción que haya sido validada, aunque muy recientemente la FDA ha elaborado una guía provisional sobre el uso de la profilaxis preexposición en parejas heterosexuales en la que se expone que la PrEP con TDF/FTC puede ser de utilidad en las parejas serodiscordantes que desean concebir34.
Mujer infectada por el virus de la inmunodeficiencia humanaLas mujeres infectadas por el VIH que desean quedarse embarazadas no deben realizar de forma sistemática técnicas de reproducción asistida. La transmisión al hombre no infectado cuando la pareja busca embarazo puede evitarse de forma sencilla con autoinseminaciones vaginales14. Consisten en inyectar en la vagina (por parte de la propia mujer o su pareja) el semen que se obtiene del preservativo (sin espermicida) con una jeringa (sin aguja), después de tener relaciones sexuales protegidas durante la fase fértil del ciclo.
Dada la sencillez de la técnica de las autoinseminaciones, no está justificada en este caso la concepción natural.
Debido a la subfertilidad descrita anteriormente en las mujeres infectadas por el VIH, es recomendable realizar previamente un estudio básico de fertilidad. En caso de infertilidad o después de la aplicación sin éxito de autoinseminaciones durante aproximadamente un año, se orientará la pareja hacia la técnica de reproducción asistida más adecuada.
En cuanto a la reproducción asistida, en mujeres con infección por el VIH deben tenerse en cuenta los siguientes aspectos:
- •
Revaloración de todos los aspectos mencionados en el consejo preconcepcional en cuanto a estabilidad de la infección por el VIH e información sobre riesgos de la gestación y de TV.
- •
Se indicará la técnica de reproducción asistida más adecuada, con las pautas de estimulación que se consideren oportunas independientemente de la infección por el VIH (IIU, fecundación in vitro, donación de ovocitos).
- •
Informar sobre la posibilidad de que los resultados obtenidos sean inferiores a lo esperado14. Los protocolos de estimulación deben considerar la posible resistencia ovárica8. Idealmente, debería transferirse un solo embrión para minimizar el riesgo de gestación múltiple. Sin embargo, en estas pacientes son esperables resultados reproductivos inferiores, por lo que se aconseja una política menos restrictiva. En el caso de no obtener una gestación, se intentará mejorar la situación inmunológica o se valorará la posibilidad de una donación de ovocitos.
- •
El laboratorio de reproducción asistida deberá realizar todos los procesos en condiciones que eviten la contaminación de otras muestras biológicas.
- •
Consentimiento informado específico firmado por ambos miembros de la pareja, detallándose los riesgos de la técnica a realizar.
Cuando ambos miembros de la pareja están infectados por el VIH, en general se puede plantear la concepción natural con relaciones desprotegidas. En caso de que el curso de la infección o el patrón de resistencias del VIH sean muy distintos entre ellos, podrían plantearse técnicas de lavado seminal o de autoinseminaciones para evitar la superinfección por el VIH del otro miembro de la pareja. La valoración de la fertilidad debe también tenerse en cuenta en estas parejas para no retrasar de forma innecesaria su proyecto reproductivo12.
Planificación familiarLa mayoría de métodos anticonceptivos pueden ser usados en caso de infección por el VIH, pero deben recomendarse medidas de planificación familiar que aseguren una protección dual, tanto para evitar gestaciones no deseadas como la transmisión del VIH u otras infecciones de transmisión sexual35,36.
Métodos de barrera- •
Preservativo masculino. Su eficacia protectora frente al embarazo y las infecciones de transmisión sexual como el VIH está sobradamente demostrada cuando se usa de forma correcta y consistente36,37. A pesar de ser el método más usado entre las personas infectadas por el VIH, su uso regular disminuye en relaciones estables, y más aún cuando se utiliza en combinación con otro método anticonceptivo.
- •
Preservativo femenino. Se considera un método tan seguro como el preservativo masculino en la prevención de embarazo y de infecciones de transmisión sexual36. Se requiere información previa para su uso, y por el momento su aceptación no es tan generalizada como el preservativo masculino.
- •
Diafragma. No se recomienda su uso por su menor eficacia respecto otros anticonceptivos y por su falta de protección frente al VIH y otras infecciones de transmisión sexual.
No debe utilizarse, ya que no ofrece protección contra la infección del VIH y su uso puede incrementar el riesgo de transmisión del virus debido a la disrupción epitelial de la mucosa vaginal que ocasionan37.
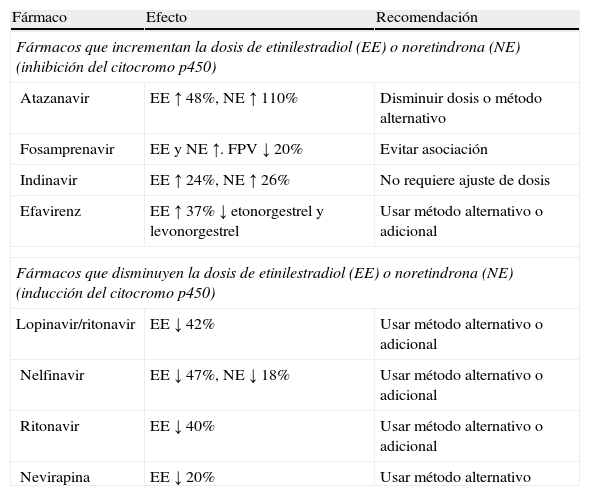
Anticoncepción hormonalTodos los sistemas de anticoncepción hormonal de estroprogestágenos o gestágenos (comprimidos orales, inyectables, implantes, parches o anillo vaginal) pueden ser usados en mujeres infectadas por el VIH38, pero no protegen frente a otras infecciones de transmisión sexual ni frente a la transmisión del VIH. Asimismo, deben tenerse en cuenta las interacciones con los FARV que pueden alterar la seguridad y la eficacia tanto de los anticonceptivos como de los ARV (tabla 2). Por todo ello, se recomienda asociar siempre un método barrera. Asimismo, se recomienda consultar información actualizada sobre interacciones con los FARV y posibles ajustes de dosis en las siguientes webs: <www.hiv-druginteractions.org>; <www.hivinsite.ucsf.edu>, y <http://reference.medscape.com/drug-interactionchecker>.
Interacciones entre fármacos antirretrovirales y anticonceptivos hormonales
| Fármaco | Efecto | Recomendación |
| Fármacos que incrementan la dosis de etinilestradiol (EE) o noretindrona (NE) (inhibición del citocromo p450) | ||
| Atazanavir | EE ↑ 48%, NE ↑ 110% | Disminuir dosis o método alternativo |
| Fosamprenavir | EE y NE ↑. FPV ↓ 20% | Evitar asociación |
| Indinavir | EE ↑ 24%, NE ↑ 26% | No requiere ajuste de dosis |
| Efavirenz | EE ↑ 37% ↓ etonorgestrel y levonorgestrel | Usar método alternativo o adicional |
| Fármacos que disminuyen la dosis de etinilestradiol (EE) o noretindrona (NE) (inducción del citocromo p450) | ||
| Lopinavir/ritonavir | EE ↓ 42% | Usar método alternativo o adicional |
| Nelfinavir | EE ↓ 47%, NE ↓ 18% | Usar método alternativo o adicional |
| Ritonavir | EE ↓ 40% | Usar método alternativo o adicional |
| Nevirapina | EE ↓ 20% | Usar método alternativo |
Ver listado de abreviaturas en el anexo 3.
El uso de anticoncepción hormonal no se asocia a mayor riesgo de progresión del VIH en términos de mortalidad, disminución de CD4+ por debajo de 200, iniciación de TAR o aumento de la CV39. Aun así, un estudio aleatorizado realizado en Zambia mostró un mayor descenso de niveles de CD4 y mayor riesgo de muerte entre usuarias de anticonceptivos hormonales40,41, si bien este estudio presenta fallos metodológicos (pérdidas en el seguimiento, cambios de método anticonceptivo, etc.) que hacen que sus resultados sean cuestionables.
- •
Anticoncepción de emergencia (píldora poscoital). Consiste en la administración de 1,5mg de levonorgestrel (dosis única) lo antes posible y en un plazo máximo de 72h después de una relación no protegida. No debe considerarse un método anticonceptivo en sí mismo, y únicamente se ha de utilizar en caso de fallo de otro método, como la rotura o deslizamiento del preservativo. Algunos autores recomiendan doblar la dosis de levonorgestrel en caso de usar TAR inductor enzimático o en pacientes que reciben efavirenz, o bien usar un DIU de cobre como método de anticoncepción de emergencia. Sin embargo, no hay estudios disponibles que avalen dichas recomendaciones25,42.
Los dispositivos intrauterinos (DIU) de cobre u hormonales pueden ser usados en caso de infección por el VIH, excepto en mujeres con diagnóstico de sida sin TAR, según las recomendaciones de la OMS38. Las ventajas de este método anticonceptivo se derivan de su comodidad, efectividad (cuya tasa de fallos oscila entre el 0,1 y el 0,6)25, larga duración (5años) y bajo coste. El DIU-levonorgestrel se asocia a menor volumen de menstruación o incluso a amenorrea. Estudios recientes no muestran un mayor riesgo de complicaciones infecciosas respecto a mujeres no infectadas, y tampoco parece existir un mayor riesgo de transmisión del VIH, siempre que se use preservativo43.
Esterilización masculina o femeninaSe trata de métodos seguros (la tasa de gestaciones en el 1.er año es de 0,1 para la vasectomía y de 0,5 para la ligadura de trompas) pero permanentes, por lo que los pacientes deben ser informados de los métodos alternativos reversibles existentes. Ninguno de ellos protege de la transmisión del VIH, por lo que debe recomendarse el uso de preservativo, especialmente en parejas serodiscordantes.
Interrupción de la gestaciónCon las medidas de prevención de TV existentes, el riesgo de transmisión al recién nacido es muy bajo y la mera infección materna por el VIH no es un motivo que justifique la interrupción de la gestación. La gestación no empeora la progresión de la enfermedad. Por tanto, toda gestante infectada por el VIH debe ser informada cuidadosamente de los riesgos y medidas preventivas adecuadas para evitar la transmisión del virus a su hijo, de la eficacia de las mismas y del buen pronóstico, en general, del embarazo. Sin embargo, existen algunas situaciones excepcionales en las que podría considerarse la interrupción del embarazo por causas médicas relacionadas con el VIH (enfermedad materna avanzada, procesos comórbidos tales como el carcinoma de cérvix que precisara cirugía o la exposición a fármacos teratógenos o con escasa experiencia de uso en el embarazo) o no.
Recomendaciones
- 1.
El consejo preconcepcional debe formar parte del manejo de la mujer infectada por el VIH en edad reproductiva (A-II). En este contexto, se debe facilitar el acceso a técnicas de reproducción asistida a las personas infectadas por el VIH (A-II).
- 2.
Cuando el hombre es el único miembro de la pareja infectado por el VIH, la opción de reproducción más segura, en el momento actual, para evitar la infección a la pareja son las técnicas de lavado seminal (A-II).
- 3.
Cuando la mujer es el único miembro de la pareja infectado por el VIH, las autoinseminaciones son un método sencillo y eficaz para obtener un embarazo (B-III).
- 4.
Se recomienda tener en cuenta, a la hora de valorar el deseo reproductivo, la disminución de la fertilidad que pueden tener las mujeres y los hombres infectados por el VIH (B-II).
- 5.
La mayoría de métodos anticonceptivos pueden ser usados en caso de infección por el VIH, aunque deben recomendarse medidas de planificación familiar que aseguren una protección dual, tanto para evitar gestaciones no deseadas como la transmisión del VIH u otras infecciones de transmisión sexual (A-II).
- 6.
Todos los sistemas de anticoncepción hormonal (comprimidos orales, inyectables, implantes, parches o anillo vaginal) pueden ser usados en mujeres infectadas por el VIH, pero deben tenerse en cuenta las interacciones con los FARV que pueden alterar su eficacia (A-III).
A fin de prevenir la TV del VIH es imprescindible que tanto las mujeres embarazadas como las que planifiquen un embarazo conozcan su posible condición de infectadas por el VIH. Por ello es obligatorio ofrecer a toda embarazada la información adecuada y la realización de la serología frente al VIH. Este primer paso es básico para poder disminuir la TV1,44. Así:
- •
La serología frente al VIH se debe indicar en la primera visita, tras ofrecerle una información adecuada al respecto, y ha de realizarse lo antes posible.
- •
Si la situación serológica con respecto al VIH es desconocida en el momento del parto, o en el posparto inmediato, se debe indicar, con carácter urgente, la realización de pruebas serológicas rápidas45.
- •
Se recomienda repetir la prueba en el tercer trimestre de gestación, puesto que la no asociación de la gestante con alguno de los factores de riesgo clásicos puede conducir a la detección de la infección tras el parto y a la TV de la misma al neonato.
- •
En mujeres con prácticas de riesgo para la infección por el VIH durante la gestación, especialmente si su pareja está infectada o tiene riesgo de estarlo, es importante educar a las pacientes en la adopción de medidas preventivas que disminuyan dicho riesgo. Además, se debe repetir la prueba al menos una vez cada trimestre. Si no es posible hacer este seguimiento, se indicará una prueba rápida antes del parto o un test viral para evitar un falso negativo de los test de anticuerpos si la paciente se encontrara en periodo ventana.
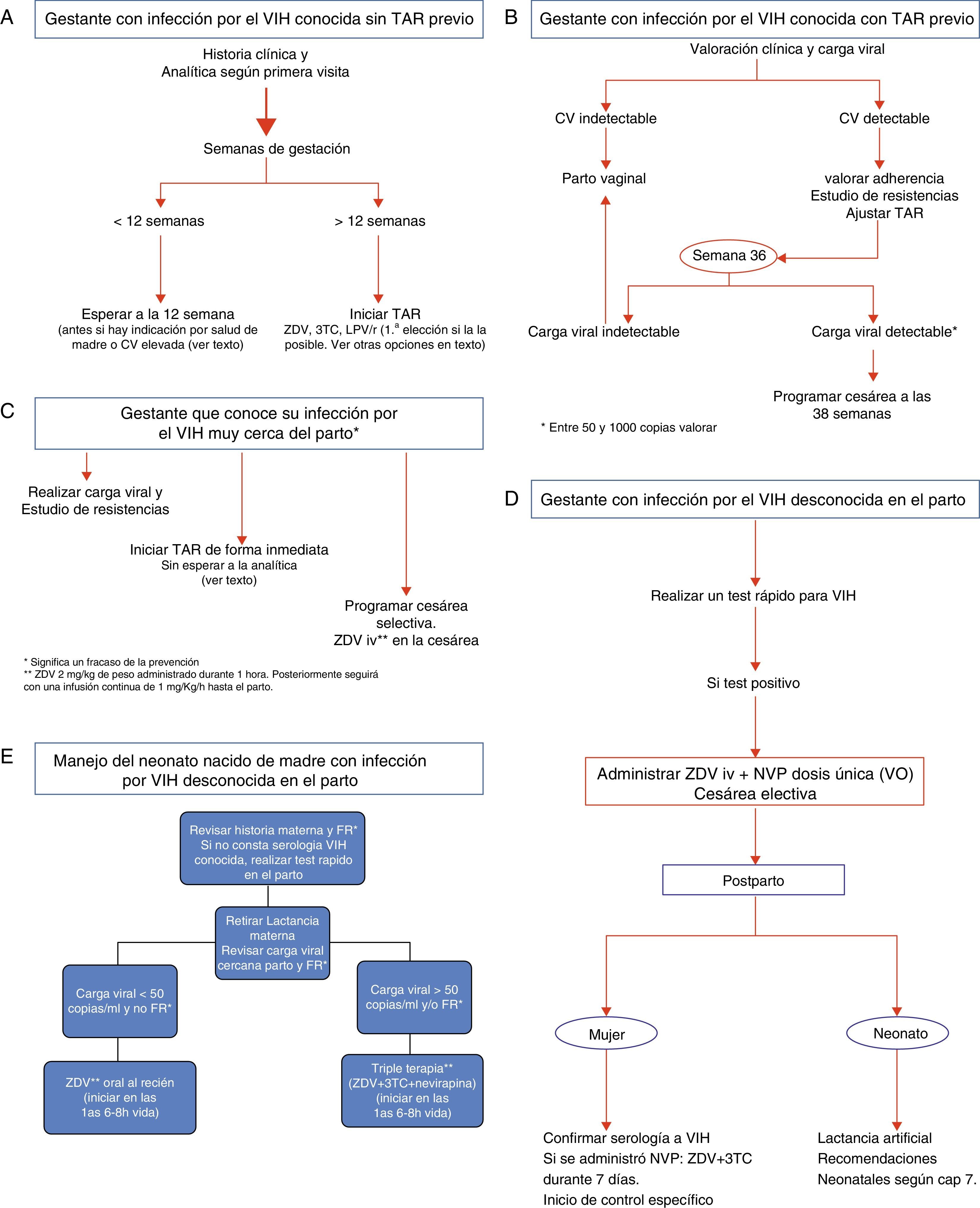
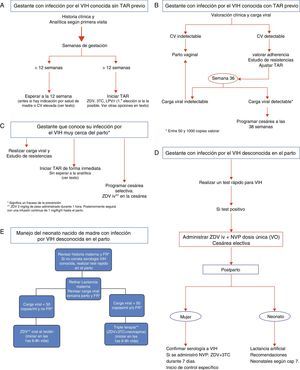
En la práctica clínica se pueden encontrar 3grupos diferentes de embarazadas con infección por el VIH: las que conocían su infección antes de la gestación, las diagnosticadas como parte del cribado al inicio del embarazo y aquellas en las que el diagnóstico se realiza en fases avanzadas del embarazo o en el periparto.
Gestante con diagnóstico de virus de la inmunodeficiencia humana previo al embarazoLa mayoría de estas pacientes conocen tanto los aspectos generales y el tratamiento de la infección por el VIH como el riesgo de transmisión a sus parejas. Sin embargo, suelen tener una información insuficiente respecto a los aspectos reproductivos y sobre las medidas para prevenir la TV.
En esta situación, es importante que el clínico pregunte a la mujer infectada por el VIH en edad de procrear por su deseo de embarazo46 y, en lo posible, se planifique el mismo teniendo en cuenta los aspectos recogidos en este documento. En este sentido, muchos de los aspectos que describimos serán ya conocidos por la mujer.
Así, los aspectos a resaltar serían los siguientes47:
- •
El TAR es importante tanto para la salud de la mujer como para evitar la TV.
- •
La instauración del TAR depende esencialmente del estado inmunovirológico de la mujer y se regirá por las recomendaciones generales de tratamiento del adulto48. En caso de no precisar tratamiento, este se recomendará en general a partir del segundo trimestre de la gestación, con el fin exclusivo de prevenir la TV. En los casos en que la CV sea elevada, debe considerase un inicio más precoz con los fármacos más seguros durante el embarazo.
- •
Las gestantes que ya reciben TAR en el momento de la concepción no deben suspenderlo si no es por indicación médica.
- •
El TAR, incluso con niveles bajos de CVP, disminuye la TV, por lo que la gestación es siempre una indicación absoluta para recibir ARV49.
- •
Se hará especial énfasis en la necesidad de lograr una buena adherencia al TAR a fin de disminuir la CVP e impedir el desarrollo de resistencias.
- •
La embarazada debe conocer tanto los aspectos beneficiosos del tratamiento (reducción de la CVP y, por consiguiente, del riesgo de TV) como las posibles repercusiones sobre el embarazo y, a largo plazo, sobre el recién nacido. No se ha demostrado que el uso del TAR durante el embarazo se asocie a una mayor frecuencia de malformaciones50, a excepción del EFV, que, a pesar de algunos datos contradictorios51, está contraindicado en el primer trimestre.
- •
En caso de intolerancia o vómitos, efectos secundarios a los ARV, muy frecuentes durante el embarazo, es necesario recordar la recomendación general de suspender toda la medicación ARV simultáneamente para evitar el desarrollo de resistencias48, con la salvedad de las pautas que llevan no nucleósidos, que precisan una suspensión «escalonada» (ver más adelante).
- •
Se debe recomendar a la paciente un estilo de vida adecuado (ejercicio, dieta…) así como suplementos de ácido fólico, yodo y hierro.
- •
La paciente debe reducir, en la medida de lo posible, el consumo de tabaco u otros tóxicos, y abstenerse, durante el embarazo, de tener relaciones sexuales sin protección con múltiples parejas.
- •
La paciente no debe lactar a su hijo en el puerperio.
El diagnóstico de infección por el VIH conlleva siempre un gran impacto emocional. En la gestante se suma, además, el temor a trasmitir el VIH a su hijo y la preocupación por su futuro. Por ello, solo las pacientes con un test de confirmación del diagnóstico positivo al VIH deben ser informadas del mismo. La información debe ser facilitada por el obstetra y por el infectólogo al cual serán derivadas, y se valorará la consulta con el/la pediatra, la cual puede ayudar a disminuir la ansiedad de los padres.
Además, ha de informarse a las pacientes de:
- •
Aspectos generales de la infección por el VIH: agente causal, historia natural, vías de transmisión y medidas de prevención, tanto para prevenir la transmisión a terceras personas como para evitar la re-infección de la paciente por una cepa viral distinta.
- •
Seguimiento del embarazo: confirmar a la paciente que va a ser atendida por un equipo multidisciplinar compuesto, entre otros, por un infectólogo, un obstetra y un pediatra con experiencia en la infección por el VIH y, en caso de necesidad, por otros especialistas como trabajadores sociales, psicólogos o psiquiatras. También ha de saber que en todo momento se respetará la necesaria confidencialidad.
- •
La paciente debe ser informada de la necesidad de contactar con las parejas sexuales previas para que puedan someterse a los tests diagnósticos oportunos.
En el momento actual, en nuestro medio, la mayoría de los niños infectados son hijos de madres no diagnosticadas o con un diagnóstico tardío de la infección. Por ello:
- •
Toda gestante no controlada, o con serología no realizada o desconocida para el VIH, ha de ser adecuadamente informada sobre la conveniencia de realizarse un test rápido para el VIH; si este resulta positivo, será informada lo antes posible. En los casos en que no se disponga de tiempo suficiente para realizar un test de confirmación, la paciente será informada del resultado positivo, así como de la posibilidad de que se trate de un falso positivo.
- •
Ante un test positivo al VIH se actuará con la mayor celeridad posible para disminuir el riesgo de TV (tal y como se detalla en los apartados «Manejo intraparto» y «Profilaxis antirretroviral en el periodo neonatal», dados los efectos beneficiosos de la cesárea, de la administración de ZDV intravenosa (iv) intraparto, etc.
- •
Una vez producido el parto, se completará la evaluación diagnóstica de la paciente, se programarán los controles médicos posteriores y se proporcionará apoyo psicosocial.
Una atención integral a la mujer embarazada e infectada por el VIH exige una adecuada coordinación y comunicación entre, al menos, el infectólogo, el obstetra y el pediatra. Además, en determinados casos, puede ser necesario contar con la atención de un psiquiatra o un psicólogo y brindar soporte social para facilitar el seguimiento44.
El principio general deberá ser tratar adecuadamente a la madre. De hecho, una adecuada supresión de la replicación viral en la madre es, sin duda, la mejor medida para disminuir el riesgo de TV. El adecuado tratamiento de la madre incluye, además de la TAR, otros elementos relacionados con las necesidades concretas que puedan existir: acceso ágil a programas de metadona, profilaxis de infecciones oportunistas, etc. En este sentido, la evaluación inicial de la mujer embarazada infectada por el VIH ha de incluir, al menos, los siguientes aspectos:
- •
Si la paciente ya había sido diagnosticada de infección por el VIH, revisión de las enfermedades relacionadas con el VIH, recuentos pretéritos de CD4 y cargas virales anteriores.
- •
Situación inmunológica mediante la determinación de linfocitos CD4.
- •
Determinación de la CV actual.
- •
Serología de virus de hepatitis A, B y C, Toxoplasma gondii y Treponema pallidum. En algunas situaciones (por ejemplo, inmigrantes de algunos países latinoamericanos) puede estar indicada la realización de otras serologías, como la de Chagas, y revisar las vacunaciones frente a sarampión y rubéola.
- •
Evaluación de la necesidad de profilaxis frente a las infecciones oportunistas (véase el Documento de Consenso GeSIDA-SPNS sobre profilaxis de infecciones oportunista: www.gesidaseimc.org/pcientifica/fuentes/DcyRc/Gesida_dcyrc200803_ProfilaxisIO-GeSIDA-PNS-EIMC2008.pdf).
- •
Evaluación del status de vacunación de la paciente, con atención particular a la hepatitisA, la hepatitisB, la gripe y la vacuna antineumocócica.
- •
Historia previa y actual del TAR, con especial énfasis en los problemas de adherencia al tratamiento.
- •
Determinación de la edad gestacional.
- •
Necesidades de soporte (social, psiquiátrico, metadona…).
- •
Test de resistencias a ARV. En caso de diagnosticarse la infección por el VIH durante el embarazo puede ser muy útil para optimizar la terapia. Igualmente es útil en la paciente con fracaso virológico (ver más adelante). Sin embargo, este test de resistencias no está indicado en la paciente estable que recibe tratamiento y que tiene una CVP indetectable. Si existen tests de resistencia previos, deben consignarse sus resultados.
- •
HLA-B*5701, tanto si se plantea el uso de abacavir (ABC) de forma inicial como si no.
- •
Recuento completo y diferencial, test de función hepática y renal.
- •
En la tabla 3 se recogen los aspectos clave en el seguimiento clínico de la mujer embrazada infectada por VIH.
Tabla 3.Control de la gestación en la mujer infectada por el virus de la inmunodeficiencia humana
Primera visita 1. Información obstétrica e infectológica en la que se detallarán a la paciente las implicaciones de la infección VIH durante la gestación 2. Anamnesis completa (tabaco, abuso de sustancias, vacunas1, parejas sexuales) 3. Exploración clínica general y obstétrica: peso, talla y presión arterial 4. Realización de citología cervicovaginal 5. Descartar infecciones de transmisión sexual. Cribado de infecciones genitales, incluyendo vaginosis bacteriana. Según resultados y/u otros factores de riesgo, valorar su repetición en la semana 28 6. Determinar el estadio clínico de la infección por el VIH 7. Historia de uso de ARV, anterior o actual. Si está indicado78, test de resistencias para elegir la combinación de fármacos ARV 8. Determinaciones analíticas generales de la gestación: Grupo sanguíneo y Rh. Hemograma y bioquímica para descartar toxicidad por ARV. Serologías: HBsAg, lúes, toxoplasma y rubéola. Urocultivo 9. Determinación analíticas específicas: VHC 10. Estudios específicos de la infección por el VIH: Determinación de la CV del VIH en plasma Recuento de linfocitos CD4 11. Ecografía: determinación de la edad gestacional79 12. Test de cribado de anomalías cromosómicas Visitas sucesivas 1. Valoración de las pruebas anteriores 2. Respetar, después del asesoramiento adecuado, la decisión de la mujer de seguir o no con el embarazo, y de tomar o no ARV 3. Iniciar el tratamiento adecuado, según las recomendaciones generales para adulto infectado e individuales para la gestante, considerando el potencial impacto para el feto y el recién nacido 4. Búsqueda de las posibles complicaciones originadas en función de los efectos secundarios de la terapia ARV recibida 5. Ofrecer las condiciones óptimas (tratamiento ARV efectivo, CV indetectable y no paso transplacentario) para la realización de la amniocentesis en el caso de que fuera precisa 6. Control de la CV plasmática (Ver el apartado «Valoración clínica y analítica») 7. Recuento de CD4 trimestral durante la gestación 8. Profilaxis de las infecciones oportunistas si los CD4<200células/mm3 9. Cribado de malformaciones: sobre todo ante el uso de regímenes que hubieran incluido efavirenz 10. Control del bienestar fetal: Ecografía y Doppler fetal periódico, cada 4-6semanas, a partir de la 20.ª semana Registro cardiotocográfico a partir de la semana 36-37 y en los casos de alteración del estudio Doppler, de bajo peso para la edad gestacional o cuando se considere preciso 11. Controles seriados de proteinuria, presión arterial y peso maternos Ver listado de abreviaturas en el anexo 3.
Recomendaciones
- 1.
La determinación del número de CD4 deberá realizarse en la visita inicial y al menos una vez por trimestre (B-III).
- 2.
Se recomienda la realización de un test de resistencia en las siguientes situaciones: gestantes sin TAR actual con PCR por encima del límite habitual de detección de resistencias (>500-1.000 copias/ml) (A-III), en el caso de gestantes que reciben TAR, pero en las que la supresión viral es subóptima, o se ha detectado un rebote de la CV (A-II). También se recomienda que, cuando se inicia un tratamiento de forma empírica sin tener el resultado del test de resistencias, el tratamiento deberá adecuarse al resultado cuando este se conozca (B-III).
- 3.
La determinación de la CV deberá hacerse en la primera visita (A-I), a las 2-4semanas de iniciado el tratamiento o de un cambio de tratamiento (B-I), mensualmente hasta que sea indetectable y al menos trimestralmente a partir de entonces (B-III). También se recomienda realizar una determinación de la CV entre las 34-36semanas para establecer la vía de parto (A-III) más adecuada para cada paciente.
La asistencia y el tratamiento de las gestantes infectadas por el VIH es un imperativo ético-médico. El seguimiento de estas pacientes ha de ser multidisciplinar (obstétrico, clínico, inmunológico, virológico y psicosocial) y basarse en el control de los parámetros analíticos relativos a la infección por el VIH, en la vigilancia de los efectos secundarios del TAR, en el control del embarazo (además de los controles prenatales que recomienda la SEGO para la gestación normal, valoración nutricional materna, evaluación de posibles infecciones oportunistas, evaluación psicológica, etc.) y en la vigilancia del bienestar fetal. Asimismo, se debe asesorar a la paciente en conductas que disminuyan la TV (reducir el consumo de tabaco u otros tóxicos que pueden alterar los tejidos placentarios y aumentan el riesgo de TV, evitar relaciones sexuales sin protección con múltiples parejas, aconsejar la lactancia artificial…)
En países con acceso universal al TAR y con alta cobertura del control prenatal, tanto la gestación como los embarazos repetidos no alteran la evolución clínica ni inmunológica ni virológica de la enfermedad52. Sin embargo, la infección por el VIH y/o su tratamiento sí pueden alterar la evolución del embarazo. Así, algunos estudios muestran una mayor tasa de prematuridad, un mayor retraso del crecimiento y una mayor tasa de muertes fetales en gestantes infectadas por el VIH53. Asimismo, el TAR se ha relacionado en algún estudio con una mayor incidencia de preeclampsia54.
Control obstétrico y complicaciones asociadas a la gestaciónLa anemia en mujeres embarazadas con infección por el VIH se asocia a un riesgo aumentado de resultado adverso perinatal y de TV, por lo que es importante corregir la causa subyacente55.
La incidencia de náuseas y vómitos puede estar aumentada en pacientes con TAR, por lo que se debe ajustar la toma de ARV para evitar que coincida con estos episodios. Se darán recomendaciones para evitar una mala adherencia al TAR por intolerancia digestiva56.
Las mujeres infectadas por el VIH tienen un riesgo aumentado de aborto espontáneo que se asocia directamente con el estadio de la enfermedad e inversamente con el número de CD4 y el tiempo de progresión de la infección57.
El TAR, obviando los ya conocidos como teratogénicos, no parece asociarse a una mayor tasa de malformaciones en los fetos ni a una variación en la frecuencia de aparición de las mismas58.
Ante síntomas propios de preeclampsia, colestasis del embarazo u otras disfunciones hepáticas, se ha de descartar que se trate de efectos adversos asociados a la medicación.
Algunos estudios han asociado el uso de IP con el incremento en la incidencia de diabetes gestacional59,60. En cambio, otros concluyen que no incrementan el riesgo de intolerancia a la glucosa o de resistencia a la insulina en gestantes61,62.
Distintos estudios realizados antes de la introducción del TAR mostraban un incremento de los malos resultados obstétricos en mujeres infectadas por el VIH (prematuridad, recién nacidos de bajo peso y retraso del crecimiento). Así, el metaanálisis realizado por Brocklehurst y French en 199863, basado en estudios realizados en países en vías de desarrollo, mostraba un OR de 3,91 para muerte intrauterina, de 1,7 para retraso de crecimiento intrauterino, de 2,09 para bajo peso y de 1,83 para prematuridad. Otro estudio realizado en Estados Unidos muestra resultados similares64. En el estudio de Lambert et al.65, por el contrario, no parece que la tasa de retraso de crecimiento, bajo peso y número de prematuros se asocie a factores diferentes en las mujeres infectadas por el VIH que en la población general. Tampoco encuentra asociación entre el estado inmunitario materno, la CV materna y los malos resultados obstétricos en mujeres tratadas con ARV, mayoritariamente con ZDV en monoterapia.
La introducción del TAR se asocia, en estudios europeos, a un incremento de la prematuridad. La cohorte suiza66 describe un aumento de la prematuridad en mujeres tratadas con TAR tanto si este incluye inhibidores de la proteasa (IP) como si no (OR: 2,7 y 2,3, respectivamente). El Grupo Colaborativo Europeo, a su vez, también encuentra asociación entre prematuridad y TAR, aun después de ajustarlo por número de CD4 y uso de drogas ilegales. El mismo grupo, en un estudio reciente, encuentra una mayor asociación con prematuridad grave (<34semanas) cuando el tratamiento se inicia antes del embarazo, siendo el OR igual a 4,4167. Las cohortes americanas, sin embargo, no encuentran diferencia entre las mujeres tratadas con ZDV sola y las tratadas con TAR (estudio PACTG185). En cambio, un estudio de cohortes en Norteamérica que comparaba monoterapia, terapia combinada con y sin IP, encontró asociación entre TAR y prematuridad, pero solo en los regímenes que contenían IP68. A pesar de todo ello, otro estudio realizado en Atlanta concluyó que la proporción de nacidos con bajo peso o prematuros descendió durante la era de aumento de TAR69. En el caso de España, no se encontró relación entre la prematuridad y los regímenes que contenían IP70.
El Grupo Colaborativo Europeo encuentra que la preeclampsia es la complicación del embarazo más frecuentemente observada en mujeres con TAR; igualmente, encuentra un aumento de la tasa de fetos muertos71. Por el contrario, otro trabajo encuentra un descenso del número de muertes intrauterinas en mujeres tratadas con ARV72.
Antes de la era TAR, la preeclampsia era una patología muy poco frecuente en mujeres no tratadas. En un estudio realizado en Sudáfrica no se observó ningún efecto de la infección por el VIH sobre la incidencia de preeclampsia73. Otro estudio realizado en Brasil muestra un descenso de la tasa de preeclampsia en mujeres tratadas con ARV74.
Estudios realizados en nuestro ámbito muestran un incremento de las tasas de preeclampsia en mujeres tratadas con ARV. Así, en un trabajo75 se describe un descenso de la incidencia en mujeres infectadas no tratadas y un incremento, hasta valores similares a la población general, en mujeres tratadas con ARV. El descenso en la época de pretratamiento se atribuye a un déficit de la respuesta inmune provocada por la propia enfermedad y el incremento, en la época de tratamiento, a la restitución de la misma. En otro trabajo realizado en nuestro medio54 se encuentra también una tasa disminuida en mujeres no tratadas (0% en mujeres VIH frente al 2,8% en la población general) y un incremento de muertes fetales (6,1%) y preeclampsia (10,9%) en mujeres en TAR, encontrando que el TAR previo al embarazo fue un factor de riesgo independiente (OR: 5,6; IC95%: 1,7-18,1; p=0,004).
Ante la falta de más estudios que aclaren las causas de muerte intrauterina y el desarrollo de preeclampsia en estas mujeres, el embarazo requiere una estrecha vigilancia que permita un diagnóstico temprano de las alteraciones hipertensivas y del bienestar fetal. Estos controles se realizarán ecográficamente (controles seriados de crecimiento y Doppler fetal) y también mediante monitorización fetal.
Como ya se ha comentado, estas gestantes pueden presentar, además, otros problemas de salud (tabaquismo, enolismo, escaso incremento ponderal…), patologías médicas (coinfección por el VHC, infecciones de transmisión sexual —algunos estudios han sugerido que la infección materna por VHS-2 está asociada a un incremento del riesgo de TV intraparto)76, displasia cervical y cáncer de cuello uterino, tuberculosis (TB)77 o necesitar otros tratamientos (psicofármacos, por ejemplo) que pueden complicar la gestación y obligan, independientemente de la infección por el VIH, a realizar un control más exhaustivo. Por todos estos factores, estas gestantes pueden tener un mayor riesgo de presentar patologías obstétricas, como rotura prematura de membranas, parto prematuro y retraso de crecimiento intrauterino.
Complicaciones del tratamiento antirretroviralSe debe vigilar la aparición de posibles efectos secundarios del TAR, investigar la dificultad en la adherencia y la valoración de posibles resistencias al tratamiento1.
Valoración psicosocialEs conveniente una primera aproximación a la esfera psicosocial de la paciente y su entorno (apoyo familiar y social) para valorar la necesidad de remitirla o no al psicólogo y/o a la asistente social. Se valorarán las posibilidades de cuidado futuro de la descendencia.
Por otro lado, tenemos que recomendar y animar a la paciente a que comunique a su pareja el estado de seropositividad, si es que esta lo desconoce. De igual modo, se ha de informar sobre la posibilidad de transmisión del VIH si la pareja es serodiscordante o tiene un patrón virológico distinto. Y recomendar, si la paciente tiene actividad sexual, el uso de métodos de barrera.
Recomendaciones
- 1.
En toda mujer embarazada con infección por el VIH se recomienda en la primera visita realizar una determinación de la CV del VIH en plasma (A-I) y un recuento de linfocitos CD4 (A-I). Durante el seguimiento se realizará una determinación de CD4 trimestralmente (B-III).
Se recomienda realizar una CV durante el segundo y tercer trimestre del embarazo, esta última lo más cercana al parto (A-I).
- 2.
Se deberá realizar una ecografía para determinar la edad gestacional (A-II).
- 3.
En caso que fuera necesario realizar una amniocentesis, se deberán ofrecer las condiciones óptimas (tratamiento ARV efectivo, CV indetectable y no paso transplacentario) (B-III).
- 4.
Se recomienda la realización de un cribado de malformaciones, especialmente en las mujeres que hubieran estado en tratamiento previo con FARV con posibles efectos teratogénicos, tales como el efavirenz (B-III).
- 5.
Se hará un seguimiento minucioso durante la gestación para identificar las posibles complicaciones secundarias a la terapia ARV (A-III).
- 6.
En mujeres con CD4<200célulasl/mm3 se iniciará profilaxis de infecciones oportunistas, valorando los posibles efectos secundarios de los fármacos a utilizar para las mismas (A-II).
Se realiza para la determinación del riesgo de tener un feto con anomalías cromosómicas del tipo trisomía18 y 21 o bien defectos del tubo neural (mielomeningocele) a tener especialmente en cuenta en mujeres que recibieran EFV en el primer trimestre79.
El cribado bioquímico tradicional consistía en la determinación en sangre materna de marcadores séricos (BhCG y alfa-fetoproteína [AFP]) en el 2.° trimestre (semana14-15 de gestación, comprobada ecográficamente), teniendo en cuenta la edad de la paciente, el peso en ese momento y si es gestación única o gemelar.
Estos marcadores séricos se ven influidos por enfermedades maternas como la diabetes, u otras que afectan el sistema inmunitario. Así, las mujeres infectadas por el VIH tienen una tasa de cribados positivos superior a la población general, apreciándose alteraciones en algunos de ellos, tanto por la CV como por la propia inmunodeficiencia o por la ingesta de determinados fármacos. Los múltiplos de la mediana de la hCG y la AFP son más elevados en gestantes VIH; las mujeres con linfocitos CD4 más bajos tienen una tasa mayor de falsos positivos en estos test de cribado, ya que el valor de la hCG está relacionado de forma inversamente proporcional con la cifra de CD4, mientras que la AFP se relaciona de forma directamente proporcional con la CV. Por otra parte, la AFP parece afectarse por los inhibidores de la proteasa, pues las gestantes tratadas con estos fármacos tienen múltiplos de la mediana más bajos que las tratadas con otros agentes, aunque los datos de los diferentes estudios son contradictorios80,81.
Por todo esto, no parece que la realización de un test de cribado exclusivamente bioquímico sea la mejor indicación en las gestantes infectados por el VIH, por lo que siempre que sea posible se ha de realizar un cribado combinado bioquímico/ecográfico82.
Este cribado puede realizarse en 2momentos:
- (a)
En el primer trimestre (de elección). Determinación de marcadores séricos: PAPP-A (pregnancy associated plasma protein A) y subunidad B de la GCH (free BhCG) en la semana10 y evaluación ecográfica de la translucencia nucal en las semanas12-13. Todo ello teniendo en cuenta la edad materna, además de otros factores (gestación única/múltiple, raza, tabaquismo, etc.).
- (b)
En el segundo trimestre (14-15semanas). Consiste tanto en la determinación en sangre materna de los marcadores séricos antes mencionados como en la búsqueda de los marcadores ecográficos como el hueso nasal. Generalmente se reserva para las pacientes en las que no se ha podido realizar el cribado del primer trimestre por no haber llegado a tiempo. Se ha de asumir una menor sensibilidad de la prueba y una posible mayor tasa de falsos positivos.
Puesto que los resultados para la detección de cromosomopatías son mucho mejores con los test combinados, estos son de elección en las gestantes con infección por el VIH. El cribado bioquímico-ecográfico del primer trimestre presenta una sensibilidad del 88% para la trisomía21 y del 75% para la trisomía18, y solo un 3,3% de falsos positivos.
Como conclusión, deben ofrecerse estas técnicas a todas las gestantes con infección por VIH en el 1.er trimestre y, si no fuera posible, en el segundo trimestre.
Determinación del cariotipo fetal mediante biopsia corial/amniocentesisLa biopsia corial se realiza en las semanas12-13 de gestación, mientras que la amniocentesis se lleva a cabo a partir de la semana15, por lo general.
Ambas técnicas pueden ofrecerse a las gestantes con infección por el VIH con CV menor de 50copias/ml y con las mismas indicaciones que las VIH negativas, con los siguientes condicionantes:
- •
Estar bajo TAR. Además, dado que el TAR se inicia, o se reintroduce, alrededor de la semana12 de gestación, excepto si la paciente estaba previamente tratada y no lo ha interrumpido, hay que tener en cuenta que algunas publicaciones señalan que la biopsia corial tiene un riesgo mayor de TV, y se recomienda la amniocentesis como procedimiento de elección. Ha de evitarse la realización de una biopsia corial salvo en casos muy señalados por lo comentado, un mayor riesgo teórico, y por la mayor experiencia con la amniocentesis, que ha demostrado ser una técnica bastante segura bajo estas condiciones
- •
Ha de evitarse, también, el paso transplacentario con el fin de no producir hemorragias que puedan favorecer la infección fetal.
En las gestantes con CV mayor o igual a 1.000copias/ml están contraindicadas estas técnicas.
En las gestantes con cargas virales entre 50 y 1.000copias/ml se debe considerar la posibilidad de retrasar la amniocentesis hasta que la CV sea indetectable. En estos casos, el protocolo de tratamiento debe incluir agentes terapéuticos que crucen de forma óptima la placenta. Puesto que los inhibidores de la proteasa lo hacen de forma muy limitada, se puede valorar la adición de una dosis única de 200mg de NVP, si no forma parte del TAR.
Cordocentesis/amniocentesis tardía/cirugía fetalEn determinadas circunstancias puede considerarse necesario realizar una amniocentesis o cordocentesis en el segundo o tercer trimestre de la gestación, como método diagnóstico de algunas anomalías y patologías fetales (cromosomopatías, infección fetal, anemia fetal, etc.), para comprobar la madurez pulmonar fetal, descartar la presencia de una corioamnionitis o bien como método de tratamiento (transfusión fetal intraútero), e incluso puede plantearse la realización de técnicas de cirugía fetal (electrocoagulación de las anastomosis de los vasos placentarios en las transfusiones gemelo-gemelo, etc.). Al no existir estudios concluyentes que evalúen el riesgo específico en estas situaciones, ha de realizarse una valoración muy detallada del riesgo/beneficio y, en caso de necesidad, realizar el procedimiento bajo un TAR optimizado. Teóricamente, la amniocentesis diagnóstica tardía presentaría un riesgo relativamente bajo, pero la indicación de otras técnicas tales como la cordocentesis y la cirugía fetal, cualquiera que sea la CV, debe ser muy restrictiva, ya que el riesgo de transmisión al feto puede ser alto al poder producirse hemorragias durante su ejecución83.
Recomendaciones
- 1.
Dadas las posibles alteraciones en los marcadores séricos de cromosomopatías en las gestantes con infección por VIH (provocadas por la disminución en las cifras de linfocitos CD4+, la CV o la medicación ARV), se recomienda el cribado combinado bioquímico-ecográfico del primer trimestre (B-II).
- 2.
En caso de que se precise realizar algún procedimiento invasivo durante el embarazo (amniocentesis, cirugía fetal, etc.), se recomienda valorar cuidadosamente el riesgo-beneficio y realizarlo bajo TAR optimizado y con CV indetectable (A-III).
La terapia ARV ha sido el factor de mayor impacto en la prevención de la TV del VIH. El objetivo principal del TAR en la gestante infectada por el VIH es prevenir la TV, preservando la salud de la madre y el hijo, y evitando la aparición de resistencias que limiten futuras opciones terapéuticas1,48.
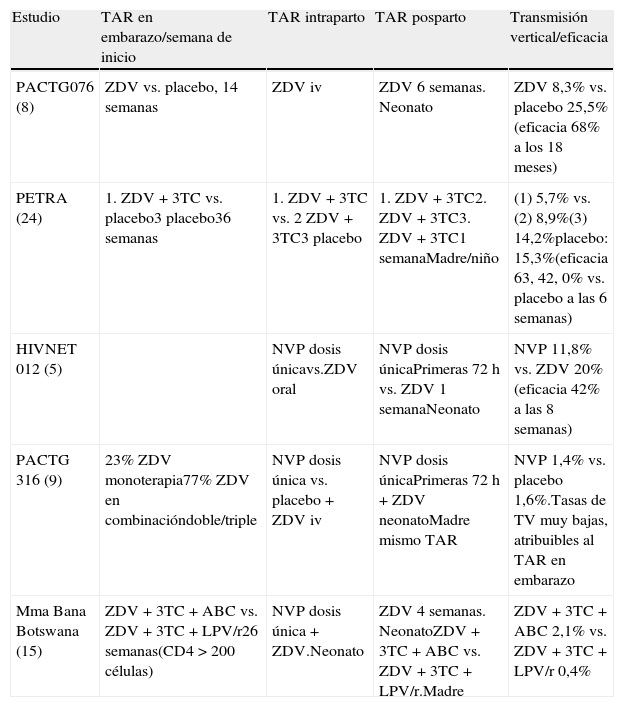
El riesgo de transmisión se relaciona estrechamente con el número de linfocitos CD4 y la CVP, especialmente en el último trimestre del embarazo y periparto. El factor materno más importante asociado al riesgo de TV es la CVP84,85, por lo que el objetivo principal del TAR es mantener la CVP indetectable durante la gestación. El empleo de ARV de baja barrera genética, como lamivudina (3TC) o nevirapina (NVP), puede ocasionar la aparición frecuente de mutaciones de resistencia, tal como se documenta en el estudio HIVNET01286 y en otros estudios en los que se emplearon estos fármacos en monoterapia o en dosis única87. Por otra parte, la interrupción de TAR conteniendo NVP al inicio de la gestación o en el puerperio, por su larga vida media puede conllevar riesgo de monoterapia encubierta y aparición de resistencias88, a diferencia de las pautas triples.
Eficacia del tratamiento antirretroviral en el embarazoEn el año 1994, el estudio PACTG076 demostró que la administración de ZDV en monoterapia a gestantes infectadas por el VIH asintomáticas durante el embarazo, el parto y al recién nacido era capaz de reducir la TV cerca del 70%89.
En el estudio PACTG31690 y en otros estudios prospectivos controlados, el empleo del TAR durante el embarazo consiguió tasas de TV muy bajas, llegando a ser inferiores al 0,1% en pacientes con CVP<50copias91. Existen, además, múltiples estudios observacionales que avalan la eficacia y la seguridad del TAR en la gestante infectada. El riesgo de desarrollo de resistencias es también mucho menor con el TAR que cuando se emplea monoterapia o terapia doble. En todos estos estudios se basan las siguientes recomendaciones:
Recomendaciones
- 1.
El objetivo principal del TAR durante la gestación es mantener la CV indetectable (A-II).
- 2.
El TAR está indicado en todas las gestantes, independientemente del número de linfocitos CD4 y de la CVP (A-I).
- 3.
El tratamiento de elección en el embarazo es el TAR, con independencia de la necesidad o no de tratamiento en la mujer (A-II).
- 4.
Se desaconseja la dosis única de NVP en monoterapia, en el parto (A-II).
- 5.
En caso de interrupción del TAR, durante la gestación o después del parto, cuando se compone de 2 ITIAN y NVP, la administración de NVP se interrumpirá 7días antes (se desconoce la duración óptima del intervalo) (B-II).
- 6.
En las pautas triples con IP, todos los fármacos deben interrumpirse a la vez (A-II).
- 7.
La elección de los fármacos concretos se basará en el estudio de resistencias, en la seguridad de los fármacos y en su facilidad de cumplimiento (A-II).
- 8.
La adherencia al TAR debe ser una prioridad en la embarazada (A-II).
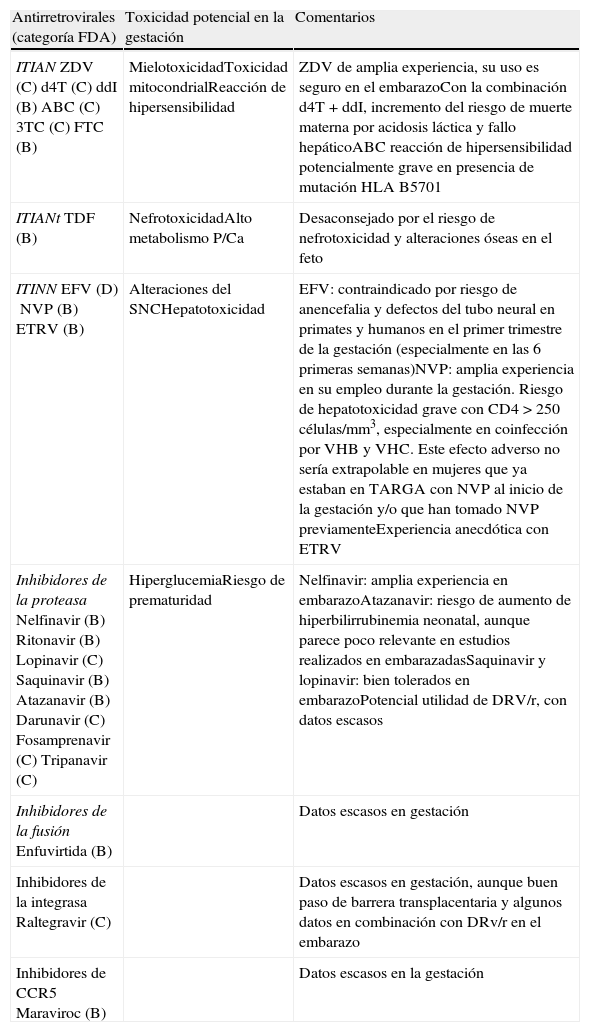
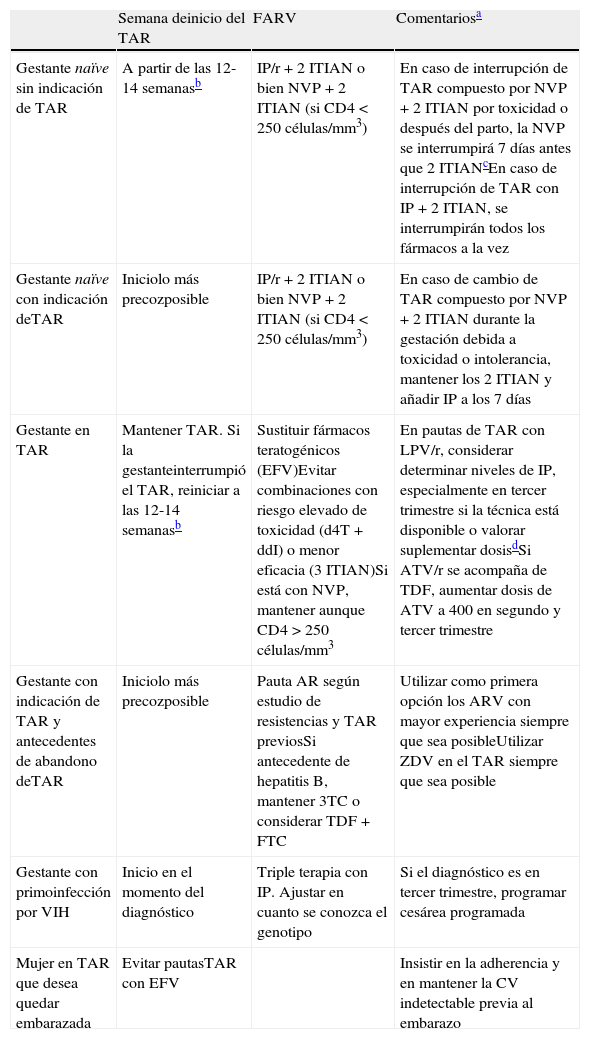
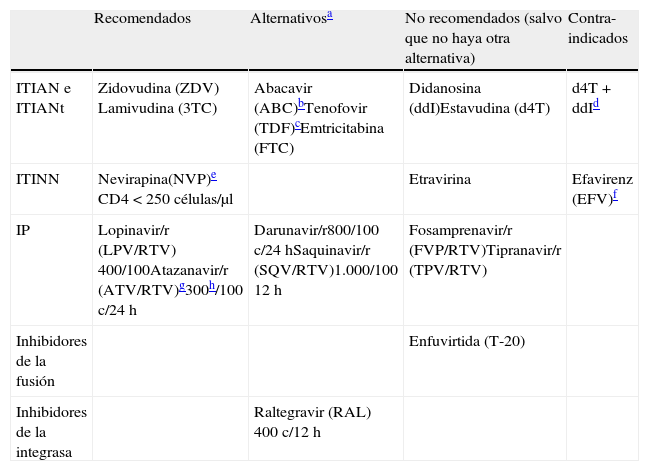
Los criterios para el uso de fármacos ARV en la mujer embarazada difieren respecto a las recomendaciones válidas para el adulto, ya que debe considerarse la seguridad de la madre y del niño. Se emplearán los fármacos en los que se dispone de mayor experiencia, como ZDV, que debe formar parte del TAR siempre que sea posible (es decir, excepto si existe resistencia documentada o intolerancia al mismo). Deben evitarse los fármacos potencialmente teratógenos, como EFV (tabla 4). Aunque el TAR con EFV está considerado de primera elección en el tratamiento de la infección VIH del adulto, no debe indicarse tratamiento con EFV en mujeres en edad fértil sin garantías de anticoncepción eficaz. Son situaciones de riesgo la adolescencia y mujeres pertenecientes a colectivos de inmigrantes con problemas de comprensión por barrera idiomática. Un caso especial lo constituye la mujer infectada por VIH tratada con EFV que es consciente de que está embarazada pasadas ya 5-6semanas desde la concepción: un metaanálisis reciente92 sugiere (si bien es cierto que con algunas limitaciones metodológicas: los propios autores definen los estudios en los que basan el metaanálisis de calidad «moderada»; la mayoría de estudios no incluyen las muertes fetales, ni los abortos espontáneos o inducidos…) que el riesgo relativo de presentar defectos de nacimiento en niños expuestos a EFV durante el primer trimestre es similar al de no expuestos (RR: 0,85; IC95%: 0,61-1,20), lo que, asociado a que uno de los factores de riesgo de fracaso virológico en el tercer trimestre es la modificación del tratamiento durante el embarazo93, hace que pueda considerarse la opción de continuar con el fármaco.
Fármacos antirretrovirales y embarazo
| Antirretrovirales (categoría FDA) | Toxicidad potencial en la gestación | Comentarios |
| ITIANZDV (C)d4T (C)ddI (B)ABC (C)3TC (C)FTC (B) | MielotoxicidadToxicidad mitocondrialReacción de hipersensibilidad | ZDV de amplia experiencia, su uso es seguro en el embarazoCon la combinación d4T + ddI, incremento del riesgo de muerte materna por acidosis láctica y fallo hepáticoABC reacción de hipersensibilidad potencialmente grave en presencia de mutación HLA B5701 |
| ITIANtTDF (B) | NefrotoxicidadAlto metabolismo P/Ca | Desaconsejado por el riesgo de nefrotoxicidad y alteraciones óseas en el feto |
| ITINNEFV (D)NVP (B)ETRV (B) | Alteraciones del SNCHepatotoxicidad | EFV: contraindicado por riesgo de anencefalia y defectos del tubo neural en primates y humanos en el primer trimestre de la gestación (especialmente en las 6 primeras semanas)NVP: amplia experiencia en su empleo durante la gestación. Riesgo de hepatotoxicidad grave con CD4 >250células/mm3, especialmente en coinfección por VHB y VHC. Este efecto adverso no sería extrapolable en mujeres que ya estaban en TARGA con NVP al inicio de la gestación y/o que han tomado NVP previamenteExperiencia anecdótica con ETRV |
| Inhibidores de la proteasaNelfinavir (B)Ritonavir (B)Lopinavir (C)Saquinavir (B)Atazanavir (B)Darunavir (C)Fosamprenavir (C)Tripanavir (C) | HiperglucemiaRiesgo de prematuridad | Nelfinavir: amplia experiencia en embarazoAtazanavir: riesgo de aumento de hiperbilirrubinemia neonatal, aunque parece poco relevante en estudios realizados en embarazadasSaquinavir y lopinavir: bien tolerados en embarazoPotencial utilidad de DRV/r, con datos escasos |
| Inhibidores de la fusiónEnfuvirtida (B) | Datos escasos en gestación | |
| Inhibidores de la integrasaRaltegravir (C) | Datos escasos en gestación, aunque buen paso de barrera transplacentaria y algunos datos en combinación con DRv/r en el embarazo | |
| Inhibidores de CCR5Maraviroc (B) | Datos escasos en la gestación |
Ver listado de abreviaturas en el anexo 3.
La combinación de NVP con ZDV+3TC se ha considerado de primera línea en el TAR de la embarazada y es generalmente bien tolerada. No obstante, se ha descrito un incremento del riesgo de toxicidad hepática grave en mujeres con CD4>250células/mm al inicio de tratamiento94.
La combinación de tenofovir y emtricitabina (TDF+FTC) se emplea con éxito en pautas de profilaxis pre y postexposición al VIH en el adulto. En el estudio OCTANE la pauta TDF+FTC+LPV/r fue la de mayor eficacia en gestantes previamente expuestas a dosis única de NVP95. No obstante, su nefrotoxicidad y acción sobre la mineralización ósea desaconsejan el uso de tenofovir en el embarazo como primera opción, por los riesgos potenciales en el feto. Una excepción son los casos de coinfección con VHB, en que los ITI de elección son la combinación TDF+FTC o 3TC.
Aunque se dispone de una amplia experiencia con nelfinavir en el embarazo, la mayor eficacia de las pautas con IP potenciado con ritonavir (RTV) en el adulto desaconseja la utilización de nelfinavir como primera elección, al disponerse ya de más datos de otros IP potenciados con ritonavir. En este sentido, en un estudio africano lopinavir/r en combinación con ZDV+3TC se mostró superior a ABC y a un grupo control observacional con nevirapina, aunque con tasas de transmisión muy bajas en los 3grupos de TAR96. Un problema en la utilización de los IP es que, dadas las especificidades farmacocinéticas de la gestación, puede producirse una disminución de los niveles de los inhibidores de proteasa a lo largo del embarazo, y especialmente en el tercer trimestre97. Aunque a menudo no se acompaña de fracaso virológico, se recomienda monitorizar los niveles de fármaco para evaluar la necesidad de aumentar la dosis (600/150mg), o, si no se dispone de la técnica, considerar aumentar la dosis del mismo. En cualquier caso, no es un tema completamente dilucidado, ya que algún trabajo en mujeres caucásicas sugiere que no hay diferencias significativas en los niveles de LPV/r entre mujeres en el tercer trimestre de embarazo y mujeres no embarazadas98. En los últimos años han aparecido también datos que sugieren la potencial utilidad de atazanavir/r, darunavir/r e incluso raltegravir. Así, atazanavir/r (tanto a dosis de 300/100 como a dosis de 400/100mg) es igualmente eficaz y seguro durante el embarazo99. Cuando se acompaña de tenofovir en lugar de ZDV, es imprescindible utilizar la dosis de 400/100mg en el segundo y tercer trimestre, dada la interacción existente entre TDF y ATV/r y las especificidades farmacocinéticas de la gestación100. Darunavir/r administrado una vez al día presenta un perfil farmacocinético favorable101 y se ha comunicado su utilidad, asociado a etravirina y, a veces, a raltegravir, en mujeres embarazadas que albergan virus con mutaciones de resistencia a fármacos clásicos102. Además de la potencial utilidad de raltegravir en mujeres embarazadas con virus resistentes a fármacos de primera línea102, se ha sugerido que, dado el buen paso transplacentario103 y la rápida caída que produce en la CV, podría ser útil también en pacientes que se diagnostican tarde y que llegan a la semana38 del embarazo con niveles elevados de CV104, aunque los datos disponibles se circunscriben (en embarazo), casi exclusivamente, a una pequeña serie de casos105.
En la tabla 5 se recogen los diferentes ensayos clínicos que avalan las indicaciones de la utilización de ARV en el embarazo.
Tratamiento antirretroviral en la gestación y la prevención de la transmisión vertical
| Estudio | TAR en embarazo/semana de inicio | TAR intraparto | TAR posparto | Transmisión vertical/eficacia |
| PACTG076 (8) | ZDV vs. placebo, 14 semanas | ZDV iv | ZDV 6 semanas. Neonato | ZDV 8,3% vs. placebo 25,5% (eficacia 68% a los 18 meses) |
| PETRA (24) | 1. ZDV + 3TC vs. placebo3 placebo36 semanas | 1. ZDV + 3TC vs. 2 ZDV + 3TC3 placebo | 1. ZDV + 3TC2. ZDV + 3TC3. ZDV + 3TC1 semanaMadre/niño | (1) 5,7% vs.(2) 8,9%(3) 14,2%placebo: 15,3%(eficacia 63, 42, 0% vs. placebo a las 6 semanas) |
| HIVNET 012 (5) | NVP dosis únicavs.ZDV oral | NVP dosis únicaPrimeras 72 h vs. ZDV 1 semanaNeonato | NVP 11,8% vs. ZDV 20% (eficacia 42% a las 8 semanas) | |
| PACTG 316 (9) | 23% ZDV monoterapia77% ZDV en combinacióndoble/triple | NVP dosis única vs. placebo + ZDV iv | NVP dosis únicaPrimeras 72 h + ZDV neonatoMadre mismo TAR | NVP 1,4% vs. placebo 1,6%.Tasas de TV muy bajas, atribuibles al TAR en embarazo |
| Mma Bana Botswana (15) | ZDV + 3TC + ABC vs. ZDV + 3TC + LPV/r26 semanas(CD4 > 200 células) | NVP dosis única + ZDV.Neonato | ZDV 4 semanas. NeonatoZDV + 3TC + ABC vs. ZDV + 3TC + LPV/r.Madre | ZDV + 3TC + ABC 2,1% vs. ZDV + 3TC + LPV/r 0,4% |
Ver listado de abreviaturas en el anexo 3.
La mayoría de los casos de TV del VIH se producen durante el parto y/o en las últimas semanas de gestación. A pesar de ello, se ha comunicado un pequeño número de casos de transmisión durante las primeras semanas de gestación. Por otra parte, el desarrollo embrionario finaliza en torno a las 10-12semanas, y después de este período la posibilidad de eventuales efectos teratógenos disminuye. En la tabla 6 se recogen las recomendaciones de actuación durante el embarazo en función de diferentes escenarios de presentación. En la tabla 7 se recoge el balance eficacia/seguridad de los distintos FARV y, por tanto, su posicionamiento para su utilización en el embarazo. Las recomendaciones concretas de utilización de fármacos en el embarazo son las siguientes.
Recomendaciones
- 1.
Los beneficios obtenidos con el tratamiento en la madre y el hijo superan a los riesgos potenciales de su uso en el embarazo (A-I).
- 2.
ZDV debe incluirse en el TAR, siempre que sea posible (A-I).
- 3.
El tratamiento de elección es el compuesto por 2análogos de nucleósido más un inhibidor de la proteasa potenciado (A-II).
- 4.
Las combinación de ITIAN+IP de elección en embarazo es ZDV+3TC+LPV/r (A-II). Otras combinaciones con un nivel aceptable de evidencia científica son ZDV+3TC+ATV/r (B-II); TDF+FTC+ATV/r a dosis de 400/100) (B-II). La combinación ABC+3TC es también una combinación de nucleósidos aceptable (C-II). La combinación TDF+FTC está especialmente indicada en pacientes coinfectadas por VHB. Si hubiera resistencias que comprometan la eficacia de LPV/r y ATV/r, DRV/r es una alternativa como tercer fármaco si el virus es sensible (B-II).
- 5.
Nevirapina como tercer fármaco en pacientes naïve solo puede utilizarse en gestantes con recuentos de CD4 inferiores a 250/μl y debe vigilarse estrechamente su potencial hepatotoxicidad, especialmente en las pacientes con hepatitis crónica por VHC y VHB (B-II).
- 6.
No se debe utilizar la combinación d4T+ddI por su toxicidad (A-II). No se recomienda la utilización del efavirenz (A-II) ni de los fármacos con los que se tiene escasa experiencia (A-III). Únicamente podrá considerarse mantener EFV en aquellos casos en que el diagnóstico del embarazo se haya hecho pasadas más de 6semanas en una mujer en tratamiento con EFV (B-II).
- 7.
Si la gestante ya estaba en TAR, se recomienda no suspenderlo en el primer trimestre, pero sí sustituir los fármacos con potencial teratogenicidad como efavirenz (A-II), especialmente si el diagnóstico de embarazo se hace antes de la sexta semana de gestación, y siempre que sea posible, de aquellos de los que se dispone de experiencia (A-III). En situaciones de resistencia a fármacos de primera línea y tras una valoración individualizada, raltegravir, darunavir/r y etravirina podrían ser utilizados (C-II, C-III).
- 8.
No se recomienda tenofovir como primera elección por su nefrotoxicidad y efectos sobre el metabolismo óseo, excepto en caso de ser necesario por fracaso o en pacientes coinfectadas por VHB (B-III).
- 9.
Los cambios en el TAR durante la gestación se basarán en la seguridad, los efectos adversos y la eficacia (A-III).
Manejo de tratamiento antirretroviral en gestación, en distintas situaciones
| Semana deinicio del TAR | FARV | Comentariosa | |
| Gestante naïve sin indicación de TAR | A partir de las 12-14 semanasb | IP/r + 2 ITIAN o bien NVP + 2 ITIAN (si CD4 < 250 células/mm3) | En caso de interrupción de TAR compuesto por NVP + 2 ITIAN por toxicidad o después del parto, la NVP se interrumpirá 7 días antes que 2 ITIANcEn caso de interrupción de TAR con IP + 2 ITIAN, se interrumpirán todos los fármacos a la vez |
| Gestante naïve con indicación deTAR | Iniciolo más precozposible | IP/r + 2 ITIAN o bien NVP + 2 ITIAN (si CD4 < 250 células/mm3) | En caso de cambio de TAR compuesto por NVP + 2 ITIAN durante la gestación debida a toxicidad o intolerancia, mantener los 2 ITIAN y añadir IP a los 7 días |
| Gestante en TAR | Mantener TAR. Si la gestanteinterrumpió el TAR, reiniciar a las 12-14 semanasb | Sustituir fármacos teratogénicos (EFV)Evitar combinaciones con riesgo elevado de toxicidad (d4T + ddI) o menor eficacia (3 ITIAN)Si está con NVP, mantener aunque CD4 > 250 células/mm3 | En pautas de TAR con LPV/r, considerar determinar niveles de IP, especialmente en tercer trimestre si la técnica está disponible o valorar suplementar dosisdSi ATV/r se acompaña de TDF, aumentar dosis de ATV a 400 en segundo y tercer trimestre |
| Gestante con indicación de TAR y antecedentes de abandono deTAR | Iniciolo más precozposible | Pauta AR según estudio de resistencias y TAR previosSi antecedente de hepatitis B, mantener 3TC o considerar TDF + FTC | Utilizar como primera opción los ARV con mayor experiencia siempre que sea posibleUtilizar ZDV en el TAR siempre que sea posible |
| Gestante con primoinfección por VIH | Inicio en el momento del diagnóstico | Triple terapia con IP. Ajustar en cuanto se conozca el genotipo | Si el diagnóstico es en tercer trimestre, programar cesárea programada |
| Mujer en TAR que desea quedar embarazada | Evitar pautasTAR con EFV | Insistir en la adherencia y en mantener la CV indetectable previa al embarazo |
Ver listado de abreviaturas en el anexo 3.
Se recomienda ZDV como parte del TAR en embarazo y ZDV en parto y neonato según protocolo ACTG 076.
En mujeres con CV elevada o con indicación de TAR por salud materna debe considerarse iniciar lo más precozmente posible, siempre que se comience con fármacos seguros y que no haya una hiperemesis gravídica incontrolable.
Recomendaciones de uso de fármacos antirretrovirales en el embarazo
| Recomendados | Alternativosa | No recomendados (salvo que no haya otra alternativa) | Contra- indicados | |
| ITIAN e ITIANt | Zidovudina (ZDV) Lamivudina (3TC) | Abacavir (ABC)bTenofovir (TDF)cEmtricitabina (FTC) | Didanosina (ddI)Estavudina (d4T) | d4T + ddId |
| ITINN | Nevirapina(NVP)e CD4 < 250 células/μl | Etravirina | Efavirenz (EFV)f | |
| IP | Lopinavir/r (LPV/RTV) 400/100Atazanavir/r (ATV/RTV)g300h/100 c/24 h | Darunavir/r800/100 c/24 hSaquinavir/r (SQV/RTV)1.000/100 12 h | Fosamprenavir/r (FVP/RTV)Tipranavir/r (TPV/RTV) | |
| Inhibidores de la fusión | Enfuvirtida (T-20) | |||
| Inhibidores de la integrasa | Raltegravir (RAL) 400 c/12 h |
Ver listado de abreviaturas en el anexo 3.
Riesgo potencial de alteraciones renales y óseas y alteraciones del metabolismo calcio-fósforo tanto en animales como en pacientes VIH. No se recomienda como primera elección, aunque debe considerarse para el tratamiento de la hepatitis B si los beneficios son superiores al riesgo.
Mayor riesgo de hepatotoxicidad en gestantes coinfectadas por VHC, VHB o linfocitos CD4 > 250 células/mm3.
Categoría D, teratógeno. Ver texto si el diagnóstico de embarazo se hace a partir de sexta semana y la paciente ya estaba en tratamiento con EFV.
Hiperbilirrubinemia, riesgo potencial de kernicterus. En adultos se ha descrito un aumento de la bilirrubina no conjugada con el uso de este fármaco. Sin embargo, en una pequeña serie de 40 gestantes tratadas con este fármaco no se ha descrito una mayor incidencia de hiperbilirrubinemia en los neonatos con respecto a la población general.
La TV del VIH se relaciona con un mecanismo multifactorial mediado por las microtransfusiones sanguíneas producidas durante las contracciones uterinas, o por el ascenso del virus a través de las secreciones vaginales después de la rotura de las membranas y su absorción por el trato digestivo del feto. Aunque existen pocas evidencias del manejo de estas patologías en las pacientes tratadas con TAR, a continuación expondremos las recomendaciones específicas complementarias a las generales, comunes a las pacientes no infectadas por el VIH.
Patología obstétricaAmenaza de parto prematuroEl parto prematuro (PP) es el que acontece entre las semanas 22 y 37 de gestación, siendo este el factor aislado más importante de mortalidad neonatal y causante del 85% de las complicaciones perinatales. La etiología es multifactorial (edad materna, bajo nivel socioeconómico, mal control gestacional, patología placentaria, factores cervicovaginales, reproducción asistida, estrés, tabaquismo, consumo de drogas, etc.). La prevención de la amenaza de parto prematuro (APP) debe enfocarse en procurar eliminar dichos factores desencadenantes, alcanzando un buen control durante la gestación y reduciendo, o eliminando, el consumo de tóxicos.
Parece haber una asociación entre PP e infección por el VIH (18% vs. 9% en controles) relacionada, entre otros factores, con el deterioro del estado inmunológico materno (CD4<500células/mm3), por la administración de TAR preconcepcional o durante el primer trimestre106. Algunos autores también lo relacionan con el uso de inhibidores de la proteasa (IP)107. Además, el PP es un factor de riesgo para la transmisión perinatal del virus: Una CV materna <400copias/ml pero en un parto que ocurría antes de las 34 semanas se asoció a un incremento de 8 veces en el riesgo de transmisión respecto al parto a término108.
El tratamiento principal de la APP en las pacientes VIH, al igual que en las pacientes no VIH, es hospitalario y se resume en la tabla 8.
Tratamiento de la amenaza de parto prematuro
| Grupo | Indicación | Fármacos |
| Corticoides | Favorecer la madurez pulmonar en gestaciones ≤ 34 semanas | BetametasonaDexametasona |
| Antibióticos | Profilaxis EGB o tratamiento de infección específica | PenicilinaAmpicilinaClindamicina |
| Tocolíticos | Prolongar gestación al menos 48 h | AtosibánNifedipinoRitodrinaIndometacina |
Ver listado de abreviaturas en el anexo 3.
El RCOG109 y la SEGO afirman que el atosibán y el nifedipino son los fármacos preferibles, ya que tienen una eficacia inhibidora del útero parecida, si bien el nifedipino no tiene licencia para su uso como tocolítico, aunque se tiene una amplia experiencia con su utilización.
Si las contracciones uterinas son regulares durante la amenaza de parto prematuro, aunque las modificaciones cervicales sean mínimas, se administrará ZDV iv (a las mismas dosis que intraparto) junto con el tratamiento tocolítico hasta la estabilización del cuadro y, generalmente, hasta un máximo de 24-48h por la posible toxicidad de las dosis altas de ZDV. Además, las pacientes bajo TAR habrán de continuarlo, y las que no lo recibieran, deben iniciarlo.
En caso de fracaso del tratamiento tocolítico se terminará el parto por vía vaginal o cesárea, dependiendo de la CVP y de las condiciones obstétricas.
Recomendaciones
- 1.
Si las contracciones uterinas son regulares durante la amenaza de parto prematuro, aunque las modificaciones cervicales sean mínimas, se administrará ZDV iv (a las mismas dosis que intraparto) junto con el tratamiento tocolítico. Además, las pacientes bajo TAR habrán de continuarlo, y las que no lo recibieran, deben iniciarlo (B-III).
- 2.
En caso de fracaso del tratamiento tocolítico, se terminará el parto por vía vaginal o mediante cesárea, dependiendo de la CV y de las condiciones obstétricas (B-III).
La rotura prematura de membranas (RPM) se define como la rotura de las membranas amnióticas antes del inicio del trabajo de parto. La RPM pretérmino (RPMP) se asocia con un aumento significativo de la morbimortalidad neonatal, debido principalmente a infección prenatal (amnionitis 13-60%), compresión del cordón umbilical y/o deformidades esqueléticas (debidas al oligohidramnios). El riesgo de complicaciones aumenta con la disminución de la edad gestacional.
Se ha observado un incremento en la TMF del virus cuando la duración de la RPM es superior a 4-6h, especialmente si se acompaña de un trabajo de parto superior a 5h110. Sin embargo, en la actualidad este riesgo se ve reducido gracias al TAR y a la obtención de CVP maternas indetectables. Así, recientemente, un estudio111 realizado sobre 717mujeres ha venido a afirmar que la duración de la RPM no tiene influencia, globalmente, en las mujeres que han recibido TARV en el embarazo (TV si <4h 1% y si >4h 1,9%, p=0,4), pero especialmente en mujeres con <1.000 copias en el momento del parto, no identificándose en este grupo (439mujeres en total) ningún caso de TV, incluso con hasta 25h de RPM.
El tratamiento de la RPM en la gestante seropositiva dependerá de la edad gestacional (EG), de la CV materna y del TAR recibido y la posible evidencia de infección aguda (corioamnionitis), según se muestra en la tabla 9.
Manejo de la rotura prematura de membranas pretérmino según la edad gestacional
| EG | Implicaciones-recomendaciones | Tratamiento |
| ≤ 22 semanas | Gran riesgo morbimortalidad fetal y morbilidad materna | Valorar ofrecer IVEa |
| 23-27 semanas | Tratamiento conservador (riesgo de secuelas graves 61,5% semana 23 y 10% semana 28)Parto si infección o sospecha de pérdida de bienestar fetal (SPBF). En esta situación la elección de la vía del parto estará en relación con las condiciones obstétricas. Dado el mayor riesgo de TV en pretérminos, se considerará la realización de una cesáreab | Corticoides y ABcTARAdministración de tocólisis controvertida |
| 28-33 semanasd | Tratamiento conservador excepto si amnionitis o SPBF o trabajo de partoValorar finalizar la gestación en pacientes no tratadas o CV elevadas. En esta situación el parto será mediante cesáreab | TARCorticoides y ATBcNo tocólisis |
| ≥ 34 semanas | Finalizar gestación según CV y BishopeCon TAR y CV baja no hay evidencia de que la cesárea reduzca el riesgo de transmisión | ¿ATB?fVer apartado «Manejo intraparto» |
aA la hora de ofrecer la IVE: Interrupción voluntaria del embarazo se tendrán en cuenta las posibilidades de cada caso concreto en alcanzar el límite de la viabilidad fetal (generalmente alrededor de la semana 24 de gestación) así como los deseos de los padres. En estas situaciones, el papel del neonatólogo a la hora de informar a los padres del pronóstico neonatal es fundamental.
Existe un mayor riesgo de TV en gestaciones pretérmino y la cesárea podría tener un efecto beneficioso, si bien esto no ha sido demostrado en gestaciones bajo TARV y con CV baja (< 1.000 copias). En estas circunstancias es recomendable, en la medida de las posibilidades, consultar con un obstetra con experiencia en la infección materna por VIH, pues son varios los factores a tener en cuenta: momento del diagnóstico, trayectoria del tratamiento ARV, etc., además de los aspectos obstétricos: test de Bishop, compromiso feto-materno, coexistencia de otras patologías, etc. En > 34 semanas la indicación, si no hay contraindicaciones, es parto vaginal bajo inducción inmediata, como se indica en el texto.
Existen distintas pautas antibióticas como profilaxis de la corioamnionitis en la RPM pretérmino:
• Ampicilina 2g iv c/6h + eritromicina 250 mg iv/6 h, durante 48 h, seguido de amoxicilina 250mg oral c/8 h + eritromicina 500mg oral c/8 h durante 5 días.
• Ampicilina 2g iv de bolo inicial y luego 1 g/6 h iv + azitromicina: 500 mg/día iv (en dosis única/día) durante 7 días.
• Eritromicina 250mg oral c/8h durante 10 días.
• Azitromicina oral 500mg primer día seguido de 250 mg/24 h durante 6 días.
• Ampicilina 1 g/6 h + gentamicina 80 mg/8 h iv durante 5 días (en RPM < 34 semanas).
• Amoxicilina-clavulánico 1 g/6 h (si RPM > 34 semanas).
• En caso de alergia a la penicilina, se administra clindamicina 900 mg/8h o azitromicina 500 mg/día (en dosis unica/dia), 7 días.
En gestaciones de más de 30 semanas se puede considerar finalizar la gestación, puesto que las complicaciones derivadas de la prematuridad pueden ser asumibles. Para ello se tendrá en cuenta el curso del embarazo, el tiempo de TARV durante el embarazo, la evolución de la CV, los cuidados neonatológicos disponibles y el deseo de los padres.
En > 34 semanas la indicación es inducir el parto vaginal, si no hay contraindicaciones, procediendo a la misma de forma inmediata. Según el valor de la CV plasmática y la puntuación de Bishop, se decidirá finalizar el parto mediante cesárea o inducción. En caso de elegir esta última, se procederá a la misma de forma inmediata, sin esperar (como suele ser la conducta habitual en las gestantes seronegativas) al inicio del parto espontáneo.
No está claro el valor de la administración de profilaxis antibiótica durante la inducción del parto vaginal por RPM en gestantes seropositivas, en ausencia de indicación de la misma (colonización por EGB, fiebre intraparto, etc.).
Ver listado de abreviaturas en el anexo 3.
El sangrado vaginal en pacientes seropositivas durante el tercer trimestre de la gestación, como consecuencia de una placenta previa, abruptio placentae (DPPNI), vasa previa, etc., puede ir acompañado de un aumento del riesgo de la TMF. No hay una clara evidencia de qué decisión tomar con respecto a la terminación de la gestación y a la forma de parto, ya que el riesgo de la madre y el feto ante la pérdida sanguínea hay que valorarlo contra el riesgo de la transmisión perinatal y la prematuridad severa.
En general, se han de administrar corticoides si la gestación es ≤34semanas. Estas pacientes continuarán con su TAR, y en casos concretos se podría utilizar tocólisis para disminuir o detener las contracciones que pueden promover la separación placentaria y el sangrado vaginal.
Manejo
- •
Si no cesa la hemorragia, se practicará una cesárea urgente.
- •
Si cesa la hemorragia: manejo expectante hasta la semana 37-38; la vía del parto estará en función de la patología subyacente y de las características de la infección por el VIH en la madre, como en los demás casos.
No cabe duda de que el periodo de mayor riesgo de TV del VIH es el momento del parto. Los factores de riesgo de mayor impacto son la CVP y la CV en las secreciones cervicovaginales, el estadio de la enfermedad, la duración de la rotura de membranas y del trabajo de parto, el TAR recibido y la vía del parto. Aunque existe una correlación entre la CVP y la CV en las secreciones cervicovaginales, en algunas ocasiones puede ser mayor en el tracto genital, lo que podría explicar, en parte, el 0,1-0,4% de TV encontrado en mujeres con CVP indetectable, TAR y parto por vía vaginal91. Por todo ello, la forma de parto debe ser consensuada con la madre y un equipo multidisciplinar formado por obstetra, neonatólogo e infectólogo, tras determinación de la CVP en la semana36, para comentar los riesgos y las ventajas de las distintas modalidades.
Recomendaciones
Recomendaciones sobre la elección de la vía de parto
| Cesárea programada (semana 38) | Parto vaginal |
| CV plasmática materna desconocida (A-II) o >1.000a copias/ml (B-II) | CV materna indetectable (B-II) |
| No TAR o monoterapia con AZT durante el embarazo o pauta ARV distinta a la triple terapia (A-II) | TAR (triple terapia) durante el embarazo (B-II) |
| Deseo de la paciente, no acepta parto vaginal (C-III) | Buen control gestacional (B-III) |
| Se valorará realizar cesárea si ante la necesidad de inducir el parto con prontitud (por RPM o sospecha de sufrimiento fetal, p.ej.) las circunstancias son desfavorables para un parto vaginal (p.ej., índice de Bishop≤4, macrosomía fetal, etc.). Si son otras las indicaciones de la inducción (p.ej., ante gestaciones cronológicamente prolongadas), se puede proceder de la forma habitual (maduración cervical previa con prostaglandinas, administración de oxitócicos con bolsa íntegra, etc.) (C-III) | Inducción si Bishop favorable (B-III) |
a En el grupo de pacientes que habiendo recibido TAR durante el embarazo la CV permanece en valores detectables (entre 50 y 1.000copias cerca del momento del parto) aunque es inferior a 1.000copias/ml, no está claro el beneficio de la cesárea programada respecto a la transmisión del virus; por tanto, es necesario individualizar los casos explicando los riesgos asociados a la cirugía frente a los potenciales beneficios, llegando a una decisión consensuada entre obstetra y madre (B-III).
Recomendaciones respecto a la cesárea programada
- 1.
Cuando la indicación de la cesárea programada es la infección por el VIH, se debe programar en la semana38, para evitar el distrés respiratorio neonatal (SDR)112 y que la paciente inicie el tratamiento espontáneo (B-II). Si la cesárea programada es por indicación obstétrica exclusivamente (p.ej., presentación podálica), se puede programar en la semana 39.
- 2.
En caso de iniciar trabajo de parto o RPM antes de la fecha en que estaba prevista la cesárea, se debe permitir un parto vaginal si la progresión del parto es rápida o realizar una cesárea urgente cuando se prevé un trabajo de parto largo (C-III).
- 3.
Administrar antibiótico intravenoso profiláctico durante la cesárea (A-II).
Recomendaciones respecto al parto por vía vaginal
- 1.
En aquellas pacientes infectadas por el VIH en las que se decida permitir un parto por vía vaginal debemos ser cuidadosos en el manejo, para no incrementar el riesgo de transmisión del virus113 (B-III)
- 2.
Se permite el uso de oxitocina para acelerar el trabajo de parto (B-III)
- 3.
Se debe evitar la rotura artificial de las membranas (B-II).
- 4.
Se deben evitar procedimientos invasivos para monitorizar el bienestar fetal, como el electrodo interno o la determinación de pH de calota fetal (B-III).
- 5.
La instrumentación del parto (fórceps o ventosa) y la episiotomía se deben realizar solo en circunstancias muy seleccionadas (B-III).
Recomendaciones de tratamiento antirretroviral intraparto
- 1.
El tratamiento intraparto recomendado por haber demostrado mayor eficacia en la reducción de la tasa de TV del virus es la ZDViv, independientemente del tratamiento que llevara previamente la paciente (A-I).Dosis: 2mg/kg de peso durante 1h seguido de ZDV a dosis de 1mg/kg de peso/h hasta finalizar el parto (en caso de cesárea, se debe iniciar, idealmente, entre 2 y 3h antes).
- 2.
No se debe suspender el TAR oral durante el parto (B-III), excepto en las pacientes tratadas con estavudina durante el embarazo, que deben interrumpirla durante el tratamiento con ZDV (A-I).
- 3.
En algunos casos de pacientes que no han recibido TAR durante el embarazo, o que habiéndolo recibido durante poco tiempo presentan cargas virales muy elevadas cerca de la fecha de parto, se puede asociar nevirapina (NVP) oral, al menos 2h antes del parto, a la ZDViv, especialmente cuando la vía de parto sea la vaginal (C-II). En este contexto se puede valorar también la adición de raltegravir, dado su rápido paso placentario, a dosis de 600mg/12h, aunque la experiencia con este fármaco es escasa (C-III).
- 4.
Este tratamiento no se recomienda en pacientes que sí han recibido ARV durante el embarazo aunque permanezcan con CV >1.000copias/ml (A-II).
- 5.
En caso de administrar NVP intraparto, el tratamiento posparto materno debe incluir ZDV/3TC 7días para prevenir la aparición de resistencias a NVP (A-II).
- 6.
Las pacientes bajo tratamiento con inhibidores de la proteasa que presentan hemorragia posparto se deben tratar con prostaglandinas, oxitocina o misoprostol. Debe evitarse el uso de ergóticos (por riesgo a excesiva respuesta vasoconstrictora); en caso necesario, se usará la menor dosis y el menor tiempo posible (C-III).
- •
Realización de test rápido de VIH.
- •
Si es positivo, iniciar tratamiento intravenoso con zidovudina, administrar una dosis unica de NVP de 200mg al menos 2h antes del parto y practicar cesárea.
- •
Confirmar la serología de VIH lo antes posible.
Figura 1.Algoritmos de manejo.
*FR: factores de riesgo: no recibir TAR en el embarazo, prematuridad (especialmente si <32semanas), mala situación clínica de la madre, mayor tiempo de bolsa rota, tipo de parto, sangrado durante el parto, infección del tracto genital concomitante.
**Dosificación y pauta: ver tablas 12 y 13.
Ver listado de abreviaturas en el anexo 3.
(0,72MB).
- •
Se recomienda iniciar TAR al tiempo que se solicitan las determinaciones de CV y CD4.
- •
Cesárea programada en la semana 38, bajo tratamiento intravenoso con zidovudina que se debe iniciar entre 2 y 3h antes de la cirugía y hasta el corte del cordón umbilical. Valorar la adición de NVP si la CV es alta.
- •
Continuar el tratamiento, ya que está respondiendo con disminución de su CVP, pero dado que todavía no se han alcanzado niveles indetectables, se recomienda cesárea programada en la semana 38, bajo tratamiento intravenoso con zidovudina, como en el caso anterior.
- •
En estos casos no se ha comprobado que la cesárea programada mejore el riesgo de TV al feto (1% o menor) frente al parto vaginal, aumentando sin embargo los riesgos maternos; por tanto, se recomienda este último, salvo otras indicaciones obstétricas.
- •
Iniciar zidovudina iv.
- •
El modo de parto debe decidirse de forma individualizada, valorando el tiempo de rotura de la bolsa, la progresión del parto, la CV y si está en TAR adecuado.
El puerperio es el proceso fisiológico que en la mujer sigue al parto hasta la aparición de la primera menstruación. Aunque su duración es variable, y por lo general se prolonga hasta un mínimo de 40días, los primeros periodos requieren una atención por parte del personal sanitario debido a la posibilidad de aparición de diversas complicaciones, principalmente hemorrágicas e infecciosas. Por ello, existen distintos protocolos de seguimiento del mismo en la población general114. En la gestante seropositiva puede ser necesaria una atención especial. Por un lado, las complicaciones obstétricas, particularmente la infección puerperal, pueden estar aumentadas en estas pacientes, sobre todo en las que el parto se produjo mediante cesárea115,116, o bien en las que la infección por el VIH presentaba un estadio avanzado117, siendo este el principal motivo que ha conducido a la administración profiláctica de antibióticos durante la cesárea en las gestantes con infección por el VIH.
Por otro lado, se ha de prestar especial cuidado a la atención de la infección por el VIH, así como a los aspectos sociales, psicológicos y de continuidad del control médico, tanto ginecológico como inmunológico, de estas pacientes.
Control del puerperioMedidas generalesEn el control del puerperio podemos diferenciar, por una parte, los cuidados generales que se facilitan a todas las pacientes, independientemente de su estado serológico y que se recogen en los protocolos antes comentados114, y las medidas de control de la infección por el VIH. En el primer caso tendríamos, por ejemplo: vigilancia del sangrado genital y de la involución uterina, constantes vitales, cuidado de la herida, etc.
Además, en la gestante seropositiva se recomienda:
- 1.
Control analítico: hemograma y bioquímica con perfil hepático, por el mayor riesgo de anemia y alteraciones analíticas por los efectos deletéreos del TAR. En la práctica clínica habitual no se obtienen determinaciones analíticas de forma generalizada en la población de puérperas sanas.
- 2.
Valorar la administración de profilaxis antitrombótica. Se ha observado un aumento de las complicaciones trombóticas en la infección por el VIH y también en el periodo posparto118, estando su incidencia aumentada hasta 3meses después del parto. Aunque en algunos centros se administra profilaxis de forma amplia en la población general, sobre todo en el caso de parto mediante cesárea, esta medida ha de ser individualizada. Por ello, en las puérperas con infección por el VIH se recomienda valorar dicha opción.
- 3.
Proceder a la inhibición de la lactancia materna por la contraindicación de la misma en la infección por el VIH.
En este apartado podemos diferenciar claramente 2poblaciones de pacientes. Por un lado, las mujeres con un buen control de la infección por el VIH durante el embarazo y el parto. En ellas no es imprescindible realizar una evaluación inmunológica y virológica de forma inmediata en el puerperio, toda vez que se hayan seguido los protocolos de vigilancia analítica durante el embarazo. Sí es muy importante asegurar la continuidad de la atención a la infección por el VIH, como se comentará más adelante.
El segundo grupo de pacientes es el compuesto por las mujeres diagnosticadas al final del embarazo, durante el parto o en el posparto inmediato. En ellas ha de realizarse una evaluación completa que incluya:
- •
Determinación analítica completa: recuento de CD4+, CV y test de resistencias.
- •
Historia de la infección por el VIH, modo de adquisición, tiempo de evolución y posibles enfermedades asociadas.
- •
Evaluación exhaustiva del TAR profiláctico de la TV que haya sido administrado, si ha podido ser el caso, y posibles interacciones. Se ha de planificar cuidadosamente el TAR inicial con el objeto de que no se desarrollen resistencias que puedan perjudicar las opciones futuras de tratamiento de la paciente.
- •
En este caso es de suma importancia asegurar la continuidad de los cuidados médicos, como luego se comentará, así como procurar soporte social.
Para todas estas medidas se recomienda fuertemente consultar con un infectólogo con experiencia en el tratamiento de la infección por el VIH, siendo muy importante la coordinación entre obstetras, neonatólogos e infectólogos.
Otras medidas. Control ginecológico, servicios sociales y depresión puerperalEl periodo posparto ofrece una oportunidad excelente para revisar y optimizar los cuidados que recibe la paciente1. Es importante una atención multidisciplinar coordinada que incluya especialistas en ginecología, infectología y pediatría, así como los servicios sociales.
Control ginecológicoDentro del control ginecológico se recomienda la realización de una citología vaginal si la paciente no tenía una realizada en el año inmediatamente anterior y, según los hallazgos y la historia previa de la paciente, valorar la conveniencia de remitir a la paciente a una consulta de seguimiento de patología cervicovaginal y de prevención del cáncer genital. Se ha observado una mayor incidencia de lesiones precancerosas en la población seropositiva en el año inmediatamente posterior al parto119 en relación con la población general. En principio, se ha de asegurar un control ginecológico anual en las mujeres con infección por el VIH120 en ausencia de alteraciones. El posparto también es un periodo importante para discutir las prácticas sexuales seguras y las opciones anticonceptivas. Si el parto ha sido mediante cesárea, sobre todo en el caso de cesárea programada, la mujer puede haber optado por una esterilización tubárica121. En caso contrario, se ha de intentar facilitar un método anticonceptivo para evitar embarazos no deseados, teniendo en cuenta que la ausencia de lactancia materna puede hacer que el retorno a la fertilidad sea relativamente precoz122. Con el objetivo adicional de evitar la transmisión del VIH a sus parejas, así como la adquisición de otras enfermedades de transmisión sexual, se recomienda la adopción de un método dual (asociación de un método de barrera)123, teniendo en cuenta las posibles interacciones de los FARV con los anticonceptivos hormonales. Otros métodos, como el dispositivo intrauterino43 o los implantes124 o los inyectables hormonales, también son opciones válidas.
Servicios sociales. Atención socialRespecto a los sistemas de atención social, han de adaptarse a las necesidades individuales de cada mujer1. Idealmente, el soporte social comenzaría antes del embarazo y continuaría durante el mismo y en el periodo posparto. Las mujeres con infección por el VIH pueden presentar más riesgo de ser víctimas de actos violentos durante el embarazo y en el posparto (no por la infección en sí, si no por las características demográficas asociadas con la infección)125, por lo que los servicios de apoyo social pueden tener un papel importante. Asimismo, se ha visto que el apoyo por parte de la pareja126 es esencial tanto para la madre como para el hijo, y debe fomentarse.
Depresión puerperalLa depresión perinatal es el trastorno depresivo, mayor o menor, que aparece durante la gestación o en el primer año tras el parto. Se trata de una patología altamente prevalente; puede oscilar entre el 5 y el 25%, pero por lo general es infradiagnosticada, y se carece asimismo de estudios fiables sobre su impacto real127. En cualquier caso, las consecuencias pueden ser importantes tanto para la madre como para el niño, o para la pareja. De esta forma, existen autores que proclaman la implantación de programas de cribado de los trastornos depresivos perinatales en la población general128. Dicho cribado podría realizarse mediante preguntas sencillas, preestablecidas (cuestionario de las dos preguntas: «En las 2 últimas semanas, 1: ¿se ha sentido deprimida, decaída o sin esperanza, y 2: ¿ha sentido poco o ningún interés o placer por hacer cosas?»; la respuesta afirmativa a una o a ambas preguntas significa que el cribado es positivo), si bien estas preguntas se han estudiado en la población general y se considera que podrían no adaptarse bien a la evaluación de la mujer en el embarazo y el puerperio al ser etapas en las que varía el estado anímico; algunos autores consideran que incluso podrían generar más estrés en la paciente. Por ello, se considera más importante el estudio de los antecedentes (psicológicos, psiquiátricos) o de los factores de riesgo (por ejemplo, mujeres inmigrantes en las cuales son más probables los síntomas de desarraigo, mujeres con falta de apoyo familiar/de su pareja) durante el embarazo y la aplicación de test validados, como la escala de depresión posparto de Edimburgo, en el puerperio. Esta escala (anexo 2) consta de 10preguntas, cada una puntuable de 0 a 3. Se considera como posible caso una puntuación superior a 12 en mujeres sin antecedentes de depresión, o superior a 10 en mujeres con antecedentes, o cualquier respuesta distinta de 0 en la pregunta 10 (ideación suicida). Los posibles casos han de ser derivados a los servicios de salud mental para una evaluación con mayor profundidad.
La depresión es uno de los principales trastornos psiquiátricos en la población infectada por el VIH; su prevalencia media se sitúa en el 37%, cifra de 2 a 3 veces superior de la encontrada en la población general129. Aunque los datos son escasos, las madres con infección por el VIH también podrían presentar mayor incidencia de síntomas depresivos (de tristeza), así como situaciones estresantes, lo que favorecería el desarrollo de trastornos del estado de ánimo o estrés130,131, y en algún estudio131 se ha utilizado el test de Edimburgo como forma de cribado. Aunque no se ha establecido el protocolo de cribado de la depresión perinatal en la población general, existen datos que muestran su utilidad en el periodo posparto precoz y, sobre todo, a las 6-8semanas posparto. En la actualidad existen proyectos para su incorporación de forma precoz, mientras la mujer permanece ingresada, así como dentro de las 6 primeras semanas, para que las pacientes que sean detectadas como posibles casos puedan ser remitidas para control por su médico de familia o por los servicios de salud mental, según el grado de posible alteración que presenten. Es muy importante tener en cuenta la existencia de un número elevado de falsos positivos al realizar el test de Edimburgo en el periodo posparto precoz, por el fenómeno conocido como «disforia prenatal» o baby blues, un tipo de reacción de adaptación con sintomatología pseudodepresiva o sensación de tristeza que se soluciona espontáneamente en 1-3semanas. En este contexto hay que prestar especial atención a los antecedentes y factores de riesgo antes de catalogar un caso como posible depresión puerperal. En las mujeres con síntomas leves y/o ausencia de factores de riesgo serían suficientes las medidas de apoyo (dar información sobre la transitoriedad del cuadro, evitar la autoinculpación, etc.) y ofrecer una nueva evaluación posterior a las 6-8semanas. Dada la posible mayor prevalencia de alteraciones depresivas en la puérpera con infección por el VIH, sería de utilidad realizar el cribado de la depresión puerperal en el periodo posparto precoz, teniendo en cuenta lo comentado anteriormente, si no se ha realizado durante la gestación, empleando para ello el test de Edimburgo, por su mayor reproducibilidad. Nuevamente se hace imprescindible una buena coordinación entre todos los responsables de la atención sanitaria de la paciente (obstetras, pediatras, infectólogos, servicios de atención social y psicólogos/psiquiatras, si se requiere su actuación).
Continuidad del control de la infección por el virus de la inmunodeficiencia humanaEn pacientes previamente diagnosticadas y que han recibido TAR durante el embarazo, es de suma importancia establecer, previamente al parto, cómo será la atención médica tras el mismo. En diversos estudios se ha observado aumento de la CVP plasmática en estas pacientes132,133 o aparición de episodios adversos134 por abandonos no planificados del tratamiento. Se ha visto, además, que la adherencia al tratamiento es mejor durante el embarazo135,136 que en el posparto. Idealmente, se habrá discutido el plan de seguimiento que se llevará a cabo tras el parto, si la paciente deberá continuar o interrumpir el TAR y, en este último caso, cómo habrá de interrumpir el tratamiento para evitar la aparición de resistencias (si, por ejemplo, en la pauta combinada se incluía un fármaco no análogo de los nucleósidos). En este caso, el obstetra ha de asegurarse de que estos parámetros se han seguido y, en caso contrario, consultar con un experto en la infección por VIH antes de proceder al alta de la paciente.
En el caso de pacientes con diagnóstico tardío (al final del embarazo, en el intraparto o en el posparto inmediato) es imperativo realizar una evaluación lo más completa posible antes del alta, consultando con un infectólogo las opciones de tratamiento, y planificar el seguimiento. No se debe permitir la lactancia materna hasta que el diagnóstico de infección por el VIH se haya excluido por completo; en el caso de un test rápido positivo, se ha de asegurar el seguimiento del niño por parte de los pediatras. Es muy importante contactar con los servicios sociales, dada la gran carga emocional que puede tener el diagnóstico reciente de infección por el VIH. Se ha de informar a la paciente, además, de la importancia de la realización del test diagnóstico de la infección por el VIH a sus hijos anteriores y a sus parejas, si las hubiera.
Recomendaciones
- 1.
El control del puerperio en la gestante seropositiva seguirá las pautas establecidas en la población general, recomendándose la realización de una analítica (hemograma y bioquímica sanguínea) y valorando la administración de profilaxis antitrombótica (B-III).
- 2.
En la puérpera con infección por el VIH se recomienda la realización de una citología vaginal y valorar la conveniencia de remitir a la paciente a una consulta de seguimiento de patología cervicovaginal y de prevención del cáncer genital. El posparto es un periodo importante para discutir las prácticas sexuales seguras y las opciones anticonceptivas (A-III).
- 3.
Se recomienda el cribado de la depresión puerperal en las mujeres infectadas por el VIH. Dicho cribado puede llevarse a cabo con el test de Edimburgo. Si la paciente es un posible caso, ha de ser remitida para su seguimiento, preferiblemente a un servicio de salud mental (B-III).
- 4.
Se ha de planificar, antes del parto, el seguimiento posterior de la infección por el VIH para evitar abandonos del tratamiento y/o mala adherencia al mismo. Se debe asegurar la evaluación completa y el seguimiento médico de las pacientes con diagnóstico reciente de infección por el VIH antes del alta hospitalaria. (A-II).
El diagnóstico de la infección por el VIH en los niños >18meses se realiza mediante serología, como en el adulto, mientras en que los <18meses se utilizarán test virológicos, como la PCRADNVIH, cuya sensibilidad aumenta con la edad (40% durante la primera semana de vida, aumentando la sensibilidad al 96% con especificidad del 99% a partir del mes) y/o la PCRARNVIH, que detecta ARN viral libre en plasma, siendo esta técnica la que se usa en la mayoría de los centros. La sensibilidad también aumenta con la edad (25-40% durante la primera semana de vida, aumentando a partir de la tercera semana de vida y alcanzando >90-100% a partir de los 2-3meses). Permite la identificación de subtipos virales distintos del B1,137-139.
El esquema diagnóstico (tabla 10) que se recomienda para la infección en recién nacido hijo de madre VIH es:
- •
Detección de ARN y/o ADN viral en las primeras 48h de vida (no utilizar sangre de cordón por posible falso positivo). Si en este momento las pruebas virológicas son positivas, nos indica que ha existido una infección intraútero. Dado que la sensibilidad de las pruebas virológicas aumentan sobre todo a partir del mes de vida, estas deben repetirse entre los 15-21días de vida (opcional si bajo riesgo de TV de VIH), a las 4 o 6semanas de vida (2semanas después de suspender la profilaxis) y ≥4meses, teniendo esta determinación especial interés en el caso de niños que hubieran recibido terapia combinada, lo cual podría haber disminuido la CV y originado falsos negativos. Si se obtiene un resultado positivo de alguna de estas técnicas, deben repetirse en una muestra diferente de sangre para confirmar la infección y descartar un falso positivo.
- •
Se considera que existe infección en un niño <18meses si presenta al menos 2PCR de ARN y/o ADN de VIH positivas en determinaciones de sangre diferentes.
- •
Se puede descartar con bastante probabilidad la infección en el niño <18meses si tiene al menos 2PCR de ARN y/o ADN de VIH negativas en determinaciones de sangre diferentes, obtenidas por encima de las 6-8semanas de vida ya sin TAR (especialmente en los niños que reciben terapia combinada) y siendo alguna de estas obtenida ≥4meses138-141, si bien en todos los casos se recomienda comprobar la desaparición de anticuerpos.
- •
Los hijos de madres de origen asiático o africano con subtipos no-B de VIH, particularmente los casos del grupo O, pueden presentar falsos negativos con los tests convencionales, por lo que debería utilizarse un test de PCR-ARN más específico.
Diagnóstico de la infección por el virus de la inmunodeficiencia humana en niños < 18 meses
| Edad | Actuación | Comentarios |
| 0-48 h vida | Iniciar profilaxis ARV. Solicitar PCR ARN/ADN HIV en las primeras 48 h | Si es negativa, repetir a los 15-21 días de vida. Si es positiva, repetir en otra muestra para confirmar infección intraútero y descartar falso positivo.Realizar CMV en orina o en saliva en la primera semana de vida para descartar infección congénita por CMVa |
| 15-21 días vida | Solicitar PCR ARN/ADN VIH (opcional si el riesgo de TV de VIH es bajo) | Si negativa, repetir a las 4-6 semanas de vida. Solicitar en caso de riesgo de TV. Si es positiva, repetir en otra muestra para confirmar infección y descartar falso positivo |
| 4-6 semanas de vida | Solicitar PCR ARN/ADN VIH. Detener la profilaxis a las 4semanas de vida | Si es negativa, repetir a los 4 meses de vida. Si es positiva, repetir en otra muestra para confirmar infección y descartar falso positivo |
| ≥ 4 meses de vida | Solicitar PCR ARN/ADN HIV | Si es negativa: infección prácticamente descartada. Si es positiva, repetir en otra muestra para confirmar infección y descartar falso positivo |
| 12-18 meses | ELISA | Comprobar la desaparición de anticuerpos para VIH |
Ver listado de abreviaturas en el anexo 3.
Si se confirma infección en algún momento, remitir al especialista sin demora.
El régimen de profilaxis ARV a administrar al neonato viene determinado por el riesgo teórico de TV de la infección VIH que exista, el cual dependerá, fundamentalmente, de la CV de la madre, si bien existen otros factores de riesgo (tabla 11).
Factores de riesgo de transmisión vertical
| El TAR en el embarazo disminuye el riesgo de TV: riesgo de TV en madres con CV < 1.000 copias/ml con TAR es < 1%, y del 9,8% si no lo recibe |
| Prematuridad (< 37 semanas, especialmente si < 32 semanas) |
| Mala situación clínica de la madre |
| Mayor tiempo de bolsa rota (riesgo considerable > 8-12 h) |
| Tipo de parto: el parto vaginal supone más riesgo |
| Presencia de sangrado durante el parto |
| Infección del tracto genital concomitante |
Ver listado de abreviaturas en el anexo 3.
La mayoría de los niños podrán recibir monoterapia con ZDV como profilaxis frente a la infección por el VIH, y en algunos casos, concretamente en los que haya más riesgo de TV, deberá valorarse la triple terapia. Recientemente se ha publicado un estudio que demuestra la importancia de la terapia combinada en ausencia de profilaxis materna. El estudio NICHD-HPTN 040/P1043, en el que se incluyeron 1.735niños alimentados con lactancia artificial y cuyas madres no habían recibido profilaxis ARV durante el embarazo o parto, se demostró que la administración de biterapia (ZDV 6semanas+3dosis de nevirapina en la primera semana) o triple terapia (ZDV+3TC+nelfinavir 6semanas) fue claramente más eficaz para reducir la tasa de TV intraparto de VIH al niño que la monoterapia con ZDV 6semanas (2,2, 2,5 y 4,9%, respectivamente; p=0,046). Los efectos adversos más comunes fueron anemia y neutropenia, siendo esta última más común en el brazo de triple terapia (27,5% vs 15%; p=0,0001)142. Por tanto, en este estudio se demuestra que en aquellos casos en los que la madre no haya recibido tratamiento durante el embarazo y parto, no debe darse solo monoterapia con ZDV al neonato.
Dosificación de los antirretrovirales usados para la prevención de la infección VIH en el hijo nacido de madre con infección VIH
| Antirretroviral | Dosificación | Efectos secundarios y monitorización |
| Zidovudina(1 cc = 10 mg) | RNT a término o ≥ 35 semanas• Oral: 4 mg/kg/12 h (0,4 cc/kg/12 h)• Intravenosa: 1,5 mg/kg/6 h o 3 mg/kg/12 h• Iniciar en las primeras 4-6 h de vida• Administrar 4 semanas, pasando a oral en cuanto sea posible (recordar que la dosis oral es mayor)Entre 30 y ≤ 34 semanas:• Oral: 2 mg/kg/12 horas (0,2 cc/kg/12 h) durante las primeras 2 semanas, luego de 2 mg/kg/8 h (0,2 cc/kg/8 h) hasta las 4 semanas de vida• (Si iv: usar 2/3 de la dosis oral = 1,5 mg/kg/12 h y 2,3 mg/kg/12 h)En < 30 semanas:• Oral: 2 mg/kg/12 h (0,2 cc/kg/12 h) durante 4 semanas. Si iv: 2/3 de la dosis oralEn el caso de infección por VIH-2: ZDV durante 4 semanas | Anemia macrocítica (reversible al suspender), neutropenia… |
| 3TC, Lamivudina(1 cc = 10 mg) | • Oral: 2 mg/kg/12 h (0,2 cc/kg/12 h)• Inicio en las primeras 12 h de vida (se puede dar a la vez que se inicia la ZDV)• Mantener 4 semanas• No existe preparación iv• Las dosis en pretérmino no han sido establecidas | Anemia, neutropenia, síntomas gastrointestinales |
| NVP, Nevirapina(1 cc = 10 mg) | Pauta 1:• Oral: 2 mg/kg/día (1 vez al día) (0,2 cc/kg/24 h) durante la primera semana de vida• Subir a 4 mg/kg/día (cada 24 h:1 vez al día) (0,4 cc/kg/24 h) durante la segunda semana de vidaPauta 2:• NVP: primera dosis dentro de las primeras 48 h de vida• Segunda dosis 48 h tras la primera dosis• Tercera dosis 96 h tras la segunda dosis• Dosis de NVP en esta pauta: 12mg oral en una sola dosis si el peso del recién nacido es >2kg, y 8mg oral en una sola dosis si el peso del recién nacido es < 2kg (4 mg/kg/dosis)Luego suspender• Se administrará durante las primeras 12 h de vida• No existe preparado iv. Las dosis en el prematuro no han sido del todo establecidas | Vigilar la hipertransaminemia, neutropenia… |
Ver listado de abreviaturas en el anexo 3.
Aclaraciones a la Pauta 1. En el caso de que la madre haya recibido NVP durante el embarazo o al menos más de 3 días antes del parto, deberá iniciarse la nevirapina en el niño directamente a 4 mg/kg/día cada 24 h, puesto que este fármaco tiene un efecto inductor sobre el hígado y atraviesa muy bien la placenta. La primera dosis se dará en este caso a las 48 h de vida. El único ARV que se puede administrar por vía iv es la ZDV. Los demás podrán administrarse por sonda nasogástrica en caso de no poder tomarlos por boca. La ZDV se puede administrar cada 12 h, como queda avalado en diferentes estudios de farmacocinética.
Pautas de profilaxis antirretroviral
| Situaciones (escenarios) en el recién nacido a término | Profilaxis |
| Madre con TAR y CV < 50 copias/ml en parto | ZDV 4 semanas |
| Madre diagnosticada en el parto sin tiempo para TAR | ZDV + 3TC desde el nacimiento hasta completar 4 semanasNVP diaria desde el nacimiento hasta los 15 días de vida o en 3 dosis la primera semana |
| Madre con TAR y CV > 50 copias/ml en parto | ZDV + 3TC desde el nacimiento hasta completar 4 semanasNVP diaria desde el nacimiento hasta los 15 días de vida o en 3 dosis la primera semana |
| Situaciones(escenarios) en el recién nacido pretérmino | Profilaxis |
| Madre con TAR y CV < 50 copias/ml en parto | ZDV 4 semanasValorar NVP dosis única intraparto a la madre (al menos 2h antes para favorecer paso transplacentario) o al recién nacido |
| Madre diagnosticada en el parto sin tiempo para TAR | ZDV desde el nacimiento hasta completar 4 semanasNVP: dosis única intraparto a la madre (al menos 2h antes para favorecer el paso transplacentario) o al recién nacido |
| Madre con TAR y CV > 50 copias/ml en parto | ZDV hasta completar 4semanasNVP: dosis única intraparto a la madre (al menos 2h antes para favorecer paso transplacentario) o al recién nacido |
Ver listado de abreviaturas en el anexo 3.
Los hijos de madres que hayan recibido TAR durante el embarazo y tengan CV <50copias/ml en el parto y sin otros factores de riesgo (bolsa rota prolongada, sangrado importante, etc.) recibirán monoterapia con ZDV durante 4semanas.
Triple terapiaDebe ofrecerse triple terapia en el caso de hijos de madres VIH en estas situaciones:
- 1.
Madre sin TAR en el embarazo ni en el parto.
- 2.
Madre sin TAR en el embarazo, aunque se administre profilaxis en el parto.
- 3.
Madre diagnosticada tarde en el embarazo con poco tiempo de TAR (especialmente, si <14días) y CV >50copias/ml.
- 4.
Madre con TAR pero con CV >50copias/ml en el parto.
- 5.
Niño hijo de madre VIH que ha sido diagnosticada tras el parto (fallo de detección). El inicio de triple terapia en el niño tras las primeras 48-72h de vida de este tiene un valor de prevención limitado.
- 6.
Parto con factores de riesgo acumulados: madre con CD4<200μl, categoría sida en el momento del parto en relación con acontecimientos definitorios recientes (no por clasificación histórica con reclasificación actual a no sida) y CV detectable, tiempo de bolsa rota prolongada, sangrado en el parto importante, enfermedades de transmisión sexual concomitantes.
- 7.
Madre de la que se desconocen los datos de CV, etc., por lo menos hasta tenerlos. En el caso de madres sin serología para VIH en el parto, debe solicitarse de forma urgente en ese mismo momento. En caso de ELISA o test rápido positivo, se debe iniciar profilaxis con triple terapia en el niño recién nacido en espera del Western Blott o prueba confirmatoria, pudiendo suspenderse la profilaxis si se tratase de un falso positivo en la madre. Si los padres se niegan a instaurar profilaxis frente al VIH en el neonato, debe comunicarse al juez de guardia con el objeto de obtener la autorización para poder iniciarla.
La pauta de ARV se muestra en las tablas 12 y 13. Si la madre presenta fracaso virológico, debería solicitarse lo antes posible un test de resistencias y diseñar una terapia apropiada para el neonato (acudir siempre a un experto). Hasta tener dichos resultados, podemos comenzar ZDV+3TC+NVP en las primeras horas de vida del niño.
Si se trata de niños pretérmino, especialmente <32semanas, dado que no existen datos de farmacocinética de los ARV salvo zidovudina, se recomienda solo el uso de ZDV durante 4semanas. En estos casos puede considerarse la administración junto con la ZDV de una dosis única de 200mg de nevirapina a la madre al menos 2h antes del parto (para que el paso transplacentario al niño sea suficiente) si esta carece de TAR con no análogos y presenta CV detectable o incluso indetectable138, cuidando el régimen posterior de ambos para evitar resistencias138,143. Nunca debe administrarse nevirapina en monoterapia, para evitar la aparición de resistencias. Se ha publicado un estudio en niños pretérmino (edad gestacional media: 34 [28-37] semanas; media peso: 2.052 [950-3.400] g) a los que se les administra una dosis de nevirapina al nacimiento (6mg si peso >2kg y 4mg si peso <2kg) junto con ZDV, consiguiendo buenos niveles de NVP incluso hasta el octavo día. Por ello, en caso de no tener tiempo en el parto, se puede dar una dosis de nevirapina al recién nacido pretérmino a dosis de 2mg/kg144. Es importante señalar que no se han reportado casos de toxicidad con dosis única de nevirapina, pero sí se han registrado casos de toxicidad (cardiaca, renal…) importante en el caso del lopinavir/ritonavir, sobre todo en niños pretérmino, por lo que se recomienda no utilizar lopinavir/ritonavir como profilaxis de TV de VIH en el neonato (concretamente, hasta alcanzar las 42semanas de edad gestacional y los 14días de vida)145.
Los hijos de madres con infección por VIH-2 deberán recibir profilaxis con ZDV 4semanas, si bien el riesgo de TV del VIH-2 es mucho menor138.
Recomendaciones
- 1.
Los hijos de madres que hayan recibido TAR alcanzando CV <50copias/ml en el parto y sin otros factores de riesgo recibirán monoterapia con ZDV durante 4semanas (A-I).
- 2.
En los casos en que exista un riesgo importante de TV de VIH debe iniciarse triple terapia, sobre todo en madres sin TAR, durante el embarazo y el parto (A-I).
- 3.
En el caso de niños pretérmino, especialmente <32semanas, se recomienda solo el uso de ZDV durante 4semanas (A-II). En estos casos, puede considerarse la administración de una dosis única de nevirapina a la madre o al niño en el parto (B-III).
La patología neonatal más frecuente en los recién nacidos hijos de madres infectadas por el VIH ha ido variando a lo largo de los años. Actualmente la mayoría de gestantes realizan un adecuado control de la gestación y presentan pocas comorbilidades. Sin embargo, existen distintas patologías que son más frecuentes en estos recién nacidos67.
- •
Coinfecciones maternas susceptibles de ser transmitidas al niño durante el embarazo y/o el parto (tabla 14); en la mayoría de los casos, el manejo pediátrico no es distinto del de la población general.
Tabla 14.Infecciones maternas que muestran mayor incidencia y mayor riesgo de transmisión vertical en la gestante con co-infección por el virus de la inmunodeficiencia humana
Herpes simple genital Citomegalovirus Lúes Toxoplasma Tuberculosis Virus de la hepatitis C Virus de la hepatitis B Virus del papiloma humano Enfermedad de Chagas (Trypanosoma cruzi) Malaria - •
Hijos de madre con diabetes gestacional146.
- •
Prematuridad. Complicación perinatal más frecuente en las gestantes que reciben TAR13.
- •
Restricción del crecimiento intrauterino. Más frecuente en gestantes de edad avanzada, con complicaciones obstétricas, toxicomanías y en algunas infecciones congénitas.
- •
Malformaciones. No se ha descrito una mayor incidencia de malformaciones en los niños expuestos a ARV. Solo el efavirenz se incluye en la categoríaD («prueba positiva de riesgo fetal humano») de la FDA (APR 2009). Se recomienda incluir de forma prospectiva y anónima a toda gestante que reciba ARV en el Antiretroviral Pregnancy Registry (www.apregistry.com)50.
- •
Síndrome de abstinencia: cuando exista el antecedente de consumo de drogas (heroína, cannabis, metadona y barbitúricos) y/o clínica neonatal sugestiva. Alteraciones neuroconductuales en los niños expuestos a cocaína.
Recomendaciones
- 1.
Se recomienda el cribado en el recién nacido de madre con infección VIH de otras infecciones maternas susceptibles de ser transmitidas por vía vertical y otras patologías neonatales, tales como la prematuridad o el síndrome de abstinencia, que el neonatólogo/pediatra debe saber reconocer y tratar (A-II).
Las alteraciones hematológicas son muy comunes en el niño sano hijo de madre con infección por el VIH y expuesto a ARV. Se han descrito sobre todo anemia y neutropenia, pero también trombocitopenia y linfopenia. En el niño a término la exposición a ZDV es la causa principal de una anemia macrocítica sin repercusión clínica, con un nadir en los valores de hemoglobina que coincide con la finalización de la profilaxis (a las 4-6semanas de vida) y que se sitúa alrededor de los 10g/dl, para normalizarse a partir de entonces147. Se describen anemias de mayor gravedad en el prematuro o en el neonato con bajo peso al nacimiento cuando se utiliza ZDViv o con terapias combinadas, aunque raramente requieren de la interrupción del tratamiento, de transfusiones u otras terapias. Para el seguimiento de esta toxicidad es suficiente realizar un hemograma/bioquímica junto con las extracciones destinadas al estudio de la TV del VIH148. La exposición a nevirapina puede traducirse en una elevación no sintomática de las transaminasas; la hepatitis clínica o el rash cutáneo son excepcionales en el neonato y no se han descrito en el caso de niños que recibieron profilaxis con 3dosis de nevirapina en la primera2. En el neonato expuesto intraútero a atazanavir se recomienda monitorizar los niveles de bilirrubina en las primeras semanas de vida.
Se ha relacionado la exposición a análogos de nucleósidos con hiperlactacidemia y alteraciones en el ADN mitocondrial149, si bien se pone en duda la repercusión clínica real de dicha toxicidad. Se trataría, por lo general, de una toxicidad subclínica y autolimitada en el tiempo; por ello, la determinación del lactato plasmático solo debe solicitarse a los pacientes con patología sugestiva de disfunción mitocondrial (convulsiones, retraso psicomotor, mal estado general, náuseas, vómitos, hipertransaminasemia…).
Actuaciones preventivasEl lactante sano expuesto al VIH tiene, al nacimiento, niveles más bajos de anticuerpos específicos transferidos por vía transplacentaria150. La respuesta vacunal de estos pacientes es igual que en la población general, y el calendario a aplicar es el mismo, aunque debe hacerse de forma rigurosa. Las vacunas con virus atenuados no están contraindicadas en el caso de niños expuestos no infectados. No debe administrarse la vacuna BCG hasta que se descarte la infección151. Se recomienda la vacunación antigripal anual, para evitar la gripe en el conviviente inmunodeprimido. El lactante en quien el estudio por PCR no permita descartar de forma razonable la TV del VIH (situación excepcional hoy en día) recibirá trimetoprim-sulfametoxazol (150mg/m2 y día de trimetoprim en 1-2dosis), 3días a la semana (consecutivos o alternos), a partir de las 6semanas de vida como profilaxis primaria de la neumonía por Pneumocystis jiroveci152. Deberá mantenerse este tratamiento hasta descartar la infección por VIH.
Apoyo social y psicológicoDurante la atención del recién nacido hijo de madre VIH se producen situaciones que comportan una importante carga emocional para las familias y problemas de índole social. Es importante detectar estas necesidades y colaborar con los profesionales adecuados para garantizar un cumplimiento terapéutico y un seguimiento clínico correctos. Las situaciones más complejas suelen darse en las personas inmigrantes, en las que se sospecha o constata consumo de drogas y en las madres adolescentes. La infección por el VIH no es una razón para la exclusión del niño de la guardería.
Seguimiento a medio y largo plazoNo disponemos aún de datos suficientes para evaluar la potencial toxicidad a largo plazo de la exposición intraútero a ARV. Diversos estudios han objetivado, hasta la fecha, un crecimiento y neurodesarrollo normales, así como la ausencia de tasas mayores a las esperadas de malformaciones o neoplasias en estos pacientes a lo largo de su infancia. Otros aspectos de los que no se dispone de datos específicos en el seguimiento a largo plazo son las funciones hepática, renal o cardíaca, la potencial toxicidad ósea o el desarrollo sexual y la fertilidad una vez estos niños sanos alcancen la edad adulta.
Recomendaciones
- 1.
Se recomienda realizar un hemograma/bioquímica junto con las extracciones destinadas a descartar la TV del VIH para descartar toxicidad hematológica (C-III).
- 2.
La determinación de lactato para el estudio de la toxicidad mitocondrial solo se justifica en el paciente sintomático (C-III).
- 3.
La profilaxis para la neumonía por Pneumocystis jiroveci con trimetoprim-sulfametoxazol a partir de las 6semanas de vida solo se recomienda, en nuestro medio, en aquellos casos en los que no es posible descartar razonablemente la TV del VIH (A-II).
La lactancia materna supone un riesgo de transmisión del VIH del 10-16%153,154, que se asocia a: la CV elevada en la leche materna y en plasma, la situación clínico-inmunológica materna avanzada, la infección aguda materna, la lactancia mixta (versus la lactancia materna exclusiva), lesiones en el pezón (erosiones o mastitis) o en la mucosa oral del lactante (erosiones o muguet), el periodo inicial de lactancia, el calostro, y el tiempo y volumen acumulados de lactancia materna. Asimismo, el uso de TAR en la madre o el mantenimiento de profilaxis con ARV en el lactante en distintas pautas serían factores protectores para la transmisión del VIH por esta vía155,156. En el momento actual, la única estrategia eficaz es la absoluta sustitución de la lactancia materna por la alimentación con fórmula adaptada. En el caso de que se hubiera producido lactancia materna de forma inadvertida antes del diagnóstico materno, se debería descartar la infección en el niño sin demora y se podría valorar instaurar profilaxis ARV con triple terapia en el niño durante 4-6semanas. En este supuesto la profilaxis no se considera tan eficaz como en otros casos de profilaxis postexposición en los que la exposición en puntual. Es necesario testar el estado de infección mediante el uso de PCRADN/ARN para VIH a las 4semanas, 3meses y 6meses del inicio de la profilaxis1. La PCRADN es preferible en el caso de pacientes con ARV. La profilaxis se interrumpirá antes de las 4-6semanas si se demuestra la infección por VIH en el niño. En este caso, debe realizarse test de resistencias antes del inicio del TAR.
Se debe evitar la premasticación de los alimentos por parte de la madre para el niño, debido a que se han descrito casos de transmisión del virus por esta vía1.
Situaciones especialesCoinfección por virus hepatotroposCoinfección por virus de la inmunodeficiencia humana/virus de la hepatitis CLa tasa de TMF del virus de la hepatitisC (VHC) varía mucho de unos estudios a otros en función del tipo de población y de la presencia de factores favorecedores, como la coinfección por el VIH, y especialmente la presencia de CV del VHC materna. No se conoce el dintel exacto a partir del cual el riesgo de transmisión se hace significativo. En una revisión sistemática de la literatura que agrupó a 1.479niños, la OR para la TV del VHC fue de 2,82 (IC95%: 1,17-6,81) si las madres presentan viremia del VHC comparado con las que no estaban virémicas157. Algunos estudios indican que existe un aumento de la TV en los casos de partos complicados o que precisen instrumentalización158,159.
En cuanto al manejo, existen pocos datos en la literatura que aclaren cuál es el mejor tratamiento de la mujer gestante coinfectada por VIH y VHC. El interferón y el interferón pegilado no se recomiendan en el embarazo, y la ribavirina está contraindicada. El TAR efectivo en la mujer gestante se asoció con una fuerte tendencia a la reducción de la TMF del VHC (OR: 0,26; IC95%: 0,07-1,01)160. El TAR será el indicado para la mujer gestante con infección por el VIH1. No existe clara evidencia de la eficacia de la cesárea programada para prevenir la TV del VHC161-163. Tampoco se ha demostrado que la lactancia aumente el riesgo de TMF del VHC.
En la gestante coinfectada se deben realizar pruebas diagnósticas para hepatitisA y B si no se han realizado con anterioridad. Si la mujer presenta negatividad para ambos virus, podría indicarse la vacunación durante la gestación una vez instaurado el TAR77. Se puede producir elevación de transaminasas tras el inicio de TAR, debido a reconstitución inmunológica o a toxicidad por FARV, por lo que sería aconsejable un seguimiento analítico hepático inicial a las 2semanas, y posteriormente mensual.
Los niños nacidos de madres coinfectadas pueden no aclarar los anticuerpos frente a VHC maternos hasta pasados los 18meses de edad. Por ello, para poder descartar la infección en el niño se necesitan, al menos, 2determinaciones negativas de PCR entre los 2 y 6meses de edad y/o la serología para el VHC después de los 18meses164,165. En el manejo de las pacientes embarazadas coinfectadas por VIH y VHC deben tenerse en cuenta las siguientes recomendaciones.
Recomendaciones
- 1.
Se recomienda realizar a todas las gestantes, una determinación de anticuerpos frente al VHC (A-III).
- 2.
Realizar al menos una determinación de viremia plasmática VHC cuantitativa, aunque durante el embarazo no se pueda incidir de manera práctica sobre ella (C-III).
- 3.
Durante la gestación el interferón no se recomienda y la ribavirina está contraindicada (A-II).
- 4.
Las recomendaciones de uso de ARV durante la gestación son las mismas para mujeres coinfectadas con VHC que para las que solo tienen infección por el VIH (B-III).
- 5.
No hay datos suficientes para indicar la cesárea programada de manera general solo en función de la infección materna por el VHC (B-III).
- 6.
Se debe realizar estudio de infección por VHC a los niños nacidos de madres con coinfección VIH/VHC (A-III) mediante ARN de VHC a los 2 y 6meses de edad y/o determinación de anticuerpos para VHC después de los 18meses de edad (C-III).
- 7.
Está indicada la vacunación contra hepatitisA y B en mujeres coinfectadas que no hayan estado expuestas a estos virus (A-III).
La transmisión transplacentaria del VHB es frecuente si la madre tiene una infección aguda muy próxima al parto o si es portadora crónica de HBsAg. La CV materna del VHB es el factor de mayor influencia para la TMF166.
Como ya se ha señalado, se debe realizar estudio para la hepatitisA, B y C a todas las embarazadas si no se dispone del mismo. Las mujeres infectadas por el VIH con hepatitis crónica por VHB y que tienen IgG de hepatitisA negativa deberían recibir vacunación para la hepatitisA. Las mujeres con infección por VIH con HBsAc y HBsAg negativo deben recibir vacunación frente a la hepatitisB167. La positividad solo del anti-HBc en ocasiones puede significar una infección por VHB oculta168. La vacunación se puede administrar durante la gestación, preferiblemente después de que la mujer esté con un TAR estable, para prevenir el teórico riesgo posvacunal de rebrote de CV de VIH77.
No hay estudios definitivos sobre seguridad del tratamiento para la hepatitisB durante la gestación y la lactancia. Aunque los datos en relación con el uso de TDF durante la gestación son limitados, en la coinfección por HBV/VIH está indicado su uso en combinación con 3TC o emtricitabina formando parte del TAR de la gestante. La profilaxis con ZDV en el parto y al recién nacido se mantendrían como se indica en el apartado correspondiente de las presentes guías. El uso de 3TC como fármaco único para el tratamiento del VHB puede ocasionar el desarrollo de mutaciones de resistencia; no obstante, un tiempo de uso inferior a 6meses se ha asociado a menos generación de resistencias del VHB a 3TC que una exposición más prolongada169. No hay apenas datos del uso de entecavir, adefovir o telmivudina en mujeres gestantes y, además, datos recientes sugieren que la utilización de entecavir puede producir la mutación M184V170. El interferón y el interferón pegilado no están recomendados en la gestación por su efecto antiproliferativo171.
Se puede producir elevación de transaminasas tras el inicio de TAR, debido a reconstitución inmunológica o a toxicidad por FARV, por lo que sería aconsejable un seguimiento analítico hepático inicial a las 2semanas y posteriormente mensual.
Todos los niños nacidos de madres con HBsAg(+) deben recibir una inmunoglobulina específica frente a VHB dentro de las primeras 12h de vida. Además, al mismo tiempo se iniciará la vacunación en lugar anatómico diferente, según las pautas habituales de vacunación. Este régimen proporciona una efectividad >95% en la prevención de la hepatitisB172-174 (tabla 15).
Recomendaciones
- 1.
Realizar una serología completa para el VHB a toda gestante infectada por VIH (A-II).
- 2.
El interferón-alfa y el interferón pegilado-alfa no se recomiendan durante el embarazo (A-III).
- 3.
Determinar la CV del VHB en toda paciente HBsAg(+) o con dudas serológicas. Este dato es útil para diseñar una pauta de TAR que sea eficaz frente al VIH y frente al VHB (C-III).
- 4.
Se debe administrar vacuna para hepatitisB a las mujeres que tengan antígeno de superficie negativo, anti-core negativo y anticuerpos frente al antígeno de superficie negativos (A-II).
- 5.
En las mujeres con IgG negativa para hepatitisA se recomienda la vacunación tras el parto (A-II).
- 6.
El tratamiento de la mujer gestante coinfectada con VIH/VHB planteará la inclusión de fármacos activos para ambos virus, siendo de elección TDF con 3TC o emtricitabina de acuerdo con las recomendaciones para el uso del TAR en la mujer gestante (A-III).
- 7.
Administrar a los niños nacidos de madres HBsAg(+) una inmunoglobulina específica frente a VHB dentro de las primeras 12h de vida. Además, al mismo tiempo se iniciará la vacunación en lugar anatómico diferente, con dosis de recuerdo al mes y a los 6meses de vida (A-I).
Recomendaciones para la prevención de la transmisión vertical del virus de la hepatitis B
| Inmunoprofilaxis | Madre HBsAg(+) | Madre HbsAg desconocidoa | Madre HbsAg(–) |
| IG anti-hepatitis Bb | En las primeras 12 h tras el nacimiento | Tan pronto como sea posible (primera semana) si la madre es HBsAg(+) | No es necesario |
| Vacuna para hepatitis Bc | Al nacer, al mes y a los 6 meses de vidad | Si madre HBsAg(+): ver columna anterior. Si madre HBsAg(–): según calendario vacunal | Según calendario vacunal |
Ver listado de abreviaturas en el anexo 3.
En relación con la TB, la evaluación diagnóstica en mujeres gestantes será la misma que para la población general. La radiografía de tórax con protección abdominal produce una mínima exposición fetal a las radiaciones, pudiendo realizarse si se considera necesario.
El tratamiento de la TB activa en la mujer embarazada debe iniciarse si la probabilidad de TB es moderada-alta o si hay diagnóstico microbiológico. La TB congénita es muy poco frecuente175. Los fármacos usados para el tratamiento habitual pasan la barrera placentaria y no parecen tener efectos perniciosos para el feto. El tratamiento recomendado es el mismo que para el resto de la población, teniendo en cuenta los datos específicos de cada fármaco en la gestación y las posibles interacciones con el TAR77.
Pirazinamida (PZ) no es teratógena en animales, pero la experiencia de su uso en mujeres gestantes es muy limitada, motivo por el que algunas guías no recomiendan su uso de manera generalizada en embarazadas77. Sin embargo, la OMS recomienda el uso de PZ formando parte de la pauta de tratamiento inicial en mujeres gestantes con infección por el VIH o formas clínicas de TB meníngea o diseminada. La duración total del tratamiento de la TB con isoniazida (INH), rifampicina (R) y PZ y ETB (pauta cuádruple que debe ser utilizada hasta disponer de los resultados de los tests de resistencia que demuestren susceptibilidad a todos los fármacos) es de 6meses176. Rifabutina (categoríaB) se puede plantear como una alternativa a la RIF por ser menos inductor enzimático que R, aunque hay poca experiencia de uso en la gestación. Los fármacos antituberculosos de segunda línea tienen pocas interacciones con los ARV, pero existe muy poca experiencia de su uso en el embarazo: estreptomicina, kanamicina, amikacina y capreomicina (categoríaD) están contraindicadas por poder producir toxicidad intraútero del viiipar. Por lo que respecta a otros fármacos, como el ácido para-aminosalicílico, quinolonas, etionamida o cicloserina (categoríaC), no se dispone de datos de seguridad en el embarazo ni en el feto177. En caso de TB multirresistente, y dado que es de vital importancia el tratar la TB, siempre se elegirá el tratamiento que resulte más eficaz para la madre, teniendo en cuenta la seguridad del feto.
Las mujeres gestantes con TB activa deben recibir simultáneamente tratamiento antituberculoso y TAR. La elección o el mantenimiento del TAR en la mujer gestante con TB son complicados, en primer lugar debido a las interacciones entre ITINN e IP con R y, en menor medida, con rifabutina178, y en segundo lugar debido a la superposición de toxicidades entre ARV y antituberculosos. Por otra parte, la gestación en sí misma ya constituye una limitación para la elección de FARV. Las opciones son179: elegir o mantener un TAR que pueda administrarse junto con RIF formando parte de la pauta antituberculosa, en cuyo caso podrían considerarse algunas de las de las siguientes alternativas:
- a)
Efavirenz debería evitarse en el primer trimestre. Después del primer trimestre se puede usar si, tras considerar las alternativas, resulta ser la mejor opción. Puede ser necesario ajustar la dosis de EFV en mujeres que pesen más de 60kg, aunque se desconoce su relevancia en la gestación.
- b)
El triple régimen (AZT+3TC/FTC+ABV) ITIAN podría utilizarse en gestantes sin historia de fracasos anteriores a otras pautas de TAR, sensibles a ITIAN y con CV indetectable mantenida o en pacientes naïve con CV bajas.
- c)
Aunque las pautas basadas en NVP en mujeres con CD4 inferiores a 250células/μl es de elección en la gestación, su asociación con R ↓Cmín y AUC de NVP del 35 a más del 50% puede potenciar los posibles efectos tóxicos hepáticos180.
- d)
Otras alternativas basadas en raltegravir o maraviroc no disponen de datos suficientes de seguridad y farmacocinética en gestación para recomendar su uso. Solo se usarán cuando los beneficios teóricos superen los riesgos.
- e)
Elegir o mantener un TAR con rifabutina formando parte de la pauta antituberculosa: se trataría de un TAR basado en los IP de elección en la gestación, junto con rifabutina a dosis ajustadas.
En cuanto al seguimiento a realizar durante el tratamiento de la TB, se ha descrito mayor toxicidad hepática con los fármacos antituberculosos en mujeres gestantes, por lo que se recomienda seguimiento mensual con determinación de las pruebas de función hepática durante el embarazo y en el posparto. Puede aparecer síndrome de reconstitución inmune que deberá manejarse, siempre que sea posible, manteniendo ambos tratamientos (tanto el de la TB como el del VIH. Debido a la complejidad, en caso de dificultad para el cumplimiento, la terapia directamente observada (TDO) es muy recomendable.
Las concentraciones de los fármacos antituberculosos de primera línea en la leche materna son bajas y no producen toxicidad en el recién nacido. Los niños nacidos de madres con TB durante la gestación o el parto deberán ser valorados por el pediatra181.
En el tratamiento de la infección tuberculosa latente, la INH, administrada bien en forma diaria, bien 2veces por semana durante 9meses, es el régimen preferido en mujeres embarazadas. Las mujeres que toman INH también deberían tomar suplementos de piridoxina (vitaminaB6)181. El manejo de la TB en la mujer embarazada infectada por VIH puede sintetizarse en las siguientes recomendaciones.
Recomendaciones
- 1.
Las gestantes con infección por el VIH con TB activa deben iniciar de inmediato tratamiento de TB (A-I).
- 2.
El tratamiento de elección en gestantes con TB activa es INH+R/rifabutina+PZ+ETB) (B-III). La experiencia de uso de PZ es muy limitada, pero se recomienda su empleo en mujeres gestantes con infección por VIH, especialmente con formas de TB diseminada o meníngea y cuando se desconoce la susceptibilidad de la cepa (C-III).
- 3.
Una rifampicina debe formar parte del tratamiento antituberculoso con ajuste de dosis si es necesario en función del TAR (A-II).
- 4.
Estreptomicina, kanamicina, amikacina y capreomicina están contraindicados en la gestante (A-II). Existe poca experiencia de otros fármacos de segunda línea, como el ácido para-aminosalicílico, quinolonas, etionamida o cicloserina, pero si son necesarios, se utilizarán en TB multirresistentes (C-III).
- 5.
Las mujeres gestantes con TB activa deben tratarse con ARV tan pronto como sea posible por la salud de la madre y para evitar la TMF (A-II).
- 6.
El síndrome inflamatorio de reconstitución inmune (IRIS) puede ocurrir después de la iniciación del TAR. Se deben mantener ambos tratamientos y manejar el IRIS (A-III).
- 7.
Se recomienda seguimiento mensual con analítica hepática durante el embarazo y el posparto (C-III).
El objetivo del TAR en el embarazo es conseguir y mantener CVP indetectable, ya que la TMF se ha relacionado directamente con la CVP materna. El test de resistencia genotípico está recomendado para todas las embarazadas antes de comenzar el TAR, así como para aquellas que, estando en tratamiento, tengan CVP detectable. En ocasiones es necesario iniciar el TAR aun sin disponer del resultado del test, sujeto a modificación posterior en función del resultado del mismo.
Consideraciones especiales en las gestantesLa aparición de resistencia a algún medicamento utilizado como profilaxis ARV puede limitar las opciones de tratamiento materno futuro, o disminuir la eficacia de tratamientos profilácticos en otros embarazos; además, supone un potencial riesgo de transmisión de virus resistente al niño, en cuyo caso las opciones de tratamiento del niño pueden verse limitadas. Durante el embarazo se producen en la mujer una serie de cambios fisiológicos, como el aumento del volumen plasmático y del aclaramiento renal, que puede motivar cambios en la farmacocinética de algunos fármacos y dar lugar a niveles subterapéuticos de los mismos. La presencia de náuseas o vómitos puede también aumentar el riesgo de aparición de resistencias. Si se retira el TAR a la madre en el posparto puede darse la circunstancia de que los fármacos que lo componen tengan una vida media distinta, como sucede con las pautas consistentes en 2ITIAN y NVP. En estos casos debe evitarse la retirada simultánea de los fármacos, ya que puede ocurrir que existan niveles persistentes en plasma de aquellos fármacos (NVP) con vida media más larga y sea una situación asimilable a la monoterapia.
Resistencia a antirretrovirales después del uso de regímenes profilácticos para prevenir la transmisión materno-fetalLa presencia de mutaciones de resistencia a ITIAN se ha correlacionado con enfermedad materna avanzada y duración de la exposición a estos fármacos. El desarrollo de resistencias a ZDV cuando se usa como fármaco único en profilaxis es poco común en mujeres con linfocitos CD4 altos y CV baja. El desarrollo de mutaciones de resistencia a NVP es frecuente cuando se utiliza en dosis única en el parto como profilaxis de TMF. La NVP tiene una barrera genética muy baja, ya que con una única mutación se genera resistencia. La vida media de NVP es muy larga, detectándose niveles en sangre hasta 21días después de una única dosis182,183. Los factores que se han asociado con la aparición de resistencia a NVP en este contexto han sido: CV materna elevada, CD4 basales bajos, subtipo viral. La tasa de resistencia genotípica a NVP después de una única dosis en el parto es variable, entre el 15 y el 65%184. En el ensayo PACTG316, a las mujeres que estaban tomando TAR preparto se les añadía una dosis única de NVP en el parto. Este estudio no demostró eficacia adicional para prevenir la TMF, mientras que sí se asoció con mayor incidencia de mutaciones de resistencia a NVP184.
En un estudio reciente se analizó la presencia de mutaciones de resistencia en gestantes que recibían TAR durante el embarazo e interrumpieron el TAR en el posparto. Todas las mujeres habían recibido ZDV+3TC y, como tercer fármaco, nelfinavir o NVP. La aparición de resistencias fue significativamente mayor en el grupo de NVP185.
Importancia de la presencia de resistencias en la gestación y riesgo de transmisión perinatal del virus de la inmunodeficiencia humanaLa transmisión perinatal de virus resistentes es poco usual, y hay poca evidencia de que la presencia de mutaciones incremente el riesgo de transmisión cuando se siguen las directrices generales de TAR en la gestación. Un subestudio de la cohorte Women and Infants Transmission Study (WITS), en el que se incluyeron 142mujeres que, en la década de los noventa, recibían solo ZDV para el tratamiento del VIH, mostró que la presencia de mutaciones de resistencia a ZDV confería un incremento del riesgo de TMF cuando el análisis se ajustaba por el tiempo de rotura de membranas y por linfocitos totales185. Otros estudios han sugerido que cuando las madres transmisoras tenían población viral mixta de virus salvaje y con resistencia de bajo nivel a ZDV, solo se detectaba en los niños virus salvaje186. Otros estudios han sugerido que las mutaciones maternas podían disminuir la fitness viral, conduciendo así a una menor transmisibilidad187.
La prevalencia de virus resistentes en niños con infección por VIH perinatal en 2periodos de tiempo (1988-1989 y 2000-2001) fue del 12 y del 19%, respectivamente. En ambos estudios la exposición ARV perinatal no se asoció con la presencia de resistencia a los fármacos188,189.
En relación con la administración de NVP en dosis única en el parto, no se demostró más transmisión perinatal entre mujeres que recibían NVP por primera vez que entre las en las que habían recibido NVP en gestaciones previas190,191.
Tratamiento de la infección por el virus de la inmunodeficiencia humana resistente a antirretrovirales en la gestaciónIdealmente, el TAR debe ser elegido durante la gestación en función de la situación clínica, la historia de TAR previo y el estudio de resistencias a ARV de la mujer. En las mujeres que tengan resistencia documentada a ZDV se indicará un TAR que no incluya ZDV y que consiga mantener a la madre con CV suprimida. En este contexto se sigue recomendando la administración de ZDViv durante el parto, ya que la eficacia de ZDV parece estar basada no solo en la reducción de la CV materna sino en su acción profiláctica pre y postexposición en los niños192. ZDV cruza la placenta, donde se metaboliza a su forma activa de trifosfato, lo que justificaría su especial protección contra la transmisión.
Varios estudios han mostrado el desarrollo de mutaciones de resistencia a NVP que decrece, pero no se elimina después de una única dosis en el parto o en combinación con TAR antenatal. Una vez retirada la NVP, se deben mantener los 2análogos al menos 7días; la duración óptima no es totalmente conocida, y algunos expertos recomiendan mantenerlos más de 30días. Otra opción puede ser asociar un IP a los análogos cuando se retire la NVP hasta la retirada de todo el tratamiento.
El tratamiento de la infección por virus multirresistentes en la gestación es complicado. Deben considerarse las siguientes premisas: a)el riesgo de TMF depende de varios factores, pero la CVP de la madre durante el embarazo y en el parto es el factor determinante, por lo que el objetivo del TAR en el embarazo es conseguir y mantener CVP indetectable; b)en la gestación existe una limitación para el uso de los FARV, algunos por riesgo teratogénico y en su mayoría por no existir información suficiente para su uso en la gestación1. El principio general de manejo es que, en mujeres con virus multirresistente, se indicará un TAR capaz de suprimir la replicación viral aunque se tengan que utilizar fármacos con los que exista poca experiencia en gestación (especialmente a partir del segundo trimestre), ya que de no ser así se comprometería el futuro tratamiento de la madre y existiría un mayor riesgo de transmisión al niño de un virus potencialmente resistente. Se insistirá a la mujer sobre la importancia del cumplimiento para evitar la aparición de mutaciones de resistencia. Por las mismas razones expuestas anteriormente, se administrará ZDV intraparto.
Recomendaciones
- 1.
El estudio de resistencias genotípico está recomendado en todas las embarazadas antes de comenzar el TAR y en aquellas que, estando con TAR, tengan CVP detectable (A-III). En ocasiones es necesario iniciar el TAR aun sin disponer del resultado del test, con lo que el tratamiento queda sujeto a modificación posterior (B-III).
- 2.
Las mujeres que tengan resistencia documentada a ZDV recibirán durante la gestación regímenes que no incluyan ZDV, para lograr la supresión virológica, pero pueden recibir ZDViv durante el parto (A-II).
- 3.
En caso de que la madre presente infección por virus multirresistente deberá iniciarse en el recién nacido un régimen diseñado en función del estudio de resistencias materno (A-II). En caso de no disponer del mismo, en el momento del parto se iniciará en el recién nacido ZDV+3TC y nevirapina, ajustando el régimen tras conocer el estudio de resistencias.
- 4.
El tratamiento óptimo del recién nacido de madre con virus resistente no se conoce. Es conveniente consultar con un pediatra experto en la infección por VIH antes del parto (A-III).
- 5.
En la mujer gestante se debe utilizar un TAR con ARV que supriman la replicación viral. Esta es la estrategia más efectiva para evitar el desarrollo de mutaciones de resistencia y minimizar el riesgo de TV (A-II).
- 6.
En el caso de infección materna por virus multirresistente, se indicará un TAR compuesto por aquellos fármacos con los que se consiga la máxima supresión viral de la madre (A-III).
- 7.
Las mujeres que reciben un TAR basado en no nucleósidos únicamente como profilaxis de la transmisión perinatal y que suspenderán el TAR en el posparto deberán tomar los análogos de nucleósidos al menos durante 7días después de la retirada del no nucleósido para minimizar el riesgo de desarrollo de mutaciones de resistencia (A-I). Una alternativa es sustituir el no nucleósido por un IP antes de la interrupción y continuar junto con los análogos 30días (B-III).
- 8.
La adición de una dosis única de NVP en el momento del parto o cercano al mismo a una mujer con TAR estable no supone un beneficio extra en la reducción de la transmisión perinatal y puede provocar la aparición de mutaciones de resistencia a NVP en la madre o en el niño; por lo tanto, no se recomienda (A-I).
La realización de este documento ha sido financiada con fondos propios de la SPNS.
Conflicto de interesesCon el fin de evitar y/o minimizar los posibles conflictos de intereses, las personas que forman el panel de expertos/as han realizado una declaración formal de intereses. En esta declaración parte de los/as autores/as han recibido financiación para participar en congresos y para a realización de investigaciones, así como han recibido pagos como ponentes por parte de instituciones públicas y laboratorios farmacéuticos. Estas actividades no afectan a la claridad del presente documento, por no entrar en conflicto de intereses lo recomendado con los honorarios y/o ayudas recibidas. Cabe resaltar que, con respecto a los fármacos, en el documento solamente se habla de principio activo y no de marca comercial.
La SPNS y las juntas directivas de GeSIDA, SEGO y SEIP agradecen las aportaciones y opiniones de Ángel Burgos y Juan Carlos Melchor, que han contribuido a mejorar la redacción y enriquecer el contenido del documento.
Rosa Polo Rodríguez. Especialista en Medicina Interna. Jefa del Área Asistencial y de Investigación. Secretaría del Plan Nacional sobre el Sida. MSSSI. Madrid.
Eloy Muñoz Galligo. Especialista en Obstetricia y Ginecología. Hospital Universitario 12 de Octubre. Madrid.
José Antonio Iribarren. Especialista en Medicina Interna. Unidad de VIH. Hospital Universitario Donostia. San Sebastián.
Pere Domingo Pedrol. Especialista en Medicina Interna. Unidad de VIH. Hospital Universitario Sant Pau. Barcelona.
María Leyes García. Especialista en Medicina Interna. Unidad de VIH. Hospital Universitario Son Dureta. Palma de Mallorca.
Vicente Maiques Montesinos. Especialista en Obstetricia y Ginecología. Hospital Universitario La Fe. Valencia.
Pilar Miralles Martín. Especialista en Medicina Interna. Unidad de VIH. Hospital Universitario Gregorio Marañón. Madrid.
Antoni Noguera Julian. Especialista en Pediatría. Hospital San Joan de Déu. Barcelona.
Antonio Ocampo Hernández. Especialista en Medicina Interna. Unidad de VIH. Hospital Universitario Xeral de Vigo. Vigo. Pontevedra.
María Lourdes Péres Bares. Especialista en Ginecología y Obstetricia. Hospital Universitario Xeral de Vigo. Vigo. Pontevedra.
Marta López Rojano. Especialista en Ginecología y Obstetricia. Hospital Universitario Clínic de Barcelona. Barcelona.
Anna Suy Franch. Especialista en Obstetricia y Ginecología. Hospital Universitario Vall d’Hebron. Barcelona.
María Carmen Viñuela Beneitez. Especialista en Obstetricia y Ginecología. Hospital Universitario Gregorio Marañón. Madrid.
María Isabel González Tomé. Especialista en Pediatría. Unidad de Inmunodeficiencias. Hospital Universitario 12 de Octubre. Madrid.
La Escala de Depresión de Posparto de Edimburgo se creó para asistir a los profesionales de la atención primaria de salud en la detección de las madres que padecen de depresión de posparto, una afección alarmante más prolongada que la «melancolía de la maternidad» (Blues en inglés), que ocurre durante la primera semana después del parto pero que es menos grave que la psicosis del puerperio. Estudios previos demostraron que la depresión de posparto afecta por lo menos al 10% de las mujeres y que muchas de las madres deprimidas se quedan sin tratamiento. Estas madres logran sobrellevar la carga de su bebé y las tareas de la casa, pero su placer por la vida se ve gravemente afectado y puede que toda la familia sufra consecuencias a largo plazo. La EPDS se creó en centros de salud en Livingston y Edimburgo. Consiste de 10 cortas declaraciones. La madre escoge cuál de las 4posibles respuestas es la que más se asemeja a la manera en la que se sintió durante la semana anterior. La mayoría de las madres pueden contestar la escala sin dificultad en menos de 5min. El estudio de validación demostró que las madres que obtienen resultados por encima del umbral del 92,3% es más probable que padezcan alguna enfermedad depresiva de diferentes niveles de gravedad. No obstante, no se debe conceder más importancia a los resultados de la EPDS que al juicio clínico. Se debe realizar una evaluación clínica prudente para confirmar el diagnóstico. La escala indica la manera en que la madre se sintió durante la semana anterior, y en casos dudosos podría ser útil repetirla después de 2semanas. La escala no detecta las madres con neurosis de ansiedad, fobias o trastornos de la personalidad
Instrucciones de uso
- 1.
Se pide a la madre que escoja la respuesta que más se asemeje a la manera en que se sintió en los 7días anteriores.
- 2.
Tienen que responder las 10preguntas.
- 3.
Se debe tener cuidado y evitar la posibilidad de que la madre hable sobre sus respuestas con otras personas.
- 4.
La madre debe responder la escala ella misma, a no ser que sus conocimientos del español sean limitados o que tenga problemas para leer.
- 5.
La EPDS se puede usar entre las 6 y 8semanas para evaluar a las mujeres en la etapa de posparto. La clínica de pediatría, la cita de control de posparto o una visita al hogar pueden ser oportunidades convenientes para realizarla.
Se suman todos los puntos para obtener la puntuación total. Una puntuación de 10+ muestra la probabilidad de una depresión, pero no su gravedad. Cualquier número que se escoja que no sea el cero para la pregunta número 10 significa que es necesario hacer evaluaciones adicionales inmediatamente. La puntuación de la EPDS está diseñada para asistir al juicio clínico, no para reemplazarlo. Se harán evaluaciones adicionales a las mujeres antes de decidir el tipo de tratamiento.
Los usuarios pueden reproducir esta escala sin necesidad de obtener permisos adicionales siempre y cuando respeten los derechos de autor y citen los nombres de los autores, el título y la fuente del artículo en todas las copias que reproduzcan.
En los últimos siete días:
1. He sido capaz de reír y ver el lado bueno de las cosas.
0 Tanto como siempre.
1 No tanto ahora.
2 Mucho menos.
3 No, no he podido.
2. He mirado el futuro con placer.
0 Tanto como siempre.
1 Algo menos de lo que solía hacer.
2 Definitivamente menos.
3 No, nada.
3. Me he culpado sin necesidad cuando las cosas no salían bien.
3 Sí, la mayoría de las veces.
2 Sí, algunas veces.
1 No muy a menudo.
0 No, nunca.
4. He estado preocupada y ansiosa sin motivo.
0 No, para nada.
1 Casi nada.
2 Sí, a veces.
3 Sí, a menudo.
5. He sentido miedo y pánico sin motivo alguno.
3 Sí, bastante.
2 Sí, a veces.
1 No, no mucho.
0 No, nada.
6. Las cosas me superan, me sobrepasan.
3 Sí, la mayor parte de las veces.
2 Sí, a veces.
1 No, casi nunca.
0 No, nada.
7. Me he sentido tan infeliz que he tenido dificultad para dormir.
3 Sí, la mayoría de las veces.
2 Sí, a veces.
1 No muy a menudo.
0 No, nada.
8. Me he sentido triste y desgraciada.
3 Sí, casi siempre.
2 Sí, bastante a menudo.
1 No muy a menudo.
0 No, nada.
9. He sido tan infeliz que he estado llorando.
3 Sí, casi siempre.
2 Sí, bastante a menudo.
1 Solo en ocasiones.
0 No, nunca.
10. He pensado en hacerme daño a mí misma.
3 Sí, bastante a menudo.
2 A veces.
1 Casi nunca.
0 No, nunca.
Los usuarios pueden reproducir el cuestionario sin permiso adicional, proveyendo que se respeten los derechos reservados y se mencionen los nombres de los autores, el título y la fuente del documento en todas las reproducciones.
Obtenido de The British Journal of Psychiatry, June 1987, Vol. 150 by J.L. Cox, J.M. Holden, R. Sagovsky.
| ABC | Abacavir |
| AN | Inhibidores transcriptasa inversa análogos nucleósido o nucleotídeo |
| APP | Amenaza de parto prematuro |
| APV | Amprenavir |
| ARV | Antirretroviral |
| ATV | Atazanavir |
| CMV | Citomegalovirus |
| CV | Carga viral |
| CVP | Carga viral plasmática |
| d4T | Estavudina |
| ddI | Didanosina |
| DPPNI | Desprendimiento prematuro de la placenta normoinserta |
| DRV | Darunavir |
| EFV | Efavirenz |
| EG | Edad gestacional |
| EGB | Estreptococo del grupo B |
| EMA | European Medicines Agency |
| ENF | Enfuvirtida |
| ETB | Etambutol |
| ETR | Etravirina |
| ETS | Enfermedades de transmisión sexual |
| FDA | US Food and Drug Administration |
| FARV | Fármacos antirretrovirales |
| FPV | Fosamprenavir |
| FSH | Hormona foliculoestimulante |
| FTC | Emtricitabina |
| HBsAg | Antígeno de superficie del virus de la hepatitis B |
| IDV | Indinavir |
| IF | Inhibidores de la fusión |
| IInt | Inhibidores de la integrasa |
| INH | Isoniazida |
| IP | Inhibidores de la proteasa |
| IP/r | Inhibidor de la proteasa (IP) potenciado con ritonavir |
| ITIAN | Inhibidores de la transcriptasa inversa análogos de nucleósidos |
| IST | Interrupción estructurada del tratamiento |
| ITT | Análisis por intención de tratamiento |
| IU | Inhibidores de la unión al receptor CCR5 |
| IVE | Interrupción voluntaria del embarazo |
| LPV | Lopinavir |
| MVC | Maraviroc |
| NFV | Nelfinavir |
| NN | Inhibidores de la transcriptasa inversa no análogos |
| NVP | Nevirapina |
| PCR | Reacción en cadena de la polimerasa |
| PZ | Pirazinamida |
| R | Rifampicina |
| RAL | Raltegravir |
| RPM | Rotura prematura de membranas |
| RPMP | Rotura prematura de membranas pretérmino |
| RTV | Ritonavir |
| SDR | Distrés respiratorio gestacional |
| SEGO | Sociedad Española de Ginecología y Obstetricia |
| SQV | Saquinavir |
| TAR | Tratamiento antirretroviral |
| TARGA | Tratamiento antirretroviral de alta eficacia |
| TDF | Tenofovir DF |
| TLOVR | Tiempo hasta la pérdida de la eficacia virológica |
| TMF | Transmisión materno-fetal |
| TNDS | Tumores no definitorios de sida |
| TPV | Tipranavir |
| 3TC | Lamivudina |
| TV | Transmisión vertical |
| ZDV, AZT | Zidovudina |
Alguna de las recomendaciones terapéuticas indicadas en este documento no están aprobadas en ficha técnica, pero el Panel las recomienda en función de los datos publicados al respecto. Cada facultativo prescriptor debe conocer las condiciones para la prescripción de medicamentos cuando se utilizan en indicaciones distintas a las autorizadas (Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales).
Todos los miembros del Panel de Expertos son autores del artículo. El Comité de Redacción se detalla en el anexo 1.