La vacunación con BCG (bacilo Calmette-Guérin) está incluida en el calendario de inmunización al nacimiento en países con alta incidencia de tuberculosis, con una cobertura global cercana al 90%. BCG tiene casi cien años de antigüedad y está basada en una cepa atenuada de Mycobacterium bovis, proporcionando protección contra las formas diseminadas de la enfermedad pero confiriendo una protección muy limitada contra las formas pulmonares de tuberculosis, responsables de su transmisión. Diferentes vacunas profilácticas contra la tuberculosis se encuentran hoy en desarrollo clínico para reemplazar a BCG o para mejorar la protección en individuos ya vacunados con BCG. MTBVAC es la primera y única vacuna candidata basada en una cepa de Mycobacterium tuberculosis atenuada en evaluación clínica. Los planes de desarrollo clínico del MTBVAC se dirigen en primer lugar a la prevención de la tuberculosis en recién nacidos, para reemplazar a BCG, y en segundo lugar en adolescentes y adultos.
BCG (Bacille Calmette-Guérin) vaccination is included in the immunization schedule for tuberculosis endemic countries with a global coverage at birth close to 90% worldwide. BCG was attenuated from Mycobacterium bovis almost a century ago, and provides a strong protection against disseminated forms of the disease, though very limited against pulmonary forms of tuberculosis, responsible for transmission. Novel prophylactic tuberculosis vaccines are in clinical development either to replace BCG or to improve its protection against respiratory forms of the disease. There are limitations understanding the immunological responses involved and the precise type of long-lived immunity that new vaccines need to induce. MTBVAC is the first and only tuberculosis vaccine candidate based on live-attenuated Mycobacterium tuberculosis in clinical evaluation. MTBVAC clinical development plans to target tuberculosis prevention in newborns, as a BCG replacement strategy, and as secondary objective to be tested in adolescents and adults previous vaccinated with BCG.
La tuberculosis es la enfermedad infecciosa que más muertes causa en todo el mundo, superando al sida. Las últimas estimaciones de la Organización Mundial de la Salud (OMS) para el año 2016 fueron de 10,4 millones de nuevos casos de tuberculosis, causando cerca de 1,7 millones de muertes1. La tuberculosis está relacionada con la pobreza y agravada con la pandemia del VIH/sida. Actualmente, una de las mayores amenazas es la aparición de cepas resistentes a múltiples fármacos. Cincuenta millones de personas están infectadas con cepas de Mycobacterium tuberculosis multirresistentes, creando un reservorio para futuros casos de tuberculosis activa que dificultan enormemente el tratamiento1. Para conseguir un control efectivo de la tuberculosis necesitamos encontrar herramientas de diagnóstico más rápidas y fiables que las actuales, nuevos fármacos que permitan acortar la terapia, así como desarrollar nuevas vacunas más eficaces que la actual vacuna BCG contra las formas pulmonares de la enfermedad, responsables de su transmisión1.
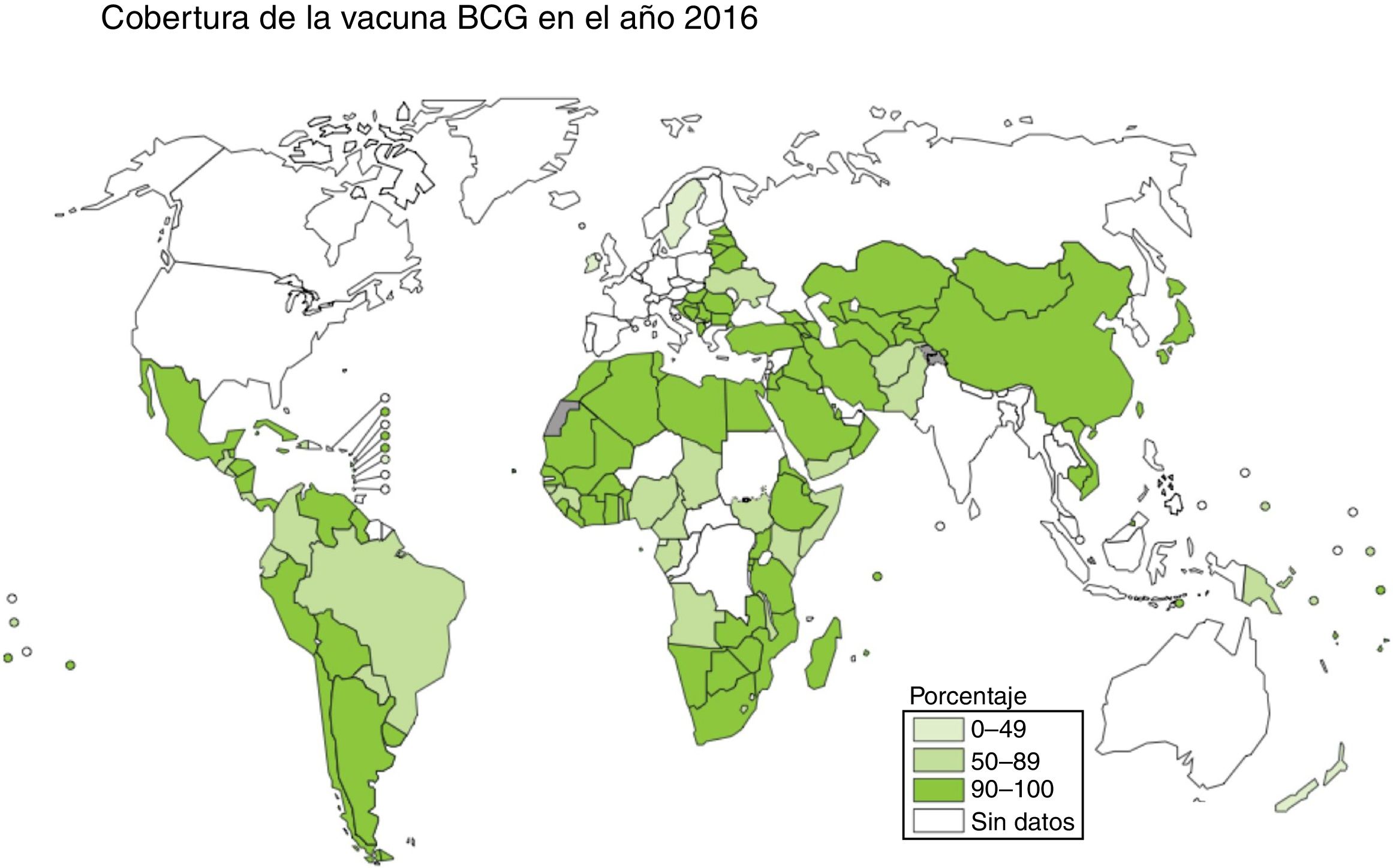
La vacunación es una de las medidas más eficaces en términos de coste-beneficio para luchar contra las enfermedades infecciosas. El bacilo Calmette-Guérin (BCG) es actualmente la única vacuna autorizada y en uso contra la tuberculosis, con una cobertura cercana al 90% en países con alta incidencia, a pesar de que su eficacia contra las formas respiratorias de la enfermedad es muy variable2,3 (fig. 1).
Historia de la BCGBCG es una vacuna atenuada derivada de Mycobacterium bovis, el agente etiológico de la tuberculosis en bóvidos4. BCG fue desarrollada por el médico Albert Calmette y el veterinario Camille Guérin entre los años 1908 y 1921 por subcultivo repetido de una cepa de M.bovis aislada de una vaca, siguiendo los principios de Pasteur para la construcción de vacunas atenuadas contra las enfermedades infecciosas. Tras 230 pases en el laboratorio durante 13años, la cepa mostró su atenuación primero en terneros y posteriormente en cobayas y otros modelos animales5. BCG se introdujo por primera vez en clínica hace casi cien años, cuando en 1921 fue administrada oralmente a un bebé cuya madre había muerto de tuberculosis el día después de su nacimiento. El bebé no mostró efectos adversos a la vacunación con BCG y, lo que es más importante, no desarrolló tuberculosis. En aquellos años se eligió la vía oral de administración para BCG al considerarse el tracto gastrointestinal la vía natural de infección tuberculosa en lactantes y niños alimentados con leche no pasteurizada6. Entre 1921 y 1926 más de 50.000niños fueron vacunados sin apenas efectos adversos. La mortalidad entre los niños vacunados fue del 1,8%, frente a una mortalidad superior al 25% en los niños no vacunados, mostrando su eficacia al disminuir la mortalidad infantil, no solo debida a tuberculosis5.
La cepa original BCG se distribuyó por todo el mundo antes de su conservación por liofilización en los años sesenta. Dada la ausencia de métodos de conservación a largo plazo de microorganismos hasta esta fecha, cada laboratorio realizaba pases repetidos subcultivando la cepa original, dando lugar a la aparición de diferentes subcepas BCG y que fueron designadas por el nombre del laboratorio o del país donde eran subcultivadas, resultando en diferentes BCG con fenotipos heterogéneos. Actualmente seis cepas BCG son las más utilizadas en todo el mundo en los programas internacionales de inmunización: BCG Pasteur 1173 P2, BCG Danish 1331, BCG Glaxo 107, BCG Tokyo 172-1, BCG Rusia-I r y BCG Brasil7.
La principal causa de la atenuación de BCG es la pérdida de la región diferencial1 (RD1) asociada con la pérdida del factor de virulencia del antígeno secretado inmunodominante de 6kDa (ESAT-6)4. El análisis genómico de las subcepas de BCG muestra múltiples diferencias, incluyendo otras deleciones diferentes a RD1 que contribuyen a las variaciones fenotípicas entre ellas, con claras diferencias de atenuación pero sin estar demostrado que contribuyan a diferencias en su eficacia8.
Vacunación con BCG en la actualidadDesde 1974, la vacunación intradérmica con BCG al nacimiento ha sido incluida en el Programa Ampliado de Inmunización (EPI) de la OMS, resultando en más de 4.000 millones de vacunas administradas en todo el mundo, con aproximadamente 200 millones de vacunas administradas cada año. La concentración de bacterias vivas en las vacunas oscila entre 50.000 y 3 millones por dosis, dependiendo de la cepa BCG utilizada9.
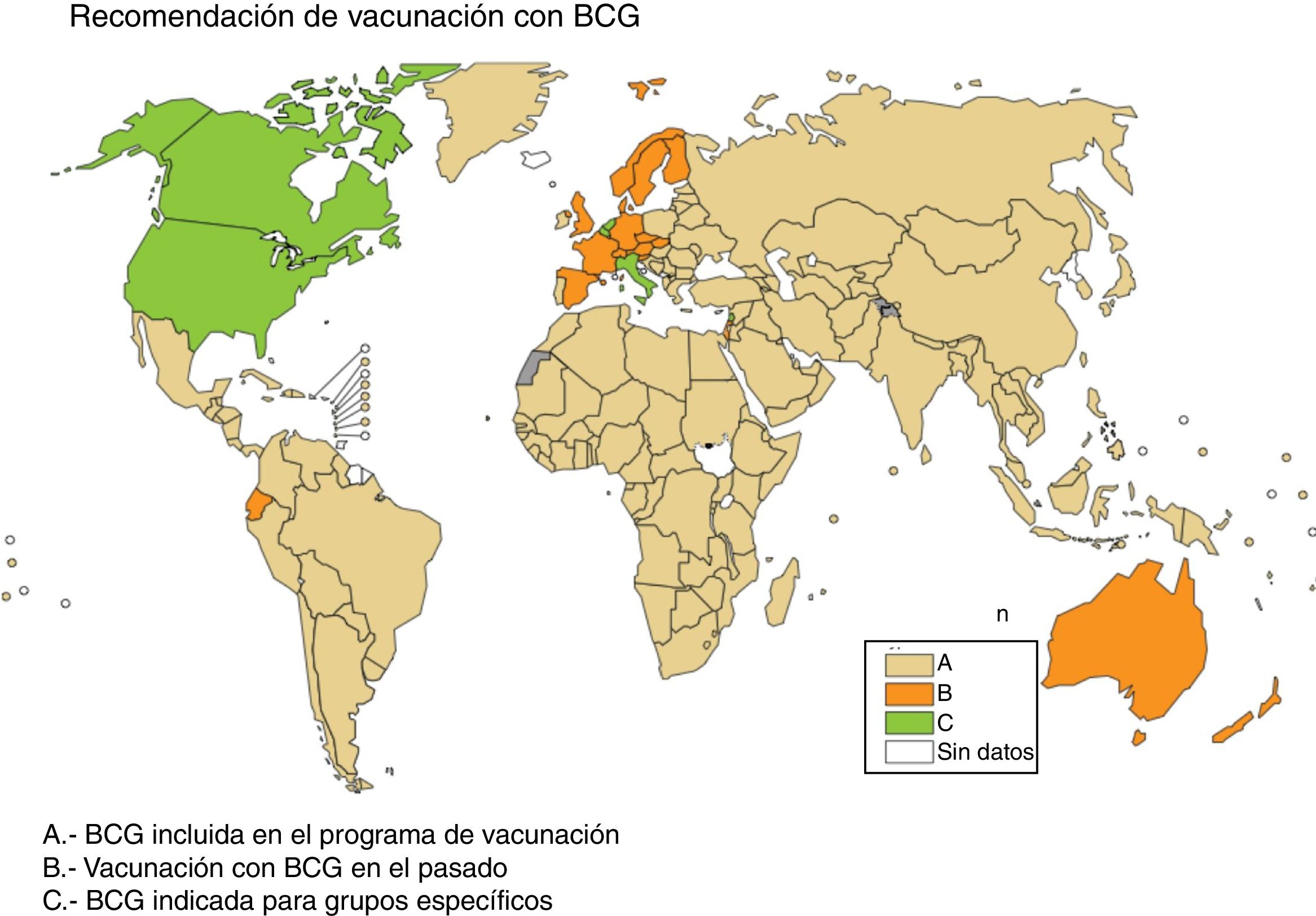
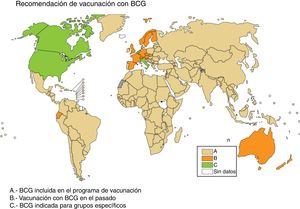
En Europa, en algunos países, como Irlanda, se recomiendan actualmente la vacunación con BCG, mientras que en otros países, como Francia o Portugal, se recomendaba la vacunación con BCG en el pasado, pero no en la actualidad (fig. 2). La información sobre las políticas y prácticas de vacunación con BCG en todo el mundo se puede consultar en <http://www.bcgatlas.org/> y las específicas para Europa en <http://vaccine-schedule.ecdc.europa.eu/Pages/Scheduler.aspx>
Recomendación de vacunación con BCG. En beige los países que incluyen BCG en su programa de vacunación (A), en naranja los países que vacunaron con BCG pero no lo hacen actualmente (B), y en verde los países que BCG solo está indicada en grupos específicos de población (C).
Fuente WHO Global Tuberculosis Report 2017.
Hoy la OMS recomienda la vacunación con BCG en todos los recién nacidos en países con alta incidencia de tuberculosis. BCG no está recomendada para bebés con infección conocida por VIH u otra inmunodeficiencia. En países con alta prevalencia de tuberculosis y VIH es importante tener precaución cuando se administra BCG de forma rutinaria debido al riesgo de enfermedad por BCG diseminada en bebés infectados con VIH. BCG está recomendada en los lactantes asintomáticos nacidos de madres con estado VIH desconocido. En la actualidad, la recomendación es la inmunización rutinaria de BCG durante la infancia, hasta que se pueda implementar un programa de cribado sistemático de VIH.
En países con baja incidencia de tuberculosis se puede considerar la inmunización con BCG en niños ≤5años procedentes de países endémicos. También si el niño está continuamente expuesto a un paciente no tratado o que no responda al tratamiento y que tiene tuberculosis pulmonar infecciosa y no es posible la separación del paciente. También cuando el niño está continuamente expuesto a un paciente que tiene tuberculosis pulmonar infecciosa causada por cepas de M.tuberculosis resistentes a isoniazida y rifampicina y la separación del paciente infeccioso no es posible10.
La Unión Internacional contra la Tuberculosis y Enfermedades Respiratorias (IUATLD) y la OMS han establecido una serie de criterios según los cuales recomiendan que un país cambie de una política de vacunación sistemática con BCG a la vacunación selectiva de grupos de alto riesgo. La recomendación de suspender la vacunación sistemática con BCG en un país determinado sería en caso de que, si existe un sistema de notificación de casos de tuberculosis eficaz, la tasa de notificación anual de tuberculosis pulmonar con baciloscopia sea inferior al 5 por 100.000, o si el riesgo anual de infección tuberculosa es <0,1%. También si la tasa anual de notificación de meningitis tuberculosa es <1 por cada 10 millones de habitantes en los últimos 5años10.
La recomendación de vacunación con BCG para adultos que viajan a áreas endémicas con alta exposición a tuberculosis multirresistente continúa siendo controvertida. Dado el riesgo potencial de fracaso del tratamiento antituberculoso, y ante la baja tasa de complicaciones relacionadas con la vacunación con BCG en individuos inmunocompetentes, se podría recomendar la administración de BCG en individuos no vacunados, tuberculina o IGRA negativos expuestos a tuberculosis multirresistente. Son necesarios más estudios para contrastar la eficacia protectora de BCG en el contexto de la exposición a la tuberculosis multirresistente en adultos10.
La seguridad de la vacuna BCG ha sido probada ampliamente después de más de 4.000 millones de unidades administradas en todo el mundo desde 1921. BCG es una vacuna muy reactogénica pero muy segura y bien tolerada, y produce una reacción local en el lugar de la inyección9. Después de 2-6 semanas de recibir la vacuna aparece una pequeña pápula que aumenta de tamaño y que en la mayoría de los casos progresa a una úlcera. Los nódulos linfáticos cervicales y axilares pueden aumentar de tamaño temporalmente. Después de un período de aproximadamente 3meses, aparecerá una cicatriz, que será permanente.
Contraindicaciones de BCGBCG al nacimiento estaría contraindicada en niños desnutridos y recién nacidos prematuros con un peso al nacer de menos de 2,5kg. Dado que la vacuna BCG es una vacuna viva, también está contraindicada en mujeres embarazadas y pacientes oncológicos o inmunocomprometidos que sufran una inmunodeficiencia congénita o adquirida por fármacos inmunosupresores, por radiación o por infección con VIH. Tampoco se recomienda administrar la vacuna BCG si el paciente ha sido tratado con antibióticos durante los últimos 30días.
BCG también está contraindicada en personas con tuberculosis activa o con prueba de tuberculina positiva o con infección tuberculosa, aunque estudios recientes han demostrado que BCG es segura en personas con infección tuberculosa latente11.
Administración con otras vacunas o productosBCG mejora las respuestas de célulasT y B a otros antígenos vacunales y puede ser co-administrada con cualquier otra vacuna (incluidas otras vacunas vivas) sin que se hayan descrito problemas mayores. La BCG mejora las respuestas de las citocinas Th1 y Th2 a antígenos no relacionados y aumenta la respuesta de anticuerpos en la vacunación oral contra la polio.
La única limitación sería la necesidad de administración en diferentes sitios anatómicos, y no se recomienda administrar ninguna otra vacuna en la misma extremidad dentro de los 3meses posteriores a la administración de BCG10.
Respuesta inmune a BCGSabemos que una inmunidad celular es importante para el control de la tuberculosis, pero no existe un marcador inmunológico que se pueda correlacionar con protección frente a la enfermedad. La respuesta inmune a la inmunización primaria con BCG ha sido evaluada en diferentes estudios en niños que demuestran que hay una inducción asociada a BCG de célulasT polifuncionales CD4+ y CD8+ interferón (IFN-γ)+, interleucina (IL) -2+, factor de necrosis tumoral (TNF-α)+, pero no ha sido posible demostrar una correlación de protección12⋅
Eficacia variable de BCGA pesar de su gran cobertura, el grado de protección de BCG contra las formas respiratorias de tuberculosis sigue siendo objeto de debate3. En lactantes está demostrado que BCG ofrece protección contra las formas diseminadas de tuberculosis (miliar y meníngea)13, mientras que en adolescentes y adultos vacunados al nacer la eficacia de BCG contra las formas pulmonares de la enfermedad es muy variable, dependiendo de la edad de vacunación y del estudio2, considerándose que la inmunidad de BCG disminuye con el tiempo y se recomienda su administración lo más cercana posible al nacimiento14.
Estudios recientes muestran que BCG, a pesar de conferir una protección moderada, dura más de lo que previamente se consideraba, hasta al menos 20años15. Hay muchas y variadas hipótesis sobre por qué hay tal variación en la eficacia de BCG; sin embargo, para ninguna se ha encontrado una respuesta definitiva. Se cree que la sobreatenuación de BCG por la pérdida de antígenos inmunodominantes durante el proceso de subcultivos repetidos podría ser una de las razones de estas diferencias, como dijimos anteriormente, pero no ha sido demostrado8. Numerosos ensayos clínicos sugieren que la revacunación con BCG no mejora su eficacia, lo que podría deberse a una inmunidad preexistente por la infección por micobacterias ambientales no tuberculosas, previas a la vacunación que podrían conducir a un enmascaramiento (masking) o bloqueo (blocking) de la re-vacunación con BCG16.
Beneficios no específicos de la vacunación con BCGUn número creciente de estudios muestran que las vacunas vivas atenuadas reducen la morbimortalidad infantil, lo cual es un hecho admitido hoy en día por la OMS17,18. En algunos países de África Occidental BCG reduce la mortalidad neonatal en más del 40%, principalmente mediante la prevención de sepsis e infecciones respiratorias y fiebre19. Estudios en países donde la mortalidad infantil es muy baja, como en España, han descrito los efectos beneficiosos inespecíficos de la vacunación con BCG al nacimiento, concluyendo que disminuye la hospitalización por infecciones respiratorias y sepsis no relacionadas con tuberculosis a través de un efecto no específico20,21. Recientemente se ha demostrado que BCG puede inducir resistencia inespecífica a patógenos a través de una reprogramación epigenética de los monocitos22,23. Estos efectos se han descrito para células del sistema inmune innato, como macrófagos y células NK (natural killer)24,25. Las vías metabólicas presentan un papel esencial en la inmunidad en monocitos humanos, regulada por mecanismos epigenéticos a nivel de la organización de la cromatina, y ponen de manifiesto el potencial terapéutico que la modulación de estas vías puede tener durante la vacunación26. Cualquier nueva vacuna con mejor eficacia contra las formas respiratorias de tuberculosis deberá conservar estos efectos inespecíficos de BCG.
Investigación y desarrollo de nuevas vacunas contra la tuberculosisDada la falta de protección de BCG contra las formas respiratorias de tuberculosis, en los últimos 20años se ha realizado un enorme esfuerzo en la investigación y el desarrollo de nuevas vacunas contra la tuberculosis27. Tras el descubrimiento de miles de candidatos y de que cientos hayan pasado a ensayos preclínicos en modelos animales, solo unas decenas pasan a ser ensayados en estudios clínicos en humanos. Hay diferentes etapas que cada candidato a vacuna necesita realizar en ensayos clínicos fasei, faseii y faseiii para alcanzar la autorización de comercialización. En Europa, la investigación impulsada por los diferentes Programas Marco de la Comisión Europea ha hecho posible que cientos de candidatos hayan pasado a ensayos preclínicos y varios estén actualmente en ensayos clínicos en humanos28.
Las vacunas más eficaces hoy en uso contra diferentes enfermedades infecciosas inducen anticuerpos neutralizantes confiriendo una inmunidad protectora, mientras que para otras enfermedades, como el sida, la malaria o la tuberculosis, es necesaria una fuerte respuesta de la inmunidad celular29.
Una de las mayores dificultades para encontrar vacunas eficaces contra estas enfermedades es que no existe un marcador inmunológico que pueda predecir la eficacia de una nueva vacuna en estudio, lo que obliga a que sean probadas en largos y costosos estudios de eficacia con miles de voluntarios (faseiib y faseiii) en países endémicos con alta incidencia de estas enfermedades tras obtener datos robustos de seguridad e inmunogenicidad en ensayos previos con decenas (fasei) y luego con centenas (faseii) de voluntarios sanos27.
Primer ensayo clínico de eficacia de una nueva vacuna contra la tuberculosisTras más de 10 años de ensayos clínicos previos, la vacuna MVA85A, desarrollada por la Universidad de Oxford y liderada por la Dra. Helen McShane, realizó el primer ensayo de eficacia de una vacuna contra la tuberculosis en un país endémico, en Worcester, Sudáfrica30. La vacuna MVA85A fue concebida para aumentar la inmunidad en niños previamente vacunados con BCG a los que se les administró el virus de la vacuna modificado de Ankara (MVA) al que se había introducido el gen que codifica para el antígeno mayor de tuberculosis Ag85A. El estudio de eficacia faseiib consistió en un estudio de doble ciego, placebo-control en niños sanos con edades comprendidas entre los 4 y los 6meses, no infectados por VIH y que habían recibido previamente BCG al nacimiento, con un seguimiento cada 3meses durante más de 3años. Un total de 2.797 niños fueron vacunados (1.399 con MVA85A y 1.398 con un placebo). El resultado mostró que 32 niños (2%) de los 1.399 vacunados con BCG+ MVA85A fueron diagnosticados de tuberculosis, frente a 39 niños (3%) de los 1.398 vacunados con BCG + placebo. La diferencia entre los dos grupos no fue significativa y la interpretación del resultado del estudio fue la ausencia de eficacia de MVA8530. Este resultado fue considerado por las agencias financiadoras del estudio como un fracaso.
Para la comunidad científica que trabajamos en vacunas contra la tuberculosis, por el contrario, fue un gran paso adelante en la investigación de nuevas vacunas, ya que este ensayo abre el camino a nuevos estudios de eficacia. El ensayo de eficacia de MVA85 fue el primero en casi cien años después de BCG en los años veinte del sigloxx. El estudio en Worcester fue coordinado por la Iniciativa Sudáfrica para vacunas contra la tuberculosis (SATVI). Años después de este estudio la comunidad científica sigue aprendiendo y sacando conclusiones sobre la inmunología de la enfermedad. Tras 3años de seguimiento de los niños del estudio, se estudió la conversión de la prueba del QuantiFERON (QFT) así como el riesgo de enfermedad. Estos resultados30 muestran que tanto en los niños con unn QFT− (menor de 0,35UI/ml) o QFT+ pero con menos de 4UI/ml, el riesgo de desarrollar tuberculosis es bajo, mientras que los niños con un QFT+ de más de 4UI/ml el riesgo es alto31.
Diversidad de los nuevos candidatos a vacuna en ensayos clínicosTras la publicación de los resultados del primer estudio de eficacia en niños, las agencias de financiación y los investigadores se plantearon cómo diversificar los candidatos de vacunas contra la tuberculosis, ya que la mayoría de los candidatos actuales son vacunas con poca diversidad de antígenos (Ag85A o Ag85B, ESAT6) diseñadas para potenciar una inmunidad previa mediada por célulasT27. En los últimos 10años, dos organizaciones se encargan de coordinar la búsqueda de nuevos candidatos a vacunas en distintas fases preclínicas y en acelerar la aplicación en humanos de las nuevas vacunas obtenidas en el laboratorio. Por un lado, TBVI, la iniciativa europea (TBVI es el acrónimo en inglés de Iniciativa Europea para la Vacuna contra la Tuberculosis) y por otro lado la estadounidense AERAS (apoyada por la Fundación Bill y Melinda Gates).
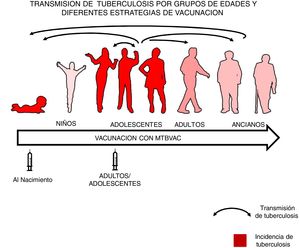
¿Cuál sería la población que debemos vacunar?Tras los resultados negativos del primer estudio de eficacia, se planteó cuál era la población prioritaria para vacunar: ¿niños o adultos? Los estudios de modelización muestran que el mayor impacto de una nueva vacuna contra la tuberculosis sería claramente en adolescentes y adultos, donde la transmisión de la enfermedad es mayor32, ya que aunque la incidencia de la enfermedad es muy importante en niños menores de 5años, no son comunes las formas respiratorias responsables de la transmisión33.
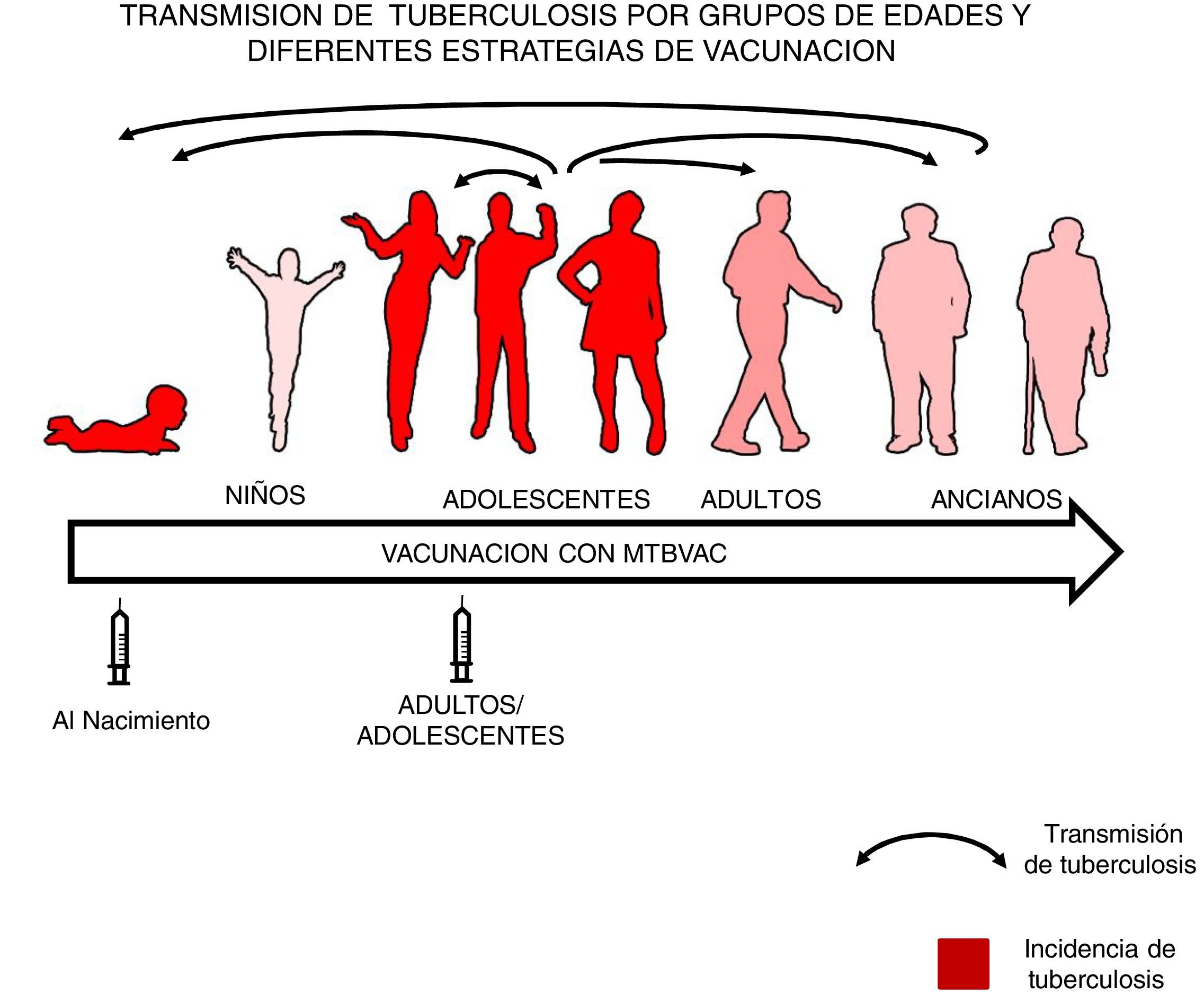
En nuestra opinión, los recién nacidos sanos representan a la población más sensible y sin inmunidad preexistente a BCG o micobacterias ambientales para ensayar la eficacia de una nueva vacuna, dado que el grupo de mayor edad puede conducir a posibles efectos de enmascaramiento y bloqueo a la vacunación16,34. Por ello pensamos que en primer lugar se debería estudiar la eficacia en recién nacidos y, una vez comprobada la eficacia de una nueva vacuna, vacunar a adolescentes y adultos, donde el impacto sobre la tuberculosis será mayor dado que las responsables de esta transmisión son las formas pulmonares34 (fig. 3).
Transmisión de tuberculosis por grupos de edades y diferentes estrategias de vacunación. El papel de los adolescentes y adultos en la transmisión de la enfermedad está indicado por flechas. En color rojo los grupos con mayor incidencia de tuberculosis, niños menores de 5 años y adolescentes. La introducción de una nueva vacuna al nacimiento permitiría la protección de los niños desde el nacimiento haciendo posible estudiar su eficacia en una población naïve no expuesta anteriormente a micobacterias ni previamente con BCG. La vacunación en población adolescente y adulta con formas pulmonares de tuberculosis, tendría un mayor impacto en la transmisión de la enfermedad.
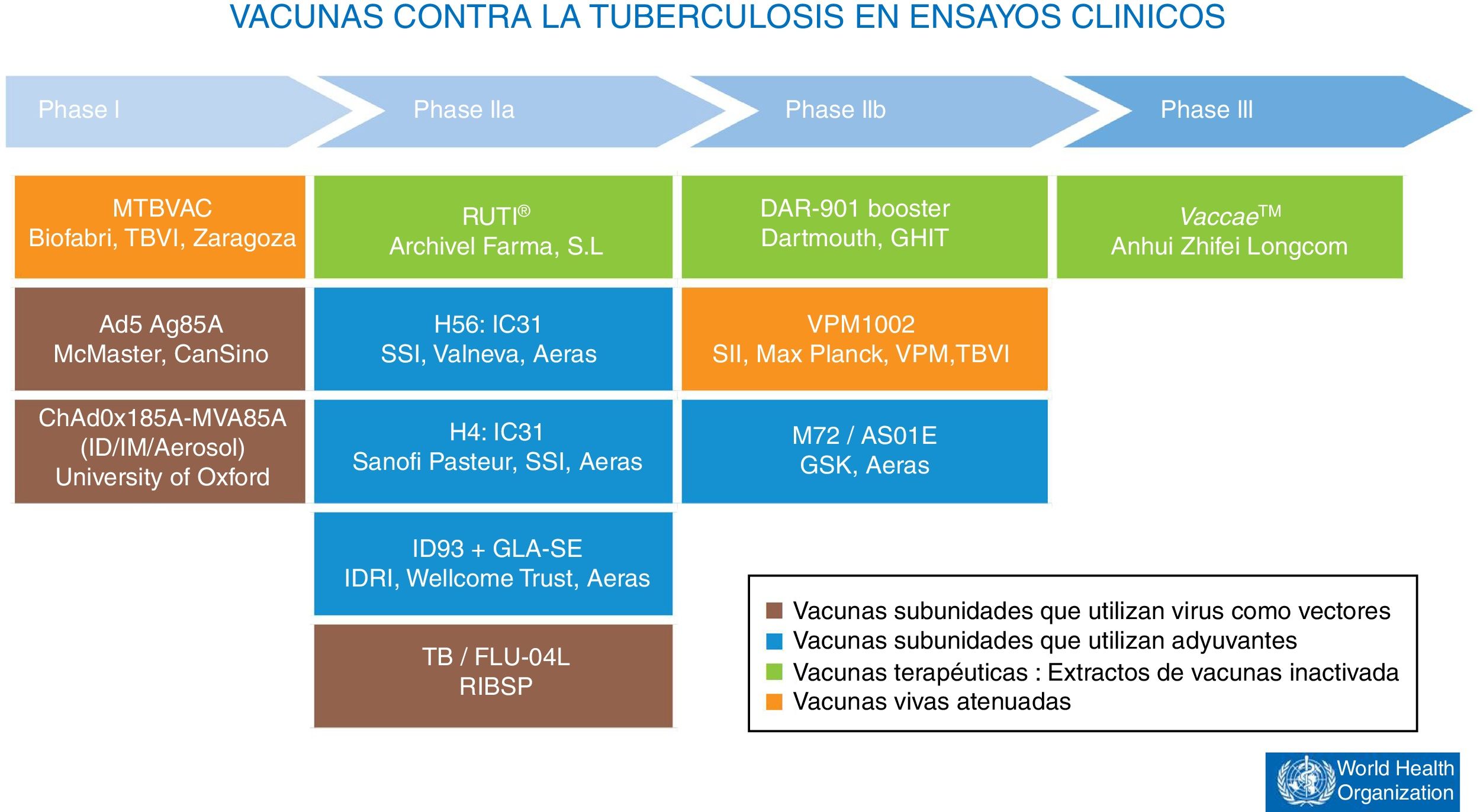
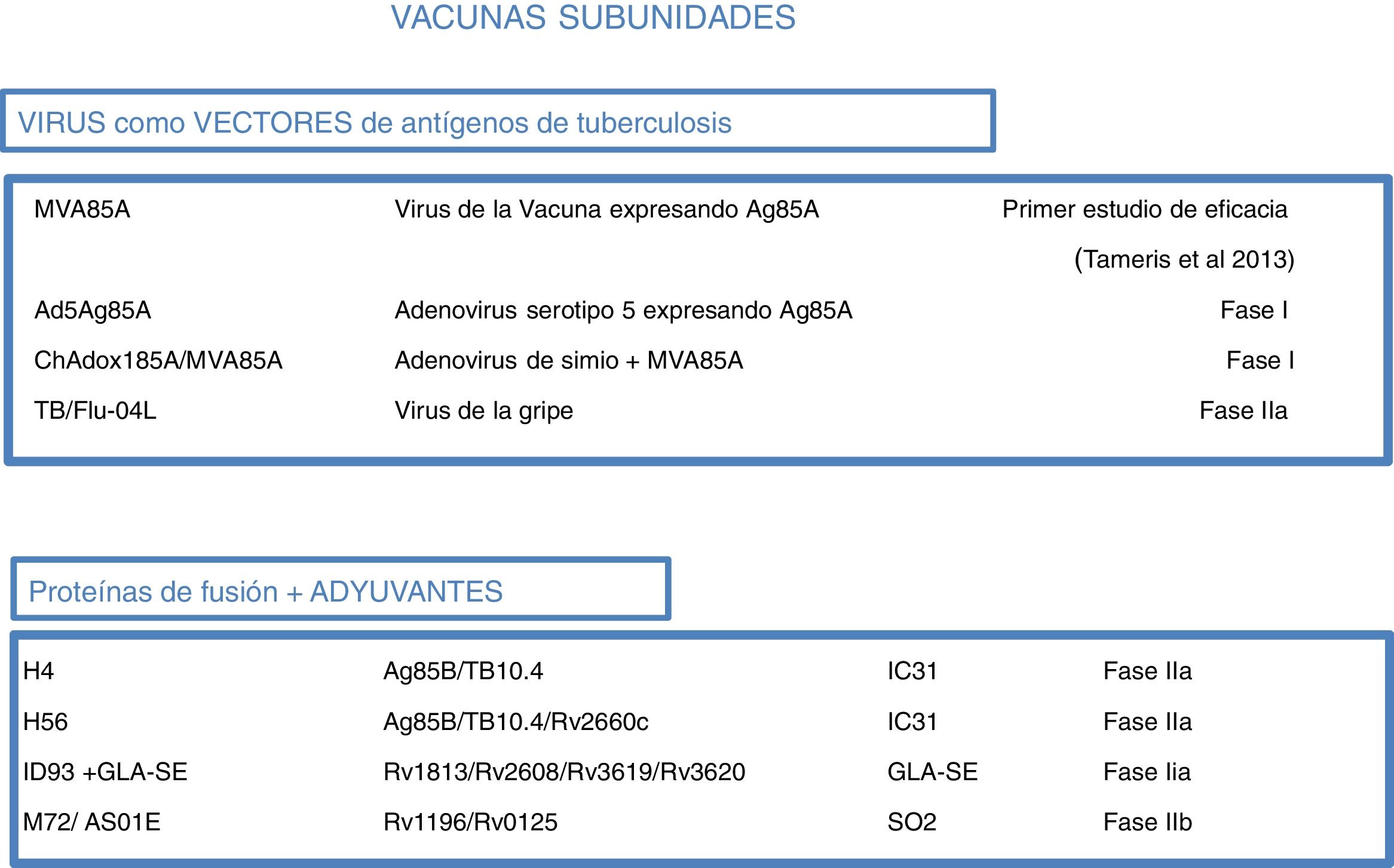
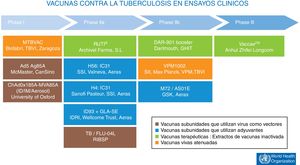
Actualmente hay 12 vacunas contra la tuberculosis en la fase de ensayos clínicos1 (fig. 4). La mayoría de estas vacunas se basan en subunidades en los que los antígenos de M.tuberculosis se expresan como proteínas recombinantes que se formulan con diferentes adyuvantes o bien expresadas por virus recombinantes que se utilizan como vehículos para la administración de antígenos.
Vacunas contra la tuberculosis en ensayos clínicos. En marrón, las vacunas subunidades que utilizan virus como vectores. En azul, las vacunas subunidades que utilizan adyuvantes para su administración. En verde, vacunas terapéuticas compuestas de extractos de vacunas inactivada. En naranja, las vacunas vivas atenuadas.
Fuente WHO Global Tuberculosis Report 2017.
Algunas de estas vacunas hoy en clínica están basadas en micobacterias inactivadas y han sido diseñadas como «vacunas terapéuticas», buscando disminuir los tiempos de tratamiento en las personas infectadas con tuberculosis latente, o bien reducir la probabilidad de recurrencia después de la finalización del tratamiento35. Las dos vacunas terapéuticas en desarrollo clínico comprenden o bien formas inactivadas de micobacterias no tuberculosas, como son VaccaeTM en estudios faseiii de eficacia, o bien fragmentos de pared de M.tuberculosis vehiculizados en liposomas, como es el caso de la vacuna RUTI® actualmente en faseiia de ensayos clínicos36.
Las estrategias de vacunación clásicas buscan prevenir la enfermedad, y es lo que denominamos vacunas profilácticas. En tuberculosis se han desarrollado dos estrategias para el desarrollo de vacunas preventivas: la primera buscaría potenciar la acción de la actual vacuna BCG reforzando su inmunidad, y la segunda, reemplazar a la actual vacuna BCG por una vacuna más eficaz.
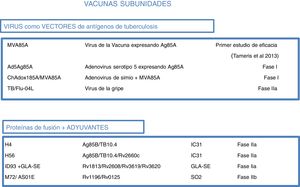
Dado que la mayor parte de la población de países endémicos de tuberculosis ha sido vacunada previamente con BCG al nacer, lo que se busca con las vacunas de refuerzo con antígenos de M.tuberculosis específicos es potenciar a BCG. Una de estas vacunas en ensayo clínico, DAR-901, se basa en una bacteria no tuberculosa inactivada por calor1,37. Otras vacunas subunidades incluyen unicamente, uno o unos pocos antígenos proteicos, específicos de M.tuberculosis y son administradas en vectores virales, o bien están formulados con adyuvantes1 (fig. 5).
Vacunas subunidades en ensayos clínicos. Las vacunas subunidades buscan en individuos previamente vacunados con BCG reforzar con antígenos de M. tuberculosis aumentar su protección. Pueden utilizar diferentes virus como vectores, como Poxvirus (MVA) o adenovirus de distintos orígenes (Ad o ChA) o el virus de la gripe. Otras vacunas subunidades utilizan distintos adyuvantes (IC31, GLA-SE o SO2) para potenciar el efecto inmunogeno de las proteínas de M. tuberculosis. Para cada candidato subunidad se indica la fase de desarrollo clínico en que se encuentra.
Son tres las vacunas subunidades que usan vectores virales utilizando distintos virus y diferentes rutas de administración. Una se encuentra en la faseiia, y es la vacuna TB/FLU-04L, que utiliza el virus de la gripe atenuado como vector recombinante expresando los antígenos Ag85A y ESAT6 y es administrada por vía mucosal. Otras dos se encuentran en fasei de ensayos clínicos, y son las vacunas Ad5Ag85 y ChadAdOx18A-MVA85A. La vacuna Ad5Ag85A está siendo desarrollada por la Universidad de McMaster, en Canadá. Consiste en un vector de adenovirus de serotipo5 que expresa Ag85A y que se administra por vía intramuscular. La vacuna ChAdOx185A, desarrollada por la Universidad de Oxford, se basa en un adenovirus de simio y MVA85A (virus de viruela modificado) que expresan Ag85A por vía sistémica y mucosal.
Otras cuatro vacunas subunidades utilizan distintos adyuvantes para la administración de antígenos de tuberculosis. M72/AS01E, desarrollada por Glaxo, se encuentra en faseiib de ensayos clínicos, y otras tres en faseiia, como son las vacunas H4:IC31 y H56:IC31, desarrolladas por el Statem Serum Institut (SSI) de Copenhague, y la vacuna ID93+ GLA-SE, desarrollada por el Infectious Disease Research Institute (IDRI) en Estados Unidos.
M72/AS01E es una vacuna de subunidad que combina dos antígenos de M.tuberculosis (32A y 39A) con el adyuvante (AS01E). Está siendo probada en un ensayo de eficacia de faseiib en adultos VIH negativos infectados con M.tuberculosis en Kenia, Sudáfrica y Zambia. H4:IC31 es una vacuna de refuerzo BCG que contiene una proteína de fusión de Ag85B y TB10.4, formulada con adyuvante IC31.
La vacuna IC31H56:IC31 combina tres antígenos de M.tuberculosis (Ag85B, ESAT-6 y Rv2660c) y el adyuvante IC31. La vacuna ID93+ GLA-SE contiene cuatro antígenos de M.tuberculosis asociados con virulencia (Rv2608, Rv3619 y Rv3620) o latencia (Rv1813) y el adyuvante GLA-SE.
En las vacunas profilácticas que buscan reemplazar a BCG se considera que la inmunidad que confieren las vacunas vivas induce respuestas inmunes de memoria específicas de larga duración que no se obtienen con las vacunas de subunidades. Este efecto podría estar relacionado con la persistencia o replicación restringida in vivo observada para otras vacunas vivas humanas (por ejemplo, polio, sarampión, fiebre amarilla)38.
Dos son las vacunas que buscan reemplazar a BCG en el nacimiento que se basan en vacunas vivas atenuadas derivadas de M.bovis BCG: la vacuna VPM1002, desarrollada por el Instituto Max Planck de Berlín en faseiia de ensayos clínicos, o de M.tuberculosis, MTBVAC, en fasei de ensayos clínicos y que en 2018 ha iniciado la fase 2a tanto para bebe como para adultos en SATVI, Sudáfrica.
La vacuna VPM1002 se basa en BCG recombinante (rBCG) expresando la listeriolisina de Listeria monocytogenes y con una deleción del gen que codifica para la ureasaC; está diseñada para mejorar la eficacia de BCG mediante la inserción de otros genes. Actualmente se está llevando a cabo un ensayo de faseii en Sudáfrica para evaluar la seguridad y la inmunogenicidad de la vacuna en recién nacidos expuestos o no expuestos al VIH39.
Estudios clínicos de eficacia de MTBVAC: una vacuna viva atenuada del patógeno humanoActualmente no sabemos cuáles son las respuestas inmunológicas ni el tipo preciso de inmunidad duradera que una nueva vacuna contra la tuberculosis debería inducir. Por ello, para comprender la inmunología de la protección contra la enfermedad necesitamos conseguir vacunas efectivas. Dado que, como hemos dicho anteriormente, la mayoría de las vacunas se basan principalmente en un pequeño número de antígenos con diferentes sistemas de administración, con la idea de aumentar la diversidad de las vacunas candidatas, elegimos construir una vacuna viva atenuada a partir de un patógeno de origen humano buscando imitar la infección natural, ya que cerca del 80% de los infectados por tuberculosis latente no sufre una reinfección por M.tuberculosis40 y que al estar la cepa atenuada se elimina el riesgo de desarrollar tuberculosis. Además, el hecho de partir de una bacteria viva hace que se mantenga todo el repertorio antigénico completo del patógeno humano.
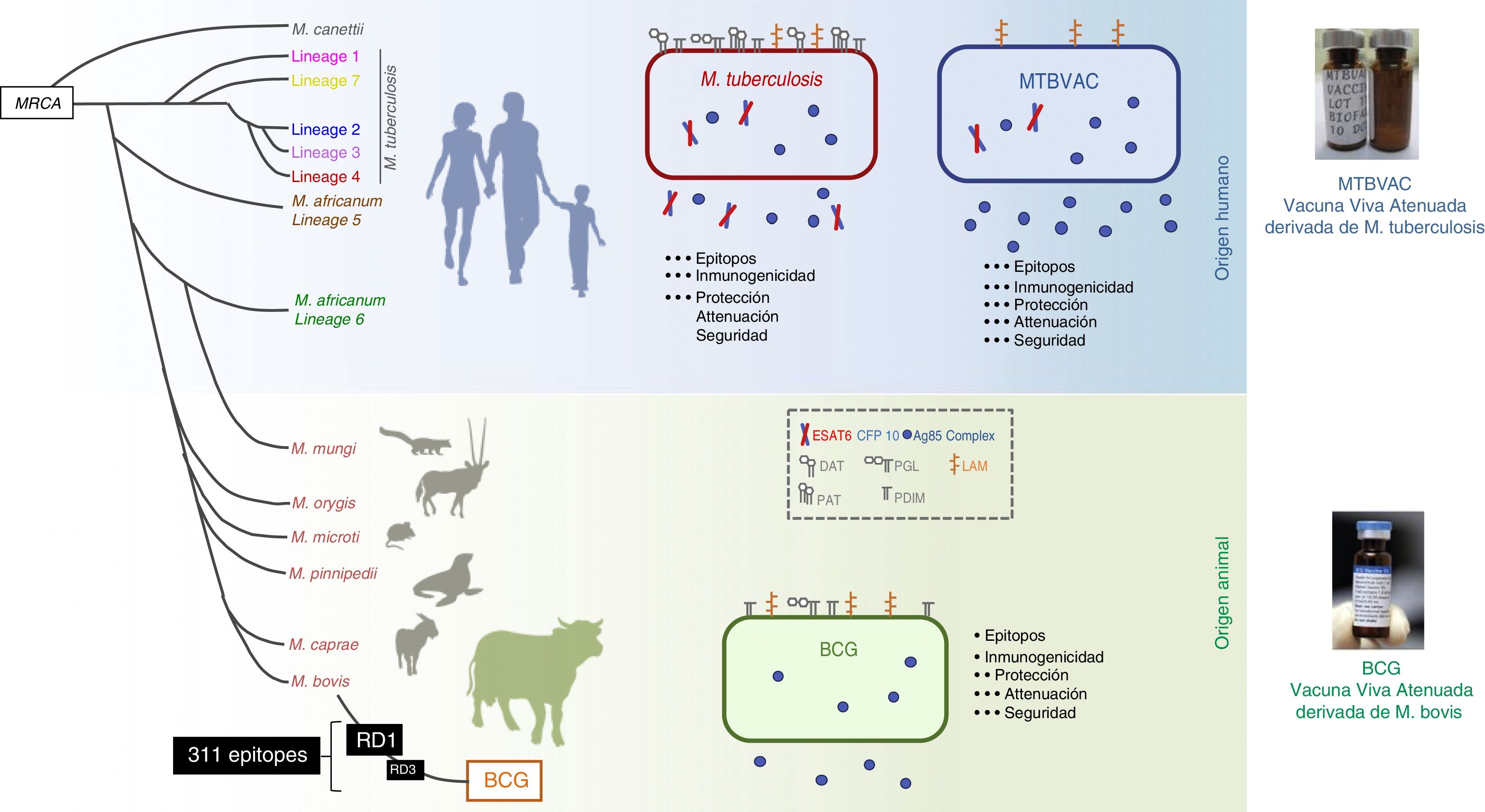
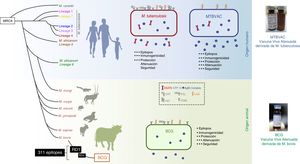
La vacuna MTBVAC es la única vacuna viva atenuada derivada de un aislamiento de M.tuberculosis en ensayos clínicos cumpliendo los requisitos exigidos en el consenso de Ginebra41,42 (fig. 6). Desarrollada por la Universidad de Zaragoza y el Instituto Pasteur con el apoyo de la Iniciativa de Vacuna contra la Tuberculosis (TBVI), MTBVAC muestra una respuesta de célulasT más duradera a diferentes antígenos de M.tuberculosis no presentes en BCG43, y confiere una mejor protección que BCG en diversos modelos animales44,45. El desarrollo industrial y el posterior desarrollo clínico lo realiza la biofarmacéutica española Biofabri, con una amplia experiencia en vacunas vivas atenuadas (CZ veterinaria), evitando el subcultivo que podría dar origen a diferentes cepas, como ocurrió con BCG en el pasado.
Diferencias entre MTBVAC y BCG. La figura muestra la representación de M. tuberculosis, BCG y MTBVAC. BCG ha perdido la región diferencial RD1 que ha llevado a su atenuación. MTBVAC contiene el repertorio antigénico de M. tuberculosis ausente en BCG incluido RD1, y que contiene más de 300 epítopos y al mismo tiempo presentar un perfil de atenuación comparable al BCG.
MTBVAC se construyó a partir de un aislado humano de M.tuberculosis, que pertenece al linaje4 (euroafricano-americano), uno de los linajes más extendidos de M.tuberculosis. La vacuna consiste en dos mutaciones estables mediante la deleción de los genes de virulencia phoP y fadD26. Por tanto, MTBVAC contiene todos los genes presentes en las cepas de M.tuberculosis, incluidos los genes ausentes en M.bovis y delecionados durante los subcultivos de BCG. MTBVAC ha completado el primer ensayo clínico en humanos46. Los resultados de la faseia en adultos mostraron un perfil de seguridad robusta para MTBVAC en las tres dosis probadas hasta llegar a una dosis de 105, equivalente a la utilizada actualmente con BCG47. Los estudios de inmunología mediante estimulación de la sangre de los participantes con BCG o MTBVAC mostraron una correlación dosis/respuesta de linfocitos CD4 polifuncionales. En los voluntarios en los que se administró la misma dosis de MTBVAC que de BCG, el número de individuos que respondieron tras 4 semanas de la vacunación fue mayor en el grupo vacunado con MTBVAC.
La prueba de Elispot para ESAT6 y CFP10, que se utiliza para diferenciar individuos vacunados con BCG e infectados por tuberculosis, fue negativo para todos los vacunados con MTBVAC47 a los 7meses después de la vacunación, pero se pudo observar un tendencia de la respuesta específica contra CFP10-ESAT 6 en los participantes vacunados con MTBVAC en comparación con BCG42.
Una de las principales diferencias entre las vacunas BCG y MTBVAC es que un gran número de epítopos ausentes en BCG está presente en MTBVAC. Podemos decir que MTBVAC posee un 50% más de epítopos reconocidos por célulasT humanas en comparación con BCG. Además, MTBVAC secreta más proteínas del complejo Ag85 que BCG48 y, a diferencia de BCG, MTBVAC secreta Ag85B. MTBVAC produce los principales antígenos delecionados en todas las cepas de BCG y presentes en la región RD1, como son ESAT6 y CFP1042. Nuestros estudios recientes muestran la importancia del reconocimiento de estos antígenos por parte del huésped, y solo los ratones cuyos MHC son capaces de reconocer ESAT6/CFP10 están mejor protegidos frente a la infección, lo que demuestra que la eficacia protectora de MTBVAC se asocia con la respuesta mediada por célulasT a CFP10/ESAT6, que pueden ser importantes para la inmunidad49.
El plan de desarrollo clínico para MTBVAC considera como primer objetivo la vacunación en recién nacidos, dado que esta población no ha estado previamente expuesta a micobacterias ambientales ni a vacunados previamente con BCG. Es importante remarcar la importancia de la vacunación de esta población dada la alta incidencia de tuberculosis en bebés menores de 5años (muy similar a los adolescentes)33.
En la actualidad, la faseib en bebés se está finalizando en SATVI en Worcester, donde los recién nacidos fueron vacunados con dosis crecientes de MTBVAC y la vacunación con la dosis más alta finalizó en septiembre de 2016. Tras más de un año de seguimiento no se han descrito efectos indeseables mayores relacionados con la vacuna, y los resultados de inmunología se espera que estén listos en el segundo semestre de 2018 (ClinicalTrials.gov Identifier: NCT02729571).
Futuros estudios clínicos de eficacia de MTBVACLa Unión Europea, mediante su programa European and Developing Countries Clinical Trials Partnership (EDCTP), aprobó recientemente la financiación de la faseiia en bebés. Esta faseiia, de búsqueda de dosis óptima en recién nacidos (VIH no expuesto, BCG sin tratamiento previo, sin exposición familiar conocida a tuberculosis), tiene como objetivo principal evaluar la seguridad y la reactogenicidad del MTBVAC en dosis crecientes, en comparación con la vacuna BCG, y evaluar la inmunogenicidad de MTBVAC con las tres dosis crecientes en comparación con la vacuna BCG. El objetivo secundario es evaluar la dinámica de la conversión y reversión QFT inducida por la vacuna MTBVAC. Un total de 99 recién nacidos serán vacunados (75 +24). Cohorte 1: 25 con cada dosis diferente de MTBVAC y 24 con BCG. En 2 sitios adicionales —Instituto Pasteur Madagascar y Saint Louis Senegal— se estudiará la epidemiología para preparar futuros ensayos de eficacia.
El segundo objetivo para el desarrollo clínico de MTBVAC son los adolescentes/adultos. El estudio aprobado recientemente por el Congreso de los Estados Unidos y el National Institutes of Health (NIH), coordinado por AERAS, se iniciará en 2018. El ensayo consistirá en un estudio de seguridad, inmunogenicidad y escalada de dosis en adultos con y sin infección latente de tuberculosis, también en Sudáfrica (ClinicalTrials.gov Identifier: NCT02933281). El objetivo principal es estudiar la seguridad y la reactogenicidad de MTBVAC comparado con BCG en adultos, y como objetivo secundario, estudiar la inmunogenicidad del MTBVAC a cuatro dosis crecientes medida por análisis de sangre completa y tasas de conversión de QuantiFERON en adultos QFT-negativos.
Las vacunas vivas, como MTBVAC, son sólidos candidatos para «reemplazar a BCG» y para ser utilizadas donde más se necesitan, es decir, en los países con mayor incidencia de tuberculosis, una vez que podamos demostrar que MTBVAC es mejor que BCG. El desafío que tenemos por delante es la planificación de ensayos clínicos de eficacia en países con alta incidencia de tuberculosis, que podría acelerarse en gran medida mediante la identificación de marcadores de protección.
FinanciaciónEste trabajo ha sido financiado por el Ministerio de Economía y Competitividad (BIO2014-5258P) y la Unión Europea dentro del programa H2020 (TBVAC2020 643381) y European & Developing Countries Clinical Trials Partnership (EDCTP) RIA2016V-1637.
Conflicto de interesesCM, JG y NA son inventores de patentes relacionadas con la vacuna contra la tuberculosis cuyo titular es la Universidad de Zaragoza y de las cuales la empresa biotecnológica española de Biofabri es licenciataria en exclusividad.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.elsevier.es/es-revista-enfermedades-infecciosas-microbiologia-clinica-28-formacion.