Las vacunas profilácticas frente al virus del papiloma humano (VPH) se consideran la intervención más efectiva para el control de la carga de enfermedad relacionada con el VPH. Este artículo revisa los principales ensayos clínicos de faseii/iii realizados con la vacuna bivalente (VPH16/18), tetravalente (VPH6/11/16/18) y la recientemente aprobada vacuna nonavalente (VPH6/11/16/18/31/33/45/52/58).
Los ensayos clínicos de faseii y iii con las vacunas bivalente y tetravalente demuestran la seguridad, inmunogenicidad y eficacia de ambas vacunas en la prevención de infecciones por VPH y lesiones precancerosas, especialmente si se administran en adolescentes antes de la exposición al virus. Los ensayos clínicos con la vacuna nonavalente también muestran su seguridad, inmunogenicidad y eficacia en la prevención de infección y enfermedad asociada con los tipos vacunales, y sugieren el potencial de la vacuna para reducir la carga de enfermedad asociada al VPH.
Informes poscomercialización en países con programas de vacunación sistemática y altas coberturas sugieren una efectividad muy alta a nivel poblacional, con descensos en la prevalencia de los VPH relacionados con la vacuna, y en la incidencia de verrugas genitales y lesiones cervicales de alto grado.
Human papillomavirus (HPV) related disease remains a major cause of morbidity and mortality worldwide. Prophylactic vaccines have been recognized as the most effective intervention to control for HPV-related diseases. This article reviews the major phaseii/iii trials of the bivalent (HPVs16/18), quadrivalent (HPVs6/11/16/18), and the recently approved 9-valent vaccine (HPVs6/11/16/18/31/33/45/52/58).
Large trials have been conducted showing the safety, immunogenicity and high efficacy of the bivalent and quadrivalent vaccines in the prevention of pre-invasive lesions and infection, especially when administered at young ages before exposure to HPV. Trials of the 9-valent vaccine have also demonstrated the safety, immunogenicity and efficacy of the vaccine in the prevention of infection and disease associated with the vaccine types, and its potential to substantially increase the overall prevention of HPV-related diseases.
Post-licensure country reports have shown the recent and early impact of these vaccines at population level after the implementation of established HPV vaccination programs, including decreases in the prevalence of vaccine HPV types, the incidence of genital warts, and the incidence of high-grade cervical abnormalities. If widely implemented, current HPV vaccines may drastically reduce the incidence of cervical cancer and other HPV-related cancers and diseases.
El presente artículo revisa los principales resultados de los ensayos clínicos de las vacunas de partículas similares a virus (VLP) frente al virus del papiloma humano (VPH) publicados hasta febrero de 2015, incluyendo los ensayos de la vacuna tetravalente (Gardasil®) y la vacuna nonavalente (Gardasil®9) (Merck & Co., Inc., Whitehouse Station, NJ, Estados Unidos) y de la vacuna bivalente (Cervarix™, GlaxoSmithKline Biologicals, Rixensart, Bélgica). Los resultados de los ensayos clínicos de la vacuna tetravalente y de la vacuna bivalente se presentan juntos. Los resultados de la recientemente aprobada vacuna nonavalente se incluyen como un apartado separado. Este artículo actualiza los contenidos de otra revisión recientemente publicada1.
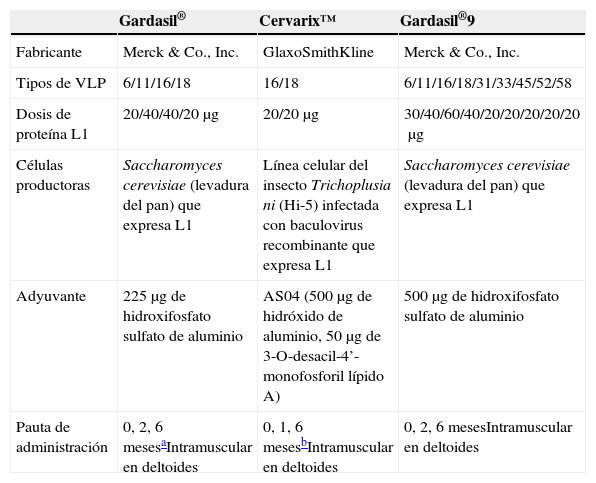
Formulación de las vacunas frente al virus del papiloma humanoLas 3 vacunas —bivalente, tetravalente y nonavalente— son vacunas compuestas principalmente por partículas similares al virus (VLP), las cuales se autoensamblan a partir de copias de L1 (la proteína estructural principal del virus), dando lugar a una estructura similar a la cápside del virus y que es capaz de inducir la producción de anticuerpos protectores frente al virus auténtico2. Las VLP son partículas noinfecciosas y nooncogénicas, puesto que carecen de ADN viral.
Las 3 vacunas difieren en algunos aspectos, como la valencia, la dosis, los adyuvantes y el sistema de producción (tabla 1)3,4.
Características de las vacunas VLP del VPH
| Gardasil® | Cervarix™ | Gardasil®9 | |
|---|---|---|---|
| Fabricante | Merck & Co., Inc. | GlaxoSmithKline | Merck & Co., Inc. |
| Tipos de VLP | 6/11/16/18 | 16/18 | 6/11/16/18/31/33/45/52/58 |
| Dosis de proteína L1 | 20/40/40/20μg | 20/20μg | 30/40/60/40/20/20/20/20/20μg |
| Células productoras | Saccharomyces cerevisiae (levadura del pan) que expresa L1 | Línea celular del insecto Trichoplusia ni (Hi-5) infectada con baculovirus recombinante que expresa L1 | Saccharomyces cerevisiae (levadura del pan) que expresa L1 |
| Adyuvante | 225μg de hidroxifosfato sulfato de aluminio | AS04 (500μg de hidróxido de aluminio, 50μg de 3-O-desacil-4’-monofosforil lípido A) | 500μg de hidroxifosfato sulfato de aluminio |
| Pauta de administración | 0, 2, 6 mesesaIntramuscular en deltoides | 0, 1, 6 mesesbIntramuscular en deltoides | 0, 2, 6 mesesIntramuscular en deltoides |
La vacuna bivalente contiene VLP de VPH16 y 18, causantes del 70% de los casos de cáncer de cuello uterino, y de fracciones variables de los cánceres de vulva, vagina, pene, ano y orofaringe asociados al VPH7,8. La vacuna tetravalente, además de VLP de VPH16 y 18, contiene VLP de VPH6 y 11, causantes de aproximadamente el 90% de las verrugas genitales externas9. La recientemente aprobada vacuna nonavalente, además de los 4 tipos de VPH incluidos en la vacuna tetravalente, contiene VLP de VPH31, 33, 45, 52 y 58, responsables de un 20% adicional de casos de cáncer de cuello uterino7.
Otra diferencia es la elección del adyuvante. Las vacunas utilizan distintas sales de aluminio. La vacuna tetravalente y la nonavalente utilizan solo un adyuvante de aluminio (hidroxifosfato sulfato de aluminio), mientras que el sistema adyuvante de la vacuna bivalente, denominado AS04, contiene monofosfosforil lípido A (MPL), una forma detoxificada de lipopolisacárido e hidróxido de aluminio2. Los adyuvantes basados en sales de aluminio inducen una respuesta tipo Th2. GlaxoSmithKline ha publicado que los títulos de anticuerpos anti-VLP en mujeres se doblan cuando las VLP se formulan con AS04 respecto a cuando lo hacen con hidróxido de aluminio10.
Características de los ensayos clínicos de eficaciaSe han realizado diversos estudios multicéntricos de faseii y de faseiii para evaluar la eficacia de las vacunas VPH, destacando los estudios FUTUREI, FUTUREII, FUTUREIII para la vacuna tetravalente, y los estudios PATRICIA, Costa Rica Vaccine Trial (CVT) y VIVIANE para la vacuna bivalente11-17. Todos estos estudios son ensayos clínicos aleatorizados, doble ciego, con uso de placebo en el grupo control, diseñados para hacer un seguimiento de las mujeres durante al menos 4años y generalmente realizados en mujeres jóvenes (media de edad, 20años), excepto los ensayos VIVIANE y FUTUREIII, que incluyeron a mujeres de más de 25años y de 24 a 45años, respectivamente.
En el caso de la vacuna nonavalente, también se han realizado diversos estudios multicéntricos de faseiii de eficacia, seguridad e inmunogenicidad que están en proceso de publicación18.
En estos estudios, la prevención del cáncer cervical y otros cánceres anogenitales no se pudo plantear como variable de eficacia viable por no considerarse un resultado éticamente válido y porque el tamaño muestral necesario, así como la duración del ensayo, serían prácticamente inasumibles.
Por ello, se determinó que la variable de eficacia utilizada fuese la neoplasia intraepitelial cervical (CIN) grado2 o más grave (CIN2+). El CIN2+ se considera el verdadero e inmediato precursor del carcinoma invasivo de cuello de útero y fue recomendado por la FDA y otras autoridades reguladoras como la variable clínica sustituta del cáncer de cuello uterino. Los análisis de final de estudio fueron diseñados para tener suficiente poder estadístico como para evaluar la eficacia ante CIN3, el más inmediato y más ampliamente aceptado como precursor real del cáncer cervical.
No obstante, basándose en las últimas evidencias científicas, la International Agency for Research on Cancer (IARC) recomienda que para los nuevos estudios se use la infección persistente por VPH durante 6meses o más como criterio de valoración para evaluar la eficacia de la vacuna, y que la reducción en la enfermedad sea verificada en el seguimiento poscomercialización19.
Los resultados de los ensayos clínicos se expresan según varios tipos de análisis: a)análisis por protocolo (ATP): solo incluyen a los participantes que cumplen todos los criterios del protocolo del ensayo clínico y se considera que son los que mejor evalúan la eficacia de la vacuna cuando se administra en condiciones idóneas; b)análisis por intención de tratar (ITT): incluyen a todos los participantes en el ensayo que hayan recibido al menos una dosis de la vacuna independientemente de la existencia de infección prevalente o lesiones asociadas a los tipos vacunales y pueden considerarse una aproximación de la efectividad de la intervención en la población general, y c)análisis por intención de tratar modificada (MITT-naïve): ocupan un terreno intermedio entre los 2 anteriores y sirven para estimar la efectividad real en distintos subgrupos de la población. En estos análisis no se tiene en cuenta el cumplimiento del protocolo, pero se incluyen solamente a las mujeres naïve, es decir, las que son negativas para VPH al inicio del estudio (para más información, consultar Bruni et al.1).
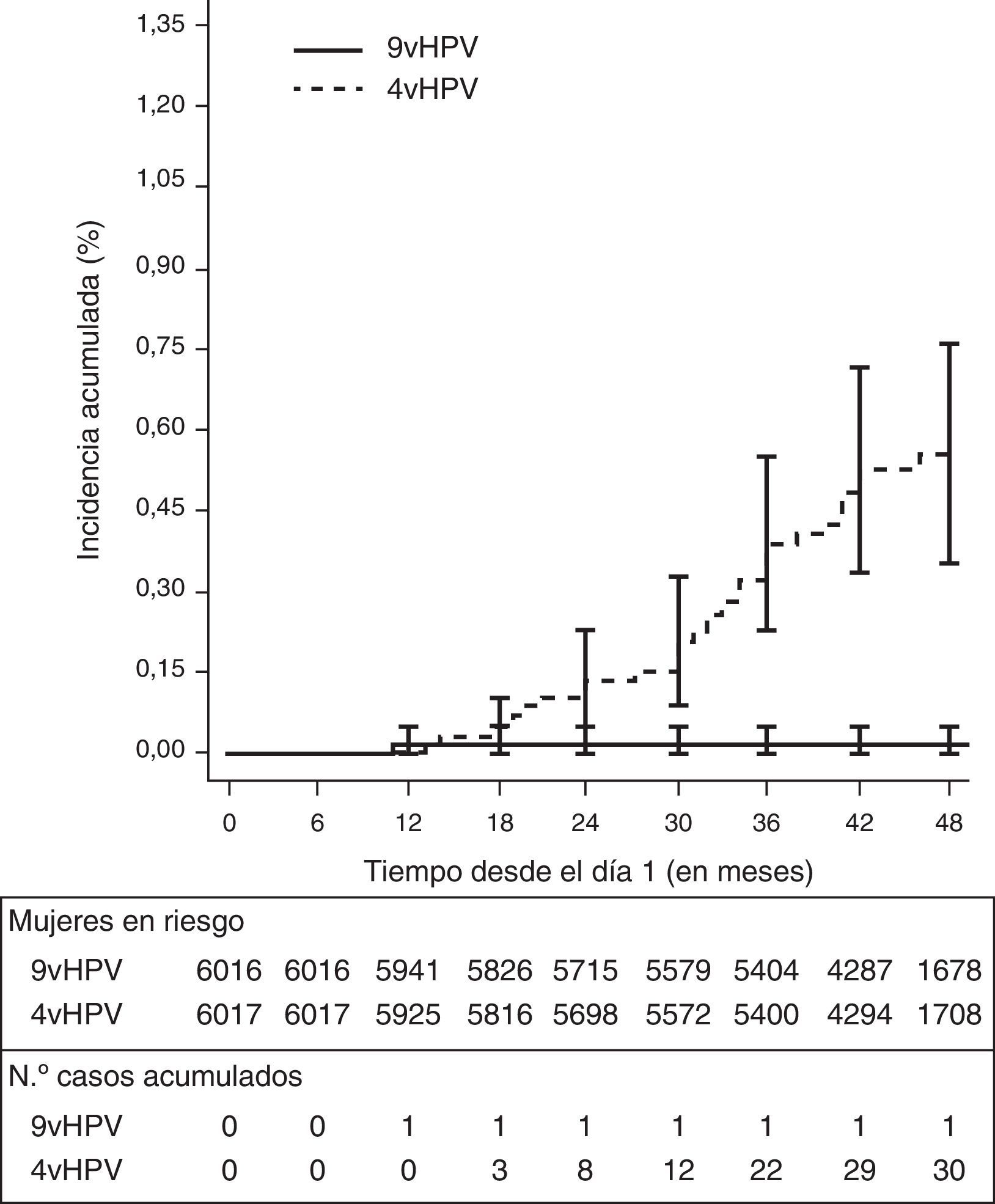
Es importante resaltar que las medidas de impacto utilizadas para presentar los resultados (eficacia y diferencia en la tasa de enfermedad entre vacunados y controles) no son medidas absolutas del funcionamiento de una vacuna, sino que son dependientes del tiempo. La dependencia es más pronunciada en los análisis por intención de tratar que en los análisis por protocolo, y para las lesiones de alto grado más que para las variables de eficacia de infección o de lesiones de bajo grado (fig. 1)11,18,20,21.
Curvas de tiempo hasta el evento la adquisición de CIN2/3, VIN2/3, VaIn2/3, AIS y cáncer de cuello uterino, vagina o vulva relacionados con VPH 31/33/45/52/58 en el análisis por protocolo (ATP).
AIS: adenocarcinoma in situ; CIN2/3: neoplasia intraepitelial cervical grado 2 o 3; VaIN2/3: neoplasia intraepitelial vaginal grado 2 o 3; VIN2/3: neoplasia intraepitelial vulvar grado 2 o 3.
Fuente: adaptada de Joura et al.18.
Aunque los resultados de los ensayos clínicos de las vacunas VPH tetravalente y bivalente se presentan juntos, hay que ser cautelosos a la hora de comparar los resultados debido a las diferencias en el diseño de los ensayos, análisis estadísticos y metodologías utilizadas para generar los datos.
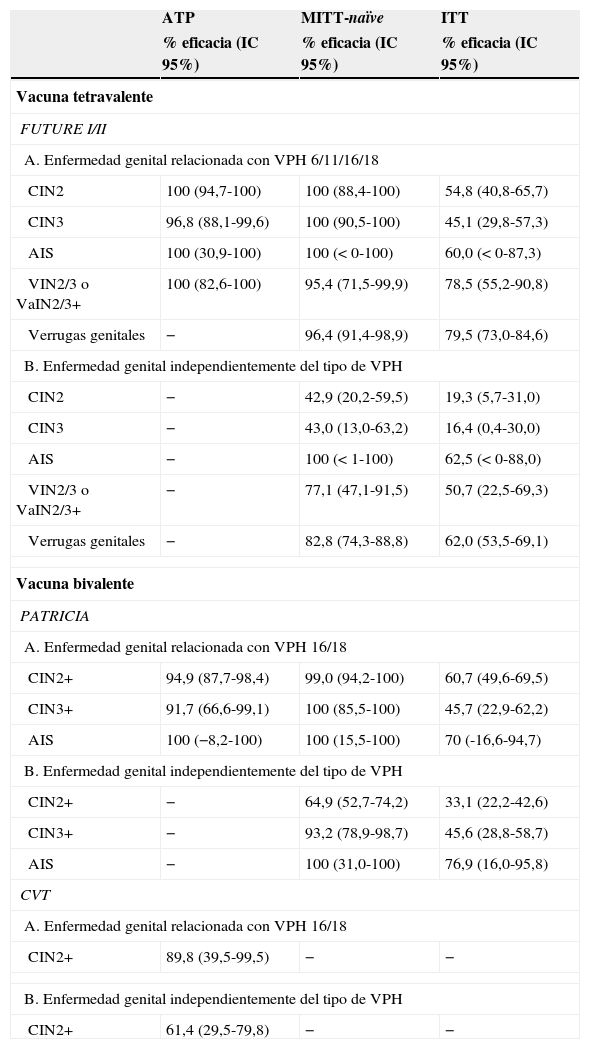
Eficacia profiláctica frente a los tipos del VPH incluidos en la vacuna en mujeres jóvenes (16-26 años)La tabla 2 resume los resultados finales de eficacia profiláctica en mujeres jóvenes obtenidos para las vacunas tetravalente y bivalente en los ensayos clínicos de faseiii frente a infección persistente y enfermedad genital asociada a los tipos del VPH vacunales. La eficacia fue consistentemente elevada tanto en las cohortes ATP (análisis por protocolo) como en las ITT (análisis por intención de tratar).
Eficacia profiláctica de las vacunas VPH frente a lesiones anogenitales
| ATP | MITT-naïve | ITT | |
|---|---|---|---|
| % eficacia (IC 95%) | % eficacia (IC 95%) | % eficacia (IC 95%) | |
| Vacuna tetravalente | |||
| FUTURE I/II | |||
| A. Enfermedad genital relacionada con VPH 6/11/16/18 | |||
| CIN2 | 100 (94,7-100) | 100 (88,4-100) | 54,8 (40,8-65,7) |
| CIN3 | 96,8 (88,1-99,6) | 100 (90,5-100) | 45,1 (29,8-57,3) |
| AIS | 100 (30,9-100) | 100 (< 0-100) | 60,0 (< 0-87,3) |
| VIN2/3 o VaIN2/3+ | 100 (82,6-100) | 95,4 (71,5-99,9) | 78,5 (55,2-90,8) |
| Verrugas genitales | − | 96,4 (91,4-98,9) | 79,5 (73,0-84,6) |
| B. Enfermedad genital independientemente del tipo de VPH | |||
| CIN2 | − | 42,9 (20,2-59,5) | 19,3 (5,7-31,0) |
| CIN3 | − | 43,0 (13,0-63,2) | 16,4 (0,4-30,0) |
| AIS | − | 100 (< 1-100) | 62,5 (< 0-88,0) |
| VIN2/3 o VaIN2/3+ | − | 77,1 (47,1-91,5) | 50,7 (22,5-69,3) |
| Verrugas genitales | − | 82,8 (74,3-88,8) | 62,0 (53,5-69,1) |
| Vacuna bivalente | |||
| PATRICIA | |||
| A. Enfermedad genital relacionada con VPH 16/18 | |||
| CIN2+ | 94,9 (87,7-98,4) | 99,0 (94,2-100) | 60,7 (49,6-69,5) |
| CIN3+ | 91,7 (66,6-99,1) | 100 (85,5-100) | 45,7 (22,9-62,2) |
| AIS | 100 (−8,2-100) | 100 (15,5-100) | 70 (-16,6-94,7) |
| B. Enfermedad genital independientemente del tipo de VPH | |||
| CIN2+ | − | 64,9 (52,7-74,2) | 33,1 (22,2-42,6) |
| CIN3+ | − | 93,2 (78,9-98,7) | 45,6 (28,8-58,7) |
| AIS | − | 100 (31,0-100) | 76,9 (16,0-95,8) |
| CVT | |||
| A. Enfermedad genital relacionada con VPH 16/18 | |||
| CIN2+ | 89,8 (39,5-99,5) | − | − |
| B. Enfermedad genital independientemente del tipo de VPH | |||
| CIN2+ | 61,4 (29,5-79,8) | − | − |
AIS: adenocarcinoma in situ; ATP: análisis por protocolo; CIN: neoplasia intraepitelial cervical; CIN2+: CIN grado 2 o más severa; ITT: análisis por intención de tratar; MITT: análisis por intención de tratar modificada; VaIN: neoplasia intraepitelial vaginal; VIN: neoplasia intraepitelial vulvar; VPH: virus del papiloma humano; CVT: Costa Rica Vaccination Trial.
Fuentes: Lehtinen et al.11, Muñoz et al.20, Kjaer et al.21 y Hildesheim et al.24.
Los análisis finales de los estudios FUTUREI/II demostraron una eficacia del 100% de la vacuna tetravalente frente a CIN3 relacionado con los tipos de VPH vacunales (VPH6, 11, 16 y 18) en mujeres susceptibles o naïve al genotipo relevante (MITT-naïve)20. La eficacia frente a CIN3 fue menor en el análisis por intención de tratar (ITT), del 45,1%, ya que este análisis incluye mujeres con infección prevalente al inicio del estudio (tabla 2). La eficacia frente a CIN3 fue menor en los análisis que no tenían en cuenta el tipo de VPH. Se observó una eficacia superior al 95% y al 75% para VIN2/3 y/o VaIN2/3+ y verrugas genitales relacionadas con los tipos vacunales en las cohortes naïve y por intención de tratar, respectivamente. La eficacia para estas lesiones también fue elevada cuando no se tenía en cuenta el tipo de VPH, lo que demuestra la predominancia de VPH6, 11, 16 y 18 en las lesiones genitales externas de las mujeres jóvenes. La disminución en las tasas absolutas fue particularmente alta en las verrugas genitales, que pasaron de 1,0 a 0,2 casos en la cohorte naïve y de 1,2 a 0,4 casos por 100 mujeres-año en la cohorte por intención de tratar, independientemente del tipo de VPH. Esto se debe a la alta incidencia de verrugas genitales y su rápida progresión desde infección incidente a enfermedad clínica.
Vacuna bivalenteEl ensayo PATRICIA muestra una eficacia frente a CIN3+ del 100% en el análisis de la cohorte naïve para los tipos de VPH relevantes al inicio de la vacunación (MITT-naïve)11. Cabe destacar la elevada eficacia, del 93,2% frente a CIN3+, en el análisis de las mujeres naïve, independientemente del tipo de VPH. Esta eficacia frente a CIN3+ disminuyó hasta el 45,7% si se incluían las mujeres con infección prevalente al inicio del estudio (análisis ITT) (tabla 2). La disminución absoluta en las tasas de enfermedad fue de 0,13 casos por 100 mujeres-año en la cohorte naïve. Aunque los resultados aún no se han publicado, la vacuna también ha demostrado una eficacia frente VIN1+ y VaIN1+ relacionados con VPH16 y 18 del 75,1% en el análisis por protocolo y del 73,1% en el análisis por intención de tratar22.
Un estudio independiente de Costa Rica confirmó la alta eficacia de la vacuna bivalente frente a infección persistente por VPH16 y 18 (90,9% en el análisis por protocolo y de 49,0% en el análisis por intención de tratar), resultados muy similares a los obtenidos en el ensayo PATRICIA. Los análisis por edad mostraron que la eficacia y la disminución absoluta de las tasas de infección eran muy similares entre los grupos de edad en la cohorte ATP, pero variaban en la cohorte ITT, que pasaba del 68,9% en las mujeres de 18-19años al 21,8% en las de 24-25años al año de la vacunación (p de tendencia =0,005). Estos datos sugieren que el máximo beneficio se obtiene cuando se administra la vacuna a mujeres jóvenes antes del inicio de relaciones sexuales23. Los análisis de eficacia frente a infección anal y frente a infección oral en muestras obtenidas en este mismo estudio sugieren una alta protección en las mujeres jóvenes, y especialmente si son naïve al inicio del ensayo24.
Consideraciones conjuntas sobre la eficacia en mujeres jóvenes de las vacunas VPH bivalente y tetravalenteEs importante destacar que la menor eficacia observada en los análisis por intención de tratar frente a la elevada eficacia en población naïve indica que la vacuna no tiene actividad terapéutica frente a infecciones o lesiones presentes en el momento de la vacunación. Por tanto, la vacunación aportará mayor potencial preventivo cuanto menos expuesta al VPH haya estado previamente la mujer, y totalmente si se vacuna antes del inicio de relaciones sexuales.
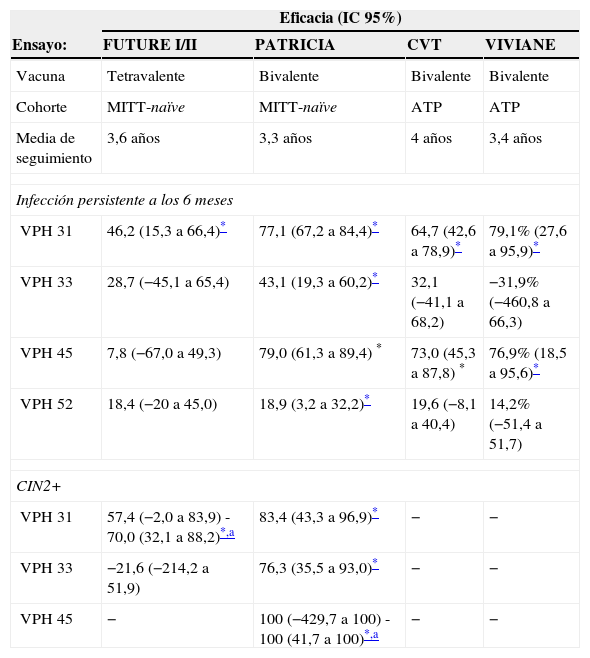
Protección cruzada: eficacia profiláctica frente a tipos de VPH no vacunalesTanto la vacuna tetravalente como la bivalente han demostrado evidencia de diversos grados de protección cruzada frente a genotipos de VPH no vacunales13,23,25-27. La protección cruzada es de especial importancia, puesto que los tipos de VPH no incluidos en estas vacunas se asocian aproximadamente con el 30% de los cánceres cervicales a nivel mundial7.
En los estudios FUTUREI/II y PATRICIA, realizados en mujeres jóvenes, la vacuna bivalente demostró eficacia significativa frente a VPH31, 33, 45 y 52, y la vacuna tetravalente frente al VPH31 (tabla 3)25,26. La vacuna bivalente demostró eficacia significativa frente a CIN2+ relacionado con VPH31 y 33 (excluyendo coinfección por VPH16 y/o 18) y relacionado con VPH45 (incluía coinfección por VPH16 y/o 18). La vacuna tetravalente demostró eficacia significativa frente a CIN2+ relacionado con VPH31 si se incluía coinfección por VPH16 y/o 18 (tabla 3)27.
Protección cruzada por tipo de VPH, frente a infección persistente y CIN2+ (solo se incluyen genotipos con resultados estadísticamente significativos en alguno de los análisis. Se excluyen lesiones coinfectadas con VPH 16 y/o 18)
| Eficacia (IC 95%) | ||||
|---|---|---|---|---|
| Ensayo: | FUTURE I/II | PATRICIA | CVT | VIVIANE |
| Vacuna | Tetravalente | Bivalente | Bivalente | Bivalente |
| Cohorte | MITT-naïve | MITT-naïve | ATP | ATP |
| Media de seguimiento | 3,6 años | 3,3 años | 4 años | 3,4 años |
| Infección persistente a los 6 meses | ||||
| VPH 31 | 46,2 (15,3 a 66,4)* | 77,1 (67,2 a 84,4)* | 64,7 (42,6 a 78,9)* | 79,1% (27,6 a 95,9)* |
| VPH 33 | 28,7 (−45,1 a 65,4) | 43,1 (19,3 a 60,2)* | 32,1 (−41,1 a 68,2) | −31,9% (−460,8 a 66,3) |
| VPH 45 | 7,8 (−67,0 a 49,3) | 79,0 (61,3 a 89,4) * | 73,0 (45,3 a 87,8) * | 76,9% (18,5 a 95,6)* |
| VPH 52 | 18,4 (−20 a 45,0) | 18,9 (3,2 a 32,2)* | 19,6 (−8,1 a 40,4) | 14,2% (−51,4 a 51,7) |
| CIN2+ | ||||
| VPH 31 | 57,4 (−2,0 a 83,9) - 70,0 (32,1 a 88,2)*,a | 83,4 (43,3 a 96,9)* | − | − |
| VPH 33 | −21,6 (−214,2 a 51,9) | 76,3 (35,5 a 93,0)* | − | − |
| VPH 45 | − | 100 (−429,7 a 100) - 100 (41,7 a 100)*,a | − | − |
ATP: análisis por protocolo; CIN: neoplasia intraepitelial cervical; CIN2+: CIN grado 2 o más severa; CIN3+: CIN grado 3 o más severa; CVT: Costa Rica Vaccination Trial; MITT: análisis por intención de tratar modificada; VPH: virus del papiloma humano.
Las mujeres positivas en el reclutamiento para alguno de los tipos analizados fueron excluidas del análisis para ese tipo en concreto.
Fuentes: Skinner et al.13, Herrero et al.23, Brown et al.25, Wheeler et al.26 y Malagón et al.27.
El seguimiento a más largo plazo refleja que la eficacia frente a infección persistente por VPH31 y 45 de la vacuna bivalente parece disminuir con el tiempo, llegando a hacerse no significativa para VPH3128. La duración de la protección cruzada es crucial para evaluar el impacto poblacional de las actuales vacunas VPH frente a tipos no vacunales, pero todavía son necesarios más datos para establecer la duración de esta protección cruzada.
En el estudio CVT realizado con la vacuna bivalente también se observó protección cruzada parcial frente a infección anal en el análisis combinado de VPH31, 33 y 45, con una protección del 49,4% en el análisis por intención de tratar29.
En las mujeres adultas (≥26años) la vacuna bivalente demostró eficacia significativa frente a infección persistente a los 6meses por los VPH31 y 45 en el análisis por protocolo (tabla 3). Cuando se tenía en cuenta la cohorte ITT, se observó protección significativa frente al VPH45 pero no frente al VPH3113. No se han presentado resultados de protección cruzada de la vacuna tetravalente para mujeres adultas.
Eficacia en mujeres con exposición previa a los tipos vacunalesLas niñas de 10-14años, principal objetivo de las campañas de vacunación, tienen una exposición previa mínima a los tipos de VPH incluidos en las vacunas. Sin embargo, en las mujeres jóvenes incluidas en las campañas de rescate, o catch-up, hay que considerar la seguridad y la eficacia de las vacunas VPH después de tener una infección por VPH16 o 18. Por ejemplo, en PATRICIA, al inicio del estudio el 7% de las mujeres eran ADN positivas para VPH16 o 18, y el 19% tenían evidencia serológica de infección por VPH16 o 1830. En el FUTUREI y II combinados, el 19,8% de las mujeres tenían serología positiva para VPH6, 11, 16 o 18 al inicio y el 26,8% eran positivas para PCR-ADN o serología por alguno de los tipos vacunales31. El estudio VIVIANE incluía al inicio del estudio un 15% de mujeres con historia previa de infección por VPH para conseguir unas condiciones más similares al mundo real y el 7,5% tenían infección intercurrente por VPH16 y/o 1813.
Los estudios realizados en estas mujeres muestran que la infección prevalente por algún tipo de VPH no impide la inducción de protección por parte de la vacuna frente a la infección incidente por otro tipo de VPH30,32. También parecen indicar que las respuestas de anticuerpos a la infección natural no protegen completamente de la reinfección, a diferencia de los anticuerpos inducidos por la vacunación. La diferencia en la protección probablemente es debida a la generación de títulos de anticuerpos mucho menores por la infección natural. En el ensayo CVT se observó que las mujeres con títulos de anticuerpos mayores al inicio estaban más protegidas de la infección incidente que aquellas con títulos bajos33. Las tasas de ataque de 2 a 5 veces más bajas en seropositivas respecto a las seronegativas sugieren que los anticuerpos inducidos por la infección natural juegan un rol fundamental en la protección frente a la reinfección o puede ser que sean un marcador de inmunidad celular.
Eficacia terapéuticaAunque las vacunas VLP fueron diseñadas específicamente para generar anticuerpos neutralizantes y, con ello, prevenir la infección, también se mostró que inducían respuestas inmunocelulares a la L1 en modelos animales y en algunos ensayos clínicos. Por lo tanto, es de interés examinar si las vacunas VPH podrían inducir la regresión de infecciones o lesiones genitales causadas por el VPH. La actividad terapéutica de la vacuna bivalente se examinó en un análisis secundario del ensayo costarricense (CVT) en el que no se detectaron diferencias significativas en la tasa de remisión de infecciones prevalentes por VPH16 o 18 ni por otros tipos de VPH en el grupo que recibió la vacuna24. La actividad terapéutica de la vacuna tetravalente se examinó en el ensayo FUTUREII. No se detectaron diferencias significativas en la tasa de progresión de infecciones prevalentes por VPH16 o 18 a CIN2+ en el grupo que recibió la vacuna VLP frente al grupo placebo16. Por lo tanto, las vacunas VLP parecen carecer de un efecto significativo sobre las tasas de regresión o progresión de infecciones cervicales prevalentes en el momento de la vacunación. No se ha presentado análisis sobre la actividad terapéutica frente a lesiones en los genitales externos.
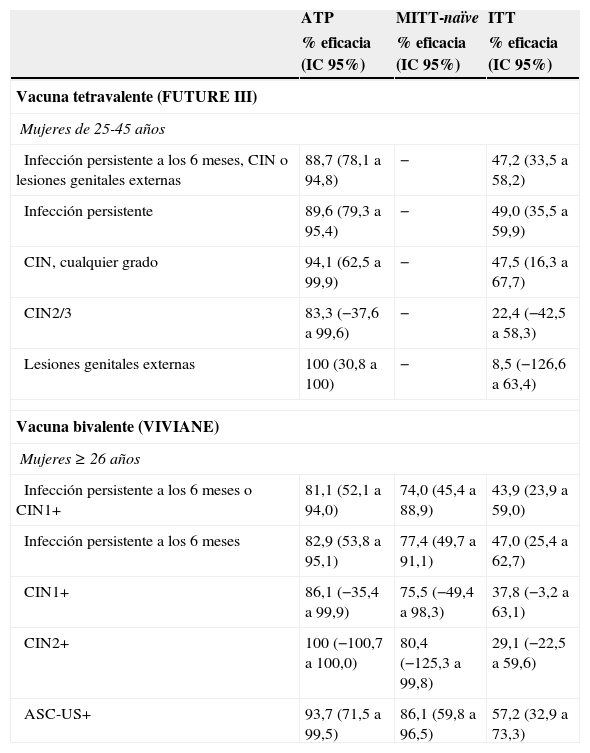
Eficacia en mujeres adultas de 24 a 45 añosSe han publicado los resultados de un ensayo multicéntrico con la vacuna tetravalente (FUTUREIII) en 3.819 mujeres con edades comprendidas entre los 24 y los 45años de edad y de otro con la vacuna bivalente (VIVIANE) en 5.752 mujeres mayores de 25años13,17. Los resultados confirman que las mujeres adultas sin evidencia previa de exposición a los tipos vacunales se podían beneficiar de la vacunación. En el análisis por protocolo, la eficacia de la vacuna tetravalente para la combinación de infección persistente, CIN y/o lesiones genitales externas relacionados con los tipos de VPH vacunales fue del 88,7%, y la eficacia de la vacuna bivalente para la combinación de infección persistente y/o CIN fue del 81,1% (tabla 4). Es conveniente resaltar que, en mujeres adultas, el análisis por intención de tratar (ITT) es el que tiene mayores implicaciones en salud pública, puesto que no se contempla hacer un cribado previo sistemático para vacunar solamente a las seronegativas y/o ADN negativas. La eficacia de la combinación de variables de eficacia en la población ITT para los tipos vacunales fue de 47,2% para la vacuna tetravalente y de 43,9% para la bivalente. Las disminuciones en las tasas de colposcopia, biopsia y tratamiento definitivo fueron modestas y estadísticamente nosignificativas en el estudio con la vacuna tetravalente, del 6,8%, 6,4% y 2,4%, respectivamente. El perfil de seguridad de ambas vacunas fue similar al de las mujeres más jóvenes, con un ligero aumento del número de efectos adversos locales en el lugar de la inyección en las vacunadas en comparación con los controles (76,2% vs 64,2% en el caso de la vacuna tetravalente y 85% vs 67% en el caso de la bivalente).
Eficacia vacunal frente a infección persistente y lesiones relacionadas con los VPH 6, 11, 16 y 18 en mujeres adultas de 24 a 45 años
| ATP | MITT-naïve | ITT | |
|---|---|---|---|
| % eficacia (IC 95%) | % eficacia (IC 95%) | % eficacia (IC 95%) | |
| Vacuna tetravalente (FUTURE III) | |||
| Mujeres de 25-45 años | |||
| Infección persistente a los 6 meses, CIN o lesiones genitales externas | 88,7 (78,1 a 94,8) | − | 47,2 (33,5 a 58,2) |
| Infección persistente | 89,6 (79,3 a 95,4) | − | 49,0 (35,5 a 59,9) |
| CIN, cualquier grado | 94,1 (62,5 a 99,9) | − | 47,5 (16,3 a 67,7) |
| CIN2/3 | 83,3 (−37,6 a 99,6) | − | 22,4 (−42,5 a 58,3) |
| Lesiones genitales externas | 100 (30,8 a 100) | − | 8,5 (−126,6 a 63,4) |
| Vacuna bivalente (VIVIANE) | |||
| Mujeres ≥ 26 años | |||
| Infección persistente a los 6 meses o CIN1+ | 81,1 (52,1 a 94,0) | 74,0 (45,4 a 88,9) | 43,9 (23,9 a 59,0) |
| Infección persistente a los 6 meses | 82,9 (53,8 a 95,1) | 77,4 (49,7 a 91,1) | 47,0 (25,4 a 62,7) |
| CIN1+ | 86,1 (−35,4 a 99,9) | 75,5 (−49,4 a 98,3) | 37,8 (−3,2 a 63,1) |
| CIN2+ | 100 (−100,7 a 100,0) | 80,4 (−125,3 a 99,8) | 29,1 (−22,5 a 59,6) |
| ASC-US+ | 93,7 (71,5 a 99,5) | 86,1 (59,8 a 96,5) | 57,2 (32,9 a 73,3) |
ATP: análisis por protocolo; ASC-US: células atípicas de significado incierto; CIN: neoplasia intraepitelial cervical; CIN1+: CIN grado 1 o más severa; CIN2+: CIN grado 2 o más severa; CIN2/3: CIN grado 2 y 3; ITT: análisis por intención de tratar; MITT: análisis por intención de tratar modificada; VPH: virus del papiloma humano.
La eficacia de la vacuna tetravalente se estudió en un ensayo con 4.065 hombres de 18 países (de los cuales 598 eran hombres que tenían sexo con hombres) con edades comprendidas entre 16 y 26años (media de edad, 20,5años), que se siguieron durante 3años34. Entre los hombres sin infección previa y que recibieron las 3 dosis de vacuna (cohorte ATP), la eficacia en la prevención de lesiones en genitales externos asociadas a los genotipos vacunales fue del 90,4%, considerando lesiones en genitales externos a las verrugas genitales externas (condilomas), la neoplasia intraepitelial peneana, perianal o perineal de cualquier grado (PIN), o cáncer en alguna de estas localizaciones (tabla 5). La eficacia para prevenir infección persistente por los VPH6, 11, 16 y 18 fue del 85,6%. La eficacia fue menor en el análisis por intención de tratar (ITT), ya que este análisis incluye hombres con infección prevalente al inicio del estudio, del 65,5% para lesiones genitales externas y del 47,8% para infección persistente. La eficacia significativa observada en ambas cohortes (ATP-ITT) frente a lesiones genitales externas, independientemente del tipo de VPH, demuestra que la mayor parte de las verrugas genitales están causadas por los tipos de VPH6 y 11. Los resultados de este estudio han permitido la autorización de la vacuna tetravalente para la prevención de lesiones genitales externas en diversos países, y en algunos de ellos —como Estados Unidos, Canadá, Austria o Australia— incluso su inclusión en el calendario de vacunación para adolescentes.
Eficacia de la vacuna tetravalente en hombres de 16 a 26 años
| ATPa | ITT | |
|---|---|---|
| % eficacia (IC 95%) | % eficacia (IC 95%) | |
| Lesiones genitales externasb | ||
| Cualquier tipo de VPH | 83,8 (61,2 a 94,4) | 60,2 (40,8 a 73,8) |
| VPH 6, 11, 16, 18 | 90,4 (69,2 a 98,1) | 65,5 (45,8 a 78,6) |
| Infecciones genitales persistentesc | ||
| VPH 6, 11, 16, 18 | 85,6 (73,4 a 92,9)d | 47,8 (36,0 a 57,6) |
| VPH 6 | − | 44,7 (24,1 a 60,1) |
| VPH 11 | − | 59,4 (25,7 a 78,8) |
| VPH 16 | 78,7(55,5 a 90,9) | 46,9 (28,6 a 60,8) |
| VPH 18 | 96,0 (75,6 a 99,9) | 56,0 (28,2 a 73,7) |
| AIN (cualquier grado)e | ||
| Cualquier tipo de VPH | 54,9 (8,4 a 79,1) | 25,7 (−1,1 a 45,6) |
| VPH 6, 11, 16, 18 | 77,5 (39,6 a 93,3) | 50,3 (25,7 a 67,2) |
| AIN2/3e | ||
| VPH 6, 11, 16, 18 | 74,9 (8,8 a 95,4) | 54,2 (18,0 a 75,3) |
| Infección anal persistentec,e | ||
| VPH 6, 11, 16, 18 | 94,9 (80,4 a 99,4) | 59,4 (43,0 a 71,4) |
| VPH 6 | 92,1 (47,2 a 99,8) | 62,5 (37,5 a 78,2) |
| VPH 11 | 100 (−15,5 a 100) | 53,7 (7,5 a 78,0) |
| VPH 16 | 93,8 (60,0 a 99,9) | 54,0 (23,9 a 2,9) |
| VPH 18 | 100 (51,5 a 100) | 49,5 (11,3 a 72,1) |
ATP: análisis por protocolo; ITT: análisis por intención de tratar; AIN: neoplasia intraepitelial anal; VPH: virus del papiloma humano.
Cohorte ATP: seronegativos para VPH 6, 11, 16 y 18 y ADN negativos para VPH 6, 11, 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, y 59 al inicio. En el grupo de hombres que mantenían sexo con hombres se pedía además una citología anal al inicio.
Lesiones genitales externas: verrugas genitales externas (condilomas) o neoplasia intraepitelial peneana, perianal o perineal de cualquier grado (PIN) o cáncer en alguna de estas localizaciones.
En hombres que declararon mantener relaciones sexuales con otros hombres, la vacuna tetravalente demostró una eficacia del 77,5% para prevenir neoplasia intraepitelial anal (AIN) debida a los tipos vacunales en la cohorte ATP y disminuyó al 50,3% en la cohorte ITT (tabla 5)35. La menor eficacia en la cohorte ITT refuerza la conveniencia de vacunar antes del inicio de la actividad sexual.
Estudios de eficacia de la vacuna nonavalenteRecientemente se han publicado los resultados de un estudio de faseiib-iii de eficacia, seguridad e inmunogenicidad, en el que se comparaban las vacunas nonavalente y tetravalente en 14.215 mujeres de 16 a 26años18. La vacuna nonavalente demostró una alta eficacia frente a infección y lesiones relacionadas con los VPH31, 33, 45, 52 y 58, no incluidos en el resto de vacunas VPH. Además demostró que la respuesta frente a VPH6, 11, 16 y 18 era equivalente a la vacuna tetravalente.
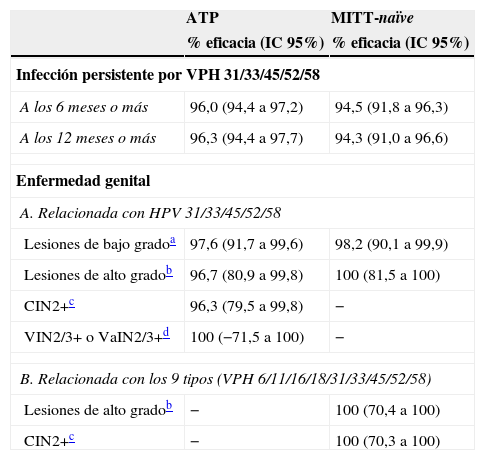
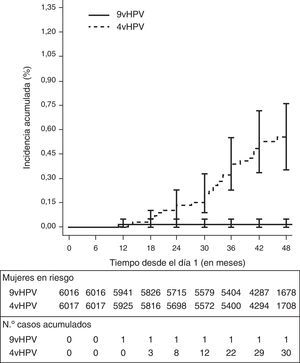
La eficacia frente a CIN2+, VIN2+ y VaIN2+ relacionados con VPH31, 33, 45, 52 y 58 fue del 96,7% en el análisis de la cohorte ATP (la tasa de incidencia pasó de 1,6 casos por 1.000 mujeres-año en el grupo de la vacuna tetravalente a 1,6 en de la nonavalente), del 100% en la cohorte MITT-naïve (la tasa de incidencia pasó de 1,8 casos por 1.000 mujeres-año a 0,0), y del 80,6 en la cohorte ITT (tabla 6). La incidencia acumulada de CIN2+, VIN2+ y VaIN2+ debidos a VPH31, 33, 45, 52 y 58, en el análisis de la cohorte ATP, fue aumentando hasta llegar a 30 casos a los 4años de la vacunación en el grupo de la vacuna tetravalente, y en cambio se mantuvo muy baja y estable en el grupo de la vacuna nonavalente (un único caso) (fig. 1).
Eficacia profiláctica de la vacuna nonavalente en relación con la vacuna tetravalente frente a lesiones anogenitales relacionadas con los tipos vacunales
| ATP | MITT-naïve | |
|---|---|---|
| % eficacia (IC 95%) | % eficacia (IC 95%) | |
| Infección persistente por VPH 31/33/45/52/58 | ||
| A los 6 meses o más | 96,0 (94,4 a 97,2) | 94,5 (91,8 a 96,3) |
| A los 12 meses o más | 96,3 (94,4 a 97,7) | 94,3 (91,0 a 96,6) |
| Enfermedad genital | ||
| A. Relacionada con HPV 31/33/45/52/58 | ||
| Lesiones de bajo gradoa | 97,6 (91,7 a 99,6) | 98,2 (90,1 a 99,9) |
| Lesiones de alto gradob | 96,7 (80,9 a 99,8) | 100 (81,5 a 100) |
| CIN2+c | 96,3 (79,5 a 99,8) | − |
| VIN2/3+ o VaIN2/3+d | 100 (−71,5 a 100) | − |
| B. Relacionada con los 9 tipos (VPH 6/11/16/18/31/33/45/52/58) | ||
| Lesiones de alto gradob | − | 100 (70,4 a 100) |
| CIN2+c | − | 100 (70,3 a 100) |
AIS: adenocarcinoma in situ; ATP: análisis por protocolo; CIN: neoplasia intraepitelial cervical; CIN2+: CIN grado 2 o más severa; ITT: análisis por intención de tratar; MITT: análisis por intención de tratar modificada; VaIN: neoplasia intraepitelial vaginal; VIN: neoplasia intraepitelial vulvar; VPH: virus del papiloma humano.
En este estudio, la tasa de incidencia de CIN2+, VIN2+ y VaIN2+, independientemente del tipo de VPH, en la cohorte ITT fue de 14,0 casos por 1.000 personas-año, mientras que en el subgrupo naïve para los tipos de VPH relevantes al inicio de la vacunación (MITT-naïve) fue de 2,4 en el grupo de la vacuna nonavalente y de 4,2 en el de la tetravalente (eficacia de la vacuna nonavalente del 42,5% (7,9-65,9). Por lo tanto, en las mujeres naïve la vacuna nonavalente incrementó la eficacia un 42,5% (7,9-65,9) respecto a la vacuna tetravalente para CIN2+, VIN2+ y VaIN2+ ocasionados por cualquier tipo de VPH (incluidos o no en la vacuna). La mayoría de casos observados durante el seguimiento del estudio ocurrieron en mujeres con infección previa en el momento de la vacunación (tabla 6). En la cohorte MITT-naïve la eficacia frente a CIN2+, VIN2+ y VaIN2+ relacionados con la vacuna fue del 100%.
La respuesta de anticuerpos frente a VPH6, 11, 16 y 18 demostró ser noinferior a la generada por la vacuna tetravalente en el análisis de la cohorte ATP. Los efectos adversos locales fueron más frecuentes en el grupo de la vacuna nonavalente que en el de la tetravalente (90,7% vs. 84,9%). Los síntomas más frecuentes fueron dolor, inflamación, eritema y prurito, y probablemente están relacionados con la mayor cantidad de adyuvante contenido en la vacuna. La aparición de efectos adversos sistémicos fue similar en ambos grupos y no fue causa de abandono del estudio.
SeguridadLas vacunas VLP son vacunas de subunidades proteicas no infecciosas, por lo que puede esperarse que tengan perfiles de seguridad similares a otras vacunas de subunidades proteicas. Los resultados de seguridad de los ensayos clínicos de la vacuna tetravalente y de la bivalente respaldan que estas vacunas son generalmente bien toleradas y tienen un adecuado perfil de seguridad, siendo muy pocos los abandonos relacionados con las vacunas. Los efectos adversos locales más comunes relacionados con las vacunas fueron el dolor transitorio de intensidad leve a moderada, el eritema y la inflamación en el lugar de inyección. Los síntomas sistémicos más comunes potencialmente relacionados con la vacuna fueron fiebre, fatiga, dolor de cabeza y dolor muscular. Estas reacciones fueron significativamente más frecuentes en las vacunadas que en los controles. Cabe destacar que ni los síntomas locales ni los sistémicos aumentaron con las dosis posteriores36. Los porcentajes de mujeres con eventos adversos graves, patologías clínicamente relevantes, nuevas enfermedades crónicas y nuevas enfermedades autoinmunes fueron similares en las vacunadas y en las mujeres control, como también lo fueron el número de embarazos y el número de eventos adversos relacionados con el embarazo36. Los síntomas tampoco fueron más intensos en mujeres con evidencia de exposición anterior a alguno de los tipos vacunales del VPH15.
Las vacunas VPH no se recomiendan a mujeres embarazadas, debido a los limitados datos de seguridad actualmente disponibles.
El perfil de seguridad de las vacunas VPH continúa evaluándose para identificar posibles efectos adversos raros no detectables en los ensayos de faseiii. Para ello se han realizado múltiples estudios de seguridad poscomercialización (ensayos clínicos faseiv), y se recurre a la vigilancia pasiva y a las revisiones internacionales. Actualmente ya se han distribuido en el mundo más de 175millones de dosis. La revisión más reciente de la Organización Mundial de la Salud (OMS) concluye que toda la evidencia acumulada hasta el momento reafirma el alto perfil de seguridad de las vacunas VPH. Los efectos adversos graves (como anafilaxias, síndrome de Guillain-Barré, convulsiones o tromboembolismos) que se detectaron puntualmente y crearon preocupación y alarma se han estudiado en más detalle y no se ha demostrado ninguna asociación con la vacuna o que tengan una aparición con una frecuencia mayor respecto a las tasas esperadas36. A pesar de ello, se han implementado varios programas de evaluación continuada de los posibles efectos secundarios de las vacunas VPH que permitirán concluir el perfil de seguridad a largo plazo.
InmunogenicidadTodas las formulaciones ensayadas muestran una elevada inmunogenicidad, con tasas de seroconversión próximas al 100% tanto para la vacuna bivalente como para la tetravalente y la nonavalente. El título de anticuerpos presenta un pico un mes después de la tercera dosis (séptimo mes), con un descenso progresivo hasta los 12-18meses, estabilizándose posteriormente en un nivel muy superior al obtenido mediante infección natural (que en ocasiones produce títulos de anticuerpos que no protegen frente a nuevas infecciones)24,37,38.
El tipo de inmunoanálisis utilizado es crucial para las determinaciones serológicas, y los ensayos con las distintas vacunas utilizan pruebas no comparables. Un ensayo clínico aleatorizado ha comparado directamente la inmunogenicidad de la vacuna tetravalente y de la bivalente en mujeres de 18 a 45años37. Sesenta meses después de la vacunación casi el 100% de las mujeres vacunadas con cualquiera de las 2 vacunas se mantenían seropositivas para VPH16. Respecto a VPH18, mientras que casi el 100% de las vacunadas con la vacuna bivalente se mantenían seropositivas, la seropositividad en las vacunadas con la vacuna tetravalente descendía al 61-77%. La vacuna bivalente indujo unos títulos de anticuerpos neutralizantes significativamente superiores a la vacuna tetravalente, 7,8 veces (18-26años), 5,6 veces (27-35años) y 2,3 veces (36-45años) para VPH16. Para VPH18, las diferencias fueron de 12,1, 13,0 y 7,8 veces, respectivamente. Los títulos serológicos más altos de anticuerpos específicos para VPH16 y 18 de la vacuna bivalente también se correspondían con títulos más elevados en las secreciones cervicovaginales37. Seguramente, la mayor respuesta de anticuerpos de la vacuna bivalente sea debida a la acción del adyuvante AS042.
Sin embargo, hay que considerar que aunque las respuestas humorales más elevadas parezcan en general más adecuadas, aún no está claro que las diferencias en las respuestas de anticuerpos entre las 2 vacunas se traduzcan en diferencias en la protección a largo plazo.
La presencia de concentraciones elevadas de anticuerpos neutralizantes es crítica en la prevención de las infecciones por VPH, ya que la infección por el virus se produce en un plazo de horas tras la infección. Los anticuerpos neutralizantes migran mediante mecanismos de trasudación y exudación desde el suero hasta la mucosa cervical, obteniéndose así niveles de anticuerpos lo suficientemente elevados en el cérvix para prevenir la infección entrante2.
Eficacia y duración de la protección a largo plazoDado que el riesgo de exposición al VPH persiste durante toda la vida sexual activa, la duración de la protección a largo plazo de las vacunas VPH se convierte en uno de los tema clave.
Ambos productores de vacunas se han comprometido a seguir monitorizando a las mujeres seleccionadas en los ensayos de faseiii en los países nórdicos39.
En el caso de la vacuna tetravalente, el seguimiento hasta 5años de los participantes en los estudios de eficacia revelaba la noaparición de lesiones cervicales precancerosas ni verrugas genitales en los vacunados. En este mismo estudio se observaba que la respuesta inmune frente a VPH16 se mantenía, mientras el título de anticuerpos frente a VPH18 caía con el paso del tiempo, asimilándose a la infección natural38. En el seguimiento de los estudios en niños y niñas de 9-15años tampoco aparecieron casos de enfermedad a los 8años de la vacunación, manteniéndose el título de anticuerpos entre el 64,1-100% según el tipo de VPH38,40.
La monitorización en los países nórdicos muestra que a los 8años de seguimiento en Dinamarca, Suecia, Noruega e Islandia no ha habido ningún caso de CIN2+, ni de cáncer de vulva o vagina relacionado con los tipos vacunales entre las mujeres vacunadas, y que la respuesta inmune se mantiene por encima del 90% para los 4 tipos de VPH38,41.
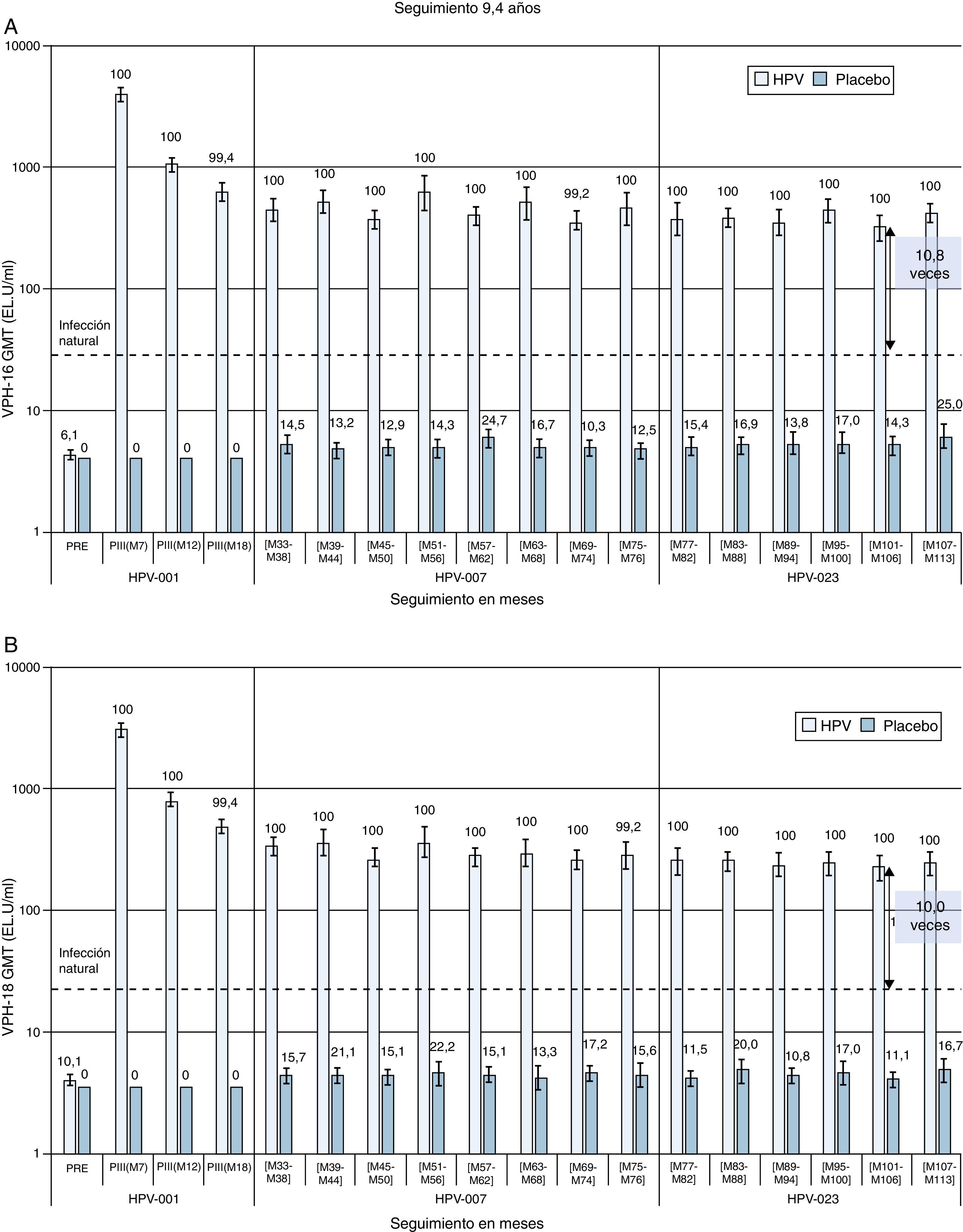
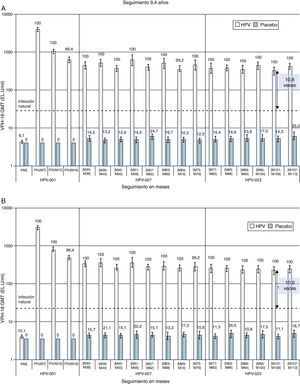
Resultados similares se han publicado para la vacuna bivalente. El seguimiento a largo plazo refleja que a los 6,4años de seguimiento la eficacia de la vacuna frente a CIN2+ se mantiene en cifras del 100% (51,3-100) para lesiones relacionadas con los tipos vacunales, y que los títulos de anticuerpos frente a VPH16 y 18 se mantienen en niveles más de 12 veces superiores a los inducidos por la infección natural38. Un estudio refleja que, hasta los 9,4años de seguimiento, los niveles de anticuerpos inducidos por la vacuna frente a VPH16 y 18 se mantienen en títulos varias veces superiores a los alcanzados con la infección natural28 (fig. 2).
Inmunogenicidad de la vacuna bivalente a los 9,4 años de seguimiento tras la primera dosis. Tasas de seropositividad y título medio geométrico (GMT) para (A) anti-VPH-16 y (B) anti-VPH-18 anticuerpos medidos mediante ELISA (cohorte ATP).
Los datos proceden de mujeres incluidas en el estudio en los centros brasileños. Los valores sobre las barras corresponden a las tasas de seropositividad para el momento correspondiente. La línea horizontal discontinua representa el nivel de anticuerpos en mujeres del estudio de eficacia que resolvieron una infección natural antes del inicio del estudio.
EL.U unidades/ml: ELISA/ml; M: mes; PII: mensaje ii dosis; PIII: después de la dosis iii; PRE: antes de la vacunación.
Fuente: adaptada de Naud et al.28.
En general, aunque los resultados sugieren que la vacuna bivalente genera una mayor respuesta inmune que la vacuna tetravalente, parece ser que estas diferencias pueden ser debidas a las pruebas de inmunoanálisis utilizadas, y que a pesar del descenso en los títulos de anticuerpos, la eficacia profiláctica de la vacuna tetravalente frente a lesiones anogenitales asociadas con HPV18 se mantiene en el tiempo38,42.
Por otro lado, los estudios sugieren que la respuesta inmune generada por las VLP induce mecanismos de memoria inmunitaria efectivos, responsables de la protección a largo plazo, como lo demuestra el aumento rápido y robusto en anticuerpos específicos del tipo de vacuna al producirse una re-exposición al antígeno. Los estudios de aplicación de una dosis extra de vacuna tetravalente o bivalente por vía sistémica se acompañan de un efecto booster con incremento del título de anticuerpos a un nivel tan alto o incluso superior al obtenido tras la tercera dosis38. Esto sugiere que la serie primaria de ambas vacunas es capaz de generar la memoria de célulasB necesaria para la protección a largo plazo.
Estudios puente de seguridad e inmunogenicidadLa seguridad y la inmunogenicidad de las vacunas bivalente y tetravalente en mujeres jóvenes, en las cuales la eficacia de las vacunas ha sido demostrada, han sido comparadas recientemente con otros grupos de estudio mediante estudios puente (también llamados estudios de extrapolación). La intención de estos estudios es generar datos que puedan respaldar la autorización de la vacuna en poblaciones distintas a las que se obtuvieron los principales datos de eficacia.
Datos para niños y niñas preadolescentesLos estudios realizados tanto con la vacuna tetravalente como con la bivalente muestran que las vacunas son inmunogénicas, seguras y bien toleradas en niños y niñas preadolescentes. La respuesta de anticuerpos de la vacuna tetravalente fue noinferior en niños comparada con niñas, y el título medio geométrico (GMT) de anticuerpos anti-VLP específicos fueron aproximadamente 2 veces superiores que las respuestas en mujeres jóvenes tanto en los niños como en las niñas43,44. Se observó además que los títulos de anticuerpos inducidos por la vacuna se mantenían 8años más tarde40.
Uno de los estudios comparaba la vacuna tetravalente con un placebo de suero salino. Las receptoras de la vacuna tuvieron reacciones adversas en el lugar de inyección con una frecuencia mayor que las receptoras de placebo (75,3% versus 50,0%), pero las tasas de fiebre fueron similares44.
En otro estudio, el eritema en el lugar de inyección fue significativamente mayor en mujeres jóvenes que en niñas y niños (9,7%, 6,8% y 6,2%, respectivamente), mientras que la fiebre fue significativamente superior en las niñas y niños (12,8%, 13,8% y 7,3%, respectivamente)43.
Un estudio con la vacuna bivalente comparó la seguridad y la inmunogenicidad en niñas adolescentes y mujeres jóvenes45. La tasa de seroconversión fue no inferior en las niñas adolescentes, y los GMT de VLP fueron aproximadamente 2 veces mayores en las niñas comparado con las mujeres jóvenes. La incidencia de reacciones en el lugar de inyección fue similar en ambos grupos, pero la incidencia de síntomas generales fue algo menor en las niñas (16,5% versus 23,0%). En otro estudio que comparaba la vacuna bivalente con la vacuna de la hepatitisB se observó que los títulos de anticuerpos inducidos por la vacuna bivalente también fueron más elevados para los niños de 10 a 18años, y que la vacuna fue bien tolerada, con perfiles de reactogenicidad similares al grupo control con vacuna frente a la hepatitisB46.
Datos en individuos infectados por el VIHLas personas inmunodeprimidas, entre las que se incluyen los infectados por el VIH, tienen un riesgo mayor de presentar infección persistente por VPH, lesiones benignas producidas por el VPH y cánceres asociados. La inmunogenicidad y la seguridad de la vacuna tetravalente y la bivalente se han evaluado en múltiples estudios tanto en adultos como en niños47. Las vacunas VPH fueron seguras y bien toleradas, sin efectos adversos sobre el recuento de CD4+ o los niveles plasmáticos de ARN de VIH. La seroconversión fue mayor del 95%, y los títulos de anticuerpos fueron aproximadamente la mitad de los medidos en individuos sin infección por VIH de edad similar. Estos hallazgos apoyan los programas de vacunación específicos para jóvenes con infección por el VIH.
Un ensayo clínico aleatorizado compara directamente la inmunogenicidad y la seguridad de las vacunas tetravalente y bivalente en individuos mayores de 18años infectados por el VIH. Los resultados del estudio sugieren que ambas vacunas son inmunógenas y bien toleradas en individuos con VIH. Los títulos de anticuerpos frente a VPH18 fueron significativamente mayores en el grupo de la vacuna bivalente en comparación con el grupo de la vacuna tetravalente, a los 7 y 12meses. No se observaron diferencias significativas en los títulos de anticuerpos frente a VPH16. Las mujeres vacunadas con la vacuna bivalente mostraron una mayor respuesta de anticuerpos frente a VPH16 y 18 en comparación con los hombres. No se encontraron diferencias específicas por sexo en el grupo de la vacuna tetravalente47.
Coadministración con otras vacunasLa coadministración de varias vacunas durante una misma visita es una buena oportunidad para mejorar la cobertura vacunal. Una revisión sistemática reciente analizaba la seguridad y la inmunogenicidad de las vacunas bivalente y tetravalente cuando se administran junto a las vacunas antihepatitisA, antihepatitisB, antihepatitisA y B, antidifteria, tétanos, tos ferina y poliomielitis combinada (dTpa-IPV) y antimeningocócica polisacáridaA, C, Y, W-135 conjugada con toxoide diftérico (MCV4). La revisión concluía que los estudios muestran la noinferioridad de la respuesta inmunitaria y en general buena tolerancia a la coadministración de las vacunas VPH con otras vacunas48.
Alternativas a la pauta de administración de 3 dosisUno de los principales problemas de la vacunación frente al VPH es el número de dosis requeridas. La disminución del número de dosis supondría una reducción de costos y un aumento de la cobertura vacunal.
Diversos estudios que evaluaban pautas de vacunación alternativas, tanto con la vacuna bivalente como con la tetravalente, revelan que se puede alcanzar una alta eficacia con pautas de 2 dosis. Los títulos medios geométricos (GMT), un mes después de la vacunación, en el grupo de 2 dosis fueron en general menores, pero noinferiores o noconcluyentes en comparación con el grupo de 3 dosis49.
Otro factor importante en la respuesta parece ser el intervalo de tiempo entre las dosis. Así, la administración de las 2 dosis separadas en 6meses produce GMT superiores que el intervalo de 2meses49. Estudios de seguimiento demuestran que 4años después de la vacunación la respuesta a anticuerpos de la pauta de 2 dosis (0, 6meses) es comparable a pauta estándar de 3 dosis50. El seguimiento a largo plazo permitirá determinar si las respuestas con pautas de 2 o 3 dosis continúan siendo comparables. No obstante, hay países —como Canadá, México, Suiza o Inglaterra— que ya han cambiado sus pautas vacunales1.
La Strategic Advisory Group of Experts on Immunization (SAGE) recomienda una pauta de vacunación de 2 dosis de VPH si la vacunación se inicia antes de los 15años de edad y el intervalo entre dosis es de 6meses (extensible a 12meses). La pauta de 3 dosis sigue considerándose la indicada si la vacunación se inicia a partir de los 15años y en individuos inmunodeprimidos, como es el caso de HIV positivos49. En Europa la pauta de 2 dosis ya está aprobada por la Agencia Europea del Medicamento (EMA) y se incluye en la ficha técnica de ambas vacunas5,6.
Impacto y efectividad de los programas de vacunación sistemáticaDesde 2007, más de 50 países han incluido las vacunas VPH en sus programas nacionales de inmunización51. El impacto poblacional respecto al cáncer de cuello uterino y otros cánceres relacionados con el VPH no se observará hasta 30-50años después del inicio del programa de vacunación, debido al largo intervalo de tiempo que transcurre entre la infección y el cáncer. No obstante, ya se han puesto en marcha diferentes estrategias para evaluar el impacto de la vacunación frente al VPH después de su introducción, y ambos productores de vacunas se han comprometido a seguir monitorizando a las mujeres seleccionadas en los ensayos de faseiii en los países nórdicos, donde tienen una infraestructura de registros de cáncer y de resultados del cribado cervical que permite un seguimiento pasivo exhaustivo39. Asimismo, informes publicados en países en los que la vacuna VPH se ha incluido en los calendarios vacunales confirman la efectividad de la vacuna. En estos países, tras la introducción de la vacuna se ha observado una disminución en la prevalencia de infecciones por los VPH incluidos en la vacuna y en la incidencia de lesiones precancerosas (CIN2+) y verrugas genitales39.
Los resultados de un metaanálisis publicado recientemente reflejan que, en países con coberturas vacunales de más del 50%, la prevalencia de infección por los VPH16 y 18 en niñas de 13 a 19años ha descendido en un 68% en el periodo posvacunal (RR: 0,32; 0,19-0,56) en comparación con el periodo prevacunal, y que adicionalmente se han observado indicios de protección cruzada frente a los VPH31, 33 y 45 (RR: 0,72; 0,54-0,96). La incidencia de verrugas genitales ha descendido el 61% (RR: 0,39; 0,22-0,71) en niñas de 13 a 19años, y se ha observado un efecto de protección de rebaño en mujeres de 20 a 39años y en niños menores de 20años. En países con coberturas inferiores al 50% también se han registrado descensos significativos en la infección y verrugas genitales debidas a los tipos vacunales, pero no se acompañan de efectos de protección cruzada, ni de inmunidad de grupo51.
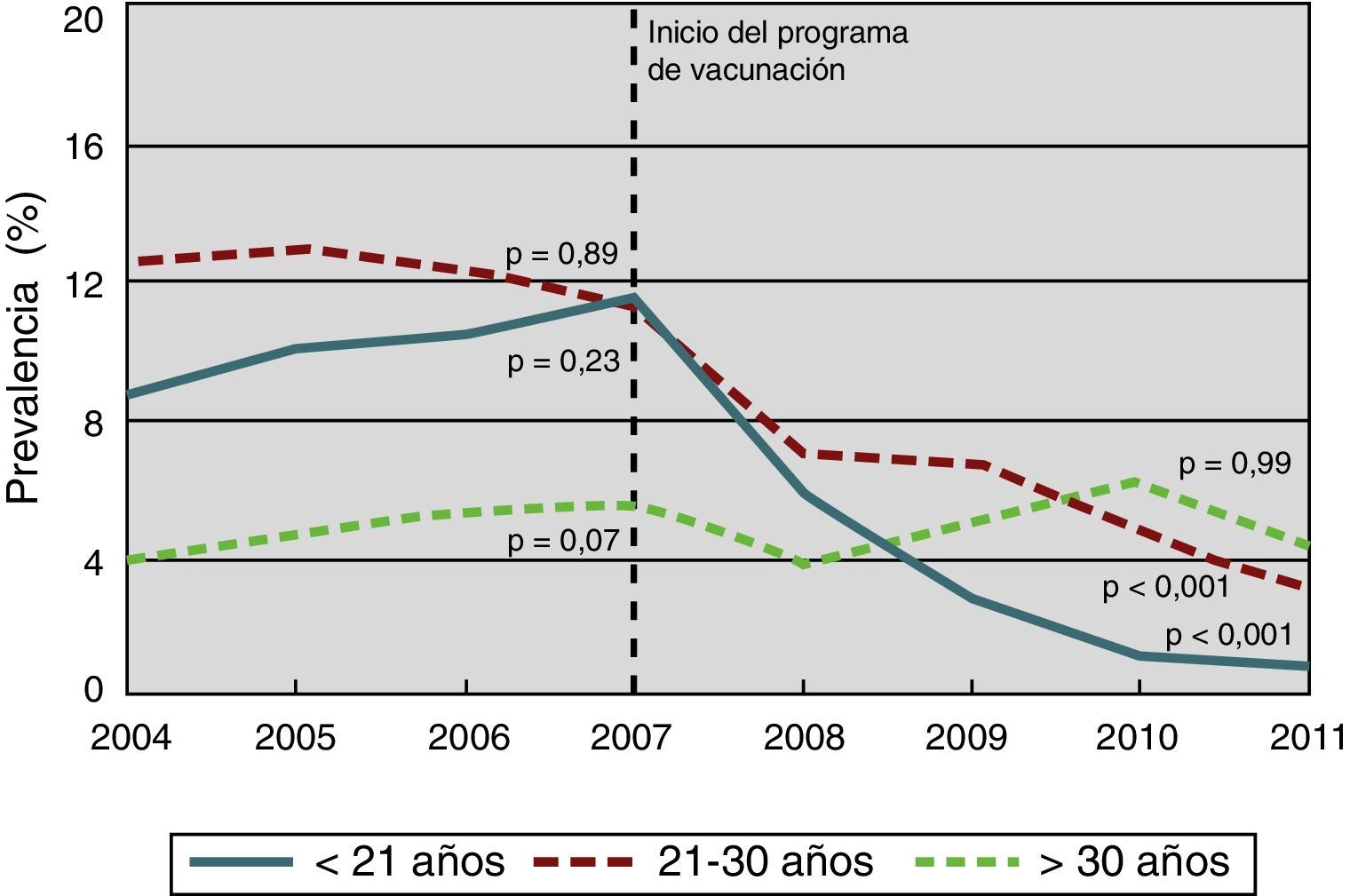
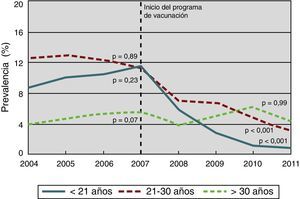
La alta incidencia de verrugas genitales en adultos jóvenes y su progresión relativamente rápida (entre 6 y 12meses) desde la infección incidente a la enfermedad clínica permiten usar las verrugas genitales como el primer resultado clínico de impacto de la vacunación. Datos de una revisión reciente que evaluaba el impacto de la vacunación con la vacuna tetravalente en la incidencia poblacional de verrugas genitales confirman los resultados obtenidos en los ensayos clínicos52. Australia fue uno de los primeros países en implementar un programa de vacunación frente al VPH, de base poblacional y totalmente financiado. Los datos obtenidos 4años después de iniciarse el programa, en abril de 2007, muestran una disminución en el número de diagnósticos de verrugas genitales del 92,6% (del 11,5% en 2007 al 0,85% en 2011) en mujeres menores de 21años, y del 72,6% en mujeres de 21 a 30años (fig. 3). La reducción también fue significativa en el grupo de hombres heterosexuales menores de 30años52. Resultados similares han sido registrados en otros países, como Nueva Zelanda, Estados Unidos, Dinamarca, Alemania y Suecia. Se demuestra un claro efecto de tendencia entre nivel de coberturas y riesgo de verrugas genitales52.
Proporción de mujeres nacidas en Australia con diagnóstico de verrugas genitales en la primera visita, por grupos de edad, desde 2004 hasta 2011 (inicio del programa de vacunación en 2007).
Fuente: adaptada de Ali et al.53.
Merece la pena destacar el efecto inesperado observado para la vacuna bivalente y recientemente descrito en los participantes en el estudio PATRICIA. La eficacia frente a infecciones persistentes por los tipos responsables de las verrugas genitales en los 6meses posteriores a la administración de la vacuna fue del 34,5% contra los VPH6/11, y del 49,5% para el VPH74 (resultados estadísticamente significativos). Estos resultados parecen confirmarse en un estudio ecológico en el Reino Unido, donde a partir de la implantación de la vacuna bivalente (entre 2008 y 2011) se observó una disminución en la incidencia de verrugas genitales en los grupos de edad en los que se había introducido la vacuna39.
ConclusionesLos resultados de los ensayos clínicos realizados en mujeres jóvenes, y en menor medida en varones y mujeres adultas, han permitido establecer el marco de seguridad, inmunogenicidad y eficacia de las vacunas VPH bivalente y tetravalente (tabla 7). Cabe destacar que ambas son vacunas profilácticas sin eficacia terapéutica. En mujeres jóvenes, las 2 vacunas han demostrado ser altamente eficaces en la prevención de CIN2+ relacionados con los VPH de alto riesgo incluidos en la vacuna (VPH16 y 18); adicionalmente, ambas vacunas, pero en especial la bivalente, han demostrado cierto grado de protección cruzada frente a otros tipos de VPH. Las vacunas también son eficaces en la prevención de VIN2+ y VaIN2+ relacionados con los VPH16 y 18.
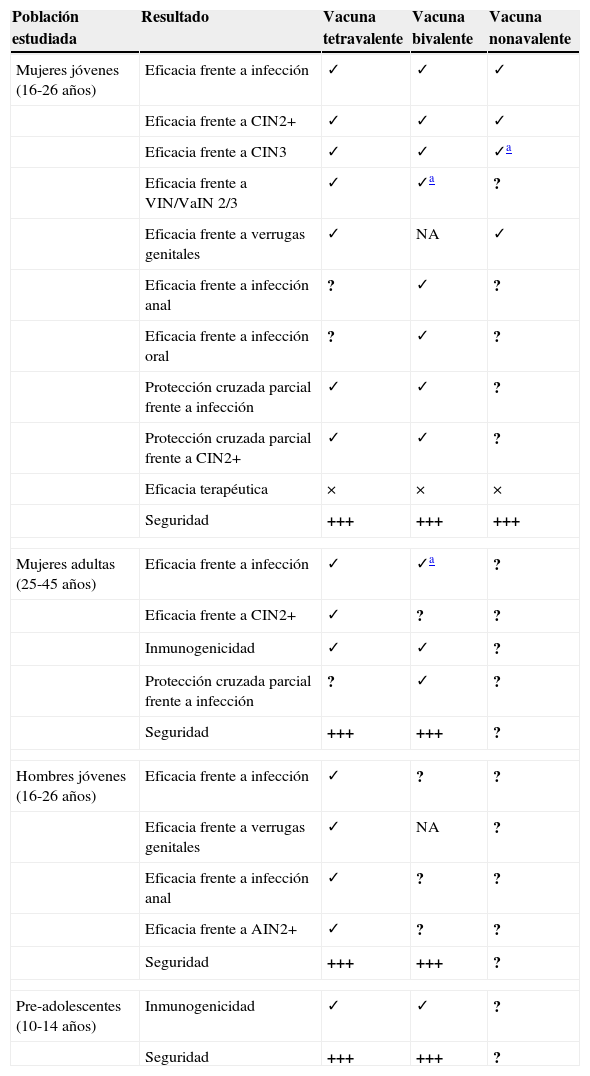
Resumen de los resultados principales de los ensayos de las vacunas VPH
| Población estudiada | Resultado | Vacuna tetravalente | Vacuna bivalente | Vacuna nonavalente |
|---|---|---|---|---|
| Mujeres jóvenes (16-26 años) | Eficacia frente a infección | ✓ | ✓ | ✓ |
| Eficacia frente a CIN2+ | ✓ | ✓ | ✓ | |
| Eficacia frente a CIN3 | ✓ | ✓ | ✓a | |
| Eficacia frente a VIN/VaIN 2/3 | ✓ | ✓a | ? | |
| Eficacia frente a verrugas genitales | ✓ | NA | ✓ | |
| Eficacia frente a infección anal | ? | ✓ | ? | |
| Eficacia frente a infección oral | ? | ✓ | ? | |
| Protección cruzada parcial frente a infección | ✓ | ✓ | ? | |
| Protección cruzada parcial frente a CIN2+ | ✓ | ✓ | ? | |
| Eficacia terapéutica | × | × | × | |
| Seguridad | +++ | +++ | +++ | |
| Mujeres adultas (25-45 años) | Eficacia frente a infección | ✓ | ✓a | ? |
| Eficacia frente a CIN2+ | ✓ | ? | ? | |
| Inmunogenicidad | ✓ | ✓ | ? | |
| Protección cruzada parcial frente a infección | ? | ✓ | ? | |
| Seguridad | +++ | +++ | ? | |
| Hombres jóvenes (16-26 años) | Eficacia frente a infección | ✓ | ? | ? |
| Eficacia frente a verrugas genitales | ✓ | NA | ? | |
| Eficacia frente a infección anal | ✓ | ? | ? | |
| Eficacia frente a AIN2+ | ✓ | ? | ? | |
| Seguridad | +++ | +++ | ? | |
| Pre-adolescentes (10-14 años) | Inmunogenicidad | ✓ | ✓ | ? |
| Seguridad | +++ | +++ | ? | |
✓: demostrada; ?: no demostrada; +++: muy alta; ×: ninguna; NA: no aplica porque no era objetivo.
AIN: neoplasia intraepitelial anal; CIN: neoplasia intraepitelial cervical; VaIN: neoplasia intraepitelial vaginal; VIN: neoplasia intraepitelial vulvar; VPH: virus del papiloma humano.
La vacuna tetravalente es eficaz en la prevención de verrugas genitales relacionadas con los VPH6 y 11, tanto en mujeres como en hombres. La vacuna bivalente protege frente a infección anal y de cavidad oral relacionada con los tipos vacunales.
Por otro lado, los estudios con la recientemente aprobada vacuna nonavalente confirman un prometedor perfil de seguridad e inmunogenicidad de la vacuna en mujeres jóvenes (tabla 7). Los resultados informan de una alta eficacia de la vacuna frente a CIN2+, VIN2+ y VaIN2+ relacionado con los VPH31, 33, 45, 52 y 58, y una respuesta de anticuerpos frente a VPH6, 11, 16 y 18 noinferior a la generada por la vacuna tetravalente.
Hay que resaltar que, a pesar de los datos disponibles, se requiere continuar estudiando y realizando seguimiento a largo plazo para dar respuesta a preguntas aún pendientes de resolver, como si la protección inducida por la primovacunación se mantendrá de por vida o si serán necesarias dosis de refuerzo; si será posible cambiar de manera generalizada las pautas vacunales a 2 dosis, o incluso a una única dosis, para así favorecer un aumento de la cobertura y reducir los costes; o preguntas relativas al perfil de seguridad a largo plazo.
El desarrollo y la implementación generalizada de las vacunas VPH en las poblaciones preadolescentes pueden significar el principio de la erradicación del cáncer de cuello de útero a nivel mundial y de la disminución drástica de los cánceres de vulva, vagina, ano, pene y orofaringe. Aunque aún faltan años para poder evaluar la efectividad de las vacunas en todo el espectro de enfermedad relacionada con el VPH y a nivel poblacional, ya se ha demostrado una alta efectividad de las vacunas frente a las verrugas genitales en países con programas de vacunación sistemática frente al VPH y altas coberturas.
FinanciaciónEl proyecto ha recibido financiación parcial a través de becas públicas del Instituto de Salud CarlosIII (referencias: RCESP C03/09, RTICESP C03/10, RTIC RD06/0020/0095 RD12/0036/0056, y CIBERESP), de la Agencia de Gestión de Ayudas Universitarias y de Investigación (AGAUR) de la Generalitat de Catalunya (referencias: 2005SGR00695, 2009SGR126 y 2014SGR01077), de la Fundación Lilly y del Departament de Sanitat de la Generalitat de Catalunya. Ninguna de las fuentes ha tenido ningún papel en la confección de esta publicación.
Conflicto de interesesLaia Bruni: ensayos de vacunas VPH y estudios epidemiológicos patrocinados por GlaxoSmithKline, Merck y Sanofi Pasteur MSD.
Beatriz Serrano: ensayos de vacunas VPH y estudios epidemiológicos patrocinados por GlaxoSmithKline, Merck y Sanofi Pasteur MSD. Becas de viaje de asistencia a reuniones científicas ocasionalmente otorgadas por Sanofi Pasteur MSD.
Xavier Bosch: ensayos de vacunas VPH y estudios epidemiológicos patrocinados por GlaxoSmithKline, Merck, Sanofi Pasteur MSD, Qiagen y Roche. Becas de viaje de asistencia a reuniones científicas y/o honorarios por consultoría ocasionalmente otorgadas por GlaxoSmithKline, Merck, Sanofi Pasteur MSD y Qiagen.
Xavier Castellsagué: ensayos de vacunas VPH y estudios epidemiológicos patrocinados por GlaxoSmithKline, Merck, Sanofi Pasteur MSD y Genticel. Becas de viaje de asistencia a reuniones científicas y/o honorarios por conferencias ocasionalmente otorgadas por Sanofi Pasteur MSD, Merck y Vianex.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion