Determinar la utilidad clínica de la detección antigénica de galactomanano (GM) en pacientes con sospecha de aspergilosis invasora.
Materiales y métodosSe realizó un estudio descriptivo retrospectivo, en el que se evaluaron los pacientes a quienes se les realizó la prueba Platelia® para la detección de GM en suero, entre el 1 de enero de 2010 y el 1 de abril de 2012, que hubiesen sido atendidos en el Hospital Universitario San Ignacio; se recolectaron los datos clínicos, microbiológicos y radiológicos para su posterior análisis.
ResultadosSe incluyeron 52 pacientes. Se diagnosticó aspergilosis invasora en 13 pacientes. De estos, el antígeno de GM fue positivo solo en 5 casos, 5 fueron diagnosticados por patología y 3 por clínica y radiología, pues fueron negativos para la patología y para el GM. Se presentaron 3 casos de falsos positivos y 5 de falsos negativos.
ConclusionesLa prueba de GM ha sido un gran avance en la atención médica de los pacientes con neoplasia hematológica. Sin embargo, cada hospital debe evaluar la utilidad de esta prueba en sus propias condiciones, a pesar de que nuestros resultados no muestran un adecuado rendimiento de la prueba, no es posible generalizar su rendimiento y es necesaria la realización de un estudio prospectivo en nuestro medio.
To determine the clinical utility of galactomannan antigen detection in patients with suspect of Invasive Aspergillosis.
Tools and methodsA retrospective descriptive study was performed on patients seen in the University Hospital who were tested with the Platelia® Galactomannan (GM), between the 1st of January 2010 and the 1 st of April of 2012. Clinical, microbiological and radiological data were collected for further analysis.
ResultsA total of 52 patients were included in the study. Invasive Aspergillosis (IA) was detec- ted in 13 patients, in whom the GM antigen was positive in only 5 cases, another 5 cases were detected by pathology, and the remaining 3 were detected clinically and by radiology because they were negative for the pathology and the GM. Additionally, 3 cases were false positives and 5 cases were false negative.
ConclusionsThe GM test has been a big advance in the medical care of patients with hema- tological malignancies. However, each hospital must evaluate the utility of these test in their own conditions, as our results do not show good performance of the test, these results can not be generalized. There is a need to perform a prospective study on this aspect.
Durante la última década, el aumento en la prevalencia de las infecciones fúngicas ha sido constante, debido fundamentalmente al incremento de pacientes inmunocomprometidos, el uso generalizado de antimicrobianos y el aumento en la utilización de inmunosupresores, maniobras diagnósticas invasivas e implementación de alimentación parenteral, entre otros1.
Aunque las especies de Candida y otras levaduras constituyen una importante causa de enfermedad fúngica invasora, otros géneros, particularmente los hongos filamentosos, han ido incrementando su prevalencia. Concretamente, las especies del género Aspergillus son en la actualidad la principal causa de enfermedad fúngica invasora por hongos filamentosos en pacientes con neutropenia prolongada, infección avanzada por el virus de la inmunodeficiencia humana e inmunodeficiencia hereditaria, y de pacientes sometidos a trasplante alogénico de células madre hematopoyéticas o a trasplante de órgano sólido1,2.
El género Aspergillus está constituido por hongos filamentosos que, habitualmente, se reproducen de forma asexual por conidios (Deuteromycetes), con algunas especies que también presentan reproducción sexual (Ascomycetes). Aunque se han descrito más de 180 especies, Aspergillus fumigatus, A. fla-vus y A. niger causan el 95% de las infecciones en humanos3. Pueden causar un amplio espectro de infecciones en el ser humano que van desde las formas superficiales (otitis externas fúngicas, onicomicosis, queratomicosis, infecciones de heridas y quemaduras) a la aspergilosis invasora (AI), que plantea los mayores retos diagnósticos al microbiólogo y al clínico4.
La AI es una causa de morbimortalidad en pacientes inmunocomprometidos2; la presentación clínica de la AI es variable, inespecífica y tardía, siendo esencial sospecharla en situaciones de riesgo5.
Adicionalmente, el diagnóstico de esta entidad continúa siendo difícil por la poca especificidad de las manifestaciones clínicas, y en algunos casos, la inexistencia de hallazgos radiológicos patognomónicos, además de la baja sensibilidad que presentan los métodos convencionales de diagnóstico de laboratorio existentes6. Con el objetivo de mejorar y adelantar el diagnóstico para instaurar un tratamiento antifúngico dirigido que permita disminuir la mortalidad asociada a la AI, se han desarrollado técnicas serológicas alternativas al cultivo basadas en la detección de antígenos tales como el polisacárido celular denominado galactomanano (GM)7, un componente de la pared celular del género Aspergillus y principal exoantígeno liberado durante la invasión tisular8.
En la actualidad, existe una prueba comercial de ELISA para la detección de antígeno GM de Aspergillus9, el cual utiliza el anticuerpo monoclonal de ratón EB-A2 y reconoce las cadenas laterales de 1-5-D-galactofuranósido de las moléculas de GM.
Estudios publicados hasta el momento de la detección antigénica de GM han demostrado que este analisis contribuye al diagnóstico precoz de la AI, presentando una sensibilidad y especificidad muy aceptable, que tiende a aumentar en la medida que se realice un estudio seriado (muestras de diferentes días) de los niveles de dicho antígeno, en algunos casos, antes de la aparición de los síntomas y signos clínicos10,11.
Otras publicaciones establecen que los títulos de GM son proporcionales a la carga fúngica en tejido, y que además de tener importancia en el diagnóstico precoz, sus niveles parecen tener importancia pronóstica, con la disminución de dichos niveles posterior al inicio de terapia antifúngica12,13.
En el Hospital San Ignacio, se implementó, desde el año 2010, la prueba GM Platelia®, pero se desconoce hasta el momento cuál ha sido su utilidad clínica y el desenlace de los pacientes a quienes se les ha solicitado. El presente estudio pretende determinar la utilidad clínica de la detección antigénica de GM en pacientes con sospecha de AI, describir las características demográficas y clínicas de los pacientes con AI y correlacionar las pruebas diagnósticas Platelia®, con presentación clínica, imágenes diagnósticas, hallazgos histopatológicos y cultivos micóticos solicitados.
Materiales y métodosSe realizó un estudio descriptivo retrospectivo de corte longitudinal, en el que se incluyeron todos los pacientes a quienes se les realizó la prueba para la detección de GM en suero entre el 1 de enero de 2010 y el 1 de abril de 2012, que hubiesen sido atendidos en el Hospital Universitario San Ignacio, tuvieran estudios microbiológicos y/o de histopatología orientados a la detección del hongo y contaran con información completa en la historia clínica.
Para la detección de antígenos de Aspergillus en suero, se utilizó la prueba Platelia®, una determinación inmu-noenzimática en sándwich en microplacas de un solo paso que detecta GM en suero humano. En el método, se utilizan anticuerpos monoclonales EBA-2 de rata, que se dirigen contra el GM de Aspergillus8.
La presencia o ausencia del antígeno GM en la muestra en estudio se determina calculando el índice (I) para cada muestra del paciente. El I es la densidad óptica de la muestra/densidad óptica media de los pocillos que contienen el suero de control del valor umbral. Los sueros con un I ≥ 0,50 se consideran positivos para el antígeno GM; sueros con un I < 0,50 se consideran negativos. Se recomienda la realización de pruebas seriadas, 2 a la semana14.
Los resultados de la prueba fueron obtenidos del laboratorio clínico del Hospital San Ignacio; posteriormente, se obtuvieron datos de la historia clínica para determinar factores de riesgo (trasplante, uso de esteroides, neutropenia, neoplasia hematológica, virus de la inmunodeficiencia humana, diabetes mellitus no controlada, tumor de órgano sólido, quimioterapia), presentación clínica, resultado de imágenes diagnósticas, resultados histopatológicos y uso de antibióticos previos.
La AI fue definida y clasificada en: confirmado, probable y posible, según los criterios de European Organization for Research and Treatment of Cancer/Mycoses Study Group15:
- •
Caso confirmado: documentación histopatológica de la infección o un resultado positivo de cultivo de una muestra tomada de un sitio normalmente estéril.
- •
Caso probable: requiere el cumplimiento de criterios dentro de 3 categorías: 1) factores relacionados con el huésped; 2) manifestaciones clínicas (síntomas y signos, y signos radiológicos compatibles), y 3) datos microbiológicos (incluye pruebas indirectas).
- •
Caso posible: paciente con factores de riesgo para AI y presentación clínica compatible, sin evidencia microbiológica o histopatológica, y cuando se ha descartado otro diagnóstico que explique el cuadro.
Para el análisis estadístico, se utilizó el programa SPSS versión 2.0, en donde se calcularon frecuencias absolutas a las variables descriptivas y promedio a variables cuantitativas.
Esta investigación estuvo sujeta a los principios de la declaración de Helsinky. Por su carácter retrospectivo, este estudio no requiere consentimiento informado.
ResultadosDurante el período comprendido entre el 1 de enero de 2010 y el 1 de abril de 2012, la prueba Platelia® fue realizada a 125 pacientes, de los cuales solo 52 cumplían los criterios de inclusión.
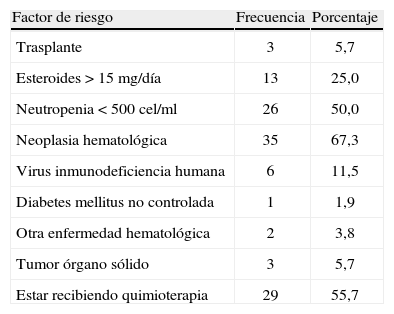
El 53,8% de los pacientes eran de sexo femenino, la edad promedio fue de 33,7 años (desviación estándar +/- 19,5) y el promedio de días de estancia hospitalaria fue de 28,2 días; fiebre, tos y disnea fueron las principales manifestaciones clínicas. En la tabla 1 se describen los factores de riesgo para AI en la población estudiada.
Factores de riesgo en pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Factor de riesgo | Frecuencia | Porcentaje |
| Trasplante | 3 | 5,7 |
| Esteroides > 15mg/día | 13 | 25,0 |
| Neutropenia < 500cel/ml | 26 | 50,0 |
| Neoplasia hematológica | 35 | 67,3 |
| Virus inmunodeficiencia humana | 6 | 11,5 |
| Diabetes mellitus no controlada | 1 | 1,9 |
| Otra enfermedad hematológica | 2 | 3,8 |
| Tumor órgano sólido | 3 | 5,7 |
| Estar recibiendo quimioterapia | 29 | 55,7 |
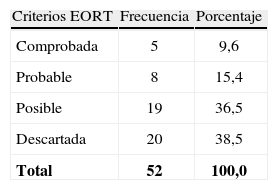
Se diagnosticó AI en 13 pacientes, los cuales fueron clasificados según los criterios de European Organization for Research and Treatment of Cancer (tabla 2).
Criterio European Organization for Research and Treatment of Cancer pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Criterios EORT | Frecuencia | Porcentaje |
| Comprobada | 5 | 9,6 |
| Probable | 8 | 15,4 |
| Posible | 19 | 36,5 |
| Descartada | 20 | 38,5 |
| Total | 52 | 100,0 |
EORT: European Organization for Research and Treatment of Cancer
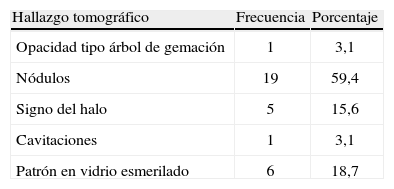
A todos los pacientes, se les realizó alguna imagen diagnóstica como radiografía de tórax y/o tomografía axial computarizada; los hallazgos tomográficos más relevantes de los 32 pacientes a quienes se les realizó tomografía axial computarizada se describen en la tabla 3.
Hallazgos tomográficos en pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Hallazgo tomográfico | Frecuencia | Porcentaje |
| Opacidad tipo árbol de gemación | 1 | 3,1 |
| Nódulos | 19 | 59,4 |
| Signo del halo | 5 | 15,6 |
| Cavitaciones | 1 | 3,1 |
| Patrón en vidrio esmerilado | 6 | 18,7 |
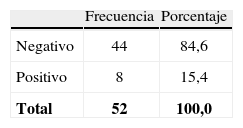
La prueba Platelia® fue positiva en 8 pacientes, 7 con la primera muestra y solo 1 fue positivo con la segunda muestra realizada a las 2 semanas (tabla 4).
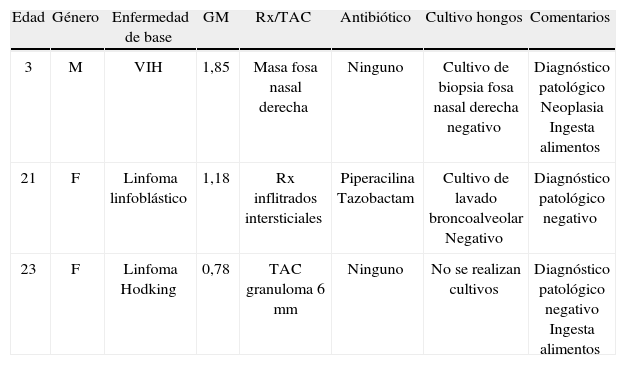
De las pruebas con resultado positivo, 3 se consideraron falsos positivos, 1 de ellas asociada al uso concomitante de piperacilina-tazobactam y los otros 2 a la ingesta de alimentos (tabla 5).
Casos falsos positivos en pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Edad | Género | Enfermedad de base | GM | Rx/TAC | Antibiótico | Cultivo hongos | Comentarios |
| 3 | M | VIH | 1,85 | Masa fosa nasal derecha | Ninguno | Cultivo de biopsia fosa nasal derecha negativo | Diagnóstico patológico Neoplasia Ingesta alimentos |
| 21 | F | Linfoma linfoblástico | 1,18 | Rx inflitrados intersticiales | Piperacilina Tazobactam | Cultivo de lavado broncoalveolar Negativo | Diagnóstico patológico negativo |
| 23 | F | Linfoma Hodking | 0,78 | TAC granuloma 6mm | Ninguno | No se realizan cultivos | Diagnóstico patológico negativo Ingesta alimentos |
F: femenino; GM: galactomanano; M: masculino; Rx: radiografía; TAC: tomografía axial computarizada; VIH: virus de la inmunodeficiencia humana
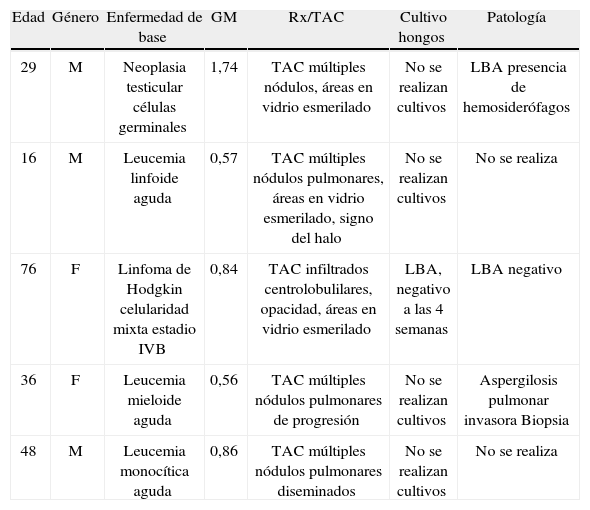
De los 13 pacientes que fueron diagnosticados con AI, el antígeno de GM fue positivo en solo en 5 casos, 5 fueron diagnosticados por patología y 3 por radiología y clínica, pues fueron negativos para la patología y para el GM (tabla 6).
Casos positivos en pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Edad | Género | Enfermedad de base | GM | Rx/TAC | Cultivo hongos | Patología |
| 29 | M | Neoplasia testicular células germinales | 1,74 | TAC múltiples nódulos, áreas en vidrio esmerilado | No se realizan cultivos | LBA presencia de hemosiderófagos |
| 16 | M | Leucemia linfoide aguda | 0,57 | TAC múltiples nódulos pulmonares, áreas en vidrio esmerilado, signo del halo | No se realizan cultivos | No se realiza |
| 76 | F | Linfoma de Hodgkin celularidad mixta estadio IVB | 0,84 | TAC infiltrados centrolobulilares, opacidad, áreas en vidrio esmerilado | LBA, negativo a las 4 semanas | LBA negativo |
| 36 | F | Leucemia mieloide aguda | 0,56 | TAC múltiples nódulos pulmonares de progresión | No se realizan cultivos | Aspergilosis pulmonar invasora Biopsia |
| 48 | M | Leucemia monocítica aguda | 0,86 | TAC múltiples nódulos pulmonares diseminados | No se realizan cultivos | No se realiza |
F: femenino; GM: galactomanano; LBA: lavado broncoalveolar; M: masculino; Rx: radiografía; TAC: tomografía axial computarizada
Se les realizaron cultivos para hongos a 31 pacientes, los cuales en todos los casos fueron negativos a las 4 semanas de incubación. Las muestras cultivadas fueron en el 64,5% (n=20) de los casos provenientes de lavado broncoalveolar (LBA), 19,5% (n=6) de líquido pleural y 16,1% (n=5) de biopsia pulmonar.
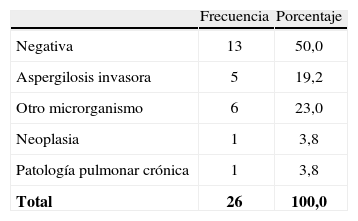
PatologíaA 26 pacientes, se les realizó examen histopatológico, encontrando 5 pacientes con diagnóstico de AI, pero todos con resultado de antígeno de GM negativo (tabla 7).
Los hallazgos histopatológicos en 6 pacientes correspondieron a la presencia de otro microrganismo diferente a Aspergillus spp. Se hallaron 2 casos de Pneumocystis jiroveci, 1 caso de Cryptococcus spp., 1 caso de Mycobacterium tuberculosis y 2 casos de neumonía por Staphylococcus aureus.
El 11,4% (n=22) de los pacientes habían recibido antibióticos en las 2 semanas anteriores a la realización de la prueba, entre los que destacan piperacilina/tazobactam (n=9) y cefepime (n=9).
De los 13 pacientes diagnosticados con AI, fallecieron 3 pacientes.
DiscusiónLa AI se ha convertido en una de las causas infecciosas más importantes de morbilidad en pacientes inmunocomprome-tidos, con una incidencia de 2–40% según la serie, cada vez más común y a menudo mortal en pacientes con neoplasias hematológicas y neutropenia prolongada16,17.
Las formas clínicas locales más frecuentes de AI tienen lugar en el ámbito pulmonar y en los senos paranasales, aunque también pueden afectar al tracto gastrointestinal o a la piel, por inoculación directa.
En el estudio, la sintomatología encontrada con más frecuencia fue fiebre, tos y disnea, teniendo en cuenta que la aspergilosis pulmonar puede cursar con una sintomatología inespecífica. La clásica tríada descrita en pacientes neutropénicos asocia fiebre, dolor pleurítico y hemoptisis. No obstante, en cualquier paciente con factores de riesgo, la presencia de síntomas respiratorios junto a la presencia de nódulos o infiltrados pulmonares deben hacer pensar en una aspergilosis pulmonar18.
La radiografía de tórax no es específica, pero la tomografía axial computarizada puede mostrar lesiones focales características. La aspergilosis pulmonar suele presentar uno o múltiples nódulos, con o sin cavitación, con consolidación segmentaria, infiltrado peribronquial o derrame pleural. Al igual que las manifestaciones clínicas, los hallazgos radiológicos dependen de las características del huésped. La progresión radiológica en la aspergilosis pulmonar ha sido más estudiada en pacientes neutropénicos.
En estos pacientes, los hallazgos iníciales suelen incluir nódulos con un contorno atenuado a su alrededor (signo del halo) que refleja hemorragia y edema circundante a la lesión18.
Los patrones tomográficos más comunes de aspergilosis pulmonar invasora son imágenes cavitadas de paredes finas, áreas de consolidación segmentaría, áreas de vidrio esmerilado y nódulos con signo del halo, siendo este signo no específico, pues también se puede encontrar en pacientes inmunodeprimidos, con infecciones por Cándida, cito mega lovi rus, herpes, coccidioidiomicosis y sarcoma de Kaposi19; sin embargo, en el estudio solo se presentó el signo del halo en 5 pacientes, y 19 presentaron nódulos pulmonares.
Entre los factores de riesgo encontrados en los 5 pacientes que fueron positivos para el antígeno de GM, cabe destacar que como enfermedad de base, 4 pacientes padecían de leucemia y 1 de neoplasia testicular, todos se encontraban neutropénicos y en manejo con quimioterapia. Es importante resaltar que solo uno de ellos fue positivo en el examen patológico.
En Colombia, existen pocas publicaciones que determinan el rendimiento de la prueba Platelia® de Aspergillus. La reciente publicación, en al año 2010, por parte del grupo de la Universidad Pontificia Bolivariana de Mede-llín, sugiere un regular comportamiento de la prueba20; en dicho estudio, la prueba Platelia® fue positiva en 31 pacientes (39,7%), en 50% de los pacientes colonizados, y en 17 (47,2%) de los 36 pacientes que recibian betalactá-micos, la prueba fue positiva.
Para evaluar la exactitud del GM, en el año 2006 se realizó un metanálisis10 que incluyó 27 estudios realizados entre los años 1996 y 2005. Los casos inculidos de AI fueron diagnosticados de acuerdo con los criterios European Organization for Research and Treatment of Cancer/Myco-ses Study Group/Mycoses Study Group. La sensibilidad y especificidad repotada en los casos probados de AI en este metanálisis fue del 71 y 89%, respectivamente. El valor predictivo negativo fue de 92–98%, y el valor predictivo positivo fue del 25–62%. Este metanálisis también concluye que el GM es más útil en pacientes que tienen malignidad hematológica o que han sido sometidos a trasplante alo-génico que en trasplante de órganos sólidos o pacientes no neutropénicos.
La especificidad de GM se ve reducida por la posibilidad de falsos positivos, habitualmente asociados al uso de beta-lactámicos. En el presente estudio, se presentaron 3 casos de falsos positivos, uno de ellos asociado al uso concomitante de piperacilina-tazobactam; los antibióticos derivados de hongos podrían estar asociados con resultados falsos positivos, como la ampicilina/sulbactam, piperacilina/tazobactam y amoxicilina/ácido clavulánico. Entre estos, los mayores casos de falsos positivos para la prueba de GM han sido en pacientes que han recibido piperacilina/tazobactam21.
Sin embargo, en un estudio reciente22 que incluyó a 207 pacientes, y comparó el uso de piperacilina-tazobactam de 3 fabricantes, no identificó ninguna asociación significativa entre los falsos positivos de GM y el fabricante 1 y 3, pero no fue así para el fabricante 2, en el que si existió una asociación significativa; estos resultados sugieren que la asociación entre los falsos positivos de GM y piperacilina-tazobactam no es sistemática, pero todavía puede prevalecer dependiendo de los fabricantes.
El GM se encuentra en los alimentos y puede ser absorbido por el tracto digestivo, especialmente en pacientes posquimioterapia por mucositis, resultando en una reacción de falsos positivos. En el estudio, hubo 2 casos asociados a la ingesta de lácteos.
La cuantificación de GM como técnica de diagnóstico precoz se considera un método de cribado. Por eso, se deben realizar determinaciones seriadas en suero en enfermos con riesgo de infección. Se aconsejan 2 a la semana, ya que así se incrementan su sensibilidad y su valor predictivo negativo. Los puntos de corte para considerar un resultado positivo es un I por encima de 0,7 en una única muestra, o por encima de 0,5 en 2 muestras consecutivas23. En este estudio, solo se les realizó cuantificación seriada de GM a 8 de los 52 pacientes, y en solo en uno de ellos la segunda prueba fue positiva.
Sería importante tener en cuenta este hallazgo e imple-mentar el uso de pruebas seriadas en la institución, ya que un único resultado de GM negativo no descarta el diagnóstico de AI.
Ahora, con respecto al tipo de paciente, la literatura dice que la sensibilidad de la prueba supera el 80% si se analizan solo los enfermos sometidos a trasplante de precursores hematopoyéticos, siendo aún mayor en trasplantes alogénicos (> 85%). Sin embargo, la sensibilidad desciende significativamente en enfermos no neutropénicos, por lo que no se recomienda como técnica de cribado en otros grupos de enfermos. En pacientes pediátricos, existen menos estudios, aunque también es útil en enfermos de alto riesgo, si bien varios trabajos han destacado que esta técnica tiene muchos falsos positivos cuando se realiza en niños24. En este estudio, se les realizó GM a 5 pacientes (2,6%) pediátricos, de los cuales hubo 1 caso falso positivo asociado a la ingesta de lácteos previa a la toma de la muestra; en ningún caso, el GM fue positivo, y se descartó AI en todos los pacientes pediátricos.
Aunque los datos clínicos y radiológicos son de gran ayuda, el diagnóstico debe ser establecido mediante la combinación de datos histológicos (visualización de hifas compatibles con las de Aspergillus) y micro biológicos (visualización de hifas en el examen en fresco y aislamiento de Aspergillus en cultivo), dado que ninguno de ellos puede, por sí solo, asegurar el diagnóstico. La visualización directa de hifas sugestivas de Aspergillus (hifas hialinas septadas de unos 2mm de diámetro con ramificaciones en ángulos de 45°) en el examen directo suele ser un dato con alto valor predictivo de enfermedad en el contexto clínico adecuado.
Si analizamos la utilidad del aislamiento de Aspergillus por cultivo convencional, es un proceso lento, con una sensibilidad diagnóstica baja (15–20%); algunos autores señalan que esta sensibilidad alcanza cifras del 50% (aún baja), cuando la muestra proviene de broncoscopias (LBA, cepillados bronquiales, biopsias)24; sin embargo, estos procedimientos invasores son difíciles de realizar en los pacientes con AI, debido a la trombocitopenia, hipoxia y mal estado general que presentan la mayoría de las veces.
La baja sensibilidad del cultivo reportada en la literatura puede ser la razón por la cual todos los cultivos de los pacientes con AI en este estudio fueron negativos, y podría explicar por qué en 3 pacientes se observaron hifas en la patología pero el cultivo fue negativo.
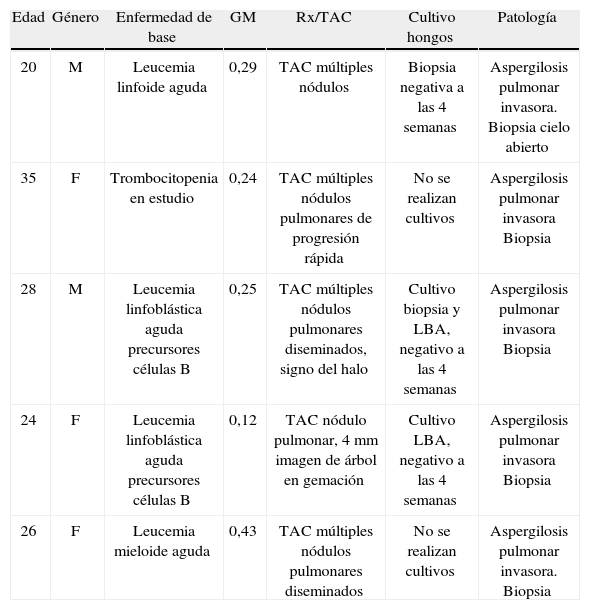
Por tratarse de un estudio retrospectivo, no es posible evaluar el desempeño diagnóstico de la prueba; es importante resaltar los 5 casos de falsos negativos que se presentaron en este estudio (tabla 8), pues correspondían a pacientes con manifestaciones clinicas, imágenes radiológicas que sugerían el diagnóstico de AI; en todos los casos, el resultado de patología confirmó el diagnóstico, lo anterior sugiere un regular comportamiento de la prueba.
Casos falsos negativos en pacientes a quienes se les realizó prueba Platelia®, Hospital Universitario San Ignacio 2010–2012.
| Edad | Género | Enfermedad de base | GM | Rx/TAC | Cultivo hongos | Patología |
| 20 | M | Leucemia linfoide aguda | 0,29 | TAC múltiples nódulos | Biopsia negativa a las 4 semanas | Aspergilosis pulmonar invasora. Biopsia cielo abierto |
| 35 | F | Trombocitopenia en estudio | 0,24 | TAC múltiples nódulos pulmonares de progresión rápida | No se realizan cultivos | Aspergilosis pulmonar invasora Biopsia |
| 28 | M | Leucemia linfoblástica aguda precursores células B | 0,25 | TAC múltiples nódulos pulmonares diseminados, signo del halo | Cultivo biopsia y LBA, negativo a las 4 semanas | Aspergilosis pulmonar invasora Biopsia |
| 24 | F | Leucemia linfoblástica aguda precursores células B | 0,12 | TAC nódulo pulmonar, 4mm imagen de árbol en gemación | Cultivo LBA, negativo a las 4 semanas | Aspergilosis pulmonar invasora Biopsia |
| 26 | F | Leucemia mieloide aguda | 0,43 | TAC múltiples nódulos pulmonares diseminados | No se realizan cultivos | Aspergilosis pulmonar invasora. Biopsia |
F: femenino; GM: galactomanano; LBA: lavado broncoalveolar; M: masculino; Rx: radiografía; TAC: tomografía axial computarizada.
Recientes estudios reportan que la sensibilidad de la detección de GM en suero es < 50%25, pero en el LBA puede superar el 90%26. Se han publicado datos sobre la utilización de la cuantificación de GM en LBA en enfermos hematológicos27, con un punto de corte de 1; la sensibilidad de la técnica supera el 90%, con un valor predictivo positivo del 95%.
La cuantificación de GM en esta muestra respiratoria se está convirtiendo en una prueba de gran utilidad diagnóstica, que podría convertirse en una alternativa para el diagnóstico de AI.
Sería importante evaluar la técnica para LBA, y realizar estudios comparativos con GM en suero.
ConclusiónLa prueba de GM ha sido un gran avance en la atención médica de los pacientes con neoplasia hematológica. Sin embargo, cada hospital debe evaluar la utilidad de esta prueba en sus propias condiciones, la características específicas de los pacientes, así como ciertas prácticas terapéuticas, es decir, el uso de piperacilina-tazobactam en pacientes neutropénicos febriles, aunque nuestros resultados no muestran un adecuado rendimiento de la prueba, no es posible generalizar su rendimiento y es necesaria la realización de un estudio prospectivo en nuestro medio.
Conflicto de interesesLos autores declaran no tener conflictos de intereses.