Introducción
El tratamiento antirretroviral (TARV) de la mujer infectada por el virus de la inmunodeficiencia humana (VIH) durante el embarazo ha tenido que superar las reticencias y confusiones que supuso plantearlo inicialmente con dos objetivos que podrían confrontar: por un lado, como quimioprofilaxis de la transmisión vertical y, por otro, como el tratamiento de la mujer infectada1. Ya nadie pone en duda el principio de que la mejor quimioprofilaxis para el niño es justamente el tratamiento óptimo de la madre2,3 ni que la mujer embarazada debe recibir el mejor TARV posible4.
La problemática que surge alrededor del embarazo de las pacientes infectadas por el VIH es compleja y requiere un abordaje multidisciplinario. En este sentido, el reciente documento de consenso de pediatras, obstetras y clínicos constituye un buen marco de referencia5. El presente documento se centrará únicamente en la elección y uso de los fármacos antirretrovirales en la mujer embarazada por los problemas medicamentosos singulares que se originan durante la gestación, que se resumen en cuatro: ¿Hay que hacer ajuste de dosis de los fármacos por los cambios que se producen en el organismo femenino durante el embarazo? ¿Cuáles son los riesgos de los antirretrovirales para el feto o recién nacido? ¿Es la mujer más sensible a ciertas toxicidades farmacológicas en este período? ¿Existe alguna otra razón para cambiar un TARV previamente eficaz?
Farmacocinética de los antirretrovirales durante el embarazo
Durante el embarazo se producen una serie de cambios fisiológicos en el organismo de la mujer que podrían afectar la farmacocinética de los diferentes medicamentos antirretrovirales. Estas modificaciones fisiológicas incluyen el enlentecimiento del ritmo intestinal, aumento del agua corporal y del volumen de distribución, incremento del gasto cardíaco y del flujo plasmático renal y hepático, así como cambios en las vías enzimáticas del metabolismo hepático. Por otro lado, la disponibilidad real de los fármacos para la madre puede verse reducida por efecto del paso transplacentario y metabolismo, biotransformación o eliminación por la placenta o el propio feto.
La información sobre la farmacocinética de los antirretrovirales en embarazadas es muy limitada. De los inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) sólo se han publicado algunos datos con lamivudina (3TC) y didanosina (ddI). En ambos casos, son resultados preliminares obtenidos en series cortas, pero los parámetros farmacocinéticos tras administración oral no se vieron significativamente afectados por la gestación6. Tampoco con nevirapina (NVP) se han encontrado diferencias notables7. Respecto a los inhibidores de la proteasa (IP) se han realizado estudios con indinavir (IDV), nelfinavir (NFV) y saquinavir (SQV)-SCG. Administrados en dosis habituales los valores séricos de los 3 fármacos se han encontrado más bajos en las mujeres estudiadas durante el embarazo que en el puerperio o en no embarazadas. Esto ha llevado a modificar el diseño de los estudios para los dos últimos, incrementando la dosis6. En el caso del IDV el problema se solventa añadiendo dosis bajas de ritonavir (RTV).
La dosificación de estavudina (d4T) y ddI en adultos se ajusta al peso del paciente, recomendándose dosis diferentes por encima y por debajo de los 60 kg. Puede suceder que una mujer que pesaba menos de 60 kg antes del embarazo supere ese límite durante el mismo, planteándose la posibilidad de ajustar la dosis de medicación al nuevo peso. Por lo habitual se sigue dosificando según el peso previo al embarazo, aunque no hay datos al respecto.
Teratogenicidad/toxicidad infantil
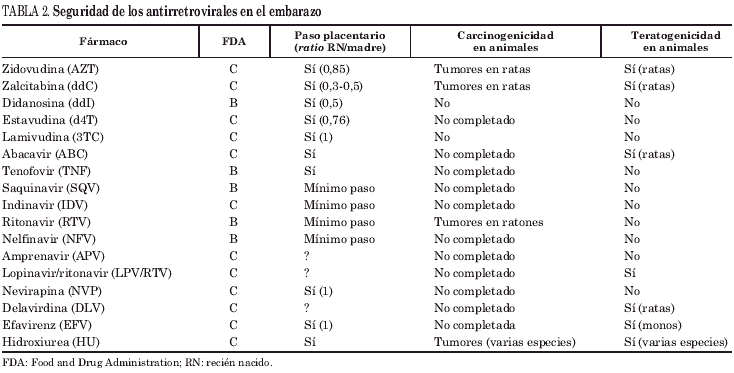
Los datos disponibles sobre los efectos de los fármacos antirretrovirales sobre el feto y/o el desarrollo ulterior del niño no son muy numerosos. En la tabla 1 se recogen los criterios de seguridad durante el embarazo de los fármacos según la Food and Drug Administration (FDA). Como se observa en la tabla 2 ninguno de los antirretrovirales se incluye en la categoría A y la mejor calificación que alcanzan es la B y sólo para cinco de ellos. A continuación se recogen los datos obtenidos de estudios en seres humanos. Para información más detallada, incluyendo estudios en animales de experimentación, se recomienda consultar un exhaustivo informe con actualización periódica6.
Inhibidores de la transcriptasa inversa análogos de nucleósidos
La zidovudina (AZT) es el fármaco con el que se ha reunido mayor experiencia y puede considerarse razonablemente seguro, al menos a corto y medio plazo. En 4 estudios de uso perinatal de AZT comparada con placebo el único efecto adverso observado fue la anemia en las primeras 6 semanas de vida sin repercusión posterior, que además podría tener más relación con la fase de tratamiento del recién nacido que con la del tratamiento materno8,9. Los datos del seguimiento hasta casi 6 años después de exposición intrauterina de estos niños no han encontrado diferencias en diversos parámetros neurológicos, inmunológicos o de desarrollo respecto a los que recibieron placebo10 ni tampoco se ha encontrado mayor incidencia de tumores11. Otro estudio prospectivo con seguimiento ecocardiográfico tampoco encontró asociación entre exposición intrauterina al AZT y alteraciones cardíacas12.
El uso de 3TC en monoterapia o asociada a AZT no se ha relacionado con toxicidad significativa en los pocos trabajos publicados13,14. En el estudio americano no se observaron diferencias en los efectos adversos en los niños en ambos grupos, con excepción de la toxicidad hematológica. Las cifras de hemoglobina al nacer y al mes fueron significativamente menores en el grupo de biterapia que en el grupo AZT, al igual que el recuento leucocitario al nacimiento14.
Tampoco se ha encontrado toxicidad infantil con ddI en la corta experiencia obtenida del PACTG 2496.
No se han publicado estudios en humanos con zalcitabina (ddC), d4T ni abacavir (ABC).
Todos los fármacos de esta familia actúan sobre las ADN polimerasas de la célula eucariota que, al igual que la transcriptasa inversa viral, utilizan los ITIAN como sustratos, lo cual bloquea la elongación de la cadena de ADN. La ADN polimerasa g es la responsable de la replicación del ADN mitocondrial y su inhibición por los ITIAN conduce a la depleción del ADN mitocondrial y de las proteínas por él codificadas entre las que destacan las de la fosforilación oxidativa. La potencia inhibitoria frente a la ADN polimerasa g no es la misma para los diferentes ITIAN, según los estudios in vitro es máxima para el ddC, seguido en orden descendiente, de ddI, d4T y AZT, esta capacidad inhibitoria es más baja para 3TC y ABC15.
En 1999, se publicó un estudio francés que encontraba, entre 1.754 niños con exposición intrauterina a ITIAN, 8 niños no infectados que presentaron a los pocos meses de nacer clínica de disfunción mitocondrial16. Dos de ellos cursaron con enfermedad neurológica grave y fallecimiento al año de edad; en ambos, sus madres habían recibido durante el embarazo AZT + 3TC. De los restantes niños, tres manifestaron síntomas neurológicos acompañados en un caso de miocardiopatía transitoria y los otros tres presentaron alteraciones bioquímicas asintomáticas. El TARV de sus madres había sido monoterapia con AZT en 4 casos y combinación de AZT + 3TC en los otros dos. En los 8 niños se encontraron alteraciones enzimáticas mitocondriales, pero sólo en tres se determinó la concentración del ADN mitocondrial y no se demostró depleción.
Esto hizo surgir la alarma, generando inquietud sobre la seguridad de los ITIAN durante el embarazo, aunque la relación de estos procesos con los fármacos se puso en cuestión desde el principio17. Un exhaustivo estudio sobre 353 muertes infantiles en cinco grandes cohortes perinatales de Estados Unidos, que incluían más de 20.000 niños nacidos de madres seropositivas, no encontró ningún caso similar9.
Recientemente se han comunicado 3 casos de acidosis láctica e hipoglucemia en recién nacidos no infectados hijos de madres seropositivas que habían recibido durante el embarazo TARV con AZT + 3TC + NVP18. Los 3 niños respondieron al tratamiento y se encontraban asintomáticos tras un seguimiento de 2 años. Los autores de la comunicación interpretan el cuadro como toxicidad mitocondrial aguda exacerbada por el estrés neonatal y añaden que todos los niños expuestos a este tipo de TARV deben ser estrechamente vigilados desde el punto de vista metabólico. Un estudio prospectivo reciente sobre acidosis láctica en recién nacidos con exposición intrauterina a TARV triple y AZT neonatal ha encontrado que 23 de los 25 niños tenían niveles séricos elevados de ácido láctico. Sólo uno de los niños presentó clínica compatible aunque inespecífica (irritabilidad) y la hiperlactatemia se resolvió en la mayoría a los 6 meses de vida19.
El mismo grupo francés, antes citado, ha descrito una mayor incidencia de convulsiones febriles en los niños con exposición perinatal a ITIAN que en los niños cuyas madres no recibieron TARV. Los autores concluyen que es un dato observacional de patogenia incierta20.
En conclusión, aunque patogénicamente plausible, está todavía por demostrar fuera de toda duda la relación causa-efecto de la exposición intrauterina a los ITIAN y la disfunción mitocondrial en el recién nacido. Hasta que no se disponga de nueva información y dada la rareza de las formas graves pensamos que el beneficio de los ITIAN tanto para la mujer embarazada como en la disminución de la transmisión vertical permiten asumir este riesgo.
Inhibidores de la transcriptasa inversa análogos de nucleótidos
El tenofovir (TNF) es el único representante de los inhibidores de la transcriptasa inversa análogos de nucleótidos (ITIANT) que se encuentra disponible clínicamente y su aprobación en Europa está muy próxima. Catalogado como categoría B por la Food and Drug Administration (FDA), no se dispone de estudios durante el embarazo en seres humanos. Al igual que los ITIAN es inhibidor de la ADN polimerasa g pero su capacidad inhibitoria parece baja, encontrándose en el rango de la del 3TC o ABC en los estudios in vitro21.
Inhibidores de la transcriptasa inversa no nucleósidos
Los 3 fármacos de esta familia han recibido la misma calificación, categoría C, por parte de la FDA; sin embargo, desde el punto de vista clínico y la realidad de la consulta diaria son totalmente diferentes.
El hallazgo de teratogenicidad en primates con efavirenz (EFV) ha llevado a no plantear estudios en seres humanos y que se proscriba totalmente su uso durante el embarazo. Esta advertencia consta en el prospecto del fármaco.
La delavirdina (DLV) no se ha evaluado en estudios prospectivos en embarazadas. Sin embargo, la experiencia negativa recogida en 7 embarazos no planeados y que continuaron tomando este fármaco6 hace que su uso no sea recomendable.
La experiencia con NVP es más amplia, aunque los estudios prospectivos publicados se han centrado fundamentalmente en pautas ultracortas dirigidas a la prevención de la transmisión vertical. Las series descriptivas de gestantes en tratamiento triple con NVP han mostrado un buen perfil de seguridad infantil22,23.
Los inhibidores de la transcriptasa inversa no nucleósidos (ITINN) no inhiben la ADN polimerasa g por lo que no se han implicado en la toxicidad mitocondrial.
Inhibidores de la proteasa
Como se comentó previamente se han realizado estudios en fase I con los IP más veteranos y ninguno de los 4 fármacos ha mostrado toxicidad infantil. Dado que el IDV puede producir elevación de la bilirrubina indirecta en los adultos se ha cuestionado su uso en el embarazo por el riesgo teórico de exacerbar la ictericia neonatal24. Esta preocupación no se ha confirmado, pues no se ha descrito ni en modelos animales ni en los ensayos en fase I en embarazadas6 ni en la experiencia en más de 250 mujeres que recibieron el fármaco durante el embarazo25.
No existe todavía experiencia con amprenavir (APV) ni con lopinavir (LPV)/RTV.
Un problema todavía no definitivamente resuelto es si el TARV triple con IP induce o no prematuridad. Las primeras voces de alarma surgieron con la publicación de una cohorte suiza de 13 embarazadas que recibieron TARV de combinación doble y 17 triple con IP y se encontró un porcentaje de prematuridad del 33%26. En una amplia serie europea se recoge la evolución de 3.920 embarazadas seropositivas27, es destacable que solamente 896 (23%) habían recibido algún tipo de TARV y que éste fue AZT en monoterapia en la gran mayoría (573 mujeres, tres cuartas partes de las tratadas). Se encontró una tasa de prematuridad del 17%. El TARV triple con IP suponía un riesgo relativo ajustado del 2,60 y del 1,86 para el tratamiento con 2 ITIAN. También se encontró que las mujeres que ya estaban en tratamiento al quedar embarazadas tenían un riesgo de prematuridad de 2,17 frente aquellas que iniciaban el TARV en el tercer trimestre.
En contraste con estos datos, en una amplia serie de Estados Unidos en la que 1.150 de las 1.472 embarazadas (78%) habían recibido tratamiento combinado no se encontró asociación entre el uso de éste y prematuridad. De hecho, las mayores tasas de parto prematuro se encontraron en las mujeres que no habían recibido tratamiento. Este hallazgo es concordante con las descripciones de series históricas que describían tasas elevadas de prematuridad en mujeres no tratadas6.
En 1989, se estableció el Antiretroviral Pregnancy Register, donde se recogen prospectivamente los datos de exposición a antivirales y la evolución de los niños. La prevalencia de malformaciones en los expuestos al TARV durante el primer trimestre de embarazo materno no se ha encontrado superior a los nacidos no expuestos28. Sin embargo, se ha sugerido que la combinación de TARV con antagonistas de folato durante esta fase sí puede aumentar el riesgo de malformaciones congénitas29.
Hidroxiurea
Incluida en la categoría C de la FDA, su demostrada teratogenicidad en numerosas especies animales junto a la escasa información en seres humanos hace que se desaconseje su uso durante el embarazo6.
Conclusión
Desde la perspectiva del riesgo infantil, los siguientes fármacos están proscritos durante el embarazo: hidroxiurea (HU), EFV y DLV. Por la escasa información disponible no se recomienda el uso de ddC, ABC, TNF, APV y LPV.
Toxicidad materna
Inhibidores de la transcriptasa inversa análogos de nucleósidos
La toxicidad mitocondrial de esta familia de fármacos y en concreto el cuadro de acidosis láctica tipo B con esteatosis hepática microvacuolar asociada ha generado preocupación en los últimos años30. Esta complicación presenta una elevada mortalidad, aunque las formas más graves de acidosis láctica son pocos frecuentes: incidencia estimada de 1,3 por 1.000 pacientes/año. Es claramente más común en las mujeres que en los varones y como otro factor de riesgo se ha incluido la obesidad. La mayoría de los casos descritos han aparecido tras tratamiento prolongado con alguno de estos fármacos, especialmente d4T.
No se conoce con claridad si el embarazo puede ser un factor de riesgo adicional para la aparición de esta toxicidad. Las coincidencias con una complicación exclusiva del tercer trimestre del embarazo como es el síndrome HELLP, trastorno mitocondrial de herencia recesiva31 lo pueden sugerir. La compañía Bristol Myers-Squibb ha comunicado tres muertes maternas y de dos de los fetos en el puerperio inmediato por acidosis láctica, de mujeres tratadas con d4T y ddI asociadas a IP o NVP. La FDA ha recogido otras comunicaciones de acidosis láctica no fatales en embarazadas que estaban tomando estos 2 fármacos32. Recientemente se han presentado otros 2 casos de acidosis láctica también en el tercer trimestre, uno de ellos con muerte fetal. Los autores especulan con el efecto aditivo de los bajos niveles de riboflavina (vitamina B2), en las fases avanzadas de la gestación, a la toxicidad mitocondrial33. La FDA acaba de presentar los casos del registro de efectos secundarios graves de los ITIAN. De los 25 casos, ocho correspondieron a mujeres embarazadas que desarrollaron pancreatitis y/o acidosis láctica en el tercer trimestre, el TARV consistía en d4T + ddI en 7 casos y en el restante d4T + 3TC. Los autores concluyen que la combinación ddI/d4T sólo debería usarse durante la gestación en aquellos casos en los que el beneficio potencial supera este riesgo34.
Aunque parece, por los datos disponibles, que el riesgo de acidosis láctica durante el embarazo no es muy elevado, su gravedad obliga a un estrecho seguimiento de las embarazadas, sobre todo si llevan tratamiento con d4T de forma prolongada. Dado que su presentación clínica es poco específica sí se hace necesario mantener un alto nivel de sospecha especialmente durante el tercer trimestre. En algunas unidades se incluye la determinación del ácido láctico de forma sistemática durante el embarazo.
Inhibidores de la transcriptasa inversa no nucleósidos
La toxicidad más característica, aunque no exclusiva, de los ITINN es el exantema cutáneo30. El espectro de gravedad abarca desde la erupción mínima y oligosintomática hasta el síndrome de Stevens-Johnson o las formas con grave respuesta inflamatoria sistémica.
La toxicidad cutánea se ha descrito con los 3 fármacos, pero se presenta con mayor frecuencia y adopta formas más graves con NVP. La incidencia de exantema por NVP es mayor en las mujeres que en varones, hasta 11 veces más en algún estudio35. La toxicidad hepática por NVP también se presenta con más frecuencia en mujeres; se observa en casi el 12% frente al 6% en varones. Puede manifestarse asociada al exantema, dentro de un síndrome de hipersensibilidad, o de forma aislada.
No parece que el embarazo suponga un mayor riesgo para la aparición del exantema y/o toxicidad hepática y tampoco se han encontrado en los estudios prospectivos en los que se ha usado NVP en monodosis para la prevención de la transmisión vertical6.
Inhibidores de la proteasa
El uso de IP se ha asociado con el desarrollo de un espectro de alteraciones del metabolismo de los hidratos de carbono que oscila entre la intolerancia a la sobrecarga oral de glucosa hasta la cetoacidosis diabética30. La hiperglucemia de novo se ha calculado hasta del 5% en alguna serie y esta toxicidad parece similar para todos los IP. En un estudio multicéntrico de 12 hospitales españoles se ha detectado intolerancia a la glucosa en el 13% de las embarazadas tratadas con IP36. La gestación per se es una situación de riesgo para el desarrollo de hiperglucemia, la incidencia de diabetes gestacional en la población general oscila entre el 3-12%. No hay estudios comparativos de una mayor incidencia de esta complicación en embarazadas comparadas con mujeres no gestantes. La media de aparición de la hiperglucemia se sitúa a los 2 meses del inicio del TARV con IP, por lo que se recomienda estar al tanto de esta eventualidad y vigilar los niveles de glucemia.
Conclusión
Desde la perspectiva del riesgo materno no hay datos definitivos para proscribir ningún otro fármaco durante el embarazo. Se recomienda especial vigilancia: a) de la acidosis láctica en las pautas con ITIAN y, especialmente, con d4T + ddI, y b) hiperglucemia en las pautas con IP.
¿Se debe modificar un tratamiento antirretroviral previamente eficaz porque la mujer se quede embarazada?
El embarazo no es el mejor momento para cambiar un TARV. Esto es especialmente aplicable a la hora de introducir fármacos que la mujer nunca ha usado con anterioridad, puesto que una toxicidad grave, en la gestante, no sólo la compromete a ella, sino que pone en peligro la vida o la salud de su hijo.
Por ello, se recomienda que en la consulta VIH se adopte una actitud activa y se plantee sistemáticamente y como parte de la más básica rutina asistencial el tema de un posible embarazo a todas las mujeres. En aquellas que estén en tratamiento con alguno de los fármacos cuyo uso se desaconseja durante el embarazo, antes citados, se advertirá de este extremo. De esta forma, si la mujer expresara su deseo de embarazo futuro habría tiempo para modificar el TARV ofreciendo una alternativa terapéutica más segura para el feto y comprobando también que la nueva pauta es segura y eficaz para la futura madre. Esta actitud evitará numerosos problemas al facultativo y la toma de decisiones angustiosas a la paciente.
Un último aspecto es si la AZT debe ser siempre incluida en la pauta terapéutica de una embarazada. La AZT fue el primer fármaco y durante años el único que ha demostrado utilidad en la prevención de la transmisión vertical a costa de escasos efectos secundarios para el niño. Esto tiene un valor objetivo y además un peso histórico indudable, por lo que en las embarazadas sin TARV previo debe formar parte de la pauta que se oferte. En las mujeres que ya estaban recibiendo TARV antes del embarazo deben individualizarse las decisiones, remitiéndonos para los diferentes escenarios al documento de consenso5.