Las micobacterias no tuberculosas forman un grupo heterogéneo de microorganismos que en numerosas ocasiones son causa de infección en humanos, si bien también pueden considerarse en ocasiones como contaminantes o colonizadores. El manejo de estas infecciones debe necesariamente tener en cuenta la especie aislada y su sensibilidad in vitro (aunque no en todas ellas), así como las características del propio paciente, ya que estos tratamientos suelen ser prolongados y, necesariamente, deben ser llevados a cabo por expertos en el manejo de estas infecciones. Clásicamente divididas en micobacterias de crecimiento lento y micobacterias de crecimiento rápido, los esquemas de tratamiento y los antibióticos empleados son diferentes en ambos casos. Además, en determinadas circunstancias este tratamiento deberá necesariamente ir unido a otras medidas (retirada de cuerpos extraños, cirugía) con el objetivo de tener las máximas posibilidades de conseguir la curación del paciente.
Nontuberculous mycobacteria are a heterogeneous group of microorganisms that can often cause human infection, although they may also be considered to be contaminants or colonisers on occasions. The management of these infections must necessarily take into account the identification of isolated species and their in vitro susceptibility testing (although not for all of them), as well as the characteristics of the patient, because these treatments are usually prolonged and must be carried out by experts in the management of these infections. Classically divided into slowly growing mycobacteria and rapidly growing mycobacteria, the treatment regimens and the antibiotics used are different for both groups. In addition, in certain circumstances, this treatment must necessarily be linked to other measures (removal of foreign bodies, surgery) in order to maximise the likelihood of curing the patient.
El género Mycobacterium está formado en el momento actual por más de 150 especies distintas1-2. El grupo de micobacterias diferentes de Mycobacterium tuberculosis complex (M.bovis, M.africanum, M.microti, M.canetti, M.caprae, M.pinnipedii, M.suricattae y M.mungi) y de las micobacterias que causan la lepra (M.leprae y M.lepromatosis) se denominan globalmente micobacterias atípicas, ambientales o no tuberculosas (MNT); son microorganismos ampliamente distribuidos en el medio ambiente, con distribución no uniforme y variaciones regionales que están posiblemente relacionadas con factores ambientales poco conocidos.
Las MNT se han clasificado tradicionalmente por sus características fenotípicas, diferenciando dos grandes grupos: micobacterias de crecimiento lento y micobacterias de crecimiento rápido. En la actualidad las técnicas de biología molecular, con su mayor capacidad discriminatoria, son la base de la clasificación taxonómica y del tipado epidemiológico de las MNT, y su desarrollo explica que en los últimos años se hayan reclasificado y añadido un gran número de especies y subespecies de micobacterias.
A diferencia de M.tuberculosis y M.leprae, la relación de las MNT con la patología humana es ocasional y oportunista; de hecho, la mayoría de las especies nunca han sido descritas como patógenos humanos, y solo un grupo relativamente pequeño de ellas aparecen como patógenos humanos frecuentes, en su mayor parte en pacientes con factores predisponentes, puesto que la capacidad de producir enfermedad de estas micobacterias depende no solo de factores de patogenicidad intrínsecos de las distintas especies, sino de factores del huésped, tales como la integridad del sistema inmune o la presencia de factores locorregionales (incisión quirúrgica, patología tisular previa, cuerpo extraño, etc.)3. El aumento en el número de pacientes con este tipo de factores de riesgo, como la coinfección por VIH; la mayor supervivencia de los pacientes oncohematológicos y receptores de trasplantes, o con otras patologías crónicas como la EPOC y la fibrosis quística, así como el creciente uso de dispositivos biomédicos, explican el incremento en el número de estas infecciones detectado en los últimos años.
Dentro del amplio grupo de posibles síndromes, denominados micobacteriosis, destacan las infecciones respiratorias, con frecuencia pero no siempre relacionadas con patología pulmonar previa (fibrosis quística, EPOC, bronquiectasias, etc.), así como las infecciones diseminadas (habitualmente asociadas a inmunodepresión), infecciones de piel y partes blandas, incluyendo linfadenitis e infecciones del lecho quirúrgico asociadas o no a implantes de biomateriales.
Las infecciones diseminadas se asocian habitualmente a inmunosupresión, y se describen sobre todo en pacientes con infección por VIH, pacientes oncohematológicos, receptores de trasplante y pacientes tratados con fármacos biológicos anti-TNF-α; la inmunidad natural frente a las micobacterias depende de la vía interferón-gamma - interleucina12, responsable de conectar monocitos, macrófagos y células dendríticas con los linfocitosT y NK (natural-killers), estando bien descritas infecciones localizadas y/o diseminadas por MNT tanto en inmunodeficiencias congénitas debidas a mutaciones de receptores o ligandos de esta vía como en inmunodeficiencias tardías asociadas al desarrollo de anticuerpos anti-interferón gamma4.
El diagnóstico microbiológico de las micobacteriosis no es muy diferente del de la tuberculosis, desde el punto de vista microbiológico; la mayoría de las MNT crecen en los medios de cultivo habituales para micobacterias incubados a 35-37°C; sin embargo, para los cultivos de muestras cutáneas y osteoarticulares se utilizan además temperaturas de incubación de 28-30°C, donde crecen mejor algunas especies, como M.abscessus, M.ulcerans o M.marinum. Algunas especies, como M.xenopi, crecen mejor a 45°C, y otras requieren medios suplementados (M.genavense y M.haemophilum) o prolongar el tiempo de incubación (M.ulcerans, M.genavense, M.malmoense).
Aunque de momento no disponemos de técnicas de diagnóstico directo rápido, la sensibilidad de las distintas técnicas de cultivo es excelente para la mayoría de las MNT más relevantes en la práctica clínica, y se dispone además de técnicas de identificación rápidas y precisas, así como de metodología estandarizada para el estudio de la sensibilidad antimicrobiana5.
Sin embargo, el principal problema que se plantea en la práctica clínica es el de establecer el significado de un aislamiento de estos organismos en muestras clínicas no habitualmente estériles, dado que las MNT pueden ser patógenos, pero también contaminantes o colonizadores. La identificación es muy importante, pues especies como M.gordonae, M.terrae o M.lentiflavum son con frecuencia contaminantes del agua y son causa excepcional de enfermedad pulmonar, mientras que M.kansasii o M.szulgai son patógenos en la mayoría de los casos.
El manejo de estos pacientes es habitualmente complejo y puede requerir no solo tratamientos antibióticos prolongados (diferentes en función de la micobacteria aislada), sino la retirada de los dispositivos afectados o incluso el empleo de cirugía para eliminar el foco de infección en algunos casos.
Biopelículas y sus implicaciones terapéuticasUn aspecto de especial relevancia en el tratamiento de los pacientes con infección por MNT es la implicación en muchas de estas infecciones (en particular las pulmonares y las asociadas a materiales) del desarrollo de biopelículas. Estas estructuras son un mecanismo de resistencia antimicrobiana de gran importancia en todos los microorganismos, incluyendo las micobacterias. Se ha demostrado que diversas especies son capaces de desarrollar estas estructuras6-7, y que este desarrollo supone un aumento en la resistencia antimicrobiana, con elevaciones de la CMI superiores a 1.000 veces, e incluso mayores, cuando la micobacteria se encuentra en forma sésil8. Este aumento en la resistencia se debe posiblemente a numerosos factores, habiéndose estudiado la capacidad de penetración del antibiótico (con escaso efecto) y el estado metabólico de la bacteria, que parece ser el mecanismo esencial, aunque no se pueden descartar otros, como la existencia de persisters o la activación de genes de resistencia9.
Las implicaciones de estos hechos son de gran importancia. En las infecciones asociadas a biomateriales el desarrollo de la biopelícula en superficies inertes no vascularizadas impediría su erradicación mediante el empleo exclusivo de antibióticos, con lo que es imprescindible la retirada del cuerpo extraño si se busca la curación del paciente. En el caso de las infecciones respiratorias, se ha descrito recientemente la implicación de las biopelículas en casos clínicos, con lo que los problemas serían similares al caso anterior10. En estas infecciones, sin embargo, no existe cuerpo extraño que retirar, lo que lleva a la necesidad de ajustar los tratamientos buscando la mayor eficacia frente a biopelículas, así como a la posibilidad de incluir en el esquema terapéutico la eliminación quirúrgica de los tejidos afectados, si es técnicamente posible.
La búsqueda de nuevas estrategias para el tratamiento de infecciones causadas por biopelículas es un campo en desarrollo, si bien sus resultados todavía no son aplicables en la práctica clínica. No obstante, es posible que en un futuro cercano existan pautas de tratamiento específicamente dirigidas contra las biopelículas que puedan asociarse con los tratamientos antibióticos convencionales para mejorar el pronóstico de los pacientes11.
Micobacterias de crecimiento lentoMycobacterium avium complexEl complejo Mycobacterium avium (MAC) es un grupo heterogéneo de micobacterias que comprendía clásicamente dos especies: M.intracellulare y M.avium con sus tres subespecies: M.avium subsp. avium, M.avium subsp. paratuberculosis y M.avium subsp. silvaticum. Recientemente se han reconocido nuevas especies, como M.chimaera —implicado en infecciones adquiridas tras cirugía cardiovascular por contaminación y aerosolización de agua—, M.colombiense, M.vulneris, M.marseillense, M.bouchedurhonense, M.yongonense, M.arosiense, M.indicus pranii y M.timonense12
MAC es la causa más frecuente de infección pulmonar por MNT. Algunos casos afectan a pacientes con enfermedad pulmonar crónica (EPOC, enfisema, asma, bronquiectasias, tuberculosis precedente, etc.) o con reflujo gastroesofágico, pero puede aparecer de novo, en pacientes sin enfermedad pulmonar preexistente ni inmunodeficiencia reconocida; una parte de estos casos afecta a mujeres no fumadoras, de constitución delgada, con afectación pulmonar crónica en forma de bronquiectasias localizadas, lo que en la literatura se ha denominado síndrome de Lady Windermere. En algunos de estos casos se detectan alteraciones genéticas que afectan a la inmunidad, a la función ciliar o a heterocigotos de mutaciones del gen CFTR implicado en la fibrosis quística.
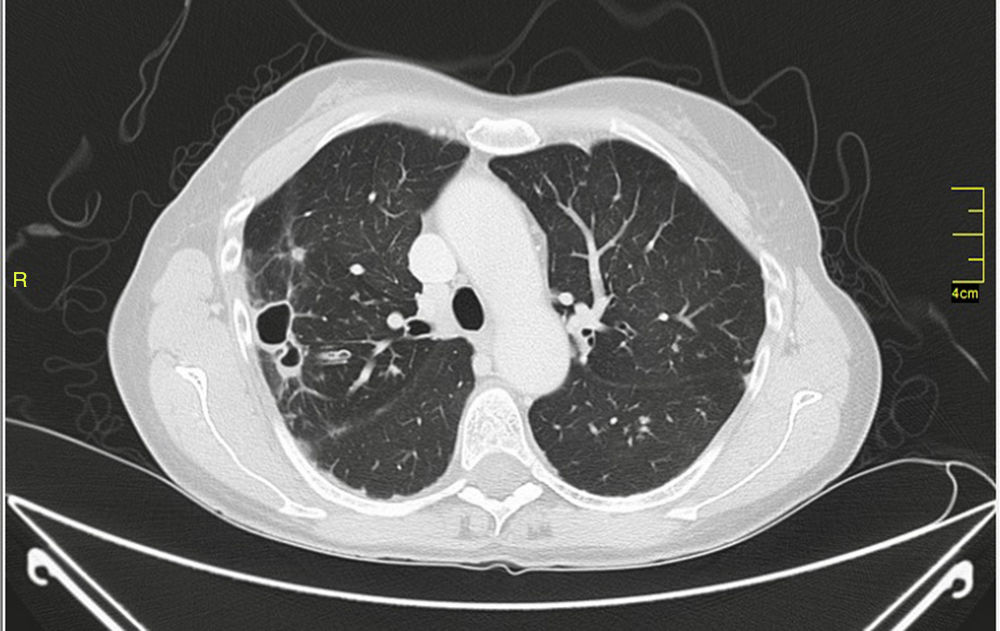
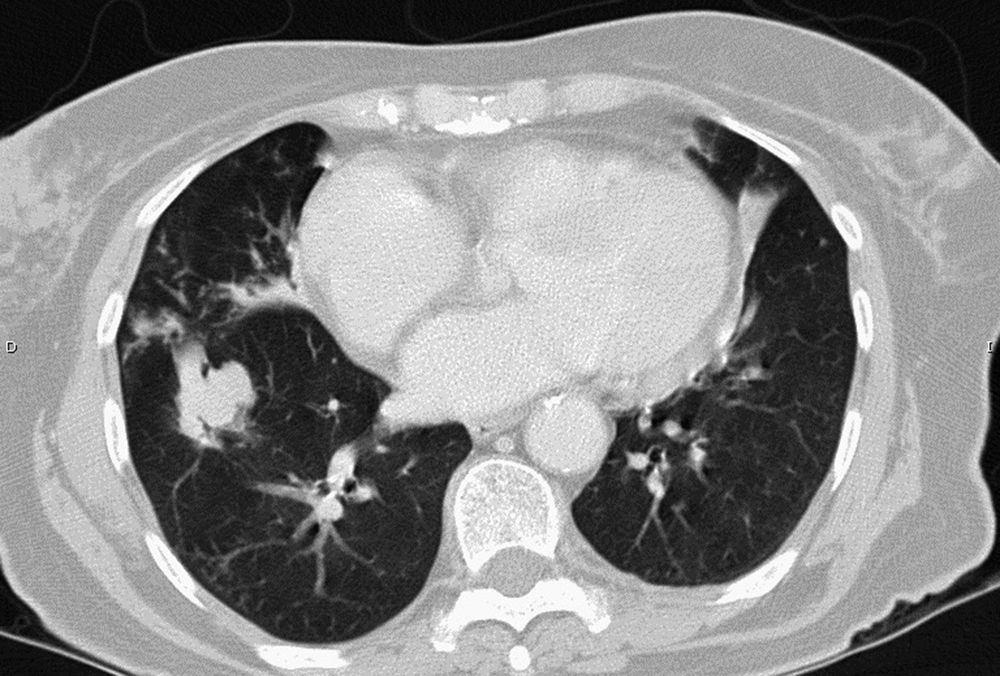
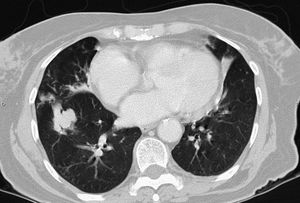
La infección pulmonar por MAC y en general por el grupo de MNT se ha clasificado en formas fibrocavitarias o multibacilares, con patrón destructivo semejante a la tuberculosis pulmonar cavitada clásica, con tinción habitualmente positiva para bacilos ácido-alcohol resistentes, y formas nodulares-bronquiectásicas, paucibacilares y más indolentes que plantean dudas de diagnóstico diferencial de enfermedad pulmonar lentamente progresiva frente a colonización respiratoria transitoria de la vía aérea por MNT (figs. 1 y 2).
MAC es además la principal causa de linfadenitis en los niños de menos de 5años, por delante de M.scrofulaceum en los países desarrollados13, y en los pacientes con sida y otras inmunodeficiencias es causa de afectación extrapulmonar y diseminada.
La introducción de los macrólidos (claritromicina y azitromicina) ha supuesto un gran avance en el tratamiento de la infección por MAC, mejorando las tasas de respuesta respecto a los regímenes clásicos basados en rifampicina, isoniazida y etambutol tanto en la infección pulmonar como en la enfermedad diseminada asociada a la infección por VIH. La combinación de un macrólido con etambutol y una rifamicina (rifampicina o rifabutina) es la base del tratamiento de la infección por MAC; las fluoroquinolonas, la amikacina y la clofazimina son también activas in vitro, si bien la respuesta clínica y la resistencia in vitro solo se correlacionan bien con los macrólidos, en los que una CMI elevada a claritromicina (CMI≥32μg/ml) se asocia claramente a fracaso terapéutico. Hay experiencia preliminar con el uso de amikacina inhalada, especialmente en casos avanzados y refractarios al tratamiento convencional, con cierto beneficio clínico y microbiológico. El uso de quinolonas (ciprofloxacino, levofloxacino o moxifloxacino), en asociación a las pautas basadas en macrólidos, es de dudosa eficacia y aumenta el riesgo de arritmias por prolongación del QT.
Aunque existe cierta controversia sobre la dosificación y elección del macrólido, claritromicina 1.000mg/día (15mg/kg si <50kg) y azitromicina 250mg/día o 500mg tres veces por semana parecen igualmente eficaces14. Lo mismo ocurre con la rifamicina, siendo rifampicina 600mg/día o rifabutina 150-300mg/día probablemente equivalentes.
Infección diseminada en pacientes con sidaLa infección diseminada por MAC afecta a pacientes con recuentos de CD4 inferiores a 50células/μl; el tratamiento de elección es la combinación de claritromicina 500mg cada 12h y etambutol 15mg/kg/día.
Azitromicina se ha empleado en sustitución de claritromicina por su mejor tolerancia digestiva y mejor perfil de interacciones farmacocinéticas, mostrando una eficacia no inferior a claritromicina.
El papel de rifampicina o rifabutina en el tratamiento de inicio en combinación de claritromicina-etambutol no está bien definido, y ambos plantean problemas de interacción con los fármacos antirretrovirales. Amikacina se plantea en casos graves y en retratamientos. En un ensayo clínico en infección diseminada por MAC15, añadir clofazimina a la pauta estándar de claritromicina-etambutol se asoció a un aumento de la mortalidad sin mejorar la respuesta clínica ni microbiológica.
El tratamiento de la infección diseminada por MAC se debe mantener durante un mínimo de 12meses, pudiendo ser suspendido en pacientes con tratamiento antirretroviral eficaz que alcanzan durante más de 3-6meses supresión virológica y recuentos de CD4 por encima de 100células/μl.
Infección pulmonar por Mycobacterium avium complexEl tratamiento inicial de la infección pulmonar por MAC debe incluir una combinación de macrólido, etambutol y una rifamicina.
Las guías de la ATS del año 200716 recomiendan preferentemente el uso de rifampicina sobre rifabutina, diferenciando los regímenes según se trate de formas fibrocavitarias multibacilares o nodulares-bronquiectásicas. En las primeras, más graves, la recomendación incluye utilizar dosis diaria de fármacos orales y asociar aminoglucósido (amikacina o estreptomicina), mientras que en las formas nodulares paucibacilares se podrían utilizar los fármacos tres veces por semana y prescindir del aminoglucósido. La duración del tratamiento debe ser de 18-24meses, y un mínimo de 12meses desde la negativización de los cultivos. La curación microbiológica ocurre en no más del 50-60% de los casos, con recidivas con aislados que muestran resistencia a macrólidos, que se interpretan a menudo por tipado molecular como reinfecciones debidas a nuevos clones17.
Linfadenitis por Mycobacterium avium complexLa linfadenitis cervical infantil por MNT se presenta en niños de 1 a 4 años y se debe a MAC, y con menos frecuencia a M. scrofulaceum y M. haemophilum. Puede resolverse espontáneamente, o bien producir fístulas cutáneas. Los mejores resultados se obtienen con la escisión quirúrgica de los ganglios afectados, sin que esté bien definido si es necesario añadir tratamiento farmacológico con las pautas habituales (macrólidos, etambutol, rifamicinas)13.
Mycobacterium kansasiiM. kansasii es una micobacteria fotocromógena que produce infecciones pulmonares con patrón fibrocavitario similar a la tuberculosis, y con menos frecuencia infecciones focales o diseminadas en pacientes con infección por VIH o con otras causas de inmunodepresión.
M. kansasii es sensible in vitro a las rifamicinas, isoniazida, macrólidos, etambutol, quinolonas, estreptomicina, linezolid y cotrimoxazol. La actividad in vitro de isoniazida frente a M.kansasii es menor que frente a M.tuberculosis, con rangos de CMI de 0,5 a 5μg/ml, es decir, a menudo por encima de las concentraciones críticas que se utilizan para M.tuberculosis (0,2 y 1μg/ml). A pesar de ello, los tratamientos basados en rifampicina-isoniazida y etambutol son a menudo eficaces, siendo la resistencia primaria a rifampicina la explicación de la mayoría de los fracasos terapéuticos. De hecho, se recomienda realizar el estudio de sensibilidad a rifampicina en los aislamientos primarios de M.kansasii y ampliar el estudio de sensibilidad a otros fármacos si la CMI supera 1μg/ml.
La pauta más utilizada ha sido rifampicina-isoniazida-etambutol durante un mínimo de 12meses desde cultivo negativo. Puede opcionalmente utilizarse un cuarto fármaco en la fase inicial en enfermedad extensa, o hasta confirmar la sensibilidad a rifampicina (estreptomicina, claritromicina o quinolona). Algunos autores proponen sustituir isoniazida por claritromicina en la pauta empírica inicial18.
Otras micobacterias de crecimiento lentoMycobacterium xenopiM. xenopi es responsable de enfermedad pulmonar fibrocavitaria o nodular y de enfermedad diseminada en inmunodeprimidos, al igual que MAC.
Puede ser contaminante (se han descrito pseudoepidemias por contaminación del agua de lavado de broncoscopias). Los estudios de sensibilidad son difíciles de interpretar por su lento crecimiento, aunque se considera como habitualmente sensible a rifampicina, etambutol, claritromicina y a concentraciones altas de isoniazida. Se recomienda tratar con combinaciones de estos fármacos durante 18-24meses, y un mínimo de 12meses desde cultivo negativo en enfermedad pulmonar19.
Mycobacterium malmoenseEs responsable de infección pulmonar, linfadenitis y tenosinovitis. Se trata con esquemas similares a los utilizados frente a MAC, pues con las dificultades e interpretación de los estudios de sensibilidad in vitro, se considera sensible a rifampicina, etambutol y claritromicina20.
Mycobacterium szulgaiEs responsable de infecciones pulmonares con patrón fibrocavitario, especialmente en pacientes con patología pulmonar previa predisponente, y en inmunodeprimidos, de infecciones diseminadas y extrapulmonares.
Es habitualmente sensible a rifampicina, isoniazida, etambutol, quinolonas y macrólidos. Se recomienda un tratamiento con al menos tres fármacos activos durante un mínimo de 12meses desde cultivo negativo en enfermedad pulmonar21.
Mycobacterium ulceransM. ulcerans es responsable de la úlcera de Buruli, una enfermedad muy prevalente en el trópico y de consecuencias devastadoras si no se diagnostica y se trata adecuadamente. El cultivo primario de las lesiones cutáneas es poco sensible; M.ulcerans crece lentamente, precisando medios suplementados, incubación a bajas temperaturas (28-33°C) e incubación prolongada. Se ha considerado una enfermedad de tratamiento básicamente quirúrgico, basado en desbridamientos amplios e injertos. Sin embargo, varios estudios sugieren mejores resultados asociando precozmente tratamiento farmacológico con pautas que combinen rifampicina, claritromicina y estreptomicina22.
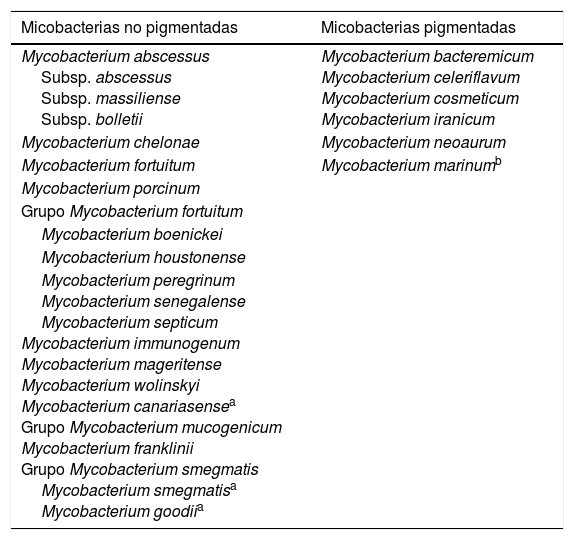
Micobacterias de crecimiento rápidoDentro del género Mycobacterium, las micobacterias de crecimiento rápido (MCR) suponen aproximadamente la mitad de las especies descritas23; la mayoría de ellas son micobacterias ambientales que nunca han sido descritas como causa de enfermedad. Sin embargo, algunas especies sí han sido descritas como patógenos humanos, especialmente el grupo formado por diversas especies no pigmentadas (tabla 1). Además de estas especies, existen casos ocasionales de infecciones causadas por otras micobacterias de crecimiento rápido23-24, si bien la mayoría de ellos son excepcionales.
Especies de micobacterias de crecimiento rápido de importancia en patología humana
| Micobacterias no pigmentadas | Micobacterias pigmentadas |
|---|---|
| Mycobacterium abscessus Subsp. abscessus Subsp. massiliense Subsp. bolletii | Mycobacterium bacteremicum Mycobacterium celeriflavum Mycobacterium cosmeticum Mycobacterium iranicum |
| Mycobacterium chelonae | Mycobacterium neoaurum |
| Mycobacterium fortuitum | Mycobacterium marinumb |
| Mycobacterium porcinum | |
| Grupo Mycobacterium fortuitum | |
| Mycobacterium boenickei | |
| Mycobacterium houstonense | |
| Mycobacterium peregrinum Mycobacterium senegalense Mycobacterium septicum Mycobacterium immunogenum Mycobacterium mageritense Mycobacterium wolinskyi Mycobacterium canariasensea Grupo Mycobacterium mucogenicum Mycobacterium franklinii Grupo Mycobacterium smegmatis Mycobacterium smegmatisa Mycobacterium goodiia |
El espectro de infecciones causadas por MCR es enormemente amplio e incluye numerosos síndromes clínicos5,23,25,26. Sin embargo, entre ellos hay tres grupos especialmente relevantes: las infecciones respiratorias, las infecciones de piel y partes blandas, y las infecciones asociadas a biomateriales. Cada una de ellas plantea problemas terapéuticos específicos.
Las infecciones respiratorias causadas por MCR son habitualmente cuadros crónicos asociados a la presencia de enfermedades pulmonares preexistentes, tales como la fibrosis quística. Pueden ser cuadros que afecten a cavidades pulmonares preexistentes (bullas, lesiones cicatriciales de infecciones previas, especialmente tuberculosis) en los cuales la micobacteria inicialmente colonizará la lesión y posteriormente dará lugar a una invasión de los tejidos, o bien puede aparecer como infección de bronquiectasias, similares a los cuadros causados por micobacterias de crecimiento lento. Un aspecto de especial relevancia en este caso es la identificación de la especie causante, puesto que el significado del aislamiento en muestras clínicas no es el mismo en todas ellas27. Además, como veremos más adelante, la sensibilidad antimicrobiana también es variable, por lo que es muy importante este aspecto. En estos cuadros es de especial relevancia la especie M.abscessus, ya que esta micobacteria da lugar a infecciones respiratorias cuya complejidad terapéutica ha hecho que se consideren extremadamente difíciles de curar. Además, se ha evidenciado la presencia de clones de especial patogenicidad capaces de extenderse incluso por varios países28, lo que hace aún más importante el conocimiento de múltiples aspectos (epidemiología, enfermedades subyacentes, especie e incluso subespecie responsable del cuadro, etc.) a la hora de plantear el tratamiento más adecuado.
En el caso de las infecciones de piel y partes blandas29, muchas de ellas se asocian con procedimientos cosméticos tales como mesoterapia, depilación o tatuajes, dando lugar a cuadros crónicos que, si bien no suelen suponer un riesgo vital para el paciente, sí producen complicaciones estéticas de importancia incluso tras la curación de los cuadros clínicos.
Las infecciones asociadas a biomateriales han adquirido una especial relevancia a lo largo de los últimos años, y estas micobacterias dan lugar a muy diversos cuadros clínicos dentro de este grupo, tales como infecciones de prótesis osteoarticulares, infección asociada a catéteres intravasculares, endocarditis de válvula protésica, etc.23. Todos estos cuadros clínicos presentan como característica común la necesidad, en el momento actual, de la retirada del material infectado como condición indispensable para la curación del paciente, dado que la micobacteria suele estar en dicho material formando una biopelícula en la superficie del mismo, con las dificultades terapéuticas que supone y que se comentarán más adelante.
Sensibilidad antimicrobianaUna característica especial de las MCR (especialmente de las cepas no pigmentadas) es su sensibilidad antimicrobiana, muy diferente a la de las cepas de crecimiento lento. En general, la gran mayoría de especies de MCR no pigmentadas son resistentes a los antituberculosos habituales (isoniazida, rifampicina, etambutol, pirazinamida y estreptomicina), siendo sensibles a otros antibióticos empleados habitualmente en el tratamiento de diversas infecciones bacterianas, tales como macrólidos, quinolonas, cotrimoxazol, tetraciclinas, aminoglucósidos, linezolid, algunos betalactámicos (cefoxitina, imipenem) o tigeciclina9,30. Recientemente se ha publicado una estandarización de los estudios de sensibilidad para estos organismos, recogida en el protocolo de la SEIMC publicado en 2017, donde se establece la microdilución como la técnica de referencia para estos estudios de sensibilidad30. Un dato de especial relevancia es que puede existir una importante variación de los patrones de sensibilidad, no solo entre las distintas especies, sino entre cepas de la misma especie, por lo que se recomienda la realización de estudios de sensibilidad individualizados en aquellos aislados que se consideren significativos.
En general, la mayoría de cepas y especies son sensibles a amikacina y presentan CMI bajas a tigeciclina (si bien no se ha establecido un punto de corte específico para este antibiótico). M.abscessus y M.chelonae suelen ser las especies más resistentes, siendo de utilidad en estos casos los macrólidos (salvo cepas poseedoras de metilasas inducibles), cefoxitina y aminoglucósidos (especialmente tobramicina para M.chelonae). Las especies del complejo M.fortuitum suelen ser sensibles a quinolonas, aminoglucósidos, cotrimoxazol y linezolid, mientras que suelen ser resistentes a macrólidos en muchos casos. Otras especies (como M.peregrinum, M.mucogenicum o M.mageritense) suelen ser sensibles a numerosos antibióticos5,9,23,30,31.
Recomendaciones de tratamientoLas recomendaciones actuales de tratamiento de estas infecciones dependen del cuadro clínico y de la micobacteria aislada (tabla 2).
Tratamiento inicial de infecciones por micobacterias no tuberculosas (individualizar en caso de fracaso, retratamiento y resistencia a fármacos)
| Micobacteria | Tratamiento | Comentario |
|---|---|---|
| M. avium complex | ||
| Pulmonar nodular/bronquiectásica | Rifampicina/Rifabutina Etambutol Claritro/Azitromicina | 18-24 meses; 12 meses desde cultivo negativo Posibilidad de dosis tres días por semana |
| Pulmonar fibrocavitaria | Rifampicina/rifabutina Etambutol Claritro/Azitromicina (Estreptomicina/Amikacina) | 18-24 meses; 12 meses desde cultivo negativo Dosis diaria Aminoglucósido opcional en enfermedad grave-extensa |
| Infección diseminada | Claritro/Azitromicina Etambutol (Estreptomicina/Amikacina) | Mínimo 12 meses y hasta 3 meses con CD4 >50/μl y carga viral indetectable Aminoglucósido opcional en enfermedad grave-extensa |
| M. kansasii | Rifampicina Etambutol Claritro/Azitromicina (Levo/Moxifloxacino) (Estreptomicina) | 12 meses desde cultivo negativo en enfermedad pulmonar Descartar resistencia a rifampicina Estreptomicina opcional Puede sustituirse el macrólido por quinolona |
| M. xenopi | Rifampicina Isoniazida Etambutol Claritro/Azitromicina (Estrepto/Amikacina) | 18-24 meses. 12 meses desde cultivo negativo en enfermedad pulmonar Estrepto/amikacina opcional según severidad |
| M. szulgai | Rifampicina/rifabutina Etambutol Claritro/Azitromicina (Levo/Moxifloxacino) | 12 meses desde cultivo negativo en enfermedad pulmonar |
| M. malmoense | Rifampicina Isoniazida Etambutol Claritro/Azitromicina (Levo/Moxifloxacino) | 18-24 meses; 12 meses desde cultivo negativo en enfermedad pulmonar |
| M. marinum | Claritro/Azitromicina Etambutol (Rifampicina) | 4-6 meses (2 meses desde resolución de las lesiones cutáneas) |
| M. ulcerans | Rifampicina 6 meses Claritromicina 6 meses Estreptomicina 2 meses | Rifampicina-claritromicina 6meses +estreptomicina los dos primeros +escisión quirúrgica |
| M. abscessus | Cefoxitina o Imipenem Amikacina Claritromicina (si es S) Tigeciclina/Doxiciclina | Debe ajustarse según antibiograma para cada cepa de forma individualizada En infección pulmonar: mínimo 12meses desde cultivo negativo |
| M. chelonae | Claritromicina 6 meses Amikacina 6 meses | Debe ajustarse según antibiograma para cada cepa de forma individualizada |
| M. fortuitum | Quinolona (Ciprofloxacino, Moxifloxacino) 6 meses Amikacina 6 meses | Debe ajustarse según antibiograma para cada cepa de forma individualizada |
| Otras micobacterias de crecimiento rápido | Usar dos antibióticos sensibles in vitro | Debe ajustarse según antibiograma para cada cepa de forma individualizada |
Dosis:
Rifampicina 600mg/día; Rifabutina 150-300mg.
Isoniazida 300-600mg/día.
Etambutol 15mg/kg/día.
Claritromicina 500mg cada 12h; Azitromicina 250mg/día o 500mg/tres veces por semana.
Estreptomicina-Amikacina 10-15mg/kg/día o tres veces por semana.
Levofloxacino 500mg/día o moxifloxacino 400mg/día.
Las infecciones de piel y partes blandas con poca expresión clínica suelen ser paucibacilares, con lo que podrían tratarse con éxito con monoterapia, empleando un antimicrobiano activo frente a la cepa aislada. Habitualmente se emplea un macrólido (claritromicina habitualmente) en las cepas del complejo M.abscessus-chelonae si la micobacteria es sensible y no hay metilasas inducibles, y una quinolona en las cepas del complejo M.fortuitum9,23,29. Como alternativas pueden emplearse cefoxitina, amikacina, cotrimoxazol o tetraciclinas, siempre que la cepa sea sensible in vitro. Aunque linezolid o tigeciclina suelen ser activos, la experiencia clínica es mucho más reducida. Un inconveniente de algunos de estos antibióticos es la necesidad de administración parenteral, lo que obligaría a ingresos prolongados, ya que la duración de los tratamientos se recomienda que no sea inferior a 4-6meses, pudiendo incorporarse un segundo antibiótico parenteral en las primeras semanas si el caso fuese más grave9,23,29.
Si la carga bacilar es importante (abscesos de gran tamaño, por ejemplo) es necesario un tratamiento combinado para evitar el desarrollo de resistencias por mutaciones en el cromosoma. Estas mutaciones han sido descritas en M.chelonae y monoterapia con claritromicina, en los que una mutación en el gen 23S rDNA confiere a las cepas resistencia de alto nivel frente a este antibiótico23. En estos casos, las limitaciones posológicas son las mismas que en el caso anterior, si bien se ha descrito la posibilidad de emplear amikacina en pautas de tratamiento alternas (3-4días a la semana) con el objetivo de facilitar el tratamiento extrahospitalario de estos pacientes. En estos casos puede ser deseable, e incluso necesario, el drenaje quirúrgico de los abscesos de mayor tamaño para reducir la carga bacilar.
El manejo de la infección respiratoria causada por MCR supone un auténtico reto en el momento actual. La mayoría de estas infecciones están causadas por M.abscessus (subespecies abscessus y massiliense), y en estos casos las opciones terapéuticas son muy reducidas, en particular en lo que se refiere a la posibilidad de administrar un tratamiento oral, sobre todo en los casos causados por cepas con el gen erm(41) funcional y, por tanto, resistentes a macrólidos. En estos casos se recomienda el empleo de 2-3 fármacos sensibles in vitro, inicialmente por vía parenteral, tales como cefoxitina, amikacina, tigeciclina o imipenem, y un tratamiento combinado oral de continuación, si es posible, con claritromicina si el aislado es sensible, durante un mínimo de 12meses desde la negativización de los cultivos de muestras respiratorias. Sin embargo, las limitaciones posológicas y de toxicidad de los fármacos, así como la dificultad de erradicar la micobacteria del tejido pulmonar si ha formado una biopelícula, hace que se haya considerado que la completa curación clínico-microbiológica de estos pacientes es a menudo imposible32, buscándose en estos casos un alivio de los síntomas y una limitación de los daños pulmonares causados por la infección mediante la realización de ciclos sucesivos de tratamiento23. Sin embargo, en aquellos casos en que la cepa es sensible a macrólidos, la inclusión de estos fármacos supone un cambio radical en el pronóstico de estos pacientes, ya que sí es factible conseguir la curación33. En el caso de las otras especies, el tratamiento seguirá los mismos principios (empleo de 2-3fármacos a los que la micobacteria sea sensible, al menos 12meses desde cultivo negativo).
En cuanto al manejo de las infecciones asociadas a biomateriales, en estos pacientes es esencial la retirada del material infectado para poder conseguir la curación de estos pacientes. En el caso de las bacteriemias asociadas a catéteres intravasculares34 o las infecciones asociadas a implantes mamarios23 puede no ser especialmente difícil, pero en otras infecciones, tales como las infecciones protésicas articulares35 o la endocarditis sobre válvula protésica26, es mucho más complejo. En estos casos se debe también emplear un tratamiento combinado basado en el estudio individualizado de la sensibilidad del aislado de cada caso concreto. El tratamiento, además, deberá durar un mínimo de 6meses, especialmente en las infecciones graves. Hay que tener en cuenta que, a pesar del ominoso pronóstico de alguna de ellas (como la endocarditis), se han descrito casos de curación, incluso sin retirada de la prótesis infectada, por M.fortuitum36-37. Probablemente la especie causante sea también de gran importancia a la hora de plantear el pronóstico del paciente.
Mycobacterium marinumEsta micobacteria ha sido descrita tanto como crecedor rápido como crecedor lento, ya que esta característica depende de la temperatura de incubación. La enfermedad causada es conocida como granuloma de las piscinas o de los acuarios, y se trata de una lesión granulomatosa habitualmente única que suele tener el antecedente epidemiológico de contacto con agua de dichas procedencias38.
En el caso de M.marinum no se recomienda la realización sistemática de pruebas de sensibilidad, dado que en muchas ocasiones la exéresis quirúrgica de la lesión es curativa. No obstante, suele ser sensible a algunos antituberculosos convencionales, como rifampicina o etambutol (ambos empleados clínicamente con buenos resultados), así como a tetraciclinas, cotrimoxazol o claritromicina38-39. Habitualmente se plantea un tratamiento empírico con etambutol asociado a claritromicina y, en ocasiones, a rifampicina, durante al menos 2meses desde la curación clínica (en total unos 3-6meses). No se recomienda la monoterapia, especialmente con quinolonas, por el riesgo de desarrollar mutantes resistentes con el consiguiente fracaso terapéutico29.
ConclusionesEl espectro de infecciones causadas por las micobacterias no tuberculosas es muy amplio y el número de estas es, además, creciente, dado el incremento en el número de pacientes susceptibles. Aunque el tratamiento de estas infecciones no está tan evaluado como en el caso de M.tuberculosis, sí se dispone de evidencia suficiente para realizarlo en base al conocimiento existente en la literatura y a los avances en las técnicas microbiológicas. Sin embargo, la base del manejo de estos pacientes es una correcta interpretación de los aislamientos para diferenciar auténticas infecciones de las colonizaciones o contaminaciones. Una vez establecido el diagnóstico de infección, el tratamiento del paciente deberá ser ajustado a la localización de la misma y a la micobacteria causante. Estos tratamientos pueden ser muy prolongados, y en algunos casos pueden dar lugar a malos resultados fruto de las características particulares de estas enfermedades. Es por ello fundamental que el manejo de estos pacientes sea realizado por equipos multidisciplinares expertos en este tipo de infecciones para conseguir los mejores resultados posibles para los pacientes.
Conflicto de interesesNinguno en relación con el presente manuscrito.