Luego del advenimiento del tratamiento antirretroviral de gran actividad (TARGA), el síndrome de reconstitución inmunológica (SRI) es una complicación cada vez más frecuente en los individuos infectados por el virus de la inmunodeficiencia humana (VIH). El artículo tuvo como objetivo presentar una revisión de las evidencias científicas disponibles sobre el tema, indizadas en Medline, PubMed, BVS-BIREME y BioMedCentral. Éste abarcó la definición, la epidemiología, la clasificación y los criterios diagnósticos del SRI. Además, se describieron las particularidades clínicas de las etiologías más frecuentes y se realizó una propuesta de enfoque terapéutico. Se abordó el pronóstico y las implicaciones futuras de esta entidad en la epidemiología de algunas enfermedades infecciosas en la población VIH positiva. Se mencionaron varios aspectos aún inconclusos sobre el tema, sobre todo los relacionados con la fisiopatología, el uso de los biomarcadores para el diagnóstico y la necesidad de algoritmos terapéuticos basados en pruebas que permitan estandarizar la conducta ante estos enfermos.
Since the arrival of highly active antiretroviral therapy (HAART), immune reconstitution syndrome (IRS) has become an increasingly more frequent complication in patients with human immunodeficiency virus (HIV) infection. This article presents a review of the available evidence on this subject, indexed in MEDLINE-PUBMED, BVS-BIREME, and BioMed Central. The review covers the definition, epidemiology, classification, and diagnostic criteria related to IRS. In addition, the clinical particularities of the most frequent etiologies are described, and a proposal for a therapeutic approach is formulated. The prognosis and future implications of this syndrome in the epidemiology of some infectious illnesses in the HIV-positive population are included. Several unresolved aspects are mentioned, such as those related to the pathophysiology of the condition, use of biomarkers for the diagnosis, and the need for evidence-based therapeutic algorithms to enable standardization of treatment for these patients.
La expresión y el desenlace clínico de las enfermedades infecciosas (EI) dependen en la mayoría de las ocasiones del daño microbiano. No obstante, la respuesta inmunitaria del huésped ha ganado un papel preponderante en la patogenia de estas enfermedades1. El paradigma de integración patógeno/individuo susceptible/ambiente, necesaria para el control de la infección, ha permitido aclarar que el desencadenamiento abrupto y consistente de la respuesta inmunitaria puede, bajo ciertas condiciones, empeorar el desenlace clínico del enfermo2.
Esta situación resultante de la activación o la restauración inmunológica se ha reconocido en situaciones tan fisiológicas como el embarazo, y tan temprano como en 1920 se describieron el comienzo y el agravamiento de la tuberculosis (TB) en el posparto inmediato1. También se ha descrito el empeoramiento clínico en los enfermos con TB al iniciar el tratamiento antituberculoso, esta situación definida como «respuesta paradójica» se atribuyó a la reversión de la inmudepresión inducida por Mycobacterium tuberculosis y se asoció a la conversión de la prueba de la tuberculina (PT) de anérgica a reactiva3. Reacciones inflamatorias semejantes se han descrito con relativa frecuencia en los pacientes infectados por Mycobacterium leprae4, y más recientemente en relación con los trasplantes de órganos sólidos, médula ósea y la quimioterapia antitumoral5,6. Sin embargo, ninguna de las anteriores condiciones ha tenido tanta relevancia en los últimos años como la infección por el virus de la inmunodeficiencia humana (VIH)-17,8.
La magnitud del denominado síndrome de reconstitución inmunológica (SRI) es mayor en los individuos infectados por VIH, no sólo porque la pandemia afectó al término del año 2007 a 33,2 millones de personas9, sino también por el espectro clínico tan amplio que abarca, desde las clásicas EI hasta los disturbios autoinmunitarios y las complejidades diagnósticas y terapéuticas que lo caracterizan5.
Marlyn French et al realizaron la primera comunicación del SRI asociado al VIH en Australia, ésta tuvo lugar en individuos que tenían monoterapia con zidovudina (AZT) y en los que se desarrolló una presentación atípica y localizada de infección por Mycobacterium avium intracellulare10. Posterior a 1995, con el advenimiento de los fármacos antirretrovíricos inhibidores de las proteasas y la subsiguiente generalización del tratamiento antirretroviral de gran actividad (TARGA), el SRI se convirtió en una entidad clínica emergente, que en muchos escenarios ha sobrepasado la problemática de las infecciones oportunistas (IO)11.
DefiniciónEl SRI, denominado por otros autores como síndrome inflamatorio de reconstitución inmunológica (SIRI), es una consecuencia clínica adversa de la restauración de la respuesta inmunológica antígeno específica (RIAE) inducida por el TARGA, que se traduce en el comienzo clínico de las infecciones subclínicas preexistentes, el empeoramiento de las EI durante el tratamiento específico o la manifestación exuberante de enfermedades autoinmunitarias y de neoplasias8,11–14.
EpidemiologíaLa incidencia del SRI está poco precisada y es muy variable entre los estudios revisados. En una de las series más amplias inherente a Shelburne et al, la entidad se diagnosticó en el 31,7% de los pacientes que iniciaron TARGA y estaban infectados por M. tuberculosis, M. avium-intracellulare o Cryptococcus neoformans15. French et al describieron uno o más episodios de SRI por patógenos subclínicos en el 25% de 132 enfermos, con buena respuesta al TARGA16. En el Reino Unido, Ratman et al reportaron la enfermedad en el 22,7%17. El SRI motivó el 63% de las IO registradas en la serie publicada por Park et al18. Particularmente, las infecciones por M. tuberculosis, M. avium-intracellulare y C. neoformans aproximadamente agrupan cada una el 30% de los casos19. El 23,4% de las hospitalizaciones de niños con TARGA en Tailandia dependieron del SRI20. En Cuba se describió en el 14,3% de una cohorte de enfermos con sida y con TB tratados con TARGA21.
Inmunopatogenia y factores de riesgos del síndrome de reconstitución inmunológicaCuando se comunicaron los primeros casos en la era del TARGA, los pacientes tenían supresión de la viremia de VIH y restauración parcial de la respuesta inmunitaria celular. Entonces, las manifestaciones atípicas de una IO u otra enfermedad inflamatoria trajeron la duda sobre si se trataba de una verdadera recuperación inmunitaria o si todo era consecuencia de un defecto residual frente a una restauración demorada de la inmunidad celular13,22.
Las pruebas más recientes indican que esta situación clínica depende de una reconstitución inmunológica antígeno específica (patógeno específica), que resulta mucho más inmunopatológica que protectora13,15,23.
Dinámica de la reconstitución inmunológica por el tratamiento antirretrovírico de alta eficaciaPara entender la inmunopatogenia del SRI es crucial elucidar la dinámica intrínseca de la recuperación inmunológica luego del inicio del TARGA. En presencia del 95% de adherencia, sin resistencia demostrada y con independencia de las variaciones individuales en la farmacocinética de los antirretrovíricos, el TARGA induce reducción mayor del 90% de la carga vírica plasmática (CVP) en las primeras semanas24,25. Esto se traduce en cambios significativos en el recuento, el fenotipo y la función de los linfocitos TCD4+ (LTCD4+)24.
Generalmente, las modificaciones tienen lugar en 2 fases, la primera (de una a 2 semanas del inicio del TARGA) se caracteriza por un rápido incremento del número de LTCD4+ circulantes que se prolonga sobre 3 meses, y es el resultado de la redistribución de las células de memoria CD45O+ activadas y de la reducción de la muerte celular por apoptosis24. Precisamente, esta fase coincide en la mayoría de los estudios con el período en que el SRI es más frecuente8,24. La segunda etapa, que es más lenta y persiste por años, es el resultado de la expansión de células naive CD45RA a partir de la función tímica restaurada. Ésta se correlaciona directamente con la magnitud y la estabilidad temporal de la supresión virológica24. El incremento de los LTCD4+ puede variar entre los individuos y puede ser inferior en los que inician el TARGA marcadamente inmunodeprimidos. De hecho, el recuento puede persistir inferior a 200 células hasta en el 20% de los pacientes con tratamiento7.
El fenotipo de los LTCD4+ es proporcional a la competencia inmunológica. Algunos estudios han demostrado que el número de LTCD4+ y de LTCD8+ que expresan la molécula coestimulatoria CD28, de importancia en la respuesta a los antígenos, no aumenta a grados normales aun en presencia del control de la viremia. Sin embargo, no hay pruebas de las implicaciones de estas observaciones en la génesis del SRI24.
La mejoría de la función de los LTCD4+ por el TARGA ya se ha demostrado; sin embargo, se caracteriza por el aumento de la respuesta a mitógenos y el cambio del patrón de citocinas hacia Th-1, con incremento de la producción de interferón (IFN)-γ e interleucina (IL)-2. También, y en correlación con la magnitud de la reducción de la CVP, hay mejoría de la respuesta de hipersensibilidad retardada. Estos cambios se han correlacionado con el SRI y, particularmente, la restauración de este tipo de respuesta inmunológica ha sido evidente en la mayoría de los SRI por micobacterias13,16,26.
No está totalmente aclarado en qué medida el síndrome es el resultado de la exacerbada producción de citocinas proinflamatorias por un sistema inmunitario parcialmente restaurado o la pérdida de la regulación inmunitaria por la incapacidad de producir citocinas reguladoras27.
Respuesta inmunitaria antígeno específicaHay suficientes pruebas que apoyan el fenómeno de restitución de la RIAE por el TARGA28,29. En la práctica clínica está probada la seguridad de suspender la profilaxis primaria y secundaria para la neumonía por Pneumocystis jirovecii, e igualmente para las infecciones por C. neoformans y por citomegalovirus (CMV), cuando el recuento de los LTCD4+ supera las 200 células, o para la infección por M. avium-intracellulare ante más de 100 células7,12,29.
La RIAE potenciada por el TARGA varía en relación con el tipo de microorganismo. Para las infecciones micobacterianas y micóticas, lo más importante parece ser la restauración de la respuesta inmunitaria celular, caracterizada por un ascenso del recuento de los LTCD4+ y una intensa actividad Th113,24,30. Varios estudios han identificado la positivización precoz de la prueba de la PT en los individuos con SRI por M. tuberculosis, lo que en el 70% de los casos ocurrió en los 90 días de iniciado el TARGA13,15,26. Contrariamente, Schluger et al demostraron que la RIAE para M. tuberculosis es tardía y no alcanza las concentraciones encontradas en los individuos VIH negativos31. Otros investigadores han demostrado que el SRI por micobacterias se caracteriza por inflamación granulomatosa, necrosis tisular y respuesta linfoproliferativa a los antígenos micobacterianos13.
Para otros grupos de microorganismos, mejor demostrado en las infecciones víricas, el SRI parece estar en relación con la restauración de la respuesta celular citotóxica (CTL) específica mediada por los LTCD8+12,13,29. Lo anterior se ha estudiado bien en la infección por CMV, particularmente la retinitis que aparece luego del TARGA13. Hay pruebas de que la inflamación que acompaña a esta entidad depende de la respuesta de los LTCD8+ o de los CMV específicos32,33. Además, este mecanismo se ha invocado en el SRI por el virus herpes simple (VHS), el virus de la varicela-zóster (VVZ) y el virus JC (poliomavirus causante de la leucoencefalopatía multifocal progresiva [LMP]), aun en ausencia de incremento del recuento de los LTCD4+12,34–36.
Disregulación de las citocinas en la génesis del síndrome de reconstitución inmunológicaIndependientemente de las variaciones individuales y de las etiológicas del SRI, pruebas actuales apoyan la existencia de disregulación entre citocinas proinflamatorias (TNF [tumor necrosis factor 'factor de necrosis tumoral']-α, IL-6, proteína inflamatoria del macrófago 1α [MIP-1α] e IFN-γ) y citocinas con actividad antiinflamatoria (IL-10, IL-13 y TGF-β [transforming growth factor beta ‘factor de crecimiento y transformación beta’])37,38. Esta alteración de la homeostasis no sólo obedece a la conocida inversión de la respuesta Th-1/Th-2 que acompaña a la infección crónica por el VIH, también se relaciona con cierto estado persistente de inflamación, estimulación antigénica crónica y alteración en la expresión de los marcadores celulares de activación por los linfocitos T38,39. A todo este bagaje de desequilibrios con una repercusión clínica tan connotada puede controlarlo parcialmente el TARGA, pero en menor escala en presencia de inmunodeficiencia grave al iniciar el tratamiento.
Recientemente, un nuevo linaje de células T, las Th-17, parece tener un papel importante en la respuesta inflamatoria sostenida que acompaña al SRI. En presencia del TGF-β y la IL-6, estas células producen señales a través de las citocinas IL-17, IL-17F e IL-22, y se incrementa la relación Th-17/células T regulatorias (TREGS), lo que facilita la activación celular y la liberación de los mediadores relacionados con el SRI37,40.
A la población de las células TREGS implicadas en la supresión de la respuesta inflamatoria puede infectarlas el VIH y pueden disminuir en presencia del sida8,12,13. TARGA induce significativa expansión numérica de las células TREGS (CD4+, CD25+, CD127+ y FoxP3+), incluso en individuos en los que se desarrolla el SRI; sin embargo, la disfunción residual de estas células para suprimir la actividad inflamatoria podría estar asociada al mecanismo patogénico de este síndrome37,40.
Susceptibilidad genética y síndrome de reconstitución inmunológicaLos factores genéticos explican una parte de la susceptibilidad humana a las infecciones. Hay alrededor de 10 millones de polimorfismos genéticos en el genoma humano, algunos de éstos se relacionan con las infecciones41. También estas alteraciones se han propuesto en la génesis del SRI, particularmente antígeno leucocitario humano (HLA)-B44, A2, DR4 y polimorfismos del gen IL12B que codifica la IL-12 p40 en el SRI por el virus herpéticos. Otras, en los genes de las citocinas TNF-α-308*2 y la IL-6-174*G con la SRI micobacteriano37.
Otros aspectos menos aclarados en la patogenia del síndrome de reconstitución inmunológicaHay un conocimiento limitado acerca de si esta entidad clínica se trata de una «enfermedad anatómicamente compartimentalizada» porque la respuesta inmunopatológica se localiza en un órgano específico, como el pulmón, el cerebro, el tracto uveal o el dermatoma, o si es una enfermedad sistémica con predilección por algunas estructuras como puede ocurrir en el SRI micobacteriano13,19.
Además, hay incertidumbre sobre la temporalidad en que ocurre este fenómeno. Actualmente se observa la tendencia de diferenciar 2 patrones fisiopatológicos del SRI: el precoz y el tardío. En el primero, la enfermedad se desencadena en los primeros 3 meses de iniciado el TARGA y generalmente representa la respuesta del sistema inmunitario restaurado ante una infección recientemente diagnosticada, para la cual el enfermo ha iniciado un tratamiento, o ante una infección quiescente y subclínica que ahora se manifiesta12,23,42. Esta modalidad fisiopatológica se ha documentado bien en la infección por M. tuberculosis23,43–45, principalmente en las primeras semanas de iniciado el TARGA respecto al tratamiento anti-TB15,44, y en mayor relación temporal con ésta que con el tratamiento específico para la TB26.
El segundo patrón traduce una respuesta directa a antígenos de patógenos no viables. Se ha observado con frecuencia en la infección por C. neoformans, que se manifesta por adenitis necrosante y meningitis con cultivos negativos, que en algunos artículos se ha denominado criptococosis tardía13,22,46. También hay descripciones semejantes en la infección por CMV, como la uveítis por reconstitución inmunitaria13. Observaciones recientes, sin embargo, han fomentado la duda de si esta modalidad puede representar un defecto inmunitario parcialmente corregido y han documentado la presencia de microorganismos viables12,42.
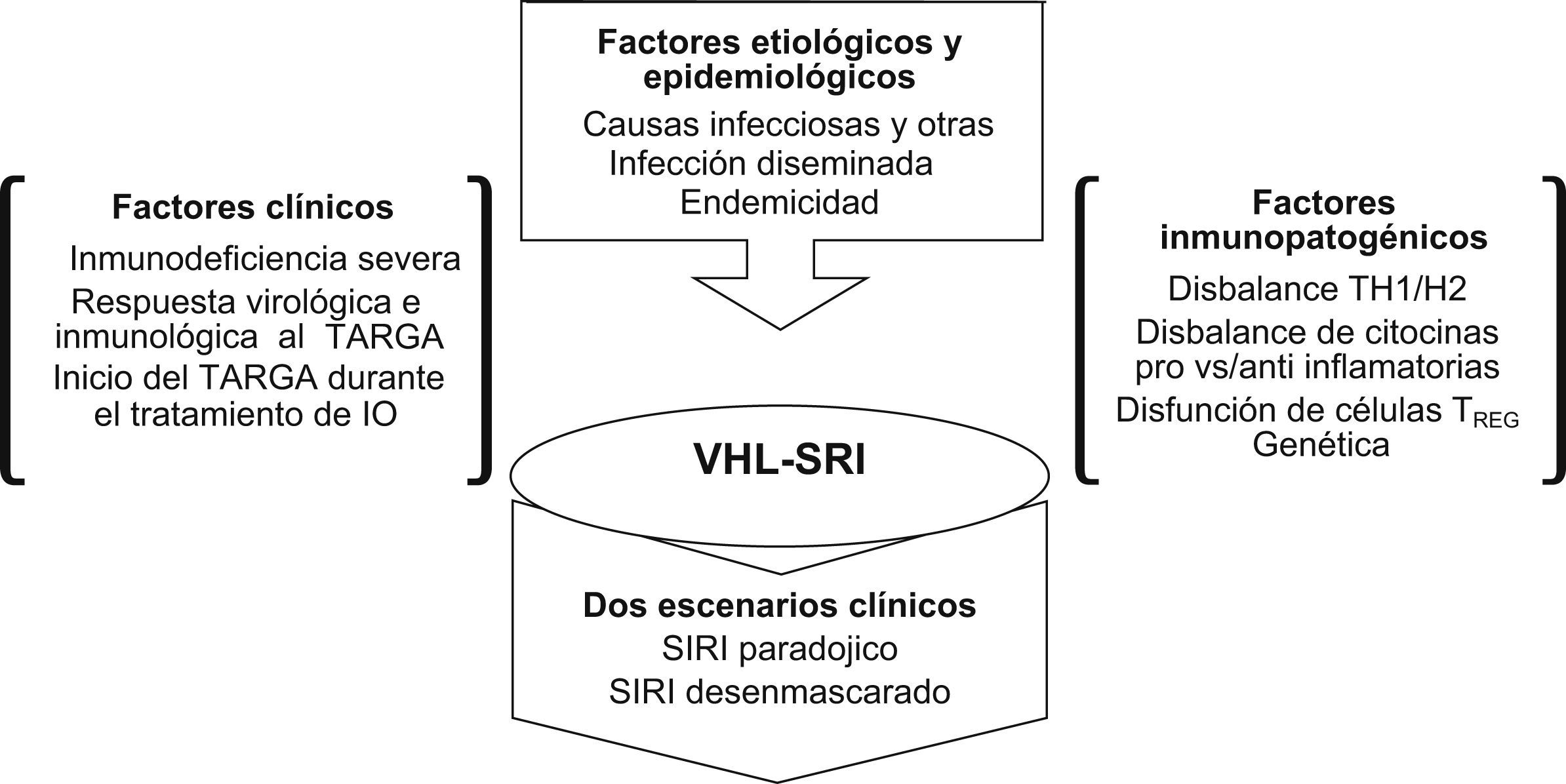
Factores de riesgo del síndrome de reconstitución inmunológicaLos factores de riesgo del SRI varían entre los individuos, las regiones y las etiologías12–17,44,46–48, por lo que resulta complejo hacer uniformes los argumentos en el contexto de una revisión. Tentativamente, la figura 1 articula los factores epidemiológicos, clínicos, etiológicos e inmunopatogénicos, en los que se ha nombrado hipótesis de integración multifactorial. Varios de estos aspectos se destacan en otros acápites del manuscrito. No obstante, se enfatizará en los más discutidos en la literatura médica consultada.
El SRI ocurre con mayor frecuencia en los pacientes que inician el TARGA marcadamente inmunodeprimidos37,39. El grado de afectación de la inmunidad celular tiene que ver con varios elementos en los cuales la mayoría de los autores están de acuerdo: mayor riesgo de IO, estado inflamatorio residual, disfunción persistente de células T y disrupción de los mecanismos homeostáticos reguladores37–40. Raramente el SRI tiene lugar en individuos que inician el tratamiento con recuento de LTCD4+ mayor o igual a 350 células37.
La respuesta virológica al TARGA se ha correlacionado con el desarrollo del SRI, sobre todo en aquellos individuos en que la CVP del VIH desciende más de 2 logaritmos de copias/ml a los 90 días de iniciado el tratamiento antirretrovírico15,37,49. Esta medición parece tener mayor importancia en los pacientes pretratados con TARGA, incluso aquéllos con resistencia preexistente, que posteriormente responden a un determinado esquema de TARVAE37,49.
Otro aspecto para destacar es la relación del SRI con la carga de antígenos microbianos presente en cada enfermo. Así, el SRI se ha asociado al antecedente de IO, a la existencia de enfermedad diseminada (bacteriemia, fungemia, viremia, etc.) y a la identificación de títulos elevados de antígenos microbianos en líquidos corporales15,37,46. Estas observaciones motivaron que algunos expertos recomendaran dilatar el inicio del TARGA durante el tratamiento de algunas infecciones activas, como TB, P. jirovecii y micosis, a modo de evitar uno de los espectros clínicos del SRI: el empeoramiento paradójico de los enfermos cuando se tratan por la IO y el VIH al unísono37,39,50. De tal manera, el momento en que se inicie el TARGA respecto al tratamiento de la IO es otro de los temas debatidos en relación con la ocurrencia de este síndrome37,47,50.
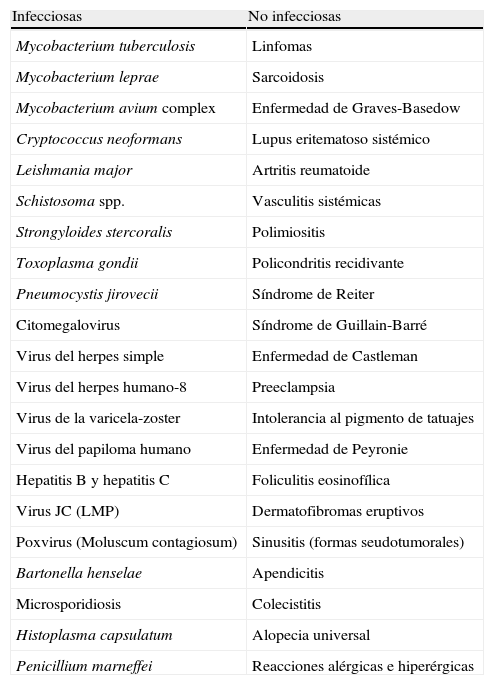
La tabla 1 enumera los procesos patológicos infecciosos o no que se han relacionado con el SRI. De éstos se derivó la clasificación etiológica propuesta por los autores de esta revisión (tabla 2).
Causas infecciosas y no infecciosas relacionadas con el síndrome de reconstitución inmunológica en los individuos infectados por el virus de la inmunodeficiencia humana11,13,22,82,101,108,118
| Infecciosas | No infecciosas |
| Mycobacterium tuberculosis | Linfomas |
| Mycobacterium leprae | Sarcoidosis |
| Mycobacterium avium complex | Enfermedad de Graves-Basedow |
| Cryptococcus neoformans | Lupus eritematoso sistémico |
| Leishmania major | Artritis reumatoide |
| Schistosoma spp. | Vasculitis sistémicas |
| Strongyloides stercoralis | Polimiositis |
| Toxoplasma gondii | Policondritis recidivante |
| Pneumocystis jirovecii | Síndrome de Reiter |
| Citomegalovirus | Síndrome de Guillain-Barré |
| Virus del herpes simple | Enfermedad de Castleman |
| Virus del herpes humano-8 | Preeclampsia |
| Virus de la varicela-zoster | Intolerancia al pigmento de tatuajes |
| Virus del papiloma humano | Enfermedad de Peyronie |
| Hepatitis B y hepatitis C | Foliculitis eosinofílica |
| Virus JC (LMP) | Dermatofibromas eruptivos |
| Poxvirus (Moluscum contagiosum) | Sinusitis (formas seudotumorales) |
| Bartonella henselae | Apendicitis |
| Microsporidiosis | Colecistitis |
| Histoplasma capsulatum | Alopecia universal |
| Penicillium marneffei | Reacciones alérgicas e hiperérgicas |
LMP: leucoencefalopatía multifocal progresiva.
Clasificación etiológica del síndrome de reconstitución inmunológica en los individuos infectados por el virus de la inmunodeficiencia humana
| Clasificación etiológica |
|
SRI: síndrome de reconstitución inmunológica.
Las definiciones presentadas en las tablas 3 y 4 se basaron en las observaciones de series de casos. En ambas hay 2 criterios homogéneos en relación con la supresión de la viremia del VIH y el aumento del número de LTCD4+. Se ausentan de las clasificaciones otras formas del SRI, como las autoinmunitarias. Tal vez podría ser necesario incluir en las definiciones pruebas diagnósticas como los cultivos, la reacción en cadena de la polimerasa y las técnicas de aglutinación con látex, mencionadas en algunas series revisadas13,22,42, de modo que se pueda dilucidar entre infección activa y respuesta inflamatoria. Sin embargo, representan una guía para el clínico y un intento de uniformar las decisiones en esta complicación asociada con el TARGA.
Definición diagnóstica del síndrome de reconstitución inmunológica en los individuos infectados por el virus de la inmunodeficiencia humana: Shelburne et al8
| VIH positivo |
| Presencia del TARGA |
|
| Síntomas clínicos indicativos de proceso inflamatorio |
| Curso clínico no relacionado con: |
|
ARN: ácido ribonucleico; IO: infección oportunista; LTCD4+: linfocitos T CD4+; TARGA: tratamiento antirretroviral de gran actividad; VIH: virus de la inmunodeficiencia humana.
Definición diagnóstica del síndrome de reconstitución inmunológica en los individuos infectados por el virus de la inmunodeficiencia humana: French et al13
| Criterios mayores* |
| A. Presentación atípica de las IO o de los tumores en pacientes con respuesta al TARGA |
|
| B. Disminución del ARN plasmático del VIH (CVP) mayor de 1 logaritmo10 copias/ml |
| Criterios menores |
| Aumento del recuento de los LTCD4+ luego del TARGA |
| Incremento de la respuesta inmune antígeno específica (p. ej. la hipersensibilidad retardada contra los antígenos micobacterianos) |
| Resolución espontánea de la enfermedad sin tratamiento antimicrobiano específico o quimioterapia antitumoral con la continuación del TARGA |
ARN: ácido ribonucleico; CMV: citomegalovirus; CVP: carga vírica plasmática; EI: enfermedad infecciosa; IO: infección oportunista; LTCD4+: linfocitos T CD4+; NTX: neurotoxoplasmosis; PCP: neumonía por Pneumocystis jirovecii; TARGA: tratamiento antirretroviral de gran actividad; TBP: tuberculosis pulmonar.
Particularmente, en relación con el SRI por TB, en noviembre del año 2006, alrededor de 100 investigadores llegaron al consenso de definirla en 3 categorías: el SIRI paradójico asociado a la TB (en referencia al empeoramiento clínico y radiológico de la TB activa cuando se inicia el TARGA), la TB asociada al tratamiento antirretrovírico (en relación con los casos de TB diagnosticados en los individuos que iniciaron el TARGA) y el SIRI asociado a la TB desenmascarada (para definir pacientes con TB subclínica que se manifiestan rápidamente luego del TARGA)5.
Probablemente la definición más acertada para el internista resulte de diferenciar 2 escenarios clínicos37,38,51:
El SRI paradójico: si hay empeoramiento o recaída de una IO u otra etiología, tratada o bajo tratamiento. El estado inflamatorio depende de un mecanismo inmunológico aberrante, aun en presencia de respuesta al tratamiento etiológico específico.
El SRI desenmascarado: si hay presentación acelerada de IO u otra etiología que se encontraba latente o subclínica cuando comenzó el TARGA. En este caso amerita enfatizar en la importancia de la identificación de estas causas previo a iniciar el tratamiento para la infección por VIH así como en la necesidad de pruebas diagnósticas de elevadas sensibilidad y especificidad para este propósito.
Un aspecto que suscita gran interés en los últimos años es el uso de biomarcadores de inflamación como predictores de riesgo del SRI. Algunos estudios han utilizado mediciones de IL-6, IFN-γ y proteína C reactiva, con importantes observaciones37. Sin embargo, la heterogeneidad etiológica e inmunopatogénica del síndrome limitan la generalización de estas determinaciones en la práctica clínica cotidiana.
Características clínicas de los síndromes de reconstitución inmunológica más frecuentesSíndromes de reconstitución inmunológica infecciososSíndromes de reconstitución inmunológica micobacterianosEl SRI por M. avium complex fue el primero que se describió y se relacionó con la monoterapia con AZT10. Desde aquella comunicación, la enfermedad es predominantemente localizada, caracterizada por linfadenitis (mesentéricas, mediastinales y axilares) que pueden supurar, dar fiebre, provocar lesiones dolorosas y masas inflamatorias granulomatosas que tienden a localizarse en los bronquios y en la cavidad peritoneal10,13,16,22. También se ha manifestado en localizaciones inusuales como la piel (nódulos), y como piomiositis, abscesos cutáneos, osteomielitis, bursitis y enfermedad de Addison22,52,53. Un estudio encontró linfadenitis cervical con intensa hipercalcemia15. En la mayor parte de los casos descritos en la literatura médica se desarrolló SRI por M. avium complex en los primeros 2 meses de iniciado el TARGA, generalmente entre la segunda y la tercera semana. La enfermedad coincidió con ascenso del recuento de LTCD4+ por el TARGA y la positivización de las pruebas de hipersensibilidad cutánea a antígenos micobacterianos13,16. El estudio histológico de los ganglios linfáticos y las masas inflamatorias evidenció inflamación granulomatosa y M. avium complex pudo cultivarse de las lesiones pero no de la sangre13,22. Varias investigaciones han señalado la utilidad de la prednisolona para el control de las linfadenopatías dolorosas16,22.
El SRI se ha descrito en otras infecciones micobacterianas, particularmente un caso de linfadenitis por el bacilo de Calmette-Guerin en un niño VIH positivo que inició un tratamiento antirretrovírico54. Recientemente se publicó el primer caso de respuesta paradójica en la infección pulmonar por Mycobacterium abscessus55.
El más paradigmático y probablemente más controvertido de los SRI es el relacionado con la infección por M. tuberculosis. Tal vez, esto está en relación con la peculiar interacción patogénica que ocurre entre M. tuberculosis y el VIH, que a diferencia de otras IO, se caracteriza por la prolongada activación inmunitaria inducida por la TB y la persistencia de la replicación vírica luego del tratamiento anti-TB exitoso56.
Robert Koch en 1880 realizó el primer reporte de reacciones al tratamiento de la TB, en lo que desde aquella fecha pudo tratarse de una reacción dependiente de la respuesta inmunitaria. Esto sucedió cuando intentó tratar enfermos de TB con la inyección de grandes cantidades de bacilos tuberculosos muertos (antigua PT de Koch), y se caracterizó por fiebre elevada, lesiones ulcerativas y elevada morbimortalidad57.
En el contexto del VIH, Narita et al26 realizaron la primera y la más detallada descripción clínica del SRI por M. tuberculosis. Estos investigadores identificaron que el síndrome fue más frecuente en el grupo de los enfermos con TB que inició el TARGA, respecto a los individuos VIH positivos con TB sin tratamiento antirretrovírico y a tuberculosos VIH negativos. Las principales características clínicas descritas en el estudio fueron fiebre héctica, linfadenopatías intratorácicas con o sin infiltrados radiológicos pulmonares, linfadenopatías cervicales y derrames pleurales. Las manifestaciones clínicas se relacionaron con la positivización de la PT y la disminución de la CVP, y tuvieron más relación temporal con el inicio del tratamiento antirretrovírico que con el tratamiento anti-TB26. Posteriormente, numerosas comunicaciones científicas han señalado similares características, incluidas las formas graves de distrés respiratorio15,30,58–60. Breen et al encontraron que esta situación clínica fue más frecuente en los pacientes con TB diseminada y en los pacientes que comenzaron el TARGA en las 6 semanas posteriores al tratamiento anti-TB; sin embargo, no se asoció a la CVP y el recuento de LTCD4+ en el diagnóstico, ni con la modificación de este recuento por el TARGA44.
De manera general se ha planteado que la enfermedad extratorácica es menos frecuente. Lawn et al demostraron participación pulmonar en el 84%, pero las manifestaciones intraabdominales no fueron infrecuentes (37%)47. Recientemente, algunas publicaciones reportaron localizaciones inusuales del SRI por TB, entre las que destacan meningitis con cultivos negativos, empeoramiento paradójico de tuberculomas cerebrales52,61, cerebritis localizada, vasculitis del sistema nervioso central, hipertensión endocraneana42, afectación hepatoesplénica y disfunción renal aguda7,42,62,63.
En Cuba, el SRI se identificó con fiebre elevada, derrame pleural y linfadenitis cervical, que reaparecieron después de una excelente respuesta al tratamiento anti-TB. La totalidad de los enfermos mantuvieron ambos tratamientos y ninguno falleció por complicaciones inherentes al SRI21.
En una cohorte retrospectiva de individuos que recibían TARGA en el Reino Unido se identificó que la TB ocurrió en uno de cada 5 pacientes con tratamiento para la infección por VIH, y el SRI fue más común en los pacientes en los que se desarrolló la TB tempranamente (media 41 días) y con marcada inmunodepresión64. A partir de estas observaciones se ha postulado la existencia de un «fenotipo inflamatorio» en los casos que manifiestan la forma temprana del SRI por M. tuberculosis. Entonces, los cuadros clínicos de TB en los pacientes con TARGA podrían indicar los efectos de este tratamiento en la amplificación clínica de la TB, principalmente en regiones de elevada endemicidad, más aún si se identificó el 85% de los enfermos de este grupo con cultivo positivo para M. tuberculosis64.
El mecanismo por el que la TB ocurre precoz o tardíamente en los pacientes con TARGA y la existencia del SRI asociado a la TB en presencia del cultivo positivo para M. tuberculosis son aspectos no totalmente dilucidados. Por otra parte, la posibilidad de confundir esta situación clínica con el fracaso y las toxicidades terapéuticas, la TB resistente a múltiples drogas (TB-MDR) u otras IO con participación pulmonar son un elemento para considerar en estos casos.
Hay SRI en asociación con la infección por M. leprae. Desde el año 2003, cuando se reportó el primer caso, varios se han descrito fundamentalmente en la India, Sudamérica y África14,65. En la mayoría de los pacientes provoca la presentación clínica de la lepra con una reacción aguda en las lesiones, que puede resultar en la pérdida rápida de la función nerviosa. Esta forma de SRI debe sospecharse ante todo individuo que durante los primeros meses de iniciado el tratamiento para el VIH presente lesiones cutáneas eritematosas o edematosas con pérdida de la función nerviosa periférica demostrada por anestesia o debilidad muscular. Se cree que el síndrome relacionado con la lepra depende más de infecciones subclínicas desenmascaradas que de nuevas infecciones16.
Batista et al reportaron 2 casos de reacción leprosa de tipo 1 como expresión clínica del SRI luego del TARGA. En ambos casos y en la literatura médica consultada por los autores, las manifestaciones clínicas incluyeron ulceración y formas inusuales de presentación. También describieron incremento de la respuesta inmunitaria celular y granulomatosa específica de la infección micobacteriana en uno de los casos con reacción positiva a la lepromina66.
Síndromes de reconstitución inmunológica por infecciones micóticasEl SRI asociado a infecciones por C. neoformans se observó inicialmente en los pacientes que presentaban episodios recurrentes de meningitis criptococócica durante las primeras semanas del TARGA13. Esto aconteció en los individuos con recuentos de LTCD4+ menores a 50 células, que tuvieron respuesta inmunológica y virológica al TARGA, caracterizado por una intensa reacción celular en el líquido cefalorraquídeo (LCR) y por cultivos positivos para C. neoformans. También se han descrito episodios recurrentes de meningitis con cultivos negativos, linfadenitis inflamatoria, neumonitis necrosante, criptococoma y absceso intramedular67. Algunos factores asociados al SRI criptococócico son comunes a los descritos en la TB, como enfermedad diseminada, inmunodeficiencia grave e inicio del TARGA en los 2 primeros meses del tratamiento antifúngico. Otros factores más característicos han sido títulos elevados de antígeno de C. neoformans en el LCR y persistencia de cultivo positivo en la segunda semana del tratamiento antimicótico sistémico46,68.
Las manifestaciones clínicas son las de un síndrome neurológico infeccioso, algunas graves. Los estudios imagenológicos, particularmente la resonancia magnética (RM), pueden mostrar microabscesos difusos cerebrales, edema marcado y captación anormal del contraste en los espacios de Virchow-Robin. A diferencia de la clásica meningitis criptococócica, la que acompaña al SRI, se caracteriza por mayor presión de abertura, mayor glucorraquia y pleocitosis del LCR67. Fuera del sistema nervioso central, el agrandamiento de los ganglios linfáticos, que pueden afectar el mediastino, es el hallazgo más frecuente13,46. Los estudios histológicos generalmente muestran inflamación granulomatosa con o sin necrosis y predominio de macrófagos CD68+ en la biopsia de nódulo pulmonar46.
Algunos investigadores se inclinan a establecer 2 patrones fisiopatológicos del SRI criptococócico en individuos VIH positivos13,46. El primero, denominado precoz, puede obedecer a una reacción aguda a una infección subclínica que se exterioriza tempranamente luego del TARGA. En este caso, la meningitis cursa con cultivos de LCR o sangre positivos13,46 y el tratamiento antifúngico está indicado. En algunos casos con recidivas de meningitis por C. neoformans se ha demostrado superposición del SRI y resistencia al fluconazol, como se ha descrito también en la TB68.
El patrón tardío es predominantemente linfadenopático y de localización mediastinal, cervical e intraabdominal. El hallazgo histológico coincide con inflamación granulomatosa, necrosis y supuración, que puede estar asociada a hipercalcemia sanguínea13. También se ha diagnosticado meningitis aséptica con hipertensión endocraneana y masas cerebrales inflamatorias. En esta vertiente del SRI por C. neoformans la respuesta inflamatoria crónica puede ser secundaria a antígenos capsulares o levaduras no viables y tiene lugar hasta 15 meses posteriores al inicio del TARGA13,15,67,68.
El SRI se ha descrito en la infección por Histoplasma capsulatum69. Recientemente, Breton et al reportaron 4 pacientes que tuvieron manifestaciones clínicas no comunes en el curso de histoplasmosis diseminada. Las principales fueron abscesos hepáticos, linfadenitis compresiva, obstrucción intestinal, uveítis y artritis. La mediana de tiempo desde el inicio del TARGA fue de 45 días y los casos mostraron un incremento de 106 células (mediana) en el recuento de LTCD4+70.
Síndrome de reconstitución inmunológica asociado a Pneumocystis jiroveciiTambién el SRI se ha relacionado con P. jirovecii11,17. Wislez et al en Francia y Dean et al en el Reino Unido71,72 han realizado los 2 reportes más destacados en la literatura médica. En ambos casos se trató de respuestas paradójicas (fiebre, insuficiencia respiratoria e infiltrados pulmonares en parches) en pacientes que habían mejorado con tratamiento anti-P. jirovecii; suspendieron los corticoides e iniciaron el TARGA. El tratamiento para el VIH se introdujo precozmente luego del diagnóstico de P. jirovecii y el SRI ocurrió en las primeras 2 semanas de iniciado el TARGA. Los enfermos estaban marcadamente inmunodeprimidos y disminuyeron la CVP en 2,87 logaritmo10 luego del tratamiento antirretrovírico72. El estudio citohistológico de las muestras obtenidas por broncoscopia con lavado broncoalveolar evidenció una reacción inflamatoria grave con persistencia de escasos quistes de P. jirovecii71. La totalidad de los enfermos mejoraron con el reinicio del tratamiento esteroideo71,72. Situaciones clínicas como la P. jirovecii resistente a cotrimoxazol, la superinfección pulmonar y la toxicidad inducida por fármacos deben excluirse antes de diagnosticar SRI.
Síndrome de reconstitución inmunológica asociado a citomegalovirusEn el SRI por CMV se han diferenciado 2 vertientes: la temprana, que generalmente coincide con los 3 primeros meses de iniciado el TARGA y su manifestación clínica principal es la retinitis de novo o recidivante, y la tardía, caracterizada por uveítis y vitritis por restauración inmunológica12,13,22. Esta entidad es más frecuente en pacientes VIH positivos con menos de 50 LTCD4+, que luego del aumento del recuento (más de 100 células × mm3) por el TARGA suspenden la profilaxis secundaria para el CMV16. Tanto la recidiva como el primer episodio de retinitis en individuos que aumentaron el recuento de LTCD4+ pueden ser el resultado de la respuesta inmunitaria exuberante contra una infección persistente o subclínica por CMV16. Una reciente comunicación describió pancolitis grave perforativa secundaria a la reactivación de la infección por CMV en un individuo que inició el TARGA73.
Síndrome de reconstitución inmunológica asociado al virus de la hepatitis B y al virus de la hepatitis CLa hepatitis B como SRI se identificó en el 9% de una cohorte retrospectiva de individuos VIH positivos con TARGA en el Reino Unido13. También se han comunicado episodios de hepatitis vírica aguda en individuos coinfectados luego de 5 a 12 semanas de iniciado el tratamiento antirretrovírico22. El virus de la hepatitis B (VHB) puede permanecer en forma episómica latente durante su ciclo replicativo y la restauración de la respuesta CTL mediada por los LTCD8+ en el hígado podría indicar las manifestaciones clínicas reportadas. En la mayoría de los casos, la clínica coincide con la detección del ácido desoxirribonucleico (ADN) y del VHB en el suero de los pacientes22. Lok et al consideraron que el riesgo de SRI por el VHB es mayor durante el ascenso del recuento de LTCD4+ por el TARGA, e indicaron no suspender el tratamiento para la hepatitis B cuando se inicia o se cambia un régimen de TARGA74.
Respecto a la hepatitis C, se han publicado casos de individuos coinfectados con el virus de la hepatitis C (VHC) y con el VIH en los que se desarrollaron manifestaciones clínicas de hepatitis aguda con concentraciones detectables de ácido ribonucleico y de VHC poco después de incorporado el TARGA75,76. Recientemente, Kim et al publicaron 2 casos de pacientes coinfectados por el VIH y el VHC con viremia indetectable del VHC, que desencadenaron hepatitis clínica y aumentos marcados de las transaminasas y la viremia del VHC durante los 4 meses posteriores al comienzo del tratamiento para el VIH77. Estos autores plantearon 2 hipótesis como posibles argumentos: la expresión clínica de una infección hepática leve persistente por el VHC a partir de la restauración de la respuesta CTL y VHC-específica por el TARGA y, como alternativa, que la restauración de la población de linfocitos T hepáticos puede favorecer la replicación de variantes del VHC encubiertas en estas células77. Sin embargo, el papel del SRI en el daño hepático y el desarrollo precoz de cirrosis hepática está poco aclarado76.
Síndrome de reconstitución inmunológica asociado a leucoencefalopatía multifocal progresiva por virus JCLa LMP es una encefalopatía desmielinizante de curso subagudo causada por poliomavirus JC, para la que el único tratamiento eficaz es el TARGA13,78. No obstante, se han descrito el comienzo o el empeoramiento de déficits neurológicos poco tiempo después de iniciado el TARGA, con hallazgos en las RM indicativos de LMP. Cinque et al encontraron que el 18% de los pacientes con antecedentes de LMP experimentaban exacerbación alrededor de la nonagésima semana de iniciado el TARGA79. Los pacientes sin este tratamiento previo tuvieron peor pronóstico, con progresión de las lesiones de LMP79. El estudio histológico cerebral en un caso evidenció extensa desmielinización, infiltrado mononuclear perivascular y oligodendrocitos reactivos al antígeno de poliovirus. La RM con gadolinio permite demostrar agrandamiento periférico de las lesiones hipodensas22. La detección del ADN vírico en el LCR puede ser de utilidad, aunque la sensibilidad alcanza el 75%. La combinación de los elementos clínicos con los hallazgos en la RM puede ser suficiente42.
Tan et al publicaron un estudio que caracterizó a 54 pacientes con SRI relacionado con LMP, 36 de ellos manifestaron el síndrome simultáneamente a la LMP y el resto presentó empeoramiento de una LMP preexistente. En el segundo grupo de casos, el SRI fue más precoz, las imágenes cerebrales en la RM fueron mayores y la mortalidad fue superior al resto. Los corticoides se utilizaron en 12 enfermos, de los cuales 7 sobrevivieron80. También, Venkataramana et al describieron 3 casos con manifestaciones neurológicas en el curso del TARGA, particularmente un paciente en el que se desarrolló un síndrome demencial progresivo, con subsiguiente deterioro, coma e infiltrado cerebral masivo de los LTCD8+. Este caso mejoró luego del uso de corticoides y de las modificaciones del TARGA81.
Las alteraciones neurológicas que acompañan a la infección por VIH son diversas y tienden a crear confusión diagnóstica. Luego de la generalización del TARGA se han descrito episodios clínicos de encefalitis, encefalomielitis aguda desmielinizante, cerebritis local que responde a esteroides, que deben incluirse entre los diagnósticos diferenciales. En la mayoría de éstos no se demostró el patógeno causal y también se justificaron por la reconstitución inmunológica16,42.
Otros síndromes de reconstitución inmunológica infecciososLa restauración de la respuesta inmunitaria por el TARGA ha facilitado la expresión clínica de otras infecciones víricas, fundamentalmente con síndromes dermatológicos exuberantes. Éstos incluyen VVZ, enfermedad mucocutánea por el VHS, lesiones por Moluscum contagiosum y por Leishmania major13,16,17. Particularmente, el SRI por VVZ se ha correlacionado con el porcentaje de LTCD8+ en el momento del diagnóstico y luego del TARGA22.
Cada día son más frecuentes las descripciones del SRI en el curso de las EI. En fecha reciente se enumeraron las infecciones por Strongyloides stercoralis, Schistosoma sp. y Penicillium marneffei82,83. Sriaroon et al publicaron un caso de peritonitis granulomatosa en un paciente VIH positivo con infección por Microsporidium y excelente respuesta virológica al TARGA. Aunque el microorganismo se identificó en heces fecales y se trató al paciente con albendazol, la histología peritoneal mostró inflamación granulomatosa sin microorganismos, hallazgo que apoya el diagnóstico del SRI84.
A pesar de que la infección por Treponema pallidum puede ser una de las etiologías infecciosas del SRI, en la literatura médica consultada no se encontró comunicación al respecto. Hay publicaciones sobre localizaciones inusuales de la enfermedad en los individuos infectados por VIH: vitritis y neuritis óptica bilateral; sin embargo, los autores no mencionan el SRI como argumento de estas manifestaciones, de otro modo destacan la importancia del TARGA y la restauración de la respuesta inmunitaria en aminorar las complicaciones neurológicas de la sífilis85,86.
Síndrome de reconstitución inmunológica autoinmunitariaAlgunas enfermedades de etiología autoinmunataria, como la artritis reumatoide, el lupus eritematoso sistémico, la polimiositis y la enfermedad de Still de comienzo en el adulto, se han manifestado luego de la introducción del tratamiento antirretrovírico13,87. También el SRI se ha relacionado con el síndrome de Guillain- Barré88 y con menor frecuencia con las enfermedades de Graves Basedow y policondritis recidivante13. O’Leary et al recientemente publicaron el primer caso reconocido en la literatura médica de hepatitis autoinmunitaria en un individuo con infección por VIH, tratamiento antirretrovírico y pruebas de reconstitución inmunológica. Los autores hicieron alusión a la alteración de la tolerancia inmunológica periférica inducida por el TARVAE como una de las posibles explicaciones89.
Es conocido que la infección crónica por VIH conduce a alteraciones de la inmunidad adaptativa dependiente de anticuerpo, en cierta medida secundarias a la persistente estimulación antigénica90; no obstante, la fundamentación del desencadenamiento de trastornos autoinmunitarios por el TARVAE no está totalmente aclarada. Probablemente obedezca a múltiples factores y se suma la disregulación de las citocinas y de la función tímica durante la reconstitución inmunológica13.
Síndrome de reconstitución inmunológica sarcoideoEsta forma de SRI en los individuos VIH positivos se ha descrito antes y después del TARGA como una enfermedad granulomatosa sistémica con predominante participación pulmonar13. La legendaria enfermedad es una paradoja inmunológica en sí, pues depende de LTCD4+ con actividad Th1 para la formación de granulomas; sin embargo, puede cursar con anergia a la PT91. Uno de los casos reportados en la literatura médica presentó tos, disnea y nódulos subcutáneos en los antebrazos. Los estudios de imágenes demostraron infiltrado reticulonodulillar pulmonar, adenopatías hiliares, sin manifestaciones clínicas indicativas de afectación visceral extratorácica92. El SRI sarcoideo aparece tardíamente en comparación con otras enfermedades granulomatosas, como las micobacterianas, generalmente varios meses después de iniciado el TARGA13,92. La enfermedad se autolimita en la mayoría de los pacientes, pero el tratamiento esteroideo puede ser necesario en determinados casos92. A pesar de la escasa frecuencia, el clínico debe incluir el SRI sarcoideo entre los diagnósticos diferenciales de otras más comunes como las asociadas a M. tuberculosis, M. avium complex o linfomas.
Síndrome de reconstitución inmunológico tumoralSíndrome de reconstitución inmunológico asociado al sarcoma de KaposiEl sarcoma de Kaposi (SK) es la neoplasia más frecuente en individuos VIH positivos y probablemente sobre la que más impacto ha tenido el TARGA en términos de reducir la incidencia y la mortalidad11. La enfermedad es predominantemente cutaneomucosa y sólo en el 15% de los casos hay afectación de órganos internos. En presencia de la reconstitución inmunológica por el tratamiento, se han descrito formas inusuales y fatales con extensa afectación pulmonar y ganglionar93–95. Los enfermos pueden fallecer de insuficiencia respiratoria y radiológicamente son frecuentes el derrame pleural y las opacidades de aspecto nodular o infiltrativo en localización peribroncovascular11,93.
Se desconoce si estas observaciones obedecen a la reconstitución inmunológica específica para el virus herpes humano-8 (HVH-8), agente etiológico de la enfermedad, o si se trata de una disregulación de citocinas inducida por el TARGA, que provoca la angioproliferación y la tumorogénesis13,96,97. La realidad es que persisten casos del SK a pesar de la efectividad del TARGA, lo que genera importantes interrogantes acerca del control de la infección por HVH-8, la progresión de la enfermedad y el papel del SRI en estas observaciones97.
Otras formas de síndrome de reconstitución inmunológica tumoralHay anecdóticas comunicaciones de SRI relacionado con la enfermedad de Castleman multicéntrica, linfoma no hodgkiniano y linfoma primario de cavidades11,13,22,97.
Síndrome de reconstitución inmunológica asociado a la gestaciónSe propone esta variante del SRI en mujeres seropositivas al VIH y se considera la ya mencionada asociación al embarazo y al puerperio con el desarrollo o el empeoramiento de las EI y las enfermedades autoinmunitarias1. Los cambios inmunológicos relacionados con la gestación como mecanismo fisiológico para tolerar el feto pueden modificarse en presencia de la replicación vírica y de la inmunodeficiencia que ataña al sida. La preeclampsia se ha propuesto entre las consecuencias del SRI en gestantes seropositivas con TARGA98. No obstante, la mayoría de las comunicaciones destacan el impacto positivo del tratamiento en la morbilidad materna y perinatal de las mujeres VIH positivas99,100. En realidad, hay desconocimiento acerca de si ciertas complicaciones de la gestación en estas mujeres pueden obedecer al SRI y en qué medida dependen de la restauración de la inmunidad inducida por el tratamiento o de los complejos cambios inmunológicos y hormonales que acompañan al embarazo100.
Otras variantes del síndrome de reconstitución inmunológicaSe han descrito formas inusuales del SRI con un mecanismo fisiopatológico aún incierto. Entre éstas se encuentran la intolerancia al pigmento de los tatuajes, las vasculitis cerebrales, la enfermedad de Peyronie, los dermatofibromas eruptivos múltiples, la queilitis eruptiva, la foliculitis eosinofílica, las formas seudotumorales de sinusitis y el granuloma pulmonar hialinizante, enfermedad pulmonar inflamatoria con gran componente inmunológico, de la que sólo 100 casos se han comunicado en la literatura médica1,13,101–103. También Rogers et al publicaron un caso de miocarditis con insuficiencia cardíaca refractaria en un individuo VIH positivo que tuvo rápida restauración de la inmunidad por el TARGA104.
Enfoque terapéutico del síndrome de reconstitución inmunológicaHasta la fecha no hay protocolos uniformes para el tratamiento del SRI. Las observaciones son en su mayoría anecdóticas e implican un abordaje individualizado más que estandarizado. Luego de esta revisión se pudieron identificar algunos aspectos que pueden orientar la necesidad, la emergencia y el tipo de tratamiento. Entre éstos se mencionan la gravedad clínica, el SRI por EI que se está tratando (empeoramiento paradójico), algunas etiologías infecciosas por M. tuberculosis, M. avium complex, P. jirovecii o CMV, y el patrón temporal del SRI: precoz (microorganismos viables) o tardío (microorganismos no viables), así como la presencia del TARGA antes del diagnóstico de la EI.
Por otra parte, la necesidad de discernir entre la falta de respuesta al tratamiento específico para la EI, la superposición de toxicidades farmacológicas entre los antirretrovíricos y los medicamentos para estas infecciones, o la aparición de una nueva IO impone frecuentes dificultades al enfoque terapéutico del SRI.
Entre las medicaciones que han mostrado utilidad para tratar el SRI destacan los fármacos antiinflamatorios no esteroideos (AINE), los corticoides (particularmente la prednisolona), los inhibidores o bloqueadores del TNF-α (pentoxifilina, talidomida y etanercept) y el rituximab (anticuerpo monoclonal antilinfocitos B CD20+). Un estudio describió el éxito del tratamiento con montelukast (Singulair), un inhibidor de los leucotrienos, y postuló el papel de estos mediadores en la respuesta inflamatoria inducida por el TARGA7,11–13,16,105.
Desde la óptica de esta revisión, el enfoque del SRI puede valorarse desde 2 vertientes:
- •
El tratamiento preventivo
- •
El tratamiento del SRI constituido
El tratamiento preventivo (recomendación C-III) incluye varias acciones, no sólo en el plano individual del enfermo, sino también debe abarcar la situación epidemiológica del país o región y, en particular, de la EI. Entre éstas se identificaron:
- 1)
Valorar la endemicidad de la EI.
- 2)
Identificar las coinfecciones múltiples.
- 3)
Diagnosticar las IO subclínicas en los individuos marcadamente inmunodeprimidos.
- 4)
Profilaxis secundaria en algunas infecciones con independencia del estado inmunológico en regiones de elevada endemicidad.
- 5)
Disminuir la carga de microorganismos en las IO bajo tratamiento antes de iniciar el TARGA.
- 6)
Retardar el inicio del TARGA en ciertas IO bajo tratamiento específico con potencialidad de empeoramiento.
Respecto a dilatar el inicio del TARGA en los individuos sin tratamiento previo, hay varias tendencias y tal vez las más estudiadas han tenido lugar en relación con la TB. La disyuntiva principal radica en ¿hasta qué punto iniciar el TARVAE facilitaría el SRI? o ¿en qué medida el retrasar el TARGA implicaría mayor riesgo de progresión a sida y mortalidad?106. Las pruebas actuales apoyan no demorar la institución del tratamiento antirretrovírico en los pacientes con bajos recuentos de LTCD4+; sin embargo, el momento y la cifra de esta medición para definir el comienzo no está bien definido en investigaciones clínicas controladas107,108.
Particularmente en la TB, el más polémico de los escenarios del SRI cuando ambas infecciones se diagnostican juntas o no hay TARGA antes de la TB, la mayoría de los autores plantean tratar de inmediato la TB y diferir el tratamiento antirretrovírico hasta la cuarta u octava semana del tratamiento anti-TB en enfermos con recuento de LTCD4+ superior a 100 células11,30. Otros hacen esta misma recomendación cuando el recuento celular al diagnosticarse la TB supera las 200 células52. Investigadores cubanos propusieron el inicio simultáneo de ambos tratamientos cuando el recuento de LTCD4+ en el momento del diagnóstico de la TB es menor de 200 células, teniendo en cuenta la elevada y la temprana mortalidad en los casos con recuentos inferiores, así como la ausencia de mortalidad en los pacientes que manifestaron el SRI21,109. Schiffer et al propusieron recientemente la introducción precoz del TARGA en los enfermos con sida y con TB110.
En la actualidad múltiples estudios se encaminan para establecer el momento y los regímenes idóneos para hacer simultáneos el tratamiento anti-TB y el TARGA. Entre éstos amerita mencionar: ANRS 1295 (CAMELIA), AACTG A5221, START, TB-HAART y PART111. Una reciente comunicación sobre la cohorte española de la Corono Metropolitana Sureste de Madrid identificó asociación entre el tratamiento simultáneo (TARGA y anti-TB) y el incremento de la supervivencia en los pacientes con ambas enfermedades112. Este alentador resultado en cierta medida aminora los históricos temores durante la primera fase del tratamiento anti-TB en los individuos VIH positivos que iniciaban el TARGA, entre los cuales el SRI no es infrecuente.
La recomendación de postergar el comienzo del TARGA se ha valorado para otras IO bajo tratamiento específico: P. jirovecii hasta la tercera semana de iniciado el tratamiento (antimicrobianos y corticoides)71,72; meningitis criptococócica hasta la normalización o negativización microbiológica del LCR46, e infección por M. avium complex hasta la mejoría sintomática (generalmente de 3 a 4 semanas)16,52.
Sin embargo, luego de los resultados recién publicados del estudio ACTG A5164, se puede recomendar el inicio del TARGA de forma ideal a los 10 o a los 14 días de inicio de la IO y preferentemente antes de los 28 días en los pacientes con IO diferentes de la TB, siempre que no haya complicaciones clínicas que lo limiten (recomendación A-I)108.
Tratamiento del SRI constituido. En esta situación las disyuntivas radican en:- •
Mantener o no el TARGA
Hay consenso en mantenerla siempre que sea posible. Aunque debe valorarse el riesgo de superposición de toxicidades, sobre todo hepática y neurológica11,30,107,108. Algunos casos de LMP por virus JC han mejorado luego de modificaciones de los esquemas del TARGA13,113,114.
- •
Mantener o no el tratamiento específico para la IO30,52,74,107,114,115
Cuando la IO se está tratando debe mantenerse el tratamiento específico. Igualmente debe iniciarse en el SRI asociado a la EI que se manifiesta precozmente (3 meses) luego del inicio del TARGA y en los relacionados con: M. tuberculosis, M. avium complex, CMV, C. neoformans, VHB, VHC, VHS y VVZ, con mayor importancia ante las pruebas microbiológicas de infección activa.
- •
Criterios para usar los corticoides y los fármacos AINES
Los datos más claros sobre la eficacia del tratamiento antiinflamatorio coadyuvante obedecen a los corticoides. Una comunicación describió la eficacia del ibuprofeno más el TARGA en curar un caso de SRI asociado a la TB pericárdica116.
Hasta la fecha las indicaciones más evidentes para el uso de prednisolona a razón de 1 a 2mg/kg/día por no más de 6 semanas en el SRI son13,16,42,107,117 las siguientes:
- 1)
Poliserositis tuberculosa.
- 2)
Linfadenitis por M. tuberculosis o por M. avium complex refractarias al tratamiento específico.
- 3)
Insuficiencia respiratoria aguda grave por P. jirovecii u otras etiologías.
- 4)
Obstrucción de las vías respiratorias por adenopatía o masa inflamatoria.
- 5)
Empeoramiento paradójico de tuberculomas.
- 6)
LMP por virus JC.
- 7)
Meningitis asépticas con hipertensión endocraneana asociada.
- 8)
Encefalitis y encefalomielitis agudas o subagudas asociadas al TARGA.
- 9)
Algunas formas de SRI «tardíos» (C. neoformans y vitritis por CMV).
- 10)
Formas graves de SRI con independencia de la etiología.
- 11)
SRI autoinmunitario.
- 12)
SRI sarcoideo.
Este aspecto es variable en la literatura médica consultada. Aunque en el peor de los escenarios el SRI puede ser mortal, la mayoría de los autores lo consideran una complicación corregible30,47,117–119. El limitado número de individuos estudiados, las particularidades de cada SRI y la carencia de estudios controlados impiden mayor claridad en este sentido. No obstante, las observaciones recientemente publicadas por Murdoch et al indicaron que las manifestaciones del SRI fueron ligeras en el mayor porcentaje de la cohorte y menos del 10% de los pacientes necesitaron suspender el TARGA o utilizar corticoides118. En el estudio realizado por Lawn et al en África subsahariana, el desarrollo del SRI no se asoció a excesivo riesgo de mortalidad, a pesar de que la mayoría de los pacientes tenían elevada morbilidad e inmunodeficiencia avanzada47,50.
Implicaciones futuras del síndrome de reconstitución inmunológica con énfasis en los países de elevada carga de enfermedades infecciosasEl SRI seguirá en ascenso en la medida que el TARGA se generaliza en varias regiones del mundo120. Sus consecuencias serán más preocupantes en los países en desarrollo, pues en éstos coexisten 2 de los factores más importantes: la inmunodeficiencia grave y la elevada carga de EI coexistentes64,120,121.
El impacto en estas regiones puede afectar el control epidemiológico de varias EI endémicas asociadas al VIH y sida, particularmente la TB y la lepra14,24,121. Para la TB en cuestión, enfermedad más comúnmente asociada al SRI en estos escenarios, uno de cada 5 de los casos ocurren en individuos con TARGA, lo que parece acontecer cada vez con mayor frecuencia64,121,122. Aunque resulta difícil de comprobar, es posible que un número considerable de los casos de TB diagnosticados en presencia del TARGA obedezca al efecto del SRI sobre infecciones subclínicas o no diagnosticadas preexistentes64,111,121,123. Varias observaciones han indicado que el riesgo de incidencia de TB en personas con 3 años de TARVAE se mantiene superior a la población VIH negativa y a la incidencia global en la comunidad24,61,111. Cuando se suman la superposición de TB-MDR, las toxicidades y las IO concurrentes, el SRI puede poner en peligro el impacto positivo del tratamiento para el VIH en la incidencia de la TB en estas regiones111,124.
ConclusionesEl SRI es una entidad clínica cada vez más frecuente. Los clínicos deben prepararse para el reconocimiento y el abordaje terapéutico de esta complicación, que en ciertas ocasiones y en determinados individuos puede ser amenazante para la vida. Se requiere de investigaciones clínicas controladas para aclarar varias facetas aún desconocidas del problema, sobre todo, aquéllas relacionadas con la definición y los criterios diagnósticos. De otra parte, amerita proseguir con la incorporación y la validación de biomarcadores para ayudar al diagnóstico y establecer el pronóstico en casos puntuales. También los estudios de genética y de genómica indican nuevos horizontes para elucidar la fisiopatología del SRI e identificar los factores de riesgo en grupos de individuos infectados por VIH. Aunque se ha avanzado en las estrategias terapéuticas para determinadas etiologías del SRI, aún es insuficiente el conocimiento en aspectos cruciales para evitar o reducir las consecuencias de esta complicación.