Introducción
El virus de la rubéola es un virus ARN encuadrado dentro del género Rubivirus en la familia Togaviridae 1. Este virus, el único del género, presenta un solo tipo serológico con al menos dos grupos clonales y varios subgenotipos 2,3. Pese a ser una enfermedad exantemática generalmente leve, cuando la rubéola se contrae en el primer trimestre de la gestación puede ocasionar aborto, muerte fetal 4 y el síndrome de rubéola congénita (SRC) 5. En la era prevacunal la rubéola surgía en forma de ondas epidémicas primaverales (entre cada 6 y 9 años en Norteamérica y entre cada 3 y 5 en Europa) 5. Entre 1964 y1965 tuvo lugar una gran pandemia que se acompañó de un importante aumento de casos de SRC 6. Fue a partir de la segunda mitad de la década de 1960 cuando se desarrollaron las primeras vacunas contra esta infección 5, cuya aplicación redujo de forma importante la incidencia de la rubéola.
Entre los objetivos prioritarios del Plan Estratégico para la Eliminación del Sarampión y el control del SRC en la región europea elaborados por la Organización Mundial de la Salud (OMS) se establece la reducción, para el año 2010, de la incidencia del SRC a menos de un caso por 100.000 nacidos vivos 7-9. El control de la rubéola y de la aparición de brotes es un paso previo a la eliminación del SRC. Siguiendo las directrices de los Centers for Disease Control and Prevention (CDC), las medidas de control deben instaurarse rápidamente tras la aparición de un solo caso 4,10. Estas medidas deben ir dirigidas a la interrupción de la transmisión del virus y a la protección de los susceptibles 10. Sin embargo, la percepción que se tiene sobre la rubéola en nuestro medio puede verse condicionada por tratarse de una enfermedad que en la era prevacunal afectaba preferentemente a niños y que, en los últimos años, se ha presentado de forma cada vez menos frecuente. La asociación entre la baja incidencia real en población infantil, relacionada con su reducida susceptibilidad conseguida con la vacunación 11 y el concepto de enfermedad pediátrica incluida en los calendarios de vacunación ha motivado que se piense en la rubéola como una patología del pasado. Al igual que sucede con el sarampión, el reservorio del virus es exclusivamente humano, se dispone de una vacuna eficaz y se cuenta con técnicas de diagnóstico apropiadas 12. Por estos motivos es coherente plantear la meta de alcanzar la interrupción de su transmisión 13,14. No obstante, a diferencia de lo que ocurría en la era prevacunal con el sarampión, en el caso de la rubéola, al ser una enfermedad menos transmisible, no se puede asumir que los adultos se encuentren protegidos de manera natural 15. En países donde no se vacuna, entre el 5 y el 15% de las mujeres en edad fértil pueden ser susceptibles a la rubéola 16. En las naciones industrializadas, la seroprevalencia es elevada en niños (en su mayoría vacunados) y adultos mayores de 40 años (expuestos al virus salvaje durante su infancia), pero resulta más baja en las edades intermedias (adultos jóvenes no vacunados y sin antecedentes de infección natural) 17. Además, otros factores que pueden entorpecer el control de la enfermedad son la elevada frecuencia de casos subclínicos 10 y la posibilidad de reinfección en individuos con anticuerpos específicos 18.
La disminución de la circulación natural del virus tras la introducción a finales del pasado siglo de la vacuna antirrubeólica y los cambios demográficos resultantes de los movimientos migratorios han generado, en países desarrollados 17,19,20, un nuevo marco en el que la rubéola reaparece en la edad adulta y afecta a segmentos definidos de población susceptible. Un ejemplo de este nuevo escenario es el notable incremento de casos de rubéola recientemente detectado en la Comunidad de Madrid 21. En este estudio se revisan algunos aspectos de estos cambios y se comenta la situación actual de la rubéola en España.
Diagnóstico
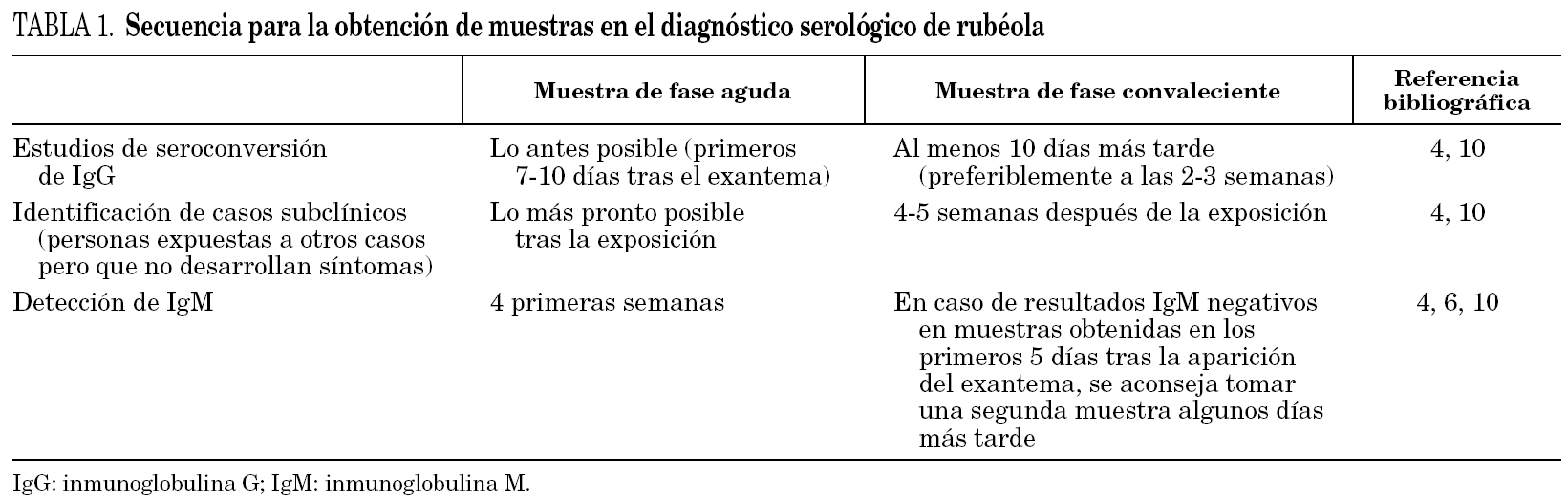
El diagnóstico de laboratorio de la rubéola se basa en el uso de procedimientos directos (cultivo y pruebas para detección del genoma del virus) o indirectos (que determinan la respuesta serológica del huésped). Entre las líneas celulares aptas para el aislamiento del virus se incluyen células Vero, RK-13 y células de riñón de mono verde africano (estas últimas son las más recomendadas) 22. La baja sensibilidad del cultivo hace que este procedimiento sea poco adecuado. En la actualidad hay disponibles métodos de reacción en cadena de la polimerasa (PCR) por transcripción inversa (RT-PCR) 23 destinados a la amplificación del genoma vírico. Las muestras empleadas para la detección directa del virus son sangre, orina, líquido cefalorraquídeo (casos de meningoencefalitis), exudados nasales y exudados faríngeos (esta última muestra es la que aporta mejor rendimiento) 4,24. En el diagnóstico de la infección fetal puede ser útil recurrir a la biopsia del trofoblasto 25. Aunque los métodos directos resultan muy específicos, su escasa disponibilidad clínica hace que en la práctica queden restringidos para el diagnóstico de la infección intrauterina y del SRC 25. Por todo esto, el diagnóstico de rutina continúa sustentándose en la serología. La inhibición de hemaglutinación ha sido una técnica clásica para el diagnóstico de rubéola. Otros procedimientos empleados son hemaglutinación pasiva, neutralización, hemólisis radial en gel, fijación de complemento, aglutinación de partículas de látex e inmunofluorescencia indirecta 22. Hoy en día, los métodos inmunoenzimáticos (análisis de inmunoabsorción ligado a enzimas [ELISA]) para detección de inmunoglobulinas (IgG e IgM) son los más empleados 10. La determinación de anticuerpos IgG se utiliza como marcador de exposición previa (asumiendo su positividad como sinónimo de inmunidad). En España, desde hace varios años, se realiza un control de IgG durante el embarazo recomendándose la vacunación posparto de las mujeres seronegativas 26. El diagnóstico serológico de la infección se basa en la detección de IgM, la seroconversión de IgG (cambio de negativo en una muestra de fase aguda a positivo en una muestra de fase convaleciente) o el serorrefuerzo de IgG (aumento al menos cuatro veces el título en la segunda muestra en un estudio en paralelo con la primera) 27. Para agilizarlo es preferible recurrir a la detección de IgM específica. Tanto los ELISA de captura como los indirectos resultan adecuados para este propósito 28. Los anticuerpos IgM suelen ser detectables desde el tercer día y durante las 6 primeras semanas (pueden perdurar hasta 3 o incluso 12 meses) 4,10. En la tabla 1 se expone la secuencia recomendada para obtención de muestras en el diagnóstico serológico de rubéola. Hay que tener presente que el valor predictivo positivo de la detección de IgM declina a medida que la incidencia de enfermedad disminuye 29. Los falsos positivos de IgM pueden ocurrir en casos de infección por otros virus como parvovirus B19 y especialmente virus del grupo herpes 4,10,27. Concretamente, en infecciones por virus Epstein Barr, pueden darse falsos positivos como consecuencia de estimulaciones policlonales de linfocitos B 30,31. Además, una proporción variable de la población puede mantener niveles detectables de IgM años después de la infección 29. Este hecho resulta especialmente crítico en el caso de las gestantes, en las que un diagnóstico erróneo puede abocar a un aborto terapéutico. Por este motivo no está indicada la investigación de IgM específica en la embarazada sana y sin antecedentes de contacto con algún caso de rubéola 26,29. Como complemento para el diagnóstico serológico de la infección puede recurrirse a la detección de avidez de IgG 32-34. Este procedimiento se basa en la distinta fuerza o afinidad que existe en la unión entre antígeno y anticuerpo 35. En la primoinfección predomina la IgG de baja avidez, mientras que en la infección antigua y en la reinfección (natural o por la vacunación) prevalece la IgG de alta avidez. Los métodos de ELISA para determinar la avidez de IgG, emplean sustancias desnaturalizantes, como la urea, que interfieren en la unión antígeno-anticuerpo. Para aplicar estas técnicas es imprescindible que la muestra contenga anticuerpos IgG específicos. Por otra parte, en caso de reinfección, la detección de IgM puede aportar resultados negativos 36. En estas situaciones la detección de IgG de alta avidez puede ser un complemento útil para el diagnóstico 18, después de evidenciar un aumento significativo en el título de anticuerpos, presencia de IgM específica o de ARN viral. Algunos estudios también apuntan a la posible utilidad de la detección de anticuerpos de la clase IgA 34,37.
El diagnóstico definitivo de la infección intrauterina debe confirmarse por métodos directos (cultivo o RT-PCR) 25. El diagnóstico en el recién nacido puede realizarse mediante detección de IgM en sangre de cordón umbilical o a través de la identificación del virus o su genoma en muestras de exudado nasofaríngeo, sangre u orina 4,10. Aproximadamente el 20% de los niños infectados intraútero pueden presentar resultados negativos para IgM durante el primer mes de vida 4. Estos niños, con sospecha de SRC y resultado IgM negativo, deben ser sometidos con posterioridad a nuevas determinaciones serológicas. Otra prueba de infección intrauterina es la persistencia de títulos elevados de IgG durante más tiempo del asumible por la transferencia pasiva materna (títulos de IgG que no decaen a un ritmo de una dilución doble por mes) 4. En niños con SRC deben obtenerse durante el primer año de vida resultados negativos para detección directa del virus en al menos dos muestras, tomadas en un intervalo de un mes, antes de considerarlos no infectivos 10.
Clínica y clasificación de casos de rubéola
El período de incubación de la rubéola es de aproximadamente de 2 a 3 semanas 5. El momento de mayor infectividad coincide con el inicio del exantema, pero el riesgo de contagio puede abarcar desde una semana antes hasta una semana después de la erupción 4. En esta infección, la proporción de casos subclínicos puede llegar a ser de hasta el 20-50% 4,10. Según los CDC 4,10 un caso puede definirse clínicamente como rubéola si se trata de un exantema maculopapular generalizado con febrícula igual o superior a 37,2 °C y se acompaña de alguno de estos tres síntomas o signos: artralgias/artritis, linfadenopatías y/o conjuntivitis. La OMS admite como caso clínico de rubéola a todo paciente (de cualquier edad) con exantema maculopapular y fiebre y que además presenta artralgia/artritis y/o adenopatías retroauriculares, suboccipitales o cervicales 6. En cualquier caso, estos signos y síntomas resultan muy similares a los de otros cuadros causados por agentes como parvovirus B19, adenovirus y enterovirus 10. Así pues, dada la inespecificidad de la clínica se aconseja realizar una confirmación de laboratorio de todos los casos sospechosos 10,29. Según la OMS se considera como confirmado por laboratorio todo caso sospechoso en el que se detecte IgM específica 6. Los criterios de confirmación de los CDC incluyen también el aislamiento del virus y la seroconversión o aumento significativo en el título de IgG 10,27. Recientemente se ha aceptado la amplificación genómica por RT-PCR como prueba diagnóstica 4. En la tabla 2 se expone la clasificación de los casos de rubéola según el grado de certeza.
El SRC puede afectar hasta el 90% de los niños nacidos de madres infectadas en las primeras 11 semanas de gestación 4. La tasa de SRC en las infecciones ocurridas hasta la semana 20 es del 20% 4. La clasificación de casos de SRC según la OMS y los CDC se expone en la tabla 3. En algunos pacientes con SRC la excreción del virus en orina y secreciones respiratorias puede persistir hasta un año o más. Por ello estos niños deben considerarse, al menos durante el primer año de vida, potencialmente infectivos 10. Una secuela tardía pero común del SRC es el desarrollo de diabetes insulinodependiente 5.
Aunque raras, son posibles las reinfecciones (suelen ser asintomáticas) 36,38. Si bien en estas situaciones se han comunicado casos de transmisión fetal 25,39, el riesgo de SRC que se deriva de ellas parece ser mínimo 10. De forma ocasional, pueden producirse reinfecciones sintomáticas en personas previamente vacunadas 18. Pese a que no existen evidencias que demuestren la afectación fetal tras la administración de la vacuna, la inmunización en la embarazada está desaconsejada 10,40. La vacunación durante el embarazo no se considera una indicación de aborto 40.
Vacunación y susceptibilidad poblacional en España
En 1978, y con el propósito de reducir el riesgo de SRC, se estableció en España una inmunización selectiva frente a rubéola en niñas adolescentes 11. La vacunación sistemática con triple vírica (sarampión, rubéola y parotiditis) fue introducida en 1981 con una dosis a los 12-15 meses. Entre 1988 y 1996 (según diferentes comunidades autónomas) se añadió, tanto en niñas como en niños, una segunda dosis a los 11 años 14,41 que en 1999 se adelantó a los cuatro 14,42. De acuerdo con los datos de la Comunidad de Madrid, en los años 1999-2000, la cobertura vacunal con una dosis de triple vírica superaba el 95% en la población de 2-15 años 43. La excelente cobertura conseguida en todo el territorio nacional 11, junto con la elevada inmunogenicidad de la cepa vacunal (cepa Wistar RA27/3) 44, comercializada por diferentes laboratorios, ha motivado un descenso importante en la incidencia de rubéola. Al principio de la década de 1980 esta incidencia era en España de 420 por 100.000 habitantes (161.000 casos) 45. Desde el comienzo de la década de 1990 hasta los primeros años de este siglo, se ha pasado de más de 2.000 casos a menos de 200 46. En 2003, año en el que se registró un brote de rubéola en la Comunidad de Madrid 47,48, la incidencia notificada en el ámbito nacional fue de 0,29 por 100.000 (115 casos) 45. En la actualidad se estima que parvovirus B19, herpes 6, enterovirus y adenovirus superan con creces a los virus de sarampión y rubéola como agentes etiológicos de exantema maculopapular entre menores de 15 años 46. Igualmente y como consecuencia de lo anterior, la aparición de casos de SRC en nuestro medio es un fenómeno excepcional 25.
Hasta hace poco tiempo, la mayor bolsa de susceptibles frente a rubéola se limitaba a una fracción reducida y muy concreta de la población española: varones jóvenes, nacidos después de que la circulación del virus salvaje había comenzado a disminuir y que, por su edad, no se beneficiaron de la administración de la vacuna 49, lo que motivó que se produjeran brotes fundamentalmente en adolescentes varones y jóvenes adultos 50. Según la última Encuesta Nacional de Serovigilancia (realizada en 1996) la menor prevalencia de anticuerpos frente a rubéola (93,8%) se detectaba en la cohorte de nacidos entre 1977 y 1981, debido fundamentalmente a la menor seroprevalencia en varones 11,45. En esta encuesta, la mayor prevalencia en mujeres se daba en las nacidas entre 1967 y 1986 (relacionada con la vacunación de niñas a los 11 años instaurada en 1978) 11,45. En 1999-2000 la seroprevalencia frente a rubéola en varones de entre 16 y 20 años residentes en la Comunidad de Madrid se situaba en el 93,1%, mientras que en mujeres de la misma edad se elevaba casi al 99% 43. Debido al efecto de inmunidad de grupo, este grado de prevalencia podía resultar suficiente para controlar circulación del virus (aun entre los sectores más susceptibles). No obstante, en los últimos años estamos asistiendo a importantes cambios en los patrones de susceptibilidad. Estos cambios vienen motivados por la nueva situación demográfica derivada de los procesos de inmigración. Muchas personas que acuden a nuestro país provienen de lugares donde no se vacuna o no se ha vacunado hasta hace poco tiempo frente a la rubéola. Como resultado puede surgir una acumulación de susceptibles que permita de nuevo (aunque en menor medida que en la época prevacunal) la circulación del virus. Una vez que esto ocurra, cualquier persona no inmune (independientemente de su edad, sexo y procedencia) podría contraer la infección.
Situación en otros países
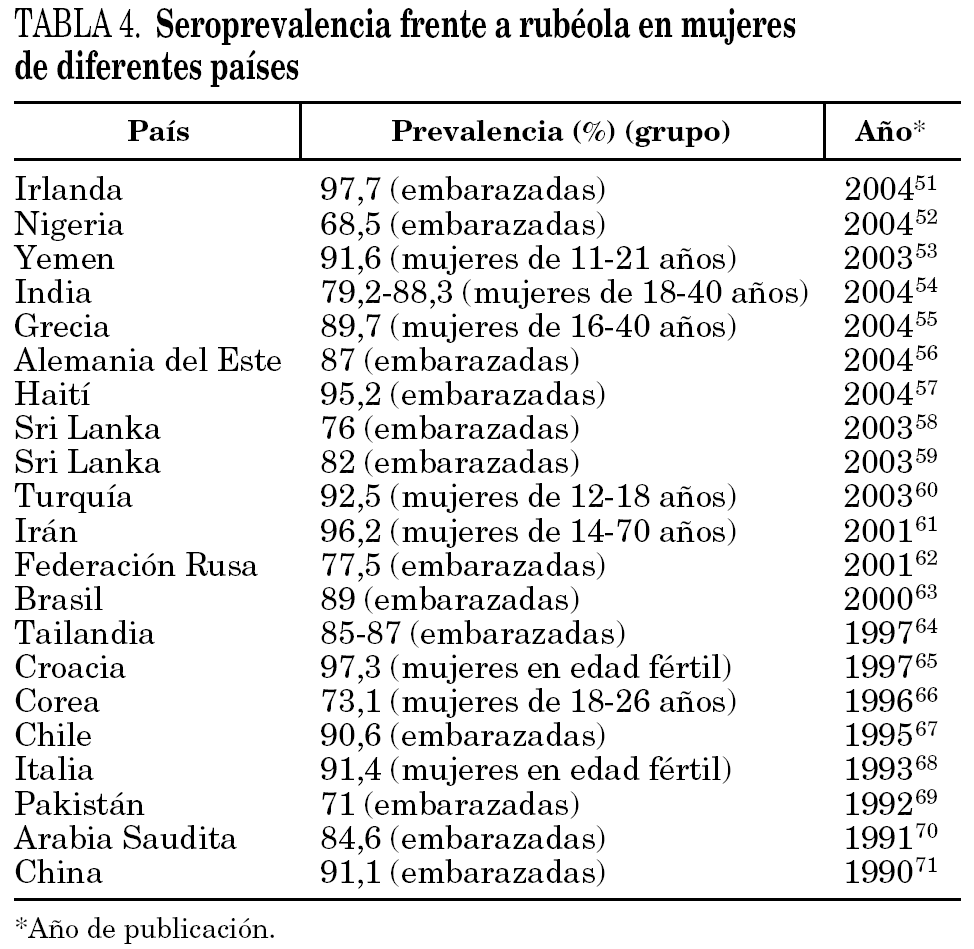
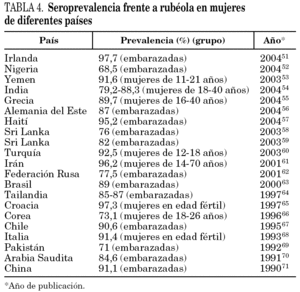
La seroprevalencia frente a rubéola informada en otros lugares del mundo depende de factores tales como el grupo de población analizado, el tipo de vacunación (generalizada o no), la circulación natural del virus, el año del estudio, la técnica serológica empleada y el tamaño muestral (tabla 4) 51-71.
La vacuna combinada sarampión-rubéola resulta cuatro veces más cara respecto a la vacuna simple frente a sarampión. En el caso de la triple vírica (que incluye parotiditis) el precio se multiplica por 10 16. Esto hace que las coberturas de inmunización activa frente a rubéola en diferentes naciones estén inversamente relacionadas con su nivel socioeconómico 6,15,16. Existen diversas estrategias para la prevención del SRC que dependen de la situación concreta de cada país y de los recursos económicos para afrontarla 26,63,68,69,72-75 (tabla 5). En algunos lugares donde se ha optado recientemente por la instauración de una vacunación específica de las adolescentes y mujeres en edad fértil se podrá proteger de manera individual a las vacunadas, pero no se evitará la circulación del virus. En los países que han adoptado una política de vacunación exclusivamente infantil podrán seguir surgiendo, durante varios años (hasta que las cohortes inmunizadas en la niñez alcancen la edad fértil), casos de rubéola y, por consiguiente, de SRC 15. Algo todavía más preocupante es que una estrategia de vacunación infantil, que sólo alcance una cobertura intermedia puede dar lugar a un retraso en la edad de aparición de los nuevos casos 15,16. Se ha calculado que una cobertura vacunal inferior al 80% en niños puede incrementar a la larga la incidencia de SRC 6.
La OMS establece tres categorías de riesgo para el SRC: países con tasas elevadas de susceptibilidad (> 25%), con tasas moderadas (10-25%) y con tasas relativamente bajas (< 10%) 76. Un elemento importante que hay que tener en cuenta es que la inmunidad conferida por la circulación natural del virus es variable en distintas áreas geográficas. Así, en algunos lugares que carecen de programas de vacunación, pero donde la mayoría de la población contrae la infección en los primeros años de la vida, el número de susceptibles puede ser comparable al de las naciones desarrolladas 76. Los datos relativos a la incidencia de rubéola en África son escasos. En ciertas regiones, más del 80% de los niños pueden haberse infectado antes de los 10 años 77. En algunos países subsaharianos las cifras de SRC llegan a ser de hasta 0,8 por cada 1.000 nacidos vivos 6. En algunas zonas de Marruecos las altas tasas de SRC indican que el virus circula en esa región 78.
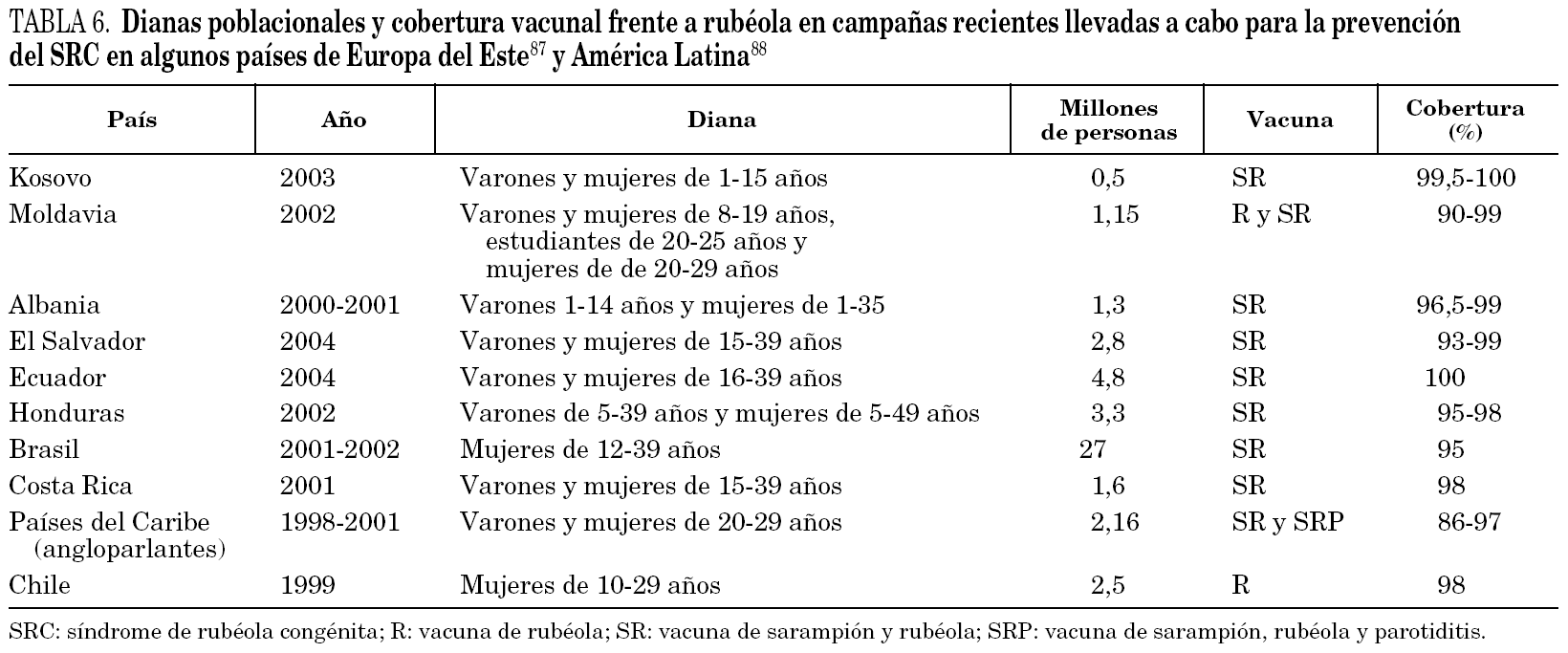
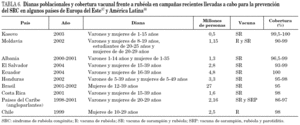
A diferencia de lo acontecido con el sarampión, el virus de la rubéola no se puede considerar totalmente controlado en Europa 79. La cobertura vacunal frente a rubéola en Europa occidental oscila desde el 60% en Italia al 98% en Finlandia) 80. Estas diferencias se reflejan en la incidencia de la enfermedad. Mientras que en países nórdicos como Dinamarca o Finlandia 81,82 apenas hay casos, en otros como Italia han surgido brotes que han originado el nacimiento de niños con SRC 38. Recientemente, se ha informado de la aparición de un brote en Holanda que se inició en septiembre de 2004 83 y que se exportó a Canadá 84. En otros brotes recientes 55 se ha podido comprobar la circulación de una misma cepa común en varias naciones 85. Un hecho muy alarmante es que, en el año 2000, algunos países del este del continente como Polonia, Rumanía, la Federación Rusa, y varias repúblicas ex soviéticas todavía no disponían de programas nacionales de vacunación frente a rubéola (estos países vacunaban exclusivamente contra sarampión) 80. Aunque algunos países como Rumanía habían establecido campañas concretas de vacunación en mujeres, la mayoría de los casos de rubéola en Europa durante 2000 fueron notificados en países del centro y este del continente y en las nuevas repúblicas ex soviéticas 6. En el año 2002 Polonia experimentó un total de 40.518 casos 86. En 2003 se declararon en Europa 304.320 casos, de los cuales el 41 y el 40% ocurrieron, respectivamente, en la Federación Rusa y en Rumanía 87. Como consecuencia de esta situación, en el año 2004 el 90% de los países de la región ya vacunaron sistemáticamente contra la rubéola 87. En la tabla 6 se exponen las dianas poblacionales y la cobertura vacunal frente a rubéola en campañas recientes llevadas a cabo para la prevención del SRC en algunos países de Europa del Este 87.
En América Latina la rubéola ha supuesto en los últimos años un serio problema de salud pública 88. En 1997 se produjeron al menos 126.000 casos 6 y se calcula que pudieron nacer miles de niños con SRC 89. En estos países, la vacuna de la rubéola fue introducida en el final de la década de 1990 90 (hasta entonces se inmunizaba sólo frente a sarampión) y, por consiguiente, los adultos jóvenes no están vacunados. Además, parece que en la década de 1980 la circulación natural del virus fue escasa en esta zona 88. Esto redujo la posibilidad de inmunización natural durante la infancia de las personas que ahora están en edad reproductiva. Fue a partir de los primeros años de la década de 1990 cuando se incrementó el número de casos de rubéola. Hasta finales de la pasada década y comienzos de la actual, sólo algunos estados habían adoptado medidas específicas para el control del SRC 88. El resto sólo contaba con programas rutinarios de vacunación en niños. Las estrategias de vacunación en América para la prevención del SRC difieren según los países. Recientemente se han llevado a cabo campañas masivas de inmunización de adultos en Honduras, El Salvador, Costa Rica, Ecuador, Chile y Brasil (en estos dos últimos países se optó por la vacunación sólo de mujeres) 88 (tabla 6). En el año 2004 la vacunación se generalizó en el continente americano 91.
A pesar de los logros alcanzados, la situación de América Latina se ha exportado a otros países. Entre 1997 y 1999 más del 75% de los afectados en 14 de los 19 brotes registrados en Estados Unidos eran personas de origen latinoamericano 92 y la mayoría de los casos de SRC (81%) acontecieron en familias oriundas de América Latina 4,93. En algunos de estos brotes se produjo una transmisión secundaria a la comunidad autóctona 74. Además, la edad de aparición de los casos se ha retrasado. En 1999 el 74% de los afectados eran mayores de 20 años 19.
Rubéola en España, presente y futuro
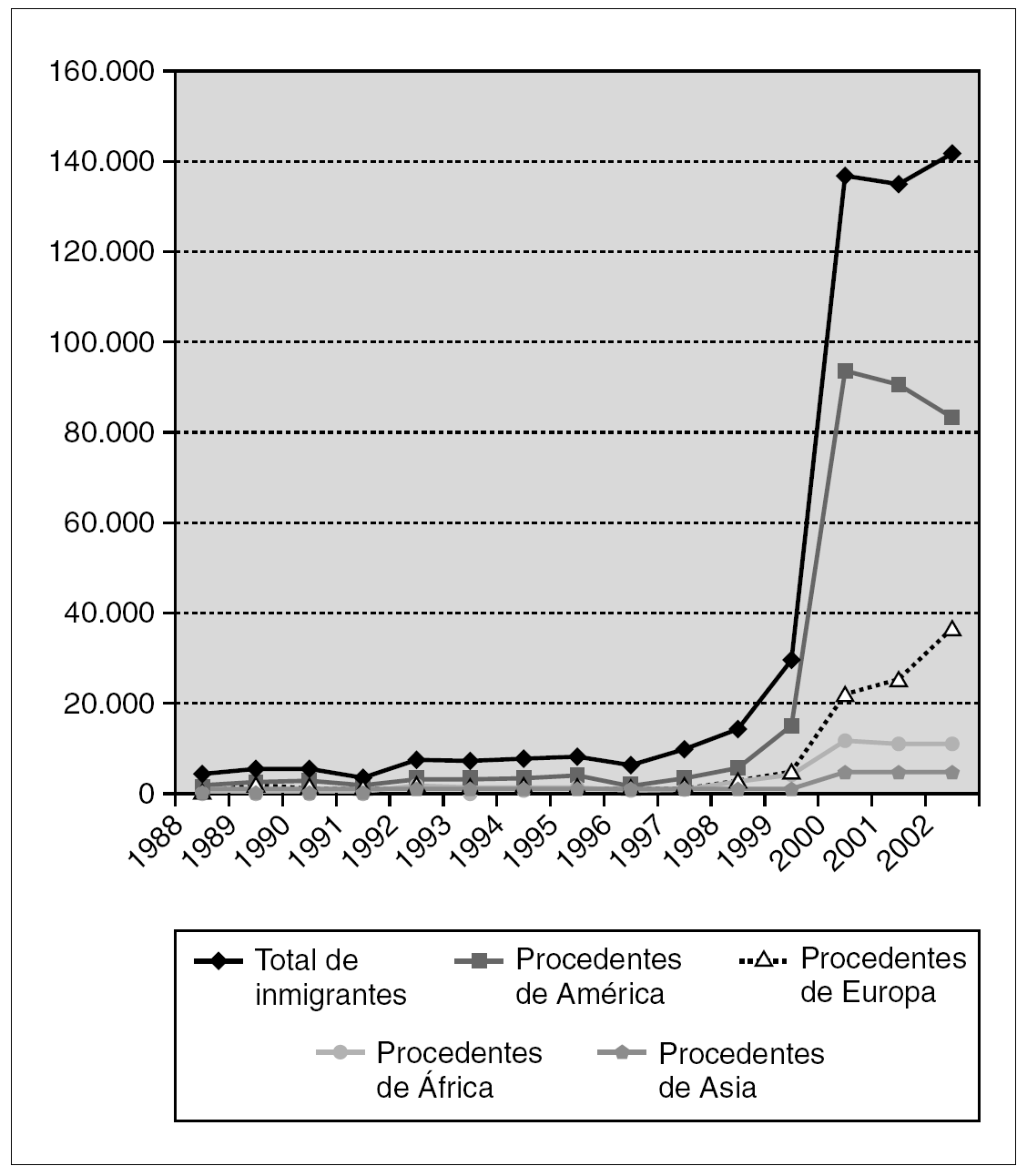
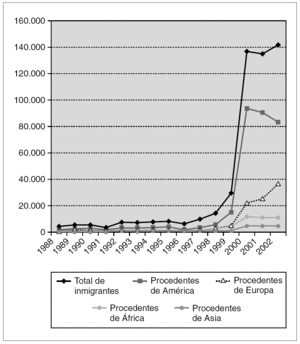
La experiencia de países que tradicionalmente han sido receptores de población foránea, como Estados Unidos y Reino Unido, advierte sobre la asociación entre rubéola e inmigración. Mientras que en el primero de estos dos países el mayor riesgo afecta a población hispana 19, en el segundo se centra en personas originarias de África, Asia y Oriente Próximo 20. En España la inmigración ha experimentado desde 1999 un crecimiento brusco y exponencial y es previsible que continúe aumentando. Las zonas que acogen el mayor flujo inmigratorio son Madrid, Cataluña, Baleares, Canarias y la costa mediterránea 94. Entre 1999 y 2003 el número de inmigrantes con destino a la Comunidad de Madrid ascendió a 572.026 personas (el 50,2% eran mujeres) 95. Un elevado número de inmigrantes adultos proviene de América Latina: a fecha 1 de enero de 2003, el 10,4% de la población de derecho en la Comunidad de Madrid era de origen extranjero y el 5,8% procedía de países de América Central y del Sur 95. La figura 1 ilustra la evolución de la inmigración en la Comunidad de Madrid entre los años 1988 y 2002 95. El fenómeno de la inmigración ha incidido a su vez en un incremento del índice de natalidad 94. Un reciente estudio llevado a cabo en la Comunidad de Madrid muestra que el nivel de susceptibilidad en las mujeres inmigrantes en edad fértil (la mayoría procedentes de América Latina) es del 11% 94. Esta cifra, de riesgo intermedio según la clasificación de la OMS, es sensiblemente más elevada que las detectadas en diferentes encuestas de población de origen español (entre el 0,5 y el 4,8%) 43,96-98. A la luz de estos datos hay que considerar la posibilidad de una reaparición de la rubéola en España. Entre febrero y marzo de 2003 se produjo un brote de rubéola en Madrid con 19 casos (14 confirmados por laboratorio) 47 que afectó en su mayoría a mujeres en edad fértil de origen latinoamericano 48. Situaciones similares son posibles y pueden extenderse también a otros grupos de población (personas del este de Europa, hombres jóvenes españoles). Las tasas de ataque entre adultos susceptibles expuestos al virus pueden llegar a ser del 52% 99.
Figura 1. Evolución de la inmigración en la Comunidad de Madrid (Años 1988-2002) 95.
El marcador de inmunidad es la detección de IgG sérica frente al virus 4, y deben considerarse susceptibles las personas con resultados serológicos equívocos 10. Dada la falta de especificidad de la clínica, el antecedente de haber pasado la rubéola en ausencia de confirmación por laboratorio no debe asumirse como una evidencia de protección 10. La única prueba aceptable de protección (además de la serología) es la acreditación por escrito de haber recibido al menos una dosis de vacuna 4 (en personas de América Latina y del Este de Europa hay que considerar que el antecedente de vacunación frente a sarampión no supone haber sido vacunado frente a rubéola) 6,80,88.
La solución definitiva al problema de la rubéola radica en la adopción de políticas de vacunación adaptadas a la nueva realidad epidemiológica. Hoy en día se recomienda ofertar la administración de una dosis de triple vírica a los adultos no vacunados o sin historia documentada de enfermedad previa, aprovechando los contactos con los servicios sanitarios 45. En las mujeres se aconseja revisar el estado de vacunación durante las visitas de rutina al ginecólogo o los centros de planificación familiar y ofertar la vacunación en los casos que sea preciso (después del parto o aborto en caso de constatar susceptibilidad). Así mismo, se propone realizar un esfuerzo para inmunizar a todos los adolescentes y mujeres procedentes de países donde la vacuna frente a rubéola tiene o tuvo un uso limitado 45. La captación de susceptibles a través de las consultas médicas de la red pública asistencial puede resultar sencilla, pero tiene como inconveniente que muchos sujetos adultos, jóvenes y sanos, en especial los varones, quizá tengan un escaso contacto con el sistema sanitario 4. Dado que los términos (joven, inmigrante) resultan en sí mismos ambiguos, se requieren nuevos y amplios estudios de seroprevalencia que definan claramente en nuestro medio grupos sociales de mayor riesgo.
La doble estrategia de continuar vacunando sistemáticamente a los niños (para mantener interrumpida la transmisión en el futuro) y a las mujeres en edad fértil que no acrediten estar protegidas (para evitar en el presente la aparición de SRC) se considera la mejor manera de controlar la enfermedad 14. Una actuación eficaz puede ser la implantación de calendarios de vacunación específicos en inmigrantes 12. Aunque, en general, el cribado serológico de IgG antirrubéola previo a la vacunación no se considera rentable 10, sí puede ser apropiado en el caso de población inmigrante 12. Por último, conviene reseñar la necesidad de realizar una vigilancia activa de la rubéola en todo el territorio nacional y su inclusión sistemática en el diagnóstico diferencial de laboratorio de las enfermedades exantemáticas en pacientes de todas las edades. Este último punto podría ser acometido de forma relativamente simple, y al igual que se ha hecho en otros lugares 100,101, aprovechando la logística de la red de laboratorios de referencia de las diferentes comunidades autónomas 28 para el Plan de Eliminación del Sarampión en España. La implantación de técnicas de tipado molecular permitirá ayudar, en el futuro inmediato, a desvelar algunos interrogantes sobre la epidemiología actual del virus de la rubéola en España.
Correspondencia: Dr. F. de Ory.
Servicio de Microbiología Diagnóstica.
Centro Nacional de Microbiología. Instituto de Salud Carlos III.
Ctra. de Majadahonda-Pozuelo, s/n. 28220 Majadahonda. Madrid. España.
Correo electrónico: fory@isciii.es
Manuscrito recibido el 27-5-2005; aceptado el 6-9-2005.