Staphylococcus saprophyticus es una causa frecuente de infecciones del tracto urinario en mujeres jóvenes, sexualmente activas1,2, por lo que es necesario conocer su epidemiología y sensibilidad antibiótica. También causa infecciones urinarias en niños y niñas3, hombres de todas las edades4 y mujeres posmenopáusicas5. Existen referencias bibliográficas de otras infecciones ajenas al tracto genitourinario, como endocarditis6, bacteriemia7 y endoftalmitis tras cirugía de cataratas8. Esta bacteria, cuyo mayor reservorio humano se localiza en el recto, la uretra y el cérvix9, está capacitada para mantener una adherencia selectiva al epitelio del tracto genitourinario2.
S.saprophyticuses sensible a los antibióticos frecuentemente prescritos para el tratamiento de las infecciones del tracto urinario (ITU) a excepción de ácido nalidíxico1 y fosfomicina10-12.
El objetivo de este estudio ha sido conocer la epidemiología e incidencia de la infección urinaria por S. saprophyticus en nuestra área sanitaria y las modificaciones en su sensibilidad antimicrobiana a lo largo de estos años.
MétodosSe ha realizado un estudio longitudinal, retrospectivo, de las cepas de S. saprophyticus aisladas durante 10 años (1997-2006) a partir de los urocultivos procesados en el Laboratorio de Microbiología del Centro de Especialidades Argüelles (Servicio de Microbiología, Hospital Universitario Puerta de Hierro), receptor de las muestras de atención primaria del área 6 de Madrid. Se utilizaron los criterios de “bacteriuria significativa” descritos por Kunin13. Se midió la leucocituria mediante el examen microscópico de la orina centrifugada; se consideró piuria más de 10 leucocitos/campo (×400)13. La identificación y las pruebas de sensibilidad se realizaron con el sistema semiautomático Pasco (Difco) (1997-1999) y Wider (Soria-Melguizo S.A.) (2000-2006). Se aplicaron los criterios de sensibilidad y resistencia recomendados por el Clinical and Laboratory Standards Institute (CLSI) para estafilococos14,15. Se han evaluado los siguientes antibióticos: gentamicina, vancomicina, rifampicina, cloranfenicol, cotrimoxazol, fosfomicina, ciprofloxacino/ levofloxacino, eritromicina, clindamicina, amoxicilina-ácido clavulánico y penicilina.
En las cepas resistentes a eritromicina se estudió el fenotipo de resistencia con discos de eritromicina (15 mg/l) y clindamicina (2 mg/l) colocados a 15-26 mm de distancia uno del otro15-17. Se identificó el fenotipo MLSB constitutivo cuando existía crecimiento alrededor de los discos de eritromicina y clindamicina; fenotipo MLSB inducible cuando había crecimiento alrededor del disco de eritromicina y aparecía una rectificación del halo de la clindamicina próxima al disco de eritromicina, y fenotipo MSB cuando existía resistencia a la eritromicina y sensibilidad a la clindamicina sin alteración de su halo.
Un total de 21 cepas resistentes a oxacilina (cantidad inhibitoria mínima [CIM] 0,5) aisladas durante 2003 y 2004 se enviaron al Laboratorio de Infección Nosocomial en el Centro Nacional de Microbiología del Instituto de Salud Carlos III (Madrid), para estudiar la presencia del gen mecA.
Los datos clínicos se tomaron de los volantes de petición que acompañaron a la muestra clínica (orina).
Para el estudio estadístico de los datos se aplicó la prueba de chi al cuadrado (2), con el programa estadístico Epi-Info versión 6.02, y se consideró significativa una diferencia entre los grupos cuando p < 0,05.
ResultadosDurante el período de estudio (1997-2006) se han procesado 283.488 urocultivos de pacientes de atención primaria, y se obtuvieron 35.136 urocultivos con recuento significativo (12,4%); de éstos, 28.647 (81,5%) pertenecían a mujeres. Se han aislado 331 cepas de S. saprophyticus (el 0,1% del total de urocultivos, el 0,9% del total de urocultivos positivos y 1,1% de los urocultivos positivos en mujeres de todas las edades); de estos 331 pacientes, 7 eran hombres (2,1%).
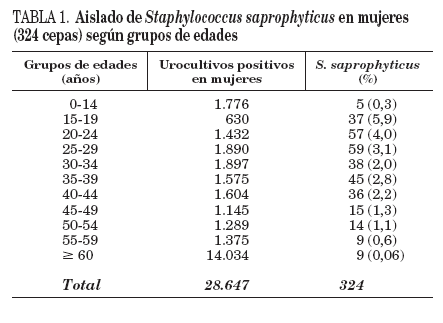
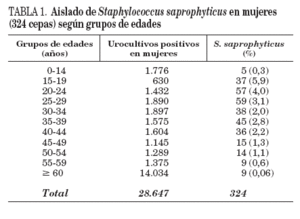
La edad media de las 324 mujeres infectadas fue 32,7 años (rango: de 8 a 85 años); 47 mujeres tenían más de 44 años (21%). Las niñas (0-14 años) representaron el 1,5% (5 pacientes) de los pacientes infectados con S. saprophyticus. El 83,9% (272) de las cepas de S. saprophyticus se aislaron en mujeres con edades comprendidas entre 15 y 44 años; en este grupo de edad, en el que se obtuvieron 9.028 urocultivos positivos, la incidencia de aislado de S. saprophyticus representó el 3%. La posibilidad de aislado de S. saprophyticus en urocultivos positivos femeninos ha sido inversamente proporcional a la edad de las pacientes, como se muestra en la tabla 1. Un total de 37 cepas (11,4%) se aislaron en mujeres gestantes. Siete mujeres estaban clínicamente diagnosticadas de pielonefritis aguda y 228 pacientes presentaron diagnóstico de cistitis y/o infección urinaria. En el resto de pacientes no constaban datos clínicos en el volante de petición. Todas las pacientes con aislado de S. saprophyticus mostraron piuria en el sedimento urinario.
TABLA 1. Aislado de Staphylococcus saprophyticus en mujeres (324 cepas) según grupos de edades
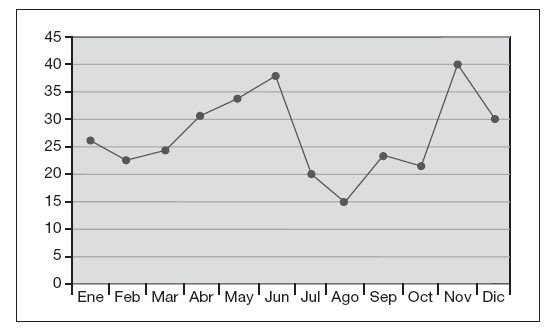
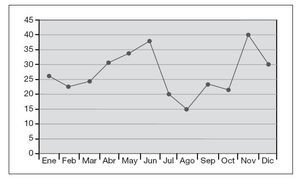
En la figura 1 se muestra la distribución anual de S. saprophyticus, y destaca el mayor número de aislados en primavera (31,5%) y otoño (28,4%).
Figura 1. Distribución anual de Staphylococcus saprophyticus, aislado en mujeres (1997-2006).
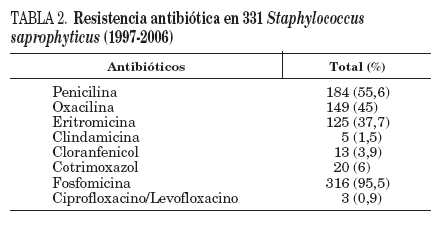
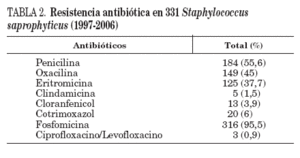
Los resultados de sensibilidad pueden observarse en la tabla 2. Todos los aislados fueron sensibles a gentamicina, rifampicina, vancomicina y amoxicilina-ácido clavulánico. Únicamente 15 cepas (4,5%) fueron sensibles a fosfomicina.
TABLA 2. Resistencia antibiótica en 331 Staphylococcus saprophyticus (1997-2006)
Un total de 125 cepas (37,7%) fueron resistentes a eritromicina, y cinco de ellas también lo fueron a clindamicina (1,5%). Estas cinco cepas se aislaron en el período 2004-2006. La resistencia a eritromicina ha ido aumentando paulatinamente a lo largo de estos años, y en 1997 fue el 25,8% y en 2006 el 48,2% (p de tendencia lineal < 0,05). De las 125 cepas resistentes a eritromicina, 120 (96%) mostraron un patrón de resistencia compatible con el fenotipo MSB y 5 con el fenotipo MLSB constitutivo. No se encontraron cepas con el fenotipo MLSB inducible.
En 20 cepas (6%) se detectó resistencia a cotrimoxazol; esta resistencia ha disminuido desde el 8,6% en el período 1997-2001 hasta el 4,6% en los últimos 5 años de estudio (p < 0,05). Siete cepas resistentes a cotrimoxazol también lo fueron a eritromicina (35%).
En 10 de las 13 cepas resistentes a cloranfenicol (3,9%) se asoció resistencia a eritromicina (76,9%).
Un total de tres S. saprophyticus no fueron sensibles a fluorquinolonas (0,9%). En un caso se mostró simultáneamente resistente a levofloxacino, eritromicina, cotrimoxazol y fosfomicina. La resistencia a penicilina alcanzó el 55,6%. Siguiendo los criterios del CLSI15, en 149 aislados de S. saprophyticus (45%) se obtuvo CIM a oxacilina 0,5 mg/l. Ninguna de las 21 cepas de S. saprophyticus examinadas en el Laboratorio de Infección Nosocomial era portadora del gen mecA.
DiscusiónS.saprophyticuses un patógeno habitualmente responsable de infecciones urinarias no complicadas (cistitis y pielonefritis) en mujeres jóvenes. La fuente de infección de la ITU por S. saprophyticus en mujeres es desconocida; sin embargo, se sabe que S. saprophyticus está muy distribuido en el ecosistema y, por tanto, es fácil la contaminación de una gran variedad de productos alimentarios y así se produce la colonización del tracto gastrointestinal18. La colonización rectal, vaginal y uretral por esta bacteria está asociada con la presencia de ITU19.
El aislado de S. saprophyticus en urocultivos positivos (0,9%) en nuestra serie es ligeramente superior al 0,5% obtenido recientemente en el norte de Israel20. Sin embargo, los porcentajes de aislado en mujeres de 15 a 44 años en nuestro estudio (3%) son inferiores a los datos aportados por otros autores1,5,18,19,21,22, cuyos trabajos se realizaron entre 1978 y 1994, con estudios prospectivos de infecciones urinarias en mujeres jóvenes (de 13 a 40 años), con signos y/o síntomas de ITU en EE.UU., Canadá, Australia, Inglaterra y Suecia, con tasas de aislado entre el 7 y el 42% dependiendo, fundamentalmente, de la edad de la población elegida y del número de relaciones sexuales. Estas diferencias en la incidencia podrían deberse a las propias diferencias en la técnica e interpretación del urocultivo utilizado por diversos autores. En nuestro caso no estudiamos una población homogénea, los urocultivos se prescriben según criterio del médico solicitante, recidivas y/o reinfecciones, características de la paciente, fracasos terapéuticos y otros.
La mayor tasa de aislado en nuestra serie se obtuvo en el segundo y cuarto trimestre del año (primavera y otoño, respectivamente), a diferencia de los datos aportados por otros autores1,5,19 con mayor número de aislados al final del verano y principios de otoño (septiembre y octubre). En los trabajos realizados en Israel20 y Australia22 no encontraron estacionalidad en el aislado de este patógeno urinario. No podemos proporcionar una explicación racional a las diferencias en la distribución anual de S. saprophyticus en nuestra área y necesitaremos realizar estudios prospectivos, no sólo en Madrid, sino en otras zonas de España, para conocer la epidemiología estacional de S. saprophyticus.
La edad media de nuestras pacientes infectadas (32,7 años) es superior a otros datos publicados5,20-28; probablemente, se deba a que, en nuestro país, cuanto mayor es la paciente, mayor número de ITU ha padecido y, por tanto, se realiza urocultivo con más frecuencia.
Existen pocos estudios de resistencia antimicrobiana en S.saprophyticus, incluso se recomienda no realizar antibiograma, ya que son bacterias consideradas sensibles a los antibióticos utilizados en el tratamiento de las ITU15. Al igual que los datos obtenidos tras las revisiones bibliográficas, no hemos encontrado cepas resistentes a gentamicina, rifampicina, amoxicilina-ácido clavulánico y vancomicinina11,12,24-27. La resistencia a cloranfenicol es escasa (3,9%) y semejante a la descrita por Alós et al11 en 1997 (2,8%), pero sorprendente, ya que es un antibiótico prácticamente eliminado de la farmacopea y, además, en nuestras cepas, su resistencia se asocia con elevada frecuencia a la resistencia a eritromicina, hecho que no hemos visto reflejado en otras publicaciones. La resistencia a eritromicina (37,7%) ha ido aumentando a lo largo de estos 10 años hasta llegar al 48,2% en 2006, mientras que los datos obtenidos de las revisiones bibliográficas11,24-28 mantienen la resistencia a eritromicina por debajo del 27%, con la salvedad de que todas las cepas estudiadas en estos trabajos se aislaron antes de 1999. La resistencia a clindamicina es muy baja (1,5%) y semejante a la obtenida en otras publicaciones11,24,26,27. La resistencia de los estafilococos a estos antibióticos se debe principalmente a dos mecanismos: bombas de expulsión activa del antibiótico y modificación del punto de unión del antibiótico al ribosoma bacteriano por metilación. Las bombas de expulsión son específicas para macrólidos de 14 y 15 átomos y estreptograminas tipo B. La clindamicina y los macrólidos de 16 átomos no son sustrato de expulsión por estas bombas. Éste es el llamado fenotipo MSB y está codificado por el gen msrA29.
El tratamiento de las ITU no complicadas se realiza habitualmente con fosfomicina trometamol, fluorquinolonas o betalactámicos; no se recomienda cotrimoxazol como terapia empírica debido al elevado porcentaje de resistencia (20-35%) que presentan los uropatógenos más frecuentes en estos procesos30,31. Se considera que la existencia de tasas de resistencia mayores del 10% y hasta el 20% limitan la elección de un antibiótico de forma empírica32. S. saprophyticus se define en la literatura científica como “habitualmente sensible a todos los antibióticos utilizados en el tratamiento de las infecciones urinarias no complicadas”. Sin embargo, esta afirmación tiene varias puntualizaciones. Primero, fosfomicina trometamol, un antibiótico ampliamente usado en el tratamiento de la ITU no complicada, no es eficaz in vitro y probablemente tampoco in vivo, a pesar de las elevadas concentraciones alcanzadas en orina, y deriva, posiblemente, a fracaso terapéutico y recidivas. Segundo, la utilización del punto de corte de los estafilococos coagulasa negativos para oxacilina (CIM 0,5 mg/l) hace que más de la mitad de las cepas aisladas de S. saprophyticus sean consideradas resistentes a los betalactámicos, antibióticos muy utilizados (sobre todo amoxicilina-ácido clavulánico, cefuroxima axetil y cefadroxilo) en el tratamiento de las ITU de pacientes ambulatorios. Esta situación se complica en las pacientes gestantes, tanto con infección urinaria como bacteriuria asintomática, y en quienes no pueden utilizarse antibióticos como cotrimoxazol o fluorquinolonas, ambos clasificados en el grupo C de la Food and Drug Administration (FDA); la fosfomicina no es eficaz in vitro, y tampoco podríamos utilizar betalactámicos en las pacientes en quienes se aísle S. saprophyticus con CMI 0,5 mg/l a oxacilina. Es en estas pacientes en quienes se plantearon los problemas en el tratamiento de ITU y bacteriurias asintomáticas producidas por cepas de S. saprofiticus resistentes a la oxacilina; una vez estudiados los antecedentes de cada paciente y de acuerdo con su médico, se pautó tratamiento con amo-xicilina-ácido clavulánico en siete gestantes con ITU que evolucionaron favorablemente y cuyos urocultivos de control resultaron negativos. Reiteradamente, el CLSI aplica a S. saprophyticus los criterios de resistencia a oxacilina de los estafilococos coagulasa negativos (SCN)15, a pesar de las escasas cepas de S. saprophyticus descritas en la literatura médica portadoras del gen mecA33-37, denegando la posibilidad de tratamiento con antibióticos betalactámicos en aquellos pacientes con CMI 0,5 mg/l a oxacilina. Recientemente, CLSI38 ha recomendado el uso de la difusión en agar con un disco de 30 mg/l de cefoxitina para detectar cepas resistentes a meticilina de SCN; un halo de inhibición 25 mm implicaría la ausencia del gen mecA. Sin embargo, la difusión con cefoxitina ha clasificado incorrectamente cepas de S. saprophyticus37,39. La medida de 19 mm de inhibición con el disco de cefoxitina (30 mg/l) sería una excelente opción para clasificar como sensibles a todos los S. saprophyticus negativos de mecA37. La escasa resistencia que hemos observado en las fluorquinolonas confirma lo encontrado en otros estudios26,27,40 a excepción de los datos aportados por Alós et al11 con cepas aisladas entre 1985 y 1995 y cuya sensibilidad a ciprofloxacino fue del 92,4%. Sin embargo, hay que tener presente que Staphylococcus spp. puede hacerse resistente a fluorquinolonas a los 3 o 4 días de tratamiento a pesar de ser inicialmente sensible15; por tanto, no parecen antibióticos de elección en las ITU causadas por este patógeno. Cotrimoxazol es un antibiótico con buena actividad en S.saprophyticus; la resistencia obtenida en nuestras cepas (6%) es ligeramente superior a otros datos publicados en los que oscila entre 0 y 3,5%11,12,21,24,26,28,40, pero con una disminución significativa (4,6%) en el período 2002-2006, consiguiéndose unos márgenes muy aceptables. Sus características farmacocinéticas y farmacodinámicas, así como su tolerancia, bajo coste y elevada concentración urinaria, hacen que sea una excelente opción de tratamiento en estas infecciones urinarias.
Existe un amplio consenso en realizar tratamiento empírico, sin urocultivo previo, en mujeres jóvenes con ITU no complicada41, ya que mayoritariamente Escherichia coli es el agente causal; sin embargo, hay que tener presente que en caso de fracaso terapéutico, hay que realizar urocultivo, tener en mente el S. saprophyticus como agente etiológico y considerar las opciones de tratamiento según los datos obtenidos en este trabajo.
El conocimiento periódico y actualizado de los patrones de sensibilidad antimicrobiana de bacterias en procesos infecciosos de un área concreta ayuda en la elección de un tratamiento empírico eficaz, permite optimizar costes, evita la aparición de resistencias y contribuye, en definitiva, a hacer un uso más racional de los antibióticos.
Correspondencia: Dra. B. Orden-Martínez. Servicio de Microbiología. Hospital Universitario Puerta de Hierro. Centro de Especialidades Argüelles. Quintana, 11. 28008 Madrid. España. Correo electrónico: beatrizorden.m@gmail.com
Manuscrito recibido el 25-6-2007; aceptado el 15-11-2007.