Determinar la proporción de personas con infección por VIH o sida que se encontraban en seguimiento en la cohorte VACH en 2012 y que resultaron perdidas del mismo en 2013 y 2014, así como establecer las características sociodemográficas relacionadas con dicha pérdida.
MétodosConsideramos perdidos del seguimiento a los sujetos con menos de un registro de consulta por año analizado. Construimos modelos de regresión logística para la estimación de las razones de ventajas (odds ratio [OR]) y sus intervalos de confianza del 95% (IC del 95%) de las variables relacionadas con la pérdida de seguimiento.
ResultadosEl porcentaje global de pérdidas en seguimiento fue del 15,5% (IC del 95%: 14,9-16,1). Las variables asociadas con la pérdida de seguimiento fueron no recibir tratamiento antirretroviral (TAR) (OR: 1,948; IC del 95: 1,651-2,298), ser inmigrante (OR: 1,746; IC del 95: 1,494-2,040), el consumo de fármacos por vía intravenosa como mecanismo de transmisión del VIH (OR: 1,498; IC del 95: 1,312-1,711), encontrarse en situación de desempleo (OR: 1,331; IC del 95: 1,179-1,503), no tener pareja (OR: 1,948, IC del 95: 1,651-1,298), pertenecer a un estrato socioeconómico bajo (OR: 1,279; IC del 95: 1,143-1,431) y ser atendido en un hospital con menos de 1.000 pacientes en seguimiento (OR: 1,257; IC del 95%: 1,121-1,457), además de menor edad y menos tiempo de seguimiento en la cohorte.
ConclusionesEl 15,5% de los pacientes fueron perdidos del seguimiento en un periodo de 2años en la cohorte VACH. Ello se asoció a una serie de variables sociodemográficas y epidemiológicas, cuya identificación puede ser útil para diseñar iniciativas focalizadas sobre las poblaciones más susceptibles de abandonar los circuitos asistenciales y a orientar estrategias diseñadas a la consecución del objetivo 90-90-90.
To determine the proportion of people infected by HIV or AIDS under follow-up in the VACH Cohort in 2012 who were lost to follow-up from 2013 to 2014, and to establish the sociodemographic features relating to this loss.
MethodsWe considered subjects with less than one recorded consultation per year studied to be lost to follow-up. We built logistic regression models to calculate the odds ratios (OR) and their 95% confidence intervals (95% CI), of the variables relating to loss to follow-up.
ResultsThe overall percentage of losses to follow-up was 15.5% (95% CI 14.9-16-1). The variables associated with loss to follow up were: not receiving antiretroviral treatment (ART) (OR: 1.948, 95% CI: 1.651 -2.298), being an immigrant (OR: 1.746; 95%CI: 1.494-2.040), intravenous drug consumption being the mechanism for HIV transmission (OR: 1.498, 95% CI: 1.312-1.711), being unemployed (OR: 1.331; 95% CI: 1.179-1.503), being without a partner (OR: 1.948, 95% CI: 1.651-1.298), belonging to a low socioeconomic class (OR: 1.279; 95% CI: 1.143-1.431), and being attended in a hospital with fewer than 1000 patients under follow-up (OR: 1.257, 95% CI: 1.121-1.457), as well as being under age and having spent less time under follow-up in the Cohort.
Conclusions15.5% of the patients were lost to follow-up over a period of 2years in the VACH Cohort. This was associated with a series of sociodemographic and epidemiological variables that it might be useful to identify to design initiatives targeting the populations most likely to abandon the circuits of care, and guide strategies towards achieving Objective 90-90-90.
El tratamiento antirretroviral (TAR), mediante el bloqueo de la replicación vírica y secundariamente la reconstitución inmunitaria y la reducción de la actividad inflamatoria, impide la progresión de la infección por el VIH, disminuyendo marcadamente la incidencia de enfermedades oportunistas, de otras enfermedades y de la mortalidad1-3. Además, reduce la infectividad de los sujetos infectados, impidiendo en la práctica (en condiciones óptimas) la transmisión vertical y la ocurrida en las relaciones sexuales4-6, así como probablemente la asociada al uso de fármacos inyectadas7. El beneficio del TAR está demostrado en cualquier momento de la evolución de la infección y para el uso ininterrumpido del mismo2,8, lo que justifica la recomendación ya universal de tratar a todas las personas infectadas9,10. Además de este beneficio individual, y a favor de la reducción de la infectividad, hay modelos matemáticos que indican que el acceso ampliado al tratamiento podría contribuir a disminuir la incidencia de infección por VIH y a su eventual eliminación11-15, al tiempo que a reducir los costes financieros de la pandemia16,17. Por estos motivos, ONUSIDA ha respaldado formalmente el «tratamiento como prevención» y propuesto como estrategia global para el tratamiento del VIH, el denominado objetivo 90-90-9018.
El acceso al tratamiento del VIH es solo una parte del espectro continuo de la atención sociosanitaria, que constituye un proceso a largo plazo. Algunas personas no lo inician porque aún no han sido diagnosticadas. En otros casos se conoce el diagnóstico pero no se establece el contacto con ningún dispositivo asistencial. Por último, otras personas, tras una vinculación inicial, no son retenidas de forma permanente y se pierden del seguimiento.
Las pérdidas del seguimiento son uno de los puntos críticos a la hora de intentar alcanzar el objetivo 90-90-90. La información disponible acerca de este fenómeno es difícil de analizar ya que no existe un consenso sobre su definición ni en la metodología para su estimación.
La mayor parte de la información disponible procede de investigaciones sobre bases de datos clínicas. Se han comunicado porcentajes de pérdidas de seguimiento muy variables. En Estados Unidos y Canadá se ha situado entre el 22 y el 60%, dependiendo de las regiones analizadas19-22. En un estudio multinacional, la proporción de personas con infección por VIH o sida (PIVS) perdidas del seguimiento varió entre el 54% observado en Georgia y el 19% de Dinamarca21. En España, otras 2grandes cohortes multicéntricas han comunicado sus datos. En la cohorte catalana PISCIS el 85% de los pacientes reclutados en 2010 tuvieron al menos una visita adicional, circunstancia definida por los investigadores como «en seguimiento regular» («retained in care»)23. En la cohorte CoRIS, el 19,8% de los pacientes no tuvieron ninguna visita en el último año de recogida de datos (octubre del 2008-octubre del 2009), por lo que fueron clasificados como perdidos de seguimiento. Los autores describen además algunos factores sociodemográficos asociados a dichas pérdidas24, análisis este que había sido inhabitual o limitado a etnia y género en los estudios previamente citados realizados en otros países25.
El objetivo principal del presente estudio es estimar la proporción de pérdidas de seguimiento e identificar las principales variables sociodemográficas relacionadas en los pacientes de la cohorte española VACH (acrónimo de VIH y AdvanCedHIV, el nombre de la historia electrónica que comparten los hospitales que integran la cohorte), con datos procedentes de la práctica real, en un país con un sistema público de salud.
MétodosPoblación y diseño del estudioLa cohorte VACH está integrada por personas con infección confirmada por el VIH en seguimiento en 24 hospitales españoles. Los criterios de inclusión y la metodología de trabajo han sido descritos con anterioridad26. El protocolo del estudio fue aprobado por la comisión de investigación del hospital del investigador principal.
Sujetos de estudioLa población objeto del estudio son todos los sujetos mayores de 16 años de la cohorte VACH en seguimiento entre enero y diciembre del 2012 en los hospitales participantes.
Recogida de datosLos datos especificados en el estudio fueron recogidos mediante un cuaderno electrónico de recogida de datos (CERD). Los CERD encriptados fueron remitidos al centro coordinador de datos para su recepción en la base de datos central (base VACH). Se utilizaron controles de duplicados, controles de calidad y validación de los datos mediante algoritmos informáticos implementados en la base central.
Análisis estadísticoDenominamos la variable principal de resultado de este estudio «pérdida (o perdidos) del seguimiento», que definimos como la ausencia de (aquellos pacientes sin) al menos un registro de visita de revisión en el periodo analizado (2013-2014).
Establecimos esta definición de pérdida en seguimiento basándonos en la frecuencia de visitas a consultas que se aconsejan en las guías de práctica clínica, en el consenso entre los investigadores del proyecto con amplia experiencia en el campo de la atención a la infección por el VIH y en la evidencia disponible27-29.
No consideramos pérdidas de seguimiento el ingreso en prisión, el fallecimiento, el cambio de hospital o de provincia de residencia o el ingreso en una comunidad terapéutica. No consideramos visitas de seguimiento las realizadas por los pacientes ambulatorios en otras especialidades, en los servicios de urgencias, farmacia, trabajador social u hospitalizaciones.
Recogimos la información sobre las siguientes variables explicativas: edad actual, sexo (hombre, mujer), mecanismo de transmisión (hombres que tienen sexo con hombres, transmisión heterosexual, usuario de fármacos por vía intravenosa, otras/desconocido), estrato socioeconómico (alto, medio, bajo, desconocido), nivel de estudios (superiores, medios, primarios, sin estudios, desconocido), situación laboral (activo, no trabaja, jubilado, pensión no contributiva, ama de casa, desconocido), antecedente de sida (sí, no), inmigrante (sí, no, desconocido), región de procedencia (España, África subsahariana, Magreb y Oriente Medio, Sudamérica y Caribe, Europa del Este, Europa occidental-Norteamérica y Australia, Asia, desconocida), pareja estable al ingreso en la cohorte (sí, no, desconocido), TAR en el momento de la pérdida en seguimiento (sí, no), nadir del recuento de linfocitos CD4+, duración del seguimiento previo y tipo de hospital definido con base en el número de pacientes incluidos en la cohorte (< 600, 600-1.000, >1.000).
Desarrollamos modelos de regresión logística para la estimación de las razones de ventajas (odds ratio [OR]) y sus intervalos de confianza del 95% (IC del 95%) de las variables relacionadas con la pérdida de seguimiento, mediante el procedimiento de eliminación por pasos condicional a partir del modelo total con las variables asociadas con la pérdida de seguimiento en el análisis bivariante (con una p <0,05).Utilizamos el programa SPSS (IBM SPSS Statistics for Windows, Version 19.0. IBM Corp., Armonk, NY, EE. UU.).
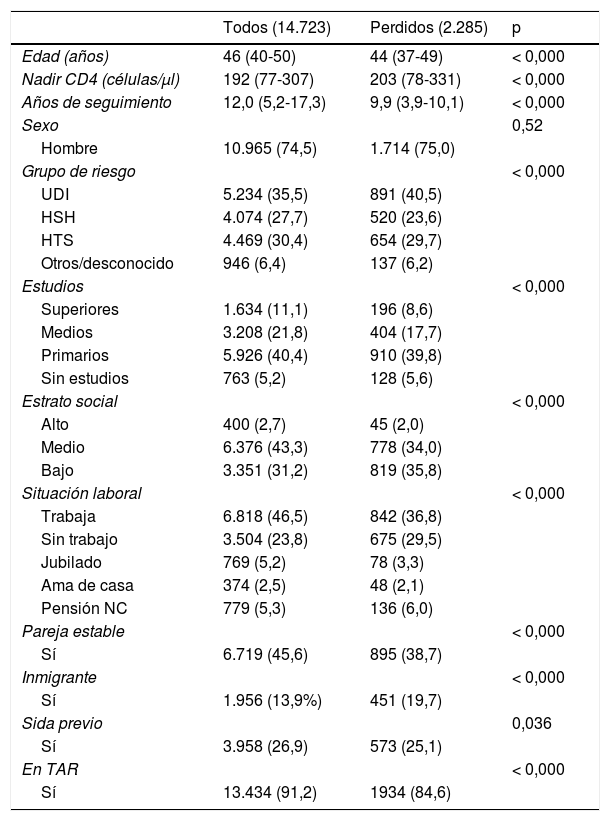
ResultadosEn el año 2012, el total de PIVS en seguimiento en la cohorte VACH era de 16.440. Excluimos del análisis a 1.717 (10,4%), de quienes no disponíamos de información actualizada sobre las variables objeto del estudio. Analizamos, por tanto, los datos de 14.723 PIVS que tenían una mediana de edad de 46 años (cuartiles: 39-50) y de quienes el 25,5% eran mujeres y el 86,1% eran de origen español; las principales características sociodemográficas de la población analizada se resumen en la tabla 1. Diez mil ochocientos cuarenta y siete pacientes (73,7%) eran nacidos españoles, 487 (3,3%) procedían de África subsahariana, 83 (0,6%) del Magreb u Oriente Medio, 954 (6,5%) de América Central, Sudamérica o el Caribe, 128 (8,7%) de Europa oriental, 268 (1,8%) de Europa occidental, Norteamérica o Australia, 15 (0,1%) de Asia y de 1.941 (13,2%) no estaba registrado el país de origen.
Características clínicas y sociodemográficas principales de todos los pacientes en seguimiento en la cohorte VACH en 2012 y de los perdidos durante 2013-2014
| Todos (14.723) | Perdidos (2.285) | p | |
|---|---|---|---|
| Edad (años) | 46 (40-50) | 44 (37-49) | < 0,000 |
| Nadir CD4 (células/μl) | 192 (77-307) | 203 (78-331) | < 0,000 |
| Años de seguimiento | 12,0 (5,2-17,3) | 9,9 (3,9-10,1) | < 0,000 |
| Sexo | 0,52 | ||
| Hombre | 10.965 (74,5) | 1.714 (75,0) | |
| Grupo de riesgo | < 0,000 | ||
| UDI | 5.234 (35,5) | 891 (40,5) | |
| HSH | 4.074 (27,7) | 520 (23,6) | |
| HTS | 4.469 (30,4) | 654 (29,7) | |
| Otros/desconocido | 946 (6,4) | 137 (6,2) | |
| Estudios | < 0,000 | ||
| Superiores | 1.634 (11,1) | 196 (8,6) | |
| Medios | 3.208 (21,8) | 404 (17,7) | |
| Primarios | 5.926 (40,4) | 910 (39,8) | |
| Sin estudios | 763 (5,2) | 128 (5,6) | |
| Estrato social | < 0,000 | ||
| Alto | 400 (2,7) | 45 (2,0) | |
| Medio | 6.376 (43,3) | 778 (34,0) | |
| Bajo | 3.351 (31,2) | 819 (35,8) | |
| Situación laboral | < 0,000 | ||
| Trabaja | 6.818 (46,5) | 842 (36,8) | |
| Sin trabajo | 3.504 (23,8) | 675 (29,5) | |
| Jubilado | 769 (5,2) | 78 (3,3) | |
| Ama de casa | 374 (2,5) | 48 (2,1) | |
| Pensión NC | 779 (5,3) | 136 (6,0) | |
| Pareja estable | < 0,000 | ||
| Sí | 6.719 (45,6) | 895 (38,7) | |
| Inmigrante | < 0,000 | ||
| Sí | 1.956 (13,9%) | 451 (19,7) | |
| Sida previo | 0,036 | ||
| Sí | 3.958 (26,9) | 573 (25,1) | |
| En TAR | < 0,000 | ||
| Sí | 13.434 (91,2) | 1934 (84,6) |
Todos los números son números absolutos y, entre paréntesis, porcentajes respecto al total de la columna, salvo para «Edad», «Nadir CD4» y « Años de seguimiento», que son medianas y, entre paréntesis, cuartiles 25 y 75. El valor de p se obtuvo mediante la prueba de Mann-Whitney para «Edad» y «Nadir CD4» y mediante la prueba de la χ2 para el resto de variables. La suma de las subcolumnas correspondientes a algunas variables no coincide con el total por faltar datos completos.
NC: no contributiva; HSH: relaciones sexuales entre varones; HTS: relaciones sexuales entre personas de diferente sexo; TAR: tratamiento antirretroviral; UDI: uso de fármacos por vía intravenosa.
Durante el periodo estudiado, 2.285 (15,5%, IC del 95%: 14,9-16,1) pacientes fueron perdidos del seguimiento. El porcentaje de pérdidas fue más elevado en los sujetos infectados a través del consumo de fármacos por vía intravenosa (17,0%, IC del 95%: 16,3-18,1), en las personas sin estudios (23,4%, IC del 95%: 20,5-23,4), en los pertenecientes a un estrato socioeconómico bajo (24,4%, IC del 95%: 23,0-25,9) y en aquellos en situación de desempleo (19,3%, IC del 95%: 18,0-20,6) y sin pareja estable (17,5%, IC del 95%: 16,7-18,3). Las pérdidas en seguimiento fueron también más elevadas en los inmigrantes infectados por el VIH que en los de origen español (el 23,1% frente al 13,5%), particularmente en las mujeres inmigrantes (el 17,7% frente al 25,4%). Exceptuando el grupo de 15 sujetos identificados como de origen «asiático», entre quienes no se registró ningún caso de pérdida de seguimiento (OR: 0,135; IC del 95%: 0,066-0,276), estas fueron significativamente más frecuentes en todos los demás grupos de pacientes definidos por su región de procedencia, por lo que, previa exclusión de los «asiáticos», agrupamos el resto como «inmigrantes» para el análisis multivariante. La proporción de pérdidas en seguimiento fue más elevada en pacientes que no recibían TAR (el 27,2% frente al 14,4%). No observamos diferencias entre los grupos definidos por el antecedente o no de sida previo. El porcentaje de perdidos de seguimiento fue mayor en los hospitales que aportan menos de 1.000 casos a la cohorte (el 16,8% en hospitales con <1.000 pacientes frente al 13,6%).
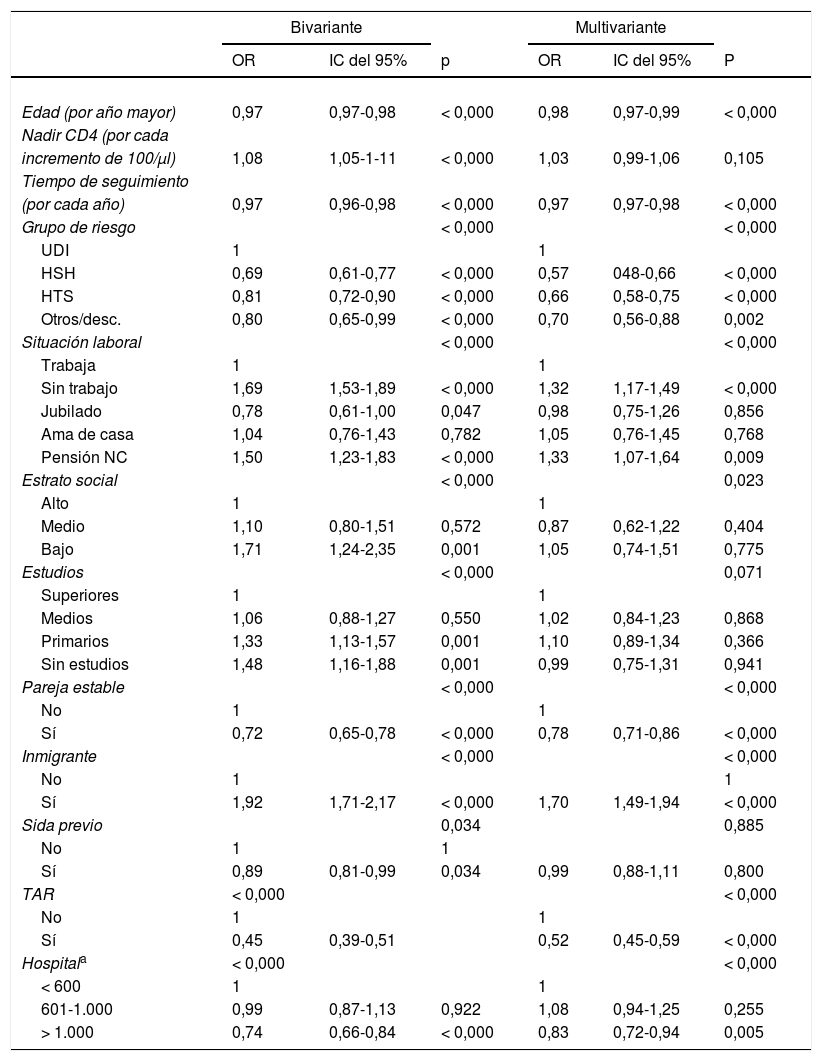
La tabla 2 muestra el modelo de regresión final con las variables sociodemográficas relacionadas con la pérdida de seguimiento. En dicho modelo la edad, el TAR, ser inmigrante, el grupo de riesgo para la adquisición del VIH, la situación laboral, no tener pareja, el estrato social, la clasificación del hospital según el número de pacientes en seguimiento y el tiempo de seguimiento en la cohorte anterior a 2012 mostraron estar asociados a la pérdida de seguimiento.
Factores de riesgo para ser perdidos del seguimiento durante 2013-2014, entre las características sociodemográficas y clínicas estudiadas en los pacientes en seguimiento en la cohorte VACH en 2012
| Bivariante | Multivariante | |||||
|---|---|---|---|---|---|---|
| OR | IC del 95% | p | OR | IC del 95% | P | |
| Edad (por año mayor) | 0,97 | 0,97-0,98 | < 0,000 | 0,98 | 0,97-0,99 | < 0,000 |
| Nadir CD4 (por cada | ||||||
| incremento de 100/μl) | 1,08 | 1,05-1-11 | < 0,000 | 1,03 | 0,99-1,06 | 0,105 |
| Tiempo de seguimiento | ||||||
| (por cada año) | 0,97 | 0,96-0,98 | < 0,000 | 0,97 | 0,97-0,98 | < 0,000 |
| Grupo de riesgo | < 0,000 | < 0,000 | ||||
| UDI | 1 | 1 | ||||
| HSH | 0,69 | 0,61-0,77 | < 0,000 | 0,57 | 048-0,66 | < 0,000 |
| HTS | 0,81 | 0,72-0,90 | < 0,000 | 0,66 | 0,58-0,75 | < 0,000 |
| Otros/desc. | 0,80 | 0,65-0,99 | < 0,000 | 0,70 | 0,56-0,88 | 0,002 |
| Situación laboral | < 0,000 | < 0,000 | ||||
| Trabaja | 1 | 1 | ||||
| Sin trabajo | 1,69 | 1,53-1,89 | < 0,000 | 1,32 | 1,17-1,49 | < 0,000 |
| Jubilado | 0,78 | 0,61-1,00 | 0,047 | 0,98 | 0,75-1,26 | 0,856 |
| Ama de casa | 1,04 | 0,76-1,43 | 0,782 | 1,05 | 0,76-1,45 | 0,768 |
| Pensión NC | 1,50 | 1,23-1,83 | < 0,000 | 1,33 | 1,07-1,64 | 0,009 |
| Estrato social | < 0,000 | 0,023 | ||||
| Alto | 1 | 1 | ||||
| Medio | 1,10 | 0,80-1,51 | 0,572 | 0,87 | 0,62-1,22 | 0,404 |
| Bajo | 1,71 | 1,24-2,35 | 0,001 | 1,05 | 0,74-1,51 | 0,775 |
| Estudios | < 0,000 | 0,071 | ||||
| Superiores | 1 | 1 | ||||
| Medios | 1,06 | 0,88-1,27 | 0,550 | 1,02 | 0,84-1,23 | 0,868 |
| Primarios | 1,33 | 1,13-1,57 | 0,001 | 1,10 | 0,89-1,34 | 0,366 |
| Sin estudios | 1,48 | 1,16-1,88 | 0,001 | 0,99 | 0,75-1,31 | 0,941 |
| Pareja estable | < 0,000 | < 0,000 | ||||
| No | 1 | 1 | ||||
| Sí | 0,72 | 0,65-0,78 | < 0,000 | 0,78 | 0,71-0,86 | < 0,000 |
| Inmigrante | < 0,000 | < 0,000 | ||||
| No | 1 | 1 | ||||
| Sí | 1,92 | 1,71-2,17 | < 0,000 | 1,70 | 1,49-1,94 | < 0,000 |
| Sida previo | 0,034 | 0,885 | ||||
| No | 1 | 1 | ||||
| Sí | 0,89 | 0,81-0,99 | 0,034 | 0,99 | 0,88-1,11 | 0,800 |
| TAR | < 0,000 | < 0,000 | ||||
| No | 1 | 1 | ||||
| Sí | 0,45 | 0,39-0,51 | 0,52 | 0,45-0,59 | < 0,000 | |
| Hospitala | < 0,000 | < 0,000 | ||||
| < 600 | 1 | 1 | ||||
| 601-1.000 | 0,99 | 0,87-1,13 | 0,922 | 1,08 | 0,94-1,25 | 0,255 |
| > 1.000 | 0,74 | 0,66-0,84 | < 0,000 | 0,83 | 0,72-0,94 | 0,005 |
Resultados de los modelos de regresión logística de la probabilidad de ser perdidos del seguimiento durante 2013-2014 sobre las características sociodemográficas y clínicas.
NC: no contributiva; HSH: relaciones sexuales entre varones; HTS: relaciones sexuales entre personas de diferente sexo; TAR: tratamiento antirretroviral; UDI: uso de fármacos por vía intravenosa.
El porcentaje de pérdidas de seguimiento en este estudio, en el que se incluyó a 14.723 PIVS en seguimiento durante el año 2012 en los hospitales españoles de la cohorte VACH, es inferior al comunicado en otros previos realizados en EE. UU., Canadá, Dinamarca o Australia19-22. En estos estudios, los autores consideraron perdidos de seguimiento a los pacientes con <2 determinaciones de linfocitos CD4 o carga viral del VIH, con intervalo> 3 meses en el año analizado. En nuestro trabajo, hemos considerado perdidas de seguimiento a las personas con <1 asistencia en consulta en el año analizado, en concordancia con el criterio usado en los estudios españoles citados anteriormente23,24. Los resultados de investigaciones recientes indican que revisiones analíticas más frecuentes pueden no ser necesarias para el buen control de la infección27,28, recomendación avalada en un reciente estudio observacional con datos de cohortes europeas y americanas29.Si hubiéramos utilizado como criterio de pérdida <2 visitas/año, el porcentaje de pérdidas hubiera sido del 24% (IC 23,3-24,8; datos no mostrados). El porcentaje de pérdidas de seguimiento es muy similar al 15% comunicado en otro estudio español realizado en Cataluña23 e inferior al registrado en CoRIS24. Aunque el criterio definitorio de «pérdida» elegido para nuestro estudio se aproxima más a los de los otros 2estudios españoles, sin una estandarización de la definición y de los métodos de registro es inapropiado aventurar explicaciones especulativas. Hay que tener en cuenta que las pérdidas de seguimiento se asocian a una adherencia subóptima, a menor probabilidad de tener una carga viral del VIH suprimida, a mayor riesgo de transmisión, a la aparición de resistencias a los fármacos y peores resultados de salud30-33.
Varios estudios previos han analizado el género y la raza o etnia, junto a otras variables como la edad o el tratamiento, con la retención en la asistencia sanitaria19,23,30,31. La inclusión de otras variables sociodemográficas anteriormente no analizadas, como el estrato social, el nivel de educación, la situación laboral o la pareja, son, en nuestra opinión, una de las fortalezas de este estudio. Esta información permitiría identificar poblaciones más vulnerables y que posiblemente tiene mayores barreras de accesibilidad al sistema sanitario.
En nuestro estudio, al contrario que en uno similar realizado en Holanda entre 2007 y 201332, las pérdidas en seguimiento fueron más elevadas en hospitales con menos de 1.000 pacientes en seguimiento (16,8% en hospitales con <1.000 pacientes vs. 13,6%, OR 1,257). Esto podría deberse a diferencias técnicas o estructurales relacionadas con el tamaño de los hospitales (diferente accesibilidad de especialistas y técnicos para asuntos psicosociales), factores socioeconómicos (migración interior a focos de mayor actividad económica en el contexto de la recesión económica) e incluso diferencias en el uso de la aplicación informática (en tiempo real o diferido).
Una limitación de nuestro estudio es la validez externa de los datos a la hora de generalizar los resultados a la población española infectada por el VIH. La cohorte VACH desde el año 2000 recluta de forma prospectiva a pacientes en seguimiento en 24 hospitales españoles con una amplia representación geográfica. En su conjunto, estos hospitales cubren la asistencia sanitaria especializada del 16% de la población, por lo que pensamos que los resultados del estudio pueden ser representativos a nivel general, teniendo en cuenta estas premisas. Respecto a la validez interna, como todos los estudios observacionales, puede verse comprometida por la calidad y el grado de cumplimentación de los datos recogidos.
En nuestra opinión, el conocimiento de la magnitud y de las características de la pérdida de seguimiento puede contribuir a conocer y monitorizar la situación de la epidemia de forma dinámica, y de esta manera ayudar a orientar una distribución más eficiente de los recursos destinados a prevención de las pérdidas y el cumplimiento del objetivo 90-90-90. La información generada también puede ser útil para determinar el impacto de las pérdidas de seguimiento, diseñar planes generales de mejora y planes focalizados sobre las poblaciones más vulnerables.
FinanciaciónEste estudio ha sido financiado por ViiV Healthcare.
Conflicto de interesesRamón Teira, Nuria Espinosa, M. Mar Gutiérrez, Marta Montero, Elisa Martínez, Francisco González, Fernando Lozano de León, Francisco Téllez, M. José Galindo, Joaquim Peraire, Elisabeth Deig y Pepa Muñoz-Sánchez declaran al menos uno de los siguientes conceptos: haber efectuado labores de consultoría, o haber participado de becas para investigación clínica, o haber recibido compensación económica por charlas, o haber colaborado en la elaboración de materiales educativos, o haber recibido becas de viaje para asistencia a congresos, de al menos uno de los siguientes: Bristol-Myers Squibb, Gilead Sciences, Janssen-Cilag, MSD, ViiV Healthcare o AbbVie.
Al Dr. Ignacio Suárez Lozano, inspirador y motor de este estudio y tantos otros en dos décadas de dirección del Grupo de Estudio VACH.
Belén de la Fuente y María Campoamor (Hospital de Cabueñes, Gijón), Pere Domingo y Teresa Puig (Hospital Arnau de Vilanova, Lleida), Esteban Ribera (Hospital Vall d́Hebron, Barcelona), Bernardino Roca (Hospital General, Castellón de la Plana), Josefina García (Hospital Santa Lucía, Cartagena), Manuel Castaño y M. Isabel Mayorga (Hospital Carlos Haya, Málaga), Alberto Terrón y Ángel Álvarez (Hospital de Jerez, Jerez de la Frontera), Ignacio Suárez-Lozano y Lola Merino (Complejo Hospitalario de Huelva), Paloma Geijo y Olga Belinchón (Hospital Virgen de la Luz, Cuenca), M. Antonia Sepúlveda (Hospital Virgen de la Salud, Toledo), Vicente Estrada (Hospital Clínico de San Carlos, Madrid), Agustín Muñoz-Sanz (Hospital Infanta Cristina, Badajoz), M. Gracia Mateo (Hospital Santa Creu i Sant Pau, Barcelona), Consuelo Viladés (Hospital Joan XXIII, Tarragona), Iván Castro (Hospital La Fe, Valencia), Luis López-Cortés (Hospital Virgen del Rocío, Sevilla), Fernando Mateos (Complejo Hospitalario, Albacete).