Recientemente hemos documentado un caso de paraparesia espástica tropical por HTLV-I en un paciente de nacionalidad española. Este retrovirus infrecuente en Europa rara vez produce sintomatología, pero cuando lo hace supone un grave problema sanitario. Aquí presentamos dicho caso y discutimos situaciones clínicas que justifiquen su detección. Se analizaron las peticiones de cribado de HTLV que recibimos durante 2014-2015 (n=123). El algoritmo diagnóstico fue: 1) Enzimoinmunoanálisis, 2) Hibridación reversa y 3) PCR de ADN proviral. Los resultados mostraron diversas situaciones de cribado de HTLV, destacando el estudio de paraparesia (22%). Se detectaron 7 casos de infección por HTLV-I: 5 pacientes de zona endémica, un paciente VIH+ y por último el caso de paraparesia mencionado. La vigilancia de HTLV-I en regiones no endémicas supone un reto sanitario al no estar bien establecido su balance coste-beneficio. Este caso apoya la inclusión de HTLV-I dentro del diagnóstico diferencial de paraparesia espástica de evolución insidiosa.
We have recently documented a case of tropical spastic paraparesis by HTLV-I in a Spanish patient. HTLV-I infection is rare in Europe, and hardly ever is accompanied by symptoms, but if it does it could trigger a major health issue. This case is presented here, as well as a discussion on the situations in which HTLV-I detection is justified. An analysis was made of the HTLV diagnostic requests at our centre during 2014-2015 (n=123). The diagnostic algorithm was: 1) Enzyme immunoassay, 2) Reverse hybridization, and 3) Proviral DNA detection by PCR. The results showed several situations of HTLV screening, emphasising those related to paraparesis (22%). Seven cases of HTLV-I infection were found: five in patients from endemic regions, one in an HIV-infected patient, and the case of TSP mentioned above. HTLV-I surveillance in non-endemic regions is a challenging issue, as the cost-benefit ratio is not well-established. This case report emphasises the importance of including HTLV within the differential diagnosis of insidious spastic paraparesis.
El virus linfotrópico de células T humanas (HTLV) pertenece a la familia Retroviridae e incluye 4 filogrupos (HTLV I/II/III/IV). Está presente en todo el mundo, siendo la prevalencia mayor (0,5 al 50%)1 en regiones endémicas como Japón, área del Caribe, África subsahariana, centro y sur de América. En Europa es muy infrecuente, observándose principalmente casos importados. En España, estudios realizados recientemente confirman la baja prevalencia, menor del 0,23% aún en grupos de riesgo2,3. Hasta diciembre de 2013 se describieron 258 casos de infección por HTLV-I y 769 casos por HTLV-II4. Ningún caso de HTLV-III o HTLV-IV ha sido reportado hasta la fecha. La transmisión de HTLV es generalmente por vía sexual, materna (durante la lactancia), a través de hemoderivados y órganos, y por consumo de drogas de administración parenteral, siendo este último mecanismo característico del HTLV-II5.
Las manifestaciones clínicas en la infección por HTLV son infrecuentes, siendo lo más habitual ser portador asintomático. Aun así, existen 2 etiologías incurables producidas por HTLV-I: la paraparesia espástica tropical (PET) o mielopatía asociada al HTLV-I, y la leucemia de células T del adulto. Ambas enfermedades suman una incidencia mundial del 5% entre los infectados6. En España, hasta diciembre de 2012 se comunicaron 27 casos de PET/mielopatía asociada al HTLV-I y 17 casos de leucemia de células T del adulto3.
En el presente trabajo exponemos un caso de PET diagnosticado en España, de origen no endémico, cuyo único factor de riesgo fue mantener relaciones sexuales con personas de zonas endémicas. Presentamos asimismo los resultados del cribado de HTLV-I/II en nuestro hospital durante el último año y discutimos los factores de riesgo asociados.
Material y métodosSe estudiaron todas las peticiones para cribado de HTLV entre enero de 2014 y marzo de 2015. La detección de anticuerpos IgG anti-HTLV-I/II se realizó mediante enzimoinmunoanálisis (EIA) en el sistema automático Architect (Abbott Laboratories, Abbott Park, IL, EE. UU.). Los resultados positivos se confirmaron por hibridación reversa (HR) mediante el test INNO-LIA™ HTLV-I/II Score (Fujirebio Europe, Gent, Bélgica). Por último, la PCR se realizó en el Instituto de Salud Carlos III de Madrid, por amplificación de la región pX del virus7,8.
También se obtuvieron datos epidemiológicos como edad, sexo y procedencia de los pacientes, coinfección por otros virus, servicio peticionario, diagnóstico de sospecha y otros datos clínicos de interés.
ResultadosCaso clínicoVarón de 34 años de nacionalidad española, ingresado para estudio de alteración de la marcha progresiva de 2 años de evolución. Como antecedentes destacaban mastocitosis sistémica diagnosticada a los 14 años, actualmente asintomática, parálisis facial periférica idiopática con recuperación incompleta 7 años antes y pancreatitis autoinmune grave 2 años y medio antes, que precisó cirugía y transfusión de 2 concentrados de hematíes. Al ingreso, la exploración neurológica demostró paraparesia espástica simétrica, con hiperreflexia en miembros inferiores y signo de Babinski bilateral. La sensibilidad superficial y profunda era normal. Presentaba urgencia miccional con ocasional incontinencia. La resonancia magnética medular no reveló anomalías. El análisis del líquido cefalorraquídeo mostró una ligera pleocitosis linfocitaria (5cél/mm3), con proteínas y glucosa normales. Los análisis de sangre fueron normales y las serologías para sífilis y VIH negativas. Los anticuerpos anti-HTLV-I/II (anti-HTLV) por EIA fueron positivos, confirmándose por HR (HTLV-I). El líquido cefalorraquídeo también resultó positivo para anti-HTLV-I. Se evidenció replicación vírica tanto en suero como en líquido cefalorraquídeo por PCR. El donante de la transfusión presentó serologías repetidamente negativas. El paciente no había realizado viajes fuera de España, pero había mantenido relaciones sexuales con al menos 2 varones de procedencia sudamericana, sin especificar el país de origen. Fue tratado con metilprednisolona durante 5 días sin mejoría clínica. Ha sido tratado con fisioterapia y toxina botulínica para la espasticidad, con mejoría parcial de la marcha.
CribadoDurante el periodo de estudio se recibieron 123 muestras para la detección de IgG anti-HTLV. El 60% correspondía a hombres y el 40% a mujeres, con una media de edad de 43,4 años. Los servicios peticionarios más frecuentes fueron enfermedades infecciosas (n=46; 37,4%), neurología (n=26; 21,1%), hematología (n=11; 8,9%) y medicina interna (n=9; 7,3%).
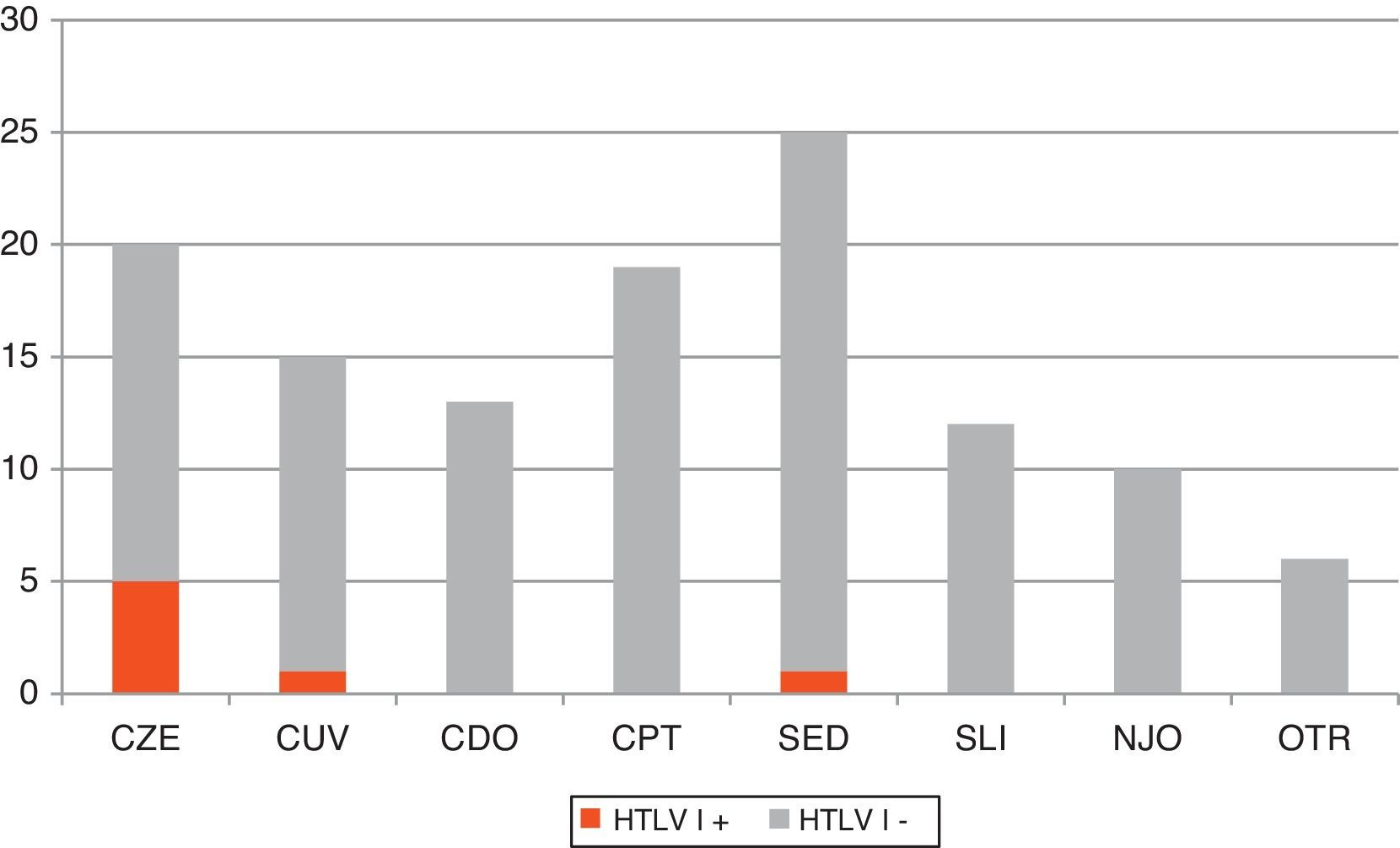
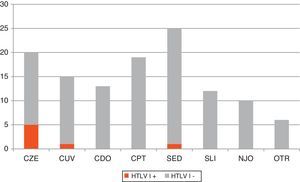
La figura 1 muestra los criterios clínicos y/o epidemiológicos seguidos para el cribado de HTLV-I/II. Del total de peticiones, el 8,1% (n=10) no cumplió ninguno de esos criterios, por lo que se consideraron peticiones no justificadas. Por otro lado, dentro de las peticiones justificadas los motivos más frecuentes fueron: estudio de paraparesia (n=25; 22,1%); cribado en paciente de zona endémica (n=20; 17,7%); cribado pre-trasplante (n=19; 16,8%); cribado en paciente UDPV y/o VIH+ (n=18; 15,9%); cribado en donante de órganos (n=13; 11,5%); sospecha de síndrome linfoproliferativo (n=12; 10,6%) y otros (n=6; 5,3%). En esta última categoría se incluyeron contextos clínicos que no justifican la sospecha de HTLV per se, pero que vienen acompañados de algún factor de riesgo.
Distribución de los distintos criterios clínicos y epidemiológicos que motivaron la realización de cribado de IgG anti-HTLV-I/II en nuestro centro. Se resaltan en color oscuro los casos HTLV-I positivos. CDO: cribado en donantes de órganos con factor de riesgo; CPT: cribado en pretrasplantados con factor de riesgo; CUV: cribado rutinario en UDPV y/o VIH+; CZE: cribado rutinario en pacientes de zona endémica; NJO: no justificado; OTR, otros; SED: sospecha de enfermedad desmielinizante; SLI: síndrome linfoproliferativo; UDVP: usuarios de drogas por vía parenteral.
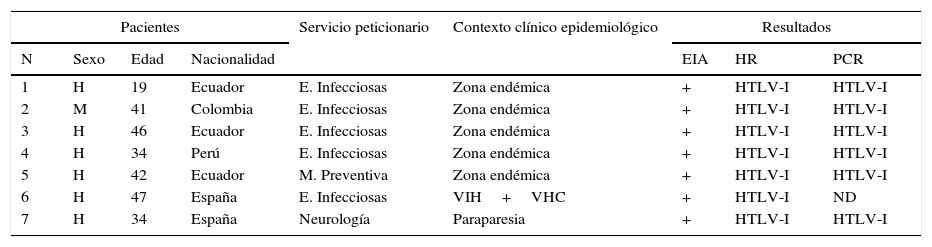
En total se obtuvieron 11 resultados positivos (el 8,9% del total) por EIA y 7 se confirmaron como positivos para HTLV-I por HR (tabla 1). En 6 se realizó la PCR en sangre total. No fue posible localizar al paciente restante. En todos se evidenció replicación vírica.
Descripción analítica, clínica y epidemiológica de los 7 pacientes HTLV-I positivos
| Pacientes | Servicio peticionario | Contexto clínico epidemiológico | Resultados | |||||
|---|---|---|---|---|---|---|---|---|
| N | Sexo | Edad | Nacionalidad | EIA | HR | PCR | ||
| 1 | H | 19 | Ecuador | E. Infecciosas | Zona endémica | + | HTLV-I | HTLV-I |
| 2 | M | 41 | Colombia | E. Infecciosas | Zona endémica | + | HTLV-I | HTLV-I |
| 3 | H | 46 | Ecuador | E. Infecciosas | Zona endémica | + | HTLV-I | HTLV-I |
| 4 | H | 34 | Perú | E. Infecciosas | Zona endémica | + | HTLV-I | HTLV-I |
| 5 | H | 42 | Ecuador | M. Preventiva | Zona endémica | + | HTLV-I | HTLV-I |
| 6 | H | 47 | España | E. Infecciosas | VIH+VHC | + | HTLV-I | ND |
| 7 | H | 34 | España | Neurología | Paraparesia | + | HTLV-I | HTLV-I |
EIA: enzimoinmunoanálisis; H: hombre; HR: hibridación reversa; HTLV: virus linfotrópico de células T humanas; M: mujer; ND: no disponible; PCR: reacción en cadena de la polimerasa; VHC: virus hepatitis C; VIH: virus de la inmunodeficiencia humana.
Por último, se analizaron las características clínicas y epidemiológicas de estos pacientes: 5 de ellos provenían de zonas endémicas, mientras que los 2 restantes eran españoles, uno de ellos coinfectado por el VIH y el VHC, y el otro correspondiente al caso de PET ya descrito.
DiscusiónEl caso de PET/mielopatía asociada al HTLV-I que presentamos aquí incluye todas las características típicas de esta enfermedad: evolución insidiosa, debilidad y espasticidad en miembros inferiores y alteración de esfínter urinario5. Cabe destacar que el estudio de HTLV se realizó dentro de la evaluación de paraparesia espástica de etiología desconocida, a pesar de que inicialmente no había sospecha epidemiológica de infección por HTLV-I.
Los criterios para realizar el cribado de HTLV-I en nuestro centro durante el periodo de estudio fueron bastante homogéneos. Llama la atención que el motivo más frecuente (22%) sea descartar este virus como causante de paraparesia espástica. Por otro lado, el rendimiento obtenido en el cribado fue bastante heterogéneo si tenemos en cuenta que encontramos casos positivos solamente en 3 de los 7 perfiles clínico-epidemiológicos que motivaron la petición. La búsqueda de HTLV-I en pacientes de zona endémica (5/20), en pacientes UDVP y/o VIH+ (1/18), y en pacientes con sospecha de paraparesia espástica tropical (1/25) resultaron las más eficientes.
La vigilancia de HTLV-I en nuestro país se ha enfocado tradicionalmente a los donantes de sangre. Diversos estudios establecieron recientemente la prevalencia de HTLV-I en nuevos donantes en Europa entre el 0 y el 0,0048%9–11. Países como Noruega y Finlandia cancelaron el screening de HTLV en sus bancos de sangre tras 7 y 13 años de búsqueda sin ningún caso positivo9. Sin embargo, en España los últimos datos arrojan una prevalencia en nuevos donantes del 0,01%6, lo que puede justificar la continuidad de la estrategia actual. Con relación al cribado de HTLV-I en la mujer embarazada, no existe consenso en regiones de baja prevalencia. Lo más indicado en España podría ser el cribado selectivo de gestantes de zonas endémicas o que hayan tenido relaciones sexuales de riesgo3. En lo que respecta a donantes y receptores de órganos se podría aplicar una estrategia similar, aunque el alto riesgo de falsos positivos y la consecuente pérdida de un órgano válido puede llegar a contraindicar tal cribado en zonas de baja prevalencia12. Por otra parte, como se desprende del caso que presentamos, el estudio de HTLV es una herramienta diagnóstica útil en casos de mielopatía crónica o síndrome linfoproliferativo de etiología desconocida. Otro grupo que puede ser incluido en el cribado es el paciente VIH+, sobre todo si es UDVP u originario de zona endémica. La coinfección VIH/HTLV, especialmente HTLV-II, es frecuente ya que comparten mecanismos de transmisión13.
El HTLV-I es un virus infrecuente en nuestro país. Su variedad en mecanismos de transmisión, su baja prevalencia y la presentación típicamente asintomática dificultan su detección. El caso descrito de PET autóctona obliga a incluir esta enfermedad dentro del diagnóstico diferencial de mielopatía progresiva. También se debe establecer un consenso claro para realizar el cribado de HTLV-I en países no endémicos como España, el cual podría valorarse en los siguientes grupos: donantes de sangre, receptores y donantes de órganos de zona endémica, sospecha de paraparesia espástica o síndrome linfoproliferativo con algún factor de riesgo asociado, gestantes de zona endémica, pacientes VIH+ o UDVP e individuos que mantienen relaciones sexuales con personas de países endémicos. En otras situaciones clínicas, la eficiencia de las distintas estrategias de cribado de HTLV-I es mínima.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.