Las infecciones relacionadas con la asistencia sanitaria constituyen un importante problema de salud pública mundial. Su incidencia es un indicador de la calidad asistencial prestada. Las medidas de prevención de la transmisión de los microorganismos hospitalarios pueden agruparse en 4 grandes áreas: precauciones estándar, precauciones específicas (incluyendo, cuando procede, las medidas de aislamiento), medidas de limpieza y desinfección ambiental, y actividades de vigilancia (incluyendo los datos de incidencia y la monitorización de procedimientos). La higiene de manos y el uso correcto de guantes son las principales medidas para prevenir las infecciones relacionadas con la asistencia sanitaria y evitar la diseminación de microorganismos multirresistentes. Se necesitan actividades de formación continuas, pero se consigue un impacto duradero mediante la vigilancia del cumplimiento de las recomendaciones de higiene de manos con retroalimentación de los resultados a los sanitarios. Son múltiples las iniciativas complementarias que se están evaluando. Entre ellas se encuentran el tratamiento de descolonización previa a determinadas cirugías, la aplicación de bundles en pacientes con catéter venoso central o sometidos a ventilación mecánica, o la higiene corporal universal con clorhexidina. El debate actual se centra en precisar en qué situaciones y a qué grupos de riesgo sería eficaz y eficiente aplicar cada una de ellas.
Health-care associated infections are an important public health problem worldwide. The rates of health-care associated infections are indicators of the quality of health care. The infection control activities related to prevention of transmission of hospital microorganisms can be grouped in 4 mayor areas: standard precautions, specific precautions (including isolation if appropriate), environmental cleaning and disinfection, and surveillance activities (including providing infection rates and monitoring procedures). Hand hygiene and the correct use of gloves are the most important measures to prevent health-care associated infections and to avoid the dissemination of multidrug-resistant microorganisms. Continuous educational activities aimed at improving adherence to hand hygiene are needed. Periodical assessment of adherence to hand hygiene recommendations with feed-back have been shown to provide sustained improvement. Several complementary activities are being evaluated, including skin decolonization prior to certain surgeries, a package of measures in patients with central venous catheters or mechanical ventilation, and universal body hygiene with chlorhexidine. The present area of discussion concerns in which situations and in which groups would such measures be effective and efficient.
Las infecciones relacionadas con la asistencia sanitaria (IRAS) constituyen un importante problema de salud a nivel mundial. Son una de las principales causas de morbimortalidad nosocomial, suponiendo además un gravoso coste económico añadido difícil de cuantificar en muchas ocasiones. De este modo las IRAS conllevan frecuentemente una prolongación de la estancia hospitalaria, una mayor utilización de antibioterapia o reintervenciones quirúrgicas, entre otras cosas, a lo que se añaden las consecuencias a nivel personal y social. Las infecciones causadas por bacterias resistentes también se asocian con mayor morbimortalidad y coste1,2. En una revisión recientemente publicada se comparó el coste medio por paciente en casos de infección por bacterias multirresistentes (BMR) frente a aquellos con infecciones por bacterias con un perfil de sensibilidad más amplio. En ella se cuantifica en 20.000 euros el coste extra asociado a las infecciones por bacilos gramnegativos no fermentadores resistentes a carbapenemas, y en 29.123 euros las infecciones debidas a Staphylococcus aureus resistente a meticilina (SARM)3. La incidencia de IRAS es, por tanto, un indicador directo de la calidad asistencial. En la actualidad es imprescindible valorar este parámetro como marcador de eficacia y calidad de la asistencia prestada, junto a otros clásicos como el índice de mortalidad o la estancia media hospitalaria.
Evitar, o al menos disminuir, la incidencia de IRAS es una tarea compleja que requiere recursos humanos. Los programas de vigilancia y control de infecciones nosocomiales, estructurados y con objetivos medibles, constituyen la estrategia más útil para lograr su prevención y control, ya que han demostrado además ser costo-eficientes4. Su objetivo principal es velar por la seguridad del paciente en lo referente a las infecciones hospitalarias. El origen de la medición del impacto de una actividad de prevención de infecciones hospitalarias se remonta a 1840, cuando Semmelweis observó que el desarrollo de fiebre puerperal se asociaba a la falta de higiene de los médicos que atendían a las pacientes tras la realización de autopsias3. El trabajo de campo de estos programas debe ser realizado por equipos multidisciplinares de control de infecciones, cuyas funciones se resumen en la tabla 15.
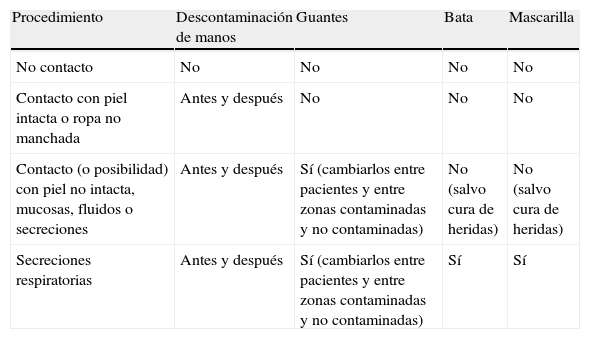
Indicaciones de aplicación de las precauciones estándar
| Procedimiento | Descontaminación de manos | Guantes | Bata | Mascarilla |
| No contacto | No | No | No | No |
| Contacto con piel intacta o ropa no manchada | Antes y después | No | No | No |
| Contacto (o posibilidad) con piel no intacta, mucosas, fluidos o secreciones | Antes y después | Sí (cambiarlos entre pacientes y entre zonas contaminadas y no contaminadas) | No (salvo cura de heridas) | No (salvo cura de heridas) |
| Secreciones respiratorias | Antes y después | Sí (cambiarlos entre pacientes y entre zonas contaminadas y no contaminadas) | Sí | Sí |
Es necesario realizar un análisis profundo de la situación propia y las prioridades en cada momento previo a la planificación de objetivos a corto y medio plazo de un programa de control de infecciones. Para ello es útil diseñar protocolos de vigilancia que incluyan aspectos relacionados no solo con los resultados, sino también con los procesos. Ejemplos habituales en relación con estos últimos son el control de la esterilización del material crítico, el control de los niveles de cloración y temperatura del agua, el nivel de cumplimiento de la higiene de manos o de administración correcta de profilaxis quirúrgica, entre otros. Deben incluirse además protocolos relacionados con los procedimientos clave que originan IRAS, las normas de actuación ante potenciales situaciones problemáticas y los procesos de mejora iniciales. En la literatura existen recomendaciones acerca de las características que deben reunir los programas de vigilancia y control de infecciones para ser eficaces6. Entre ellas se encuentran disponer de unos objetivos claros, usar definiciones estandarizadas tanto para los criterios de infección y tipos como para las variables a recoger, comprobar la calidad de los datos recogidos, analizar los datos ajustándolos por riesgo, interpretarlos y comunicarlos a los interesados, realización de actividades formativas y planificación y ejecución de intervenciones.
Medidas de prevención de la transmisión de microorganismos entre pacientes hospitalizados. La cadena de transmisiónLa frecuencia con que un paciente adquiere microorganismos hospitalarios depende de diversos factores, entre los que se incluyen factores intrínsecos, el uso de antimicrobianos, la duración de la exposición (estancia), el nivel de cumplimiento de las medidas de prevención y la presión de colonización. Las medidas de prevención y control deben contemplar la cadena de transmisión en todos sus aspectos. La comprensión e interpretación de los mecanismos de transmisión de cada patógeno permiten dilucidar los mecanismos de control con mayores posibilidades de ser eficaces en cada caso. La cadena de transmisión se compone de los reservorios o fuentes del patógeno, del mecanismo o mecanismos de transmisión y de la existencia de un huésped susceptible.
El reservorio puede ser humano (pacientes o personal sanitario colonizado) o ambiental (superficies secas o reservorios húmedos). El personal sanitario puede ser también reservorio en el caso de SARM7, principalmente. Los fómites son objetos inanimados que, si se contaminan, son capaces de hacer de vehículo. Ejemplos frecuentes en la clínica asistencial son los fonendoscopios o los tensiómetros. Las superficies secas inanimadas que rodean al paciente pueden constituir reservorios para microorganismos de larga supervivencia en estas condiciones y para esporas. Es necesario considerar además los aparatos o lugares que puedan conferir ambientes húmedos y con temperatura adecuada, como termos, incubadoras, sifones de lavabos o duchas, etc.; estos pueden constituirse en reservorios de forma prolongada de diversos microorganismos8.
En cuanto a los mecanismos de transmisión, suelen ser específicos para cada patógeno, aunque hay algunos que pueden emplear más de uno. Los más frecuentes asociados a las IRAS son por contacto, aéreo y por gotas. El mecanismo de transmisión más frecuente de microorganismos hospitalarios y de la mayoría de los microorganismos resistentes es, con mucho, el contacto. Este puede ser directo, desde el reservorio (en el caso de fómites contaminados que contactan con el paciente) o indirecto, a través de un vehículo que se contamina transitoriamente; el mejor ejemplo de esto son las manos (y guantes o ropa) del personal sanitario, en lo que se llama habitualmente la transmisión cruzada.
Finalmente, se necesita un huésped susceptible. Durante la estancia hospitalaria acontecen circunstancias que favorecen el desarrollo de IRAS, bien por su naturaleza invasiva (cirugía, canalización de accesos vasculares, etc.), por impedir el adecuado funcionamiento de los mecanismos de defensa del propio organismo (ventilación mecánica invasiva, sondaje urinario, etc.), por el empleo de antibioterapia de amplio espectro o de duración prolongada, o por la utilización de inmunosupresores, entre otros. Es en el medio hospitalario donde se rompe el equilibrio agente infeccioso-huésped debido a la aparición de nuevos mecanismos de transmisión, nuevas puertas de entrada y nuevos factores de susceptibilidad asociados al huésped.
En general, las medidas de control de infecciones con eficacia probada pueden agruparse en 4 grandes áreas: (1) precauciones estándar; (2) precauciones específicas para la transmisión; (3) medidas de limpieza y desinfección ambiental; y (4) actividades de vigilancia e intervenciones específicas.
Precauciones estándar. Higiene de manosLas precauciones estándar son medidas que deben aplicarse a todos los pacientes en todas las circunstancias, y persiguen evitar la transmisión de microorganismos entre pacientes, entre el ambiente y los pacientes, y a los sanitarios. Son sencillas y de fácil aprendizaje y realización. Se componen del lavado o descontaminación de manos (que llamaremos higiene de manos) y la utilización de dispositivos de barrera (batas, guantes, mascarilla y gafas de protección ocular) cuando son precisos. Deben considerarse de obligado cumplimiento por el personal sanitario, y en ocasiones por sus cuidadores. En la tabla 1, tomada de las recomendaciones realizadas en 2002 por los Centers for Disease Control and Prevention (CDC)9 se resumen las indicaciones de las distintas precauciones estándar.
La higiene de manos se considera la principal medida para prevenir las IRAS y evitar la diseminación de microorganismos multirresistentes7,8. El concepto higiene de manos engloba el lavado de arrastre con agua y un agente antiséptico y la desinfección con soluciones alcohólicas. La utilización de soluciones alcohólicas supuso una revolución en la higiene de manos, al permitir una mayor accesibilidad a los productos (pueden colocarse dispensadores en todos los puntos de atención, e incluso pueden portarse por los sanitarios), por la rapidez y por no requerir secado posterior. La fórmula recomendada por la Organización Mundial de la Salud (OMS) contiene 75%v/v isopropanol o 80%v/v etanol. En la tabla 2 se describen las situaciones en que se recomienda una u otra técnica9–11.
Indicaciones para el lavado de manos y la descontaminación
| Lavado de manos con agua y jabón | Descontaminación de manos (puede realizarse con solución alcohólica, o con lavado de manos con agua y jabón antiséptico) |
| Al iniciar y terminar la jornada laboralManos visiblemente manchadas o suciasManos contaminadas con sangre o fluidos corporalesAntes y después de comer, preparar, repartir o servir comidaDespués de ir al bañoDespués de estornudar, sonarse, etc.Contacto con pacientes que presenten infección por Clostridium difficile | Antes del contacto directo con el pacienteAntes de la colocación de los guantesDespués de tocar la piel intacta de un paciente (tomar pulso o la tensión arterial, levantar al paciente, etc.)Al pasar las manos de un punto corporal sucio a otro limpio durante el cuidado del pacienteDespués de contactar con líquidos orgánicos o excreciones, membranas, mucosas, piel no intacta y vendajes de heridas, si no están visiblemente manchadasTras la retirada de los guantesTras utilizar objetos situados cerca del paciente: equipos médicos, cuñas, bombas de perfusión, ventiladores, etc. |
Es importante recordar que en los casos en que se produzca contacto con pacientes con infección por Clostridium difficile (C. difficile) es imprescindible realizar el lavado de manos con agua y jabón, ya que las soluciones de clorhexidina no son capaces de eliminar las esporas de este patógeno12,13. La frecuencia de infecciones por C. difficile en un centro hospitalario puede constituir un marcador indirecto de la calidad de la antibioterapia prescrita y la efectividad de los aislamientos de contacto aplicados a este tipo de pacientes. Diversos estudios han demostrado que la reducción del empleo de antibióticos como clindamicina, fluorquinolonas o cefalosporinas se acompaña de una disminución de las infecciones por C. difficile14.
Con el objetivo de mejorar el cumplimiento del lavado de manos, la OMS lanzó una iniciativa denominada «Mis 5 momentos para la higiene de manos»15. En efecto, la higiene de manos es una acción simple, pero su incumplimiento por parte del personal asistencial es un problema habitual. Entre los estudios de cumplimiento, es frecuente que el personal facultativo presenta cifras más bajas de cumplimiento16. Son necesarios programas de educación e intervenciones de estímulo y promoción de la higiene de manos en los centros sanitarios (se han usado carteles recordatorios que van cambiándose, recordatorios en pantallas de ordenador, etc.), que deben repetirse con cierta frecuencia a modo estimulo y como actividad de formación16,17. Estas actividades deben incluir un apartado específico sobre cómo realizar el lavado de manos de forma correcta. En el caso del lavado con agua y jabón antiséptico, la secuencia adecuada se detalla a continuación:
- 1.
Mojar las manos y las muñecas y aplicar el jabón.
- 2.
Enjabonar bien y frotar al menos durante 30s.
- 3.
No olvidar el dorso de las manos y el borde sagital.
- 4.
Poner especial cuidado en los espacios interdigitales y los bordes de las uñas.
- 5.
Friccionar los dedos recogidos contra la palma opuesta.
- 6.
Aclarar abundantemente.
- 7.
Secar correctamente (toalla de papel de celulosa o de tejido de un solo uso).
- 8.
Cerrar el grifo con la toalla del secado.
Con las soluciones alcohólicas, el procedimiento es el mismo salvo los puntos 1 y 2 (se sustituyen por la aplicación de solución en la palma de la mano) y 6 a 8, que son innecesarios.
Los 5 momentos para la higiene de manos definidos por la OMS son18: (1) antes de tocar al paciente, (2) antes de realizar una tarea limpia o aséptica, (3) después del riesgo de exposición a agentes corporales, (4) después de tocar al paciente, y (5) después del contacto con el entorno del paciente.
Independientemente de las medidas formativas y de promoción de la higiene de manos, un aspecto clave que se incluye entre las recomendaciones de la OMS es la realización de una vigilancia de la adherencia a la higiene de manos en los 5 momentos. La OMS proporciona abundante información metodológica y herramientas al respecto18. El objetivo de esta vigilancia es proporcionar retroalimentación a los profesionales, de manera que sirva como motivo para la formación continuada, como estímulo para mejorar la adherencia y como método de evaluación de las intervenciones realizadas. Dado que el personal cambia, que toda medida educativa tiene un impacto solo temporal, la medición de la adherencia deberá realizarse periódicamente. Se trata de realizar observaciones de la actividad de los sanitarios, y de medir las veces que se realiza higiene de manos en cada oportunidad que existe para hacerlo, en función de los 5 momentos definidos. La vigilancia debe realizarse por personal entrenado para mejorar su reproducibilidad. En hospitales grandes es impensable que esta tarea pueda ser realizada en exclusiva por el personal del equipo de control de infecciones (tabla 3).
Funciones de los equipos de control de infecciones
| Vigilancia de procedimientos y de infeccionesProtocolización de procedimientos relacionados con la prevención de infeccionesActividades educativas y formativasIntervenciones encaminadas a mejorar los resultadosActuaciones específicas en caso de brotesEducación sobre la prevención de infeccionesInvestigación de brotesPlanificación de la limpieza, desinfección y esterilización de equipos y eliminación de residuos biológicosPrevención de la salud de los empleados del hospital relacionadas con la patología infecciosa, especialmente tras la exposición a agentes patógenos transmitidos por la sangre o respiratoriasColaboración con el equipo de antibióticos en la revisión de la prescripción de antibióticos y su relación con los patrones locales de resistencia a antibióticosPrevención de las infecciones asociadas a dispositivos intravascularesDesarrollo de políticas y procedimientos de control de infeccionesSupervisión de la utilización de nuevos productos que directa o indirectamente se relacionen con el riesgo de infecciones nosocomiales |
En nuestra opinión es aconsejable contar con personas referentes en cada unidad, que además de realizar las observaciones en esa u otras unidades, servirán como líderes locales implicados en la promoción de la higiene de manos. No es un problema avisar a los sanitarios de que se les va a observar; el objetivo no es punitivo, sino de ayuda a la mejora, y las primeras observaciones tienen un importante efecto educativo y formativo. Existen experiencias interesantes en nuestro país con la aplicación de la vigilancia periódica y retroalimentación; es evidente que la frecuencia de las observaciones debe adaptarse a las características del centro y los medios disponibles.
En los últimos años se están desarrollando herramientas electrónicas para medir el cumplimiento de higiene de manos (como el uso de «contadores» que lleva cada sanitario, que permiten conocer las veces que se activa el dispensador), o señales recordatorias al entrar en la habitación. Asimismo, en algunos países se promueve activamente que los pacientes exijan que los sanitarios realicen higiene de manos antes de tocarles.
Un segundo aspecto de las medidas estándar es la utilización de guantes. Se trata de una cuestión que frecuentemente se pasa por alto. Los guantes se utilizan con mayor frecuencia de lo que sería deseable, ya que producen al sanitario una sensación de protección que hace que se usen en situaciones en las que no son necesarios. El problema es que el uso de guantes se asocia frecuentemente a una sensación inconsciente de falta de necesidad de realizar la higiene de manos, y a que se vaya de paciente a paciente (o a superficies ambientales, etc.) sin cambiarlos. Por tanto, es necesario recordar que deben utilizarse siempre que pueda existir contacto con sangre, secreciones, fluidos corporales, piel no intacta o mucosas del paciente, pero no en otras circunstancias, y que deben retirarse después del contacto con cada paciente y desecharlos de forma inmediata. Por tanto, deben cambiarse siempre entre pacientes, así como entre zonas contaminadas y no contaminadas de un mismo paciente. Es imprescindible recordar que la utilización de guantes no evita la necesidad de la higiene de manos previa y posterior al uso de los mismos.
Otras medidas incluidas entre las precauciones estándar son la utilización de mascarillas, batas o protectores oculares en situaciones específicas. De forma general se recomienda la utilización de mascarillas con 3 objetivos:
- -
Para proteger al personal sanitario en procedimientos o situaciones que puedan ocasionar transmisión de patógenos por gotas (como en la realización de aspiración de secreciones respiratorias y aerosoles que contengan sangre o fluidos corporales).
- -
Para proteger a los pacientes sometidos a procedimientos estériles de los aerosoles respiratorios generados por el personal sanitario.
- -
Para limitar la propagación de microorganismos que se transmiten por gotas desde pacientes con infección por estos. Esta no es una medida de precaución estándar sino que se incluye entre las medidas específicas para evitar la transmisión por gotas.
Es frecuente confundir las precauciones específicas con el aislamiento. El aislamiento de un paciente en una habitación individual es una medida de segregación o separación de pacientes, que eventualmente puede sustituirse por otras como el establecimiento de cohortes en unidades abiertas o ante la ausencia de habitaciones individuales, etc.; de hecho, aunque somos partidarios del aislamiento en habituación individual siempre que sea posible, es un tema controvertido.
El objetivo de las precauciones específicas es evitar la transmisión de determinados patógenos desde un paciente colonizado o con una infección activa al resto de los pacientes o al personal sanitario. Una cuestión clave es que su aplicación no debe afectar a la calidad asistencial recibida por el paciente, y que estas medidas se añaden a las estándar. Estas precauciones específicas se definen en función de las formas de transmisión de los microorganismos:
Precauciones respiratoriasSu objetivo es evitar la transmisión por vía aérea debido a la diseminación aérea de partículas menores de 5μ, que pueden permanecer suspendidas en el aire durante periodos prolongados de tiempo. Indicadas en pacientes con sospecha o confirmación de tuberculosis respiratoria, varicela, sarampión o herpes zoster diseminado, entre otros. Su aplicación requiere las siguientes medidas:
- -
Habitación individual: preferentemente dotadas de presión negativa, con 6-12 intercambios de aire por hora y salida de aire directamente al exterior o filtrado a través de un filtro de alta eficacia. La puerta de la habitación debe permanecer siempre cerrada para preservar estas condiciones.
- -
Para entrar en la habitación, esté o no el paciente en ese momento, deben usarse respiradores (mascarillas) de alta filtración inspiratoria (filtro HEPA).
- -
Las salidas del paciente deben limitarse a las necesarias. En estos casos debe colocarse una mascarilla quirúrgica al paciente.
- -
Tras el alta hospitalaria, la habitación debe permanecer cerrada 6h antes de ser ocupada de nuevo, salvo si no existe sistema de alto recambio de aire, en cuyo caso el tiempo debe ser de 12h al menos.
Se emplea para evitar la transmisión de patógenos a través de gotas procedentes de secreciones orales y respiratorias de mayor tamaño que contengan microorganismos contagiosos. La transmisión por gotas requiere un contacto cercano entre la fuente y el huésped susceptible. Está indicado para pacientes con sospecha o confirmación de enfermedad infecciosa por Neisseria meningitidis, Haemophilus influenzae, adenovirus, gripe A o parotiditis, entre otras. Las medidas que requiere este aislamiento son:
- -
Separación de al menos 1m entre pacientes, si no es posible la habitación individual.
- -
Bata para contacto directo con el paciente.
- -
Uso de mascarilla quirúrgica.
- -
Limitar las salidas de la habitación del paciente a las necesarias. En estos casos debe colocarse una mascarilla al paciente.
El objetivo es evitar la transmisión por contacto, tanto directo con el paciente (piel, sangre o fluidos) como indirecto (objetos o superficies contaminadas). Está indicado en las siguientes situaciones:
- -
Infecciones gastrointestinales, respiratorias, cutáneas o heridas infectadas o colonizadas por BMR de especial relevancia clínica o epidemiológica.
- -
Infecciones entéricas con una baja dosis infectiva o una prolongada supervivencia en el medio, incluyendo C. difficile.
- -
Recién nacidos o niños con infecciones por virus respiratorio sincitial, virus parainfluenza, o infecciones por enterovirus.
- -
Infecciones cutáneas contagiosas como: difteria, herpes, impétigo, pediculosis, sarna, etc.
En cuanto a las BMR, la Comisión de Infecciones de cada centro debe decidir cuáles son susceptibles de precauciones de contacto. Esta decisión debe basarse en las recomendaciones existentes19,20, pero han de considerarse la epidemiología microbiológica local y a la capacidad de transmisión entre pacientes de cada una de las BMR evaluadas. Habitualmente se recomienda su aplicación en todos los casos de SARM, Enterococcus spp. resistente a vancomicina, Acinetobacter baumannii y enterobacterias productoras de betalactamasas de espectro extendido (con la posible excepción de Escherichia Coli [E. coli]), enterobacterias productoras de carbapenemasas (sin excepciones) y Pseudomonas aeruginosa con resistencia extensa. En cuanto a las cepas de E. coli productor de betalactamasas de espectro extendido, dada la alta frecuencia de colonización en la comunidad y su baja capacidad de transmisión nosocomial, son muchos los centros que han decidido excluirlo de las indicaciones de esta medida21,22. Además, en caso de brote, cualquier microorganismo que pueda transmitirse por contacto será indicación de aplicación de estas medidas.
Las medidas incluidas en las precauciones de contacto son las siguientes:
Respecto a las habitaciones- -
Siempre que sea posible, el paciente debe ocupar una habitación individual para facilitar las medidas de contacto; si no fuera posible, es una alternativa la cohorte de pacientes (ingreso de pacientes colonizados o infectados por un mismo patógeno en la misma habitación o área de una unidad abierta, con asignación de personal sanitario dedicado en exclusiva o no).
- -
La habitación de aislamiento debe tener 2 contenedores, uno para ropa y otro para el material desechable.
- -
En la puerta tendrá un cartel que indique el tipo de aislamiento.
- -
A diario se realizará la limpieza habitual. Cuando el paciente abandone definitivamente la habitación por alta o traslado, se realizará limpieza terminal de la misma.
- -
El personal vestirá una bata limpia no estéril y guantes, colocados antes de entrar en la habitación, y que se retirará antes de salir de la misma, desechándolos en el contenedor de la habitación, seguido de higiene de manos.
- -
Solo será necesaria la utilización de mascarilla cuando se realice aspiración de secreciones de pacientes con colonización o en caso de infección respiratoria.
- -
Debe contar con el material propio que sea posible dentro de la habitación, incluyendo termómetro, tensiómetro, fonendoscopio, material de cura (si fuese necesario), etc.
- -
Los aparatos exclusivos no deben abandonar la habitación y en caso de que ello fuese necesario, se realizará una desinfección exhaustiva de los mismos.
- -
La historia clínica no debe entrar en la habitación.
- -
En caso de usar aparatos personales como fonendoscopios, deberemos protegerlos y realizar desinfección de los mismos al finalizar su uso.
- -
La higiene corporal diaria se realizará con gel de clorhexidina.
- -
Cuando sea necesario el traslado a otra área hospitalaria, se notificará previamente la situación de aislamiento de contacto. El traslado se realizará de manera que se evite durante el mismo la posibilidad de transmisión por contacto.
- -
Las exploraciones o intervenciones quirúrgicas regladas deberán programarse en último lugar del parte y deberá constar en el mismo que el paciente se encuentra en aislamiento de contacto. En la unidad donde se realiza el procedimiento deben tomarse medidas específicas, como proteger camillas o aparatos que contacten con paños, etc. En caso de no haber sido posible, se seguirá de limpieza exhaustiva de la habitación. El personal que atiende al paciente en estas unidades debe seguir las medidas antes indicadas.
- -
El aislamiento no deberá ser causa de demora de procedimientos urgentes. La colonización de un paciente no debe afectar al manejo clínico del mismo ni a la toma de decisión del alta hospitalaria. Si la situación clínica del paciente lo permite, este podrá salir de la habitación con una bata limpia previa comunicación al personal asistencial.
- -
El horario de visitas y su limitación será el establecido en cada hospital. En todo caso, puede ser razonable limitar las visitas de personas claramente predispuestas a sufrir infecciones por estos microorganismos.
- -
No es necesario que el familiar utilice bata o guantes, solo será necesaria la higiene de manos.
- -
No deben entrar en ninguna otra habitación del hospital.
Las soluciones de clorhexidina resultan útiles en la higiene bucal y corporal de los pacientes. Varios estudios han valorado la eficacia de esta última medida para disminuir la tasa de colonizaciones e infecciones por BMR en pacientes ingresados en unidades de cuidados intensivos. Una reciente revisión sistemática concluyó que el lavado corporal con clorhexidina podría ser eficaz en la prevención de la colonización y posiblemente de las infecciones bacteriémicas por enterococos resistentes a vancomicina y SARM23. No existen datos concluyentes acerca de su efecto sobre bacilos gramnegativos.
Medidas ambientales. Limpieza y desinfecciónVa más allá de los objetivos de esta revisión el profundizar en estos aspectos. En cualquier caso, la importancia de la contaminación ambiental está siendo reconocida en los últimos años como un factor importante en la diseminación de las BMR en los hospitales. Existen recomendaciones generales al respecto20. En general, se trata de realizar limpieza de superficies con productos que garanticen la eliminación de microorganismos patógenos (habitualmente soluciones de lejía) con una frecuencia diaria, y además, una limpieza terminal o exhaustiva y completa al alta o traslado del paciente; de hacer una desinfección adecuada de todos los dispositivos móviles tras contactar con cada paciente; de garantizar circuitos de limpio-sucio en las unidades de riesgo. Finalmente, debe recordarse que no se han de utilizar como vertederos los lavabos, puesto que esto puede contaminar los sifones y tuberías de los mismos, que podrán causar aerosoles contaminantes por el reflujo que frecuentemente existe en los mismos.
Intervenciones de controlDebido a que los pacientes detectados como portadores de BMR mediante la realización de muestras clínicas (realizadas para diagnosticar una infección) solo son una minoría del total de pacientes colonizados, se ha planteado desde hace décadas realizar el estudio de cribado de portadores de BMR, bien universal, bien en determinados grupos de riesgo (colonización conocida en el año previo, residentes en unidades de larga estancia o centros sociosanitarios, pacientes trasladados desde otros centros hospitalarios, reingresadores, etc.). Se trata de una actuación que ha mostrado utilidad en programas que incluyen otras medidas, pero que es controvertido24.
Existe, además, la posibilidad del tratamiento de descolonización. El debate se centra en 3 aspectos fundamentales: en qué patógenos aplicarla, a qué grupos de riesgo y cuál es el momento más apropiado para llevarla a cabo. El SARM es probablemente el patógeno nosocomial sobre el que existe mayor experiencia en relación con la efectividad clínica de programas de descolonización. Su virulencia, el espectro de infecciones que es capaz de producir, su perfil multirresistente y el aumento de la prevalencia en los centros sanitarios, han sido los motivos por los que se ha priorizado su estudio frente a otros patógenos causantes de IRAS. En el caso de unidades con alta tasa de transmisión de SARM, puede ser útil además incluir al personal asistencial en los programas de detección de portadores y descolonización selectiva. En un estudio de intervención realizado en nuestro país, la aplicación de medidas de vigilancia activa y descolonización de SARM en pacientes y personal sanitario de determinados servicios específicos se acompañó de una reducción significativa en la incidencia de infección/colonización (0,56 a 0,28 casos por 1.000 pacientes/día; IC95% 0,17–0,40)25. En unidades de alto riesgo de IRAS y con un número limitado de pacientes/año, podría ser útil aplicar estrategias distintas al aislamiento de contacto y la descolonización selectiva. Así parece demostrarlo un reciente ensayo clínico realizado en 74 unidades de cuidados intensivos y 74.000 pacientes en el periodo de intervención26. Este estudio comparó 3 estrategias distintas de prevención de IRAS por SARM. El primer grupo realizó una tarea activa de detección de portadores y aislamiento de contacto; el segundo, detección, aislamiento de contacto y descolonización selectiva; y el tercero descolonización universal. El tercer grupo presentó una reducción del 37% en aislamientos clínicos y un 44% menos de bacteriemias por SARM, con diferencias estadísticamente significativas. Fue necesario realizar 181 descolonizaciones para prevenir el aislamiento de SARM en una muestra clínica y 54 para prevenir un episodio de bacteriemia. Esta estrategia puede resultar atractiva por varios motivos. Debido al amplio espectro antimicrobiano de la clorhexidina, su utilización en la higiene corporal diaria permite disminuir la concentración cutánea de múltiples bacterias, por lo que su efecto sobre las IRAS no se centra solo en aquellas debidas a SARM27–30. Además, su aplicación de carácter universal hace innecesarios los estudios de portadores y reduce la necesidad de aislamientos de contacto30–32. En cualquier caso, se trata de una cuestión controvertida. Otra de las aplicaciones en auge de los programas de descolonización es de forma previa a la cirugía con alto riesgo de infecciones por cocos grampositivos. Los casos más estudiados en este sentido son el implante de prótesis articulares y la cirugía cardiaca. En una reciente revisión sistemática y metaanálisis, la aplicación combinada de descolonización nasal y tratamiento con glucopéptidos disminuyó el número de infecciones de herida quirúrgica por cocos grampositivos33. Existen otras situaciones (p. ej., tras el alta hospitalaria) en las que aún no se ha aclarado la utilidad de la descolonización, debido fundamentalmente a la elevada frecuencia de recolonización (tanto en el medio comunitario como en actividades relacionadas con los cuidados sanitarios).
Aunque existe menor experiencia, también se han planteado estrategias de descolonización en enterobacterias productores de betalactamasas de espectro extendido. Utilizando de forma combinada enjuagues bucales con clorhexidina, paromomicina para la descolonización intestinal y antibioterapia oral para la urinaria, Buehlmann et al.34 consiguieron este objetivo en el 83% de los sujetos a estudio.
Una cuestión clave es la aplicación de múltiples medidas de forma conjunta (bundles). Aunque esta práctica hace difícil analizar la eficacia de cada medida aislada, parece razonable que un conjunto de medidas orientadas a todos los aspectos relevantes de la transmisión de los microorganismos actúen sinérgicamente para ayudar a su control.
En resumen, el control de la transmisión de BMR en los hospitales requiere estrategias bien planificadas, multidisciplinares (expertos en enfermedades infecciosas, microbiología clínica, medicina preventiva, cuidados intensivos y enfermería de control de infecciones) aplicadas de forma constante en el tiempo, con medición de sus resultados y aplicación de intervenciones adaptadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion.