Estudiar la evolución de la incidencia de sepsis neonatal precoz (SNP) por Streptococcus agalactiae en el área de Barcelona y analizar los fallos de cumplimiento del protocolo de prevención.
MétodosSe revisaron retrospectivamente todas las SNP en 8 centros sanitarios del área de Barcelona durante 2004-2010.
ResultadosSe diagnosticaron 49 SNP (48 gestantes). La incidencia fue de 0,29‰ recién nacidos vivos (0,18-0,47‰), presentando oscilaciones sin diferencias significativas a lo largo de los 7 años de estudio. La mortalidad fue del 8,16%. En el 68,5% los estudios de colonización maternos fueron negativos y en el 21% no se realizaron. El 58,3% de las gestantes no presentaron ningún factor de riesgo y el 22,9% de los partos fueron prematuros. El 58% de las gestantes no recibieron profilaxis antibiótica intraparto por no estar indicada según protocolo, y el 42%, por fallo de cumplimiento (3 cepas fueron resistentes a eritromicina). La resistencia a clindamicina fue del 33,3%. Los serotipos de Streptococcus agalactiae más frecuentes fueron el iii, el v y el ia.
ConclusionesNo se han producido cambios significativos en la incidencia de SNP por Streptococcus agalactiae en los 7 años del estudio. El aumento de la sensibilidad de los métodos de cribado, las técnicas moleculares intraparto, la realización del antibiograma de las cepas de gestantes y la mayor comunicación entre los centros sanitarios pueden contribuir a una mejor aplicación del protocolo y a una reducción de la incidencia de SNP.
To study the evolution of the incidence of early-onset neonatal sepsis (EOS) by Streptococcus agalactiae in the area of Barcelona and to analyze failure of compliance with the prevention protocol.
MethodsA retrospective review was carried out on EOS cases in 8 Health-Care Centers in the Barcelona area between 2004 and 2010.
ResultsForty-nine newborns from 48 mothers were diagnosed with EOS. The incidence was 0.29‰ living newborns (0.18-0.47‰), with no significant differences in the fluctuations along the 7 years. The mortality rate was 8.16%. In 68.5% cases the maternal colonization studies were negative, and in 21% these studies were not performed. No risk factors were detected in 58.3% of pregnant women, and 22.9% of births were premature. In 58% of cases intra-partum antibiotic prophylaxis was not administered because it was not indicated, and in 42% due to failure to follow the protocol (3 strains were resistant to erythromycin). Resistance to clindamycin was 33.3%. The Streptococcus agalactiae serotypes more frequently isolated were iii, v, and ia.
ConclusionsNo significant changes were detected in the incidence of Streptococcus agalactiae EOS in the 7 years of the study. The increased sensitivity of screening methods with the use of molecular techniques, the performance of susceptibility testing of strains isolated from pregnant women, and the improvement of communication between Health-Care Centers, can contribute to a better implementation of the protocol, as well as to reduce the incidence of EOS.
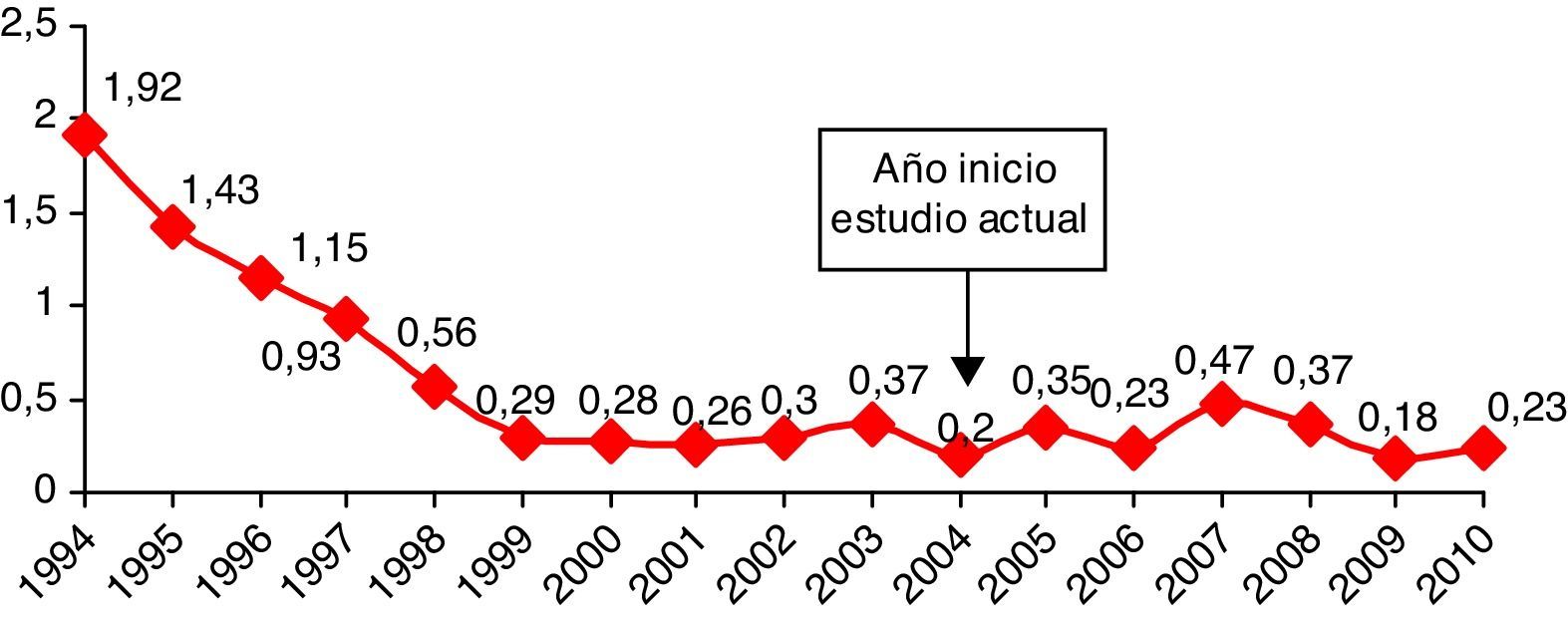
La sepsis neonatal precoz (SNP) por Streptococcus agalactiae (EGB) continúa siendo una de las principales causas de morbimortalidad en los recién nacidos, a pesar de los protocolos ya establecidos y consolidados de profilaxis antibiótica intraparto, que determinaron en las últimas décadas una reducción muy importante de esta enfermedad en los países de renta elevada1–5. El Grupo de Microbiólogos para el Estudio de las Infecciones de Transmisión Vertical, perteneciente a la Societat Catalana de Malalties Infeccioses i Microbiologia Clínica, se constituyó en el año 1994 con el objetivo de conocer la situación epidemiológica de la infección perinatal por EGB en Catalunya y promover medidas de profilaxis. En un estudio efectuado en 10 centros del área de Barcelona durante el período 1994-2001 se observó una incidencia inicial de SNP por EGB de 1,92 casos por 1.000 recién nacidos vivos, que pasó a 0,26 casos al final del citado estudio6. Desde entonces no se ha conseguido disminuir la incidencia de sepsis neonatal precoz por EGB. El objetivo de este estudio es hacer un seguimiento de la incidencia de esta enfermedad en los hospitales participantes y analizar los casos de SNP para identificar los fallos del cumplimiento de la estrategia de prevención.
MétodosEn el estudio han participado 10 centros sanitarios (8 hospitales y 2 centros de asistencia primaria) del área de Barcelona. Se han recogido todos los casos de SNP por EGB diagnosticados en los 8 hospitales durante el período de 2004 a 2010. La SNP se definió como la presencia de EGB en un producto estéril (sangre, líquido cefalorraquídeo [LCR]), en niños menores de 7 días de vida. Las muestras de sangre y LCR se procesaron según los métodos microbiológicos convencionales, determinándose la sensibilidad antibiótica en todas las cepas aisladas.
El serotipado capsular se realizó mediante un método de aglutinación con partículas de látex utilizando el kit GBS Serotyping Kit (Essum AB, Umeå, Suecia) de acuerdo con las instrucciones del fabricante.
Se diseñó una ficha de recogida de datos y mediante revisión de las historias clínicas se analizaron:
- 1)
Resultados del estudio de colonización por EGB a las 35-37 semanas de gestación, tipos de muestras (frotis vaginal y/o rectal), métodos microbiológicos utilizados (medios de enriquecimiento y/o selectivos).
- 2)
Factores de riesgo obstétrico: fiebre intraparto≥38°C, rotura prolongada de membranas≥18h, parto prematuro<37 semanas de gestación.
- 3)
Profilaxis antibiótica intraparto (PAI): antibiótico, dosis y momento de administración, considerándose como correctas las recomendaciones de los Centers for Disease Control and Prevention (CDC) de 20022.
- 4)
Datos del neonato: semanas de gestación, resultados de los cultivos de sangre y LCR y evolución.
Para estudiar los cambios en la incidencia a lo largo del período valorado se analizaron los incrementos de riesgo respecto al riesgo relativo inicial utilizando el modelo de regresión de Poisson. El análisis se realizó con el paquete estadístico Stata versión 8.0. Los resultados se presentan con su incremento de riesgo relativo y su intervalo de confianza del 95%. El nivel de significación utilizado en los contrastes fue de p≤0,05.
ResultadosEn los 7 años estudiados se han diagnosticado 49 sepsis precoces por EGB en neonatos nacidos de 48 gestantes (2 correspondían a un mismo parto gemelar) en los hospitales participantes en el estudio. En los 49 neonatos las cepas se aislaron en el hemocultivo, y en 6, también en LCR. Durante este período, el número total de nacidos vivos en los 8 hospitales fue de 168.277, lo cual supone una incidencia global de 0,29‰ recién nacidos vivos.
En la figura 1 se muestra la evolución de la incidencia de las SNP por EGB de 1994 a 2010 en los hospitales del estudio. Desde 1994 a 2001 se observa una disminución del 86,1% (p<0,001)6. Sin embargo, en el período estudiado los porcentajes se estabilizaron, observándose pequeñas fluctuaciones entre 0,18 y 0,47‰, sin diferencias estadísticamente significativas.
En 10 (21%) de las 48 gestantes no estaba disponible el resultado de la investigación del EGB en el momento del parto, en 6 casos no se había realizado por parto prematuro, en 3 por tratarse de embarazos no controlados y en un caso se realizó, pero el parto se produjo de forma precipitada.
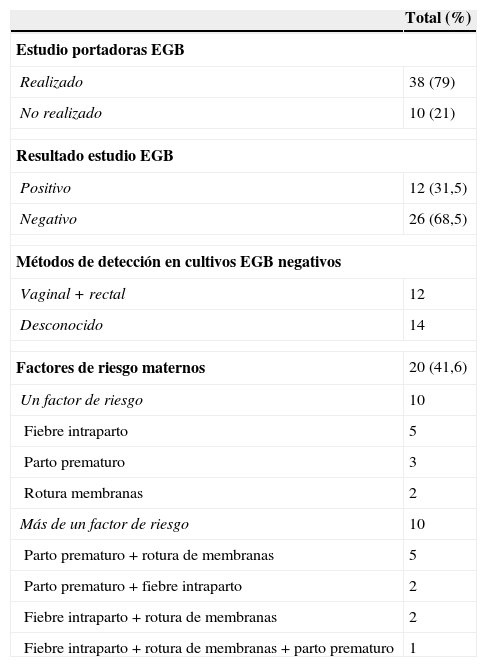
Del total de 38 gestantes estudiadas (tabla 1), en 12 (31,5%) el cultivo realizado fue positivo para EGB, y en 26 casos (68,5%), negativo. De estos, en 14 el estudio se había realizado en laboratorios externos, desconociéndose los métodos microbiológicos y los tipos de muestras empleados. En un caso, la cepa causante de la infección no era ni hemolítica ni pigmentada (como se observó posteriormente, en la cepa aislada del neonato). En los 12 casos restantes, en los que el estudio se realizó en los propios centros, los métodos utilizados fueron los recomendados, por lo que los resultados pueden considerarse falsos negativos. En otro de estos casos también se aisló en el neonato una cepa de EGB no hemolítica ni pigmentada, lo que explica que escapara a la detección por los métodos microbiológicos convencionales.
Datos relativos al estudio de colonización de las gestantes por Streptococcus agalactiae y a los factores de riesgo obstétrico (N=48)
| Total (%) | |
|---|---|
| Estudio portadoras EGB | |
| Realizado | 38 (79) |
| No realizado | 10 (21) |
| Resultado estudio EGB | |
| Positivo | 12 (31,5) |
| Negativo | 26 (68,5) |
| Métodos de detección en cultivos EGB negativos | |
| Vaginal+rectal | 12 |
| Desconocido | 14 |
| Factores de riesgo maternos | 20 (41,6) |
| Un factor de riesgo | 10 |
| Fiebre intraparto | 5 |
| Parto prematuro | 3 |
| Rotura membranas | 2 |
| Más de un factor de riesgo | 10 |
| Parto prematuro+rotura de membranas | 5 |
| Parto prematuro+fiebre intraparto | 2 |
| Fiebre intraparto+rotura de membranas | 2 |
| Fiebre intraparto+rotura de membranas+parto prematuro | 1 |
Veintiocho gestantes (58,3%) no presentaron ningún factor de riesgo durante el parto. Hubo 11 (22,9%) partos prematuros (uno gemelar), 10 con una edad gestacional entre las 24-34 semanas y uno de 36 semanas. En la tabla 1 se detallan los distintos factores de riesgo que presentaban estas gestantes.
Profilaxis antibiótica intrapartoNo recibieron profilaxis 37 (77%) de los 48 casos; en 28 (76%) no lo indicaba el protocolo, en 18 casos porque el cultivo fue negativo y no presentaban factores de riesgo, en 7 casos por cultivo negativo con factores de riesgo y en 3 casos por cultivo desconocido sin factores de riesgo.
En 9 casos (24%) la profilaxis estaba indicada y no se administró. En 5 casos el cultivo fue positivo (en 2 de ellos el parto fue precipitado y no hubo tiempo de administrar la profilaxis), en otros 3 el cultivo no se había realizado pero presentaban factores de riesgo, y en una gestante, aunque el cultivo era positivo, no se dispuso del resultado en el momento del parto, pero presentaba factores de riesgo.
Los 11 casos restantes recibieron profilaxis, pero solo en 3 de forma correcta. En 5 gestantes el antibiótico se administró solo una hora antes del expulsivo. En otros 3 casos se indicó eritromicina por antecedente de alergia a la penicilina y las cepas aisladas resultaron resistentes a dicho antibiótico. En las cepas maternas no se había realizado la determinación de la sensibilidad antibiótica.
Datos del neonatoEl parto fue por cesárea en 20 casos (41,6%), 20 fueron partos eutócicos, 8 eutócicos instrumentados y en uno se desconocía. En 37 casos (75,5%) la edad gestacional fue superior a 37 semanas, y de los 12 niños prematuros, en 11 (91,6%) la edad gestacional fue≤34 semanas. Evolución: 4 (2 de parto gemelar) fallecieron (8,16%) y los demás evolucionaron favorablemente. Estudio de sensibilidad antibiótica: el 37,5% de las cepas fueron resistentes a eritromicina y el 33,3% a clindamicina.
Se serotiparon 34 de las 49 cepas, de las cuales 14 pertenecían al serotipo iii, 7 al v, 6 al ia, uno al ib, 3 al ii, uno al iv y 2 fueron no tipables.
DiscusiónLa SNP causada por EGB sigue siendo la principal causa de morbimortalidad de causa infecciosa en los recién nacidos1, a pesar de las estrategias de prevención. Nuestros datos demuestran que la vigilancia del cumplimiento del protocolo de prevención es fundamental para continuar educando en la prevención y conseguir disminuir las tasas residuales de SNP.
Las guías de los CDC editadas en la década de los 90 y revisadas posteriormente en 20022 y 20103, así como los documentos de consenso SEIMC/SEGO/SEN/SEQ/SEMFYC4,5 en los que se recomienda el cribado universal entre las 35 y 37 semanas de gestación y la profilaxis antibiótica intraparto en las mujeres colonizadas por EGB, han contribuido de forma importante al descenso de las tasas de incidencia. Entre 1994 y 1999 se produjo la disminución más acusada del número de casos, siendo del 80% en Estados Unidos7. En un trabajo previo realizado por nuestro grupo, en el que participaban diferentes hospitales del área de Barcelona, Andreu et al.6 describían un descenso del 87% en el mismo período de tiempo. En los años siguientes, la incidencia se ha mantenido estable, con ligeras fluctuaciones, por debajo de 0,5 por 1.000 nacidos vivos, similar a diversos trabajos publicados por los hospitales del Grupo Castrillo8. Edmond et al.9, en un metaanálisis de reciente publicación, refieren que la incidencia media de SNP fue de 0,43 (intervalo de confianza del 95% 0,37-0,49), siendo más alta en África y América que en Europa. Estas tasas se basan en las infecciones por EGB con cultivo positivo obtenido a partir de muestras de sangre o LCR; sin embargo, en muchas ocasiones no se dispone de cultivos o estos son negativos debido a tratamiento previo o a la administración de la profilaxis materna intraparto. Esto hace que la incidencia real pueda ser de una a 3 veces superior a la comunicada.
Los recién nacidos prematuros (23% en nuestro estudio) tienen un mayor riesgo de desarrollar SNP por EGB10. En las series con porcentajes inferiores al 20% de niños infectados prematuros, el riesgo es 2 veces inferior al de las que refieren porcentajes del 20-39%.
La mortalidad de la SNP se sitúa alrededor del 12%11, siendo en nuestra serie del 8,16%, superior a la de las sepsis neonatales tardías, diagnosticadas en estos mismos centros, en el período 1996-201012. De ahí la importancia de la correcta aplicación del protocolo de prevención basado en el cribado universal. En nuestro trabajo se refleja que a pesar de la amplia implementación de dicho protocolo en la práctica asistencial desde los años 90, todavía presenta limitaciones y puntos de mejora. En un 21% de las sepsis por EGB no se dispuso de cultivos en el momento del expulsivo, ya fuera por parto prematuro o por gestación no controlada, y en un 68% de los casos los cultivos realizados fueron negativos. Van Dyke et al.13, en un estudio realizado en 10 estados de los Estados Unidos, refieren porcentajes similares, del 18 y del 61,4%, respectivamente. Se ha visto que el cultivo es capaz de predecir la colonización por EGB en el momento del parto con una sensibilidad del 87-91% y una especificidad del 89-96%14. En el caso de no disponer de cultivos, según las guías2–5, si la gestante presenta uno o más factores de riesgo (parto antes de las 37 semanas, rotura de membranas>18h o fiebre intraparto) se administra PAI; sin embargo, las gestantes con cultivo negativo no recibirían PAI para EGB, independientemente de la presencia o no de factores de riesgo. En un 60% de los casos de SNP de nuestro estudio no existía ningún factor de riesgo materno, por lo que tanto las gestantes con cultivo negativo, como aquellas en las que estos no se realizaron o tenían un resultado desconocido, no recibieron PAI. Los casos con cultivo negativo son especialmente preocupantes y se han atribuido a muestra insuficiente, retraso en el procesamiento, utilización de técnicas diagnósticas inadecuadas, cepas no hemolíticas, uso reciente de antibióticos o colonización materna con posterioridad a la toma de muestras5,13,15. En nuestro estudio encontramos un 4,17% de cepas no hemolíticas, cifra similar al 4% que refieren los CDC3.
Las técnicas de diagnóstico point of care basadas en la reacción en cadena de la polimerasa pueden contribuir a paliar este problema, ya que permiten identificar el EGB de forma rápida en el momento del parto16–18. Sin embargo, hasta el momento, aunque ofrecen ventajas como la rapidez, la posibilidad de detectar cepas no hemolíticas o no pigmentadas (2 casos en nuestro estudio) y una sensibilidad y especificidad superiores al 90%, no permiten detectar resistencias a los macrólidos y lincosaminas y se han descrito resultados falsamente negativos en casos de rotura de membranas16. Las recomendaciones de consenso de la SEIMC/SEGO/SEN/SEQ/SEMFYC5, en su actualización de 2012, aconsejan aplicar estas técnicas en mujeres en las que se desconoce el estado de portadoras de EGB y no presentan factores de riesgo en el momento del parto. Sin embargo, en las gestantes con factores de riesgo recomiendan aplicar PAI independientemente del resultado de la reacción en cadena de la polimerasa, por lo que en este caso no estaría indicado realizar esta técnica. Por otro lado, las mismas guías5, aunque no las de los CDC, recomiendan que si la madre debió recibir PAI y no la recibió o no fue adecuada, se administre al recién nacido, independientemente del estado clínico, una dosis de penicilina G durante la primera hora de vida; en el caso del prematuro se aconseja, además, practicar hemocultivo y pruebas diagnósticas. Aunque la práctica de administrar penicilina no se ha generalizado, el hecho de conocer de manera rápida intraparto, mediante técnica de biología molecular, que la madre es portadora, puede modificar el manejo del recién nacido en las primeras 24h (alargando hasta 48h el período de observación y realizando analítica para el cribado de la infección) y, por lo tanto, contribuir a la prevención de la SNP.
De los 48 casos de SNP de nuestro estudio, 28 (58,3%) no recibieron PAI porque no lo indicaba el protocolo. Del 41,7% restante en los que debía administrarse, lo recibieron de forma correcta 3 casos, el 15%. Las principales causas de no administración o administración incorrecta fueron el parto precipitado, la resistencia a eritromicina en 3 gestantes alérgicas a betalactámicos o la administración iniciada en un tiempo inferior a las 4h previas al parto. Se comunican cifras parecidas en diferentes trabajos y se evidencia el hecho de que el problema principal en la no administración de la PAI es el elevado porcentaje de cultivos negativos11,17.
La incidencia más elevada de SNP, con tasas parecidas a las publicadas con anterioridad a las recomendaciones de PAI, se produce en las madres con cultivo negativo y, como mínimo, un factor de riesgo19 (7 casos en nuestro estudio, un 14,5%). En este grupo, en el que no estaría indicado, según las guías4,5, administrar PAI, es especialmente necesario incrementar el rendimiento de las técnicas microbiológicas, mediante pruebas de biología molecular en el momento del parto, así como disponer de estrategias de prevención adicionales, como la inmunización.
En las gestantes con antecedentes de alergia a penicilina, las guías4,5 recomiendan la administración de clindamicina. La resistencia a este antibiótico se ha incrementado considerablemente en los últimos 20 años20, describiéndose porcentajes variables según el área geográfica y el consumo de macrólidos y lincosaminas20,21. En nuestro estudio, el 33,3% de las cepas fueron resistentes a clindamicina; este elevado porcentaje hace imprescindible la determinación de la sensibilidad a este antibiótico en las cepas de las gestantes, incluyendo la detección de la resistencia inducible a clindamicina. En caso de no disponer del resultado del antibiograma en el momento del parto, el antibiótico de elección en alérgicas a la penicilina sería la vancomicina.
La distribución de serotipos causantes de SNP fue parecida a la de otros países europeos22, siendo más frecuentes el iii, v y ia. En el estudio de Martins et al.23, en el que se analizaron los serotipos de las cepas causantes de infección invasiva por EGB durante 18 años, ya se determinó que existe una estructura clonal estable de los serotipos causantes de SNP en el área de Barcelona.
Desde el año 2008 el programa europeo conocido como DEVANI24 ha estado trabajando en el diseño de la vacuna de EGB conjugada trivalente (serotipos ia, ib y iii), actualmente en fase iii, que podría ser eficaz para prevenir tanto la SNP como la tardía. La inmunización paliaría las limitaciones del cribado universal y de la PAI, como la imposibilidad de disponer de cultivo en los prematuros, los falsos negativos del cribado o la profilaxis inadecuada en los partos precipitados. Esta vacuna ha demostrado ser coste-efectiva en países con incidencia elevada de SNP y dificultades para la aplicación del cribado universal25.
En conclusión, la SNP por EGB sigue siendo en la actualidad, y a pesar del descenso en su incidencia, un problema importante de salud pública. La revisión de los casos de SNP demuestra que todavía existen «oportunidades perdidas» para su prevención y que a pesar de la adecuada implementación de las recomendaciones existe un potencial de mejora para la disminución de los casos residuales de esta grave enfermedad26.
La mejora en la comunicación entre las diferentes especialidades y centros sanitarios (atención primaria y hospitales), así como el procesamiento rápido y con una metodología estandarizada de las muestras, facilitarán el diagnóstico microbiológico y el acceso rápido al resultado de los cultivos. El incremento de la sensibilidad de los métodos microbiológicos de cribado y de las pruebas moleculares intraparto con determinación de la sensibilidad antibiótica, así como la administración materna de la vacuna contra EGB, pueden contribuir a un descenso adicional de la incidencia de la SNP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. Carlos Rodrigo Gonzalo de Liria, jefe del Servicio de Pediatría del Hospital Universitario Germans Trias i Pujol, por la revisión crítica del trabajo.
A E.R. Martins, J. Melo-Cristino y M. Ramírez, del Instituto de Microbiología, Instituto de Medicina Molecular, Faculdade de Medicina, Universidade de Lisboa, Portugal, que han realizado el serotipado de las cepas.