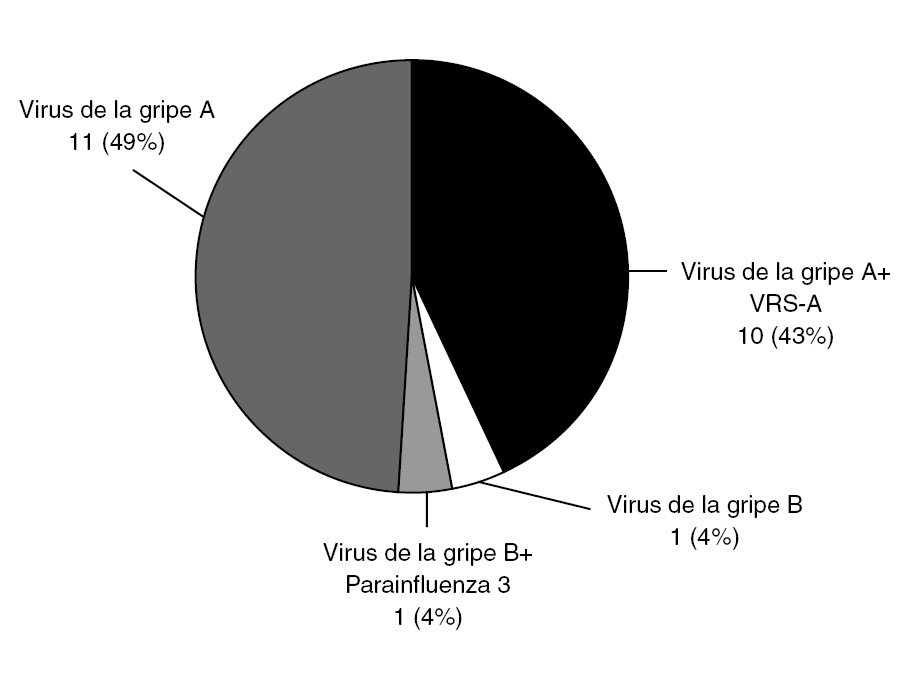Introducción
La morbilidad atribuible al virus de la gripe en niños y adolescentes ha sido subestimada durante décadas por considerarse una enfermedad banal exenta prácticamente de complicaciones a estas edades y por infradiagnosticarse con frecuencia. Este último hecho puede ser explicado, al menos parcialmente, porque la estacionalidad del virus de la gripe coincide con la de otros virus respiratorios, como el virus respiratorio sincitial (VRS), parainfluenza, adenovirus, rinovirus, metaneumovirus, etc., cuya clínica en pacientes pediátricos es, con frecuencia, muy similar a la gripe 1,2.
Durante la época epidémica de la gripe se produce un aumento significativo en las tasas de hospitalización en la población pediátrica 3. En un estudio prospectivo 4, se observó una tasa de hospitalización del 20% de los casos de gripe en niños de 0 a 11 meses.
Estudios recientes han tratado de estimar y diferenciar la proporción de hospitalizaciones atribuibles al virus de la gripe. Si bien los resultados han variado entre los distintos trabajos (por diferente metodología empleada y gravedad variable en la época epidémica según áreas geográficas y años), parecen coincidir en que los niños sin patología de base menores de 24 meses constituyen un grupo de mayor riesgo que los niños de más edad, siendo por tanto el riesgo de hospitalización mayor en el primer grupo 2,5. Incluso los adultos sanos entre 50 y 64 años, cuya vacunación contra el virus de la gripe es recomendada desde el año 2000 por los Centers for Diseases Control and Prevention (CDC) 6, tienen menos riesgo de ingreso hospitalario que los niños menores de 24 meses, cuyas tasas de hospitalización se equiparan a los grupos reconocidos como de alto riesgo 1,2,7. Además, los niños y jóvenes presentan las tasas de ataque más altas en períodos epidémicos, oscilando entre el 15-42%, siendo por otra parte una importante fuente de contagio 7-9. La mayoría de los estudios epidemiológicos demuestran que la población infantil es la responsable de la introducción, difusión y, probablemente, del mantenimiento de la gripe en la comunidad 2,10-12.
En los últimos años se han ido realizando estudios acerca de la gripe, al haberse constatado la morbilidad que representa para la población pediátrica, el papel que ésta desempeña como fuente de contagio y el coste que lleva implícito. Sin embargo, los datos publicados en España son escasos y procedentes en su mayor parte de estudios retrospectivos, algunos de ellos coetáneos a éste 13-16. El objetivo del estudio es evaluar las características clínicas de niños hospitalizados con gripe, describiendo la clínica, datos epidemiológicos, factores de riesgo, posibles coinfecciones y complicaciones que estos sujetos presentan.
Material y métodos
Estudio prospectivo incluyendo los pacientes ingresados en el Hospital Materno-Infantil de Málaga (hospital terciario referencia de más de 300.000 niños de 0 a 14 años) desde el 1 de diciembre de 2003 hasta el 28 de febrero de 2004.
Criterios de inclusión
Pacientes que en el momento del ingreso o en las primeras 24 h del mismo cumplían: 1. Edad menor de 3 años y uno de los siguientes: 1.1. Fiebre igual o superior a 38 °C axilar y algún síntoma respiratorio (rinorrea, tos, dificultad respiratoria, etc.); 1.2. Fiebre superior a 38 °C sin foco evidente. 2. Niños menores de 5 años con neumonía adquirida de la comunidad, definida como la asociación de algún síntoma respiratorio (con o sin fiebre) con radiografía de tórax alterada, con o sin leucocitosis/neutrofilia según el subgrupo. Se consideran 2 subgrupos: 2.1. Fiebre igual o superior a 38 °C (con o sin síntomas respiratorios), leucocitosis superior a 20.000/μl y/o neutrofilia superior a 15.000/μl y/o proteína C reactiva superior a 80 mg/l y radiografía de tórax con condensación alveolar superior a 2,5 cm; 2.2. Síntomas respiratorios (con o sin fiebre), leucocitos inferiores a 20.000/μl y neutrófilos inferiores a 15.000/μl y proteína C reactiva inferior a 80 mg/l y radiografía de tórax con infiltrado distinto al considerado en el apartado 2.1.
Con el grupo 1.1 se valoró la frecuencia de infección por virus de la gripe A y/o B en pacientes hospitalizados en ese grupo de edad frente a otras etiologías virales. En el grupo 1.2. se estudió el porcentaje de lactantes con fiebre sin foco aparente debida a gripe. Con el grupo 2 se estudió una posible asociación de gripe en neumonías típicas y su papel en otras neumonías no bacterianas.
Análisis de la muestra
La técnica de recogida empleada fue el aspirado nasofaríngeo, ya que es la muestra que parece ofrecer mayor rentabilidad. En los casos de secreción/rinorrea escasa, se obtuvo la muestra con torunda nasofaríngea (el antígeno viral se encuentra más concentrado que si se emplea lavado nasofaríngeo).
Las muestras se recogieron en las primeras 48 h del ingreso, preferiblemente en las primeras 24 h, para evitar falsos negativos al disminuir la carga viral en el moco con el tiempo y falsos positivos debidos a contagio nosocomial.
Se realizó reacción en cadena de polimerasa (PCR) frente a virus de la gripe A y B, así como para parainfluenza 1, 2 y 3 y para VRS-A y B, con objeto de estudiar posibles coinfecciones. Para ello se extrajo ARN mediante protocolo de Bertina et al realizándose amplificación mediante RT-Multiplex PCR con cebadores específicos para los virus indicados 17-19. Se realizó retrotranscripción mediante kit First Strand cDNA RT-PCR (AMV) de Roche y posterior amplificación en nested-PCR con primers específicos para la detección simultánea de parainfluenza 1, 2 y 3, y de virus gripal A (H1N1 y H3N2), B y RSV A y B.
Se empleó de forma paralela un test de detección antigénica, Directigen Flu A + B, (BD Diagnostic Systems, Sparks, MD) un enzimoinmunoanálisis sobre membrana para la detección directa cualitativa, rápida e in vitro, de los antígenos procedentes de virus gripales A y B, viables o inviables, con una sensibilidad del 87,5% y una especificidad del 96,8% en relación al cultivo viral y según la literatura especializada 20,21.
Tanto la toma como el procesamiento de las muestras, el test antigénico y la recogida de datos han sido realizados en el hospital por dos únicos investigadores, para evitar sesgos en la obtención y manipulación de las muestras. La PCR se realizó en un laboratorio que colabora habitualmente con el hospital.
Análisis estadístico
El procesamiento estadístico de los datos se realizó mediante S.P.S.S.11.0. En variables cualitativas se realizaron las comparaciones mediante el test de la chi cuadrado y en caso de no cumplirse las condiciones de aplicación mediante la prueba de F exacta de Fisher. En el caso de variables con categorías ordenadas se realizó también el test de tendencia lineal. Las variables cuantitativas que se distribuyeron de forma normal se compararon mediante la prueba de la t de Student y si su distribución no era normal se usaron pruebas no paramétricas (Mann-Whitney, prueba de la mediana). Se aceptó una p < 0,05 como indicativa de significación estadística.
Resultados
Población
Inicialmente fueron incluidas un total de 213 muestras de 211 pacientes (2 pacientes reingresaron). Cuatro pacientes del grupo 1.1 se excluyeron posteriormente al no presentar fiebre ni previo al ingreso ni durante las primeras 24 h del mismo, y otros seis lo hicieron por problemas en la recogida, cantidad/calidad y/o procesamiento de la muestra, por lo que el número final de muestras incluidas fue de 203.
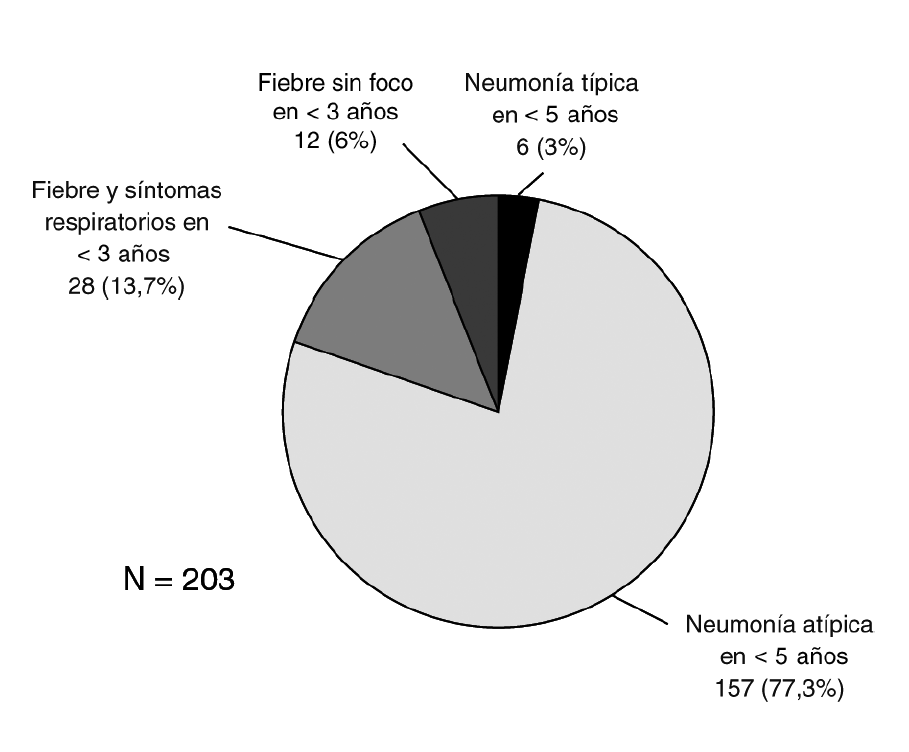
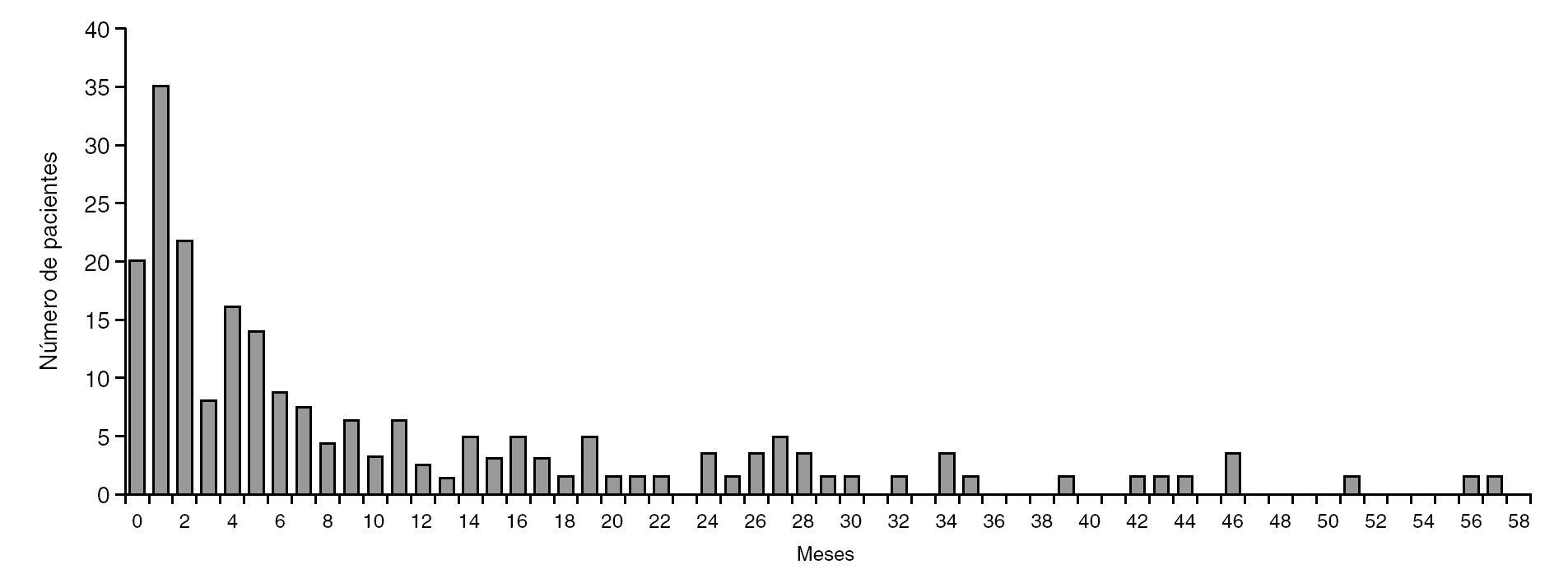
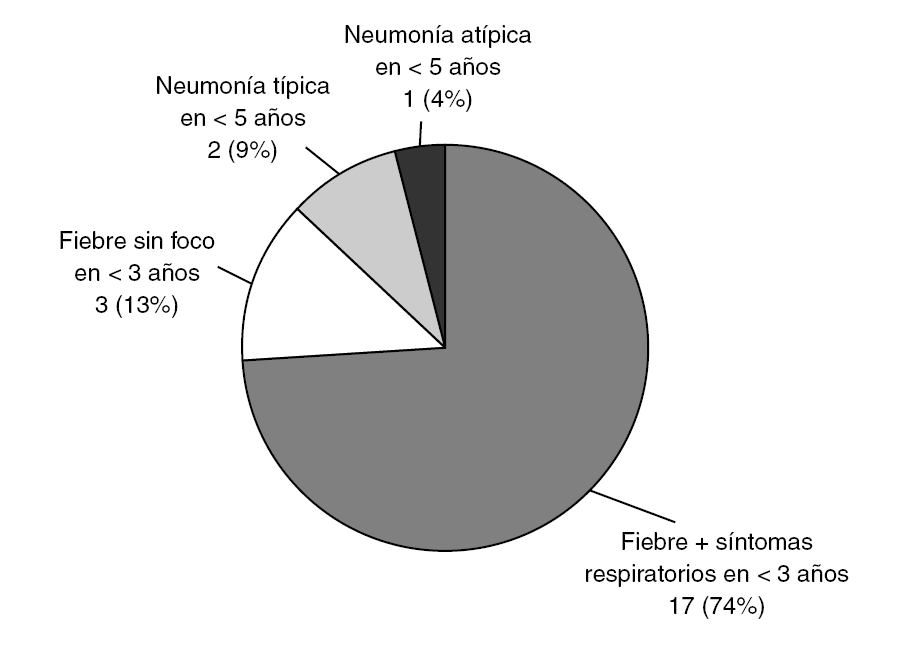
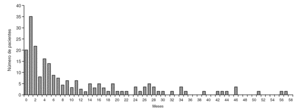
La distribución según los criterios de inclusión se muestra en la figura 1. El grupo más numeroso lo constituyeron los pacientes menores de 3 años con fiebre y síntomas respiraorios que no cumplían criterios de neumonía (grupo 1.1). No hubo diferencias en cuanto a género (46,8% mujeres, 52,2% varones). La edad siguió una distribución asimétrica, con muchos pacientes agrupados entre los más jóvenes. Kolmogorov-Smirnov, p < 0,001 (fig. 2).
Figura 1. Distribución de los pacientes según los criterios de inclusión.
Figura 2. Gráfica de distribución etaria (meses de vida).
Reacción en cadena de la polimerasa (PCR)
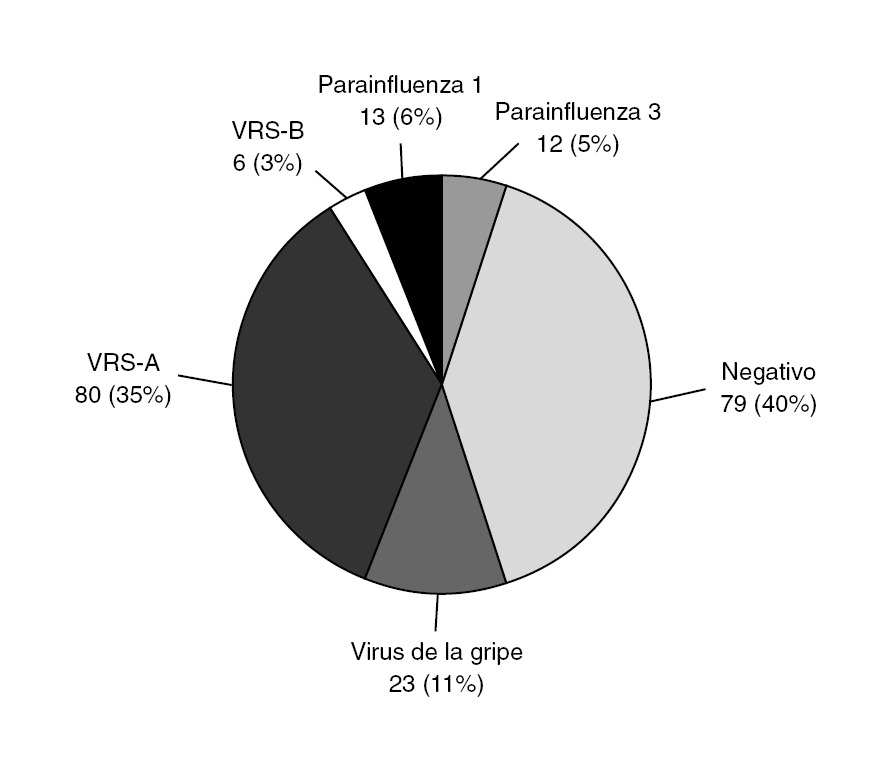
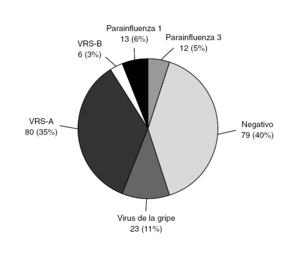
Fue positiva en el 61% de los casos, siendo en un 11,3% (23 pacientes) positiva para virus de la gripe (Grupo influenza, GI); se denominó grupo no-influenza (GnI) a todos los casos en los que la PCR a virus gripal fue negativa. La distribución de estos grupos se muestra en las figuras 3 y 4.
Figura 3. Resultados de reacción en cadena de polimerasa (PCR).
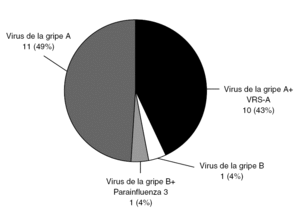
Figura 4. Pacientes con PCR positiva a virus de la gripe (23/203). Virus de la gripe A 21/23; B 2/23. Nótese que se apreció coinfección en 11/23 casos, especialmente virus de la gripe A y VRS-A. VRS: Virus respiratorio sincitial.
El virus de la gripe A se detectó con mucha más frecuencia que el B (21/23), correspondiendo 20 casos a H3N2 y uno a H1N1. Las coinfecciones han sido un hallazgo frecuente: en 10 de los 21 casos de virus de la gripe A se detectó coinfección con VRS-A y en 1 de los 2 pacientes con virus de la gripe B también se detectó parainfluenza 3. Al ser limitado el número de sujetos con infección por virus de la gripe, se analizan conjuntamente A y B.Test de diagnóstico rápido
Se realizó el test en 197 pacientes (en los otros 6 la muestra era escasa y se empleó para PCR). Tomando como técnica de referencia la PCR, se obtuvo una sensibilidad del 45,5%, una especificidad del 95,4% y, para nuestra prevalencia del 11,2%, un valor predictivo positivo de 55,6% y negativo de 93,3%.
Epidemiología
No se observaron diferencias en cuanto a la distribución del conjunto de los pacientes en los 3 meses del estudio, mientras que es significativamente mayor la proporción de pacientes con gripe en el mes de diciembre, respecto a enero y febrero (test de la chi cuadrado de Pearson para variables de varias categorías, p = 0,009 y test de tendencia lineal, p = 0,006).
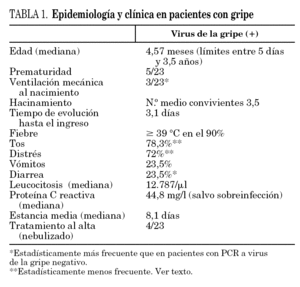
La mediana de edad en el GI fue de 4,87 meses (rango 5 días-3,5 años), siendo 16/23 < 24 meses. No hubo diferencias en la distribución por sexos. El 22% fueron prematuros, frente al 16% en el GnI (diferencia sin significación estadística). Tres de los 23 pacientes del GI (13%) precisaron ventilación mecánica en el período neonatal, frente a 5/180 (2,8%) del GnI (p = 0,05).
Un 85,7% de los pacientes del GI habían recibido lactancia materna y continuaban con dicha alimentación en el momento del ingreso la mitad de ellos. El número medio de convivientes en el GI fue de 3,8 y en aproximadamente el 50% de las ocasiones existía alguno con cuadro catarral o gripal. Datos todos ellos sin significación estadística respecto al GnI.
Clínica y laboratorio
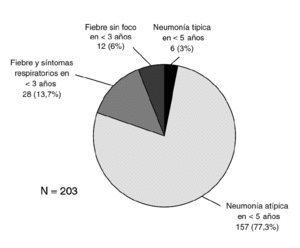
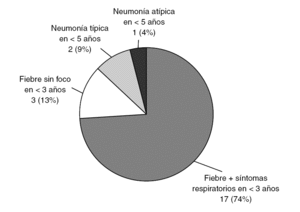
En la figura 5 se representa la distribución del GI en función de los criterios de inclusión en el estudio. Es un dato que hay que considerar que el 13% de ellos ingresaron por fiebre sin foco, todos ellos menores de un mes de vida. Los síntomas más frecuentes se recogen en la tabla 1. La fiebre fue elevada ≥39 °C rectal) en el 90% de los casos. La diarrea fue un síntoma estadísticamente más frecuente en el GI (p = 0,04), al contrario que la tos y la dificultad respiratoria, encontrados con menos frecuencia en este grupo (p = 0,004 y p = 0,016, respectivamente).
Figura 5. Distribución de los pacientes con gripe según los criterios de inclusión en el estudio.
El tiempo medio de evolución de los síntomas hasta el ingreso fue de 3,1 días, similar al GnI. Como complicaciones en los pacientes con gripe del grupo 1.1 (fiebre y dificultad respiratoria) se produjo sobreinfección bacteriana pulmonar en 3 casos, en otro caso se objetivó otitis media aguda y en otro gastroenteritis por rotavirus (nosocomial). Un caso precisó ingreso en cuidados intensivos pediátricos por insuficiencia respiratoria aguda, no requiriendo ventilación mecánica (diferencia estadística no significativa, F exacta de Fisher p = 1,0).
En uno de los dos reingresos que se detectaron, correspondiente a un lactante sin patología crónica de base, se aisló influenza B en la primera ocasión y VRS-A en el reingreso, trascurriendo algo más de una semana entre uno y otro y comportándose clínicamente como bronquiolitis en las dos ocasiones.
En cuanto a datos analíticos, en el GI se observó una leucocitosis discreta (media 12.787/μl), con recuento leucocitario anodino (cifra media de neutrófilos 57,3%) y proteína C reactiva con valor medio de 44,8 mg/l. Los casos en los que se elevaron los reactantes de fase aguda se correspondían con neumonías al ingreso o sobreinfección bacteriana durante la evolución.
La estancia media hospitalaria en el GI fue de 8,1 días (p = 0,7 comparado con GnI). Cuatro de ellos precisaron tratamiento domiciliario con broncodilatadores al alta, lo que supone un 17,4% frente al 34% en el GnI, diferencia no estadísticamente significativa, probablemente por el número reducido de pacientes con gripe.
Factores de riesgo y vacunación
De los 203 pacientes del estudio, 40 tenían antecedentes de enfermedad crónica: 33 pacientes, enfermedad respiratoria (3 displasia broncopulmonar y el resto hiperreactividad bronquial); dos, cardiopatías congénitas con repercusión clínica; 4 pacientes, ambos antecedentes y un último paciente inmunodeficiencia primaria (hiper-IgE) (tabla 2). Únicamente 4 pacientes habían sido vacunados contra la gripe en ese período epidémico y sólo uno tenía factores de riesgo para la vacunación, los otros tres habían sido vacunados por recomendación de su pediatra. Por lo tanto, de los 34 sujetos mayores de 6 meses con factores de riesgo que indicarían la vacunación anual de gripe según las recomendaciones vigentes actualmente en nuestro país, sólo uno había sido vacunado. Esto supone una cobertura del 4,5% entre los pacientes del estudio y únicamente un 2,9% entre los mayores de 6 meses con criterios para la vacunación anual. En ninguno de los sujetos vacunados se aisló virus de la gripe y al contrario, ninguno de los pacientes con gripe había sido vacunado contra la misma. Cinco de los otros 33 pacientes mayores de 6 meses y con factores de riesgo ingresaron por gripe (15%).
Discusión
Los datos obtenidos coinciden con los de otras publicaciones, en las que la incidencia de gripe encontrada es mayor de la supuesta 1,2, con una tasa de hospitalización por esta causa en niños y adolescentes similar a la encontrada en adultos con alto riesgo de complicaciones gripales. En nuestra serie, la proporción de casos de gripe fue del 11,3%, que corresponde a un número no despreciable del total de niños ingresados. No es posible comparar con los resultados de otros trabajos, al ser distintos el diseño, el tamaño muestral, las épocas epidémicas, las áreas geográficas y, sobre todo, el rango de edad de los pacientes estudiados, si bien en todos se concluye que la gripe por influenza es una causa importante de patología en la edad pediátrica. En un análisis finlandés retrospectivo realizado entre 1980 y 1999 en pacientes de 0 a 17 años ingresados 10, se obtuvieron 683 casos positivos a influenza de los 15.420 pacientes estudiados (4,42%). En el Reino Unido 3 la tasa de hospitalización fue del 5,4% entre niños menores de 3 años y en un período de 9 meses (octubre de 2001-junio de 2002). Este porcentaje es mayor, del 33%, en un estudio francés 4, realizado en la época epidémica 2001-2002 en lactantes de 0 a 11 meses. De ellos, un 20% precisó hospitalización. En un estudio español 15, se atribuía a gripe un 4,1% de las hospitalizaciones entre 1991 y 2003 de lactantes con fiebre o procesos respiratorios.
Como en otros trabajos 2,4,10,13-16, se ha encontrado que la infección por virus de la gripe A (especialmente el subtipo H3N2) fue claramente superior al virus de la gripe B (91,3 y 8,7%, respectivamente), si bien estos datos pueden variar en distintas temporadas. En [10], un 79,6% se debió a influenza A; en [4], un 90%. En nuestro estudio se detectaron 2 casos de virus de la gripe B y un H1N1 (resultados comprobados), cuando la Red Centinela Española de Gripe durante la temporada 2003-2004 no detectó ningún caso de virus de la gripe A H1N1 (si bien 269 casos, 34%, no se subtiparon, y tan sólo la red de Aragón detectó 2 casos de virus de la gripe B 22.
Es de reseñar el alto número de coinfecciones (en 11 de los 23 casos de influenza), siendo la asociación más frecuente virus de la gripe A y VRS-A. Esta asociación podría deberse a que comparten el mismo período epidémico o bien a que la coinfección es un factor de riesgo para ingresar. Son precisos más estudios al respecto.
Se encontró una agrupación de casos en diciembre, primer mes del estudio. Esto coincide con los datos de la Red Nacional de Vigilancia Epidemiológica, que registró el pico de máxima incidencia de gripe de la temporada 2003-2004 en España entre la segunda quincena de noviembre y la primera quincena de diciembre 22.
La clínica más frecuente es la misma que la de otros estudios publicados 3-5,10: fiebre, alta y de comienzo generalmente brusco, y síntomas respiratorios. Los pacientes con gripe presentaron síntomas gastrointestinales con mayor frecuencia que en los no casos, la inmensa mayoría con infección por VRS (p < 0,05).
Merece una especial atención el grupo de pacientes ingresados con fiebre sin foco aparente, todos ellos menores de un mes de vida (5-29 días), al ser la gripe la etiología en la mitad de los casos (3/6). De confirmarse esta incidencia durante la época epidémica, sería interesante la realización de tests rápidos con alta especificidad en casos seleccionados, especialmente si algún conviviente está cursando un cuadro gripal, con lo que podrían evitarse pruebas complementarias, tratamientos e ingresos innecesarios. No obstante estos datos han de tomarse con cautela, siendo necesarios estudios más amplios al respecto. De hecho, nuestra experiencia con el test de diagnóstico rápido empleado no ha sido satisfactoria, con una sensibilidad en relación a la PCR muy inferior a la publicada anteriormente 20,21 (inaceptable), por lo que el método no parece muy aconsejable, al menos en nuestras manos. La sensibilidad registrada es algo menor de la que se conseguiría lanzando una moneda al aire. Además, aunque teóricamente es fácil distinguir un test positivo del control de calidad de la prueba, en un número no despreciable de ocasiones nos encontramos con resultados ininterpretables. No obstante, la limitación es la genérica del estudio ya que los casos de gripe son muy pocos.
En los pacientes con gripe no se halló leucocitosis con desviación a la izquierda ni elevación de la proteína C reactiva, siendo estos datos de laboratorio útiles en el diagnóstico de sobreinfección bacteriana. La proteína C reactiva media obtenida en nuestro estudio (obviando los casos de neumonía) es algo mayor a la de otros trabajos: 44,8 mg/dl frente a PCR < 20 mg/dl en el estudio de Peltola 8.
La morbilidad que se intuye a raíz de los datos obtenidos (necesidad de ingreso hospitalario, tratamiento con aerosoles y antibioterapia, etc.) constituye un argumento más para insistir en la vacunación antigripal en pacientes de riesgo. Sin embargo, se viene denunciando que la vacunación anual frente a gripe no se realiza con la seriedad que merece en todos los casos. Por este motivo se está estudiando la idoneidad de la vacunación antigripal universal a partir de los 6 meses, como ya se hiciera en Ontario (Canadá) durante 5 años, que prácticamente duplicó la cobertura vacunal entre pacientes de riesgo 23. Según el Centers for Diseases Control and Prevention (CDC) 24, la cobertura vacunal antigripal es baja en niños, incluso en aquéllos con enfermedades crónicas, como asma, en las que la vacunación anual es recomendada. En España, la cobertura antigripal cruda para todos los sujetos de menos de 65 años con enfermedad crónica apenas supera el 30% 25. La información disponible en niños en nuestro país es prácticamente nula, pero los datos de países en los que las recomendaciones son iguales a las nuestras sugieren un muy bajo cumplimiento: entre el 5 y el 10% en niños con asma 26. En nuestro estudio, únicamente un 2,9% de los pacientes mayores de 6 meses con criterios para la vacunación antigripal la habían recibido (1/34) y 5 de los otros 33 ingresaron por gripe. No se detectó virus de la gripe en ninguno de los sujetos vacunados.
En Estados Unidos, según el CDC 6, el riesgo de infección del tracto respiratorio inferior asociado a la gripe (motivo de ingreso más frecuente en nuestro estudio) es mayor en los niños menores de 2 años (7,8/100 personas-año). Por su parte, Izurieta et al 5 encontraron que los niños con enfermedades crónicas tenían un riesgo de ser hospitalizados por enfermedad respiratoria aguda de 4 a 21 veces mayor que los niños sanos de su misma edad.
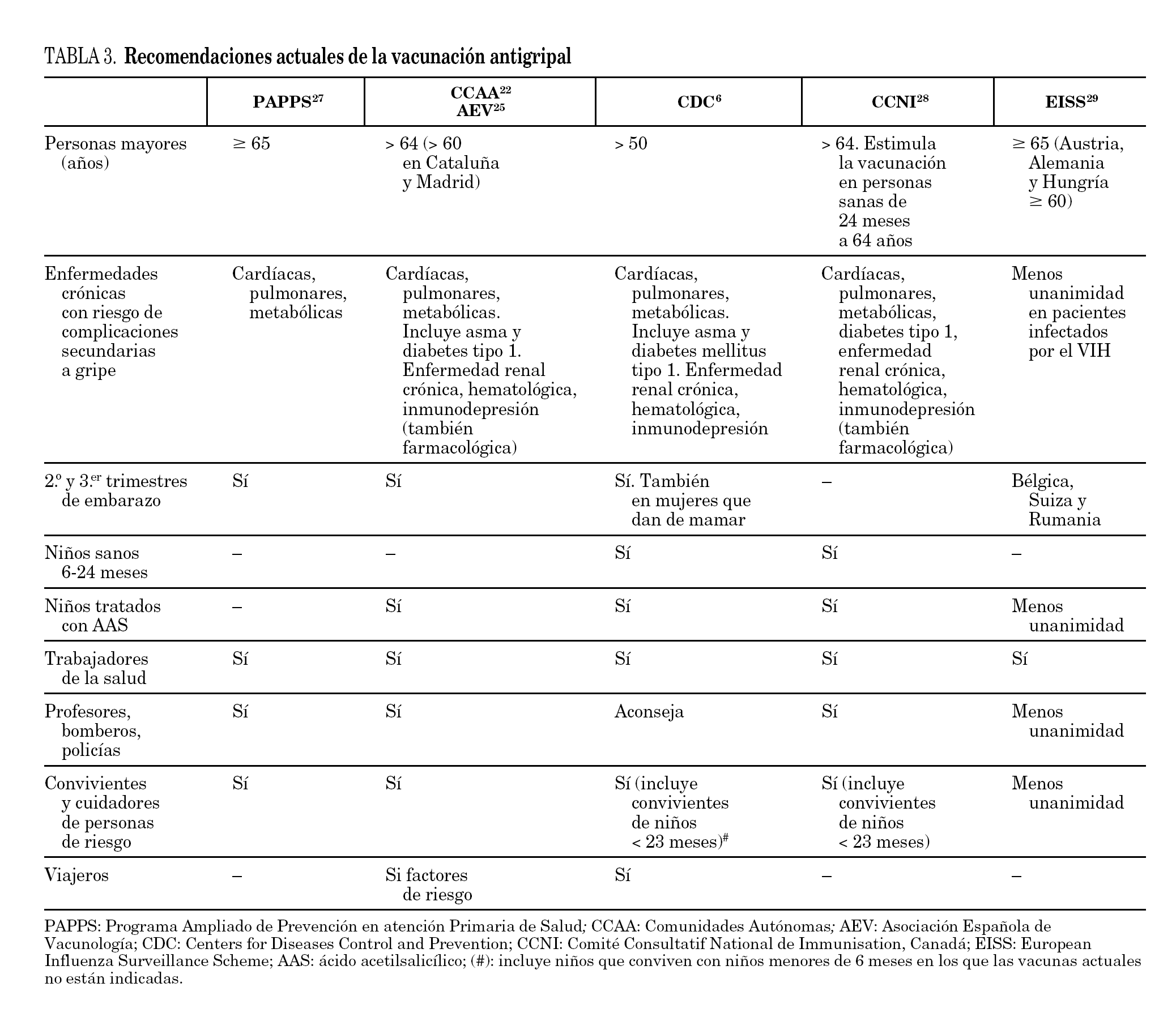
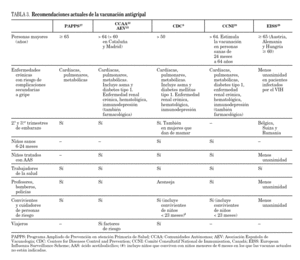
Por esta razón, el Advisory Committee on Immunization Practices (ACIP) y el CDC, aconsejan la vacunación anual de niños sanos entre los 6 y los 23 meses de edad desde el año 2004. Atendiendo a esta recomendación podrían haber sido vacunados un 82,5% de los pacientes (23 pacientes entre 6 y 24 meses más 11 pacientes mayores de 24 meses con factores de riesgo). Pensamos que quizás así se podría haber evitado ingresos. La vacunación entre los 6 y los 23 meses de edad en niños sanos podría ser una medida coste-efectiva al disminuir la gripe en la población pediátrica (con lo que ello supone como se ha ido argumentando), y al reducir la transmisión del virus, disminuyendo la mortalidad en la población de riesgo 26. Sin embargo, esta indicación no está recogida en Europa. En la tabla 3 se especifican las principales diferencias en las indicaciones de vacunación antigripal de las principales sociedades y países 6,22,24-27.
En resumen, y a pesar de que el número de sujetos incluidos en el estudio no es muy numeroso (lo que pudiera condicionar que algunas de las diferencias observadas no tengan significación estadística), con este trabajo se incide en que la gripe en pediatría no siempre es una enfermedad banal, siendo los menores de 24 meses los pacientes con mayor riesgo para hospitalización. La identificación precoz de la enfermedad podría reducir el número de pruebas complementarias (tanto de laboratorio como de imagen), el uso innecesario de antibióticos y el número de hospitalizaciones. Se debería reflexionar acerca de la baja cobertura vacunal en pacientes con factores de riesgo; quizás este estudio sirva para una mayor sensibilización. Por último, pensamos que sería interesante valorar la vacunación antigripal sistemática en niños de 6 a 24 meses. No obstante, son necesarios más estudios, pues probablemente un mejor y mayor conocimiento sobre la gripe entre padres y profesionales de la salud es sin duda una estrategia eficaz para aumentar la cobertura vacunal.
Agradecimientos
Deseamos expresar nuestro agradecimiento al personal médico y de enfermería del hospital, sin cuya dedicación y profesionalidad no hubiera sido posible este trabajo. Agradecemos también a D. Manuel del Álamo Rodríguez su paciencia y colaboración en el análisis estadístico.
El trabajo de campo ha sido financiado por Laboratorios Wyeth.
Estos datos han sido parcialmente expuestos en el 4th World Congress of the World Society for Pediatric Infectious Diseases-WSPID. Varsovia (Polonia), 1 al 4 de septiembre de 2005.
Correspondencia:
Dra. M. Cruz-Cañete.
Unidad de Infectología e Inmunodeficiencias. Hospital Materno-Infantil. Complejo Hospitalario Carlos Haya.
Avda. Arroyo de los Ángeles, s/n. 29011 Málaga. España.
Correo electrónico: macruca@gmail.com
Manuscrito recibido el 28-5-2006; aceptado el 2-10-2006.