La insuficiencia renal aguda es frecuente en pacientes críticos. En aquellos que necesitan depuración extrarrenal, las técnicas contínuas de depuración extrarrenal (TCDE) son una alternativa a la hemodiálisis intermitente cada vez más empleada. En muchas ocasiones, los pacientes críticos presentan una infección, que puede ser causa de shock séptico y del fallo renal. Un tratamiento antibiótico precoz y a dosis adecuadas es fundamental. Staphylococcus aureus resistente a meticilina (SARM) es un patógeno nosocomial frecuente que provoca una eleva morbi-mortalidad en pacientes críticos.
Muchos antibióticos se eliminan de forma significativa por las TCDE, con el riesgo de infradosificación y fracaso terapéutico o aparición de resistencias. El objetivo de esta revisión es analizar la evidencia clínica disponible sobre el comportamiento farmacocinético y las recomendaciones posológicas de los principales grupos de antibióticos empleados en el tratamiento de las infecciones por SARM en pacientes sometidos a técnicas continuas de depuración extrarrenal.
Acute renal failure is frequent in critically ill patients. In those patients who need renal replacement therapy, continuous techniques are an alternative to intermittent haemodialysis. Critically ill patients often have an infection, which can lead to sepsis and renal failure. An early and adequate antibiotic treatment at correct dosage is extremely important. Methicillin resistant Staphylococcus aureus (MRSA) is a frequent nosocomial pathogen that causes a high rate of morbidity and mortality in critically ill patients.
Many antibiotics are easily removed by continuous renal replacement therapies (CRRT) leading to a high risk of under dosing and therapeutic failure or resistance breakthrough. The objective of this review is to assess the clinical evidence on the pharmacokinetics and dosage recommendations of the main antibiotic groups used in MRSA treatment in patients treated with CRRT.
La insuficiencia renal aguda (IRA) es relativamente frecuente en el ámbito hospitalario, sobre todo en los pacientes críticos de las unidades de cuidados intensivos (UCI), y la mortalidad asociada es elevada1,2. Un alto porcentaje de enfermos críticos con IRA que requieren soporte renal no toleran la hemodiálisis intermitente debido, principalmente, a inestabilidad hemodinámica3,4. Las técnicas continuas de depuración extrarrenal (TCDE) permiten una mayor estabilidad hemodinámica al eliminar solutos y volumen de forma más lenta y permiten un control preciso y adaptable de la volemia.
Asimismo, en pacientes críticos son también frecuentes las infecciones nosocomiales, que presentan también una la mortalidad asociada elevada5–7. El inicio tardío de un tratamiento antibiótico apropiado, así como la administración de dosis subóptimas del antibiótico se asocian a una mayor mortalidad8. Staphylococcus aureus resistente a meticilina (SARM) es una causa frecuente de infecciones nosocomiales asociada a una elevada morbilidad y mortalidad9,10.
Los datos referentes a la farmacocinética de fármacos en hemodiálisis convencional no pueden extrapolarse a las TCDE por la naturaleza continua de estas últimas, los diferentes filtros empleados y las diferencias en los flujos de líquidos de diálisis, de ultrafiltrado y de sangre. En general, para que un soluto sea eliminado de forma efectiva por las TCDE deben cumplirse una serie de requerimientos, tales como: (i) eliminarse, en condiciones normales, mayoritariamente por vía renal, (ii) tener un peso molecular (PM) inferior al tamaño de poro de las membranas, (iii) unirse poco a proteínas plasmáticas y (iv) presentar un volumen de distribución bajo (poca distribución a tejidos). El coeficiente de Sieving (Sc) representa la fracción de una determinada molécula que atraviesa una determinada membrana. Si una molécula pasa libremente la membrana tendrá un Sc de 1, y si la membrana es impermeable a una molécula, esta tendrá un Sc de 0.
Como norma general, las TCDE afectan más a antibióticos hidrófilos (β-lactámicos, aminoglucósidos, glicopéptidos) ya que su distribución está limitada al plasma y espacio extravascular y se suelen excretar en gran parte inalterados por vía renal. Sin embargo, estas técnicas no afectan tanto a antibióticos lipófilos (fluoroquinolonas, oxazolidinonas), ya que atraviesan las membranas plasmáticas y presentan un volumen de distribución mucho mayor. Además, los antibióticos lipófilos suelen eliminarse por vías distintas a la renal11. No obstante, existen excepciones a esta asunción.
La hemofiltración continua venovenosa (HFCVV) se basa en convección, donde se extrae una determinada cantidad de plasma y solutos mediante la creación de un gradiente de presión transmembrana. Por el contrario, la hemodiálisis continua venovenosa (HDCVV) depura los solutos por difusión, mecanismo de depuración basado en un movimiento pasivo de solutos a través de la membrana en respuesta a un gradiente de concentración entre la sangre y el líquido de diálisis. La hemodiafiltración continua venovenosa (HDFCVV) utiliza convección y difusión. Al incorporar dos mecanismos de depuración, en general se espera que la HDFCVV sea más efectiva que las otras dos técnicas en la depuración de sustancias. A su vez, la HFCVV se espera más eficaz que la HDCVV.
En todas las técnicas puede darse también el fenómeno de adsorción, por el que la membrana retiene en su superficie determinadas moléculas; es un mecanismo de eliminación de sustancias de menor eficacia pero que puede tener trascendencia clínica.
Un fármaco susceptible de eliminarse por TCDE se eliminará en mayor grado cuanto mayor sea el flujo de efluente, mayor el flujo sanguíneo en el circuito de depuración y mayor la superficie de filtro. En hemodiafiltración, el tipo de reposición (prefiltro o posfiltro) también influye en el rendimiento del tratamiento difusivo. En la reposición prefiltro se disminuye el rendimiento ya que la hemodilución disminuye la concentración de sustancias a eliminar de la sangre que entra en el hemofiltro. Esta pérdida de rendimiento podría tener importancia en tratamientos deplectivos de alto flujo (>35mL/kg/h).
El objetivo de esta revisión es analizar la evidencia clínica disponible sobre el comportamiento farmacocinético y las recomendaciones posológicas de los principales grupos de antibióticos empleados en el tratamiento del SARM en pacientes críticos sometidos a técnicas continuas de depuración extrarrenal.
MétodoSe realizó una búsqueda bibliográfica en Medline de artículos publicados en inglés hasta junio del 2011 sobre vancomicina, teicoplanina, daptomicina, linezolid y cotrimoxazol (antibióticos empleados en el tratamiento del SARM) en pacientes sometidos a hemofiltración, hemodiafiltración o hemodiálisis venovenosa continua. Los términos de búsqueda usados fueron: (i) «hemofiltration», (ii) «hemodiafiltration», (iii) «hemodialysis» y (iv) «vancomycin», «teicoplanin», «daptomycin», «cotrimoxazole», «linezolid». Se consideraron los artículos disponibles a texto completo que aportaban alguna información sobre la farmacocinética de antibióticos por estas técnicas continuas de depuración en pacientes críticos con insuficiencia renal aguda. No se incluyeron estudios in vitro ni en animales. Se descartaron los artículos que aportaban datos en hemodiálisis intermitente y los artículos no escritos en inglés o español. También se excluyeron los artículos que incluían pacientes con insuficiencia renal crónica no críticos y los tratados con otros antibióticos activos frente a S. aureus resistente a meticilina, tales como: tigeciclina, clindamicina y quinupristina/dalfopristina. Tigeciclina no se incluyó en la revisión puesto que se elimina principalmente por heces; su eliminación por vía renal supone<13%12,13. Clindamicina también se elimina mayoritariamente por vía hepática, por lo que su farmacocinética no se ve afectada en pacientes con insuficiencia renal ni en sometidos a técnicas de depuración14. Del mismo modo, la eliminación principal de quinupristina/dalfopristina es por vía hepática (la excreción fecal constituye el 75–77% de la dosis). La excreción urinaria es de 15% de la dosis de quinupristina aproximadamente y un 19% de la de dalfopristina15.
A lo largo de la revisión se emplean las abreviaturas siguientes:
IRA: insuficiencia renal aguda; TCDE: técnicas continuas de depuración extrarrenal; HDFCVV: hemodiafiltración continua venovenosa; HFCVV: hemofiltración continua venovenosa; HDCVV: hemodiálisis continua venovenosa; t1/2: semivida de eliminación; Vd: volumen aparente de distribución; Vss: volumen aparente de distribución en estado de equilibrio estacionario; Clt: aclaramiento corporal total; Clr: aclaramiento renal; Clnr: aclaramiento no renal; ClTCDE: aclaramiento por la TCDE; ClHDFCVV: aclaramiento por la hemodiafiltración continua venovenosa; ClHFCVV: aclaramiento por la hemofiltración continua venovenosa; Clcr: aclaramiento de creatinina; UPP: unión a proteínas plasmáticas; Qr: flujo de reposición; QD: flujo de diálisis; Qef: flujo de efluente; QUF: flujo de ultrafiltrado; AUC: área bajo la curva de concentraciones plasmáticas; Cmin: concentración plasmática mínima; CminSS: concentración plasmática mínima en estado de equilibrio estacionario; Cmax: concentración plasmática máxima; CmaxSS: concentración plasmática máxima en estado de equilibrio estacionario; CMI: concentración mínima inhibitoria; Sc: coeficiente de Sieving; Cp: concentración plasmática; Css: concentración en estado de equilibrio estacionario.
GlicopéptidosLos glicopéptidos teicoplanina y vancomicina son fármacos hidrófilos, con un volumen aparente de distribución bajo y eliminación fundamentalmente por vía renal (Clr aproximadamente el 70% del Clt). La t1/2 de vancomicina en voluntarios sanos es aproximadamente 7-15h, mientras que en pacientes con enfermedad renal terminal se alarga a 140-180h. Se une en un 30% aproximadamente a proteínas plasmáticas y su eliminación es principalmente por vía renal, por lo que es susceptible de eliminarse por TCDE. Su Vd es aproximadamente 0,7L/kg16. Teicoplanina es un glicopéptido con t1/2 más larga (hasta 150h) y mayor UPP respecto a vancomicina (unión aproximada del 90%). Se excreta principalmente en orina, por lo que la insuficiencia renal prolonga su semivida de eliminación y causa acúmulo del fármaco en sangre. Su volumen aparente de distribución y peso molecular son similares a vancomicina17. Son pocos los estudios realizados con glicopéptidos en TCDE, por lo que es arriesgado dar una recomendación de ajuste de dosis, aunque su elevado porcentaje de unión a proteínas plasmáticas hace suponer que su eliminación será escasa.
VancomicinaHemofiltraciónEl ClTCDE de vancomicina supuso aproximadamente el 70% del Clt en dos pacientes anúricos con shock séptico sometidos a HFCVV (Qr: 1,60L/h)18. La cantidad total de vancomicina eliminada por el hemofiltro fue aproximadamente de 250mg en 12 horas. En base a estos resultados, los autores recomendaron una dosis de carga de 15-20mg/kg y una dosis de mantenimiento entre 250-500mg cada 12 horas, siendo la dosis de 250mg/12h necesaria para sustituir la cantidad eliminada por HFCVV y la dosis adicional de 250mg/12h necesaria para sustituir el aclaramiento no renal (dependiendo de factores relacionados con el paciente). Los autores propusieron que la dosis de mantenimiento debería ajustarse según monitorización farmacocinética (tabla 1).
Vancomicina: estudios en TCDE
| Estudios en TCDE | Características TCDE | Parámetros farmacocinéticos en TCDE | Función renal residual | Dosis recomendada |
| Boereboom et al.18(2 pacientes)Paciente 1: dosis única 1gPaciente 2: 500mg/12h, stop durante24 h+250mg/12h x 2 dosis | HFCVV-Flujo sangre: 200mL/min-Qef: 1,6 L/h-Reposición posfiltro-Filtro: PAN 06 (0,6 m2) (poliacrilonitrilo) | Paciente 1Vss: 55,8 Lt1/2: 15,4hClt: 2,5 L/hClTCDE: 1,4 L/hVancomicina eliminada por TCDE: 245mg en 12hSc: 0,89±0,03Paciente 2Vss: 41,7 Lt1/2: 20,3hClt: 1,4 L/hClCVVHF: 1,4 L/hVancomicina eliminada por TCDE: 228mg en 12h.Sc: 0,88±0,03 | Anúricos | Dosis de carga:15-20mg/kgDosis mantenimiento: 250-500mg/12h |
| Macias et al.19 | HFCVV- Flujo sangre: 150mL/min- Qr: 0,5-1 L/h- Reposición prefiltro- Filtro Amicon-20 (0,4 m2)(polisulfona) | Vd: 0,55±0,12L/kg (rango 0,34-0,81 L/kg)Clt: 28,5±6,4mL/min (rango 17,1-36,6mL/min)ClTCDE: 6,7mL/min (Qr 0,5 L/h)/13,3mL/min (Qr 1L/h)Clnr: 16,8±6,8mL/min (primer día), 9,9±9,3mL/min tras 4-6 días. | Anúricos | 750-1.000mg/24h |
| Uchino et al.21 | HFCVV- Flujo sangre: 300mL/min- Qr: 6L/h- Filtro AN69HF (1,6m2)(copolímero de acrilonitrilo y sulfonato metalil sódico) | Clt: 53,9±7,3mL/min y 67,2±11,5mL/minSc: 0,57-0,76 | 500mg/6h o 1g/12h | |
| Chaijamorn et al.20 (7 pacientes) | HFCVV- Flujo sangre: 200-250mL/min- Qr: 0,8-1,2 L/h- Reposición prefiltro- Filtro Sureflux-F 150E (1,5 m2)(triacetato de celulosa) | t1/2: 12,02±7h;Vd: 2469±1,1LClHDFCVV:0,73±0,21L/h (49,4±20,8% del CLt)Clt: 1,59±0,47L/hVancomicina eliminada por HDFCVV durante 12h: 213,9±104mg (20% de la dosis administrada)Sc: 0,71±0,13 | 500-750mg/12h para alcanzar Cminss 15-20mg/L. | |
| DelDot et al.22(10 pacientes)750mg/12h | HDFCVV- Flujo sangre: 200mL/min.- QD: 1 L/h- Qr: 2 L/h- Reposición prefiltro- Filtro AN69HF (0,9 m2)(copolímero de acrilonitrilo y sulfonato metalil sódico) | t1/2: 15,6±8,7hClHDFCVV:1,8±0,4 L/h (30±6,7mL/min, 76±16,5% del CLt)Clt: 2,5±0,7L/h (41,7±11,7mL/min)Vancomicina eliminada por HDFCVV durante 12h: 413±191mg (55±25% de la dosis administrada)Sc: 0,7±0,10 | 450mg/12hpara alcanzarCss 15mg/L. | |
| Santre et al.23(3 pacientes)7,5mg/kg/24h | HDFCVV- Flujo sangre: 100-150mL/min- QD: 1 L/h- Flujo de ultrafiltración10mL/min (470mL/h)- Filtro AN69S (0,6m2)(copolímero de acrilonitrilo y sulfonato metalil sódico) | Cmax: 27,3mg/L (15,6-45,6mg/L)Cmin: 3,6mg/L (2,6-4,5mg/L)t1/2: 13,9±0,68hVss: 47,3±6,4LClt: 38,9±4,3mL/minClTCDE: 4,2±1,3mL/min (5-15% del Clt) | 0mL/24h (n=1)146mL/24h (n=1)4560mL/24h (n=1) | 7,5mg/kg/12h |
Macias et al. determinaron de forma prospectiva el perfil farmacocinético de vancomicina en 10 pacientes anúricos con IRA sometidos a HFCVV19. Los parámetros farmacocinéticos de vancomicina tras la primera dosis fueron los siguientes: Clt 28,5±6,4mL/min (intervalo: 17,1-36,6mL/min); ClHFCVV 6,7mL/min (flujo de ultrafiltración de 0,5L/h) o 13,3mL/min (flujo de ultrafiltración de 1 L/h); Clnr 16,8±6,8mL/min;Vd 0,55±0,12L/kg (intervalo: 0,34-0,81L/kg). En 3 pacientes se obtuvieron nuevas muestras 4-6 días tras las muestras iniciales y se observó que el Clnr disminuyó a 9,9±9,3mL/min (disminución significativa a medida que aumentaron los días en HFCVV). En base a los parámetros obtenidos y deseando unos valores de Cmax entre 25-35mg/L y Cmin entre 8-12mg/L, los autores recomendaron una dosis de 750mg/24h en 4 pacientes, 1g/24h en 4 pacientes y 1.500mg/48h en 2 pacientes.
Chaijamorn et al. obtuvieron resultados similares en 7 pacientes críticos con IRA en HFCVV (ClHFCVV 12,11±3,5mL/min con un flujo de ultrafiltración de 0,8-1,2 L/h; Clt 26,5±7,8mL/min;Vd 0,38±0,18L/kg)20. Los valores de Cmin objetivo fueron entre 15 y 20mg/L (superiores a los deseados por Macias et al.), por lo que en intervalo posológico recomendado por los autores fue cada 12 horas (dosis recomendada 500-750mg/12h).
Uchino et al. determinaron la eliminación de vancomicina en 7 pacientes con shock séptico y disfunción multiorgánica sometidos a HFCVV de alto flujo (Qr: 6 L/h, flujo sanguíneo: 300mL/min)21. El Sc fue 0,76±0,11 cuando todo el flujo de reposición se administró prefiltro y disminuyó a 0,57±0,15 cuando toda la reposición se aplicó posfiltro. El ClHFCVV fue 53,9±7,3mL/min cuando toda la reposición se administró prefiltro y alcanzó un valor máximo de 67,2±11,5mL/min cuando 2 L/h de líquido de reposición se administraron prefiltro y 4 L/h posfiltro. Estos valores son cercanos al Clr de vancomicina en pacientes con función renal normal, por lo que los autores recomendaron dosis de 500mg/6h o 1g/12h en pacientes con shock séptico y HFCVV de alto flujo.
HemodiafiltraciónDelDot et al. determinaron la farmacocinética de vancomicina, tras una dosis de 750mg cada 12 horas, en diez pacientes críticos con IRA sometidos a HDFCVV22. La cantidad de vancomicina eliminada por HDFCVV durante un período de 12 horas fue 413±191mg, que representó el 55±25% de la dosis administrada. La eliminación de vancomicina por HDFCVV fue 1,8±0,4L/h (30±6,7mL/min), que representó el 76±16,5% de la eliminación corporal total (41,7mL/min). De media, el 60±10% de la primera dosis se eliminó durante un período de 12 horas. El Sc para vancomicina fue 0,7±0,10. Los autores propusieron la dosis de 450mg/12h para alcanzar concentraciones medias en plasma en equilibrio estacionario de 15mg/L (tabla 1).
En otro estudio, tres pacientes críticos con IRA sometidos a HDFCVV recibieron una dosis de vancomicina de 7,5mg/kg/24h (infusión de 60 minutos)23. La concentración de vancomicina 1 hora post infusión fue 27,3mg/L (intervalo 15,6-45,6mg/L). La Cmin observada antes de la siguiente dosis fue 3,6mg/L (intervalo 2,6-4,5mg/L). La t1/2 fue 13,9±0,68h. El Vd fue 47,4±6,4L. El Clt de vancomicina fue 38,9±4,3mL/min. El ClHDFCVV representó el 5-15% del Clt. En base a los resultados de este estudio, los autores propusieron una dosis de vancomicina de 7,5mg/kg cada 12h para alcanzar concentraciones plasmáticas medias en estado de equilibrio estacionario de aproximadamente 15mg/L.
TeicoplaninaEn tres pacientes anúricos sometidos a HDFCVV tratados con 400mg/día de teicoplanina, los parámetros Vd y t1/2 en estado de equilibrio estacionario fueron 1,23±0,77L/kg y 78,6±12,6h, respectivamente24. La t1/2 fue superior a la observada en voluntarios sanos (41-62h), pero inferior a la observada en pacientes con insuficiencia renal crónica (157-567h). La eliminación por hemodiafiltración supuso aproximadamente el 30% del Clt de teicoplanina (3,46±1,1mL/min respecto a 11,3±9,1mL/min). El Clt fue ligeramente inferior al observado en voluntarios sanos (11,3 vs. 14,7mL/min). Las características de la TCDE fueron las siguientes: filtro FB-150 F 1,5m2 (triacetato de celulosa), flujo sanguíneo 105±5mL/min, Qr 135mL/h, QD 75mL/h y reposición postfiltro. Los autores recomendaron la monitorización de las concentraciones plasmáticas de teicoplanina, puesto que en una simulación farmacocinética se recomendaron dosis muy variables para mantener CminSS 10-20mg/L (200mg cada 48h en dos casos, 400/24h en otro caso).
Bellmann et al. obtuvieron resultados diferentes en 4 pacientes críticos con insuficiencia renal aguda o crónica sometidos a HFCVV (características de la técnica: filtro Aquamax® HF 12, 1,2m2 de polisulfona, flujo sanguíneo 180mL/min, flujo de ultrafiltración 35mL/kg/h, reposición pre y posfiltro)25. Los pacientes recibieron una dosis de carga de 1.200mg, seguida de dosis diarias de mantenimiento de 1.200±424mg. Los valores de CmaxSS y CminSS de teicoplanina fueron 81,28±28,55mg/L y 21,3±5,6mg/L, respectivamente. El Vd fue 0,48±0,09L/kg y la t1/2 35,1±12,3h, valores similares a los descritos en voluntarios sanos. La eliminación de teicoplanina por hemofiltración (7,07±4,6mL/min) supuso el 54,7±26,5% del Clt de teicoplanina. El Sc de teicoplanina fue 0,17±0,07. Los autores concluyeron que son necesarias dosis diarias de mantenimiento elevadas similares a pacientes sin fallo renal para alcanzar Cmin de 15-25mg/L. No obstante, ante la elevada variabilidad interindividual, recomendaron realizar monitorización de las concentraciones plasmáticas de teicoplanina en pacientes sometidos a TCDE.
Pea et al. estudiaron la eliminación de teicoplanina durante HFCVV en un paciente con sepsis de origen abdominal y fallo multiorgánico (características de la técnica: filtro AN69® HF, 0,9m2 de acrilonitrilo y sulfonato metalil sódico, Qr 2 L/h, reposición prefiltro, flujo sanguíneo 150mL/min)26. La dosis recibida inicialmente por el paciente fue 11,42mg/kg. El paciente inició HFCVV el día 9 de tratamiento con teicoplanina debido a fallo renal. La Cmin de teicoplanina determinada el día 6 fue de 22,79mg/L. La Cmin de teicoplanina determinada el primer día de hemofiltración fue 18,52mg/L, menor que la determinada antes de iniciar la técnica. A partir del segundo día de hemofiltración, la velocidad del líquido de reposición (prefiltro) y el flujo sanguíneo se modificaron a 1L/h y 100mL/min, respectivamente. La Cmin al tercer día fue elevada (26,17mg/L), por lo que se disminuyó la dosis de teicoplanina a la mitad de forma empírica (5,71mg/kg). Se observó una disminución del 40% en las concentraciones séricas mínimas al quinto día (15,69mg/L). El Sc varió entre 0,13 y 0,17. El paciente presentó una evidente hipoalbuminemia (2,12–2,43g/L). Para evitar una posible infradosificación, se aumentó de nuevo la dosis a 8,57mg/kg/día, pero la CminSS continuó disminuyendo hasta que se paró la hemofiltración el séptimo día, probablemente como consecuencia de la hipoalbuminemia (mayor cantidad de teicoplanina libre en plasma por lo que está disponible para eliminarse por el hemofiltro). Tras interrumpir la hemofiltración, la Cmin aumentó. En este estudio, no se determinó directamente el ClTCDE. Los autores recomendaron la monitorización de concentraciones plasmáticas de teicoplanina en pacientes sometidos a hemofiltración.
DaptomicinaPor sus características (peso molecular de 1.620,67daltons, Vd bajo 0,06-0,15L/kg y excreción del 54% por vía renal de forma inalterada), daptomicina es susceptible de eliminarse por TCDE, a pesar de que su UPP es elevada (92%).
En un estudio en 15 voluntarios sanos, la Cmax de daptomicina tras una dosis de 6mg/kg administrada en infusión de 30 minutos fue de 88,4mg/L. Esta concentración aumentó a 94,7mg/L cuando el antibiótico se administró en forma de bolus de 2 minutos27. El valor medio de t1/2 fue 8,7h en ambos grupos. El Clt de daptomicina fue aproximadamente 7-9mL/h/kg y su Clr 4-7mL/h/kg.
En una sesión de hemodiálisis convencional, se eliminó el 15% de la dosis. Tras 48h de diálisis peritoneal continua se eliminó un 11% de la dosis28.
Kielstein et al. estudiaron la farmacocinética de daptomicina en diez pacientes críticos anúricos con IRA sometidos a diálisis extendida (diálisis de alto flujo con filtro F60S de polisulfona y superficie 1,3m2, flujo de sangre y de dializado 160mL/min, duración media 456±13 minutos)29. Los pacientes recibieron una dosis única de daptomicina (6mg/kg, infusión de 30 minutos, 8 horas antes del inicio de la hemodiálisis extendida). El aclaramiento plasmático de daptomicina por hemodiálisis fue 63±9mL/min. La t1/2 de daptomicina durante la diálisis extendida fue comparable a la presentada por individuos sanos (8±1,8h período diálisis vs. 7,8±1h en voluntarios sanos). La cantidad total de daptomicina recogida en el dializado fue 116±27mg, que equivale a 23,3% de la dosis total de la daptomicina administrada. La concentración plasmática de daptomicina 30 minutos después de finalizar la hemodiálisis aumentó un 31% respecto a los valores al final de la hemodiálisis. Los autores concluyeron que este aumento podría deberse a un desequilibrio en la distribución del antibiótico entre diferentes compartimientos corporales (desde el espacio intracelular al extracelular).
Vilay et al. determinaron la farmacocinética de daptomicina en ocho pacientes críticos anúricos en tratamiento con hemodiálisis continua venovenosa (8mg/kg/48h en seis pacientes, 7mg/kg/48h en dos pacientes)30. Las características de la TCDE fueron las siguientes: filtro Optiflux F160 NR de polisulfona, superficie 1,5m2, QD 26±4mL/kg/h, Qr 4-9mL/kg/h, Qef 33±5mL/kg/h. La CmaxSS de daptomicina fue 93mg/L y la CminSS 5mg/L. El Vss fue 0,23±0,14L/kg, superior al presentado por voluntarios sanos. La fracción libre de daptomicina fue 17,5±5%, también ligeramente superior a la descrita en voluntarios sanos. El Sc fue 0,14±0,05, similar a la fracción no unida a proteínas plasmáticas. El ClTCDE fue 6,3±2,9mL/min, y el Clt 11,3±4,7mL/min. No se observaron efectos adversos asociados a daptomicina. Los autores concluyeron que dosis de 8mg/kg/48h en pacientes críticos sometidos a hemodiálisis continua proporcionaban una buena exposición del fármaco, con CmaxSS de aproximadamente 100mg/L, suficientemente altas para maximizar la actividad concentración dependiente de daptomicina y sin causar toxicidad.
LinezolidLinezolid es un antibiótico bacteriostático con efecto antibacteriano significativo frente a la mayoría de patógenos gram-positivos.
Tras la administración intravenosa de 600mg dos veces al día, las CmaxSS y CminSS plasmáticas medias de linezolid en voluntarios sanos determinadas en estado de equilibrio estacionario fueron de 15,1 y 3,6mg/L, respectivamente. Su Vss en adultos sanos es de 40-50L y se aproxima al agua corporal total. Su UPP es aproximadamente del 31%31.
La eliminación extrarenal representa aproximadamente el 65% de la eliminación total de linezolid32. No obstante, debido a sus propiedades farmacocinéticas (distribución limitada al espacio extracelular, baja UPP y bajo peso molecular), linezolid es susceptible de eliminarse por TCDE. En la tabla 2 se resumen los estudios realizados con linezolid en TCDE.
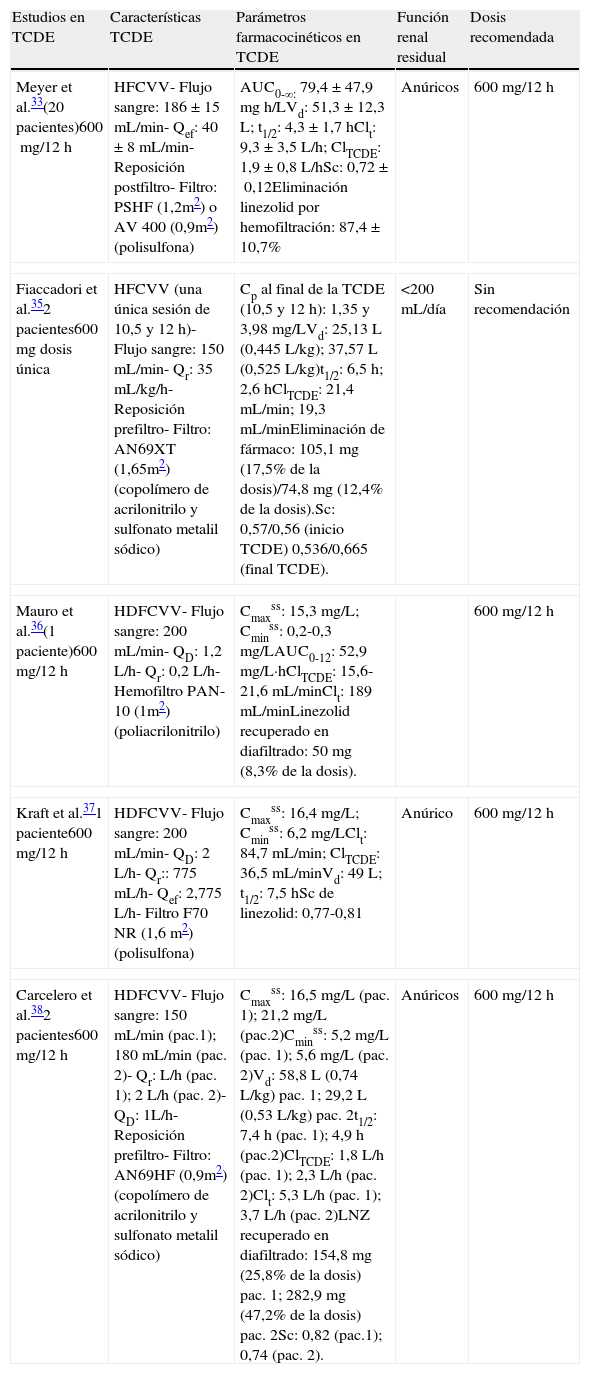
Linezolid: estudios en TCDE
| Estudios en TCDE | Características TCDE | Parámetros farmacocinéticos en TCDE | Función renal residual | Dosis recomendada |
| Meyer et al.33(20 pacientes)600mg/12h | HFCVV- Flujo sangre: 186±15mL/min- Qef: 40±8mL/min- Reposición postfiltro- Filtro: PSHF (1,2m2) o AV 400 (0,9m2) (polisulfona) | AUC0-∞: 79,4±47,9mgh/LVd: 51,3±12,3L; t1/2: 4,3±1,7hClt: 9,3±3,5L/h; ClTCDE: 1,9±0,8L/hSc: 0,72±0,12Eliminación linezolid por hemofiltración: 87,4±10,7% | Anúricos | 600mg/12h |
| Fiaccadori et al.352 pacientes600mg dosis única | HFCVV (una única sesión de 10,5 y 12h)- Flujo sangre: 150mL/min- Qr: 35mL/kg/h- Reposición prefiltro- Filtro: AN69XT (1,65m2) (copolímero de acrilonitrilo y sulfonato metalil sódico) | Cp al final de la TCDE (10,5 y 12h): 1,35 y 3,98mg/LVd: 25,13 L (0,445L/kg); 37,57 L (0,525L/kg)t1/2: 6,5h; 2,6hClTCDE: 21,4mL/min; 19,3mL/minEliminación de fármaco: 105,1mg (17,5% de la dosis)/74,8mg (12,4% de la dosis).Sc: 0,57/0,56 (inicio TCDE) 0,536/0,665 (final TCDE). | <200mL/día | Sin recomendación |
| Mauro et al.36(1 paciente)600mg/12h | HDFCVV- Flujo sangre: 200mL/min- QD: 1,2 L/h- Qr: 0,2 L/h- Hemofiltro PAN-10 (1m2) (poliacrilonitrilo) | Cmaxss: 15,3mg/L;Cminss: 0,2-0,3mg/LAUC0-12: 52,9mg/L·hClTCDE: 15,6-21,6mL/minClt: 189mL/minLinezolid recuperado en diafiltrado: 50mg (8,3% de la dosis). | 600mg/12h | |
| Kraft et al.371 paciente600mg/12h | HDFCVV- Flujo sangre: 200mL/min- QD: 2 L/h- Qr:: 775mL/h- Qef: 2,775 L/h- Filtro F70 NR (1,6 m2) (polisulfona) | Cmaxss: 16,4mg/L;Cminss: 6,2mg/LClt: 84,7mL/min; ClTCDE: 36,5mL/minVd: 49 L; t1/2: 7,5hSc de linezolid: 0,77-0,81 | Anúrico | 600mg/12h |
| Carcelero et al.382 pacientes600mg/12h | HDFCVV- Flujo sangre: 150mL/min (pac.1); 180mL/min (pac. 2)- Qr: L/h (pac. 1); 2 L/h (pac. 2)- QD: 1L/h- Reposición prefiltro- Filtro: AN69HF (0,9m2)(copolímero de acrilonitrilo y sulfonato metalil sódico) | Cmaxss: 16,5mg/L (pac. 1); 21,2mg/L (pac.2)Cminss: 5,2mg/L (pac. 1); 5,6mg/L (pac. 2)Vd: 58,8 L (0,74L/kg) pac. 1; 29,2 L (0,53L/kg) pac. 2t1/2: 7,4h (pac. 1); 4,9h (pac.2)ClTCDE: 1,8 L/h (pac. 1); 2,3 L/h (pac. 2)Clt: 5,3 L/h (pac. 1); 3,7 L/h (pac. 2)LNZ recuperado en diafiltrado: 154,8mg (25,8% de la dosis) pac. 1; 282,9mg (47,2% de la dosis) pac. 2Sc: 0,82 (pac.1); 0,74 (pac. 2). | Anúricos | 600mg/12h |
Meyer et al. estudiaron la farmacocinética de linezolid en veinte pacientes críticos anúricos con IRA sometidos a HFCVV (reposición posfiltro) y tratados con 600mg/12h33. Aproximadamente un 20% de la dosis de linezolid se eliminó en gran medida por la HFCVV. Los valores de CmaxSS de linezolid fueron comparables a las concentraciones observadas en pacientes sanos y en pacientes sometidos a hemodiálisis. Los valores de t1/2, AUC y Vd también fueron comparables a los descritos en voluntarios sanos (4,3±1,7h, 79,4±47,9mgh/L y 51,3±12,3L, respectivamente). Sin embargo, los valores de CminSS fueron un 50% menores que en condiciones normales. El Clt de linezolid fue 9,3±3,5L/h (25% mayor que en pacientes con función renal normal) y el ClTCDE fue 1,9±0,8L/h. El Sc fue 0,72±0,12. La eliminación total del antibiótico durante la hemofiltración fue del 87,4±10,7%. Ante esta elevada eliminación de fármaco los autores concluyeron que podría ser necesario aumentar la dosis en el tratamiento de infecciones causadas por bacterias con sensibilidad reducida a linezolid.
En otro estudio, dos pacientes críticos con IRA e infección intraabdominal grave sometidos a HFCVV recibieron linezolid 600mg/12h34. El ClTCDE fue 23,4mL/min (similar al Clr en voluntarios sanos) y el Sc fue alto (0,84). Los valores de Cmax mostraron una alta variabilidad, ya que fueron muy diferentes entre los dos pacientes estudiados (40,26 y 17,08mg/L). Los autores afirmaron que esta diferencia podría explicarse porque la HFCVV se aplicó en el primer paciente solo durante 24h antes del estudio, mientras que el segundo paciente llevaba 27 días en hemodilafiltración. La cantidad de linezolid eliminada durante 12 horas también varió de manera significativa entre los dos pacientes (314mg y 160mg). La t1/2 (paciente 1: 18,48h; paciente 2: 12,54h) fue mayor que la descrita en el estudio de Meyer et al. en pacientes sometidos a HFCVV. Los autores concluyeron que 600mg/12h es la dosis adecuada en pacientes sometidos a HFCVV.
Fiaccadori et al. estudiaron la farmacocinética de linezolid en dos pacientes críticos con IRA sometidos a HFCVV durante 10,5 y 12h35. Los pacientes recibieron una dosis de linezolid una hora antes de iniciar el tratamiento de soporte renal. Las concentraciones plasmáticas al final de la hemofiltración (10,5 y 12h) fueron 1,35 y 3,98mg/L, respectivamente. En 12 horas se eliminó el 17,5% de la dosis (105,1mg) y en 10,5h se eliminó el 12,4% de la dosis (74,8mg). La t1/2 de linezolid durante la hemofiltración en los dos pacientes estudiados fue 6,5 y 2,6h, respectivamente. Estos valores son muy similares a los valores observados en pacientes con función renal normal.
HemodiafiltraciónMauro et al. estudiaron la eliminación de linezolid por HDFCVV en un paciente de 33 años con fascitis necrotizante e insuficiencia renal crónica agudizada36. El paciente recibió linezolid 600mg/12h por una infección urinaria causada por Enterococcus faecium resistente a vancomicina. No se determinó la CMI de la bacteria para linezolid. El Clt (180mL/min) fue mayor que en voluntarios sanos (123mL/min), probablemente debido al peso corporal elevado del paciente (125kg). La CmaxSS (15,3mg/L) fue similar a la presentada por voluntarios sanos (aproximadamente 15mg/L), pero la CminSS (0,2-0,3mg/L) fue inferior (valor en voluntarios sanos 3,6mg/L). El AUC0-12 fue 52,9mg/L·h. La eliminación de linezolid por HDFCVV supuso solo el 8% de la eliminación total del fármaco. La cantidad de linezolid recuperada en el diafiltrado fue de 50mg. El flujo de efluente fue bajo (1,4L/h), lo que puede explicar la baja eliminación por hemodiafiltración. Ante la baja eliminación de linezolid por el hemofiltro los autores concluyeron que no son necesarias dosis extras de linezolid en pacientes sometidos a HDFCVV.
Kraft et al. hallaron resultados diferentes en un paciente crítico de 85 años con IRA anúrico sometido a HDFCVV37. La CmaxSS fue 16,4mg/L y la CminSS 6,2mg/L. En base a estos resultados los autores concluyeron que no es necesario modificar la dosis de linezolid en HDFCVV.
Carcelero et al. determinaron la farmacocinética de linezolid en dos pacientes críticos con anuria por IRA sometidos a HDFCVV38. Los valores de Cmax en ambos pacientes fueron similares a los descritos en voluntarios sanos y a los descritos por Mauro et al. y Kraft et al. en pacientes con hemodiafiltración. No obstante, los valores de Cmin en ambos pacientes fueron mayores a los descritos en voluntarios sanos, probablemente debido a la insuficiencia renal. La cantidad total de linezolid eliminada por hemodiafiltración fue 154,8mg en el primer paciente (25,8% de la dosis) y 282,9mg en el segundo (47,2% de la dosis). La diferencia entre los dos pacientes probablemente se debe al mayor flujo de efluente en el segundo paciente (3L/h vs. 2L/h). La eliminación por hemodiafiltration (ClHDF) supuso el 34 y el 63% de la eliminación total del antibiótico en los pacientes 1 y 2, respectivamente, valores similares al descrito por Kraft et al. (43%) y al Clr de linezolid observado en pacientes con función renal normal (35-40% del Clt). El coeficiente de sieving (Sc) fue alto y similar en ambos pacientes (0,82 y 0,74).
CotrimoxazolUn 10-30% de sulfametozaxol (SMX) y un 50-70% de trimetoprim (TMP) se eliminan por el riñón como fármacos inalterados. En pacientes con insuficiencia renal se recomienda reducir la dosis de estos fármacos y/o prolongar el intervalo posológico. En un estudio en dos pacientes con insuficiencia renal aguda sometidos a HDFCVV los dos fármacos se eliminaron de forma significativa por hemodiafiltración39. El ClHDFCVV de TMP (21,5-28,9mL/min) estaba en el límite bajo del Clr descrito para pacientes con función renal normal (20-80mL/min); el ClHDFCVV de SMX (42,6mL/min; 26,7mL/min) excedió el Clr en pacientes con función renal normal (1-5mL/min). Asi pues, en pacientes críticos sometidos a HDFCVV, probablemente sean necesarias dosis plenas de SMX/TMP para asegurar concentraciones terapéuticas.
DiscusiónSon muchos los factores a tener en cuenta al analizar este tipo de estudios para poder evaluar su comparabilidad. A menudo pueden encontrarse resultados diferentes en dos estudios con la misma técnica, y ello es debido a variaciones en los filtros empleados, en los flujos, en el modo de administración del líquido de reposición (pre o posfiltro), en la diuresis residual del paciente, etc. En general, la eliminación de fármacos susceptibles de ser eliminados por TCDE es mayor cuanto mayor es el flujo de líquido de diálisis y/o reposición; también es mayor a mayor superficie de hemofiltración y a mayor flujo sanguíneo.
En relación a vancomicina, los valores de ClTCDE y Clt en el estudio de Boereboom et al. (HFCVV) fueron menores (23,3 y 32,5mL/min, respectivamente) a los hallados por DelDot et al. (HDFCVV; 30 y 41,7mL/min), mientras que las características de la técnica de depuración (hemofiltro, flujos) fueron similares18,22. En el estudio de Chaijamorn et al. (HFCVV) estos valores fueron también menores (12,11 y 26,5mL/min)20. En el estudio de DelDot et al., aproximadamente el 60% de la dosis se eliminó por la TCDE, este porcentaje se redujo al 20% en el estudio de Chaijamorn et al. De esta comparación podría concluirse que la hemodiafiltración es una técnica más eficaz que la hemofiltración en la eliminación de vancomicina. En el estudio de Santre et al. el flujo de ultrafiltración fue muy inferior al flujo del estudio de DelDot et al. (470mL/h vs. 2.000mL/h), hecho que puede explicar el menor ClTCDE (4,17mL/min vs. 30mL/min)22,23.
Respecto a las dosis de vancomicina recomendadas en TCDE, estas fueron inferiores a las dosis empleadas en pacientes con función renal normal; no obstante variaron entre estudios (500mg/12h, 750mg/12h, 750-1.000mg/24h), debido a las diferencias entre las técnicas y a las diferentes concentraciones objetivo. Así pues, es difícil dar una recomendación. Podría recomendarse un intervalo posológico de 12 horas si se pretende alcanzar CminSS de 15-20mg/L, mientras que el intervalo de 24 horas se recomendaría para obtener CminSS inferiores. La monitorización de concentraciones plasmáticas es útil para garantizar las concentraciones óptimas.
En los estudios realizados con teicoplanina, el flujo de efluente fue mucho mayor en el estudio de Bellmann et al. (2,5L/h) respecto al estudio de Yagasaki et al. (0,2L/h), por lo que puede explicar la mayor eliminación de antibiótico por la TCDE (54,7±26,5% del Clt de teicoplanina respecto al 30% del Clt)24,25. Los flujos de efluente empleados actualmente son mucho mayores a los del estudio de Yagasaki et al., por lo que hoy por hoy sus resultados son de poca aplicabilidad. Tan solo se dispone de un artículo donde las condiciones de la TCDE son iguales o similares a las empleadas en nuestro medio, por lo que no pueden darse recomendaciones generales de dosis. La monitorización de las concentraciones plasmáticas de teicoplanina en pacientes sometidos a TCDE sería adecuada para asegurar su eficacia terapéutica.
Son necesarios más estudios de daptomicina en pacientes sometidos a TCDE, puesto que tan solo se ha publicado un estudio en hemodiálisis continua30. Según dicho estudio, 8mg/kg/48h proporciona CmaxSS de aproximadamente 100mg/L suficientemente altas para maximizar la actividad concentración dependiente de daptomicina y CminSS inferiores a 10mg/L (7,2±5,2mg/L), que evitarían toxicidad muscular. No se han encontrado en la literatura estudios realizados en pacientes sometidos a hemodiafiltración ni hemofiltración.
Se han realizado pocos estudios farmacocinéticos de linezolid en pacientes sometidos a TCDE. Los resultados obtenidos hasta el momento sugieren que no es necesario modificar la dosis de 600mg/12h. Estos datos han sido corroborados en dos casos clínicos evaluados por nuestro grupo, en los que se observó que no era preciso modificar la dosis de fármaco en pacientes críticos sometidos a HDFCVV38.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.