Actualizar las recomendaciones sobre alteraciones metabólicas y riesgo cardiovascular en pacientes con infección por el VIH.
MétodosEste documento ha sido consensuado por un panel de expertos de GEAM, de la SPNS y de GESIDA tras revisar los resultados de eficacia y seguridad de ensayos clínicos, estudios de cohortes y de farmacocinética publicados en revistas biomédicas (PubMed y Embase) o presentados a congresos. La fuerza de la recomendación y la gradación de su evidencia se basan en los criterios del sistema GRADE.
ResultadosSe recomienda un estilo de vida saludable, no fumar y realizar al menos 30min de ejercicio aeróbico al día. En los pacientes diabéticos se recomienda utilizar el mismo algoritmo terapéutico que en la población no VIH. Los pacientes VIH con dislipidemia deben ser considerados como mínimo de alto riesgo cardiovascular, por lo que su objetivo terapéutico será cLDL menor de 100mg/dl. Los antihipertensivos de las familias IECA y ARAII son los mejor tolerados y con menor riesgo de interacciones. Se recomienda descartar esteatosis hepática en pacientes diabéticos o con síndrome metabólico y con elevación de transaminasas sin etiología definida. Se actualizan así mismo las recomendaciones de actuación en alteraciones hormonales.
ConclusionesEn este nuevo documento se actualizan las recomendaciones previas respecto a todas las alteraciones metabólicas que intervienen en el riesgo cardiovascular. Así mismo se incluyen las alteraciones hormonales y su manejo, y la repercusión hepática de las alteraciones metabólicas.
This consensus document is an update of metabolic disorders and cardiovascular risk (CVR) guidelines for HIV-infected patients.
MethodsThis document has been approved by an expert panel of GEAM, SPNS and GESIDA after reviewing the results of efficacy and safety of clinical trials, cohort and pharmacokinetic studies published in biomedical journals (PubMed and Embase) or presented in medical scientific meetings. Recommendation strength and the evidence in which they are supported are based on the GRADE system.
ResultsA healthy lifestyle is recommended, no smoking and at least 30min of aerobic exercise daily. In diabetic patients the same treatment as non-HIV infected patients is recommended. HIV patients with dyslipidemia should be considered as high CVR, thus its therapeutic objective is an LDL less than 100mg/dL. The antihypertensive of ACE inhibitors and ARAII families are better tolerated and have a lower risk of interactions. In HIV-patients with diabetes or metabolic syndrome and elevated transaminases with no defined etiology, the recommended is to rule out a hepatic steatosis Recommendations for action in hormone alterations are also updated.
ConclusionsThese new guidelines update previous recommendations regarding all those metabolic disorders involved in CVR. Hormone changes and their management and the impact of metabolic disorders on the liver are also included.
La importancia de las alteraciones en el metabolismo hidrocarbonado y lipídico, y su repercusión en aparatos y sistemas en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH), requiere un estudio particularizado y una actualización continuada.
El objetivo del presente documento es aportar información práctica desde el punto de vista asistencial, relativo a las principales alteraciones metabólicas que se producen en la infección por el VIH con el fin de proporcionar estrategias de tratamiento adecuadas a cada paciente y servir de herramienta de consulta para todos los profesionales que atienden a pacientes con infección por el VIH y que pueden presentar o presentan alguna de las alteraciones metabólicas recogidas en este documento.
El documento va dirigido a todos los profesionales que trabajan en la práctica clínica en el ámbito del VIH.
MetodologíaPara la elaboración de este documento se constituyó un grupo de expertos compuesto por especialistas en medicina interna, endocrinología y nutrición y pediatría con experiencia en el ámbito del VIH, actuando 3 miembros del panel como coordinadores. Cada miembro del panel ha aceptado participar de forma voluntaria y altruista.
Cada redactor realiza una revisión de la evidencia científica (última revisión, diciembre de 2013) disponible de cada uno de los aspectos que se incluyen en el documento, y con ella escribe su capítulo, que es discutido y revisado por el revisor asignado. Una vez compilado el documento, se remite a todos los miembros del panel para su discusión. Posteriormente se realiza una reunión de consenso de todo el panel y se somete a la revisión externa, exponiéndose durante un periodo de tiempo en la Web de las entidades promotoras para que los profesionales a los que va dirigido y cualquier persona interesada puedan sugerir matices o cambios, decidiendo el panel a posteriori su inclusión o no.
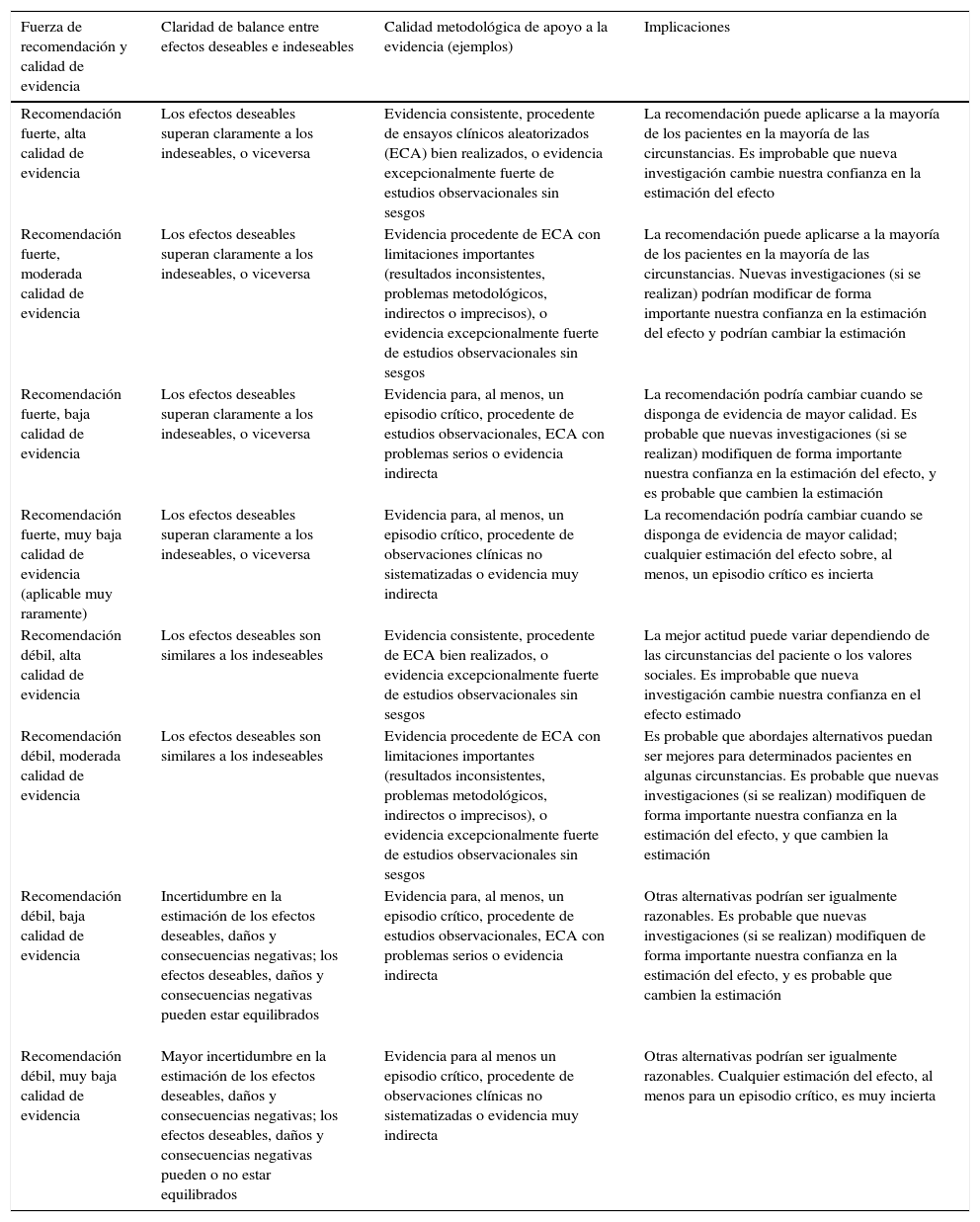
Para la valoración de la calidad de la evidencia y la graduación de las recomendaciones se ha utilizado el sistema Grading of Recommendations of Assessment Development and Evaluations (GRADE) (tabla 1)1-5.
Fuerza de las recomendaciones y calidad de evidencias según el sistema GRADE
| Fuerza de recomendación y calidad de evidencia | Claridad de balance entre efectos deseables e indeseables | Calidad metodológica de apoyo a la evidencia (ejemplos) | Implicaciones |
|---|---|---|---|
| Recomendación fuerte, alta calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia consistente, procedente de ensayos clínicos aleatorizados (ECA) bien realizados, o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La recomendación puede aplicarse a la mayoría de los pacientes en la mayoría de las circunstancias. Es improbable que nueva investigación cambie nuestra confianza en la estimación del efecto |
| Recomendación fuerte, moderada calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia procedente de ECA con limitaciones importantes (resultados inconsistentes, problemas metodológicos, indirectos o imprecisos), o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La recomendación puede aplicarse a la mayoría de los pacientes en la mayoría de las circunstancias. Nuevas investigaciones (si se realizan) podrían modificar de forma importante nuestra confianza en la estimación del efecto y podrían cambiar la estimación |
| Recomendación fuerte, baja calidad de evidencia | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia para, al menos, un episodio crítico, procedente de estudios observacionales, ECA con problemas serios o evidencia indirecta | La recomendación podría cambiar cuando se disponga de evidencia de mayor calidad. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y es probable que cambien la estimación |
| Recomendación fuerte, muy baja calidad de evidencia (aplicable muy raramente) | Los efectos deseables superan claramente a los indeseables, o viceversa | Evidencia para, al menos, un episodio crítico, procedente de observaciones clínicas no sistematizadas o evidencia muy indirecta | La recomendación podría cambiar cuando se disponga de evidencia de mayor calidad; cualquier estimación del efecto sobre, al menos, un episodio crítico es incierta |
| Recomendación débil, alta calidad de evidencia | Los efectos deseables son similares a los indeseables | Evidencia consistente, procedente de ECA bien realizados, o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | La mejor actitud puede variar dependiendo de las circunstancias del paciente o los valores sociales. Es improbable que nueva investigación cambie nuestra confianza en el efecto estimado |
| Recomendación débil, moderada calidad de evidencia | Los efectos deseables son similares a los indeseables | Evidencia procedente de ECA con limitaciones importantes (resultados inconsistentes, problemas metodológicos, indirectos o imprecisos), o evidencia excepcionalmente fuerte de estudios observacionales sin sesgos | Es probable que abordajes alternativos puedan ser mejores para determinados pacientes en algunas circunstancias. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y que cambien la estimación |
| Recomendación débil, baja calidad de evidencia | Incertidumbre en la estimación de los efectos deseables, daños y consecuencias negativas; los efectos deseables, daños y consecuencias negativas pueden estar equilibrados | Evidencia para, al menos, un episodio crítico, procedente de estudios observacionales, ECA con problemas serios o evidencia indirecta | Otras alternativas podrían ser igualmente razonables. Es probable que nuevas investigaciones (si se realizan) modifiquen de forma importante nuestra confianza en la estimación del efecto, y es probable que cambien la estimación |
| Recomendación débil, muy baja calidad de evidencia | Mayor incertidumbre en la estimación de los efectos deseables, daños y consecuencias negativas; los efectos deseables, daños y consecuencias negativas pueden o no estar equilibrados | Evidencia para al menos un episodio crítico, procedente de observaciones clínicas no sistematizadas o evidencia muy indirecta | Otras alternativas podrían ser igualmente razonables. Cualquier estimación del efecto, al menos para un episodio crítico, es muy incierta |
Para la elaboración de los capítulos se ha realizado una búsqueda bibliográfica en las siguientes bases de datos: Medline, PubMed, UpToDate, Web of Science, Registro Cochrane y MD Consult, incluyendo artículos hasta enero de 2014.
Está prevista la actualización del presente documento con carácter bianual, siendo cada uno de los autores responsable de realizar su capítulo.
Evaluación clínicaEn la tabla 2 se recogen las recomendaciones de evaluación clínica de un paciente en cuanto a alteraciones metabólicas e infección por VIH5-7:
Recomendaciones de evaluación clínica de un paciente en cuanto a alteraciones metabólicas e infección por el VIH
| Primera visita | Anualmente | Bienalmente |
|---|---|---|
| a) Historia clínica completa, con especial incidencia en antecedentes familiares de diabetes, cardiopatía isquémica e HTA, así como posibles diagnósticos previos de HTA, diabetes o enfermedad vascular o coronaria, y estilo de vida del paciente. (Recomendación fuerte, moderada calidad de la evidencia.) | Valoración del estilo de vida. (Recomendación fuerte, baja calidad de la evidencia.) | ECG y estimación de riesgo cardiovascular. (Recomendación fuerte, moderada calidad de la evidencia.) |
| b) Si el paciente ya estaba tomando TAR: historia de TAR, nadir de CD4 y duración de regímenes previos. (Recomendación fuerte, moderada calidad de la evidencia.) | Exploración física completa (Recomendación fuerte, moderada calidad de la evidencia), con especial énfasis en toma de presión arterial, IMC, circunferencia de cintura, evaluación clínica de lipodistrofia | |
| c) Exploración física completa (Recomendación fuerte, moderada calidad de la evidencia), con especial énfasis en toma de tensión arterial, IMC, circunferencia de cintura, evaluación clínica de lipodistrofiaa | Estudio hematológico y bioquímico general; triglicéridos, CT, cHDL y cLDL; glucemia, sistemático de orina y cociente urinario proteína/creatinina, estimación de filtrado glomerular (MDRD)/CKD/EPI. (Recomendación fuerte, moderada calidad de la evidencia.) | |
| d) Estudio hematológico y bioquímico general; triglicéridos, CT, cHDL y cLDL; glucemia basal, sistemático de orina, y cociente urinario proteína/creatinina, estimación de filtrado glomerular (MDRD)/CKD/EPI. b(Recomendación fuerte, moderada calidad de la evidencia.) | ||
| e) ECG; estimación de riesgo cardiovascularc. (Recomendación fuerte, moderada calidad de la evidencia.) | ||
| f) En casos seleccionados puede ser recomendable medir el índice tobillo- brazo o el grosor íntima-media carotídeo para detectar aterosclerosis subclínica. (Recomendación débil, alta calidad de la evidencia.) | ||
| g) En casos seleccionados puede ser recomendable medir las concentraciones plasmáticas de PCR y/o dímero D para detectar un estado hiperinflamatorio y/o procoagulante mantenido. (Recomendación débil, moderada calidad de la evidencia.) |
CKD/EPI: creatinine equation; ECG: electrocardiograma; HDL: lipoproteínas de alta densidad; HTA: hipertensión arterial; LDL: lipoproteínas de baja densidad; MDRD: Modification of Diet in Renal Disease; TAR: tratamiento antirretroviral.
Con el objetivo de conocer la composición corporal sería conveniente realizar una DEXA en los casos en que se disponga del mismo. Si no es posible se realizará: índice de masa corporal, circunferencia de cintura y evaluación morfológica de lipodistrofia.
Se debe basar en 3 aspectos fundamentales: alimentación saludable, erradicar el hábito del tabaco y realización de ejercicio de forma regular.
Los objetivos dependerán del riesgo cardiovascular (RCV) de cada individuo tomados a partir de una valoración completa del paciente con VIH (tabla 3).
Parámetros para evaluar el riesgo cardiovascular del paciente con VIH
| Valoración del paciente con VIH | Parámetros clave a evaluar |
|---|---|
| Historia clínica del paciente | Edad, sexo. Antecedentes familiares de ECV. Tabaquismo y otras drogas |
| Valoración sanitaria | Presión arterial |
| Valoración antropométrica | Peso, talla e índice de masa corporal (IMC). Circunferencia de cintura. Composición corporal. Distribución de la grasa corporal |
| Valoración dietética | Recordatorio de 24ha. Frecuencia del consumo de alimentos. Patrón del consumo de alimentos |
| Valoración de actividad física | Tipo de ejercicio, tiempo e intensidad |
| Valoración bioquímica | Glucosa en ayunas y hemoglobina glucosilada (si glucosa basal alterada). Perfil lipídico en sangre: CT, cLDL, cHDL y ratio CT/cHDL. Función renal |
La modificación en la dieta es recomendada para hacer frente a un perfil lipídico alterado que predisponga a la enfermedad cardiovascular (ECV) en pacientes con VIH. Las pautas de alimentación saludable deben tener como objetivo suministrar los nutrientes para mantener los procesos metabólicos, mantener un peso adecuado y favorecer el buen estado de salud del paciente. El paciente con infección por el VIH precisa de apoyo nutricional, bien en situaciones de pérdida de peso secundarias a desnutrición, o bien para modificar a través de la dieta las alteraciones metabólicas y de composición corporal8,9.
TabaquismoDe acuerdo con la American Heart Association, el tabaquismo es por sí mismo el mayor factor de RCV modificable que contribuye a la morbimortalidad prematura10. No debemos olvidar que alrededor del 60-80% de los pacientes VIH+ fuman11.
Existen diversos métodos aprobados de ayuda en la deshabituación tabáquica, que van desde el consejo médico, pasando por el uso de parches de nicotina, hasta la administración de fármacos como el bupropión y la vareniclina; con ambos fármacos se han descrito hasta un 38-44% de ceses tabáquicos al año entre pacientes VIH+, similares a los obtenidos entre la población general11. Los efectos secundarios, especialmente de la vareniclina12, se dirigen hacia la esfera psiquiátrica, por lo que, antes de su uso se debe investigar si la persona tiene antecedentes de depresión, bipolaridad o esquizofrenia, no siendo recomendado en estos casos. Como recomendación general, no se debe manejar maquinaria peligrosa y hay que evitar la conducción. Así mismo, existen diferentes unidades de tabaquismo tanto en hospitales públicos o privados con el objeto de ayudar a los fumadores a dejar el hábito tabáquico.
En relación con los cigarrillos electrónicos, todavía no disponemos de información suficiente para poder recomendar con seguridad su uso13. La Organización Mundial de la Salud (OMS) advierte a los consumidores que no reconoce a las marcas que se autoproclaman como terapia efectiva de reemplazo o se digan reconocidas por este organismo debido a la carencia de estudios rigurosos que demuestren la efectividad del cigarrillo electrónico como terapia de reemplazo o sus niveles de toxicidad. Sin embargo, la OMS no descarta su utilidad conforme se vayan realizando estudios más en profundidad14. La Agencia para la administración de alimentos y medicamentos estadounidense (FDA), en un análisis a 2 marcas líderes encontró 2 grupos de sustancias dañinas: el dietilenglicol y las nitrosaminas15. La Sociedad Española de Neumología torácica (SEPAR) afirma que a corto plazo pueden causar cambios en los pulmones muy parecidos a los que se producen al fumar cigarros normales.
Por el momento en España no existe una normativa nacional relacionada con el uso del cigarrillo electrónico, a excepción de su prohibición en centros educativos, sanitarios, transporte público y administraciones públicas.
En la siguiente página web http://www.cnpt.es/listado-enlaces.asp se puede obtener direcciones de apoyo al cese del tabaquismo.
Actividad físicaLas intervenciones dirigidas a lograr la práctica progresiva del ejercicio han demostrado en los pacientes con VIH mejoras en la función y fuerza muscular, en la redistribución de la grasa y en la función cardiovascular (especialmente con el ejercicio aeróbico), así como en el perfil lipídico y la sensibilidad a la insulina, lo que redunda en una mejora del RCV11.
Como pauta general aceptada por la Guía Europea de Prevención Cardiovascular en la Práctica Clínica, debe realizarse al menos 30min de ejercicio aeróbico al día16. Andar ligero, correr, nadar o montar en bicicleta son ejemplos de ejercicio aeróbico.
Recomendaciones- 1.
Se recomienda modificar los hábitos de conducta para obtener un estilo de vida saludable. (Recomendación fuerte, moderada calidad de la evidencia.)
- 2.
Se recomienda no fumar o abandonar el hábito tabáquico con el objeto de disminuir los efectos sobre la salud. (Recomendación fuerte, alta calidad de la evidencia.)
- 3.
Se recomienda, como pauta general, realizar al menos 30min de ejercicio aeróbico al día. (Recomendación fuerte, moderada calidad de la evidencia.)
Desde el punto de vista morfológico, en el paciente con VIH se producen 2 alteraciones importantes: la lipoatrofia y la acumulación grasa, que probablemente tienen mecanismos patogénicos distintos17.
Los factores de riesgo para la lipoatrofia son la edad, el sexo, el índice de masa corporal (IMC) basal y el grupo étnico. La infección por VIH contribuye al desarrollo de lipoatrofia por la alteración de expresión génica en tejido adiposo, produciendo un incremento de PGC-1a, TNFα y α-2 microglobulina y un descenso en ARNm de COX-2, COX-4, UCP2, C/EBP-a, PPAR-γ, GLUT4, LPL, leptina y adiponectina.
En relación con la implicación de los fármacos antirretrovirales (FARV), principalmente los análogos timidínicos (estavudina [d4T], didanosina [ddI] y zidovudina [ZDV] especialmente) (ITIAN), los inhibidores de la proteasa (IP) —especialmente los de primera generación— y el fármaco efavirenz (EFV) parecen modificar la adipogénesis, promover la lipólisis y la apoptosis de los adipocitos y afectar de forma decisiva las funciones secretoras de las células adiposas. Además, los ITIAN y los IP también favorecen el desarrollo de la resistencia a la insulina18.
El efecto global de todos estos mecanismos conducirá a una reducción del número o del tamaño de los adipocitos o la combinación de ambos, dando lugar a la aparición de lipoatrofia.
Los mecanismos exactos que conducen a la adiposidad visceral son en gran parte desconocidos, si bien se ha demostrado que los antirretrovirales (ARV) ejercen efectos característicos sobre los depósitos de tejido adiposo visceral y subcutáneo19,20.
Diagnóstico y tratamiento (tabla 4)El diagnóstico, a excepción de la lipoatrofia facial, actualmente se basa en la realización de absorciometría radiológica dual (DEXA), que es un método objetivo de medida de grasa, barato, popular y tiene baja radiación. Otros métodos de objetivos de medida del tejido adiposo son la ecografía (especialmente para la lipoatrofia facial), la bioimpedancia y las medidas antropométricas.
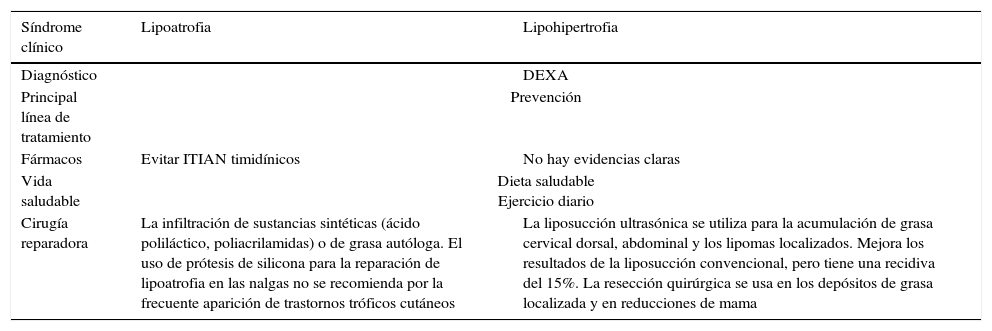
Manejo del síndrome lipodistrófico
| Síndrome clínico | Lipoatrofia | Lipohipertrofia |
|---|---|---|
| Diagnóstico | DEXA | |
| Principal línea de tratamiento | Prevención | |
| Fármacos | Evitar ITIAN timidínicos | No hay evidencias claras |
| Vida saludable | Dieta saludable Ejercicio diario | |
| Cirugía reparadora | La infiltración de sustancias sintéticas (ácido poliláctico, poliacrilamidas) o de grasa autóloga. El uso de prótesis de silicona para la reparación de lipoatrofia en las nalgas no se recomienda por la frecuente aparición de trastornos tróficos cutáneos | La liposucción ultrasónica se utiliza para la acumulación de grasa cervical dorsal, abdominal y los lipomas localizados. Mejora los resultados de la liposucción convencional, pero tiene una recidiva del 15%. La resección quirúrgica se usa en los depósitos de grasa localizada y en reducciones de mama |
Una vez que se han instaurado los cambios en el reparto de la grasa son muy difíciles de revertir, y es por ello que la prevención es la mejor estrategia para evitar su aparición. La prevención se basará en establecer estrategias terapéuticas que incluyan, siempre que sea posible, ITIAN no timidínicos, evitando su uso en aquellos casos en los cuales no se puedan incluir en la pauta terapéutica.
La alternativa quirúrgica no debe obviarse ante el fracaso de las estrategias conservadoras21,22. La liposucción ultrasónica se utiliza para la acumulación de grasa cervical dorsal, abdominal y los lipomas localizados. Mejora los resultados de la liposucción convencional pero tiene riesgo de recidiva. La resección quirúrgica se usa en los depósitos de grasa localizada y en reducciones de mama. La infiltración de sustancias sintéticas o de grasa autóloga se utiliza para corregir la lipoatrofia facial. El efecto es beneficioso para los pacientes en los que la lipoatrofia sea evidente y comporte una carga psicológica y social importante que disminuya su calidad de vida. Sin embargo, y aunque efectivas, se trata solo de una solución estética que no corrige los cambios metabólicos que han llevado a la alteración del reparto de la grasa.
RecomendacionesDiagnóstico- 1.
Se recomienda el uso de la DEXA como método diagnóstico de la distribución de la grasa corporal. (Recomendación fuerte, baja calidad de la evidencia.) En caso de no disponer de DEXA, se podrán utilizar en su lugar medidas antropométricas, bioimpedancia y ecografía. (Recomendación débil, alta calidad de la evidencia.)
- 1.
Se recomienda llevar un estilo de vida saludable. (Recomendación fuerte, baja calidad de la evidencia.)
- 2.
Se recomienda evitar los análogos timidínicos en cualquier pauta de tratamiento antirretroviral (TAR). (Recomendación fuerte, alta calidad de la evidencia.)
- 1.
Se recomienda la cirugía facial reparadora con grasa autóloga o sustancias sintéticas en los pacientes con lipoatrofia. (Recomendación fuerte, moderada calidad de la evidencia.)
- 2.
Solo se recomienda la liposucción ultrasónica para corregir la acumulación de grasa cervical dorsal, en los casos en los que se presente una impotencia funcional. (Recomendación fuerte, muy baja calidad de la evidencia.)
- 3.
Se recomienda la resección quirúrgica en los casos de depósitos de grasa localizada. (Recomendación fuerte, muy baja calidad de la evidencia.)
La prevalencia de alteraciones en el metabolismo hidrocarbonado es mayor en los pacientes con infección por VIH, con un rango que varía entre el 10-25%, y el 5-10% de nuevos diagnósticos de diabetes. La incidencia de diabetes mellitus (DM) es 4 veces mayor que en la población general23-25.
Las alteraciones del metabolismo de la glucosa constituyen un factor de riesgo determinante para el desarrollo de ECV, mayor cuanto más tiempo de duración de la hiperglucemia23. En la población general, la diabetes es un equivalente coronario26. Sin embargo, existe controversia en los pacientes con VIH, ya que los datos de la cohorte D:A:D no lo confirman27.
Diagnóstico y tratamientoSe recomienda determinar cifras de glucemia en ayunas en el momento del diagnóstico de la infección por VIH, previo al inicio del tratamiento, a los 3-6 meses de un cambio, y anualmente una vez estabilizado el tratamiento. En caso de glucemia basal alterada (≥100mg/dl) o diabetes conocida, determinar también la hemoglobina glucosilada (HbA1c)28,29 (tabla 5).
Criterios diagnósticos de las alteraciones del metabolismo hidrocarbonado
| Glucosa en ayunas (mg/dl) | Glucosa 2 h tras SOG75g (mg/dl) | HbA1c (%) | |
|---|---|---|---|
| Diabetes | ≥ 126 ---> o | Glu 2 h ≥ 200 o → | HbA1c ≥ 6,5% |
| Glucosa basal alterada | 100-125 ---> y | Glu 2 h < 140 | |
| Intolerancia a la glucosa | < 126 ---> y | Glu 2h 140-199 o → | HbA1c 5,7-6,4% |
SOG75g: sobrecarga oral con 75g glucosa.
En la población VIH, la medición de HbA1c puede infraestimar los valores de glucemia plasmática por el mayor volumen corpuscular medio (VCM) de los hematíes y el uso de abacavir, por lo que los valores de glucemia basal y posprandial alcanzan una mayor significación30.
En relación con los nuevos fármacos, con un mecanismo de acción mediado por las denominadas hormonas incretinas —en concreto por el péptido similar al glucagón tipo1 (GLP-1): los inhibidores de dipeptidil peptidasa-4 (IDPP4) (orales) y los agonistas del receptor del GLP-1 (aGLP-1, en inyección subcutánea)—, si bien existe ya amplia experiencia clínica en la población general, su uso en la población VIH es muy limitada31,32. Entre estos últimos, los IDPP4 quizá serían los más indicados por sus menores efectos secundarios33 y la posibilidad de uso en insuficiencia renal ajustando dosis.
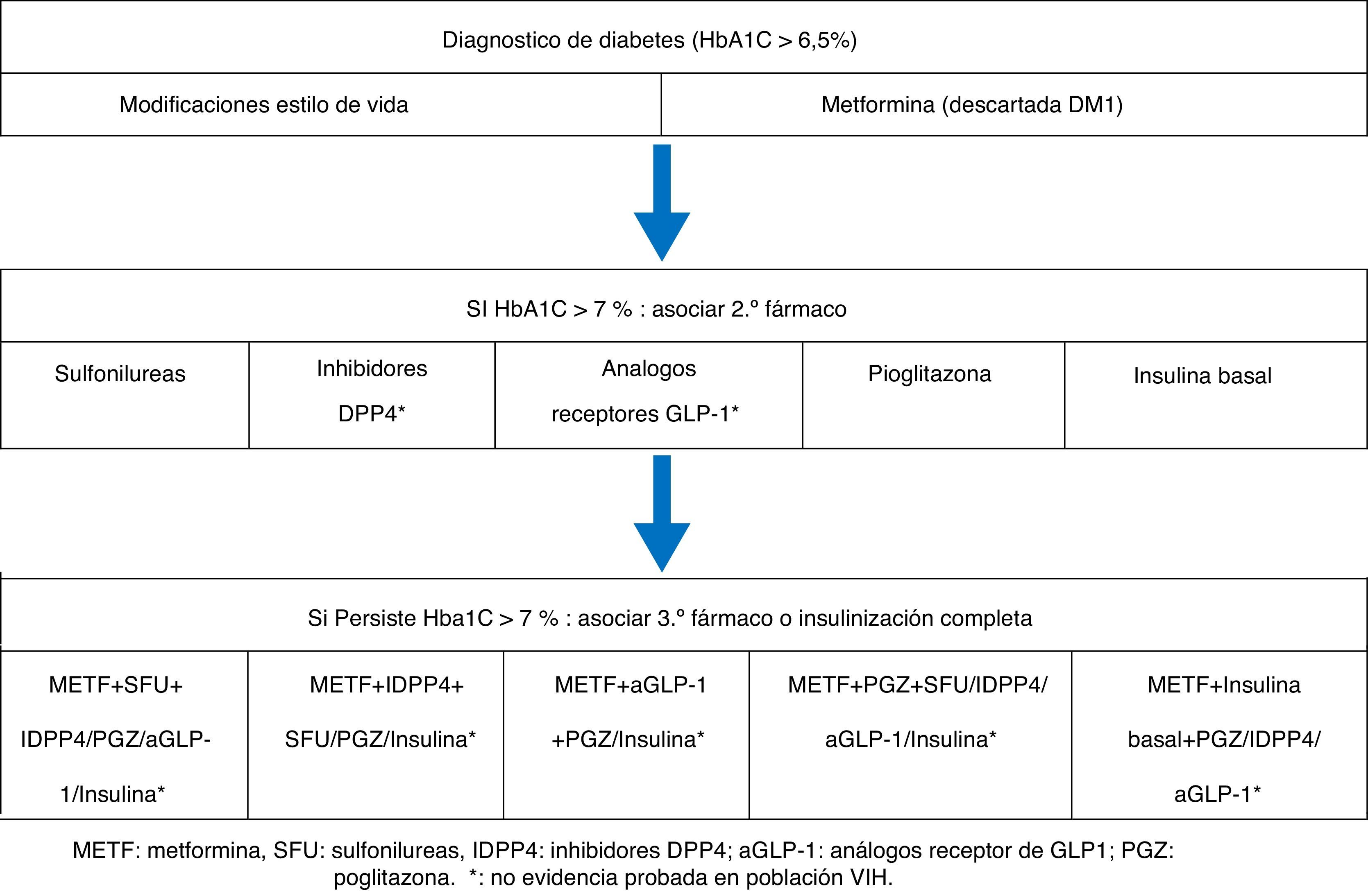
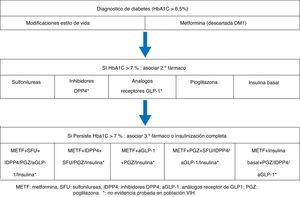
El manejo de la diabetes mellitus tipo2 (DM2) se esquematiza en el algoritmo1 (fig. 1). A grandes rasgos, es igual que para la población no VIH, con algunas consideraciones34.
Algoritmo terapéutico de la diabetes (modificación EACS 2013)34.
aGLP-1: análogos receptor de GLP1; IDPP4: inhibidores DPP4; METF: metformina, PGZ: pioglitazona; SFU: sulfonilureas.
* Sin evidencia probada en la población VIH.
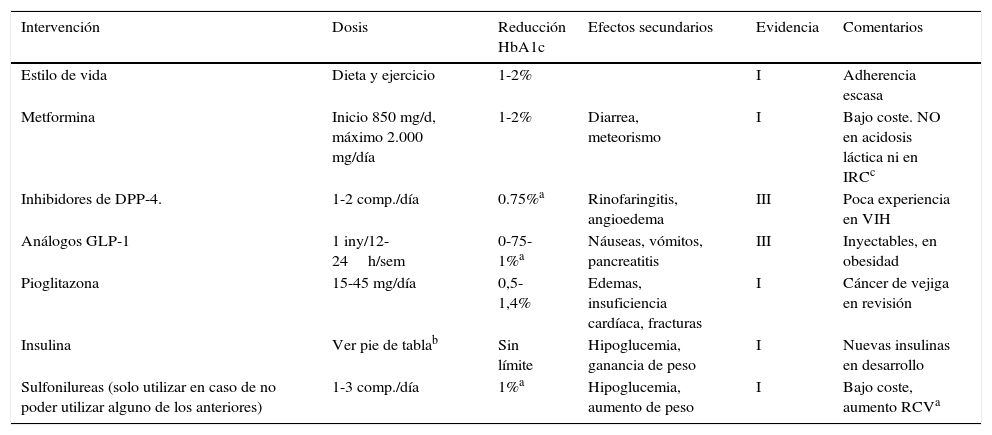
Las sulfonilureas quedan relegadas a pacientes no obesos con hiperglucemia severa, dadas las consideraciones sobre seguridad cardiovascular de algunas de ellas. A pesar de que no existen ensayos clínicos en pacientes VIH que lo avalen, el grupo de las incretinas supone una buena opción frente a las sulfonilureas, por su seguridad hasta la fecha y escasas interacciones con los FARV. Finalmente, si no es posible el control con combinaciones de antidiabéticos orales, la hiperglucemia es severa o bien se trata de una diabetes tipo1, se recomienda la insulinoterapia con las mismas pautas que la población no VIH (tabla 6).
Características de los principales fármacos para el tratamiento de la diabetes
| Intervención | Dosis | Reducción HbA1c | Efectos secundarios | Evidencia | Comentarios |
|---|---|---|---|---|---|
| Estilo de vida | Dieta y ejercicio | 1-2% | I | Adherencia escasa | |
| Metformina | Inicio 850 mg/d, máximo 2.000 mg/día | 1-2% | Diarrea, meteorismo | I | Bajo coste. NO en acidosis láctica ni en IRCc |
| Inhibidores de DPP-4. | 1-2 comp./día | 0.75%a | Rinofaringitis, angioedema | III | Poca experiencia en VIH |
| Análogos GLP-1 | 1 iny/12-24h/sem | 0-75-1%a | Náuseas, vómitos, pancreatitis | III | Inyectables, en obesidad |
| Pioglitazona | 15-45 mg/día | 0,5-1,4% | Edemas, insuficiencia cardíaca, fracturas | I | Cáncer de vejiga en revisión |
| Insulina | Ver pie de tablab | Sin límite | Hipoglucemia, ganancia de peso | I | Nuevas insulinas en desarrollo |
| Sulfonilureas (solo utilizar en caso de no poder utilizar alguno de los anteriores) | 1-3 comp./día | 1%a | Hipoglucemia, aumento de peso | I | Bajo coste, aumento RCVa |
- 1.
La hiperglucemia es un factor de RCV que debe tratarse. (Recomendación fuerte, alta calidad de la evidencia.)
- 2.
Se recomienda el cribado periódico, al inicio del TAR y anualmente por encima de los 45 años, o por debajo si existen factores de riesgo asociados. (Recomendación fuerte, moderada calidad de la evidencia.)
- 3.
La hemoglobina glucosilada (HbA1c) es el parámetro de control a utilizar para el diagnóstico y seguimiento. (Recomendación fuerte, alta calidad de la evidencia.) El objetivo de control es el mismo que para la población general (HbA1c<7%). (Recomendación fuerte, alta calidad de la evidencia.)
- 4.
Se considerará la modificación del TAR en todos los pacientes con factores de riesgo de desarrollar DM, especialmente aquellos con lipodistrofia, historia familiar de DM e IMC elevado. En estos pacientes deberían evitarse los ARV claramente relacionados con resistencia a la insulina o DM. (Recomendación fuerte, muy baja calidad de la evidencia.)
- 5.
Se recomienda utilizar el mismo algoritmo terapéutico que en la población no VIH. La metformina sigue siendo la primera opción farmacológica excepto en pacientes con lipoatrofia marcada, riesgo de lactacidosis o enfermedad renal avanzada. (Recomendación fuerte, muy baja calidad de la evidencia.)
- 6.
Tras la metformina puede utilizarse cualquier otro grupo farmacológico comercializado. La pioglitazona tiene su papel en pacientes con resistencia insulínica y lipoatrofia marcada. (Recomendación fuerte, muy baja calidad de la evidencia.)
- 7.
Cuando los antidiabéticos fracasan, cuando hay clínica franca de hiperglucemia o cuando se trata de una diabetes tipo1, la insulina sigue siendo el fármaco de elección, con un manejo y ajuste similar al de la población general. (Recomendación fuerte, alta calidad de la evidencia.)
- 8.
El tratamiento del resto de los factores de RCV asociados (dislipidemia, hipertensión arterial) ha demostrado ser de igual o mayor importancia para la prevención de episodios cardiovasculares y deben tenerse en cuenta. (Recomendación fuerte, alta calidad de la evidencia.)
- 9.
El seguimiento de los pacientes con infección por VIH y alteraciones del metabolismo hidrocarbonado incluye la determinación de HbA1c, función renal, lípidos semestralmente y fondo de ojo y microalbuminuria anual (recomendación fuerte, alta calidad de la evidencia), descartando la posibilidad de polineuropatía asociada, no solo por la DM, sino al propio virus, ARV o infecciones concomitantes.
El patrón observado con más frecuencia en pacientes en tratamiento suele ser el de la dislipidemia aterogénica, caracterizada por cHDL bajo y triglicéridos (TG) elevados, acompañado de elevaciones variables de colesterol total (CT) y cLDL. Habitualmente este patrón se asocia a partículas de cLDL aterogénicas, densas y pequeñas. En pacientes con infección VIH sin tratamiento se suele observar un patrón característico, con CT y cHDL bajos y TG elevados35.
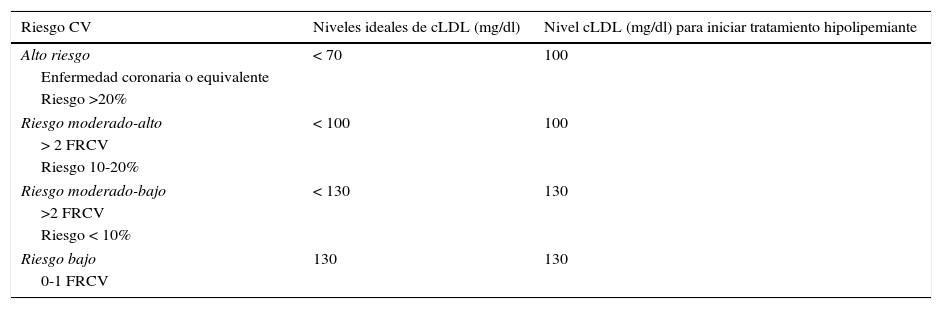
Valoración de los pacientes candidatos a tratamientoPor la existencia de múltiples datos epidemiológicos que soportan el concepto de que la ECV es más frecuente en pacientes con infección VIH, y la relevancia que tiene en estos pacientes la inflamación crónica sumada a los factores de RCV (FRCV) tradicionales, el Panel considera que los pacientes VIH deberían alcanzar unos niveles de cLDL inferiores a los considerados ideales en las recomendaciones NCEPIII36 (tabla 7).
Criterios diagnósticos y de intervención terapéutica según niveles de colesterol LDL
| Riesgo CV | Niveles ideales de cLDL (mg/dl) | Nivel cLDL (mg/dl) para iniciar tratamiento hipolipemiante |
|---|---|---|
| Alto riesgo | < 70 | 100 |
| Enfermedad coronaria o equivalente | ||
| Riesgo >20% | ||
| Riesgo moderado-alto | < 100 | 100 |
| > 2 FRCV | ||
| Riesgo 10-20% | ||
| Riesgo moderado-bajo | < 130 | 130 |
| >2 FRCV | ||
| Riesgo < 10% | ||
| Riesgo bajo | 130 | 130 |
| 0-1 FRCV | ||
En el caso de que el paciente tenga una cifra de triglicéridos >400mg/dl es aconsejable utilizar como objetivo el colesterol no-HDL.
Es importante también descartar posibles causas de hiperlipidemia secundaria, ya que su corrección o mejoría podrían restaurar los valores lipídicos anormales.
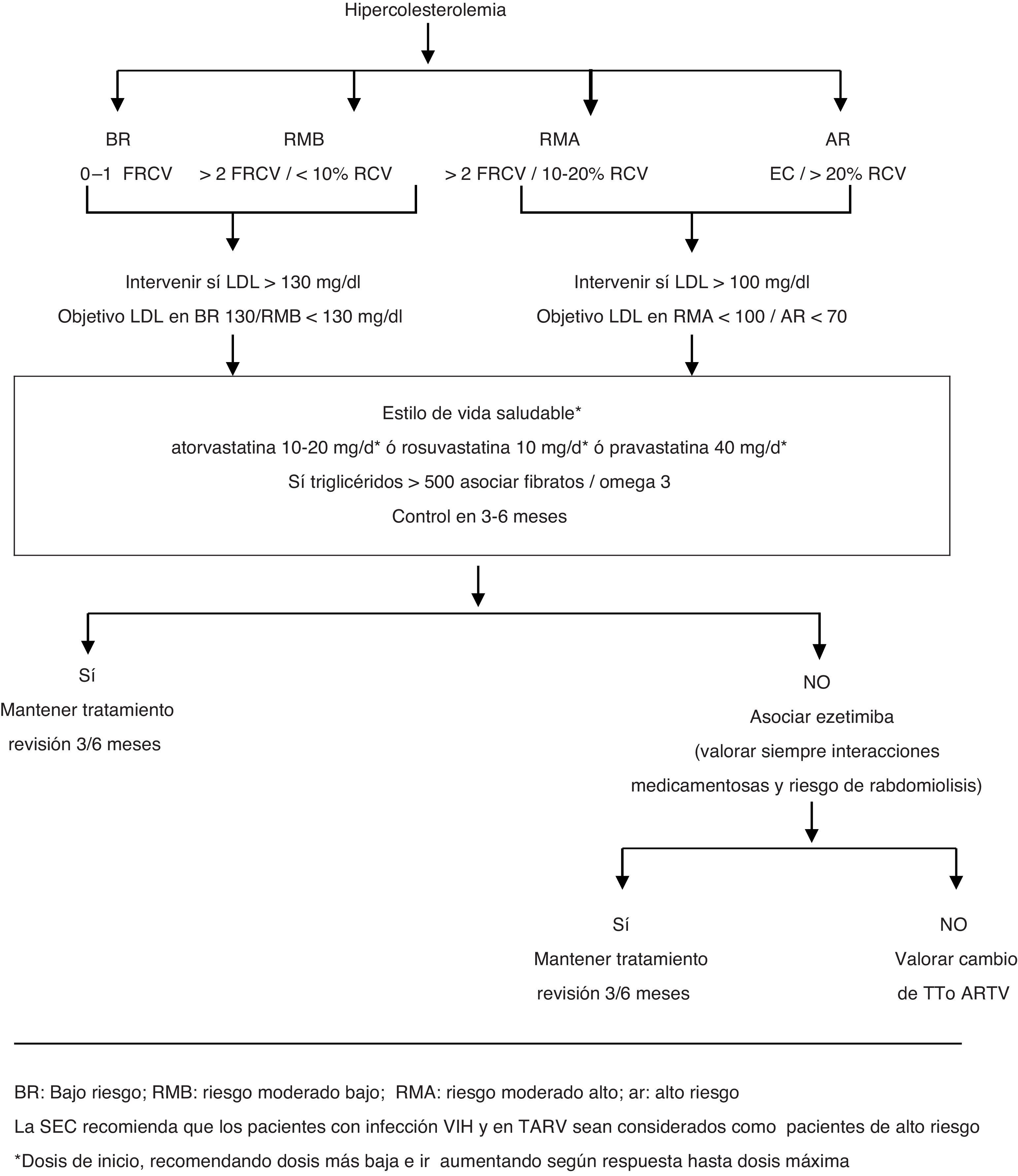
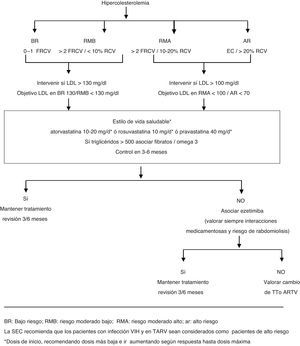
Abordaje terapéuticoEl manejo de la dislipidemia en pacientes con VIH se resume en el algoritmo2 (fig. 2).
Algoritmo del tratamiento de la dislipidemia en pacientes VIH en TAR, en prevención primaria.
AR: alto riesgo; BR: bajo riesgo; RMA: riesgo moderado alto; RMB: riesgo moderado bajo.
La SEC recomienda que los pacientes con infección VIH y en TARV sean considerados como pacientes de alto riesgo
* Dosis de inicio, recomendando dosis más baja e ir aumentando según respuesta hasta dosis máxima.
Son los fármacos hipolipemiantes de elección por su seguridad, eficacia clínica, capacidad para reducir los niveles de cLDL y coste35,37.
Todas las estatinas son metabolizadas a nivel del citocromo P450 excepto la pravastatina, que utiliza otras vías, por lo que evita las interferencias con los ARV. El fármaco de primera elección en este escenario es la atorvastatina debido a su eficacia, tolerabilidad, experiencia y precio, pero también pueden considerarse rosuvastatina y pravastatina. La eficacia hipolipemiante a igualdad de dosis es por este orden: mayor para rosuvastatina, intermedia para atorvastatina y baja para pravastatina. Está contraindicado el uso de la simvastatina con IP. La coadministración de simvastatina o lovastatina con atazanavir/ritonavir no se recomienda debido a un aumento del riesgo de miopatía, incluyendo rabdomiólisis. El uso concomitante de atazanavir con lovastatina o simvastatina está contraindicado debido al potencial de reacciones graves, como la miopatía, incluyendo rabdomiólisis.
La pitavastatina es un nuevo fármaco de esta familia que posee como ventaja principal su escasa capacidad de provocar interacciones. Solo existen datos clínicos de interacciones con lopinavir/r, no siendo estas clínicamente significativas38.
En general se recomienda iniciar tratamiento con dosis bajas de estatinas, incrementándose la dosis en función de la eficacia y/o la toxicidad.
FibratosLos fibratos pueden considerarse de elección en el manejo de la hipertrigliceridemia severa que no responde a medidas higiénico-dietéticas o con historia de pancreatitis asociada a hipertrigliceridemia. La combinación de fibratos y estatinas puede contemplarse en algunas ocasiones monitorizando al paciente, ya que se puede producir un aumento de miopatías.
Otros fármacosExisten datos sobre la eficacia para el control lipídico en pacientes con infección por VIH, especialmente del uso de ezetimiba junto con estatinas a dosis bajas en aquellos casos en que la respuesta a la estatina sola sea escasa35.
Cambio del tratamiento antirretroviral para mejorar el perfil metabólicoExisten determinados ARV que se asocian con un cambio en el perfil de lípidos favorable. Dentro de la familia de los inhibidores de la transcriptasa inversa no análogos de nucleósido (ITINN), nevirapina (NVP) se asocia con un mejor perfil lipídico que EFV, en especial por su efecto incrementando los niveles de cHDL. Este efecto está mediado por la capacidad de NVP de incrementar la producción de apoA1. Etravirina (ETR) y rilpivirina (RPV) también poseen un mejor perfil lipídico que EFV, sobre todo en lo referido a los TG y el CT, con similar efecto sobre el cHDL.
Entre los IP, lopinavir/ritonavir (LPV/r) y fosamprenavir/r (FPV/r) se asocian con mayores incrementos de TG y CT que el resto de los fármacos de su clase. No existen diferencias significativas en cuanto al perfil lipídico entre darunavir/r (DRV/r) y atazanavir/r (ATV/r).
Raltegravir (RAL) posee un perfil lipídico neutro, superior al de EFV en cuanto a TG y CT. Los nuevos inhibidores de la integrasa, dolutegravir y elvitegravir, presentan un perfil lipídico también neutro. Maraviroc, inhibidor de los receptores CCR5, posee también un perfil lipídico neutro, más favorable que el de EFV.
Dentro de la familia de ITIAN, los fármacos que se asocian con peor perfil lipídico son los timidínicos (ZDV y d4T), con mayor propensión a asociarse a hipertrigliceridemia y elevación de CT y cLDL que el resto de los fármacos de esta familia. Lamivudina (3TC) presenta un efecto neutro sobre los lípidos. Tenofovir (TDF) se asocia con menores elevaciones de CT, cLDL y TG que abacavir (ABC), si bien este podría elevar en mayor medida los niveles de cHDL, con lo que el cociente CT/cHDL podría ser similar entre ambos fármacos. TDF podría poseer un efecto hipolipemiante per se, independiente de su acción antiviral39.
Antes de iniciar un TAR se debe valorar el RCV de los pacientes para elegir el tratamiento más adecuado desde el punto de vista metabólico.
El planteamiento de la modificación del TAR antes que el uso de agentes específicos hipolipemiantes debe ser analizado y valorado en cada paciente, siempre que no exista riesgo de fallo virológico y considerando que el paciente se expone a los efectos adversos del nuevo fármaco.
Añadir un fármaco hipolipemiante significa añadir complejidad al régimen terapéutico y posibilidad de aparición de nuevos efectos adversos e interacciones. La decisión en este caso debe individualizarse, ya que no existen evidencias suficientes que avalen una alternativa.
Recomendaciones- 1.
Descartar la presencia de dislipidemia en pacientes con infección por el VIH, por ser esta una complicación frecuente en pacientes en TAR. (Recomendación fuerte, alta calidad de la evidencia.)
- 2.
Iniciar siempre tratamiento de la dislipidemia con recomendaciones alimentarias y de estilo de vida específicas según la alteración lipídica presente. (Recomendación fuerte, moderada calidad de la evidencia.)
- 3.
Los pacientes VIH con dislipidemia deben ser considerados como mínimo de alto RCV, por lo que su objetivo terapéutico será cLDL menor de 100mg/dl. (Recomendación fuerte, moderada calidad de la evidencia.)
- 4.
Se recomienda como primera elección la atorvastatina, aunque también pueden valorarse pravastatina y rosuvastatina como tratamiento farmacológico más seguro en prevención primaria y secundaria de la hipercolesterolemia. (Recomendación fuerte, moderada calidad de la evidencia.)
- 5.
Se recomiendan los fibratos como tratamiento farmacológico más eficaz de la hipertrigliceridemia grave (>500mg/dl) refractaria a tratamiento dietético (Recomendación fuerte, moderada calidad de la evidencia)
- 6.
No se recomienda de forma sistemática el tratamiento combinado de estatina y fibratos porque favorece la toxicidad de ambos fármacos. (Recomendación fuerte, moderada calidad de la evidencia.)
- 7.
Se recomienda valorar la asociación de ezetimiba a estatinas, ya que puede mejorar el control de la dislipidemia en algunos pacientes. (Recomendación fuerte, moderada calidad de la evidencia.)
- 8.
En pacientes con factores de RCV se recomienda iniciar TAR con fármacos con buen perfil metabólico. (Recomendación fuerte, moderada calidad de la evidencia.)
- 9.
En pacientes que desarrollan alteraciones metabólicas o presentan un empeoramiento del RCV se recomienda valorar cambio de TAR siempre que no se comprometa la eficacia inmunovirológica, asociado o no al tratamiento hipolipemiante. (Recomendación fuerte, moderada calidad de la evidencia.)
No hay evidencia de que la infección por VIH se asocie a un mayor riesgo de hipertensión arterial (HTA). Por ello, se asume que la monitorización, las implicaciones clínicas y el tratamiento deben ser similares a la población general, teniendo en cuenta evitar riesgo de interacciones entre el TAR y el tratamiento antihipertensivo.
Se han comunicado como factores asociados con HTA en pacientes VIH la cifra de linfocitos CD4 baja, mayor edad, género masculino, mayor IMC, lipodistrofia, síndrome metabólico, índice cintura-cadera aumentado, diabetes, obesidad central o CT elevado. No hay evidencia de que el tratamiento antirretroviral influya sobre el riesgo de HTA en pacientes VIH40.
La medición correcta de la TA debe ser una práctica rutinaria en la atención a los pacientes con infección por VIH34. Se recomienda realizarla en la visita inicial y posteriormente una vez al año si las cifras son normales (TAS < 130mmHg y TAS < 85mmHg) y con mayor periodicidad si están en el límite alto de la normalidad (TAS 130-139mmHg o TAD 85-89mmHg) o si existen otros factores de RCV.
La tabla 8 resume las determinaciones a realizar en pacientes VIH con HTA34,41,42.
Determinaciones a realizar en pacientes VIH con HTA
| En todos los pacientes |
| • Analítica de sangre con glucemia, CT, cLDL y cHDL, triglicéridos, sodio y potasio, ácido úrico, creatinina (para cálculo de filtrado glomerular) • Análisis básico de orina con proteínas, albúmina, creatinina • Electrocardiograma |
| En pacientes seleccionados |
| • Ecocardiograma • Ecografía carotídea • Índice tobillo-brazo • Fondo de ojo |
| Evaluación ampliada (competencia del especialista) |
| • Búsqueda en profundidad de lesión cerebral, cardiaca, renal o vascular. Obligatorio en caso de HTA complicada • Búsqueda de HTA secundaria cuando lo sugiera la anamnesis, exploración o pruebas sistemáticas: determinación de renina, aldosterona, corticoides y catecolaminas en plasma y orina, arteriografía, ecografía renal y suprarrenal, TAC o RNM |
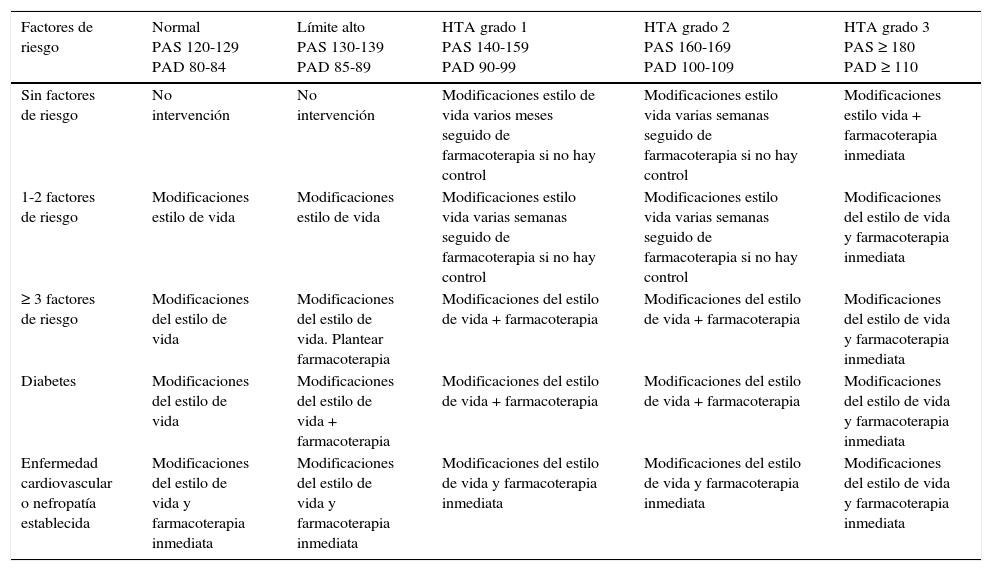
La elevación de la TA en pacientes con VIH, debe tratarse siguiendo las mismas normas que se usan para la población general43-46. La decisión de iniciar tratamiento se basa en las cifras de TA y en el grado de RCV total34,42. Las indicaciones de tratamiento antihipertensivo se recogen en la tabla 9. Todos los pacientes con HTA grado 2 ó 3 son candidatos al mismo. La evidencia científica apoya los objetivos de reducir las cifras de TA por debajo de 140/90mmHg sin que exista suficiente evidencia para recomendar descensos mayores.
Indicaciones de tratamiento según cifras de TA y factores de RCV
| Factores de riesgo | Normal PAS 120-129 PAD 80-84 | Límite alto PAS 130-139 PAD 85-89 | HTA grado 1 PAS 140-159 PAD 90-99 | HTA grado 2 PAS 160-169 PAD 100-109 | HTA grado 3 PAS ≥ 180 PAD ≥ 110 |
|---|---|---|---|---|---|
| Sin factores de riesgo | No intervención | No intervención | Modificaciones estilo de vida varios meses seguido de farmacoterapia si no hay control | Modificaciones estilo vida varias semanas seguido de farmacoterapia si no hay control | Modificaciones estilo vida + farmacoterapia inmediata |
| 1-2 factores de riesgo | Modificaciones estilo de vida | Modificaciones estilo de vida | Modificaciones estilo vida varias semanas seguido de farmacoterapia si no hay control | Modificaciones estilo vida varias semanas seguido de farmacoterapia si no hay control | Modificaciones del estilo de vida y farmacoterapia inmediata |
| ≥ 3 factores de riesgo | Modificaciones del estilo de vida | Modificaciones del estilo de vida. Plantear farmacoterapia | Modificaciones del estilo de vida + farmacoterapia | Modificaciones del estilo de vida + farmacoterapia | Modificaciones del estilo de vida y farmacoterapia inmediata |
| Diabetes | Modificaciones del estilo de vida | Modificaciones del estilo de vida + farmacoterapia | Modificaciones del estilo de vida + farmacoterapia | Modificaciones del estilo de vida + farmacoterapia | Modificaciones del estilo de vida y farmacoterapia inmediata |
| Enfermedad cardiovascular o nefropatía establecida | Modificaciones del estilo de vida y farmacoterapia inmediata | Modificaciones del estilo de vida y farmacoterapia inmediata | Modificaciones del estilo de vida y farmacoterapia inmediata | Modificaciones del estilo de vida y farmacoterapia inmediata | Modificaciones del estilo de vida y farmacoterapia inmediata |
Las guías europeas concluyen que los 5 grupos principales de antihipertensivos, diuréticos tiazídicos, betabloqueantes, IECA, ARAII, y calcioantagonistas reducen de forma adecuada la TA y el RCV. Todos son válidos para el inicio y mantenimiento del tratamiento tanto en monoterapia como en combinación. Se preferirán los fármacos con efecto durante 24h y administración en dosis única porque favorecen el cumplimiento terapéutico34.
La monoterapia reduce eficazmente la TA en un limitado número de pacientes, por lo que, la mayoría requieren combinaciones para conseguir un adecuado control. La monoterapia estaría indicada en pacientes con HTA leve y RCV total bajo o moderado. Se preferirá una combinación en dosis bajas con TA inicial en grado 2 o 3 o RCV alto o muy alto. Las combinaciones han demostrado una mayor reducción de la presión arterial que el doblar dosis de un solo agente. No debemos olvidar que al menos el 15-20% de los pacientes necesitan más de 2 fármacos para conseguir una reducción efectiva42.
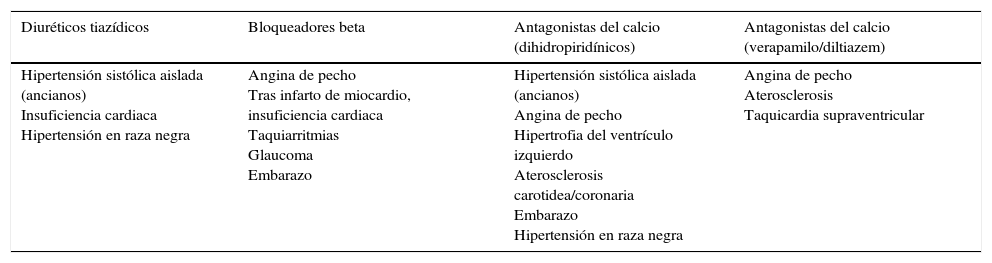
A la hora de decidir qué fármaco antihipertensivo emplear, deberemos considerar diversos factores relacionados con las vías metabólicas del TAR y de los distintos antihipertensivos, ya que existen potenciales interacciones farmacológicas o efectos tóxicos que limitan su uso34,43-49. Las interacciones más esperadas ocurren entre ITINN e IP por sus interacciones con el grupo del CYPP450, siendo poco probables con raltegravir o maraviroc. Los inhibidores de la enzima convertidora de angiotensina (IECA) y los antagonistas de los receptores de angiotensinaii (ARAII) son los antihipertensivos mejor tolerados y con menor riesgo de interacciones con los FARV (ver www.hiv-druginteractions.org). Los diuréticos tiazídicos y el amlodipino en general también son seguros y se pueden utilizar en determinadas situaciones clínicas (tabla 10), si no se pueden usar los anteriores (IECA o ARAII) o si es necesario tratamiento combinado de la HTA.
Situaciones que favorecen el uso de determinados fármacos antihipertensivos
| Diuréticos tiazídicos | Bloqueadores beta | Antagonistas del calcio (dihidropiridínicos) | Antagonistas del calcio (verapamilo/diltiazem) |
|---|---|---|---|
| Hipertensión sistólica aislada (ancianos) Insuficiencia cardiaca Hipertensión en raza negra | Angina de pecho Tras infarto de miocardio, insuficiencia cardiaca Taquiarritmias Glaucoma Embarazo | Hipertensión sistólica aislada (ancianos) Angina de pecho Hipertrofia del ventrículo izquierdo Aterosclerosis carotidea/coronaria Embarazo Hipertensión en raza negra | Angina de pecho Aterosclerosis Taquicardia supraventricular |
| IECA | Antagonistas de los receptores de angiotensina | Diuréticos (antialdosterónicos) | Diuréticos de asa |
|---|---|---|---|
| Insuficiencia cardiaca Disfunción del ventrículo izquierdo Tras infarto de miocardio Nefropatía diabética Hipertrofia del ventrículo izquierdo Aterosclerosis carotídea Proteinuria/microalbuminuria Fibrilación auricular Síndrome metabólico | Insuficiencia cardiaca Tras infarto de miocardio Nefropatía diabética Hipertrofia del ventrículo izquierdo Proteinuria/microalbuminuria Fibrilación auricular Síndrome metabólico Tos inducida por IECA | Insuficiencia cardiaca Tras infarto de miocardio | Enfermedad renal en fase terminal Insuficiencia cardiaca |
IECA: inhibidores de la enzima de conversión de angiotensina.
- 1.
En la actualidad las recomendaciones para el diagnóstico y el manejo terapéutico de la HTA en pacientes con infección por el VIH deben ser las mismas que las de la población general. Para ello se recomienda modificar el estilo de vida y, si es preciso, tratamiento con antihipertensivos, con el objeto de disminuir el RCV y la morbimortalidad por ECV. (Recomendación fuerte, alta calidad de la evidencia.)
- 2.
A la hora de seleccionar los fármacos antihipertensivos en pacientes con TAR se recomienda tener en cuenta las potenciales interacciones medicamentosas y los efectos adversos. Los antihipertensivos de las familias IECA y ARAII son los mejor tolerados y con menor riesgo de interacciones. (Recomendación fuerte, alta calidad de la evidencia.)
Los pacientes con infección por el VIH tienen mayor riesgo de ECV que la población general. Aunque el mecanismo por el que se produce la lesión vascular no se conoce con certeza, intervienen diversos factores, que incluyen los FRCV tradicionales (tablas 11 y 12), el TAR y parámetros relacionados con el VIH como son los cambios inflamatorios e inmunológicos, incluso en pacientes con buen control inmunovirológico50-55. Es posible que las consecuencias inmunológicas e inflamatorias de la infección por el VIH crónica subyazcan en el desarrollo de la arteriosclerosis prematura y el envejecimiento acelerado56.
Principales factores de riesgo cardiovascular
| No modificables |
| • Edad (varón ≥ 45 años; mujer ≥ 55 años o menopausia precoz sin tratamiento hormonal sustitutivo) |
| • Sexo masculino |
| • Historia familiar de cardiopatía isquémica precoz (en parientes de primer grado, antes de los 55 años si es varón o antes de los 65 años si es mujer) |
| • Antecedentes personales de isquemia |
| Modificables |
| • Tabaquismo |
| • Hipertensión arterial (≥ 140/90mmHg o en tratamiento) |
| • Diabetesa o intolerancia a la glucosa |
| • Colesterol LDL elevado (límite alto, 130-159mg/dl; alto, 160-189mg/dl; muy alto, >190mg/dl) |
| • Colesterol HDL bajo (<40 mg/dl en hombres y <50 mg/dl en mujeres)b |
| • Obesidad |
| • Inactividad física |
| • Dieta aterogénica |
Factores de riesgo cardiovascular emergentes
| Lipídicos |
| • Concentraciones plasmáticas de triglicéridos elevadas |
| • Concentraciones plasmáticas de lipoproteína(a) elevadas |
| • Partículas de cLDL pequeñas y densas |
| • Concentraciones plasmáticas de apolipoproteína B elevadas |
| • Concentraciones plasmáticas de apolipoproteína A-I reducidas |
| • Cociente CT/cHDL elevado |
| No lipídicos |
| • Concentraciones plasmáticas de homocisteína elevadas |
| • Factores protrombóticos |
| • Marcadores inflamatorios, sobre todo PCR |
| • Glucosa basal alterada (110-125mg/dl) |
Los FARV actualmente recomendados para pautas de primera línea tienen escaso impacto desde el punto de vista metabólico y cardiovascular51-55,57.
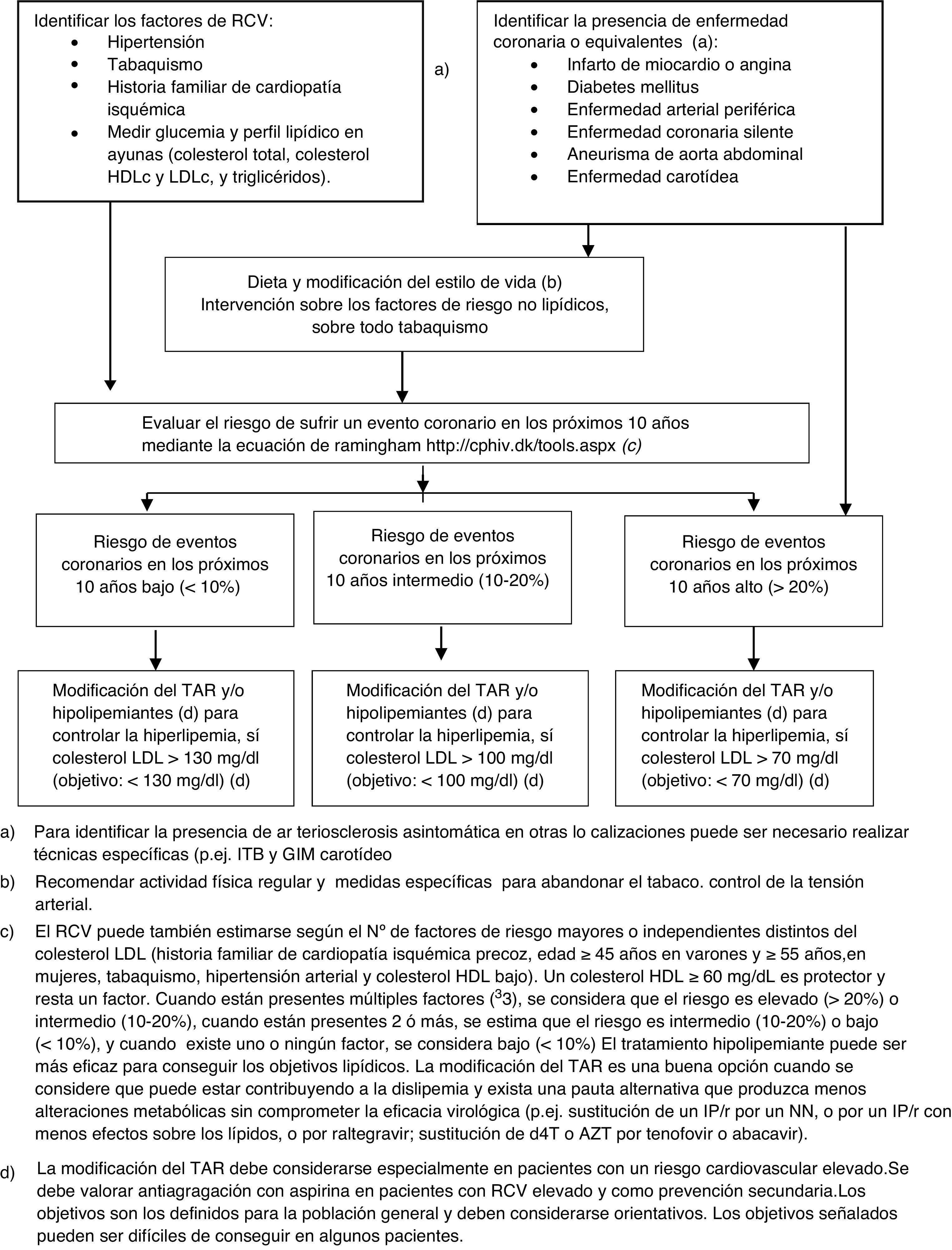
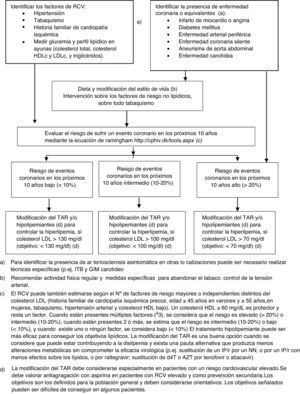
Recomendaciones para la evaluación del riesgo cardiovascular y estrategias de prevenciónLa identificación de los pacientes con elevado riesgo de sufrir ECV es esencial para la adopción de medidas preventivas y debería formar parte de la evaluación clínica ordinaria de los pacientes con infección por el VIH, especialmente de los que reciben TAR. En esencia, se trata de estimar el riesgo individual de sufrir un ECV con la mayor exactitud posible y de actuar sobre los FRCV modificables, con mayor o menor intensidad dependiendo del riesgo estimado58-63 (algoritmo 3, fig. 3).
Evaluación del RCV en pacientes con infección por el VIH y recomendaciones para la prevención de episodios cardiovasculares.
a) Para identificar la presencia de arteriosclerosis asintomática en otras localizaciones puede ser necesario realizar técnicas específicas (p.ej., ITB y GIM carotídeo.
b) Recomendar actividad física regular y medidas específicas para abandonar el tabaco. Control de la presión arterial.
c) El RCV puede también estimarse según el número de factores de riesgo mayores o independientes distintos del colesterol LDL (historia familiar de cardiopatía isquémica precoz, edad ≥45 años en varones y ≥55 años,en mujeres, tabaquismo, hipertensión arterial y colesterol HDL bajo). Un colesterol HDL ≥60mg/dl es protector y resta un factor. Cuando están presentes múltiples factores (≥3), se considera que el riesgo es elevado (>20%) o intermedio (10-20%); cuando están presentes 2 o más, se estima que el riesgo es intermedio (10-20%) o bajo (<10%), y cuando existe uno o ningún factor, se considera bajo (<10%). El tratamiento hipolipemiante puede ser más eficaz para conseguir los objetivos lipídicos. La modificación del TAR es una buena opción cuando se considere que puede estar contribuyendo a la dislipidemia y exista una pauta alternativa que produzca menos alteraciones metabólicas sin comprometer la eficacia virológica (p.ej., sustitución de un IP/r por un NN, o por un IP/r con menos efectos sobre los lípidos, o por raltegravir; sustitución de d4T o AZT por tenofovir o abacavir).
d) La modificación del TAR debe considerarse especialmente en pacientes con un riesgo cardiovascular elevado. Se debe valorar antiagregación con aspirina en pacientes con RCV elevado y como prevención secundaria. Los objetivos son los definidos para la población general y deben considerarse orientativos. Los objetivos señalados pueden ser difíciles de conseguir en algunos pacientes.
- 1.
Se debe estimar el riesgo individual de sufrir un episodio cardiovascular con la mayor exactitud posible. (Recomendación fuerte, baja calidad de la evidencia.)
- 2.
Se debe modificar la dieta y estilo de vida e intervenir sobre todos los factores modificables, muy especialmente sobre el tabaquismo, con mayor o menor intensidad dependiendo del riesgo estimado. (Recomendación fuerte, moderada calidad de la evidencia.)
- 3.
Se deben remitir al cardiólogo los pacientes con antecedentes de ECV y debe considerarse en aquellos con RCV elevado. (Recomendación fuerte, baja calidad de la evidencia.)
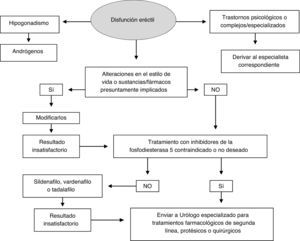
La prevalencia de disfunción sexual en los pacientes VIH es superior —y aparece a edad más temprana— que en la población seronegativa (51% en los varones y 60% en las mujeres)64-68. En los varones se describe con mayor frecuencia disfunción eréctil, disminución de la líbido y alteraciones de la eyaculación y del orgasmo64,65,68. En las mujeres son más frecuentes disminución del deseo sexual y menor satisfacción en la relación sexual67.
Entre los factores implicados se incluyen: edad, hipogonadismo, factores psicológicos, comorbilidades (HTA, ECV, síndrome metabólico, obesidad, hepatopatía, disfunción autonómica y neuropatía), fármacos (antihipertensivos, diuréticos, hipolipemiantes, antidepresivos, benzodiacepinas, antipsicóticos, ketoconazol, fluconazol, ganciclovir, megestrol, metadona, cimetidina, IP), consumo de drogas y alcohol69-74.
La evaluación de la disfunción sexual debe incluir una analítica general con perfil lipídico y metabólico y determinaciones de testosterona y estradiol, preferiblemente determinación del cociente testosterona libre/testosterona total, ya que en los pacientes VIH seropositivos pueden estar aumentados los niveles de globulinas ligadoras de las hormonas sexuales. Si se detecta hipogonadismo, se determinarán también gonadotropinas y prolactina75,24.
En pacientes sin evidencia de hipogonadismo deberá considerarse interconsulta con especialista.
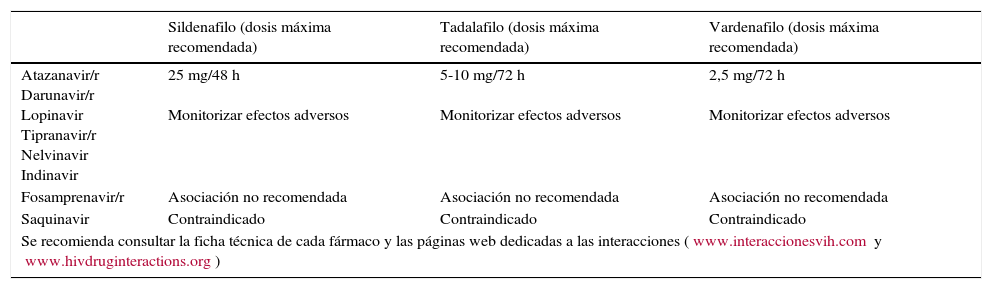
TratamientoEn el hombre, si se detecta hipogonadismo se debe hacer una terapia sustitutiva con testosterona. Si hay problemas de erección, pueden evaluarse los inhibidores de la fosfodiesterasa 5 (sildenafilo, vardenafilo y tadalafilo)24. El uso conjunto de estos fármacos con IP pueden elevar sustancialmente los niveles de los primeros, lo que obliga a una reducción sustancial de la dosis (tabla 13). Los inhibidores de la fosfodiesterasa5 están contraindicados en pacientes que tomen nitratos porque pueden potenciar sus efectos antihipertensivos. Aunque los IP se han asociado a disfunción eréctil, no se conoce su patogenia y no hay evidencia de que su interrupción produzca mejoría.
Recomendaciones de ajuste de dosis entre IP e inhibidores de la fosforilesterasa 5
| Sildenafilo (dosis máxima recomendada) | Tadalafilo (dosis máxima recomendada) | Vardenafilo (dosis máxima recomendada) | |
|---|---|---|---|
| Atazanavir/r Darunavir/r Lopinavir Tipranavir/r Nelvinavir Indinavir | 25 mg/48 h Monitorizar efectos adversos | 5-10 mg/72 h Monitorizar efectos adversos | 2,5 mg/72 h Monitorizar efectos adversos |
| Fosamprenavir/r | Asociación no recomendada | Asociación no recomendada | Asociación no recomendada |
| Saquinavir | Contraindicado | Contraindicado | Contraindicado |
| Se recomienda consultar la ficha técnica de cada fármaco y las páginas web dedicadas a las interacciones (www.interaccionesvih.com y www.hivdruginteractions.org) | |||
En la mujer, los estrógenos tópicos mejoran la dispareunia asociada a la atrofia vulvovaginal en las mujeres menopáusicas, pero el papel de los estrógenos sistémicos o de la testosterona no está claro67.
Si no hay una causa evidente o el tratamiento resulta ineficaz, debe remitirse al especialista. El algoritmo4 (fig. 4) muestra el tratamiento del paciente VIH+ con disfunción eréctil.
Recomendaciones- 1.
La evaluación de la disfunción sexual debe formar parte de la atención integral de los pacientes seropositivos por su elevada prevalencia y sus consecuencias. (Recomendación fuerte, baja calidad de la evidencia.)
- 2.
Si se utilizan los inhibidores de la fosfodiesterasa5 deben tenerse en cuenta las interacciones con los FARV, especialmente con los IP. (Recomendación fuerte, moderada calidad de la evidencia.)
La mayoría se han descrito en pacientes en estadios avanzados de la infección por VIH antes de disponer de un TAR eficaz76-78. Las alteraciones hormonales pueden ser causadas por efecto directo del VIH sobre los órganos endocrinos, por efecto sistémico mediado por citoquinas, por infecciones y neoplasias oportunistas asociadas al VIH, por los fármacos utilizados en su tratamiento, o por el consumo de drogas78-80.
La evaluación debe ser individualizada y guiada por la clínica76,77. En muchas ocasiones los síntomas son inespecíficos y comunes a la propia infección por el VIH y a las enfermedades asociadas, y se requiere un alto nivel de sospecha para su diagnóstico.
No se recomienda la medición rutinaria de las hormonas, excepto en los casos en que exista indicación clínica por hipo o hiperfunción, al igual que en la población general. Las recomendaciones de tratamiento en los pacientes VIH seropositivos son similares a las de la población general76,77.
Recomendaciones- 1.
Las recomendaciones de tratamiento en los pacientes VIH son limitadas y deben aplicarse las recomendaciones generales utilizadas en la población sin infección. (Recomendación fuerte, muy bajo nivel de evidencia.)
La infección por VIH y determinados ARV producen efectos adversos similares a los observados en el síndrome metabólico, entre los que se incluye la esteatosis hepática. Su prevalencia en pacientes VIH positivos es del 30-50%81,82.
La resistencia a la insulina es un factor patogénico clave83,84. La infección por virus de hepatitisC y el abuso de alcohol son relativamente prevalentes en pacientes con el VIH y pueden influir en la patogenia. La esteatosis no suele ocasionar síntomas per se. El diagnóstico de laboratorio muestra habitualmente una elevación de transaminasas en una cuantía inferior a 5 veces los valores normales con GPT>GOT, elevación de GGT y fosfatasa alcalina; también puede existir hipertrigliceridemia. La ecografía es el método confirmatorio de elección, y ayuda a conocer si existen otros problemas hepáticos o extrahepáticos85. También son útiles el TAC, la RMN y la elastografía con atenuación controlada.
El pronóstico de la esteatosis hepática es en general benigno86-88. Al igual que en la población general, es importante distinguir este cuadro de la esteatohepatitis, que se presenta en pacientes con obesidad visceral e insulinorresistencia, así como con otras manifestaciones clínico-biológicas que se encuentran en el síndrome metabólico. Estos pacientes tienen un riesgo considerable de progresión del daño hepático y de desarrollo de cirrosis.
El tratamiento incluye la modificación de los hábitos dietéticos si están alterados y la pérdida ponderal de al menos un 10%. Si existen alteraciones metabólicas, como diabetes o dislipidemia o infección por virus de hepatitis crónicas, se deberán tratar específicamente. Si no existen alteraciones de hábitos de vida o metabólicas, o su tratamiento específico no es suficientemente eficaz, podría considerarse tratamiento con vitaminaE durante 1-2meses, aunque los datos disponibles son limitados90-92.
Recomendaciones- 1.
Se recomienda descartar esteatosis hepática en pacientes diabéticos o con síndrome metabólico y con elevación de transaminasas sin etiología definida. (Recomendación fuerte, bajo nivel de evidencia.)
- 2.
En el paciente con factores de riesgo para la progresión de esteatosis hepática se deben tomar medidas para el diagnóstico y tratamiento precoz para prevenir la progresión del daño hepático. (Recomendación fuerte, bajo nivel de evidencia.)
- 3.
Para la confirmación diagnóstica, se recomienda la realización al menos de un método por imagen (Recomendación fuerte, moderado nivel de evidencia.)
- 4.
El tratamiento se dirige a modificar hábitos de vida no saludables y tratar adecuadamente la diabetes o la dislipidemia, si existen. (Recomendación fuerte, moderado nivel de evidencia.)
Con el fin de evitar y/o minimizar los posibles conflictos de intereses, las personas que forman el panel de expertos/as han realizado una declaración formal de intereses. En esta declaración parte de los/as autores/as han recibido financiación para participar en congresos y para la realización de investigaciones así como han recibido pagos como ponentes por parte de instituciones públicas y laboratorios farmacéuticos. Estas actividades no afectan a la claridad del presente documento por no entrar en conflicto de intereses lo recomendado con los honorarios y/o ayudas recibidas. Cabe resaltar que con respecto a los fármacos en el documento solamente se habla de principio activo y no de marca comercial.
La SPNS y las juntas directivas de GEAM y GeSIDA agradecen las aportaciones y opiniones de Adrián Curran y Juan Emilio Losa, que han contribuido a mejorar la redacción y enriquecer el contenido del documento.
Rosa Polo Rodríguez. Especialista en Medicina Interna. Secretaría Plan Nacional sobre el Sida. Madrid.
María José Galindo Puerto. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Clínico Universitario. Valencia.
Carlos Dueñas. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario. Burgos.
Carmen Gómez Candela. Especialista en Endocrinología y Nutrición. Hospital Universitario La Paz. Madrid.
Vicente Estrada. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Clínico Universitario San Carlos. Madrid.
Noemí GP Villar. Especialista en Endocrinología y Nutrición. Hospital Universitario La Paz. Madrid.
Jaime Locutura. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas Hospital Universitario. Burgos.
Ana Mariño. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Arquitecto Marcide. Ferrol.
Javier Pascua. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Complejo Hospitalario de Cáceres.
Rosario Palacios. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Virgen de la Victoria. Málaga.
Miguel Ángel von Wichmman. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Donostia. San Sebastian.
Julia Álvarez. Especialista en Endocrinología y Nutrición. Hospital Universitario Príncipe de Asturias. Alcalá Henares, Madrid.
Victor Asensi. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario Central de Asturias. Oviedo.
José Lopez Aldeguer. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital La Fe. Valencia.
Fernando Lozano. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario de Valme. Sevilla.
Eugenia Negredo. Fundació Lluita contra la Sida. Hospital Germans Trias i Pujol. Badalona. Universitat Autónoma de Barcelona. Barcelona.
Enrique Ortega. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario. Valencia.
Enric Pedrol. Especialista en Medicina Interna. Servicio de Medicina Interna. Hospital de Figueres. Gerona.
Félix Gutiérrez. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital General Universitario. Elche. Alicante.
Jesús Sanz Sanz. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario de La Princesa. Madrid.
Esteban Martínez Chamorro. Especialista en Medicina Interna. Unidad de Enfermedades Infecciosas. Hospital Universitario Clínic. Barcelona.