La colonización por Staphylococcus aureus desempeña un papel importante en la epidemiología y patogénesis de las infecciones que causa. La población infantil es una de las más susceptibles a colonizarse; sin embargo, en Colombia los estudios en comunidad y en población infantil son escasos.
ObjetivoDeterminar la relación clonal de aislamientos colonizantes de S.aureus en menores de 8 hogares infantiles de Medellín y describir las características epidemiológicas presentes en esta población.
MétodosSe realizó un estudio observacional transversal donde se seleccionó una muestra de 200 menores entre los 6meses y los 5años de edad, provenientes de 8 hogares infantiles de Medellín, Colombia, durante 2011. Las muestras fueron tomadas de fosas nasales. Los aislamientos de S.aureus y la resistencia a meticilina se confirmaron molecularmente, empleando los genes nuc y mec. La genotipificación incluyó tipificación del SCCmec, tipificación de spa, PFGE y MLST. La información epidemiológica fue obtenida de los padres y analizada en SPSS® 21.0.
ResultadosLa frecuencia de colonización en los hogares varió entre el 16,7% (n=3) y el 53,6% (n=15). En el interior de 4 hogares infantiles se identificaron aislamientos de S.aureus relacionados entre sí. Adicionalmente, el 50% de todos los aislamientos de S. aureus sensible a meticilina se agruparon en 3 clúster, que pertenecían a los complejos clonales CC45, CC30 y CC121.
ConclusiónLa tipificación molecular de los aislamientos de los menores colonizados y el análisis realizado en el interior de los hogares permitió describir la diseminación de las cepas colonizantes en el interior de los hogares infantiles de la ciudad de Medellín, principalmente del CC45, un clon exitoso en colonización.
Colonization plays a major role in the epidemiology and pathogenesis of Staphylococcus aureus infections. The child population is one of the most susceptible to colonization; however, community and children studies are limited in Colombia.
ObjectiveTo assess the clonal relationship of S.aureus strains isolated from colonized children in eight day care centers (DCCs) from Medellin and to determine the presence of epidemiological characteristics in these populations.
MethodsAn observational cross-sectional study was conducted on a sample of 200 children aged from 6months to 5years attending eight DCCs in Medellin, Colombia, during 2011. Nasal samples were collected from each nostril. The isolates species and methicillin resistance were molecularly confirmed using nuc and mec genes. Genotypic analysis included SCCmec typing, spa typing, PFGE and MLST. Epidemiological information was obtained from the parents and analyzed using the statistics program SPSS 21.0
ResultsThe colonization frequency in DCCs ranged from 16.7% (n=3) to 53.6% (n=15). Genetically related isolates were identified inside four DCCs. Half (50%) of the isolates were grouped in 3 clusters, which belonged to the clonal complexes CC45, CC30, and CC121.
ConclusionMolecular typing of isolates from colonized children and comparison among DCCs showed the spread of colonizing strains inside DCCs in Medellin; predominantly the CC45 clone, a successful child colonizer.
Staphylococcus aureus es un patógeno causante de un amplio rango de infecciones asociadas a la comunidad y al cuidado en salud1. La importancia de este microorganismo radica no solo en su capacidad de patogénesis, sino también en su capacidad de desarrollar resistencia a los antimicrobianos, en particular resistencia a meticilina (S.aureus resistente a meticilina [SARM]), lo que ha generado importantes problemas terapéuticos1. Este microorganismo se caracteriza por colonizar piel y mucosas de humanos, factor que juega un papel importante en la epidemiología y la patogénesis de las infecciones que causa2. La población infantil se encuentra dentro de las más susceptibles a colonizarse, y por lo tanto presenta mayor riesgo de sufrir infección3. Los hogares infantiles, donde se concentra gran parte de los menores, se describen como reservorios del microorganismo y parecen contribuir a su transmisión y diseminación en la comunidad4,5.
En general, los estudios de colonización por S.aureus se han realizado en ambientes hospitalarios; los de comunidad son recientes, y todavía no han definido de forma clara el papel de la colonización en la transmisión y en la infección de SARM6-8. En Colombia, los estudios en comunidad y en población infantil son pocos9,10. Recientemente, un estudio realizado por nuestro grupo de investigación, en población pediátrica de un hospital universitario y de hogares infantiles de Medellín, describió diferencias en las características epidemiológicas y moleculares de la colonización nasal por S.aureus entre ambas poblaciones y evidenció la presencia de cepas de SARM colonizantes similares a las causantes de infección, sugiriendo la capacidad de diseminación de S.aureus y el posible riesgo de infección en la población infantil11. Teniendo en cuenta lo anterior y el vacío en el conocimiento sobre la situación de S.aureus en la comunidad, en este estudio se propuso realizar una descripción de la relación clonal de aislamientos colonizantes de S.aureus en menores de 8 hogares infantiles de Medellín y de las características epidemiológicas presentes en esta población.
MetodologíaPoblación de estudioEn el año 2011 se realizó un estudio observacional transversal donde se seleccionó una muestra de 200 menores entre los 6meses y los 5años de edad matriculados en 8 hogares infantiles (A-H) pertenecientes al Programa Buen Comienzo de la Alcaldía Mayor de Medellín, Colombia. Se seleccionaron 8 hogares distribuidos estratégicamente en las diferentes zonas de la ciudad, con énfasis en aquellos barrios y sectores de mayor vulnerabilidad o de bajo estrato socioeconómico que atendieran niños de los 0 a los 5años por un período de tiempo de 8h diarias (fig. 1).
Distribución de los hogares infantiles en la ciudad de Medellín.
Fuente: Mapa de Medellín de división en comunas. Alcaldía de Medellín, 200740.
El número de niños atendidos en cada hogar varió entre 55 y 100 menores. Los menores seleccionados para el estudio debían cumplir los criterios de inclusión: tener más de 6meses en el hogar infantil, no presentar consumo de antibióticos en los 7días previos a la toma de la muestra y contar con el consentimiento de los padres o adultos responsables. En total, el número de niños evaluados por hogar fue: hogar A=33, B=32, C=28, D=18, E=25, F=19, G=18 y H=27.
Consideraciones éticasLos protocolos de investigación y de consentimiento informado fueron aprobados por el Comité de Bioética para la Investigación en Humanos de la Sede de Investigación Universitaria de la Universidad de Antioquia (CBEIH-SIU) (aprobación núm. 10-041-277). El consentimiento informado para participar en el estudio se obtuvo de los padres o tutores antes de la toma de muestra de cada paciente.
Recolección de las muestras y aislamiento de cepas bacterianasLas muestras fueron tomadas en cada fosa nasal de forma independiente, utilizando hisopos de algodón estéril previamente humedecidos con solución salina estéril al 0,9%; mediante frotes rotatorios firmes 3 veces en sentido de las manecillas del reloj y 3 veces en sentido contrario. Inmediatamente se depositaron en el medio de transporte de amies con carbón activado (Sterile Transport Swab, Copan, Brescia, Italia)12. Los hisopos se transportaron a 4°C al laboratorio de microbiología, dentro de las 4h posteriores a la toma de la muestra. En el laboratorio, las muestras fueron inmediatamente sembradas en agar manitol sal (MDM científica, Medellín, Colombia) e incubadas a 37°C por 24 a 48h. Las colonias fermentadoras de manitol sal, con morfología sugestiva de Staphylococcus fueron subcultivadas en agar sangre y sometidas a coloración de Gram y pruebas bioquímicas, incluyendo catalasa y coagulasa (Coagulase Plasma Rabbit-Becton, Dickinson and Company, Sparks, MD, EE.UU.)13.
Caracterización epidemiológica de los menores colonizados por Staphylococcus aureusLa información epidemiológica de los menores fue obtenida de los padres o adultos responsables, e incluía aspectos demográficos y factores de riesgo relacionados con la colonización por S.aureus, como historia médica, uso previo de antibióticos, comorbilidades, número de miembros de la familia, nivel educativo de la madre, entre otros.
Caracterización molecular de los aislamientos de Staphylococcus aureusA las cepas de S.aureus se les realizó la confirmación molecular de especie empleando el gen nuc14, la detección de resistencia a meticilina mediante el gen mecA y la genotipificación de los aislamientos empleando la caracterización del casete cromosómico estafilocócico mec (SCCmec) mediante la estrategia de PCR descrita por Kondo et al.15.
Tipificación de la región polimorfa de la proteína A (tipo spa) y tipificación por secuenciación de loci múltiplesLa tipificación de spa fue realizada a todos los aislamientos SARM y a una muestra representativa de cepas de Staphylococcus aureus sensible a meticilina (SASM), las cuales fueron seleccionadas aleatoriamente. Un total de 34 cepas fueron procesadas, lo que equivale al 53% de los aislamientos sensibles. La amplificación y secuenciación de la proteína A se realizó siguiendo la metodología de Shopsin et al.16. Los tipos de spa fueron determinados usando Ridom Staphtype software (version 1.4; Ridom, GmbH, Wurzburg, Alemania [http://spa.ridom.de/index.shtml]). Además, a un subconjunto de 10 aislamientos se les realizó tipificación por secuenciación de loci múltiples (Multilocus Sequence Typing [MLST]) empleando la metodología descrita por Enright et al.17. Los alelos y los tipos de secuencia se asignaron por medio de la base de datos del sitio web de MLST (http://saureus.mlst.net/), mientras que los complejos «clonales» (CC) se determinaron mediante el algoritmo eBURST18. Los complejos clonales de las cepas que no fueron procesadas por MLST fueron inferidos a partir del análisis de los patrones de repetición de spa19,20 o consultando la página web Ridom SpaServer.
Electroforesis de campo pulsadoSe tipificaron todos los aislamientos de S.aureus. Para realizar la electroforesis de campo pulsado (PFGE) se empleó el método descrito por Mulvey et al.21 con la enzima SmaI. La corrida electroforética se realizó en el sistema CHEF-DRIII (Bio-Rad, Hercules). Para normalizar los fragmentos de ADN y permitir la comparación entre los diferentes geles, se empleó la cepa de referencia S.aureus NCTC8325. La asignación de las bandas se realizó de forma automática y luego se ajustó manualmente. Para el análisis se consideraron bandas entre 36 y 600kb. El análisis de los clúster se realizó usando el coeficiente de Dice en el software BioNumerics versión 6.0 (Applied Maths, Sint-Martens-Latem, Bélgica). Los dendrogramas se generaron empleando el método UPGMA, con 1% de tolerancia y 0,5% de optimización. Para definir clúster relacionados se empleó un punto de corte de similitud del 80%21.
Análisis estadísticoSe obtuvieron frecuencias absolutas y relativas para las variables cualitativas y medidas de resumen para las variables cuantitativas. Esta información fue analizada en el software SPSS® v21.0. Se describieron las características epidemiológicas de los menores colonizados por cepas pertenecientes a los clúster encontrados por PFGE en el estudio.
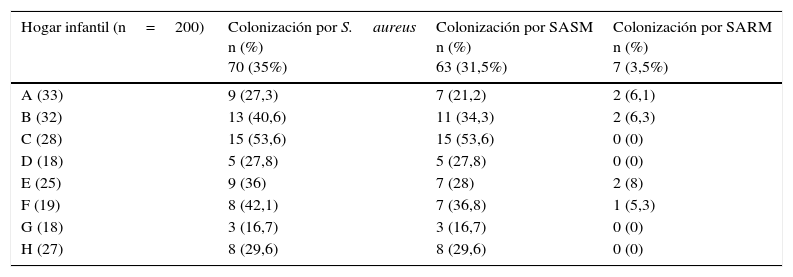
ResultadosDescripción general de la población y colonización nasal por Staphylococcus aureusLa mediana de la edad de los menores participantes fue de 3años, con un rango de edad entre 1 y 5años. El 52% (n=104) fueron de sexo masculino. En la población seleccionada para el estudio se encontró una frecuencia de colonización nasal por S.aureus del 35% (n=70), de los cuales el 31,5% (n=63) se encontraban colonizados por SASM y el 3.5% (n=7) por SARM; sin embargo, dentro de cada hogar infantil la colonización varió desde el 16,7% en el hogar G (n=3) hasta el 53,6% en el hogar C (n=15) para SASM; para SARM, desde el 0% en los hogares C, D, G y H, hasta el 8% en el hogar E (n=2) (tabla 1).
Frecuencia de colonización por Staphylococcus aureus (SASM y SARM) de acuerdo con el hogar infantil
| Hogar infantil (n=200) | Colonización por S.aureus n (%) 70 (35%) | Colonización por SASM n (%) 63 (31,5%) | Colonización por SARM n (%) 7 (3,5%) |
|---|---|---|---|
| A (33) | 9 (27,3) | 7 (21,2) | 2 (6,1) |
| B (32) | 13 (40,6) | 11 (34,3) | 2 (6,3) |
| C (28) | 15 (53,6) | 15 (53,6) | 0 (0) |
| D (18) | 5 (27,8) | 5 (27,8) | 0 (0) |
| E (25) | 9 (36) | 7 (28) | 2 (8) |
| F (19) | 8 (42,1) | 7 (36,8) | 1 (5,3) |
| G (18) | 3 (16,7) | 3 (16,7) | 0 (0) |
| H (27) | 8 (29,6) | 8 (29,6) | 0 (0) |
n: número de menores evaluados por hogar infantil.
Las frecuencias de los menores colonizados por S.aureus, SASM y SARM fueron calculadas en base al n de cada hogar infantil.
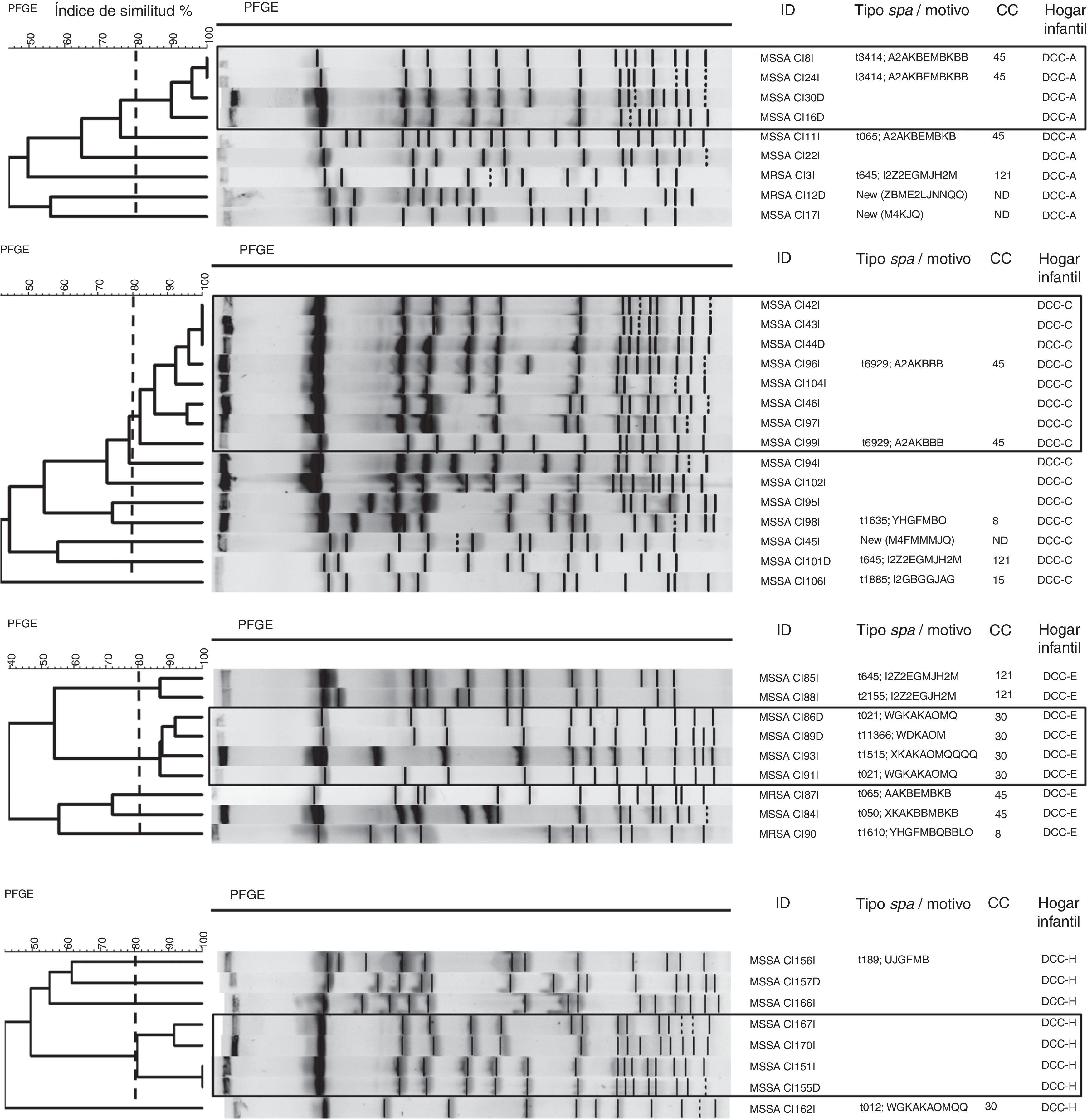
Los resultados de la tipificación molecular se muestran en la figura 2. En el análisis de la PFGE realizada a las cepas de S.aureus de cada hogar infantil se identificaron aislamientos de S.aureus relacionados entre sí en los hogares infantiles A, C, E y H. En el hogarC se agruparon 8 aislamientos, y en los hogaresA, E y H se agruparon 4 aislamientos. Por su parte, en los hogares infantilesB, D, F y G, los aislamientos no se relacionaron entre sí.
Dendrogramas de los patrones de electroforesis de campo pulsado de los aislamientos de Staphylococcus aureus por hogar infantil.
La línea discontinua corresponde a un coeficiente de similitud del 80% que se utiliza para definir clones relacionados por PFGE.
ID: identificación de la muestra; NT: no tipificable; Hogar infantil: DCC (A-H).
Adicionalmente, en el análisis de la PFGE de todos los aislamientos de S.aureus (n=70) obtenidos de los menores de los hogares infantiles (fig. 3) se distinguieron 3 grupos que correspondían al 50% de los aislamientos, distribuidos de la siguiente manera: el clúster 1 con 24 aislamientos (34,3%), el clúster 2 con 5 (7,1%) y el clúster 3 con 6 (8,6%). Al relacionar estos datos con los resultados de la tipificación de MLST, se observó que el clúster 1 pertenecía al complejo clonal CC45, el clúster 2 al CC30 y el clúster 3 al CC121.
PFGE de los aislamientos de Staphylococcus aureus recolectados en 8 hogares infantiles de Medellín (n=70).
La línea discontinua corresponde a un coeficiente de similitud del 80% que se utiliza para definir clones relacionados por PFGE.
ID: identificación de la muestra; NT: no tipificable; Hogar infantil: DCC (A-H).
Las características epidemiológicas de los menores cuyos aislamientos de S.aureus se relacionaron por PFGE se resumen en la tabla 2.
Características epidemiológicas de los menores colonizados por cepas de Staphylococcus aureus relacionadas por PFGE
| Característica | Clúster 1 (n=24) n (%) |
|---|---|
| Sexo | |
| Masculino | 13 (54,2) |
| Femenino | 11 (45,8) |
| Hogar infantil | |
| A | 4 (16,7) |
| B | 2 (8,3) |
| C | 8 (33,3) |
| D | 3 (12,5) |
| E | 1 (4,2) |
| F | 2 (8,3) |
| G | — |
| H | 4 (16,7) |
| Tiempo de estadía | |
| Menos de un año | 14 (58,3) |
| Más de un año | 10 (41,7) |
| Hospitalización | 5 (20,8) |
| Uso de antibióticos (penicilina) | 14 (58,3) |
| Enfermedad subyacente (atopia) | 10 (41,7) |
| Antecedentes personales y familiares de infección en piel y tejidos blandos | 13 (54,2) |
| Hospitalización previa de un miembro familiar | 2 (8,3) |
| Contacto con trabajadores del área de la salud | 1 (4,2) |
| Tipo de vivienda | |
| Apartamento | 6 (25) |
| Casa | 18 (75) |
| Inquilinato | — |
| Número de personas con las que convive en la vivienda | |
| 0-3 | 4 (16,7) |
| 4-6 | 12 (50) |
| 7-9 | 7 (29,2) |
| 10-12 | 1 (4,2) |
| Convive con otros menores en la vivienda | 18 (75) |
| Comparte objetos | 15 (62,5) |
| Nivel educativo madre | |
| Ninguno | — |
| Primaria | 4 (16,7) |
| Secundaria | 18 (75) |
| Educación superior | 2 (8,3) |
| Uso de spray nasal | 3 (12,5) |
El clúster 1 estuvo conformado por 24 aislamientos pertenecientes al CC45 (34% de todos los aislamientos), los cuales se encontraron distribuidos en 7 de los 8 hogares infantiles, predominando el hogar C, con 8 aislamientos (33,3%), y los hogares H y A, con 4 aislamientos cada uno. La mayoría de los menores colonizados por estas cepas eran de sexo masculino (54,2%; n=13) y habían permanecido entre 6 y 12meses en el hogar infantil (58,3%; n=14), habitaban en casa (75%; n=18), convivían en sus viviendas con más de 4 personas (83,3%; n=20) y con otros menores (75%; n=18). En cuanto a los antecedentes clínicos, la mayoría de los menores (79,2%; n=19) y sus convivientes (91,7%; n=22) no tenían historia de hospitalización, y no habían tenido contacto con personal del área de la salud (95,8%; n=23). Sin embargo, el 54,2% (n=13) habían tenido antecedentes personales y familiares de infecciones en piel y tejidos blandos. No se describieron las características de los clúster 2 y 3 por estar conformados por un bajo número de aislamientos.
DiscusiónEn Colombia, en los últimos años ha aumentado el interés sobre los estudios de colonización por S.aureus en la comunidad, principalmente en población infantil9-11. En este estudio se propuso realizar una descripción de la relación clonal de aislamientos colonizantes de S.aureus en menores de 8 hogares infantiles de Medellín y de las características que presentan los niños colonizados por estos clones, con el fin de contribuir al conocimiento local de S.aureus y orientar la toma de medidas de control al interior de estos espacios.
Las frecuencias de colonización por S.aureus encontradas al interior de cada hogar infantil son cercanas a lo reportado en otros estudios realizados en menores de hogares infantiles, donde se ha descrito una colonización por S.aureus desde el 17,4 hasta el 56%, y por SARM del 1,2 al 12%22-27. La alta frecuencia de colonización por SASM (31,5%) es de importancia, dado que estas cepas albergan frecuentemente gran diversidad de factores de virulencia28 y se ha descrito un aumento en las infecciones causadas por este microorganismo en los últimos años en población infantil29, lo cual destaca la necesidad del estudio y la vigilancia de estas cepas sensibles, tanto en colonización como en infección30,31.
Con respecto a la PFGE de los aislamientos colonizantes de S.aureus, en algunos hogares (A, C, E y H) se identificaron aislamientos relacionados genotípicamente entre sí, lo cual podría determinar la presencia de características que favorecen la transmisión del microorganismo al interior de estas instituciones y muestran la importancia de mejorar la educación y las medidas de control para reducir la transmisión cruzada en esta población5,22,23,27. Por su parte, en los hogares infantiles B, D, F y G, los aislamientos no se relacionaron entre sí, lo cual indica que no se está presentando una diseminación del microorganismo al interior de estos lugares y que la adquisición de este se da a partir de fuentes externas. Adicionalmente, como se ha mostrado en otros estudios, sugiere la presencia de prácticas de higiene adecuadas26,32.
En general, la mayoría de los aislamientos de S.aureus obtenidos fueron SASM y pertenecen a los complejos clonales descritos principalmente a nivel mundial en estas cepas: CC5, CC8, CC22, CC30 y CC451,32,33. En Colombia, la prevalencia de estos clones ha sido informada tanto en cepas infecciosas como en colonizantes34,35. De manera interesante, los aislamientos SASM se han reportado en la literatura presentando una alta diversidad genotípica4,32; sin embargo, en el análisis por PFGE se observó una tendencia a presentarse una relación clonal entre los aislamientos, principalmente dentro de algunos hogares infantiles. No obstante, el otro 50% de los aislamientos evidenció la alta variabilidad descrita4,32. Es así que cepas SASM pertenecientes al CC45, que con mayor frecuencia fue observado en el estudio (34%), se encontraron distribuidas dentro de varios hogares (A, C y H), similar a lo reportado en otros estudios, donde ha alcanzado una frecuencia de 25% en menores33,36,37. Estos hallazgos indican que este complejo clonal es exitoso en la colonización de los menores de hogares infantiles de Medellín. Adicionalmente, se encontraron cepas relacionadas pertenecientes al CC30 y al CC121. El hallazgo de aislamientos pertenecientes al CC121 cobra importancia, a pesar de que este ha sido reportado como cepa colonizante en población pediátrica4,32, en su mayoría se ha asociado a infecciones como impétigo y forunculosis38,39, lo cual también representa una alarma de colonización con una cepa potencialmente infecciosa. Finalmente, los resultados del trabajo muestran, tal como se ha reportado, que los hogares infantiles no solo permiten la amplificación de clones previamente reconocidos, como se pudo mostrar con la prevalencia del CC45 en 3 hogares que participaron en el estudio, sino que también podrían contribuir a la aparición y a la diseminación de cepas no reconocidas5.
En general, existe poca información sobre los factores del hospedero asociados con la colonización e infección por una cepa de S.aureus en particular33, por lo cual uno de los resultados importantes de este trabajo fue describir las características epidemiológicas de los menores colonizados por cepas pertenecientes al CC45, que fue el más prevalente en la población infantil. Estos menores se caracterizaron por convivir en sus viviendas con otros menores, compartir objetos de uso personal en sus casas y no tener antecedentes de contacto con el ambiente hospitalario, hecho que señala un posible riesgo de transmisión del microorganismo en sus viviendas y reafirma la importancia y el éxito de este clon en la comunidad. Estudios similares en población infantil, como el de Blumental et al.32 en 2013, intentaron hacer algunas descripciones con respecto a este complejo clonal pero no encontraron características asociadas; no obstante, otros autores, como Sangvik et al.33 en 2011, describen que menores colonizados por cepas pertenecientes al tipo de spa t065, que pertenece al CC45, con mayor frecuencia eran de sexo masculino, hallazgo similar a lo encontrado en este estudio.
Por último, entre las limitaciones del estudio se encuentra que no se indagaron otras características epidemiológicas dentro de cada hogar infantil que podrían haber aportado en la evaluación de transmisión del microorganismo en estos espacios; además, la ausencia de toma de muestra en otros sitios anatómicos podría haber subestimado la frecuencia de colonización por SARM. Con la realización de este estudio se logró describir la diseminación de cepas colonizantes de S.aureus de menores en el interior de algunos hogares infantiles de la ciudad de Medellín, principalmente pertenecientes al CC45, el cual se reporta como un clon exitoso en la colonización de la población infantil de la ciudad. Adicionalmente se encontraron diferencias en los porcentajes de colonización entre los hogares. Los resultados del trabajo contribuyen a la comprensión de la epidemiología de la colonización por S.aureus a nivel local y reafirman la influencia de las condiciones particulares de cada lugar33,34 —en este caso de los hogares infantiles— sobre la colonización y la transmisión de S.aureus y la necesidad de tomar o reforzar medidas de control al interior de estos lugares.
FinanciaciónEsta investigación fue financiada por el Comité para el Desarrollo de la Investigación - CODI, Universidad de Antioquia, proyecto CIMB-032-11.
Conflicto de interesesLos autores declaran no presentar conflicto de intereses.